Zovirax 200mg, 400mg, 800mg Acyclovir Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zovirax 800 mg en hoe wordt het gebruikt?
Zovirax is een receptgeneesmiddel dat wordt gebruikt om de symptomen van koortslippen (Herpes Labialis) en genitale herpes te behandelen. Zovirax 800 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Zovirax 400 mg behoort tot een klasse geneesmiddelen die antivirale middelen, actueel wordt genoemd.
Het is niet bekend of Zovirax 200 mg veilig en effectief is bij kinderen jonger dan 12 jaar.
Wat zijn de mogelijke bijwerkingen van Zovirax 800 mg?
Zovirax 200 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- gemakkelijk blauwe plekken of bloedingen,
- paarse of rode puntvlekken onder de huid,
- weinig of geen plassen,
- pijnlijk of moeilijk plassen,
- zwelling in uw voeten of enkels,
- moe voelen, en
- kortademigheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zovirax zijn:
- misselijkheid,
- braken,
- diarree,
- algemeen ziek gevoel,
- hoofdpijn, en
- mondpijn tijdens het gebruik van een aciclovir-buccale tablet
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zovirax. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
SAMENVATTING PRODUCTINFORMATIE
Medicijnstof
Goede naam: aciclovir
Chemische naam: 9-[(2-hydroxyethoxy)methyl]guanine
Andere naam: acycloguanosine
Moleculaire formule: C8H11N503
Moleculaire massa: 225.2 Structuurformule:
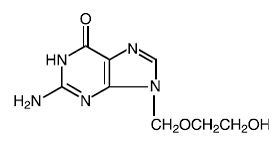
Fysisch-chemische eigenschappen: Acyclovir is een wit, kristallijn poeder met een maximale oplosbaarheid in water van 1,3 mg/ml bij 25°C.
INDICATIES
Indicaties en klinisch gebruik
ZOVIRAX® (aciclovir) is geïndiceerd voor de volgende aandoeningen:
- De behandeling van de eerste episodes van herpes genitalis.
- De onderdrukking van ongewoon frequente recidieven van herpes genitalis (6 of meer afleveringen per jaar).
- De acute behandeling van herpes zoster (gordelroos) en varicella (waterpokken).
De resultaten van klinische onderzoeken suggereren dat sommige patiënten met recidiverende genitale herpes klinisch voordeel kunnen halen uit de toediening van orale ZOVIRAX® als het wordt ingenomen bij het eerste teken van een naderende episode. Degenen die het meest waarschijnlijk baat hebben, zijn patiënten die ernstige, langdurige recidieven ervaren; dergelijke intermitterende therapie kan geschikter zijn dan suppressieve therapie wanneer deze recidieven zeldzaam zijn.
Vroegtijdige behandeling van acute herpes zoster (gordelroos) bij immunocompetente personen met orale ZOVIRAX® resulteerde in verminderde virale uitscheiding; verminderde tijd tot genezing; minder verspreiding; en verlichting van acute pijn.
Behandeling van varicella (waterpokken) bij immunocompetente patiënten met orale ZOVIRAX® verminderde het totale aantal laesies, versnelde de progressie van laesies naar de korstige en genezen stadia en verminderde het aantal resterende gehypopigmenteerde laesies. Bovendien verminderde ZOVIRAX® koorts en constitutionele symptomen geassocieerd met waterpokken.
Het profylactische gebruik van aciclovir bij waterpokken is niet vastgesteld.
Geriatrie (≥ 65 jaar): Gebruik bij de geriatrische populatie kan in verband worden gebracht met verschillen in veiligheid als gevolg van leeftijdsgerelateerde veranderingen in de nierfunctie en een korte bespreking is te vinden in de desbetreffende rubrieken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Kindergeneeskunde ( Er zijn geen gegevens beschikbaar.
DOSERING EN ADMINISTRATIE
Doseringsoverwegingen
- De dosering van ZOVIRAX® (aciclovir) moet worden verlaagd bij patiënten met een verminderde nierfunctie.
- De therapie moet zo snel mogelijk worden gestart na een diagnose van waterpokken of herpes zoster, of bij de eerste tekenen of symptomen van een uitbraak van genitale herpes.
- De aanbevolen dosering en gebruiksduur is afhankelijk van de indicatie.
Aanbevolen dosis en dosisaanpassing
Behandeling van initiële infectie van herpes genitalis: 200 mg (één tablet van 200 mg of één theelepel suspensie [5 ml]) elke 4 uur, 5 maal daags voor een totaal van 1 g per dag gedurende 10 dagen. De therapie moet zo snel mogelijk worden gestart na het optreden van tekenen en symptomen.
Suppressieve therapie voor terugkerende herpes genitalis
De aanbevolen aanvangsdosering is driemaal daags 200 mg (één tablet van 200 mg of één theelepel suspensie [5 ml]). Dit kan worden verhoogd als doorbraak optreedt tot een dosering van één tablet van 200 mg of één theelepel [5 ml] suspensie, vijfmaal daags. Indien nodig kan een dosis van 400 mg (twee tabletten van 200 mg of twee theelepels suspensie [10 ml]) tweemaal daags worden overwogen. Periodieke herevaluatie van de noodzaak van therapie wordt aanbevolen.
Toediening van ZOVIRAX® voor intermitterende therapie is 200 mg (één tablet van 200 mg of één theelepel [5 ml] suspensie) elke 4 uur 5 maal daags gedurende 5 dagen. De therapie moet worden gestart bij het eerste teken of symptoom (prodroom) van een recidief.
Behandeling van herpes zoster
800 mg oraal ZOVIRAX®, elke 4 uur, 5 keer per dag gedurende 7 tot 10 dagen. De behandeling moet binnen 72 uur na het begin van de laesies worden gestart. In klinische onderzoeken trad het grootste voordeel op wanneer de behandeling binnen 48 uur na het begin van de laesies werd gestart.
Behandeling van waterpokken
20 mg/kg (niet meer dan 800 mg) oraal, 4 maal daags gedurende 5 dagen. De therapie moet binnen 24 uur na het optreden van huiduitslag worden gestart.
Patiënten met acute of chronische nierinsufficiëntie
Voorzichtigheid is geboden bij toediening van aciclovir aan patiënten met een verminderde nierfunctie. Er moet voldoende hydratatie worden gehandhaafd.
Uitgebreide farmacokinetische onderzoeken zijn voltooid na intraveneuze aciclovir-infusies bij patiënten met nierinsufficiëntie.
Op basis van deze onderzoeken worden dosisaanpassingen aanbevolen in Tabel 5 voor indicaties voor genitale herpes en herpes zoster.
Hemodialyse
Voor patiënten die hemodialyse nodig hebben, is de gemiddelde plasmahalfwaardetijd van aciclovir tijdens hemodialyse ongeveer 5 uur. Dit resulteert in een verlaging van 60% van de plasmaconcentraties na een dialyseperiode van zes uur. Daarom moet het doseringsschema van de patiënt worden aangepast, zodat na elke dialyse een extra dosis wordt toegediend.
Peritoneale dialyse
Na aanpassing van het doseringsinterval blijkt geen aanvullende dosis nodig te zijn.
Gemiste dosis
Als een dosis ZOVIRAX® wordt gemist, moet de patiënt worden geadviseerd deze in te nemen zodra hij/zij het zich herinnert, en vervolgens verder te gaan met de volgende dosis met het juiste tijdsinterval.
HOE GELEVERD
Opslag en stabiliteit
ZOVIRAX®-tabletten moeten bij een gecontroleerde kamertemperatuur (15 tot 25 ° C) op een droge plaats en beschermd tegen licht worden bewaard.
ZOVIRAX® Suspensie moet worden bewaard bij een gecontroleerde kamertemperatuur (15 tot 25°C).
Doseringsvormen, samenstelling en verpakking
Oponthoud: Elke theelepel (5 ml) ZOVIRAX®-suspensie bevat 200 mg aciclovir en de niet-medicinale ingrediënten bananensmaak, cellulose, glycerine, methylparaben, propylparaben, sorbitol, vanilline en water.
Elke ZOVIRAX® 200-tablet bevat 200 mg aciclovir en de niet-medicinale ingrediënten cellulose, indigotine, lactose, magnesiumstearaat, povidon en natriumzetmeelglycolaat.
ZOVIRAX® Suspensie is verkrijgbaar in flessen van 125 ml* en 475 ml. Elke theelepel (5 ml) gebroken witte suspensie met bananensmaak bevat 200 mg aciclovir.
*fles van 125 ml niet beschikbaar in Canada
ZOVIRAX® 200 tabletten zijn verkrijgbaar in flacons van 100 tabletten. Elke blauwe, schildvormige, gecomprimeerde tablet met schuine randen bevat 200 mg aciclovir en is bedrukt met "ZOVIRAX" aan de ene kant en een driehoek aan de andere kant.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Herzien: 10 november 2014
BIJWERKINGEN
Overzicht van bijwerkingen van geneesmiddelen
De meest voorkomende bijwerkingen die verband houden met het gebruik van ZOVIRAX® (aciclovir) zijn hoofdpijn en misselijkheid.
In zeldzame gevallen zijn ook neurologische bijwerkingen gemeld. Oudere patiënten en patiënten met een voorgeschiedenis van nierinsufficiëntie lopen een verhoogd risico om deze effecten te ontwikkelen. In de gemelde gevallen waren deze reacties over het algemeen reversibel na stopzetting van de behandeling (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES , Bijwerkingen na het op de markt brengen van geneesmiddelen ).
Bijwerkingen van klinische proeven
Omdat klinische onderzoeken onder zeer specifieke omstandigheden worden uitgevoerd, is het mogelijk dat de in de klinische onderzoeken waargenomen bijwerkingen niet overeenkomen met de in de praktijk waargenomen percentages en mogen ze niet worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel. Informatie over bijwerkingen van geneesmiddelen uit klinische onderzoeken is nuttig voor het identificeren van geneesmiddelgerelateerde bijwerkingen en voor het benaderen van de percentages.
Behandeling van herpes simplex
Kortdurende toediening (5-10 dagen): De meest voorkomende bijwerkingen die zijn gemeld tijdens klinische onderzoeken naar de behandeling van genitale herpes met oraal ZOVIRAX® bij 298 patiënten staan vermeld in tabel 1.
Onderdrukking van Herpes Simplex
Langdurige toediening: De meest voorkomende bijwerkingen die zijn gemeld in een klinisch onderzoek ter preventie van recidieven bij continue toediening van 400 mg (twee capsules van 200 mg) 2 maal daags staan vermeld in Tabel 2.
Bewijs tot dusverre uit klinische onderzoeken suggereert dat het onwaarschijnlijk is dat de ernst en frequentie van bijwerkingen het staken van de behandeling noodzakelijk maken.
Herpes zoster
De meest voorkomende bijwerkingen die zijn gemeld tijdens drie klinische onderzoeken naar de behandeling van herpes zoster (gordelroos) met 800 mg oraal ZOVIRAX® 5 maal daags gedurende 7 of 10 dagen of placebo, staan vermeld in tabel 3.
Waterpokken
De meest voorkomende bijwerkingen die zijn gemeld tijdens drie klinische onderzoeken naar de behandeling van waterpokken met oraal ZOVIRAX® of placebo, staan vermeld in tabel 4.
Minder vaak voorkomende bijwerkingen van klinische onderzoeken (
Andere bijwerkingen die werden gemeld bij minder dan 1% van de patiënten die ZOVIRAX® kregen in een klinisch onderzoek waren: buikpijn, anorexia, constipatie, duizeligheid, oedeem, vermoeidheid, winderigheid, inguinale adenopathie, slapeloosheid, pijn in de benen, smaak van medicijnen, huiduitslag, pijn keel, krampachtige handbewegingen en urticaria.
Abnormale hematologische en klinische chemie bevindingen
Er zijn geen klinisch significante veranderingen in laboratoriumwaarden waargenomen in klinische onderzoeken voor de behandeling van waterpokken en zoster, en voor de behandeling en onderdrukking van genitale herpes met ZOVIRAX®.
Bijwerkingen na het op de markt brengen van geneesmiddelen
De volgende voorvallen zijn vrijwillig gemeld tijdens post-market gebruik van ZOVIRAX® in de klinische praktijk. Deze voorvallen zijn gekozen voor opname vanwege hun ernst, frequentie van rapportage, mogelijk causaal verband met ZOVIRAX® of een combinatie van deze factoren. Post-market bijwerkingen worden spontaan gemeld vanuit een populatie van onbekende omvang, dus schattingen van de frequentie kunnen niet worden gemaakt.
Algemeen: Koorts, hoofdpijn, pijn en perifeer oedeem.
Zenuwachtig: Duizeligheid, paresthesie, agitatie, verwardheid, tremor, ataxie, dysartrie, hallucinaties, psychotische symptomen, convulsies, slaperigheid, encefalopathie en coma zijn gemeld. Deze voorvallen zijn over het algemeen reversibel en worden gewoonlijk gemeld bij patiënten met een nierfunctiestoornis of met andere predisponerende factoren (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ). Deze symptomen kunnen uitgesproken zijn, vooral bij oudere volwassenen.
spijsvertering: Diarree, gastro-intestinale klachten en misselijkheid.
Hematogisch en lymfatisch: Bloedarmoede, leukopenie, lymfadenopathie en trombocytopenie.
Overgevoeligheid en huid: Alopecia, erythema multiforme, Stevens-Johnson-syndroom, toxische epidermale necrolyse, huiduitslag waaronder lichtgevoeligheid, pruritus, urticaria, dyspneu, angio-oedeem en anafylaxie.
Lever- en galwegen en pancreas: Meldingen van omkeerbare hyperbilirubinemie en verhoogde levergerelateerde enzymen. Hepatitis en geelzucht.
Musculoskeletaal: Spierpijn.
Speciale zintuigen: Visuele afwijkingen.
Urogenitaal: Verhoogde bloedcreatinine en bloedureumstikstof (BUN). Acuut nierfalen, nierpijn en hematurie zijn gemeld. Nierpijn kan in verband worden gebracht met nierfalen (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
DRUG-INTERACTIES
Geneesmiddel-geneesmiddelinteracties
Er zijn geen klinisch significante interacties vastgesteld.
Aciclovir wordt voornamelijk onveranderd in de urine uitgescheiden via actieve renale tubulaire secretie. Alle gelijktijdig toegediende geneesmiddelen die met dit mechanisme concurreren, kunnen de plasmaconcentraties van aciclovir verhogen. Probenecide en cimetidine vergroten door dit mechanisme de oppervlakte onder de curve (AUC) van aciclovir en verminderen de renale klaring van aciclovir. Evenzo zijn verhogingen van de plasma-AUC's van aciclovir en van de inactieve metaboliet van mycofenolaatmofetil, een immunosuppressivum dat wordt gebruikt bij transplantatiepatiënten, aangetoond wanneer de geneesmiddelen gelijktijdig worden toegediend. Er is echter geen dosisaanpassing nodig vanwege de brede therapeutische index van aciclovir.
Geneesmiddel-voedselinteracties
Er is geen interactie met voedsel bekend (zie: Actie en klinische farmacologie , Farmacokinetiek ).
Geneesmiddel-kruid interacties
Interacties met kruidenproducten zijn niet vastgesteld.
Geneesmiddel-laboratoriumtestinteracties
Interacties met laboratoriumtests zijn niet vastgesteld.
WAARSCHUWINGEN
ZOVIRAX (aciclovir) capsules, tabletten en suspensie zijn alleen bedoeld voor orale inname. Nierfalen, in sommige gevallen met overlijden tot gevolg, is waargenomen bij behandeling met aciclovir (zie: BIJWERKINGEN: waargenomen tijdens klinische praktijk en OVERDOSERING ). Trombotisch trombocytopenisch purpura/hemolytisch-uremisch syndroom (TTP/HUS), dat tot de dood heeft geleid, is opgetreden bij immuungecompromitteerde patiënten die behandeld werden met aciclovir.
PREVENTIEVE MAATREGELEN
Aanpassing van de dosering wordt aanbevolen bij toediening van ZOVIRAX (aciclovir) aan patiënten met een nierfunctiestoornis (zie: DOSERING EN ADMINISTRATIE ). Voorzichtigheid is ook geboden bij het toedienen van ZOVIRAX (aciclovir) aan patiënten die mogelijk nefrotoxische middelen krijgen, aangezien dit het risico op nierdisfunctie en/of het risico op reversibele symptomen van het centrale zenuwstelsel kan verhogen, zoals die zijn gemeld bij patiënten die worden behandeld met intraveneuze aciclovir. . Er moet voldoende hydratatie worden gehandhaafd.
Herpes zoster: Er zijn geen gegevens over de behandeling die meer dan 72 uur na het begin van de herpes zosteruitslag is gestart. Patiënten moeten worden geadviseerd om de behandeling zo snel mogelijk na een diagnose van herpes zoster te starten.
Genitale herpesinfecties: Patiënten moeten worden geïnformeerd dat ZOVIRAX (aciclovir) geen remedie is voor genitale herpes. Er zijn geen gegevens die evalueren of ZOVIRAX (aciclovir) de overdracht van infectie naar anderen zal voorkomen. Omdat genitale herpes een seksueel overdraagbare aandoening is, moeten patiënten contact met laesies of geslachtsgemeenschap vermijden wanneer laesies en/of symptomen aanwezig zijn om te voorkomen dat partners worden geïnfecteerd. Genitale herpes kan ook worden overgedragen als er geen symptomen zijn door asymptomatische virale uitscheiding. Als medische behandeling van een recidief van genitale herpes geïndiceerd is, moeten patiënten worden geadviseerd om de behandeling te starten bij het eerste teken of symptoom van een episode.
Waterpokken: Waterpokken bij overigens gezonde kinderen is meestal een zelfbeperkende ziekte van milde tot matige ernst. Adolescenten en volwassenen hebben de neiging om ernstiger ziekte te hebben. De behandeling werd gestart binnen 24 uur na de typische waterpokkenuitslag in de gecontroleerde onderzoeken en er is geen informatie over de effecten van de behandeling die later in het ziekteverloop is begonnen.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
De onderstaande gegevens bevatten verwijzingen naar de maximale steady-state plasmaconcentraties van aciclovir die zijn waargenomen bij mensen die werden behandeld met 800 mg 5 maal daags oraal toegediend (dosering geschikt voor de behandeling van herpes zoster) of 200 mg 5 maal daags oraal toegediend (dosering geschikt voor behandeling van genitale herpes). De plasmaconcentraties van geneesmiddelen in dierstudies worden uitgedrukt als veelvouden van de menselijke blootstelling aan aciclovir bij de hogere en lagere doseringsschema's (zie KLINISCHE FARMACOLOGIE: Farmacokinetiek ).
Acyclovir werd getest in levenslange bioassays bij ratten en muizen met enkelvoudige dagelijkse doses tot 450 mg/kg, toegediend via een sonde. Er was geen statistisch significant verschil in de incidentie van tumoren tussen behandelde en controledieren, noch verkortte aciclovir de latentietijd van tumoren. De maximale plasmaconcentraties waren 3 tot 6 maal de menselijke niveaus in de bioassay bij muizen en 1 tot 2 maal de menselijke niveaus in de bioassay bij ratten.
Acyclovir is getest in 16 in vitro en in vivo genetische toxiciteitstesten. Acyclovir was positief in 5 van de testen.
Aciclovir had geen nadelige invloed op de vruchtbaarheid of reproductie bij muizen (450 mg/kg/dag, po) of bij ratten (25 mg/kg/dag, sc). In de muisstudie waren de plasmaspiegels 9 tot 18 keer de menselijke niveaus, terwijl ze in de rattenstudie 8 tot 15 keer de menselijke niveaus waren. Bij hogere doses (50 mg/kg/dag, sc) bij ratten en konijnen (respectievelijk 11 tot 22 en 16 tot 31 maal de humane niveaus) was de implantatie-efficiëntie, maar niet de worpgrootte, verminderd. In een peri- en postnataal onderzoek bij ratten met 50 mg/kg/dag, sc, was er een statistisch significante afname van het groepsgemiddelde aantal corpora lutea, totale implantatieplaatsen en levende foetussen.
Er werden geen testikelafwijkingen gezien bij honden die 50 mg/kg/dag, IV gedurende 1 maand kregen (21 tot 41 maal menselijke niveaus) of bij honden die 60 mg/kg/dag oraal kregen gedurende 1 jaar (6 tot 12 maal menselijke niveaus). Testiculaire atrofie en aspermatogenese werden waargenomen bij ratten en honden bij hogere doseringen.
Zwangerschap
Teratogene effecten: Zwangerschap Categorie B. Acyclovir toegediend tijdens de organogenese was niet teratogeen bij de muis (450 mg/kg/dag, po), konijn (50 mg/kg/dag, sc en IV) of rat (50 mg/kg/dag, sc). Deze blootstellingen resulteerden in plasmaspiegels van respectievelijk 9 en 18, 16 en 106, en 11 en 22 keer de humane spiegels.
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Een prospectieve epidemiologische registratie van het gebruik van aciclovir tijdens de zwangerschap werd opgericht in 1984 en voltooid in april 1999. Er waren 749 zwangerschappen gevolgd bij vrouwen die tijdens het eerste trimester van de zwangerschap waren blootgesteld aan systemische aciclovir, resulterend in 756 uitkomsten. Het voorkomen van geboorteafwijkingen benadert dat in de algemene bevolking. De kleine omvang van het register is echter onvoldoende om het risico op minder vaak voorkomende defecten te beoordelen of om betrouwbare of definitieve conclusies te trekken over de veiligheid van aciclovir bij zwangere vrouwen en hun zich ontwikkelende foetussen. Aciclovir mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Moeders die borstvoeding geven
Aciclovirconcentraties zijn gedocumenteerd in moedermelk bij 2 vrouwen na orale toediening van ZOVIRAX (aciclovir) en varieerden van 0,6 tot 4,1 maal de overeenkomstige plasmaspiegels. Deze concentraties zouden de zuigeling mogelijk blootstellen aan een dosis aciclovir tot 0,3 mg/kg/dag. ZOVIRAX (aciclovir) moet met voorzichtigheid aan een zogende moeder worden toegediend en alleen op indicatie.
Pediatrisch gebruik
De veiligheid en werkzaamheid van orale formuleringen van aciclovir bij pediatrische patiënten jonger dan 2 jaar zijn niet vastgesteld.
Geriatrisch gebruik
Van de 376 proefpersonen die ZOVIRAX (aciclovir) kregen in een klinisch onderzoek naar de behandeling van herpes zoster bij immunocompetente proefpersonen 50 jaar, waren er 244 65 jaar en ouder, terwijl 111 75 jaar en ouder waren. Er werden geen algemene verschillen in effectiviteit gerapporteerd tussen geriatrische proefpersonen en jongere volwassen proefpersonen. De duur van pijn na genezing was langer bij patiënten van 65 jaar en ouder. Misselijkheid, braken en duizeligheid werden vaker gemeld bij oudere proefpersonen. Oudere patiënten hebben meer kans op een verminderde nierfunctie en hebben een dosisverlaging nodig. Oudere patiënten hebben ook meer kans op nier- of CZS-bijwerkingen. Met betrekking tot CZS-bijwerkingen die tijdens de klinische praktijk werden waargenomen, werden slaperigheid, hallucinaties, verwardheid en coma vaker gemeld bij oudere patiënten (zie KLINISCHE FARMACOLOGIE, BIJWERKINGEN: waargenomen tijdens klinische praktijk, en DOSERING EN ADMINISTRATIE ).
OVERDOSERING
Neem voor de behandeling van een vermoedelijke overdosis drugs contact op met uw regionale Antigifcentrum.
Geactiveerde kool kan worden toegediend om te helpen bij het verwijderen van niet-geabsorbeerd geneesmiddel. Algemene ondersteunende maatregelen worden aanbevolen.
Aciclovir wordt slechts gedeeltelijk geabsorbeerd in het maagdarmkanaal. Patiënten hebben in één keer tot 20 g aciclovir ingenomen, zonder onverwachte bijwerkingen. In klinische onderzoeken was de hoogste plasmaconcentratie waargenomen bij een enkele patiënt bij deze doses 10,0 g/ml. Accidentele, herhaalde overdoseringen van oraal aciclovir gedurende meerdere dagen zijn in verband gebracht met gastro-intestinale effecten (zoals misselijkheid en braken) en neurologische effecten (hoofdpijn en verwardheid).
Intraveneuze doses die aan mensen werden toegediend, waren tot wel 1200 mg/m² (28 mg/kg) driemaal daags gedurende maximaal 2 weken. Piekplasmaconcentraties hebben 80 g/ml bereikt. Overdosering van intraveneuze aciclovir heeft geleid tot verhogingen van serumcreatinine, bloedureumstikstof en daaropvolgend nierfalen. Neurologische effecten, waaronder verwardheid, hallucinaties, agitatie, toevallen en coma, zijn beschreven in verband met intraveneuze overdosering.
Patiënten moeten nauwlettend worden geobserveerd op tekenen van toxiciteit. Hemodialyse verbetert de verwijdering van aciclovir uit het bloed aanzienlijk en kan daarom worden beschouwd als een behandelingsoptie in het geval van symptomatische overdosering. Neerslag van aciclovir in de niertubuli kan optreden als de oplosbaarheid (2,5 mg/ml) in de intratubulaire vloeistof wordt overschreden. In het geval van nierfalen en anurie kan de patiënt baat hebben bij hemodialyse totdat de nierfunctie is hersteld (zie: DOSERING EN ADMINISTRATIE ).
CONTRA-INDICATIES
ZOVIRAX® (aciclovir) is gecontra-indiceerd voor patiënten die overgevoeligheid ontwikkelen of die overgevoelig zijn voor aciclovir, valaciclovir of andere componenten van de formuleringen van ZOVIRAX®. Voor een volledige lijst, zie Doseringsvormen , Samenstelling en verpakking gedeelte van de productmonografie .
KLINISCHE FARMACOLOGIE
Actie en klinische farmacologie
Werkingsmechanisme
ZOVIRAX® (acyclovir), een synthetisch acyclisch purine-nucleoside-analogon, is een substraat met een hoge mate van specificiteit voor herpes simplex en varicella-zoster gespecificeerd thymidinekinase. Acyclovir is een slecht substraat voor gastheercel-gespecificeerde thymidinekinase. Herpes simplex en varicella-zoster gespecificeerde thymidinekinase zetten acyclovir om in zijn monofosfaat, dat vervolgens door een aantal cellulaire enzymen wordt omgezet in acyclovirdifosfaat en acyclovirtrifosfaat. Acyclovirtrifosfaat is zowel een remmer van als een substraat voor herpesvirus-gespecificeerd DNA-polymerase. Hoewel het cellulaire α-DNA-polymerase in geïnfecteerde cellen ook kan worden geremd door aciclovirtrifosfaat, gebeurt dit alleen bij concentraties van aciclovirtrifosfaat die hoger zijn dan die welke het door herpesvirus gespecificeerde DNA-polymerase remmen. Acyclovir wordt selectief omgezet in zijn actieve vorm in met herpesvirus geïnfecteerde cellen en wordt dus bij voorkeur door deze cellen opgenomen. Acyclovir heeft in vitro een veel lager toxisch potentieel aangetoond voor normale niet-geïnfecteerde cellen omdat: 1) er minder wordt opgenomen; 2) minder wordt omgezet in de actieve vorm; en 3) cellulair a-DNA-polymerase heeft een lagere gevoeligheid voor de werking van de actieve vorm van het geneesmiddel. Een combinatie van de thymidinekinasespecificiteit, remming van DNA-polymerase en voortijdige beëindiging van DNA-synthese resulteert in remming van herpesvirusreplicatie. Er is geen effect op latent niet-replicerend virus aangetoond. Remming van het virus verkort de periode van virale uitscheiding, beperkt de mate van verspreiding en het niveau van pathologie en vergemakkelijkt daardoor de genezing. Tijdens onderdrukking is er geen bewijs dat aciclovir neurale migratie van het virus voorkomt. Het stopt episodes van terugkerende herpes als gevolg van remming van virale replicatie na reactivering.
Farmacokinetiek
De farmacokinetiek van aciclovir na orale toediening is geëvalueerd in 6 klinische onderzoeken met 110 volwassen patiënten.
Absorptie
In één onderzoek onder 35 immuungecompromitteerde patiënten met herpes simplex- of varicella-zoster-infectie die ZOVIRAX®-capsules kregen in doses van 200 tot 1.000 mg elke 4 uur, 6 maal daags gedurende 5 dagen, werd de biologische beschikbaarheid geschat op 15 tot 20%. In deze studie werden steady-state plasmaspiegels bereikt op de tweede dag van toediening. De gemiddelde steady-state piek- en dalconcentraties na de laatste dosis van 200 mg waren respectievelijk 0,49 g/ml (0,47 tot 0,54 g/ml) en 0,31 μg/ml (0,18 tot 0,41 μg/ml), en na de laatste dosis van 800 mg waren 2,8 g/ml (2,3 tot 3,1 g/ml) en 1,8 μg/ml (1,3 tot 2,5 g/ml). In een ander onderzoek kregen 20 immunocompetente patiënten met terugkerende genitale herpes simplex-infecties ZOVIRAX®-capsules in een dosis van 800 mg om de 6 uur, 4 maal daags gedurende 5 dagen. De gemiddelde steady-state piek- en dalconcentraties waren 1,4 g/ml (0,66 tot 1,8 g/ml) en 0,55 g/ml (0,14 tot 1,1 g/ml).
In een cross-overonderzoek met meerdere doses waarbij 23 vrijwilligers ZOVIRAX® kregen als één capsule van 200 mg, één tablet van 400 mg en één tablet van 800 mg zesmaal daags, nam de absorptie af met toenemende dosis en waren de geschatte biologische beschikbaarheid van aciclovir 20, 15 en 10% , respectievelijk. Aangenomen wordt dat de afname van de biologische beschikbaarheid een functie is van de dosis en niet van de doseringsvorm. Er werd aangetoond dat aciclovir niet dosisproportioneel is over het doseringsbereik van 200 tot 800 mg. In deze studie waren de steady-state piek- en dalconcentraties van aciclovir 0,83 en 0,46 g/ml, 1,21 en 0,63 g/ml, en 1,61 en 0,83 g/ml voor respectievelijk de 200, 400 en 800 mg doseringsschema's.
In een ander onderzoek bij 6 vrijwilligers was de invloed van voedsel op de absorptie van aciclovir niet duidelijk.
Een onderzoek naar de biologische beschikbaarheid van een enkele orale dosis bij 23 normale vrijwilligers toonde aan dat ZOVIRAX®-capsules 200 mg bio-equivalent zijn aan 200 mg aciclovir in waterige oplossing. In een afzonderlijke studie bij 20 vrijwilligers werd aangetoond dat ZOVIRAX®-suspensie bio-equivalent is aan ZOVIRAX®-capsules. In een ander onderzoek naar biologische beschikbaarheid/bio-equivalentie met een enkele dosis bij 24 vrijwilligers, werd aangetoond dat één ZOVIRAX® 800 mg-tablet biologisch gelijkwaardig is aan vier ZOVIRAX® 200 mg-capsules.
Verdeling
De plasma-eiwitbinding is relatief laag (9 tot 33%) en geneesmiddelinteracties met verdringing van de bindingsplaats worden niet verwacht.
Eliminatie
Na orale toediening varieerde de gemiddelde plasmahalfwaardetijd van aciclovir bij vrijwilligers en patiënten met een normale nierfunctie van 2,5 tot 3,3 uur. De gemiddelde renale excretie van onveranderd geneesmiddel is goed voor 14,4% (8,6 tot 19,8%) van de oraal toegediende dosis. De enige metaboliet in de urine (geïdentificeerd door hogedrukvloeistofchromatografie) is 9-[(carboxymethoxy)methyl]guanine.
Speciale populaties en omstandigheden
Kindergeneeskunde
Over het algemeen is de farmacokinetiek van aciclovir bij kinderen vergelijkbaar met die bij volwassenen. De gemiddelde halfwaardetijd na orale doses van 300 en 600 mg/m² bij kinderen van 7 maanden tot 7 jaar was 2,6 uur (spreiding 1,59 tot 3,74 uur).
Oraal toegediende aciclovir bij kinderen jonger dan 2 jaar is nog niet volledig onderzocht.
Geriatrie
Bij ouderen neemt de totale lichaamsklaring af met toenemende leeftijd, wat gepaard gaat met een afname van de creatinineklaring, hoewel er weinig verandering is in de terminale plasmahalfwaardetijd. Een verlaging van de dosering kan nodig zijn bij geriatrische patiënten met een verminderde nierfunctie (zie: DOSERING EN ADMINISTRATIE ).
Nierinsufficiëntie
De halfwaardetijd en totale lichaamsklaring van aciclovir zijn afhankelijk van de nierfunctie.
Bij patiënten met een verminderde nierfunctie wordt een dosisaanpassing aanbevolen (zie: DOSERING EN ADMINISTRATIE ).
Klinische proeven
Initiële genitale herpes
Dubbelblinde, placebogecontroleerde onderzoeken hebben aangetoond dat oraal toegediende ZOVIRAX® de duur van een acute infectie en de duur van de genezing van de laesie significant verminderde. De duur van de pijn en de vorming van nieuwe laesies was in sommige patiëntengroepen verminderd.
Terugkerende genitale herpes
In een onderzoek onder patiënten die ZOVIRAX® 400 mg tweemaal daags kregen gedurende 3 jaar, bleven 45, 52 en 63% van de patiënten vrij van recidieven in respectievelijk het eerste, tweede en derde jaar. Seriële analyses van de recidiefpercentages van 3 maanden voor de patiënten toonden aan dat 71 tot 87% recidiefvrij was in elk kwartaal.
Herpes zoster-infecties
In een dubbelblinde, placebogecontroleerde studie van immunocompetente patiënten met gelokaliseerde cutane zoster-infectie, verkortte ZOVIRAX® (800 mg 5 maal daags gedurende 10 dagen) de tijd tot korstvorming, genezing en volledige stopzetting van de pijn van de laesie, en verminderde de duur van virale verlies en de duur van de vorming van nieuwe laesies.
In een vergelijkbare dubbelblinde, placebo-gecontroleerde studie verkortte ZOVIRAX® (800 mg 5 maal daags gedurende 7 dagen) de tijd tot volledige korstvorming, genezing en stopzetting van de laesie, en verminderde de duur van de vorming van nieuwe laesies.
De behandeling werd binnen 72 uur na het begin van de uitslag gestart en was het meest effectief als deze binnen de eerste 48 uur werd gestart. Volwassenen ouder dan 50 jaar toonden meer voordeel.
Waterpokken
Drie gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken werden uitgevoerd bij 993 pediatrische patiënten van 2 tot 18 jaar met waterpokken. Alle patiënten werden binnen 24 uur na het begin van de uitslag behandeld. In twee onderzoeken werd ZOVIRAX® viermaal daags (tot 3.200 mg per dag) gedurende 5 dagen toegediend in een dosering van 20 mg/kg. In het derde onderzoek werden gedurende 5 tot 7 dagen viermaal daags doses van 10, 15 of 20 mg/kg toegediend. Behandeling met ZOVIRAX® verkortte de genezingstijd tot 50%, verminderde het maximale aantal laesies, verminderde het mediane aantal blaasjes, verminderde het mediane aantal resterende laesies op dag 28 en verminderde het aantal patiënten met koorts, anorexia en lethargie op dag 2. Behandeling met ZOVIRAX® had geen invloed op varicella zoster-virus-specifieke humorale of cellulaire immuunresponsen 1 maand of 1 jaar na de behandeling.
Gedetailleerde farmacologie
Zien Actie en klinische farmacologie.
Virologie
De kwantitatieve relatie tussen de in vitro gevoeligheid van herpes simplex-virus (HSV) en varicella-zoster-virussen (VZV) voor aciclovir en de klinische respons op therapie is bij de mens niet vastgesteld en het testen op virusgevoeligheid is niet gestandaardiseerd. De resultaten van gevoeligheidstests, uitgedrukt als de concentratie van het geneesmiddel die nodig is om de groei van het virus in celkweek (ID50) met 50% te remmen, variëren sterk, afhankelijk van de specifieke gebruikte test, het gebruikte celtype en het laboratorium dat de test uitvoert. De ID50 van aciclovir tegen HSV-1-isolaten kan variëren van 0,02 g/ml (vermindering van plaque in Vero-cellen) tot 5,9-13,5 g/ml (vermindering van plaque in niercellen van groene apen [GMK]). De ID50 tegen HSV-2 varieert van 0,01 tot 9,9 g/ml (plaquereductie in respectievelijk Vero- en GMK-cellen).
Met behulp van een kleurstofopnamemethode in Vero-cellen, die ID50-waarden geeft die ongeveer 5 tot 10 keer hoger zijn dan plaquereductie-assays, werden 1.417 HSV-isolaten (553 HSV-1 en 864 HSV-2) van ongeveer 500 patiënten onderzocht gedurende een 5- jaar periode. Uit deze testen bleek dat 90% van de HSV-1-isolaten gevoelig was voor ≤ 0,9 g/ml aciclovir en dat 50% van alle isolaten gevoelig was voor ≤ 0,2 g/ml aciclovir. Voor HSV-2-isolaten was 90% gevoelig voor ≤ 2,2 g/ml en 50% van alle isolaten was gevoelig voor ≤ 0,7 g/ml aciclovir. Bij 44 patiënten werden isolaten met een significant verminderde gevoeligheid gevonden. Benadrukt moet worden dat noch de patiënten, noch de isolaten willekeurig werden geselecteerd en daarom niet de algemene bevolking vertegenwoordigen. De meeste van de minder gevoelige klinische isolaten van HSV waren relatief deficiënt in het virale thymidinekinase (TK). Stammen met veranderingen in virale TK of virale DNA-polymerase zijn ook gemeld.
De ID50 tegen VZV varieert van 0,17-1,53 g/ml (opbrengstreductie, humane voorhuidfibroblasten) tot 1,85-3,98 μg/ml (focusreductie, humane embryofibroblasten [HEF]). De reproductie van het EBV-genoom wordt in supergeïnfecteerde Raji-cellen of P3HR-1-lymfoblastoïde cellen met 50% onderdrukt door 1,5 g/ml aciclovir. Cytomegalovirus (CMV) is relatief resistent tegen aciclovir met ID50-waarden variërend van 2,3-17,6 g/ml (plaquereductie, HEF-cellen) tot 1,82-56,8 g/ml (DNA-hybridisatie, HEF-cellen). Het is niet bekend dat de latente toestand van het genoom van een van de menselijke herpesvirussen gevoelig is voor aciclovir.
Weerstand
Langdurige blootstelling van HSV aan subremmende concentraties (0,1 g/ml) aciclovir in celcultuur heeft geleid tot het ontstaan van een verscheidenheid aan aciclovir-resistente stammen. Aangenomen wordt dat het ontstaan van resistente stammen plaatsvindt door "selectie" van natuurlijk voorkomende virussen met een relatief lage gevoeligheid voor aciclovir. Dergelijke stammen zijn gerapporteerd in pre-therapie isolaten uit verschillende klinische onderzoeken.
Er zijn twee resistentiemechanismen beschreven waarbij viraal thymidinekinase betrokken is (vereist voor activering van aciclovir). Dit zijn: (a) selectie van thymidine-kinase-deficiënte mutanten die weinig of geen enzymactiviteit induceren na infectie, en (b) selectie van mutanten die een thymidinekinase bezitten met veranderde substraatspecificiteit die in staat is om het natuurlijke nucleoside thymidine te fosforyleren maar niet aciclovir. De meeste minder gevoelige virussen die in vitro ontstaan, zijn van het thymidine-kinase-deficiënte type, die een verminderde infectiviteit en pathogeniteit hebben en minder kans hebben om latentie bij dieren te induceren.
Een aciclovir-resistente HSV-infectie bij een ontvanger van een beenmergtransplantaat met immunosuppressie die langdurig met aciclovir werd behandeld, bleek echter te wijten te zijn aan een klinisch isolaat met een normaal thymidinekinase maar een gewijzigd DNA-polymerase. Dit derde resistentiemechanisme waarbij DNA-polymerase van het herpes-simplexvirus betrokken is, is te wijten aan de selectie van mutanten die coderen voor een veranderd enzym, dat resistent is tegen inactivatie door aciclovirtrifosfaat.
VZV lijkt resistentie tegen aciclovir te vertonen via mechanismen die vergelijkbaar zijn met die bij HSV.
Beperkt klinisch onderzoek heeft echter geen bewijs opgeleverd voor een significante verandering in de in vitro gevoeligheid van VZV met aciclovirtherapie, hoewel resistente mutanten van dit virus in vitro kunnen worden geïsoleerd op een manier die analoog is aan HSV. Analyse van een klein aantal klinische isolaten van patiënten die orale aciclovir of placebo kregen voor acute herpes zoster, suggereert dat in vivo het ontstaan van resistente VZV niet vaak voorkomt. Langdurige behandeling met aciclovir van sterk immuungecompromitteerde patiënten met verworven immunodeficiëntiesyndroom en ernstige VZV kan leiden tot het optreden van resistent virus.
Kruisresistentie tegen andere antivirale middelen komt in vitro voor bij aciclovir-resistente mutanten. HSV-mutanten die resistent zijn tegen acyclovir vanwege de afwezigheid van viraal thymidinekinase, zijn kruisresistent tegen andere middelen die worden gefosforyleerd door herpesvirus-thymidinekinase, zoals broomvinyldeoxyuridine, ganciclovir en de 2'-fluoropyrimidine-nucleosiden, zoals 2'-fluoro -5-joodarabinosyl-cytosine (FIAC).
De klinische respons op behandeling met aciclovir was gewoonlijk goed voor patiënten met een normale immuniteit bij wie HSV met verminderde gevoeligheid voor aciclovir is hersteld, vóór, tijdens of na de behandeling. Er is echter vastgesteld dat bepaalde patiëntengroepen, zoals ernstig immuungecompromitteerde (met name ontvangers van een beenmergtransplantatie) en patiënten die chronische onderdrukkende behandelingen ondergaan, het vaakst worden geassocieerd met het ontstaan van resistente herpes simplex-stammen, die al dan niet gepaard gaan met een slechte respons. aan het medicijn. De mogelijkheid van het optreden van minder gevoelige virussen moet worden erkend bij de behandeling van dergelijke patiënten, en monitoring van de gevoeligheid van klinische isolaten van deze patiënten moet worden aangemoedigd.
Samenvattend is de kwantitatieve relatie tussen de in vitro gevoeligheid van HSV en VZV voor aciclovir en de klinische respons op therapie bij de mens niet duidelijk vastgesteld. Er zijn gestandaardiseerde methoden voor het testen van virusgevoeligheid vereist om nauwkeuriger correlaties mogelijk te maken tussen in vitro virusgevoeligheid en klinische respons op aciclovirtherapie.
Toxicologie
Acute toxiciteitsstudies
Volwassen muizen en ratten : De acute toxiciteit van oraal aciclovir werd bepaald zoals weergegeven in Tabel 6.
Neonatale, onvolwassen en volwassen ratten
Groepen van 10 mannelijke en 10 vrouwelijke Charles River CD (Sprague-Dawley) ratten kregen enkele grote doses (5 verschillende dosisniveaus) van een oplossing (pH 11,0) van aciclovir door subcutane injectie toen ze 3, 10, 28 en 71 dagen oud waren. oud. Ze werden gedurende 14 dagen na behandeling geobserveerd en LD50-waarden werden berekend met de Litchfield- en Wilcoxon-methode (zie Tabel 7 hieronder). Deze studie werd uitgevoerd om te bepalen of leeftijd bij blootstelling de acute toxiciteit van aciclovir beïnvloedt; er was geen bewijs dat jonge ratten gevoeliger waren dan oudere ratten voor de acute toxische effecten van aciclovir.
Er was geen duidelijk verband tussen de overlevingsduur na de behandeling en de leeftijd waarop de behandeling werd gegeven. Klinische tekenen voor de ratten die werden behandeld op een leeftijd van 3 en 10 dagen waren onder meer rode en paarse huidblaren, blauwe gebieden, korsten, littekens, necrotische en vervelling van de huid, open wonden, lichaamstrillingen en alopecia. Verminderde activiteit, tranenvloed, gesloten oogleden, roodbruin of bruin materiaal rond de ogen, neus en mond, ataxie, uitputting, lichaamstrillingen, urinevlekken rond de buik of het genitale gebied, korst- of necrotische gebieden en alopecia werden waargenomen bij ratten die werden behandeld met 28 en 71 dagen oud.
Onderzoek naar subchronische orale toxiciteit
muizen
Vier groepen, elk bestaande uit 28 mannelijke en 28 vrouwelijke Charles River CD-1 (ICR)-muizen, werden gedurende 33 dagen oraal via een maagsonde toegediend met suspensies van aciclovir. De dagelijkse dosisniveaus waren 0, 50, 150 en 450 mg/kg. Hematologische en klinische chemiemetingen werden gedaan op nog eens 8 mannelijke en 8 vrouwelijke muizen per groep (op dezelfde manier gedoseerd) na de eerste en vierde week van dosering en tijdens de 3e week na dosering.
Plasma-geneesmiddelconcentraties werden gemeten in gepoolde monsters van nog eens 4 mannelijke en 4 vrouwelijke muizen per groep op dosisdagen 1, 15 en 30.
Gebaseerd op voorlopige experimenten met ratten en muizen, werd de hoge dosis van 450 mg/kg gekozen om de hoogst haalbare plasmaspiegels van het geneesmiddel te produceren, op een praktische manier, door orale dosering bij een knaagdiersoort. De gemiddelde plasmaconcentraties van het geneesmiddel varieerden van ongeveer 3,4 (bij de lage dosis) tot 11,0 (bij de hoge dosis) g/ml plasma één uur na orale toediening.

Er traden geen veranderingen op in metingen van gezondheid, groeisnelheid, hematologie en klinische chemie die zeker kunnen worden toegeschreven aan dosering met aciclovir. Grove en histopathologische onderzoeken van 16 mannelijke en 16 vrouwelijke ratten uit de hoge dosis- en controlegroepen aan het einde van de dosisperiode brachten niets opmerkelijks aan het licht.
Onderzoek naar chronische toxiciteit
Levenslange orale toxiciteitsstudie bij ratten die aciclovir kregen via maagintubatie
Charles River CD (Sprague-Dawley) ratten kregen suspensies van aciclovir via een sonde. Er waren 50 mannelijke en 50 vrouwelijke ratten bij elk van de volgende dosisniveaus: 0, 50, 150 en 450 mg/kg. Na 30 en 52 weken behandeling werd bij 10 mannelijke en 10 vrouwelijke ratten uit elke groep necropsie uitgevoerd. De overige ratten werden elke dag gedoseerd totdat de natuurlijke sterfte een groepsgrootte verminderde tot ongeveer 20% van het aantal dieren van dat geslacht dat aanwezig was in de testgroepen toen het onderzoek werd gestart. Alle overblijvende ratten werden gedood en aan necropsie onderworpen toen het afkappunt van 20% werd bereikt. Dit was in week 110 voor de mannelijke ratten en in week 122 voor de vrouwelijke ratten. Weefsels van controleratten en die in de groep met een hoge dosis werden geëvalueerd met lichtmicroscopie. Weefsels van ratten in de groepen met lage en middelhoge doses met massa's, knobbeltjes of ongebruikelijke laesies werden ook onderzocht met lichtmicroscopie. Vaste weefsels van ratten die tijdens de eerste 52 weken van het onderzoek dood werden aangetroffen, werden ook beoordeeld met lichtmicroscopie.
Er werden geen tekenen van toxicose waargenomen. Plasmamonsters werden 1,5 uur na dosering verzameld op dag 7, 90, 209, 369, 771 (alleen mannen) en 852 (alleen vrouwen). De gemiddelde plasmaspiegels gevonden bij mannen met een hoge dosis (450 mg/kg/dag) op de hierboven aangegeven tijden waren als volgt: 1,54, 1,63, 1,39, 1,60 en 1,70 g/ml (6,84, 7,26, 6,17, 7,10 en 7,56 M) . Overeenkomstige gemiddelde plasmaspiegels voor de hooggedoseerde vrouwtjes voor de overeenkomstige tijdsperioden waren 1,76, 2,38, 2,12, 1,71 en 1,81 g/ml (7,82, 10,58, 9,44, 7,62 en 8,03 M). Plasmaspiegels bij zowel mannen als vrouwen bij alle dosisniveaus na een jaar behandeling waren over het algemeen vergelijkbaar met plasmaspiegels verkregen bij eerdere monsternames. Waarden voor laboratoriumtests, waaronder hematologie, klinische chemie en oftalmoscopie, waren allemaal binnen het normale bereik. Er waren geen door geneesmiddelen veroorzaakte grove of microscopische laesies en er was geen bewijs dat aciclovir de overleving beïnvloedde.
Levenslang oraal carcinogeniteitsonderzoek bij ratten
Er waren geen tekenen van toxicose bij Charles River CD (Sprague-Dawley) ratten (100 ratten/geslacht/dosisgroep) die aciclovir kregen via orale sondevoeding van 50, 150 en 450 mg/kg in een levenslang oraal carcinogeniteitsonderzoek. De gemiddelde plasmaspiegels verkregen bij mannen met een hoge dosis 1,5 uur na toediening op verschillende bemonsteringstijden tijdens het onderzoek waren als volgt: 1,54, 1,63, 1,39, 1,60 en 1,70 g/ml (6,84, 7,26, 6,17, 7,10 en 7,56 M) op dagen respectievelijk 7, 90, 209, 369 en 771. Overeenkomstige gemiddelde waarden voor de hooggedoseerde vrouwtjes waren respectievelijk 1,76, 2,38, 2,12, 1,71 en 1,81 g/ml (7,82, 10,58, 9,44, 7,62 en 8,03 M).
Waarden voor klinische laboratoriumtests, waaronder hematologie, klinische chemie, urineonderzoek, lichaamsgewicht, voedselconsumptie en oftalmoscopie waren allemaal binnen de normale grenzen. Er waren geen door geneesmiddelen geïnduceerde grove of microscopische laesies en er was geen bewijs dat aciclovir de overleving, temporele patronen van tumorincidentie of tumoraantallen voor goedaardige of kwaadaardige neoplasmata beïnvloedde.
De meeste van de relatief weinige ratten die tijdens de eerste 52 weken van dit onderzoek dood of stervende werden aangetroffen, leden aan doseringsongevallen, zoals blijkt uit postmortale bevindingen van slokdarmperforatie die pleurale effusie, longontsteking of mediastinitis veroorzaakten.
Levenslang oraal carcinogeniteitsonderzoek bij muizen
Er waren geen tekenen van toxicose bij Charles River CD-1 (ICR) muizen (115 muizen/geslacht/dosisgroep) die aciclovir kregen via orale sondevoeding van 50, 150 en 450 mg/kg/dag in een levenslang oraal carcinogeniteitsonderzoek. De gemiddelde plasmaspiegels die werden verkregen bij mannen met een hoge dosis 1,5 uur na toediening op verschillende bemonsteringstijden tijdens het onderzoek waren als volgt: 2,83, 3,17 en 1,82 g/ml (12,59, 14,10 en 8,10 M) op respectievelijk dag 90, 365 en 541. Overeenkomstige gemiddelde waarden voor de hooggedoseerde vrouwtjes waren 9,81, 5,85 en 4,0 g/ml (43,60, 26,0 en 17,79 M).
Waarden voor klinische laboratoriumtests, waaronder hematologie, lichaamsgewicht en voedselconsumptie, lagen allemaal binnen de normale waarden. Er waren geen door geneesmiddelen veroorzaakte grove of microscopische laesies. Vrouwelijke muizen die 150 en 450 mg/kg aciclovir kregen, overleefden significant langer dan vrouwelijke controlemuizen; overleving van behandelde mannen was vergelijkbaar met overleving van controlemannetjes. Patronen van tumorincidentie en tumoraantallen voor goedaardige of kwaadaardige neoplasmata werden niet beïnvloed door behandeling met aciclovir.
Onderzoek naar chronische orale toxiciteit van 12 maanden bij honden
Raszuivere Beagle-honden kregen gedurende de eerste twee weken van een eenjarig onderzoek elke dag 0, 15, 45 of 150 mg/kg/dag aciclovir. Er waren 9 mannelijke en 9 vrouwelijke honden in elke testgroep. De honden kregen gelatinecapsules die de juiste dosis bevatten. Ze werden driemaal behandeld, vandaar dat de doseringen die werden toegediend in elk van drie op gelijke afstand van elkaar gelegen doseringsperioden 0, 5, 15 en 50 mg/kg waren. De dosisniveaus van 45 en 150 mg/kg veroorzaakten diarree, braken, verminderde voedselconsumptie en gewichtsverlies bij zowel mannelijke als vrouwelijke honden tijdens de eerste twee weken van het onderzoek. Om deze reden werd tijdens de derde week van het onderzoek besloten om de midden- en hoge doseringen te verlagen tot 30 en 60 mg/kg/dag (10 en 20 mg/kg driemaal daags). De lage dosis van 15 mg/kg/dag (5 mg/kg driemaal daags) was onveranderd. Honden die 60 mg/kg/dag kregen, braken af en toe en hadden af en toe diarree, maar deden het goed voor de duur van de test, en de waarden voor lichaamsgewichtstoename en voedselconsumptie waren vergelijkbaar met de controlewaarden.
Tijdens de toxicose veroorzaakt door de hogere doses aciclovir waren de plasmaspiegels van het geneesmiddel waarschijnlijk erg hoog (zoals aangegeven door initiële gemiddelde waarden van 24,0 g/ml (106,6 μM) voor mannen met een hoge dosis en 17,4 g/ml (77,2 M) voor vrouwen met een hoge dosis wanneer bepaald 1 uur na de derde dosis op dag 1 van het onderzoek). Bij meting op dag 15 waren de plasmaspiegels van aciclovir bij honden met een hoge dosis (150 mg/kg/dag) nog steeds erg hoog, maar ze namen later af toen de doseringen werden verlaagd. Waarden voor plasmaspiegels na 12 maanden behandeling waren over het algemeen vergelijkbaar met waarden die werden geregistreerd na 1, 3 en 6 maanden behandeling. Er waren dus geen aanwijzingen voor een verhoogd metabolisme van aciclovir als gevolg van chronische behandeling.
Tijdens de 13e week vertoonden sommige mannelijke en vrouwelijke honden bij zowel de gemiddelde als de hoge dosering de volgende tekenen: gevoeligheid in de voorpoten, erosie van voetzolen en breken en losraken van nagels. Regeneratie van verloren nagels begon een paar weken later. Na 6 maanden herstelden de nagels (wanneer 3 mannetjes en 3 vrouwtjes van elke groep werden gedood voor een tussentijdse opoffering) en tegen het einde van het onderzoek waren ze van over het algemeen goede kwaliteit. Er waren nooit tekenen van een effect op poten of nagels bij honden in de laaggedoseerde groep (15 mg/kg/dag).
Het is algemeen aanvaard dat beschadiging van het coriale epitheel dat nagelkeratine produceert, kan leiden tot een stopgezette productie van keratine en de productie van abnormale keratine. De voorbijgaande toxicose die wordt veroorzaakt door de hoge doses (45 en 150 mg/kg/dag) aciclovir die tijdens de eerste twee weken van het onderzoek worden gegeven, kan het coriale epitheel hebben aangetast. Als er een voorbijgaand effect was op het coriale epitheel (mogelijk gerelateerd aan directe effecten of secundair aan door geneesmiddelen veroorzaakte ziekte tijdens de eerste twee weken van het onderzoek), zou later verlies van de nagel een gevolg kunnen zijn. Er werden geen waarneembare effecten op andere keratine-producerende of keratine-bevattende weefsels waargenomen. Benadrukt moet worden dat de veranderingen in de nagels verband leken te houden met de voorbijgaande toxicose veroorzaakt door dosisniveaus van 50 en 150 mg/kg/dag die werden getest tijdens de eerste twee weken van het onderzoek en niet met de 30 en 60 mg/kg vervolgens geteste dosisniveaus per dag.
Er waren geen belangrijke door geneesmiddelen geïnduceerde veranderingen in waarden voor biochemische serumtests, urineanalyses en elektrocardiografische tests die met geschikte tussenpozen werden uitgevoerd tijdens dit onderzoek. De waarden voor serumalbumine en totaal eiwit waren licht verlaagd bij honden die gedurende 6 en 12 maanden werden behandeld met 30 en 60 mg/kg/dag. Alle waarden voor deze parameters bleven echter binnen de normaal aanvaarde grenzen.
Met uitzondering van resterende veranderingen in oude keratine aan de toppen van de klauwen, waren er geen tekenen van behandelingsgerelateerde effecten in een van de met lichtmicroscopie onderzochte weefsels. Ook waren er geen betekenisvolle veranderingen in waarden voor de organen gewogen bij necropsie. Zo werden dosisniveaus tot 60 mg/kg/dag gedurende één jaar goed verdragen. Het dosisniveau "geen dosis-effect" van aciclovir was 15 mg/kg/dag (5 mg/kg driemaal daags); de enige nadelige effecten bij 30 of 60 mg/kg/dag waren echter veranderingen in nagels en voetzolen (30 en 60 mg/kg/dag) en milde gastro-intestinale verschijnselen (60 mg/kg/dag).
Reproductiestudies
Teratologie – Ratten
Acyclovir werd toegediend aan zwangere vrouwelijke ARS Sprague-Dawley-ratten door subcutane injectie tijdens de periode van organogenese (dag 6 tot en met dag 15 van de dracht) in doseringen van 0,0, 6,0, 12,5 en 25,0 mg/kg lichaamsgewicht tweemaal daags.
Criteria die werden geëvalueerd voor het effect van de verbinding waren onder meer het lichaamsgewicht van de moeder, gewichtstoename, uiterlijk en gedrag, overlevingspercentages, oogveranderingen, zwangerschapspercentages en reproductiegegevens. Levensvatbaarheid en ontwikkeling van nakomelingen werden ook geëvalueerd.
Naast de bovenstaande metingen werden aangewezen dieren 1 uur na de eerste dosis op dag 15 opgeofferd om monsters van moederlijk bloed, vruchtwater en foetussen te verzamelen voor metingen van de geneesmiddelconcentratie. De gemiddelde waarden van deze monsters staan vermeld in tabel 8.
De voor plasma verkregen waarden zouden ongeveer 30% van de initiële plasmaspiegels vertegenwoordigen, zoals beoordeeld aan de hand van de plasmahalfwaardetijd bij knaagdieren.
Er werden geen effecten waargenomen die kunnen worden toegeschreven aan de toediening van aciclovir bij vergelijkingen van het lichaamsgewicht van de moeder, uiterlijk en gedrag, overlevingspercentages, zwangerschapspercentages of implantatie-efficiëntie. Bovendien werden er geen verbindingsgerelateerde verschillen opgemerkt bij evaluaties van foetale grootte, geslacht en ontwikkeling.
Hoewel de incidenties van resorptie en foetale levensvatbaarheid in alle groepen binnen het bereik van de normale variabiliteit lagen, werden iets grotere incidenties van resorptie waargenomen bij de dieren met een hoge dosis die werden opgeofferd op dag 15 en 19 van de dracht; duidelijke dosisgerelateerde trends deden zich echter niet voor.
Daarom werd aciclovir niet als teratogeen of embryotoxisch beschouwd bij toediening aan ratten in hoeveelheden tot 50,0 mg/kg lichaamsgewicht per dag tijdens de organogenese.
Teratologie – Konijnen
Er werd een teratologisch onderzoek uitgevoerd bij witte konijnen uit Nieuw-Zeeland met in wezen hetzelfde experimentele ontwerp als bij de rat, behalve dat de dosering van dag 6 tot dag 18 van de dracht was. Ook vond het verzamelen van foetussen, vruchtwater en monsters van moederlijk bloed plaats op dag 18 in plaats van op dag 15.
Bij geen enkele dosis werden tekenen van maternale toxiciteit waargenomen, maar er was een statistisch significante (p
Concentraties van aciclovir werden gedetecteerd in plasma- en vruchtwatermonsters, evenals in homogenaten van foetale weefsels. Alle monsters werden één uur na de eerste dosis op dag 18 van de dracht genomen. De geneesmiddelconcentraties in het vruchtwater waren aanzienlijk hoger dan die van plasma (zie tabel 9).
Voortplanting - Vruchtbaarheid
In een vruchtbaarheidsonderzoek van twee generaties werd aangetoond dat aciclovir de vruchtbaarheid of reproductie niet schaadt in groepen van 15 mannelijke en 30 vrouwelijke muizen. De muizen in deze studie kregen aciclovir toegediend via maagintubatie in doseringen van 50, 150 en 450 mg/kg/dag. Mannetjes werden gedoseerd gedurende 64 opeenvolgende dagen voorafgaand aan het paren en vrouwtjes gedurende 21 dagen voorafgaand aan het paren.
In een vruchtbaarheidsonderzoek bij ratten waarbij groepen van 20 mannelijke en 20 vrouwelijke ratten 0, 12,5, 25,0 en 50,0 mg/kg/dag kregen via subcutane injectie, bleek aciclovir geen effect te hebben op de paring of vruchtbaarheid. De mannetjes werden gedurende 60 dagen voorafgaand aan het paren gedoseerd en totdat hun paringsschema was voltooid. Vrouwelijke ratten werden gedurende 14 dagen voorafgaand aan de paring en tot dag 7 van de dracht gedoseerd. Bij 50 mg/kg/dag sc was er een statistisch significante toename van post-implantatieverlies, maar geen gelijktijdige afname van de worpgrootte.
Bij 25 vrouwelijke konijnen die subcutaan werden behandeld met 50 mg/kg/dag aciclovir op dag 6 tot 18 van de dracht, was er een statistisch significante afname van de implantatie-efficiëntie, maar geen gelijktijdige afname van de worpgrootte. Er was ook een dosisgerelateerde toename van het aantal foetussen met overtollige ribben in alle met geneesmiddel behandelde groepen. Deze toename was niet dosisgerelateerd wanneer de incidentie van overtollige ribben per worp werd onderzocht.
Bij 15 vrouwelijke konijnen die intraveneus werden behandeld met 50 mg/kg/dag aciclovir op dag 6 tot 18 van de dracht, was er geen effect op de implantatie-efficiëntie of de worpgrootte.
In een peri- en postnataal onderzoek bij ratten (20 vrouwelijke ratten per groep) werd aciclovir subcutaan toegediend in een dosis van 0, 12,5, 25 en 50 mg/kg/dag vanaf 17 dagen zwangerschap tot 21 dagen postpartum. Bij 50 mg/kg/dag sc was er een statistisch significante afname in het groepsgemiddelde aantal corpora lutea, totale implantatieplaatsen en levende foetussen in de F1-generatie. Hoewel niet statistisch significant, was er ook een dosisgerelateerde afname van het groepsgemiddelde aantal levende foetussen en implantatieplaatsen bij 12,5 mg/kg/dag en 25 mg/kg/dag sc.
In een dosisbereikonderzoek met 5 vrouwelijke konijnen veroorzaakte de intraveneuze toediening van aciclovir in een dosis van 100 mg/kg/dag van dag 6 tot 8 van de zwangerschap, een dosis waarvan bekend is dat deze obstructieve nefropathie veroorzaakt, een significante toename van foetale resorptie en een overeenkomstige afname van de worpgrootte. Bij een maximaal getolereerde intraveneuze dosis van 50 mg/kg/dag bij konijnen waren er geen geneesmiddelgerelateerde reproductieve effecten.
In een subchronische toxiciteitsstudie waarbij groepen van 20 mannelijke en 20 vrouwelijke ratten gedurende één maand intraperitoneale doses aciclovir kregen van 0, 20, 80 of 320 mg/kg/dag, en gevolgd werden gedurende een periode van één maand na de dosis, was er testiculaire atrofie. Enig histologisch bewijs van herstel van de spermaproductie was 30 dagen na de dosis duidelijk, maar dit was onvoldoende tijd om volledige reversibiliteit aan te tonen.
Groepen van 25 mannelijke en 25 vrouwelijke ratten kregen gedurende 6 maanden intraperitoneale doses aciclovir van 0, 5, 20 of 80 mg/kg/dag toegediend. Tien mannelijke en 10 vrouwelijke ratten in elke groep werden gedurende 13 weken ongedeerd voortgezet. Testiculaire atrofie was beperkt tot hoge doses ratten die gedurende 6 maanden 80 mg/kg/dag kregen. Gegevens over het orgaangewicht en lichtmicroscopie definieerden de volledige reversibiliteit van de testiculaire atrofie tegen het einde van de herstelperiode na de dosis.
In een 31 dagen durend onderzoek bij honden (16 reuen en 16 vrouwtjes per groep) waarbij aciclovir intraveneus werd toegediend in hoeveelheden van 50, 100 en 200 mg/kg/dag, waren de testikels normaal bij honden bij 50 mg/kg. Doses van 100 of 200 mg/kg/dag veroorzaakten de dood van sommige honden als gevolg van cytostatische effecten (beenmerg en gastro-intestinaal epitheel) en aspermische testikels of testikels met verspreide aspermische tubuli. Het kan niet worden uitgesloten dat de testiculaire verandering primair kan zijn geweest, maar soortgelijke veranderingen kunnen worden waargenomen secundair aan ernstige stress bij stervende honden.
Ontwikkelingstoxiciteitsstudies
Neonatale ratten - subchronisch onderzoek
Acyclovir opgelost in 0,4% steriele zoutoplossing werd door subcutane injectie toegediend aan Charles River CD (Sprague-Dawley) neonatale ratten gedurende 19 opeenvolgende dagen, beginnend op de 3e postpartumdag. De geteste dosisniveaus waren 0, 5, 20 en 80 mg/kg lichaamsgewicht. Er waren 12 nesten (elk bestaande uit 5 mannelijke en 5 vrouwelijke pasgeborenen die het natuurlijke moederdier verzorgden) bij elk dosisniveau. De dammen werden niet behandeld. Pasgeborenen werden uit elke groep verwijderd voor necropsie en microscopische evaluatie van een grote verscheidenheid aan weefsels, waaronder ogen en meerdere hersensecties, nadat ze 5, 12 of 19 dagen waren behandeld en na een periode van 3 weken na toediening van het geneesmiddel ( toen ze 45 dagen oud waren). Hematologische (hemoglobine, gepakt celvolume, RBC, WBC en differentiële celtellingen) en klinische chemie (BUN) testen werden gedaan na 16 dagen behandeling en herhaald 18 dagen nadat de laatste (19e) dosis was gegeven.
Bij sommige pasgeborenen werd 30 minuten na de behandeling op dag 1, op dag 9 en aan het einde van de doseringsperiode bloed afgenomen voor de bepaling van de concentraties van aciclovir in plasma. De hoogste concentratie aciclovir in plasma was 99,1 g/ml (440,5 M) gevonden in gepoold plasma verzameld van 6 vrouwelijke hooggedoseerde (80 mg/kg) neonaten 30 minuten nadat de eerste dosis was gegeven. Behandeling met aciclovir verhoogde de mortaliteit in de neonatale periode niet.
Ratten in de groep met een lage dosis kregen evenveel lichaamsgewicht als de respectievelijke controleratten. Tijdens de behandelingsperiode werden significante (p
Oogonderzoek en lichtmicroscopie brachten geen nadelige effecten op de oogontwikkeling aan het licht. Benadrukt moet worden dat er geen morfologisch of functioneel bewijs was van nadelige effecten op de zich ontwikkelende hersenen of andere delen van het centrale zenuwstelsel. Aciclovir is dus duidelijk anders dan cytosine-arabinoside, waarvan werd gemeld dat het prominente cerebellaire en retinale dysplasie veroorzaakt bij neonatale ratten.
Mutageniteit en andere kortetermijnstudies
Acyclovir is getest op mutageen potentieel in een aantal in vitro en in vivo systemen: 10 november 2014 Pagina 27 van 38
microbieel
Acyclovir werd getest op mutagene activiteit in de Ames Salmonella-plaatassay; in een pre-incubatiemodificatie van de Ames-assay; in de Rosenkrantz E. coli polA+/polA- DNA-reparatietest; en in de eukaryoot S. cerevisiae, D-4. Alle onderzoeken werden uitgevoerd zowel in aanwezigheid als in afwezigheid van exogene metabolische activering bij zoogdieren. Acyclovir gaf geen positieve reacties in een van deze systemen.
De eerdere Salmonella-onderzoeken werden uitgebreid tot extreem hoge concentraties om toxiciteit te bereiken. Er werden geen positieve effecten waargenomen in aan- of afwezigheid van exogene metabolische activering bij zoogdieren, bij concentraties van aciclovir tot 300 mg/plaat of 80 mg/ml.
Zoogdiersystemen
Acyclovir werd getest op mutagene activiteit in gekweekte L5178Y muizenlymfoomcellen, heterozygoot op de thymidinekinase (TK)-locus, door de voorwaartse mutatiesnelheid naar TK-deficiëntie (TK+/- → TK-/-) te meten; aanvullende onderzoeken werden uitgevoerd op de HGPRT locus en op de Ouabain-resistentiemarker in dezelfde cellen. Alle onderzoeken werden uitgevoerd in aanwezigheid en in afwezigheid van exogene metabolische activering van zoogdieren. De testverbinding was mutageen op de TK-locus bij hoge concentraties (400-2.400 g/ml) (Ter vergelijking: de bovengrens van de piekplasmaspiegels van aciclovir na orale dosering van 200 mg elke 4 uur is 0,9 g/ml. Het was negatief op de HGPRT-locus en de Ouabain-resistentiemarker. Identieke resultaten werden verkregen met en zonder metabole activering.
Er werden geen overtuigende resultaten verkregen zonder duidelijke dosisgerelateerde respons wanneer de mutageniteit van aciclovir werd onderzocht op elk van de 3 loci (APRT-, HGPRT- en Ouabain-resistentie) in ovariumcellen van Chinese hamsters (CHO), zowel in aanwezigheid als in afwezigheid van exogene metabole activering.
Het is aangetoond dat aciclovir, in een concentratie van 50 g/ml (222 μM) voor een blootstelling van 72 uur, een statistisch significante toename veroorzaakt in de incidentie van morfologisch getransformeerde foci als gevolg van de behandeling van BALB/C-3T3-cellen in vitro in de afwezigheid van exogene metabole activering. Van de morfologisch getransformeerde foci is aangetoond dat ze groeien als tumoren na transplantatie in immunosuppressieve, syngene, gespeende muizen. Tumorweefsels werden gediagnosticeerd als ofwel ongedifferentieerde sarcomen of lymfosarcomen.
Acyclovir, in concentraties tussen 8 en 64 g/ml gedurende 18 uur blootstelling, veroorzaakte geen morfologisch getransformeerde foci tussen C3H/10T ½-cellen die in vitro werden behandeld in afwezigheid van exogene metabole activering.
Acyclovir, in concentraties van 62,5 en 125 g/ml voor een blootstelling van 48 uur, veroorzaakte geen chromosoomafwijkingen in gekweekte menselijke lymfocyten bij afwezigheid van exogene metabole activering. Bij hogere concentraties, 250 en 500 g/ml gedurende 48 uur blootstelling, veroorzaakte aciclovir een significante toename in de incidentie van chromosoombreuk. Er was ook een significante dosisgerelateerde afname van de mitotische index bij blootstelling aan aciclovir.
Acyclovir, in doses van 25 en 50 mg/kg/dag ip gedurende 5 opeenvolgende dagen, veroorzaakte geen dominant letaal effect bij mannelijke BKA (CPLP) muizen. Verder was er geen bewijs van een dominant dodelijk effect op Charles River CD-1 (ICR) mannelijke en vrouwelijke muizen die oraal werden behandeld met dosisniveaus van 50, 150 en 450 mg/kg/dag, zoals samengevat voor de Two Generation Reproduction/ Fertility Study .
Bij enkelvoudige intraperitoneale doses van 25, 50 en 100 mg/kg veroorzaakte aciclovir geen chromosoomafwijkingen in beenmergcellen van Chinese hamsters bij onderzoek 24 uur na toediening. Bij hogere nefrotoxische doses (500 en 1.000 mg/kg) werd een blastogeen effect gezien. (Een intraperitoneale dosis van 500 mg/kg produceert gemiddelde piekplasmaspiegels bij Chinese hamsters van 611 μg/ml (2,72 mM), wat 680 keer hoger is dan de bovengrens van menselijke piekplasmaspiegels tijdens orale dosering van 200 mg elke 4 uur).
Bij enkelvoudige intraveneuze doses van 25, 50 en 100 mg/kg veroorzaakte aciclovir geen chromosoomafwijkingen in beenmergcellen van mannelijke en vrouwelijke ratten bij onderzoek 6, 24 en 48 uur na de behandeling.
Al deze onderzoeken toonden dus aan dat aciclovir geen enkelvoudige genmutaties veroorzaakt, maar in staat is om chromosomen te breken.
Immunotoxicologische onderzoeken
Acyclovir werd onderworpen aan een aantal in vitro en in vivo immunologische tests.
In twee in vivo tests, lymfocyt-gemedieerde cytotoxiciteit en neutrofiele chemotaxis, vertoonde aciclovir geen remmende effecten bij concentraties tot wel 135 g/ml (600 μM). De verbinding remde de rozetvorming ongeveer 50% bij 0,9 g/ml (4 M).
In vier in vivo tests bij muizen die celgemedieerde immuniteit (complementafhankelijke cellulaire cytotoxiciteit, complementonafhankelijke cellulaire cytotoxiciteit, vertraagde overgevoeligheid en graft-versus-hostreactie) hebben gemeten, vertoonde aciclovir geen remmende effecten bij enkelvoudige doses tot 200 mg/kg gegeven op dag 2 na antigene stimulatie.
Vier dagelijkse doses van 100 mg/kg/dag hadden geen significant effect op Jerne-hemolysineplaques of circulerend antilichaam op dag 7 na antigene stimulatie. Toen de Jerne-hemolysineplaques en antilichaamtiters vier dagen na antigene challenge en een dag na de laatste geneesmiddeldosis werden onderzocht, vertoonde 100 mg/kg slechts een licht onderdrukkend effect. 200 mg/kg produceerde echter enig gewichtsverlies (-2,2 g), een matige vermindering van het aantal Jerne-hemolysineplaques (PFC/milt was verminderd tot 33% van de controle, PFC/107 WBC tot 46,5% van de controle). Er was echter slechts een kleine verlaging van de circulerende hemagglutininetiter (van 8,3 naar 6,5) en de circulerende hemolysinetiter (van 9,5 naar 8,3) bij 200 mg/kg.
In experimenten met muizen die waren ontworpen om te testen of aciclovir het immunosuppressieve effect van azathioprine op de vorming van antilichamen zou versterken, werd gevonden dat de effecten van de twee geneesmiddelen niet meer dan additief waren. Alleen de dosis aciclovir van 200 mg/kg vertoonde een verhoogde onderdrukking van de antilichaamrespons bij toediening in combinatie met azathioprine in doses van meer dan 25 mg/kg.
Er zijn onderzoeken uitgevoerd om de invloed van aciclovir in vitro op de functie van menselijke lymfocyten te evalueren. Remmende effecten op de blastogenese werden alleen waargenomen in testen die piekconcentraties van krachtige mitogenen, fytohemagglutinine (PHA) en concanavaline A (Con A) onderzochten, en alleen bij concentraties van het geneesmiddel boven 50 g/ml (222 μM) en waren veel lager bij monilia en tetanustoxoïde-antigenen, waarbij de blastogene respons karakteristiek minder krachtig is. Er was zeer weinig effect op de cytotoxiciteit of LIF-productie, behalve bij concentraties van 200 g/ml (890 μM) waar al een direct cytotoxisch effect is aangetoond. Deze remmende concentraties zijn veel hoger dan de verwachte niveaus van doses die zijn geselecteerd voor klinische toepassing en meer dan 1000 keer hoger dan de concentratie die nodig is om de vermenigvuldiging van herpesvirus in vitro te remmen.
Het effect van aciclovir op menselijke cellen werd gemeten. Een concentratie van 11,2 - 22,5 g/mL (50-100 M) remt de deling van fibroblasten in variabele mate, afhankelijk van het experimentele ontwerp en de confluentie van de monolaag. De omvang van dit effect was minder dan dat veroorzaakt door adenine-arabinoside of humaan leukocyten-interferon wanneer deze drie antivirale middelen werden vergeleken bij klinisch relevante concentraties. Acyclovir remde ook de opname van thymidine door mononucleaire cellen uit perifeer bloed gestimuleerd door PHA of drie verschillende herpesvirusantigenen. Bij deze cellen werd een lineaire dosis-responscurve waargenomen en hun proliferatie werd voor 50% geremd door 22,5 g/ml (100 μM) aciclovir. Er werd remming uitgeoefend op de proliferatie van T-cellen zonder duidelijk effect op de afgifte van lymfokinen of op de functie van monocyten.
Er moet ook worden vermeld dat er geen aanwijzingen waren voor nadelige effecten op het immuunsysteem in de gedetailleerde subchronische en chronische dierproeven die eerder in deze samenvatting zijn behandeld, behalve bij te hoge doses (50 tot 100 mg/kg tweemaal daags) bij honden met duidelijke lymfoïde hypoplasie heeft plaatsgevonden.
REFERENTIES
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Behandeling met aciclovir van varicella bij overigens gezonde kinderen. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Behandeling met aciclovir van varicella bij overigens gezonde adolescenten. De collaboratieve Acyclovir Varicella-studiegroep. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Antivirale geneesmiddelen: aciclovir, in recente vooruitgang in klinische farmacologie. Turner P, Shand DG (eds) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Virale resistentie in de klinische praktijk: samenvatting van vijf jaar ervaring met aciclovir. Farmacologische en klinische benaderingen van herpesvirussen en viruschemotherapie, Aiso, Japan, 10-13 september 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Virale resistentie, klinische ervaring. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Virale resistentie in de klinische praktijk: samenvatting van vijf jaar ervaring met aciclovir. Proceedings of the International Symposium on Pharmacological and Clinical Approches to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985; 269-270.
7. Biron KK, Elion GB. Effect van aciclovir in combinatie met andere antiherpetica op het varicella zoster-virus in vitro. Ben J Med 1982; 73(1A):54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Farmacokinetiek van meerdere doses intraveneus aciclovir bij patiënten die continue ambulante peritoneale dialyse ondergaan. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et al. Behandeling van eerste episodes van genitale herpes simplex-virusinfectie met oraal aciclovir. Een gerandomiseerde dubbelblinde gecontroleerde studie bij normale proefpersonen. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C et al. Isolatie en karakterisering van resistent Herpes simplex-virus na aciclovir-therapie. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Karakterisering van aciclovir-resistente en -gevoelige klinische herpes simplex-virusisolaten van een immuungecompromitteerde patiënt. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Varicella-Zoster-virus wordt tijdens de therapie niet resistenter tegen aciclovir. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer-DJ. De activiteit in vitro tegen herpesvirus van 9-(2-hydroxyethoxymethyl)guanine (acycloguanosine), een nieuw antiviraal middel. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Monitoring van de gevoeligheid van herpes simplex-virusisolaten van patiënten die aciclovir krijgen. J Antimicrob Chemother 1986; 18 Suppl B:103-112.
15. Collins P. Virale gevoeligheid na de introductie van aciclovir. Ben J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Karakterisering van een DNA-polymerasemutant van herpes simplex-virus van een ernstig immuungecompromitteerde patiënt die aciclovir krijgt. J generaal Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Groeiremming door acycloguanosine van herpesvirussen geïsoleerd uit menselijke infecties. Antimicrobiële middelen Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistentie tegen antivirale geneesmiddelen van herpes simplex-virus geïsoleerd van een patiënt die werd behandeld met aciclovir. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Resistentiemechanismen tegen nucleoside-analoogremmers van het herpes simplex-virus. 6e Int Congr Virol 1984; (Abstract # W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF et al. Vergelijkende werkzaamheid van antiherpesgeneesmiddelen tegen verschillende stammen van het herpes simplex-virus. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Vergelijkende werkzaamheid van antiherpesgeneesmiddelen in verschillende cellijnen. Antimicrobiële middelen Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Virusresistentie in de klinische praktijk. J Antimicrob Chemother 1983; 12 Suppl B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. Een dubbelblind, placebogecontroleerd onderzoek naar het effect van chronisch toegediende orale aciclovir op de spermaproductie bij mannen met vaak terugkerende genitale herpes. J Infect Dis 1988 maart; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et al. Een dubbelblinde studie van orale aciclovir voor het onderdrukken van recidieven van genitale herpes simplex-virusinfectie. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. Een gecontroleerde studie van aciclovir voor waterpokken bij normale kinderen. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S et. Karakterisering van een klinisch HSV-2-isolaat dat een ACV-resistente mutant bevat die een thymidinekinase produceert met veranderde substraatspecificiteit. Negende Int Herpesvirus Workshop, Seattle, Washington, 24-29 augustus 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Klinisch isolaat van herpes simplex-virus type 2 dat een thymidinekinase induceert met veranderde substraatspecificiteit. Antimicrob-middelen Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex-virus dat resistent is tegen aciclovir. Een studie in een tertiair zorgcentrum. Ann Stagiair Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Foscarnet-therapie voor ernstige aciclovir-resistente herpes simplex-virus type-2-infecties bij patiënten met het verworven immunodeficiëntiesyndroom (AIDS). Een ongecontroleerde proef. Ann Stagiair Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Aciclovir-resistente herpes simplex-virusinfecties bij patiënten met het verworven immunodeficiëntiesyndroom. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Isolatie en karakterisering van aciclovir-resistente mutanten van herpes simplex-virus. J generaal Virol 1980; 49(1): 115-124.
32. Veld HJ. Het probleem van door geneesmiddelen geïnduceerde resistentie bij virussen, in Problems of Antiviral Therapy. Stuart-Harris CH, Oxford J (Eds) Academic Press, Londen 1983.
33. Fyfe K. Herhalingspatronen van genitale herpes na stopzetting van meer dan 5 jaar chronische aciclovir-suppressie. VIII Int Conf AIDS/III Std Wrld Cong 1992; (B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et al. Therapie van herpes zoster met orale aciclovir. Ben J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Aciclovir-resistente varicella zoster-virusinfectie na chronische orale behandeling met aciclovir bij patiënten met het verworven immunodeficiëntiesyndroom (AIDS). Ann Stagiair Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et al. Langdurige continue behandeling met aciclovir van normale volwassenen met vaak terugkerende genitale herpes simplex-virusinfectie. De Acyclovir-studiegroep. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Invloed van hemodialyse op de farmacokinetiek van aciclovir bij patiënten met chronisch nierfalen. Ben J Med 1982; 73(1A):202-204.
38. Kurtz T. Veiligheid en werkzaamheid van langdurige suppressieve ciclovirbehandeling van vaak terugkerende genitale herpes: resultaten van jaar 5. 30e Intersci Conf Antimicrob Agents Chemother 1990; 270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et al. Effect van nierfalen op de farmacokinetiek van aciclovir. Ben J Med 1982; 73(1A)::197-201.
40. Lau RJ, Emery MG, Galinsky RE. Onverwachte accumulatie van aciclovir in moedermelk met schatting van blootstelling van zuigelingen. Obstet Gynacol 1987; 69 (3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Terugkerende genitale herpes en onderdrukkende orale aciclovir-therapie. Relatie tussen klinische uitkomst en in-vitro-geneesmiddelgevoeligheid. Ann Stagiair Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Gevoeligheid van HSV-genitale isolaten na orale aciclovir. 24e Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8-10 oktober 1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A et al. Dubbelblind, placebo-gecontroleerd onderzoek waarin langdurige onderdrukkende therapie wordt vergeleken met kortdurende orale aciclovir-therapie voor de behandeling van terugkerende genitale herpes. Ben J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack-cd, Barry DW. Spectrum van gevoeligheid van aciclovir van klinische isolaten van herpes simplex-virus. Ben J Med 1982; 73(1A):376-379.
45. McLaren C, Ellis MN, Hunter GA. Een colorimetrische test voor het meten van de gevoeligheid van herpes simplex-virussen voor antivirale middelen. Antiviraal onderzoek 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In vitro gevoeligheid voor aciclovir bij genitale herpes simplex-virussen van met aciclovir behandelde patiënten. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et al. Dubbelblinde, placebo-gecontroleerde studie van orale aciclovir bij genitale herpes simplex-virusinfectie in de eerste episode. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Langdurige aciclovir-onderdrukking van vaak terugkerende genitale herpes simplex-virusinfectie. Een dubbelblind onderzoek in meerdere centra. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et al. Langdurige continue versus intermitterende orale behandeling met aciclovir bij normale volwassenen met vaak terugkerende genitale herpes simplex-virusinfectie. Ben J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Acyclovir in menselijke moedermelk. Am J Obstet Gynecol 1988; 158 (3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et al. Profylactische orale aciclovir bij terugkerende genitale herpes. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Orale aciclovir bij de behandeling van herpes zoster in de huisartspraktijk. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Relatie van cytohistopathologie van genitale herpesvirusinfectie met cervicale anaplasie. Kankeronderzoek 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et al. Werkzaamheid van orale aciclovir bij de behandeling van initiële en terugkerende genitale herpes. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. De in vitro aciclovirgevoeligheid van herpesvirus dat wordt uitgescheiden door patiënten die onderdrukkende orale therapie krijgen. 24e Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8-10 oktober 1984; (Abstract #1015).
56. O'Brien JJ, Campoli-Richards DM. Aciclovir. Een bijgewerkt overzicht van zijn antivirale activiteit, farmacokinetische eigenschappen en therapeutische werkzaamheid. Geneesmiddelen 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N et al. Continue varicella-zoster-infectie geassocieerd met aciclovir-resistentie bij een kind met aids. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Acyclovir-resistente herpes simplex-virusinfectie als gevolg van gewijzigd DNA-polymerase. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Herpes simplex-virusvarianten beperken zich tot hoge concentraties aciclovir in klinische isolaten. Antimicrobiële middelen Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Gevoeligheid van vaccinstammen van het varicella-zoster-virus voor antivirale verbindingen. Antimicrobiële middelen Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Behandeling van terugkerende genitale herpes simplex-infecties met orale aciclovir. Een gecontroleerde proef. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Farmacokinetiek van aciclovir bij een patiënt die continue ambulante peritoneale dialyse ondergaat. Ben J Nier Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Pathogeniteit van aciclovir-resistent herpes simplex-virus type 1 van een immunodeficiënt kind. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Orale aciclovir om terugkerende herpes simplex-virusinfecties bij immunodeficiënte patiënten te onderdrukken. Ann Stagiair Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Onderdrukking van vaak terugkerende genitale herpes. Een placebogecontroleerde dubbelblinde studie van orale aciclovir. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Aciclovir-onderdrukking van vaak terugkerende genitale herpes. Werkzaamheid en afnemende behoefte gedurende opeenvolgende jaren van behandeling. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Chronische herpesinfectie bij een immuungecompromitteerde patiënt: melding van een geval. J Mondelinge Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Intraveneuze aciclovir voor de behandeling van mucocutane herpes simplex-virusinfectie na beenmergtransplantatie: een dubbelblind onderzoek. Ann Stagiair Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Frequentie en betekenis van aciclovir-resistent herpes simplex-virus geïsoleerd uit beenmergtransplantatiepatiënten die meerdere behandelingskuren met aciclovir krijgen. J Infect Dis 1983; 148(6):1077-1082.
PATIËNT INFORMATIE
Patiënten worden geïnstrueerd om hun arts te raadplegen als ze ernstige of lastige bijwerkingen ervaren, als ze zwanger worden of van plan zijn zwanger te worden, als ze van plan zijn borstvoeding te geven tijdens orale toediening van ZOVIRAX (aciclovir) of als ze andere vragen hebben.
Patiënten moeten worden geadviseerd om voldoende hydratatie te behouden.
