Famvir 250mg, 500mg Famciclovir Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Famvir en hoe wordt het gebruikt?
Famvir is een receptgeneesmiddel dat wordt gebruikt om de symptomen van acute herpes zoster (gordelroos), herpes labiallis en genitale herpes te behandelen. Famvir 250 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Famvir 250 mg behoort tot een klasse geneesmiddelen die Antivirale middelen, Overige worden genoemd.
Het is niet bekend of Famvir veilig en effectief is bij kinderen jonger dan 18 jaar.
Wat zijn de mogelijke bijwerkingen van Famvir 250 mg?
Famvir 250 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- verwardheid,
- weinig of geen plassen,
- zwelling in uw voeten of enkels,
- vermoeidheid, en
- kortademigheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Famvir 500 mg zijn:
- hoofdpijn, en
- misselijkheid
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Famvir. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Het werkzame bestanddeel in FAMVIR 500 mg tabletten is famciclovir, een oraal toegediende prodrug van het antivirale middel penciclovir. Chemisch gezien staat famciclovir bekend als 2-[2-(2-amino-9H-purin-9-yl)ethyl]-1,3-propaandioldiacetaat. De moleculaire formule is C14H19N5O4; het molecuulgewicht is 321,3. Het is een synthetisch acyclisch guaninederivaat en heeft de volgende structuur:
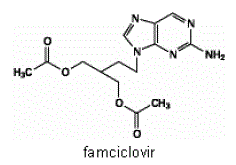
Famciclovir is een witte tot lichtgele vaste stof. Het is vrij oplosbaar in aceton en methanol en matig oplosbaar in ethanol en isopropanol. Bij 25°C is famciclovir aanvankelijk vrij oplosbaar (>25% w/v) in water, maar het slaat snel neer als het matig oplosbare (2%-3% w/v) monohydraat. Famciclovir is niet hygroscopisch onder 85% relatieve vochtigheid. Verdelingscoëfficiënten zijn: octanol/water (pH 4,8) P=1,09 en octanol/fosfaatbuffer (pH 7,4) P=2,08.
FAMVIR 250 mg tabletten bevatten 125 mg, 250 mg of 500 mg famciclovir, samen met de volgende inactieve ingrediënten: hydroxypropylcellulose, hydroxypropylmethylcellulose, lactose, magnesiumstearaat, polyethyleenglycolen, natriumzetmeelglycolaat en titaniumdioxide.
INDICATIES
Immunocompetente volwassen patiënten
Herpes Labialis (koortslip)
FAMVIR is geïndiceerd voor de behandeling van terugkerende herpes labialis.
Genitale herpes
Terugkerende afleveringen:
FAMVIR is geïndiceerd voor de behandeling van terugkerende episodes van genitale herpes. De werkzaamheid van FAMVIR bij aanvang meer dan 6 uur na het begin van de symptomen of laesies is niet vastgesteld.
Suppressieve therapie:
FAMVIR 250 mg is geïndiceerd voor chronische onderdrukkende therapie van terugkerende episodes van genitale herpes. De werkzaamheid en veiligheid van FAMVIR voor de onderdrukking van terugkerende genitale herpes na 1 jaar zijn niet vastgesteld.
Herpes zoster (gordelroos)
FAMVIR 500 mg is geïndiceerd voor de behandeling van herpes zoster. De werkzaamheid van FAMVIR bij aanvang meer dan 72 uur na het begin van de uitslag is niet vastgesteld.
HIV-geïnfecteerde volwassen patiënten
Terugkerende orolabiale of genitale herpes
FAMVIR is geïndiceerd voor de behandeling van terugkerende episodes van orolabiale of genitale herpes bij met hiv geïnfecteerde volwassenen. De werkzaamheid van FAMVIR bij aanvang meer dan 48 uur na het begin van de symptomen of laesies is niet vastgesteld.
Beperking van gebruik
De werkzaamheid en veiligheid van FAMVIR zijn niet vastgesteld voor:
- Patiënten
- Patiënten met een eerste episode van genitale herpes
- Patiënten met oogheelkundige zoster
- Immuungecompromitteerde patiënten anders dan voor de behandeling van recidiverende orolabiale of genitale herpes bij HIV-geïnfecteerde patiënten
- Zwarte en Afro-Amerikaanse patiënten met terugkerende genitale herpes
DOSERING EN ADMINISTRATIE
FAMVIR 500 mg kan met of zonder voedsel worden ingenomen.
Doseringsaanbeveling bij immuuncompetente volwassen patiënten
Herpes Labialis (koortslip)
De aanbevolen dosering van FAMVIR 500 mg voor de behandeling van recidiverende herpes labialis is 1500 mg als een enkele dosis. De therapie moet worden gestart bij het eerste teken of symptoom van herpes labialis (bijv. tintelingen, jeuk, branderig gevoel, pijn of laesie).
Genitale herpes
Terugkerende afleveringen
De aanbevolen dosering van FAMVIR voor de behandeling van terugkerende episodes van genitale herpes is tweemaal daags 1000 mg gedurende 1 dag. De therapie moet worden gestart bij het eerste teken of symptoom van een terugkerende episode (bijv. tintelingen, jeuk, branderig gevoel, pijn of laesie).
Suppressieve therapie
De aanbevolen dosering van FAMVIR 500 mg voor chronische onderdrukkende therapie van terugkerende episodes van genitale herpes is 250 mg tweemaal daags.
Herpes zoster (gordelroos)
De aanbevolen dosering van FAMVIR 250 mg voor de behandeling van herpes zoster is 500 mg om de 8 uur gedurende 7 dagen. De therapie moet worden gestart zodra herpes zoster is gediagnosticeerd.
Doseringsaanbeveling bij met HIV geïnfecteerde volwassen patiënten
Terugkerende orolabiale of genitale herpes
De aanbevolen dosering van FAMVIR voor de behandeling van recidiverende orolabiale of genitale herpes bij HIV-geïnfecteerde patiënten is 500 mg tweemaal daags gedurende 7 dagen. De therapie moet worden gestart bij het eerste teken of symptoom van een terugkerende episode (bijv. tintelingen, jeuk, branderig gevoel, pijn of laesie).
Doseringsaanbeveling bij patiënten met nierinsufficiëntie
Doseringsaanbevelingen voor volwassen patiënten met nierinsufficiëntie worden gegeven in tabel 1 [zie: Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
FAMVIR-tabletten zijn verkrijgbaar in 3 sterktes:
- 125 mg: witte, ronde filmomhulde, biconvexe, afgeschuinde randen, ingeslagen met "FAMVIR" aan de ene kant en "125" aan de andere kant
- 250 mg: witte, ronde filmomhulde, biconvexe, afgeschuinde randen, ingeslagen met "FAMVIR" aan de ene kant en "250" aan de andere kant
- 500 mg: wit, ovaal, filmomhuld, biconvex, met de inscriptie "FAMVIR" aan de ene kant en "500" aan de andere kant
Opslag en behandeling
FAMVIR tabletten worden als volgt geleverd als filmomhulde tabletten: 125 mg in flessen van 30; 250 mg in flessen van 30; 500 mg in flessen van 30 en enkelvoudige verpakkingen van 50 (alleen bedoeld voor institutioneel gebruik).
- FAMVIR 125 mg tablet: Witte, ronde filmomhulde, biconvexe, afgeschuinde randen, met de inscriptie “FAMVIR” aan de ene kant en “125” aan de andere. 125 mg 30's NDC 0078-0366-15
- FAMVIR 250 mg tablet : Witte, ronde filmomhulde, biconvexe, afgeschuinde randen, ingeslagen met “FAMVIR” aan de ene kant en “250” aan de andere. 250 mg 30's NDC 0078-0367-15
- FAMVIR 500 mg-tablet : Wit, ovale filmomhulde, biconvex, ingeslagen met “FAMVIR” aan de ene kant en “500” aan de andere. 500 mg 30's NDC 0078-0368-15 500 mg SUP 50's NDC 0078-0368-64
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP-gecontroleerde kamertemperatuur].
Gedistribueerd door: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Herzien: september 2016
BIJWERKINGEN
Acuut nierfalen wordt in meer detail besproken in andere secties van het etiket [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De meest voorkomende bijwerkingen die gemeld zijn bij ten minste 1 indicatie door >10% van de volwassen patiënten die met FAMVIR 250 mg werden behandeld, zijn hoofdpijn en misselijkheid.
Ervaring met klinische onderzoeken bij volwassen patiënten
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Immunocompetente patiënten
De veiligheid van FAMVIR 250 mg is geëvalueerd in actieve en placebogecontroleerde klinische onderzoeken met 816 met FAMVIR behandelde patiënten met herpes zoster (FAMVIR, 250 mg driemaal daags tot 750 mg driemaal daags); 163 met FAMVIR behandelde patiënten met terugkerende genitale herpes (FAMVIR, 1000 mg tweemaal daags); 1.197 patiënten met recidiverende genitale herpes die werden behandeld met FAMVIR 250 mg als suppressieve therapie (125 mg eenmaal daags tot 250 mg driemaal daags), van wie 570 patiënten FAMVIR (open-label en/of dubbelblind) kregen gedurende ten minste 10 maanden; en 447 met FAMVIR behandelde patiënten met herpes labialis (FAMVIR 500 mg, 1500 mg eenmaal daags of 750 mg tweemaal daags). Tabel 2 geeft een overzicht van geselecteerde bijwerkingen.
Tabel 3 geeft een overzicht van geselecteerde laboratoriumafwijkingen in onderzoeken naar genitale herpessuppressie.
HIV-geïnfecteerde patiënten
Bij hiv-geïnfecteerde patiënten waren de meest frequent gemelde bijwerkingen voor respectievelijk FAMVIR (500 mg tweemaal daags; n=150) en aciclovir (400 mg, 5x/dag; n=143), hoofdpijn (17% vs. 15% ), misselijkheid (11% vs. 13%), diarree (7% vs. 11%), braken (5% vs. 4%), vermoeidheid (4% vs. 2%) en buikpijn (3% vs. 6%).
Postmarketingervaring
De hieronder vermelde bijwerkingen zijn gemeld tijdens het gebruik van FAMVIR na goedkeuring. Omdat deze gebeurtenissen vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan drugs:
Bloed- en lymfestelselaandoeningen : Trombocytopenie
Lever- en galaandoeningen : Abnormale leverfunctietesten, cholestatische geelzucht
Immuunsysteemaandoeningen : Anafylactische shock, anafylactische reactie
Zenuwstelselaandoeningen : Duizeligheid, slaperigheid, toevallen
Psychische stoornissen Verwardheid (inclusief delirium, desoriëntatie en verwardheid die voornamelijk voorkomt bij ouderen), hallucinaties
Huid- en onderhuidaandoeningen : Urticaria, erythema multiforme, Stevens-Johnson-syndroom, toxische epidermale necrolyse, angio-oedeem (bijv. gezicht, ooglid, periorbitaal en farynxoedeem), overgevoeligheidsvasculitis
Hartaandoeningen : Hartkloppingen
DRUG-INTERACTIES
Potentieel voor FAMVIR 250 mg om andere geneesmiddelen te beïnvloeden
De steady-state farmacokinetiek van digoxine werd niet veranderd door gelijktijdige toediening van meerdere doses famciclovir (500 mg driemaal daags). Er werd geen klinisch significant effect op de farmacokinetiek van zidovudine, zijn metaboliet zidovudineglucuronide of emtricitabine waargenomen na een enkelvoudige orale dosis van 500 mg famciclovir gelijktijdig toegediend met zidovudine of emtricitabine.
Een in vitro-onderzoek met menselijke levermicrosomen suggereert dat famciclovir geen remmer van CYP3A4-enzymen is.
Potentieel voor andere geneesmiddelen om penciclovir te beïnvloeden
Er werden geen klinisch significante veranderingen in de farmacokinetiek van penciclovir waargenomen na toediening van een enkelvoudige dosis van 500 mg famciclovir na voorbehandeling met meerdere doses allopurinol, cimetidine, theofylline, zidovudine, promethazine, wanneer toegediend kort na een antacidum (magnesium en aluminiumhydroxide), of gelijktijdig met emtricitabine. Er werd geen klinisch significant effect op de farmacokinetiek van penciclovir waargenomen na toediening van meerdere doses (driemaal daags) van famciclovir (500 mg) met meervoudige doses digoxine.
Gelijktijdig gebruik met probenecide of andere geneesmiddelen die significant worden geëlimineerd door actieve renale tubulaire secretie, kan leiden tot verhoogde plasmaconcentraties van penciclovir.
De omzetting van 6-deoxypenciclovir in penciclovir wordt gekatalyseerd door aldehydeoxidase. Interacties met andere geneesmiddelen die door dit enzym worden gemetaboliseerd en/of dit enzym remmen, kunnen mogelijk optreden. Klinische interactiestudies van famciclovir met cimetidine en promethazine, in vitro remmers van aldehydeoxidase, lieten geen relevante effecten zien op de vorming van penciclovir. Raloxifeen, een krachtige aldehydeoxidaseremmer in vitro, zou de vorming van penciclovir kunnen verminderen. Er is echter geen klinisch onderzoek naar geneesmiddelinteracties uitgevoerd om de omvang van de interactie tussen penciclovir en raloxifeen te bepalen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Acuut nierfalen
Er zijn gevallen van acuut nierfalen gemeld bij patiënten met een onderliggende nierziekte die voor hun niveau van nierfunctie ongepast hoge doses FAMVIR hebben gekregen. Dosisverlaging wordt aanbevolen bij toediening van FAMVIR aan patiënten met nierinsufficiëntie [zie: DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering (Patiëntinformatie) te lezen.
Er zijn geen aanwijzingen dat FAMVIR de rijvaardigheid of het vermogen om machines te bedienen beïnvloedt. Patiënten die echter last krijgen van duizeligheid, slaperigheid, verwardheid of andere stoornissen van het centrale zenuwstelsel tijdens het gebruik van FAMVIR 500 mg, dienen af te zien van het besturen van een voertuig of het bedienen van machines.
Omdat FAMVIR lactose bevat (FAMVIR 125 mg, 250 mg en 500 mg tabletten bevatten respectievelijk 26,9 mg, 53,7 mg en 107,4 mg lactose), moeten patiënten met zeldzame erfelijke aandoeningen als galactose-intolerantie, een ernstige lactasedeficiëntie of glucose-galactosemalabsorptie geadviseerd om met hun zorgverlener te overleggen voordat ze FAMVIR innemen.
Herpes Labialis (koortslip)
Patiënten moeten worden geadviseerd om de behandeling te starten bij het eerste teken of symptoom van een herhaling van een koortslip (bijv. tintelingen, jeuk, branderig gevoel, pijn of laesie). Patiënten moeten worden geïnstrueerd dat de behandeling van koortslippen niet hoger mag zijn dan 1 dosis. Patiënten moeten worden geïnformeerd dat FAMVIR geen remedie is voor koortsblaasjes.
Genitale herpes
Patiënten moeten worden geïnformeerd dat FAMVIR geen remedie is voor genitale herpes. Er zijn geen gegevens die beoordelen of FAMVIR de overdracht van infectie naar anderen zal voorkomen. Omdat genitale herpes een seksueel overdraagbare aandoening is, moeten patiënten contact met laesies of geslachtsgemeenschap vermijden wanneer laesies en/of symptomen aanwezig zijn om te voorkomen dat partners worden geïnfecteerd. Genitale herpes wordt vaak overgedragen in afwezigheid van symptomen door asymptomatische virale uitscheiding. Daarom moeten patiënten worden geadviseerd om veiligere sekspraktijken te gebruiken.
Als episodische therapie voor recidiverende genitale herpes geïndiceerd is, moet patiënten worden geadviseerd om de therapie te starten bij het eerste teken of symptoom van een episode.
Er zijn geen gegevens over de veiligheid of effectiviteit van chronische suppressieve therapie met een duur van langer dan 1 jaar.
Herpes zoster (gordelroos)
Er zijn geen gegevens over de behandeling die meer dan 72 uur na het begin van de uitslag van zoster is gestart. Patiënten moeten worden geadviseerd om de behandeling zo snel mogelijk na een diagnose van herpes zoster te starten.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Twee jaar durende carcinogeniteitsstudies via de voeding met famciclovir werden uitgevoerd bij ratten en muizen. Een toename van de incidentie van borstadenocarcinoom (een veel voorkomende tumor bij dieren van deze stam) werd gezien bij vrouwelijke ratten die de hoge dosis van 600 mg/kg/dag kregen (1,1 tot 4,5x de systemische blootstelling bij de mens bij de aanbevolen totale dagelijkse orale dosis). variërend tussen 500 mg en 2000 mg, gebaseerd op vergelijkingen van de oppervlakte onder de plasmaconcentratiecurve [24 uur AUC] voor penciclovir). Er werden geen verhogingen van de tumorincidentie gemeld bij mannelijke ratten die werden behandeld met doses tot 240 mg/kg/dag (0,7 tot 2,7x de humane AUC), of bij mannelijke en vrouwelijke muizen met doses tot 600 mg/kg/dag (0,3 tot 2,7x de humane AUC). 1,2x de menselijke AUC).
Mutagenese
Famciclovir en penciclovir (de actieve metaboliet van famciclovir) werden getest op genotoxisch potentieel in een reeks in vitro- en in vivo-assays. Famciclovir en penciclovir waren negatief in in vitro tests voor genmutaties in bacteriën (S. typhimurium en E. coli) en ongeplande DNA-synthese in HeLa 83-cellen van zoogdieren (in doses tot respectievelijk 10.000 en 5.000 mcg/plaat). Famciclovir was ook negatief in de L5178Y-lymfoomtest bij muizen (5000 mcg/ml), de in vivo micronucleustest bij muizen (4800 mg/kg) en bij ratten dominante letale studie (5000 mg/kg). Famciclovir induceerde in vitro een toename van polyploïdie in humane lymfocyten in afwezigheid van chromosomale schade (1200 mcg/ml). Penciclovir was positief in de L5178Y muislymfoomtest voor genmutatie/chromosomale aberraties, met en zonder metabolische activering (1000 mcg/ml). In humane lymfocyten veroorzaakte penciclovir chromosomale afwijkingen bij afwezigheid van metabolische activering (250 mcg/ml). Penciclovir veroorzaakte een verhoogde incidentie van micronuclei in het beenmerg van muizen in vivo bij intraveneuze toediening in doses die zeer toxisch zijn voor het beenmerg (500 mg/kg), maar niet bij orale toediening.
Aantasting van de vruchtbaarheid
Testiculaire toxiciteit werd waargenomen bij ratten, muizen en honden na herhaalde toediening van famciclovir of penciclovir. Veranderingen in de testikels omvatten atrofie van de tubuli seminiferi, vermindering van het aantal zaadcellen en/of verhoogde incidentie van sperma met abnormale morfologie of verminderde beweeglijkheid. De mate van toxiciteit voor mannelijke reproductie was gerelateerd aan de dosis en de duur van de blootstelling. Bij mannelijke ratten werd verminderde vruchtbaarheid waargenomen na 10 weken dosering van 500 mg/kg/dag (1,4 tot 5,7x de humane AUC). Het niveau zonder waarneembaar effect voor sperma- en testikeltoxiciteit bij ratten na chronische toediening (26 weken) was 50 mg/kg/dag (0,15 tot 0,6x de humane systemische blootstelling op basis van AUC-vergelijkingen). Testiculaire toxiciteit werd waargenomen na chronische toediening aan muizen (104 weken) en honden (26 weken) in doses van 600 mg/kg/dag (0,3 tot 1,2x de humane AUC) en 150 mg/kg/dag (1,3 tot 5,1x de menselijke AUC), respectievelijk.
Famciclovir had geen effect op de algemene reproductieprestaties of vruchtbaarheid bij vrouwelijke ratten bij doses tot 1000 mg/kg/dag (2,7 tot 10,8x de humane AUC).
Twee placebogecontroleerde onderzoeken bij in totaal 130 overigens gezonde mannen met een normaal spermaprofiel gedurende een baselineperiode van 8 weken en terugkerende genitale herpes die oraal FAMVIR (250 mg tweemaal daags) (n=66) of placebo (n=64) kregen behandeling gedurende 18 weken toonde geen bewijs van significante effecten op het aantal zaadcellen, de motiliteit of morfologie tijdens de behandeling of tijdens een follow-up van 8 weken.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie B
Na orale toediening wordt famciclovir (prodrug) omgezet in penciclovir (actief geneesmiddel). Er zijn geen adequate en goed gecontroleerde onderzoeken naar het gebruik van famciclovir of penciclovir bij zwangere vrouwen. Er werden geen nadelige effecten op de embryofoetale ontwikkeling waargenomen in reproductieonderzoeken bij dieren waarbij famciclovir en penciclovir werden gebruikt in doses hoger dan de maximaal aanbevolen dosis voor de mens (MRHD) en blootstelling bij de mens. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons bij de mens, mag famciclovir alleen tijdens de zwangerschap worden gebruikt als dat nodig is.
In reproductieonderzoeken bij dieren kregen drachtige ratten en konijnen oraal famciclovir toegediend in doses (tot 1000 mg/kg/dag) die 2,7 tot 10,8 keer (ratten) en 1,4 tot 5,4 keer (konijnen) de systemische blootstelling bij de mens gaven op basis van de AUC. Er werden geen nadelige effecten waargenomen op de embryo-foetale ontwikkeling. In andere onderzoeken kregen drachtige ratten en konijnen intraveneus famciclovir toegediend in doses (360 mg/kg/dag) 1,5 tot 6 maal (ratten) en (120 mg/kg/dag) 1,1 tot 4,5 maal (konijnen) of penciclovir in doses (80 mg/kg/dag) 0,3 tot 1,3 keer (ratten) en (60 mg/kg/dag) 0,5 tot 2,1 keer (konijnen) de MRHD op basis van vergelijkingen van het lichaamsoppervlak. Er werden geen nadelige effecten waargenomen op de embryo-foetale ontwikkeling.
Rapportage van zwangerschapsblootstelling
Om de maternale-foetale uitkomsten te controleren van zwangere vrouwen die zijn blootgesteld aan FAMVIR 500 mg, heeft Novartis Pharmaceuticals Corporation een FAMVIR-zwangerschapsrapportagesysteem. Artsen worden aangemoedigd om hun patiënten te melden door te bellen naar 1-888-NOW-NOVA (669-6682).
Moeders die borstvoeding geven
Het is niet bekend of famciclovir (prodrug) of penciclovir (actief geneesmiddel) in de moedermelk wordt uitgescheiden. Na orale toediening van famciclovir aan zogende ratten, werd penciclovir uitgescheiden in de moedermelk in hogere concentraties dan die in het plasma. Er zijn geen gegevens over de veiligheid van FAMVIR 250 mg bij zuigelingen. FAMVIR 500 mg mag niet worden gebruikt door moeders die borstvoeding geven, tenzij de mogelijke voordelen opwegen tegen de mogelijke risico's van de behandeling.
Pediatrisch gebruik
De werkzaamheid van FAMVIR 250 mg is niet vastgesteld bij pediatrische patiënten. Het farmacokinetische profiel en de veiligheid van famciclovir (experimentele korrels gemengd met OraSweet® of tabletten) werden bestudeerd in 3 open-label onderzoeken.
Studie 1 was een farmacokinetische en veiligheidsstudie met een enkelvoudige dosis bij zuigelingen van 1 maand tot
Studie 2 was een open-label farmacokinetische, meervoudige dosis veiligheidsstudie met een enkelvoudige dosis van experimenteel famciclovir granulaat gemengd met OraSweet bij kinderen van 1 tot
Een totaal van 100 patiënten namen deel aan het veiligheidsgedeelte van meervoudige doses van de studie; 47 proefpersonen met actieve of latente HSV-infectie en 53 proefpersonen met waterpokken. Patiënten met actieve of latente HSV-infectie kregen gedurende 7 dagen tweemaal daags famciclovir. De dagelijkse dosis famciclovir varieerde van 150 mg tot 500 mg tweemaal daags, afhankelijk van het lichaamsgewicht van de patiënt. Patiënten met waterpokken kregen gedurende 7 dagen driemaal daags famciclovir. De dagelijkse dosis famciclovir varieerde van driemaal daags 150 mg tot 500 mg, afhankelijk van het lichaamsgewicht van de patiënt. De klinische bijwerkingen en afwijkingen in laboratoriumtests die in dit onderzoek werden waargenomen, waren vergelijkbaar met die bij volwassenen. De beschikbare gegevens zijn om de volgende redenen onvoldoende om het gebruik van famciclovir voor de behandeling van kinderen van 1 tot
Waterpokken
De werkzaamheid van famciclovir voor de behandeling van waterpokken is niet vastgesteld bij pediatrische of volwassen patiënten. Famciclovir is goedgekeurd voor de behandeling van herpes zoster bij volwassen patiënten. Extrapolatie van werkzaamheidsgegevens van volwassenen met herpes zoster naar kinderen met waterpokken zou echter niet geschikt zijn. Hoewel waterpokken en herpes zoster door hetzelfde virus worden veroorzaakt, zijn de ziekten anders.
Genitale herpes
Klinische informatie over genitale herpes bij kinderen is beperkt. Daarom kunnen werkzaamheidsgegevens van volwassenen niet worden geëxtrapoleerd naar deze populatie. Verder is famciclovir niet onderzocht bij kinderen van 1 tot
Herpes Labialis
Er zijn geen farmacokinetische en veiligheidsgegevens bij kinderen van 1 tot
Studie 3 was een open-label, eenarmige studie om de farmacokinetiek, veiligheid en antivirale activiteit te evalueren van een enkele dosis van 1500 mg (drie tabletten van 500 mg) famciclovir bij kinderen van 12 tot
In een fase 3-onderzoek bij volwassenen waarbij patiënten een enkelvoudige dosis van 1500 mg famciclovir of placebo kregen, was de mediane tijd tot genezing bij patiënten met niet-geaborteerde laesies 4,4 dagen in de famciclovir 1500 mg groep met enkelvoudige dosis en 6,2 dagen in de placebogroep. Merk op dat in de studie bij volwassenen de behandeling door patiënten werd gestart binnen 1 uur na het begin van de symptomen [zie Klinische studies ]. Op basis van de werkzaamheidsresultaten in onderzoek 3 wordt famciclovir niet aanbevolen bij kinderen van 12 tot
Geriatrisch gebruik
Van de 816 patiënten met herpes zoster in klinische onderzoeken die werden behandeld met FAMVIR, waren 248 (30,4%) ≥65 jaar en 103 (13%) ≥75 jaar. Er werden geen algemene verschillen waargenomen in de incidentie of soorten bijwerkingen tussen jongere en oudere patiënten. Van de 610 patiënten met recidiverende herpes simplex (type 1 of type 2) in klinische onderzoeken die werden behandeld met FAMVIR 500 mg, waren 26 (4,3%) >65 jaar en 7 (1,1%) >75 jaar. Klinische onderzoeken met FAMVIR 500 mg bij patiënten met terugkerende genitale herpes omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen.
Er wordt geen dosisaanpassing van famciclovir op basis van leeftijd aanbevolen, tenzij de nierfunctie is aangetast [zie: DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ]. Over het algemeen dient de nodige voorzichtigheid te worden betracht bij het toedienen en controleren van FAMVIR 250 mg bij oudere patiënten, gezien de grotere frequentie van verminderde nierfunctie en gelijktijdig gebruik van andere geneesmiddelen.
Patiënten met nierinsufficiëntie
De schijnbare plasmaklaring, renale klaring en de plasma-eliminatiesnelheidsconstante van penciclovir namen lineair af met afname van de nierfunctie. Na toediening van een enkelvoudige orale dosis famciclovir van 500 mg (n=27) aan gezonde vrijwilligers en aan vrijwilligers met een verschillende mate van nierfunctiestoornis (CLCR varieerde van 6,4 tot 138,8 ml/min), werden de volgende resultaten verkregen (tabel 4):
In een onderzoek met meerdere doses famciclovir, uitgevoerd bij proefpersonen met verschillende gradaties van nierfunctiestoornis (n=18), was de farmacokinetiek van penciclovir vergelijkbaar met die na enkelvoudige doses.
Een dosisaanpassing wordt aanbevolen voor patiënten met nierinsufficiëntie [zie: DOSERING EN ADMINISTRATIE ].
Patiënten met leverinsufficiëntie
Lichte of matige leverfunctiestoornis (chronische hepatitis [n=6], chronisch ethanolmisbruik [n=8] of primaire biliaire cirrose [n=1]) had geen effect op de mate van beschikbaarheid (AUC) van penciclovir na een enkele dosis van 500 mg famciclovir. Er was echter een afname van 44% in de gemiddelde maximale plasmaconcentratie (Cmax) van penciclovir en de tijd tot de maximale plasmaconcentratie (tmax) nam toe met 0,75 uur bij patiënten met leverinsufficiëntie in vergelijking met normale vrijwilligers. Er wordt geen dosisaanpassing aanbevolen voor patiënten met een lichte of matige leverfunctiestoornis. De farmacokinetiek van penciclovir is niet onderzocht bij patiënten met een ernstige leverfunctiestoornis. De omzetting van famciclovir naar de actieve metaboliet penciclovir kan bij deze patiënten verstoord zijn, wat resulteert in een lagere plasmaconcentratie van penciclovir, en dus mogelijk een afname van de werkzaamheid van famciclovir [zie KLINISCHE FARMACOLOGIE ].
Zwarte en Afro-Amerikaanse patiënten
In een gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie, uitgevoerd bij 304 immunocompetente zwarte en Afro-Amerikaanse volwassenen met terugkerende genitale herpes, was er geen verschil in mediane tijd tot genezing tussen patiënten die FAMVIR of placebo kregen. Over het algemeen was het bijwerkingenprofiel vergelijkbaar met dat waargenomen in andere klinische onderzoeken met FAMVIR voor volwassen patiënten [zie: ONGEWENSTE REACTIES ]. De relevantie van deze onderzoeksresultaten voor andere indicaties bij zwarte en Afro-Amerikaanse patiënten is onbekend [zie Klinische studies ].
OVERDOSERING
Er moet passende symptomatische en ondersteunende therapie worden gegeven. Penciclovir wordt verwijderd door hemodialyse.
CONTRA-INDICATIES
FAMVIR 250 mg is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor het product, de componenten ervan of Denavir® (penciclovircrème).
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Famciclovir is een oraal toegediende prodrug van het antivirale middel penciclovir [zie Microbiologie ].
Farmacokinetiek
Famciclovir is de diacetyl 6-deoxy-analoog van de actieve antivirale verbinding penciclovir. Na orale toediening ondergaat famciclovir een snel en uitgebreid metabolisme tot penciclovir en wordt weinig of geen famciclovir in plasma of urine gedetecteerd. Penciclovir wordt voornamelijk onveranderd door de nieren uitgescheiden. Daarom moet de dosis FAMVIR 500 mg worden aangepast bij patiënten met verschillende gradaties van nierinsufficiëntie [zie: DOSERING EN ADMINISTRATIE ].
Farmacokinetiek bij volwassenen
Absorptie en biologische beschikbaarheid:
De absolute biologische beschikbaarheid van penciclovir is 77 ± 8%, zoals bepaald na toediening van een orale dosis famciclovir van 500 mg en een intraveneuze dosis penciclovir van 400 mg aan 12 gezonde mannelijke proefpersonen.
De penciclovirconcentraties namen evenredig met de dosis toe over een dosisbereik van famciclovir van 125 mg tot 1000 mg toegediend als een enkele dosis. Tabel 5 toont de gemiddelde farmacokinetische parameters van penciclovir na eenmalige toediening van FAMVIR aan gezonde mannelijke vrijwilligers.
Na orale toediening van een enkelvoudige dosis van 500 mg famciclovir aan 7 patiënten met herpes zoster, waren de AUC (gemiddelde ± SD), Cmax en tmax 12,1 ± 1,7 mcg uur/ml, 4,0 ± 0,7 mcg/ml en 0,7 ± 0,2 uur , respectievelijk. De AUC van penciclovir was ongeveer 35% hoger bij patiënten met herpes zoster in vergelijking met gezonde vrijwilligers. Een deel van dit verschil kan te wijten zijn aan verschillen in nierfunctie tussen de 2 groepen.
Er is geen accumulatie van penciclovir na toediening van 500 mg famciclovir driemaal daags gedurende 7 dagen.
De Cmax van penciclovir nam met ongeveer 50% af en de tmax werd 1,5 uur vertraagd wanneer een capsuleformulering van famciclovir met voedsel werd toegediend (voedingsgehalte was ongeveer 910 Kcal en 26% vet). Er was geen effect op de mate van beschikbaarheid (AUC) van penciclovir. Er was een afname van 18% in Cmax en een vertraging in tmax van ongeveer 1 uur wanneer famciclovir 2 uur na een maaltijd werd gegeven in vergelijking met toediening 2 uur vóór een maaltijd. Omdat er geen effect was op de mate van systemische beschikbaarheid van penciclovir, kan FAMVIR 250 mg worden ingenomen zonder rekening te houden met maaltijden.
Verdeling:
Het distributievolume (Vdβ) was 1,08 ± 0,17 l/kg bij 12 gezonde mannelijke proefpersonen na een enkelvoudige intraveneuze dosis penciclovir van 400 mg toegediend als een 1 uur durende intraveneuze infusie. Penciclovir is
Metabolisme:
Na orale toediening wordt famciclovir gedeacetyleerd en geoxideerd tot penciclovir. Metabolieten die inactief zijn, zijn onder meer 6-deoxypenciclovir, monogeacetyleerd penciclovir en 6-deoxy monogeacetyleerd penciclovir (respectievelijk 5%, DRUG-INTERACTIES ].
Eliminatie:
Ongeveer 94% van de toegediende radioactiviteit werd teruggevonden in de urine gedurende 24 uur (83% van de dosis werd uitgescheiden in de eerste 6 uur) na toediening van 5 mg/kg radioactief gelabelde penciclovir als een 1-uurs infusie aan 3 gezonde mannelijke vrijwilligers. Penciclovir was verantwoordelijk voor 91% van de radioactiviteit die in de urine werd uitgescheiden.
Na de orale toediening van een enkelvoudige dosis van 500 mg radioactief gelabeld famciclovir aan 3 gezonde mannelijke vrijwilligers, werd respectievelijk 73% en 27% van de toegediende radioactiviteit teruggevonden in urine en feces gedurende 72 uur. Penciclovir vertegenwoordigde 82% en 6-deoxypenciclovir vertegenwoordigde 7% van de radioactiviteit die in de urine werd uitgescheiden. Ongeveer 60% van de toegediende radioactief gelabelde dosis werd in de eerste 6 uur in de urine opgevangen.
Na intraveneuze toediening van penciclovir aan 48 gezonde mannelijke vrijwilligers was de gemiddelde ± SD totale plasmaklaring van penciclovir 36,6 ± 6,3 l/uur (0,48 ± 0,09 l/uur/kg). De renale klaring van penciclovir was goed voor 74,5±8,8% van de totale plasmaklaring.
De renale klaring van penciclovir na orale toediening van een enkelvoudige dosis van 500 mg famciclovir aan 109 gezonde mannelijke vrijwilligers was 27,7 ± 7,6 l/uur. Actieve tubulaire secretie draagt bij tot de renale eliminatie van penciclovir.
De plasma-eliminatiehalfwaardetijd van penciclovir was 2,0 ± 0,3 uur na intraveneuze toediening van penciclovir aan 48 gezonde mannelijke vrijwilligers en 2,3 ± 0,4 uur na orale toediening van 500 mg famciclovir aan 124 gezonde mannelijke vrijwilligers. De halfwaardetijd bij 17 patiënten met herpes zoster was respectievelijk 2,8 ± 1,0 uur en 2,7 ± 1,0 uur na enkelvoudige en herhaalde doses.
Speciale populaties
Geriatrische patiënten
Op basis van een cross-studievergelijking was de AUC van penciclovir 40% hoger en de renale klaring van penciclovir 22% lager bij oudere proefpersonen (n=18, leeftijd 65-79 jaar) in vergelijking met jongere proefpersonen. Een deel van dit verschil kan te wijten zijn aan verschillen in nierfunctie tussen de 2 groepen. Er wordt geen dosisaanpassing van famciclovir op basis van leeftijd aanbevolen, tenzij de nierfunctie is aangetast [zie: DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ]
Patiënten met nierinsufficiëntie
Bij proefpersonen met verschillende gradaties van nierinsufficiëntie namen de schijnbare plasmaklaring, renale klaring en de plasma-eliminatiesnelheidsconstante van penciclovir lineair af met vermindering van de nierfunctie, na zowel eenmalige als herhaalde dosering (zie Gebruik bij specifieke populaties ]. Een dosisaanpassing wordt aanbevolen voor patiënten met nierinsufficiëntie [zie: DOSERING EN ADMINISTRATIE ].
Patiënten met leverinsufficiëntie
Een lichte of matige leverfunctiestoornis had geen effect op de mate van beschikbaarheid (AUC) van penciclovir [zie: Gebruik bij specifieke populaties ]. Er wordt geen dosisaanpassing aanbevolen voor patiënten met een lichte of matige leverfunctiestoornis. Het effect van een ernstige leverfunctiestoornis op de farmacokinetiek van penciclovir is niet onderzocht.
HIV-geïnfecteerde patiënten
Na orale toediening van een enkele dosis van 500 mg famciclovir aan hiv-positieve patiënten waren de farmacokinetische parameters van penciclovir vergelijkbaar met die waargenomen bij gezonde proefpersonen.
Geslacht
De farmacokinetiek van penciclovir werd geëvalueerd bij 18 gezonde mannelijke en 18 gezonde vrouwelijke vrijwilligers na orale toediening van een enkelvoudige dosis van 500 mg famciclovir. De AUC van penciclovir was respectievelijk 9,3 ± 1,9 mcg u/ml en 11,1 ± 2,1 mcg u/ml en 11,1 ± 2,1 mcg u/ml. De renale klaring van penciclovir was respectievelijk 28,5 ± 8,9 l/uur en 21,8 ± 4,3 l/uur. Deze verschillen werden toegeschreven aan verschillen in nierfunctie tussen de 2 groepen. Er wordt geen dosisaanpassing van famciclovir op basis van geslacht aanbevolen.
Ras
Er werd een retrospectieve evaluatie uitgevoerd om de farmacokinetische parameters te vergelijken die werden verkregen bij zwarte en blanke proefpersonen na eenmalige en herhaalde eenmaal daagse, tweemaal daagse of driemaal daagse toediening van famciclovir 500 mg. Gegevens uit een onderzoek bij gezonde vrijwilligers (eenmalige dosis), een onderzoek bij proefpersonen met een verschillende mate van nierinsufficiëntie (eenmalige en herhaalde dosis) en een onderzoek bij proefpersonen met een leverinsufficiëntie (eenmalige dosis) wezen niet op significante verschillen in de farmacokinetiek van penciclovir tussen zwarte en blanke proefpersonen.
Microbiologie
Werkingsmechanisme
Famciclovir is een prodrug van penciclovir, waarvan een remmende werking is aangetoond tegen herpes simplex virus type 1 (HSV-1) en 2 (HSV-2) en varicella zoster virus (VZV). In cellen die zijn geïnfecteerd met HSV-1, HSV-2 of VZV, fosforyleert het virale thymidinekinase penciclovir tot een monofosfaatvorm die op zijn beurt door cellulaire kinasen wordt omgezet in de actieve vorm penciclovirtrifosfaat. Biochemische studies tonen aan dat penciclovirtrifosfaat HSV-2 DNA-polymerase competitief remt met deoxyguanosinetrifosfaat. Dientengevolge worden herpes virale DNA-synthese en dus replicatie selectief geremd. Penciclovirtrifosfaat heeft een intracellulaire halfwaardetijd van 10 uur in HSV-1-, 20 uur in HSV-2- en 7 uur in met VZV geïnfecteerde cellen die in kweek zijn gekweekt. De klinische betekenis van de intracellulaire halfwaardetijd is echter niet bekend.
Antivirale activiteit
In celkweekstudies remt penciclovir de volgende herpesvirussen: HSV-1, HSV-2 en VZV. De antivirale activiteit van penciclovir tegen wildtype stammen gekweekt op menselijke voorhuidfibroblasten werd beoordeeld met een plaqueverminderingstest en kleuring met kristalviolet 3 dagen na infectie voor HSV en 10 dagen na infectie voor VZV. De mediane EC50-waarden van penciclovir tegen laboratorium- en klinische isolaten van HSV-1, HSV-2 en VZV waren 2 M (bereik 1,2 tot 2,4 M, n=7), 2,6 M (bereik 1,6 tot 11 M, n=6) , en 34 M (bereik 6,7 tot 71 M, n = 6), respectievelijk.
Weerstand
Penciclovir-resistente mutanten van HSV en VZV kunnen het gevolg zijn van mutaties in de virale thymidinekinase (TK) en DNA-polymerasegenen. Mutaties in het virale TK-gen kunnen leiden tot volledig verlies van TK-activiteit (TK-negatief), verminderde niveaus van TK-activiteit (TK gedeeltelijk) of verandering in het vermogen van virale TK om het geneesmiddel te fosforyleren zonder een equivalent verlies in het vermogen om te fosforyleren thymidine (TK veranderd). De mediane EC50-waarden die werden waargenomen in een plaqueverminderingstest met penciclovir-resistente HSV-1, HSV-2 en VZV waren 69 M (bereik 14 tot 115 M, n=6), 46 M (bereik 4 tot >395 M, n= 9) en 92 M (bereik 51 tot 148 M, n = 4), respectievelijk. De mogelijkheid van virale resistentie tegen penciclovir moet worden overwogen bij patiënten die niet reageren of terugkerende virale uitscheiding ervaren tijdens de behandeling.
Kruisweerstand
Kruisresistentie is waargenomen bij HSV-DNA-polymeraseremmers. De meest voorkomende aciclovir-resistente mutanten die TK-negatief zijn, zijn ook resistent tegen penciclovir.
Klinische studies
Herpes Labialis (koortslip)
Een gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie werd uitgevoerd bij 701 immunocompetente volwassenen met recidiverende herpes labialis. Patiënten startten zelf de therapie binnen 1 uur na het eerste begin van tekenen of symptomen van een terugkerende episode van herpes labialis met FAMVIR 1500 mg als een enkele dosis (n=227), FAMVIR 750 mg tweemaal daags (n=220) of placebo (n= 254) voor 1 dag. De mediane tijd tot genezing bij patiënten met niet-geaborteerde laesies (voortschrijdend voorbij het papulestadium) was 4,4 dagen in de FAMVIR 1500 mg-groep met een enkele dosis (n=152) vergeleken met 6,2 dagen in de placebogroep (n=168). . Het mediane verschil in tijd tot genezing tussen de met placebo en met FAMVIR 1500 mg behandelde groepen was 1,3 dagen (95%-BI: 0,6-2,0). Er werden geen verschillen waargenomen in het aantal patiënten met geaborteerde laesies (die niet verder gingen dan het papulestadium) tussen patiënten die FAMVIR 250 mg of placebo kregen: 33% voor FAMVIR 1500 mg enkelvoudige dosis en 34% voor placebo. De mediane tijd tot verlies van pijn en gevoeligheid was 1,7 dagen bij met FAMVIR 1500 mg behandelde patiënten met een enkelvoudige dosis versus 2,9 dagen bij met placebo behandelde patiënten.
Genitale herpes
Terugkerende afleveringen
Een gerandomiseerde, dubbelblinde, placebo-gecontroleerde studie werd uitgevoerd bij 329 immunocompetente volwassenen met terugkerende genitale herpes. Patiënten startten zelf de therapie binnen 6 uur na het eerste teken of symptoom van een terugkerende episode van genitale herpes met ofwel 1000 mg FAMVIR tweemaal daags (n=163) ofwel placebo (n=166) gedurende 1 dag. De mediane tijd tot genezing bij patiënten met niet-geaborteerde laesies (voortschrijdend voorbij het papulestadium) was 4,3 dagen bij met FAMVIR behandelde patiënten (n=125) vergeleken met 6,1 dagen bij met placebo behandelde patiënten (n=145). Het mediane verschil in tijd tot genezing tussen de met placebo en FAMVIR behandelde groepen was 1,2 dagen (95%-BI: 0,5 tot 2,0). Drieëntwintig procent van de met FAMVIR behandelde patiënten had geaborteerde laesies (geen ontwikkeling van laesies voorbij erytheem) versus 13% bij met placebo behandelde patiënten. De mediane tijd tot verlies van alle symptomen (bijv. tintelingen, jeuk, branderig gevoel, pijn of gevoeligheid) was 3,3 dagen bij met FAMVIR behandelde patiënten versus 5,4 dagen bij met placebo behandelde patiënten.
Een gerandomiseerde (2:1), dubbelblinde, placebo-gecontroleerde studie werd uitgevoerd bij 304 immunocompetente zwarte en Afro-Amerikaanse volwassenen met terugkerende genitale herpes. Patiënten startten zelf de therapie binnen 6 uur na het eerste teken of symptoom van een terugkerende episode van genitale herpes met ofwel 1000 mg FAMVIR tweemaal daags (n=206) ofwel placebo (n=98) gedurende 1 dag. De mediane tijd tot genezing bij patiënten met niet-geaborteerde laesies was 5,4 dagen bij met FAMVIR behandelde patiënten (n=152) vergeleken met 4,8 dagen bij met placebo behandelde patiënten (n=78). Het mediane verschil in tijd tot genezing tussen de met placebo en FAMVIR behandelde groepen was -0,26 dagen (95% BI: -0,98 tot 0,40).
Suppressieve therapie
Er werden twee gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken van 12 maanden uitgevoerd bij 934 immunocompetente volwassenen met een voorgeschiedenis van 6 of meer recidieven van genitale herpes-episodes per jaar. Vergelijkingen omvatten FAMVIR 125 mg driemaal daags, 250 mg tweemaal daags, 250 mg driemaal daags en placebo. Na 12 maanden kreeg 60% tot 65% van de patiënten nog steeds FAMVIR en 25% kreeg een placebobehandeling. Herhalingspercentages na 6 en 12 maanden bij patiënten die werden behandeld met de 250 mg tweemaal daagse dosis worden weergegeven in Tabel 6.
Met FAMVIR behandelde patiënten hadden ongeveer 1/5 van het mediane aantal recidieven in vergelijking met met placebo behandelde patiënten. Hogere doses FAMVIR 250 mg gingen niet gepaard met een toename van de werkzaamheid.
Terugkerende orolabiale of genitale herpes bij met HIV geïnfecteerde patiënten
Een gerandomiseerde, dubbelblinde studie vergeleek famciclovir 500 mg tweemaal daags gedurende 7 dagen (n=150) met orale aciclovir 400 mg 5 maal daags gedurende 7 dagen (n=143) bij HIV-geïnfecteerde patiënten met recidiverende orolabiale of genitale herpes die werden behandeld binnen 48 uur na aanvang van de laesie. Ongeveer 40% van de patiënten had een CD4+-telling van minder dan 200 cellen/mm3, 54% van de patiënten had anogenitale laesies en 35% had orolabiale laesies. De behandeling met famciclovir was vergelijkbaar met orale aciclovir wat betreft het verminderen van de vorming van nieuwe laesies en in de tijd tot volledige genezing.
Herpes zoster (gordelroos)
Twee gerandomiseerde, dubbelblinde onderzoeken, 1 placebogecontroleerd en 1 actief gecontroleerd, werden uitgevoerd bij 964 immunocompetente volwassenen met ongecompliceerde herpes zoster. De behandeling werd gestart binnen 72 uur na het verschijnen van de eerste laesie en werd gedurende 7 dagen voortgezet.
In het placebogecontroleerde onderzoek werden 419 patiënten behandeld met FAMVIR 500 mg driemaal daags (n=138), FAMVIR 750 mg driemaal daags (n=135) of placebo (n=146). De mediane tijd tot volledige korstvorming was 5 dagen bij met FAMVIR 500 mg behandelde patiënten vergeleken met 7 dagen bij met placebo behandelde patiënten. De tijden tot volledige korstvorming, verlies van blaasjes, verlies van zweren en verlies van korsten waren korter voor met FAMVIR 500 mg behandelde patiënten dan voor met placebo behandelde patiënten in de totale onderzoekspopulatie. De effecten van FAMVIR 500 mg waren groter wanneer de behandeling binnen 48 uur na het begin van de uitslag werd gestart; het was ook ernstiger bij patiënten van 50 jaar of ouder. Van de 65,2% van de patiënten met ten minste 1 positieve virale kweek, hadden met FAMVIR behandelde patiënten een kortere mediane duur van virale uitscheiding dan met placebo behandelde patiënten (respectievelijk 1 dag en 2 dagen).
Er waren geen algemene verschillen in de duur van pijn vóór genezing van de uitslag tussen de met FAMVIR en placebo behandelde groepen. Bovendien was er geen verschil in de incidentie van pijn na genezing van huiduitslag (postherpetische neuralgie) tussen de behandelingsgroepen. Bij de 186 patiënten (44,4% van de totale onderzoekspopulatie) die postherpetische neuralgie ontwikkelden, was de mediane duur van postherpetische neuralgie korter bij patiënten die werden behandeld met FAMVIR 500 mg dan bij degenen die werden behandeld met placebo (respectievelijk 63 dagen en 119 dagen). Er werd geen extra werkzaamheid aangetoond met een hogere dosis FAMVIR.
In de actief-gecontroleerde studie werden 545 patiënten behandeld met 1 van de 3 doses FAMVIR driemaal daags of met aciclovir 800 mg vijfmaal daags. Tijden tot volledige korstvorming van de laesie en tijd tot verlies van acute pijn waren vergelijkbaar voor alle groepen en er waren geen statistisch significante verschillen in de tijd tot verlies van postherpetische neuralgie tussen met FAMVIR en met aciclovir behandelde groepen.
PATIËNT INFORMATIE
FAMVIR® (Fam'-veer) (famciclovir) Tabletten
Lees deze patiënteninformatie voordat u FAMVIR gaat gebruiken en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling.
Wat is FAMVIR?
Famvir is een antiviraal geneesmiddel op recept dat wordt gebruikt om:
- uitbraken van koortsblaasjes (koortsblaasjes) bij gezonde volwassenen behandelen
- uitbraken van genitale herpes bij gezonde volwassenen behandelen
- het aantal uitbraken van genitale herpes bij gezonde volwassenen verminderen
- uitbraken van herpes simplex-laesies in of rond de mond, geslachtsdelen en anale gebieden behandelen bij mensen die besmet zijn met hiv
- gordelroos (herpes zoster) behandelen bij volwassenen met een normaal immuunsysteem
Het is niet bekend of FAMVIR 500 mg veilig en effectief is bij kinderen jonger dan 18 jaar.
FAMVIR 250 mg is geen remedie voor herpes. Het is niet bekend of FAMVIR de verspreiding van herpes naar anderen kan stoppen. Als u seksueel actief bent, kunt u herpes doorgeven aan uw partner, zelfs als u FAMVIR gebruikt. Herpes kan zelfs worden overgedragen als u geen actieve symptomen heeft. U moet doorgaan met veiliger vrijen om de kans te verkleinen dat u genitale herpes naar anderen verspreidt. Heb geen seksueel contact met uw partner tijdens een uitbraak van genitale herpes of als u symptomen van genitale herpes heeft. Gebruik bij seksueel contact een condoom van latex of polyurethaan. Vraag uw zorgverlener om meer informatie over veiligere sekspraktijken.
Wie mag FAMVIR niet gebruiken?
Gebruik FAMVIR 250 mg niet als u allergisch bent voor een van de ingrediënten of voor Denavir® (penciclovircrème). Zie het einde van deze patiëntenbijsluiter voor een volledige lijst van ingrediënten in FAMVIR.
Wat moet ik mijn zorgverlener vertellen voordat ik FAMVIR 500 mg inneem?
Voordat u FAMVIR 500 mg gaat gebruiken, moet u uw zorgverlener informeren als u:
- nier- of leverproblemen heeft
- een zeldzaam genetisch probleem heeft met galactose-intolerantie, een ernstige lactasedeficiëntie of u neemt geen glucose-galactose op (malabsorptie)
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of FAMVIR 250 mg schadelijk is voor uw ongeboren baby
- Rapportage van zwangerschapsblootstelling: Novartis Pharmaceuticals Corporation verzamelt zwangerschapsrapporten die op vrijwillige basis worden gerapporteerd. Praat in geval van zwangerschap met uw zorgverlener over het melden van uw zwangerschap
- borstvoeding geeft of van plan bent borstvoeding te geven
Vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Vertel het uw zorgverlener vooral als u:
- alle andere geneesmiddelen en producten die u gebruikt om herpes-uitbraken te behandelen
- probenecide (Probalan)
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om elke keer dat u een nieuw geneesmiddel krijgt aan uw zorgverlener en apotheker te laten zien.
Hoe moet ik FAMVIR gebruiken?
- Neem FAMVIR precies zoals voorgeschreven
- Uw zorgverlener zal u vertellen hoeveel FAMVIR u moet innemen en wanneer u ze moet innemen. Uw dosis FAMVIR 250 mg en hoe vaak u deze inneemt, kan verschillen afhankelijk van uw aandoening
- FAMVIR kan met of zonder voedsel worden ingenomen
- Het is belangrijk dat u al het geneesmiddel afmaakt zoals voorgeschreven, zelfs als u zich beter begint te voelen
- Uw symptomen kunnen aanhouden, zelfs nadat u al uw FAMVIR heeft voltooid. Dit betekent niet dat u meer medicijnen nodig heeft, aangezien u al een volledige kuur met FAMVIR 500 mg heeft gehad en het in uw lichaam zal blijven werken. Neem contact op met uw zorgverlener als u vragen heeft over uw aandoening en uw behandeling
Wat zijn de mogelijke bijwerkingen van FAMVIR 250 mg?
De meest voorkomende bijwerkingen van FAMVIR 500 mg zijn:
- hoofdpijn
- misselijkheid
Neem contact op met uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van FAMVIR. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw zorgverlener voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA1088.
Hoe moet ik FAMVIR 500 mg bewaren?
- Bewaar FAMVIR bij kamertemperatuur tussen 59 ° F en 86 ° F (15 ° C tot 30 ° C).
Houd FAMVIR en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over FAMVIR
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in de patiëntenbijsluiters. Gebruik FAMVIR niet voor een aandoening waarvoor het niet is voorgeschreven. Geef FAMVIR 500 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze folder vat de belangrijkste informatie over FAMVIR samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. Uw zorgverlener of apotheker kan u informatie geven over FAMVIR 500 mg die is geschreven voor gezondheidswerkers. Ga voor meer informatie naar www.FAMVIR.com of bel 1-888-669-6682.
Wat zijn de ingrediënten in FAMVIR?
Actief ingrediënt: famciclovir
Inactieve ingredienten: hydroxypropylcellulose, hydroxypropylmethylcellulose, lactose, magnesiumstearaat, polyethyleenglycolen, natriumzetmeelglycolaat en titaniumdioxide
