Sustiva 200mg, 600mg Efavirenz Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Sustiva 600 mg en hoe wordt het gebruikt?
Sustiva is een receptgeneesmiddel dat wordt gebruikt om de symptomen van een hiv-infectie te behandelen. Sustiva kan alleen of in combinatie met andere medicijnen worden gebruikt.
Sustiva behoort tot een klasse geneesmiddelen die hiv, NNRTI's, wordt genoemd.
Het is niet bekend of Sustiva veilig en effectief is bij kinderen jonger dan 3 maanden.
Wat zijn de mogelijke bijwerkingen van Sustiva?
Sustiva kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- koorts,
- keelpijn,
- brandende ogen,
- huid pijn,
- rode of paarse huiduitslag met blaarvorming en vervelling,
- hartinfarct,
- hallucinaties,
- moeite met concentreren,
- problemen met spreken of bewegen (kan maanden of jaren na aanvang van het geneesmiddel optreden),
- duizeligheid,
- slaperigheid,
- verwardheid,
- moeite met concentreren,
- vreemde dromen,
- slapeloosheid,
- problemen met spraak,
- problemen met uw evenwicht of spierbeweging,
- ongerustheid,
- paranoia,
- vreemd gedrag,
- verdrietig of hopeloos voelen,
- zelfmoordgedachten,
- misselijkheid,
- buikpijn,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- Nacht zweet,
- opgezwollen klieren,
- koortsblaasjes,
- hoesten,
- piepende ademhaling,
- diarree,
- gewichtsverlies,
- Moeite met slikken,
- problemen met evenwicht of oogbewegingen,
- zwakheid,
- stekelig gevoel,
- zwelling in uw nek of keel (vergrote schildklier),
- menstruatieveranderingen, en
- impotentie
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Sustiva zijn:
- misselijkheid,
- braken,
- duizeligheid,
- slaperigheid,
- moeite met concentreren,
- uitslag,
- hoofdpijn,
- vermoeidheid,
- slaapproblemen (slapeloosheid),
- vreemde dromen, en
- veranderingen in de vorm of locatie van lichaamsvet (vooral in uw armen, benen, gezicht, nek, borsten en taille)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Sustiva. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
SUSTIVA® (efavirenz) is een hiv-1-specifieke, niet-nucleoside, reverse transcriptase-remmer (NNRTI). Efavirenz wordt chemisch beschreven als (S)-6-chloor-4-(cyclopropylethynyl)-1,4-dihydro4-(trifluormethyl)-2H-3,1-benzoxazine-2-on. De empirische formule is C14H9ClF3NO2 en de structuurformule is:
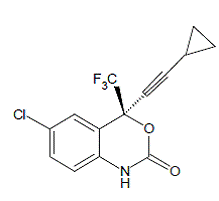
Efavirenz is een wit tot lichtroze kristallijn poeder met een molecuulmassa van 315,68. Het is praktisch onoplosbaar in water (
Capsules
SUSTIVA is verkrijgbaar als capsules voor orale toediening die 50 mg of 200 mg efavirenz en de volgende inactieve ingrediënten bevatten: lactosemonohydraat, magnesiumstearaat, natriumlaurylsulfaat en natriumzetmeelglycolaat. Het omhulsel van de capsule bevat de volgende inactieve ingrediënten en kleurstoffen: gelatine, natriumlaurylsulfaat, titaniumdioxide en/of geel ijzeroxide. De capsuleomhulsels kunnen ook siliciumdioxide bevatten. De capsules zijn bedrukt met inkt die karmijn 40 blauw, FD&C Blue No. 2 en titaniumdioxide bevat.
Tabletten
SUSTIVA 600 mg is verkrijgbaar als filmomhulde tabletten voor orale toediening die 600 mg efavirenz en de volgende inactieve ingrediënten bevatten: croscarmellosenatrium, hydroxypropylcellulose, lactosemonohydraat, magnesiumstearaat, microkristallijne cellulose en natriumlaurylsulfaat. De filmcoating bevat Opadry Yellow en Opadry Clear. De tabletten zijn gepolijst met carnaubawas en bedrukt met paarse inkt, Opacode WB.
INDICATIES
SUSTIVA® (efavirenz) in combinatie met andere antiretrovirale middelen is geïndiceerd voor de behandeling van infectie met het humaan immunodeficiëntievirus type 1 (hiv-1) bij volwassenen en bij pediatrische patiënten van ten minste 3 maanden oud en met een gewicht van ten minste 3,5 kg.
DOSERING EN ADMINISTRATIE
Leverfunctie
Controleer de leverfunctie vóór en tijdens de behandeling met SUSTIVA [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. SUSTIVA 600 mg wordt niet aanbevolen bij patiënten met een matige of ernstige leverfunctiestoornis (Child Pugh B of C) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
volwassenen
De aanbevolen dosering van SUSTIVA (efavirenz) is 600 mg oraal, eenmaal daags, in combinatie met een proteaseremmer en/of nucleoside-analoge reverse transcriptaseremmers (NRTI's). Het wordt aanbevolen SUSTIVA op een lege maag in te nemen, bij voorkeur voor het slapengaan. De verhoogde efavirenz-concentraties die worden waargenomen na toediening van SUSTIVA 600 mg met voedsel, kunnen leiden tot een toename van de frequentie van bijwerkingen [zie KLINISCHE FARMACOLOGIE ]. Dosering voor het slapengaan kan de verdraagbaarheid van symptomen van het zenuwstelsel verbeteren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES , en PATIËNT INFORMATIE ]. SUSTIVA-capsules of -tabletten moeten intact worden doorgeslikt met vloeistof. Voor patiënten die geen capsules of tabletten kunnen doorslikken, wordt de toedieningswijze met capsules aanbevolen [zie Capsulestrooiwijze van toediening ].
Gelijktijdige antiretrovirale therapie
SUSTIVA moet worden gegeven in combinatie met andere antiretrovirale geneesmiddelen [zie: INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
Dosering Aanpassing
Als SUSTIVA 200 mg gelijktijdig wordt toegediend met voriconazol, moet de onderhoudsdosis voriconazol worden verhoogd tot 400 mg om de 12 uur en moet de dosis SUSTIVA 200 mg worden verlaagd tot eenmaal daags 300 mg met behulp van de capsuleformulering (één 200 mg en twee 50 mg capsules of zes 50 mg capsules). mg-capsules). SUSTIVA 600 mg tabletten mogen niet worden gebroken. [zien DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE .]
Als SUSTIVA gelijktijdig met rifampicine wordt toegediend aan patiënten die 50 kg of meer wegen, wordt een verhoging van de dosis SUSTIVA 200 mg tot 800 mg eenmaal daags aanbevolen [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Pediatrische patiënten
Het wordt aanbevolen om SUSTIVA 600 mg op een lege maag in te nemen, bij voorkeur voor het slapengaan. Tabel 1 beschrijft de aanbevolen dosis SUSTIVA voor pediatrische patiënten van 3 maanden of ouder en met een gewicht tussen 3,5 kg en 40 kg [zie KLINISCHE FARMACOLOGIE ]. De aanbevolen dosering van SUSTIVA voor pediatrische patiënten die 40 kg of meer wegen, is eenmaal daags 600 mg. Voor pediatrische patiënten die geen capsules kunnen doorslikken, kan de inhoud van de capsule worden toegediend met een kleine hoeveelheid voedsel of zuigelingenvoeding met behulp van de capsule-strooimethode van toediening [zie Capsulestrooiwijze van toediening ].
Capsulestrooiwijze van toediening
Voor pediatrische patiënten van ten minste 3 maanden oud en met een gewicht van ten minste 3,5 kg en volwassenen die geen capsules of tabletten kunnen doorslikken, kan de inhoud van de capsule worden toegediend met een kleine hoeveelheid (1 tot 2 theelepels) voedsel. Het gebruik van zuigelingenvoeding voor het mengen mag alleen worden overwogen voor die jonge zuigelingen die niet op betrouwbare wijze vast voedsel kunnen consumeren. Patiënten en zorgverleners moeten worden geïnstrueerd om de capsule voorzichtig te openen om morsen of verspreiden van de inhoud van de capsule in de lucht te voorkomen. De capsule moet horizontaal boven een kleine container worden gehouden en voorzichtig worden gedraaid om te openen. Voor patiënten die vast voedsel kunnen verdragen, moet de volledige inhoud van de capsule voorzichtig worden gemengd met zacht voedsel dat geschikt is voor de leeftijd, zoals appelmoes, druivengelei of yoghurt, in de kleine container. Voor jonge zuigelingen die het mengsel voor zuigelingenvoeding in capsules krijgen, moet de volledige inhoud van de capsule voorzichtig worden gemengd in 2 theelepels gereconstitueerde zuigelingenvoeding op kamertemperatuur in een kleine container door voorzichtig te roeren met een kleine lepel en het mengsel vervolgens op te zuigen in een 10 ml doseerspuit voor orale toediening. Na toediening van het SUSTIVA-voedsel- of -formulemengsel moet een extra kleine hoeveelheid (ongeveer 2 theelepels) voedsel of formule worden toegevoegd aan de lege mengbeker, geroerd om eventueel achtergebleven SUSTIVA-residu te verspreiden en aan de patiënt te worden toegediend. Het SUSTIVA-voedsel- of -formulemengsel moet binnen 30 minuten na het mengen worden toegediend. Gedurende 2 uur na toediening van SUSTIVA mag geen extra voedsel worden ingenomen.
Verdere instructies voor de patiënt over de wijze van toediening van de capsule zijn te vinden in de door de FDA goedgekeurde patiëntetikettering (zie: PATIËNT INFORMATIE en GEBRUIKSAANWIJZING ).
HOE GELEVERD
Doseringsvormen en sterke punten
Capsules
200 mg capsules zijn goudkleurig, aan de achterzijde bedrukt met “SUSTIVA” op de romp en bedrukt met “200 mg” op de dop.
50 mg capsules zijn goudkleurig en wit, bedrukt met “SUSTIVA” op de goudkleurige dop en omgekeerd gedrukt “50 mg” op de witte romp.
Tabletten
600 mg tabletten zijn gele, kapselvormige, filmomhulde tabletten, aan beide zijden bedrukt met “SUSTIVA”.
Opslag en behandeling
Capsules
SUSTIVA® (efavirenz) capsules zijn als volgt verkrijgbaar:
Capsules 200 mg zijn goudkleurig, omgekeerd bedrukt met “SUSTIVA” op de romp en bedrukt met “200 mg” op de dop.
Flessen van 90 - NDC 0056-0474-92
Capsules van 50 mg zijn goudkleurig en wit, bedrukt met “SUSTIVA” op de goudkleurige dop en omgekeerd gedrukt “50 mg” op de witte romp.
Flessen van 30 - NDC 0056-0470-30
Tabletten
SUSTIVA® (efavirenz) tabletten zijn als volgt verkrijgbaar:
Tabletten 600 mg zijn gele, kapselvormige, filmomhulde tabletten, met aan beide zijden de opdruk 'SUSTIVA'.
Flessen van 30 - NDC 0056-0510-30
Opslag
SUSTIVA 600 mg capsules en SUSTIVA-tabletten moeten worden bewaard bij 25°C (77°F); excursies toegestaan tot 15 ° C-30 ° C (59 ° F-86 ° F) [zie USP-gecontroleerde kamertemperatuur].
Gedistribueerd door: Bristol-Myers Squibb Company Princeton, NJ 08543 VS. Herzien: okt 2020
BIJWERKINGEN
De belangrijkste bijwerkingen die zijn waargenomen bij patiënten die met SUSTIVA werden behandeld, zijn:
- psychiatrische symptomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ],
- symptomen van het zenuwstelsel [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ],
- uitslag [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- hepatotoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de gemelde bijwerkingen niet direct worden vergeleken met de percentages in andere klinische onderzoeken en komen ze mogelijk niet overeen met de percentages die in de klinische praktijk zijn waargenomen.
Bijwerkingen bij volwassenen
De meest voorkomende (>5% in beide behandelgroepen met efavirenz) van ten minste matige ernst bij patiënten in onderzoek 006 die werden behandeld met SUSTIVA 200 mg in combinatie met zidovudine/lamivudine of indinavir waren huiduitslag, duizeligheid, misselijkheid, hoofdpijn, vermoeidheid, slapeloosheid, en braken.
Geselecteerde klinische bijwerkingen van matige of ernstige intensiteit die zijn waargenomen bij ≥2% van de met SUSTIVA behandelde patiënten in twee gecontroleerde klinische onderzoeken, worden weergegeven in tabel 2.
Pancreatitis is gemeld, hoewel een causaal verband met efavirenz niet is vastgesteld. Asymptomatische verhogingen van serumamylasespiegels werden waargenomen bij een significant groter aantal patiënten behandeld met efavirenz 600 mg dan bij controlepatiënten (zie Laboratoriumafwijkingen ).
Zenuwstelselsymptomen
Voor 1008 patiënten die werden behandeld met regimes die SUSTIVA bevatten en 635 patiënten die werden behandeld met een controleregime in gecontroleerde onderzoeken, vermeldt Tabel 3 de frequentie van symptomen van verschillende gradaties van ernst en geeft de stopzettingspercentages voor een of meer van de volgende symptomen van het zenuwstelsel: duizeligheid, slapeloosheid, verminderde concentratie, slaperigheid, abnormaal dromen, euforie, verwardheid, opwinding, geheugenverlies, hallucinaties, verdoving, abnormaal denken en depersonalisatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. De frequenties van specifieke symptomen van het centrale en perifere zenuwstelsel worden gegeven in Tabel 2.
Psychiatrische symptomen
Ernstige psychiatrische bijwerkingen zijn gemeld bij patiënten die met SUSTIVA werden behandeld. In gecontroleerde onderzoeken waren de psychiatrische symptomen die met een frequentie van meer dan 2% werden waargenomen bij patiënten die werden behandeld met SUSTIVA 600 mg of controleregimes respectievelijk depressie (19%, 16%), angst (13%, 9%) en nervositeit (7%). , 2%).
Uitslag
In gecontroleerde klinische onderzoeken was de frequentie van huiduitslag (alle gradaties, ongeacht de causaliteit) 26% voor 1008 volwassenen die werden behandeld met regimes die SUSTIVA 200 mg bevatten en 17% voor 635 volwassenen die werden behandeld met een controleregime. De meeste meldingen van huiduitslag waren licht of matig van ernst. De frequentie van uitslag van graad 3 was 0,8% voor met SUSTIVA behandelde patiënten en 0,3% voor controlegroepen, en de frequentie van uitslag van graad 4 was 0,1% voor SUSTIVA en 0 voor controlegroepen. De stopzettingspercentages als gevolg van huiduitslag waren 1,7% voor met SUSTIVA behandelde patiënten en 0,3% voor controlegroepen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ervaring met SUSTIVA bij patiënten die stopten met andere antiretrovirale middelen van de NNRTI-klasse is beperkt. Negentien patiënten die stopten met nevirapine vanwege huiduitslag, zijn behandeld met SUSTIVA. Negen van deze patiënten ontwikkelden milde tot matige huiduitslag tijdens de behandeling met SUSTIVA, en twee van deze patiënten stopten vanwege huiduitslag.
Laboratoriumafwijkingen
Geselecteerde laboratoriumafwijkingen van graad 3-4 die zijn gemeld bij ≥2% van de met SUSTIVA behandelde patiënten in twee klinische onderzoeken, worden weergegeven in Tabel 4.
Patiënten gecoïnfecteerd met hepatitis B of C
Leverfunctietesten dienen te worden gecontroleerd bij patiënten met een voorgeschiedenis van hepatitis B en/of C. In de langetermijngegevensverzameling van onderzoek 006 werden 137 patiënten behandeld met SUSTIVA-bevattende regimes (mediane duur van de behandeling, 68 weken) en 84 behandelde met een controleregime (mediane duur, 56 weken) waren seropositief bij screening op hepatitis B (oppervlakteantigeen-positief) en/of C (hepatitis C-antilichaam-positief). Onder deze gecoïnfecteerde patiënten ontwikkelden zich verhogingen van ASAT tot meer dan vijf keer de ULN bij 13% van de patiënten in de SUSTIVA-armen en 7% van degenen in de controle-arm, en verhogingen van ALAT tot meer dan vijf keer de ULN ontwikkelden zich bij 20% van de patiënten in de SUSTIVA-armen en 7% van de patiënten in de controle-arm. Onder co-geïnfecteerde patiënten stopten 3% van degenen die werden behandeld met SUSTIVA-bevattende regimes en 2% in de controle-arm met het onderzoek vanwege lever- of galaandoeningen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Lipiden
Bij sommige niet-geïnfecteerde vrijwilligers die SUSTIVA kregen, zijn verhogingen van het totale cholesterolgehalte van 10-20% ten opzichte van de uitgangswaarde waargenomen. Bij patiënten die werden behandeld met SUSTIVA + zidovudine + lamivudine, werden vanaf baseline stijgingen van het niet-nuchtere totale cholesterol en HDL van respectievelijk ongeveer 20% en 25% waargenomen. Bij patiënten die met SUSTIVA + indinavir werden behandeld, werden vanaf baseline verhogingen van niet-nuchtere cholesterol en HDL van respectievelijk ongeveer 40% en 35% waargenomen. Niet-nuchtere totale cholesterolwaarden van ≥240 mg/dL en ≥300 mg/dL werden gemeld bij respectievelijk 34% en 9% van de patiënten die werden behandeld met SUSTIVA + zidovudine + lamivudine; respectievelijk 54% en 20% van de patiënten behandeld met SUSTIVA + indinavir; en respectievelijk 28% en 4% van de patiënten die werden behandeld met indinavir + zidovudine + lamivudine. De effecten van SUSTIVA 600 mg op triglyceriden en LDL in dit onderzoek waren niet goed gekarakteriseerd omdat er monsters werden genomen van niet-nuchtere patiënten. De klinische betekenis van deze bevindingen is onbekend [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bijwerkingen bij pediatrische patiënten
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de gemelde bijwerkingen niet direct worden vergeleken met de percentages in andere klinische onderzoeken en komen ze mogelijk niet overeen met de percentages die in de klinische praktijk zijn waargenomen.
Beoordeling van bijwerkingen is gebaseerd op drie klinische onderzoeken bij 182 met hiv-1 geïnfecteerde pediatrische patiënten (3 maanden tot 21 jaar oud) die SUSTIVA 200 mg kregen in combinatie met andere antiretrovirale middelen gedurende een mediane periode van 123 weken. De bijwerkingen die in de drie onderzoeken werden waargenomen, waren vergelijkbaar met de bijwerkingen die werden waargenomen in klinische onderzoeken bij volwassenen, behalve dat huiduitslag vaker voorkwam bij pediatrische patiënten (32% voor alle gradaties, ongeacht de causaliteit) en vaker van hogere graad (dwz ernstiger). Twee (1,1%) pediatrische patiënten hadden uitslag van graad 3 (samenvloeiende uitslag met koorts, gegeneraliseerde uitslag) en vier (2,2%) pediatrische patiënten hadden uitslag van graad 4 (allemaal erythema multiforme). Vijf pediatrische patiënten (2,7%) stopten met het onderzoek vanwege huiduitslag [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van SUSTIVA na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting van de frequentie ervan of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam als geheel: allergische reacties, asthenie, herverdeling/ophoping van lichaamsvet [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Centraal en perifeer zenuwstelsel: abnormale coördinatie, ataxie, encefalopathie, cerebellaire coördinatie- en evenwichtsstoornissen, convulsies, hypesthesie, paresthesie, neuropathie, tremor, duizeligheid
Endocrien: gynaecomastie
Gastro-intestinaal: constipatie, malabsorptie
Cardiovasculair: blozen, hartkloppingen
Lever en galwegen: verhoging van leverenzymen, leverfalen, hepatitis.
Metabool en voedingswaarde: hypercholesterolemie, hypertriglyceridemie
Musculoskeletaal: artralgie, myalgie, myopathie
Psychiatrisch: agressieve reacties, agitatie, wanen, emotionele labiliteit, manie, neurose, paranoia, psychose, zelfmoord, katatonie
Ademhaling: kortademigheid
Huid en aanhangsels: erythema multiforme, fotoallergische dermatitis, Stevens-Johnson-syndroom
Speciale zintuigen: abnormaal zicht, tinnitus
DRUG-INTERACTIES
Potentieel voor SUSTIVA om andere geneesmiddelen te beïnvloeden
Van efavirenz is in vivo aangetoond dat het CYP3A en CYP2B6 induceert. Andere verbindingen die substraten zijn van CYP3A of CYP2B6 kunnen verlaagde plasmaconcentraties hebben bij gelijktijdige toediening met SUSTIVA.
Potentieel voor andere geneesmiddelen om SUSTIVA te beïnvloeden
Geneesmiddelen die CYP3A-activiteit induceren (bijv. fenobarbital, rifampicine, rifabutine) zouden naar verwachting de klaring van efavirenz verhogen, wat resulteert in verlaagde plasmaconcentraties (zie DOSERING EN ADMINISTRATIE ].
QT-verlengende medicijnen
Er is beperkte informatie beschikbaar over de mogelijkheid van een farmacodynamische interactie tussen SUSTIVA 600 mg en geneesmiddelen die het QTc-interval verlengen. QTc-verlenging is waargenomen bij het gebruik van efavirenz [zie: KLINISCHE FARMACOLOGIE ]. Overweeg alternatieven voor SUSTIVA 600 mg bij gelijktijdige toediening met een geneesmiddel met een bekend risico op torsade de pointes.
Gevestigde en andere potentieel significante interacties tussen geneesmiddelen
Geneesmiddelinteracties met SUSTIVA zijn samengevat in Tabel 5. Voor farmacokinetische gegevens, [zie: KLINISCHE FARMACOLOGIE ] Tabellen 7 en 8. Deze tabel bevat mogelijk significante interacties, maar is niet allesomvattend.
Geneesmiddelen zonder klinisch significante interacties met SUSTIVA
Er wordt geen dosisaanpassing aanbevolen als SUSTIVA 600 mg wordt gegeven met de volgende middelen: antacida van aluminium/magnesiumhydroxide, azitromycine, cetirizine, famotidine, fluconazol, lorazepam, nelfinavir, nucleoside reverse transcriptaseremmers (abacavir, emtricitabine, lamivudine, stavudine, zidoxovudine-fumaraat). ), paroxetine en raltegravir.
Cannabinoïde Test Interactie
Efavirenz bindt niet aan cannabinoïdereceptoren. Er zijn vals-positieve cannabinoïde-testresultaten in urine gemeld bij sommige screeningsassays bij niet-geïnfecteerde en met hiv geïnfecteerde proefpersonen die efavirenz kregen. Bevestiging van positieve screeningtests voor cannabinoïden door een meer specifieke methode wordt aanbevolen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Geneesmiddelinteracties
De plasmaconcentraties van efavirenz kunnen worden gewijzigd door substraten, remmers of inductoren van CYP3A. Evenzo kan efavirenz de plasmaconcentraties veranderen van geneesmiddelen die worden gemetaboliseerd door CYP3A of CYP2B6. Het meest prominente effect van efavirenz bij steady-state is de inductie van CYP3A en CYP2B6 [zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ].
QTc-verlenging
QTc-verlenging is waargenomen bij het gebruik van efavirenz [zie: DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ]. Overweeg alternatieven voor SUSTIVA 600 mg wanneer het gelijktijdig wordt toegediend met een geneesmiddel met een bekend risico op torsade de pointes of wanneer het wordt toegediend aan patiënten met een hoger risico op torsade de pointes.
Weerstand
SUSTIVA 200 mg mag niet worden gebruikt als enkelvoudig middel voor de behandeling van HIV-1-infectie of als enig middel worden toegevoegd aan een falend regime. Resistent virus ontstaat snel wanneer efavirenz als monotherapie wordt toegediend. Bij de keuze van nieuwe antiretrovirale middelen voor gebruik in combinatie met efavirenz moet rekening worden gehouden met de mogelijkheid van virale kruisresistentie.
Gelijktijdige toediening met gerelateerde producten
Gelijktijdige toediening van SUSTIVA met ATRIPLA (efavirenz 600 mg/emtricitabine 200 mg/tenofovirdisoproxilfumaraat 300 mg) wordt niet aanbevolen, tenzij dit nodig is voor dosisaanpassing (bijv. met rifampicine), aangezien efavirenz een van de actieve ingrediënten is.
Psychiatrische symptomen
Ernstige psychiatrische bijwerkingen zijn gemeld bij patiënten die met SUSTIVA werden behandeld. In gecontroleerde onderzoeken met 1008 patiënten die werden behandeld met regimes die SUSTIVA 600 mg bevatten gedurende gemiddeld 2,1 jaar en 635 patiënten die werden behandeld met controleregimes gedurende gemiddeld 1,5 jaar, was de frequentie (ongeacht de causaliteit) van specifieke ernstige psychiatrische voorvallen bij patiënten die SUSTIVA of controleregimes waren respectievelijk ernstige depressie (2,4%, 0,9%), zelfmoordgedachten (0,7%, 0,3%), niet-fatale zelfmoordpogingen (0,5%, 0), agressief gedrag (0,4%, 0,5%), paranoïde reacties (0,4 %, 0,3%), en manische reacties (0,2%, 0,3%). Wanneer psychiatrische symptomen die vergelijkbaar zijn met de hierboven vermelde werden gecombineerd en geëvalueerd als een groep in een multifactoriële analyse van gegevens uit onderzoek 006, ging behandeling met efavirenz gepaard met een toename van het optreden van deze geselecteerde psychiatrische symptomen. Andere factoren die verband houden met een toename van het optreden van deze psychiatrische symptomen waren een voorgeschiedenis van het gebruik van injectiemedicatie, een psychiatrische voorgeschiedenis en het ontvangen van psychiatrische medicatie bij binnenkomst in het onderzoek; vergelijkbare associaties werden waargenomen in zowel de SUSTIVA- als de controlegroep. In onderzoek 006 traden tijdens het onderzoek nieuwe ernstige psychiatrische symptomen op bij zowel de met SUSTIVA behandelde als de controlebehandelde patiënten. Eén procent van de met SUSTIVA behandelde patiënten stopte of onderbrak de behandeling vanwege een of meer van deze geselecteerde psychiatrische symptomen. Er zijn ook incidentele postmarketingmeldingen geweest van overlijden door zelfmoord, wanen en psychose-achtig gedrag, hoewel uit deze meldingen geen oorzakelijk verband met het gebruik van SUSTIVA kan worden vastgesteld. Postmarketinggevallen van catatonie zijn ook gemeld en kunnen in verband worden gebracht met een verhoogde blootstelling aan efavirenz. Patiënten met ernstige psychiatrische bijwerkingen moeten onmiddellijk medisch worden onderzocht om de mogelijkheid te beoordelen dat de symptomen verband kunnen houden met het gebruik van SUSTIVA, en zo ja, om te bepalen of de risico's van voortzetting van de therapie opwegen tegen de voordelen. [zien ONGEWENSTE REACTIES .]
Zenuwstelselsymptomen
Drieënvijftig procent (531/1008) van de patiënten die SUSTIVA 600 mg kregen in gecontroleerde onderzoeken meldde symptomen van het centrale zenuwstelsel (elke graad, ongeacht de causaliteit) vergeleken met 25% (156/635) van de patiënten die controleregimes kregen [zie ONGEWENSTE REACTIES ]. Deze symptomen omvatten, maar waren niet beperkt tot, duizeligheid (28,1% van de 1008 patiënten), slapeloosheid (16,3%), verminderde concentratie (8,3%), slaperigheid (7,0%), abnormale dromen (6,2%) en hallucinaties (1,2 %). Deze symptomen waren ernstig bij 2,0% van de patiënten; en 2,1% van de patiënten stopte als gevolg van de behandeling. Deze symptomen beginnen gewoonlijk tijdens de eerste of tweede dag van de behandeling en verdwijnen over het algemeen na de eerste 2-4 weken van de behandeling. Na 4 weken therapie varieerde de prevalentie van symptomen van het zenuwstelsel van ten minste matige ernst van 5% tot 9% bij patiënten die werden behandeld met regimes die SUSTIVA bevatten en van 3% tot 5% bij patiënten die werden behandeld met een controleregime. Patiënten moeten worden geïnformeerd dat deze veelvoorkomende symptomen waarschijnlijk zouden verbeteren bij voortzetting van de therapie en niet voorspellend waren voor het daaropvolgende optreden van de minder frequente psychiatrische symptomen [zie Psychiatrische symptomen ]. Dosering voor het slapengaan kan de verdraagbaarheid van deze symptomen van het zenuwstelsel verbeteren [zie: DOSERING EN ADMINISTRATIE ].
Analyse van langetermijngegevens uit onderzoek 006 (mediane follow-up 180 weken, 102 weken en 76 weken voor patiënten die werden behandeld met respectievelijk SUSTIVA + zidovudine + lamivudine, SUSTIVA + indinavir en indinavir + zidovudine + lamivudine) toonde aan dat Na 24 weken therapie was de incidentie van nieuw optredende symptomen van het zenuwstelsel bij patiënten behandeld met SUSTIVA over het algemeen vergelijkbaar met die in de indinavir-bevattende controle-arm.
Laat optredende neurotoxiciteit, waaronder ataxie en encefalopathie (verminderd bewustzijn, verwardheid, psychomotorische vertraging, psychose, delirium), kan maanden tot jaren na het begin van de behandeling met efavirenz optreden. Sommige gevallen van laat optredende neurotoxiciteit zijn opgetreden bij patiënten met genetische CYP2B6-polymorfismen die ondanks de standaarddosering van SUSTIVA gepaard gaan met verhoogde efavirenz-spiegels. Patiënten die tekenen en symptomen van ernstige neurologische bijwerkingen vertonen, moeten onmiddellijk worden geëvalueerd om de mogelijkheid te beoordelen dat deze voorvallen verband kunnen houden met het gebruik van efavirenz en of stopzetting van SUSTIVA 600 mg gerechtvaardigd is.
Patiënten die SUSTIVA 600 mg krijgen, moeten worden gewaarschuwd voor de mogelijkheid van additieve effecten op het centrale zenuwstelsel wanneer SUSTIVA 200 mg gelijktijdig wordt gebruikt met alcohol of psychoactieve geneesmiddelen.
Patiënten die symptomen van het centrale zenuwstelsel ervaren, zoals duizeligheid, verminderde concentratie en/of slaperigheid, dienen potentieel gevaarlijke taken zoals autorijden of machines bedienen te vermijden.
Embryo-foetale toxiciteit
Efavirenz kan schade aan de foetus veroorzaken wanneer het tijdens het eerste trimester aan een zwangere vrouw wordt toegediend. Adviseer vrouwen in de vruchtbare leeftijd die SUSTIVA 600 mg krijgen om zwangerschap te voorkomen. [zien Gebruik bij specifieke populaties .]
Uitslag
In gecontroleerde klinische onderzoeken kreeg 26% (266/1008) van de volwassen patiënten die werden behandeld met 600 mg SUSTIVA een nieuwe huiduitslag, vergeleken met 17% (111/635) van de patiënten die werden behandeld in de controlegroepen [zie ONGEWENSTE REACTIES ]. Huiduitslag geassocieerd met blaarvorming, vochtige desquamatie of ulceratie kwam voor bij 0,9% (9/1008) van de patiënten die met SUSTIVA werden behandeld. De incidentie van uitslag van graad 4 (bijv. erythema multiforme, Stevens-Johnson-syndroom) bij volwassen patiënten die in alle onderzoeken en uitgebreide toegang met SUSTIVA werden behandeld, was 0,1%. Huiduitslag is gewoonlijk milde tot matige maculopapuleuze huiderupties die optreden binnen de eerste 2 weken na aanvang van de behandeling met efavirenz (mediane tijd tot het optreden van huiduitslag bij volwassenen was 11 dagen) en, bij de meeste patiënten die de behandeling met efavirenz voortzetten, verdwijnt de huiduitslag binnen 1 maand (mediane duur, 16 dagen). Het stopzettingspercentage voor huiduitslag in klinische onderzoeken bij volwassenen was 1,7% (17/1008).
Huiduitslag werd gemeld bij 59 van de 182 pediatrische patiënten (32%) die werden behandeld met SUSTIVA (zie: ONGEWENSTE REACTIES ]. Twee pediatrische patiënten hadden uitslag van graad 3 (samenvloeiende uitslag met koorts, gegeneraliseerde uitslag) en vier patiënten hadden uitslag van graad 4 (erythema multiforme). De mediane tijd tot het optreden van huiduitslag bij pediatrische patiënten was 28 dagen (bereik 3-1642 dagen). Bij pediatrische patiënten dient profylaxe met geschikte antihistaminica te worden overwogen voordat de behandeling met SUSTIVA wordt gestart.
SUSTIVA 600 mg kan over het algemeen opnieuw worden gestart bij patiënten die de behandeling onderbreken vanwege huiduitslag. SUSTIVA 200 mg moet worden gestaakt bij patiënten die ernstige huiduitslag ontwikkelen die gepaard gaat met blaarvorming, afschilfering, slijmvliesaantasting of koorts. Geschikte antihistaminica en/of corticosteroïden kunnen de verdraagbaarheid verbeteren en het verdwijnen van huiduitslag versnellen. Voor patiënten die een levensbedreigende huidreactie hebben gehad (bijv. Stevens-Johnson-syndroom), moet alternatieve therapie worden overwogen [zie CONTRA-INDICATIES ].
Hepatotoxiciteit
Postmarketinggevallen van hepatitis, waaronder fulminante hepatitis die zich ontwikkelt tot leverfalen waarvoor transplantatie nodig is of de dood tot gevolg heeft, zijn gemeld bij patiënten die met SUSTIVA werden behandeld. In rapporten zijn patiënten opgenomen met een onderliggende leverziekte, waaronder co-infectie met hepatitis B of C, en patiënten zonder reeds bestaande leverziekte of andere identificeerbare risicofactoren.
SUSTIVA 600 mg wordt niet aanbevolen voor patiënten met een matige of ernstige leverfunctiestoornis. Zorgvuldige controle wordt aanbevolen bij patiënten met een lichte leverfunctiestoornis die SUSTIVA krijgen. [zien ONGEWENSTE REACTIES en Gebruik bij specifieke populaties ].
Controle van leverenzymen voor en tijdens de behandeling wordt aanbevolen voor alle patiënten [zie: DOSERING EN ADMINISTRATIE ].
Overweeg om te stoppen met SUSTIVA 600 mg bij patiënten met aanhoudende verhogingen van serumtransaminasen tot meer dan vijf keer de bovengrens van het normale bereik.Stop met SUSTIVA 200 mg als verhoging van serumtransaminasen gepaard gaat met klinische tekenen of symptomen van hepatitis of leverdecompensatie.
stuiptrekkingen
Er zijn convulsies waargenomen bij volwassen en pediatrische patiënten die efavirenz kregen, meestal in aanwezigheid van een bekende medische voorgeschiedenis van epileptische aanvallen [zie Niet-klinische toxicologie ]. Voorzichtigheid is geboden bij elke patiënt met een voorgeschiedenis van epileptische aanvallen. Patiënten die gelijktijdig anticonvulsiva krijgen die voornamelijk door de lever worden gemetaboliseerd, zoals fenytoïne en fenobarbital, kunnen periodieke controle van de plasmaspiegels nodig hebben [zie DRUG-INTERACTIES ].
Lipideverhogingen
Behandeling met SUSTIVA heeft geleid tot verhogingen van de concentratie van totaal cholesterol en triglyceriden [zie: ONGEWENSTE REACTIES ]. Cholesterol- en triglyceridentests moeten worden uitgevoerd voordat de behandeling met SUSTIVA 200 mg wordt gestart en met periodieke tussenpozen tijdens de behandeling.
Immuunreconstitutiesyndroom
Immuunreconstitutiesyndroom is gemeld bij patiënten die werden behandeld met antiretrovirale combinatietherapie, waaronder SUSTIVA. Tijdens de beginfase van antiretrovirale combinatiebehandeling kunnen patiënten bij wie het immuunsysteem reageert een ontstekingsreactie ontwikkelen op indolente of resterende opportunistische infecties (zoals Mycobacterium avium-infectie, cytomegalovirus, Pneumocystis jiroveci-pneumonie [PCP] of tuberculose), wat verdere evaluatie noodzakelijk kan maken en behandeling.
Er is ook gemeld dat auto-immuunziekten (zoals de ziekte van Graves, polymyositis, Guillain-Barré-syndroom en auto-immuunhepatitis) optreden in de setting van immuunreconstitutie; de tijd tot aanvang is echter meer variabel en kan vele maanden na het begin van de behandeling optreden.
Herverdeling van vet
Herverdeling/ophoping van lichaamsvet, waaronder centrale obesitas, vergroting van het dorsocervicale vet (buffalo hump), perifere aderlating, gezichtsverlies, borstvergroting en "cushingoïde verschijning" zijn waargenomen bij patiënten die antiretrovirale therapie kregen. Het mechanisme en de langetermijngevolgen van deze gebeurtenissen zijn momenteel niet bekend. Een causaal verband is niet vastgesteld.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE en Gebruiksaanwijzing ).
Geneesmiddelinteracties
Op het etiket van de fles van het product staat een verklaring voor patiënten en zorgverleners: WAARSCHUWING: Lees meer over geneesmiddelen die NIET samen met SUSTIVA mogen worden ingenomen.
SUSTIVA kan een wisselwerking hebben met sommige geneesmiddelen; raad patiënten daarom aan hun arts te informeren over het gebruik van andere voorgeschreven of niet-voorgeschreven medicijnen.
Algemene informatie voor patiënten
Informeer patiënten dat SUSTIVA 200 mg geen remedie is voor hiv-1-infectie en dat patiënten ziekten kunnen blijven ervaren die verband houden met hiv-1-infectie, waaronder opportunistische infecties. Patiënten dienen tijdens het gebruik van SUSTIVA onder behandeling van een arts te blijven.
Adviseer patiënten om geen dingen te doen die de HIV-1-infectie naar anderen kunnen verspreiden.
- Deel of hergebruik naalden of andere injectieapparatuur niet.
- Deel geen persoonlijke spullen waar bloed of lichaamsvloeistoffen op kunnen zitten, zoals tandenborstels en scheermesjes.
- Heb geen enkele vorm van seks zonder bescherming. Beoefen altijd veiliger seks door een condoom van latex of polyurethaan te gebruiken om de kans op seksueel contact met sperma, vaginale afscheidingen of bloed te verkleinen.
- Geef geen borstvoeding. Moeders met hiv-1 mogen geen borstvoeding geven omdat hiv-1 via de moedermelk aan de baby kan worden doorgegeven.
Doseringsinstructies:
Adviseer patiënten om SUSTIVA elke dag in te nemen zoals voorgeschreven. Als een patiënt vergeet SUSTIVA in te nemen, vertel de patiënt dan de gemiste dosis meteen in te nemen, tenzij het bijna tijd is voor de volgende dosis. Adviseer de patiënt om geen 2 doses tegelijk in te nemen en de volgende dosis op het reguliere geplande tijdstip in te nemen. Adviseer de patiënt om een zorgverlener te vragen of hij/zij hulp nodig heeft bij het plannen van de beste tijden om zijn/haar geneesmiddel in te nemen.
SUSTIVA 200 mg moet altijd worden gebruikt in combinatie met andere antiretrovirale geneesmiddelen. Adviseer patiënten om SUSTIVA 600 mg op een lege maag in te nemen, bij voorkeur voor het slapengaan. Inname van SUSTIVA met voedsel verhoogt de efavirenz-concentraties en kan de frequentie van bijwerkingen verhogen. Dosering voor het slapengaan kan de verdraagbaarheid van symptomen van het zenuwstelsel verbeteren [zie DOSERING EN ADMINISTRATIE en ONGEWENSTE REACTIES ]. Zorgverleners moeten ouders of verzorgers helpen bij het bepalen van het beste SUSTIVA-doseringsschema voor zuigelingen en jonge kinderen.
Voor volwassen en pediatrische patiënten die geen capsules of tabletten kunnen doorslikken, moeten patiënten of hun verzorgers worden geadviseerd om de instructies voor het toedienen van de inhoud van de capsule in een kleine hoeveelheid voedsel of zuigelingenvoeding te lezen en zorgvuldig op te volgen [zie DOSERING EN ADMINISTRATIE en door de FDA goedgekeurde patiëntetikettering ( PATIËNT INFORMATIE en GEBRUIKSAANWIJZING )]. Patiënten moeten hun zorgverlener of apotheker bellen als ze vragen hebben.
Zenuwstelselsymptomen
Informeer patiënten dat symptomen van het centrale zenuwstelsel (NSS), waaronder duizeligheid, slapeloosheid, verminderde concentratie, slaperigheid en abnormale dromen vaak worden gemeld tijdens de eerste weken van de behandeling met SUSTIVA [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Dosering voor het slapengaan kan de verdraagbaarheid van deze symptomen verbeteren, die waarschijnlijk zullen verbeteren bij voortzetting van de therapie. Waarschuw patiënten voor de mogelijkheid van additieve effecten wanneer SUSTIVA gelijktijdig wordt gebruikt met alcohol of psychoactieve geneesmiddelen. Instrueer patiënten dat als ze NSS ervaren, ze potentieel gevaarlijke taken zoals autorijden of het bedienen van machines moeten vermijden.
Informeer patiënten dat er een risico bestaat op het ontwikkelen van laat optredende neurotoxiciteit, waaronder ataxie en encefalopathie, die maanden tot jaren na het begin van de SUSTIVA-therapie kunnen optreden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Psychiatrische symptomen
Informeer patiënten dat ernstige psychiatrische symptomen, waaronder ernstige depressie, zelfmoordpogingen, agressief gedrag, wanen, paranoia, psychose-achtige symptomen en katatonie zijn gemeld bij patiënten die SUSTIVA kregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Als ze ernstige psychiatrische bijwerkingen ervaren, moeten ze onmiddellijk medische hulp zoeken. Adviseer patiënten om hun arts te informeren over een voorgeschiedenis van psychische aandoeningen of middelenmisbruik.
Uitslag
Informeer patiënten dat huiduitslag een vaak voorkomende bijwerking is [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Huiduitslag verdwijnt meestal zonder enige verandering in de behandeling. Aangezien huiduitslag echter ernstig kan zijn, dient u patiënten te adviseren onmiddellijk contact op te nemen met hun arts als huiduitslag optreedt.
Hepatotoxiciteit
Informeer patiënten om te letten op vroege waarschuwingssignalen van leverontsteking of leverfalen, zoals vermoeidheid, zwakte, gebrek aan eetlust, misselijkheid en braken, evenals latere tekenen zoals geelzucht, verwardheid, zwelling van de buik en verkleurde ontlasting, en om hun arts te raadplegen. zorgverlener onverwijld als dergelijke symptomen optreden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Vrouwtjes met reproductief potentieel
Adviseer vrouwen in de vruchtbare leeftijd om effectieve anticonceptie en een barrièremethode te gebruiken tijdens de behandeling met SUSTIVA 600 mg en gedurende 12 weken na het stoppen met SUSTIVA. Adviseer patiënten om contact op te nemen met hun zorgverlener als ze van plan zijn zwanger te worden, zwanger worden of als zwangerschap wordt vermoed tijdens de behandeling met SUSTIVA [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Zwangerschapsblootstellingsregister
Adviseer patiënten dat er een zwangerschapsblootstellingsregister is dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan SUSTIVA zijn blootgesteld [zie Gebruik bij specifieke populaties ].
Herverdeling van vet
Informeer patiënten dat herverdeling of accumulatie van lichaamsvet kan optreden bij patiënten die antiretrovirale therapie krijgen en dat de oorzaak en langetermijneffecten van deze aandoeningen niet bekend zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
SUSTIVA is een geregistreerd handelsmerk van Bristol-Myers Squibb Pharma Company. ATRIPLA is een handelsmerk van Bristol-Myers Squibb & Gilead Sciences, LLC.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Met efavirenz zijn langdurige carcinogeniteitsonderzoeken bij muizen en ratten uitgevoerd. Muizen kregen gedurende 2 jaar 0, 25, 75, 150 of 300 mg/kg/dag toegediend. De incidentie van hepatocellulaire adenomen en carcinomen en pulmonale alveolaire/bronchiolaire adenomen was hoger dan de achtergrond bij vrouwen. Bij mannen werd geen toename van de tumorincidentie boven de achtergrond waargenomen. Er werd geen NOAEL bij vrouwen vastgesteld voor dit onderzoek omdat bij alle doses tumorbevindingen optraden. De AUC bij de NOAEL (150 mg/kg) bij mannen was ongeveer 0,9 keer die bij mensen bij de aanbevolen klinische dosis. In het onderzoek bij ratten werd geen toename van de tumorincidentie waargenomen bij doses tot 100 mg/kg/dag, waarvoor de AUC's 0,1 (mannetjes) of 0,2 (vrouwtjes) maal die bij mensen waren bij de aanbevolen klinische dosis.
Mutagenese
Efavirenz testte negatief in een reeks in vitro en in vivo genotoxiciteitstests. Deze omvatten bacteriële mutatietesten in S. typhimurium en E. coli, zoogdiermutatietesten in ovariumcellen van Chinese hamsters, chromosoomafwijkingen in lymfocyten van menselijk perifeer bloed of ovariumcellen van Chinese hamsters, en een in vivo micronucleustest in beenmerg bij muizen.
Aantasting van de vruchtbaarheid
Efavirenz had geen invloed op de paring of vruchtbaarheid van mannelijke of vrouwelijke ratten en had geen invloed op het sperma van behandelde mannelijke ratten. De reproductieprestaties van nakomelingen van vrouwtjesratten die efavirenz kregen, werden niet beïnvloed. De AUC's bij de NOAEL-waarden bij mannelijke (200 mg/kg) en vrouwelijke (100 mg/kg) ratten waren ongeveer ≤ 0,15 keer die bij mensen bij de aanbevolen klinische dosis.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapsblootstellingsregister
Er is een register voor blootstelling aan zwangerschap dat de zwangerschapsuitkomsten controleert bij vrouwen die tijdens de zwangerschap aan SUSTIVA 600 mg zijn blootgesteld. Artsen worden aangemoedigd om patiënten te registreren door de Antiretroviral Pregnancy Registry te bellen op 1-800-258-4263.
Risico Samenvatting
Er zijn retrospectieve casusrapporten van neurale buisdefecten bij zuigelingen van wie de moeder in het eerste trimester van de zwangerschap werd blootgesteld aan behandelingen die efavirenz bevatten. Toekomstige zwangerschapsgegevens uit het antiretrovirale zwangerschapsregister zijn niet voldoende om dit risico adequaat te beoordelen. Beschikbare gegevens van de Antiretroviral Pregnancy Registry laten geen verschil zien in het risico op algemene ernstige geboorteafwijkingen in vergelijking met het achtergrondpercentage voor ernstige geboorteafwijkingen van 2,7% in de Amerikaanse referentiepopulatie van het Metropolitan Atlanta Congenital Defects Program (MACDP). Hoewel er geen oorzakelijk verband is vastgesteld tussen blootstelling aan efavirenz in het eerste trimester en neuralebuisdefecten, zijn vergelijkbare misvormingen waargenomen in onderzoeken bij apen bij doses die vergelijkbaar zijn met de dosis voor mensen. Bovendien trad foetale en embryonale toxiciteit op bij ratten, bij een dosis die tien keer lager was dan de menselijke blootstelling bij de aanbevolen klinische dosis. Vanwege het mogelijke risico op neurale buisdefecten mag efavirenz niet worden gebruikt in het eerste trimester van de zwangerschap. Adviseer zwangere vrouwen over het mogelijke risico voor een foetus.
Gegevens
Menselijke gegevens
Er zijn retrospectieve postmarketingmeldingen van bevindingen die overeenkomen met neurale buisdefecten, waaronder meningomyelocele, allemaal bij zuigelingen van moeders die in het eerste trimester waren blootgesteld aan efavirenz-bevattende regimes.
Op basis van prospectieve rapporten van het Antiretroviral Pregnancy Registry (APR) van ongeveer 1000 levendgeborenen na blootstelling aan efavirenz-bevattende regimes (inclusief meer dan 800 levendgeborenen blootgesteld in het eerste trimester), was er geen verschil tussen efavirenz en algemene geboorteafwijkingen vergeleken met de achtergrond geboorteafwijkingspercentage van 2,7% in de Amerikaanse referentiepopulatie van het Metropolitan Atlanta Congenital Defects Program. Vanaf het tussentijdse APR-rapport van december 2014 was de prevalentie van geboorteafwijkingen na blootstelling in het eerste trimester 2,3% (95%-BI: 1,4%-3,6%). Een van deze prospectief gemelde defecten bij blootstelling in het eerste trimester was een neuraalbuisdefect. Een enkel geval van anoftalmie met blootstelling aan efavirenz in het eerste trimester is ook prospectief gemeld. Dit geval omvatte ook ernstige schuine gezichtsspleten en vruchtwaterbanden, waarvan bekend is dat ze verband houden met anoftalmie.
Dierlijke gegevens
De effecten van efavirenz op de embryo-foetale ontwikkeling zijn onderzocht bij drie niet-klinische soorten (cynomolgus-apen, ratten en konijnen). Bij apen werd efavirenz 60 mg/kg/dag toegediend aan drachtige vrouwtjes tijdens de dracht (draagtijd 20 tot en met 150). De maternale systemische geneesmiddelblootstelling (AUC) was 1,3 maal de blootstelling bij mensen bij de aanbevolen klinische dosis (600 mg/dag), met foetale navelstrengveneuze geneesmiddelconcentraties van ongeveer 0,7 maal de maternale waarden. Drie van de 20 foetussen/baby's hadden een of meer misvormingen; er waren geen misvormde foetussen of baby's van met placebo behandelde moeders. De misvormingen die bij deze drie apenfoetussen voorkwamen, omvatten anencefalie en unilaterale anoftalmie bij één foetus, microftalmie bij een tweede en gespleten gehemelte bij de derde. Er was geen NOAEL (no observeerable adverse effect level) vastgesteld voor deze studie omdat er slechts één dosering werd geëvalueerd. Bij ratten werd efavirenz toegediend tijdens de organogenese (draagtijd 7 tot 18 dagen) of vanaf dag 7 tot en met lactatiedag 21 met 50, 100 of 200 mg/kg/dag. Toediening van 200 mg/kg/dag bij ratten ging gepaard met een toename van de incidentie van vroege resorpties; en doses van 100 mg/kg/dag en hoger waren geassocieerd met vroege neonatale mortaliteit. De AUC bij de NOAEL (50 mg/kg/dag) in dit onderzoek bij ratten was 0,1 keer zo hoog als bij mensen bij de aanbevolen klinische dosis. De geneesmiddelconcentraties in de melk op lactatiedag 10 waren ongeveer 8 keer hoger dan die in maternaal plasma. Bij drachtige konijnen was efavirenz embryo-letaal noch teratogeen wanneer het werd toegediend in doses van 25, 50 en 75 mg/kg/dag gedurende de periode van organogenese (draagtijd 6 tot 18). De AUC bij de NOAEL (75 mg/kg/dag) bij konijnen was 0,4 keer die bij mensen bij de aanbevolen klinische dosis.
Borstvoeding
Risico Samenvatting
De Centers for Disease Control and Prevention bevelen aan dat met HIV geïnfecteerde moeders hun baby's geen borstvoeding geven om het risico van postnatale overdracht van HIV te vermijden. Vanwege de mogelijkheid van overdracht van hiv bij zuigelingen die borstvoeding krijgen, dient u vrouwen te adviseren geen borstvoeding te geven.
Vrouwtjes en mannetjes met reproductief potentieel
Vanwege mogelijke teratogene effecten moet zwangerschap worden vermeden bij vrouwen die SUSTIVA krijgen. [zien Zwangerschap .]
Zwangerschapstesten
Vrouwen in de vruchtbare leeftijd moeten een zwangerschapstest ondergaan voordat met SUSTIVA wordt gestart.
anticonceptie
Vrouwen in de vruchtbare leeftijd dienen effectieve anticonceptie te gebruiken tijdens de behandeling met SUSTIVA 200 mg en gedurende 12 weken na het stoppen met SUSTIVA 200 mg vanwege de lange halfwaardetijd van efavirenz. Barrière-anticonceptie moet altijd worden gebruikt in combinatie met andere anticonceptiemethoden. Hormonale methoden die progesteron bevatten, kunnen een verminderde effectiviteit hebben [zie DRUG-INTERACTIES ].
Pediatrisch gebruik
De veiligheid, het farmacokinetische profiel en de virologische en immunologische respons van SUSTIVA 600 mg werden geëvalueerd bij antiretroviraal-naïeve en - ervaren met hiv-1 geïnfecteerde pediatrische patiënten van 3 maanden tot 21 jaar in drie open-label klinische onderzoeken [zie ONGEWENSTE REACTIES , KLINISCHE FARMACOLOGIE , en Klinische studies ]. Het type en de frequentie van bijwerkingen in deze onderzoeken waren over het algemeen vergelijkbaar met die van volwassen patiënten, met uitzondering van een hogere frequentie van huiduitslag, waaronder een hogere frequentie van graad 3 of 4 huiduitslag, bij pediatrische patiënten in vergelijking met volwassenen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Het gebruik van SUSTIVA bij patiënten jonger dan 3 maanden OF met een lichaamsgewicht van minder dan 3,5 kg wordt niet aanbevolen omdat de veiligheid, farmacokinetiek en antivirale activiteit van SUSTIVA 600 mg niet zijn beoordeeld in deze leeftijdsgroep en er een risico bestaat op het ontwikkelen van hiv-resistentie als SUSTIVA ondergedoseerd is. zien DOSERING EN ADMINISTRATIE voor doseringsaanbevelingen voor pediatrische patiënten.
Geriatrisch gebruik
Klinische onderzoeken met SUSTIVA 200 mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, gezien de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere therapie.
Leverfunctiestoornis
SUSTIVA wordt niet aanbevolen voor patiënten met een matige of ernstige leverfunctiestoornis, omdat er onvoldoende gegevens zijn om te bepalen of dosisaanpassing noodzakelijk is. Patiënten met een lichte leverfunctiestoornis kunnen met efavirenz worden behandeld zonder enige dosisaanpassing. Vanwege het uitgebreide door cytochroom P450 gemedieerde metabolisme van efavirenz en de beperkte klinische ervaring bij patiënten met een leverfunctiestoornis, is voorzichtigheid geboden bij het toedienen van SUSTIVA aan deze patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Sommige patiënten die per ongeluk tweemaal daags 600 mg innamen, hebben verhoogde symptomen van het zenuwstelsel gemeld. Eén patiënt ervoer onwillekeurige spiersamentrekkingen.
Behandeling van overdosering met SUSTIVA 200 mg dient te bestaan uit algemene ondersteunende maatregelen, waaronder controle van de vitale functies en observatie van de klinische status van de patiënt. Toediening van actieve kool kan worden gebruikt om de verwijdering van niet-geabsorbeerd geneesmiddel te vergemakkelijken. Er is geen specifiek antidotum voor overdosering met SUSTIVA. Aangezien efavirenz sterk eiwitgebonden is, is het onwaarschijnlijk dat dialyse het geneesmiddel significant uit het bloed verwijdert.
CONTRA-INDICATIES
- SUSTIVA is gecontra-indiceerd bij patiënten met eerder aangetoonde klinisch significante overgevoeligheid (bijv. Stevens-Johnson-syndroom, erythema multiforme of toxische huiduitslag) voor een van de componenten van dit product.
- Gelijktijdige toediening van efavirenz met elbasvir en grazoprevir is gecontra-indiceerd [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Efavirenz is een antiviraal middel [zie Microbiologie ].
farmacodynamiek
Cardiale elektrofysiologie
Het effect van SUSTIVA 600 mg op het QTc-interval werd geëvalueerd in een open-label, positieve en placebogecontroleerde, vaste single-sequentie 3-periode, 3-behandelingen cross-over QT-onderzoek bij 58 gezonde proefpersonen verrijkt met CYP2B6-polymorfismen. De gemiddelde Cmax van efavirenz bij proefpersonen met het CYP2B6 *6/*6-genotype na toediening van een dagelijkse dosis van 600 mg gedurende 14 dagen was 2,25 maal de gemiddelde Cmax die werd waargenomen bij proefpersonen met het CYP2B6 *1/*1-genotype. Er werd een positieve relatie waargenomen tussen de efavirenz-concentratie en QTc-verlenging. Op basis van de concentratie-QTc-relatie zijn de gemiddelde QTc-verlenging en de bovengrens van het 90%-betrouwbaarheidsinterval 8,7 ms en 11,3 ms bij proefpersonen met het CYP2B6*6/*6-genotype na toediening van een dagelijkse dosis van 600 mg gedurende 14 dagen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Farmacokinetiek
Absorptie
Piekplasmaconcentraties van efavirenz van 1,6-9,1 M werden bereikt binnen 5 uur na enkelvoudige orale doses van 100 mg tot 1600 mg toegediend aan niet-geïnfecteerde vrijwilligers. Dosisgerelateerde verhogingen van Cmax en AUC werden gezien voor doses tot 1600 mg; de verhogingen waren minder dan proportioneel, wat wijst op verminderde absorptie bij hogere doses.
Bij met HIV-1 geïnfecteerde patiënten bij steady state waren de gemiddelde Cmax, de gemiddelde Cmin en de gemiddelde AUC dosisproportioneel na dagelijkse doses van 200 mg, 400 mg en 600 mg. Tijd tot piekplasmaconcentraties waren ongeveer 3-5 uur en steady-state plasmaconcentraties werden bereikt in 6-10 dagen. Bij 35 patiënten die eenmaal daags 600 mg SUSTIVA kregen, was de steady-state Cmax 12,9 ± 3,7 M (gemiddelde ± SD), de steady-state Cmin was 5,6 ± 3,2 M en de AUC was 184 ± 73 M•u.
Effect van voedsel op orale absorptie:
Capsules
Toediening van een enkelvoudige dosis van 600 mg efavirenz-capsules met een vetrijke/calorische maaltijd (894 kcal, 54 g vet, 54% calorieën uit vet) of een vetarme/normaal-calorische maaltijd (440 kcal, 2 g vet, 4% calorieën uit vet) werd geassocieerd met een gemiddelde toename van respectievelijk 22% en 17% van de AUC∞ van efavirenz en een gemiddelde toename van respectievelijk 39% en 51% van de Cmax van efavirenz, vergeleken met de blootstellingen die werden bereikt bij toediening in nuchtere toestand . [zien DOSERING EN ADMINISTRATIE en PATIËNT INFORMATIE .]
Tabletten

Toediening van een enkele tablet van 600 mg efavirenz met een vetrijke/calorische maaltijd (ongeveer 1000 kcal, 500-600 kcal uit vet) ging gepaard met een stijging van 28% van de gemiddelde AUC∞ van efavirenz en een stijging van 79% van de gemiddelde Cmax van efavirenz in verhouding tot de blootstellingen bereikt onder nuchtere omstandigheden. [zien DOSERING EN ADMINISTRATIE en PATIËNT INFORMATIE .]
Biologische beschikbaarheid van capsule-inhoud gemengd met voedselvehikels
Bij gezonde volwassen proefpersonen voldeed de AUC van efavirenz, indien toegediend als de inhoud van drie capsules van 200 mg gemengd met 2 theelepels van bepaalde voedseldragers (appelmoes, druivengelei of yoghurt, of zuigelingenvoeding), aan de bio-equivalentiecriteria voor de AUC van de toegediende intacte capsuleformulering die werd toegediend. onder nuchtere omstandigheden.
Verdeling
Efavirenz is sterk gebonden (ongeveer 99,5-99,75%) aan humane plasma-eiwitten, voornamelijk albumine. Bij met hiv-1 geïnfecteerde patiënten (n=9) die SUSTIVA 200 tot 600 mg eenmaal daags gedurende ten minste één maand kregen, varieerden de concentraties van de cerebrospinale vloeistof van 0,26 tot 1,19% (gemiddeld 0,69%) van de overeenkomstige plasmaconcentratie. Dit aandeel is ongeveer 3 keer hoger dan de niet-eiwitgebonden (vrije) fractie van efavirenz in plasma.
Metabolisme
Studies bij mensen en in vitro studies met humane levermicrosomen hebben aangetoond dat efavirenz voornamelijk wordt gemetaboliseerd door het cytochroom P450-systeem tot gehydroxyleerde metabolieten met daaropvolgende glucuronidering van deze gehydroxyleerde metabolieten. Deze metabolieten zijn in wezen inactief tegen HIV-1. De in-vitro-onderzoeken suggereren dat CYP3A en CYP2B6 de belangrijkste iso-enzymen zijn die verantwoordelijk zijn voor het metabolisme van efavirenz.
Van efavirenz is aangetoond dat het CYP-enzymen induceert, wat resulteert in de inductie van zijn eigen metabolisme. Meerdere doses van 200-400 mg per dag gedurende 10 dagen resulteerden in een lager dan voorspelde mate van accumulatie (22-42% lager) en een kortere terminale halfwaardetijd van 40-55 uur (enkele dosis halfwaardetijd 52-76 uur ).
Eliminatie
Efavirenz heeft een terminale halfwaardetijd van 52-76 uur na enkelvoudige doses en 40-55 uur na meervoudige doses. Een één maand durende massabalans-/excretiestudie werd uitgevoerd met 400 mg per dag met een C-gelabelde dosis toegediend op dag 8. Ongeveer 14-34% van het radiolabel werd teruggevonden in de urine en 16-61% werd teruggevonden in de feces . Bijna alle uitscheiding via de urine van het radioactief gelabelde geneesmiddel was in de vorm van metabolieten. Efavirenz was verantwoordelijk voor het grootste deel van de totale radioactiviteit gemeten in feces.
Speciale populaties
pediatrisch
De farmacokinetische parameters voor efavirenz bij steady-state bij pediatrische patiënten werden voorspeld door een populatiefarmacokinetisch model en worden in tabel 6 samengevat op basis van gewichtsbereiken die overeenkomen met de aanbevolen doses.
Geslacht en ras
De farmacokinetiek van efavirenz bij patiënten lijkt vergelijkbaar te zijn tussen mannen en vrouwen en tussen de onderzochte raciale groepen.
Nierfunctiestoornis
De farmacokinetiek van efavirenz is niet onderzocht bij patiënten met nierinsufficiëntie; minder dan 1% van efavirenz wordt echter onveranderd in de urine uitgescheiden, dus de invloed van een nierfunctiestoornis op de eliminatie van efavirenz zou minimaal moeten zijn.
Leverfunctiestoornis
Een onderzoek met meerdere doses liet geen significant effect zien op de farmacokinetiek van efavirenz bij patiënten met een lichte leverfunctiestoornis (Child-Pugh-klasse A) in vergelijking met controlepersonen. Er waren onvoldoende gegevens om te bepalen of een matige of ernstige leverfunctiestoornis (Child-Pugh-klasse B of C) de farmacokinetiek van efavirenz beïnvloedt.
Geneesmiddelinteractiestudies
Van efavirenz is in vivo aangetoond dat het leverenzyminductie veroorzaakt, waardoor de biotransformatie van sommige geneesmiddelen die door CYP3A en CYP2B6 worden gemetaboliseerd, toeneemt. In-vitro-onderzoeken hebben aangetoond dat efavirenz de CYP-isozymen 2C9 en 2C19 remde met Ki-waarden (8,5-17 M) binnen het bereik van de waargenomen efavirenz-plasmaconcentraties. In in-vitro-onderzoeken remde efavirenz CYP2E1 niet en remde het CYP2D6 en CYP1A2 (Ki-waarden 82-160 M) alleen bij concentraties die ver boven de klinisch bereikte concentraties lagen. Gelijktijdige toediening van efavirenz met geneesmiddelen die voornamelijk worden gemetaboliseerd door CYP2C9-, CYP2C19-, CYP3A- of CYP2B6-iso-zymen kan leiden tot veranderde plasmaconcentraties van het gelijktijdig toegediende geneesmiddel. Van geneesmiddelen die CYP3A- en CYP2B6-activiteit induceren, wordt verwacht dat ze de klaring van efavirenz verhogen, wat resulteert in verlaagde plasmaconcentraties.
Er zijn geneesmiddelinteractieonderzoeken uitgevoerd met efavirenz en andere geneesmiddelen die waarschijnlijk gelijktijdig worden toegediend of geneesmiddelen die vaak worden gebruikt als probes voor farmacokinetische interactie. De effecten van gelijktijdige toediening van efavirenz op de Cmax, AUC en Cmin zijn samengevat in Tabel 7 (effect van efavirenz op andere geneesmiddelen) en Tabel 8 (effect van andere geneesmiddelen op efavirenz). Zie voor informatie over klinische aanbevelingen: DRUG-INTERACTIES .
Microbiologie
Werkingsmechanisme
Efavirenz is een NNRTI van hiv-1. De activiteit van efavirenz wordt voornamelijk gemedieerd door niet-competitieve remming van HIV-1 reverse transcriptase. HIV-2 reverse transcriptase en humane cellulaire DNA-polymerasen α, β, γ en worden niet geremd door efavirenz.
Antivirale activiteit in celcultuur
De concentratie van efavirenz die de replicatie van wild-type laboratoriumstammen en klinische isolaten in celcultuur remt met 90- 95% (EC90-95) varieerde van 1,7 tot 25 nM in lymfoblastoïde cellijnen, perifere mononucleaire bloedcellen (PBMC's) en macrofaag /monocytculturen. Efavirenz vertoonde antivirale activiteit tegen clade B en de meeste niet-clade B isolaten (subtypes A, AE, AG, C, D, F, G, J, N), maar had een verminderde antivirale activiteit tegen groep O-virussen. Efavirenz vertoonde additieve antivirale activiteit zonder cytotoxiciteit tegen HIV-1 in celkweken in combinatie met de NNRTI's delavirdine en nevirapine, NRTI's (abacavir, didanosine, emtricitabine, lamivudine, stavudine, tenofovir, zalcitabine, zidovudine), PI's (amprenavir, nelfinavir, ritonavir, saquinavir) en de fusieremmer enfuvirtide. Efavirenz toonde additieve tot antagonistische antivirale activiteit in celkweek met atazanavir. Efavirenz was niet antagonistisch voor adefovir, gebruikt voor de behandeling van hepatitis B-virusinfectie, of ribavirine, gebruikt in combinatie met interferon voor de behandeling van hepatitis C-virusinfectie.
Weerstand
In celkweek
In celkweek kwamen hiv-1-isolaten met verminderde gevoeligheid voor efavirenz (>380-voudige toename van EC90-waarde) snel op in aanwezigheid van het geneesmiddel. Genotypische karakterisering van deze virussen identificeerde enkele aminozuursubstituties L100I of V179D, dubbele substituties L100I/V108I en drievoudige substituties L100I/V179D/Y181C in reverse transcriptase.
Klinische studies
Er zijn klinische isolaten verkregen met verminderde gevoeligheid in celcultuur voor efavirenz. Een of meer substituties op aminozuurposities 98, 100, 101, 103, 106, 108, 188, 190, 225 en 227 in reverse transcriptase werden waargenomen bij patiënten bij wie de behandeling met efavirenz in combinatie met indinavir of met zidovudine plus lamivudine faalde. De K103N-substitutie werd het vaakst waargenomen. Lange-termijn surveillance van resistentie (gemiddeld 52 weken, bereik 4-106 weken) analyseerde 28 overeenkomende baseline isolaten en isolaten van virologisch falen. Eenenzestig procent (17/28) van deze isolaten die faalden, had een verminderde gevoeligheid voor efavirenz in celkweken met een mediane verandering van 88-voudige in efavirenz-gevoeligheid (EC50-waarde) ten opzichte van de referentie. De meest voorkomende NNRTI-substitutie die zich bij deze isolaten van patiënten ontwikkelde, was K103N (54%). Andere NNRTI-substituties die zich ontwikkelden, waren onder meer L100I (7%), K101E/Q/R (14%), V108I (11%), G190S/T/A (7%), P225H (18%), en M230I/L (11 %).
Kruisweerstand
Kruisresistentie tussen NNRTI's is waargenomen. Klinische isolaten die eerder werden gekenmerkt als efavirenz-resistent waren ook fenotypisch resistent in celcultuur tegen delavirdine en nevirapine in vergelijking met baseline. Delavirdine- en/of nevirapine-resistente klinische virale isolaten met NNRTI-resistentie-geassocieerde substituties (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F227L of M230L) vertoonden verminderde gevoeligheid voor efavirenz in celcultuur. Meer dan 90% van de NRTI-resistente klinische isolaten die in celkweken werden getest, behielden de gevoeligheid voor efavirenz.
Dierlijke toxicologie
Niet-aanhoudende convulsies werden waargenomen bij 6 van de 20 apen die efavirenz kregen in doses die plasma-AUC-waarden opleverden die 4 tot 13 maal hoger waren dan die bij mensen die de aanbevolen dosis kregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Klinische studies
volwassenen
Studie 006 een gerandomiseerde, open-label studie, vergeleek SUSTIVA (600 mg eenmaal daags) + zidovudine (ZDV, 300 mg elke 12 uur) + lamivudine (LAM, 150 mg elke 12 uur) of SUSTIVA (600 mg eenmaal daags) + indinavir (IDV, 1000 mg elke 8 uur) met indinavir (800 mg elke 8 uur) + zidovudine (300 mg elke 12 uur) + lamivudine (150 mg elke 12 uur). Twaalfhonderd zesenzestig patiënten (gemiddelde leeftijd 36,5 jaar [bereik 18-81], 60% blank, 83% man) werden geïncludeerd. Alle patiënten waren efavirenz-, lamivudine-, NNRTI- en PI-naïef bij aanvang van de studie. De mediane baseline CD4+-celtelling was 320 cellen/mm3 en de mediane baseline hiv-1 RNA-spiegel was 4,8 log kopieën/ml. Behandelingsresultaten met standaardassay (assaylimiet 400 kopieën/ml) tot 48 en 168 weken worden weergegeven in Tabel 9. Plasma hiv-RNA-spiegels werden gekwantificeerd met standaard (assaylimiet 400 kopieën/ml) en ultragevoelig (assaylimiet 50 kopieën/ml) versies van de AMPLICOR HIV-1 MONITOR-assay. Tijdens het onderzoek werd versie 1.5 van de test in Europa geïntroduceerd om de detectie van niet-clade B-virus te verbeteren.
Voor patiënten die werden behandeld met SUSTIVA + zidovudine + lamivudine, SUSTIVA + indinavir of indinavir + zidovudine + lamivudine, was het percentage responders met hiv-1-RNA
ACTG 364 is een gerandomiseerde, dubbelblinde, placebogecontroleerde studie van 48 weken bij patiënten die eerder met NRTI waren behandeld en die twee eerdere ACTG-onderzoeken hadden voltooid. Honderdzesennegentig patiënten (gemiddelde leeftijd 41 jaar [bereik 18-76], 74% blank, 88% man) kregen NRTI's in combinatie met SUSTIVA (600 mg eenmaal daags) of nelfinavir (NFV, 750 mg driemaal daags ), of SUSTIVA (600 mg eenmaal daags) + nelfinavir op een gerandomiseerde, dubbelblinde manier. Het gemiddelde aantal CD4+-cellen bij aanvang was 389 cellen/mm3 en het gemiddelde hiv-1-RNA-niveau bij aanvang was 8130 kopieën/ml. Bij deelname aan de studie kregen alle patiënten een nieuw open-label NRTI-regime toegewezen, dat afhankelijk was van hun eerdere NRTI-behandelingservaring. Er was geen significant verschil in het gemiddelde aantal CD4+-cellen tussen de behandelingsgroepen; de totale gemiddelde toename was ongeveer 100 cellen na 48 weken bij patiënten die doorgingen met de onderzoeksregimes. De resultaten van de behandeling worden weergegeven in tabel 10. De plasma-hiv-RNA-spiegels werden gekwantificeerd met de AMPLICOR HIV-1 MONITOR-assay met een ondergrens van kwantificering van 500 kopieën/ml.
Een Kaplan-Meier-analyse van de tijd tot het falen van de behandeling gedurende 72 weken toont een langere duur van virologische onderdrukking (hiv-RNA
Pediatrische patiënten
Onderzoek AI266922 is een open-label onderzoek om de farmacokinetiek, veiligheid, verdraagbaarheid en antivirale activiteit van SUSTIVA 200 mg in combinatie met didanosine en emtricitabine te evalueren bij antiretrovirale-naïeve en -ervaren pediatrische patiënten. Zevenendertig patiënten in de leeftijd van 3 maanden tot 6 jaar (mediaan 0,7 jaar) werden behandeld met SUSTIVA. Bij baseline was het mediane plasma hiv-1-RNA 5,88 log kopieën/ml, het mediane aantal CD4+-cellen was 1144 cellen/mm3 en het mediane CD4+-percentage was 25%. De mediane duur van de studietherapie was 60 weken; 27% van de patiënten stopte vóór week 48. Bij gebruik van een ITT-analyse was het totale aandeel patiënten met hiv-RNA
Onderzoek PACTG 1021 was een open-label onderzoek om de farmacokinetiek, veiligheid, verdraagbaarheid en antivirale activiteit van SUSTIVA 200 mg in combinatie met didanosine en emtricitabine te evalueren bij pediatrische patiënten die nog geen antiretrovirale therapie hadden. Drieënveertig patiënten in de leeftijd van 3 maanden tot 21 jaar (mediaan 9,6 jaar) kregen SUSTIVA toegediend. Bij baseline was het mediane plasma hiv-1-RNA 4,8 log kopieën/ml, het mediane aantal CD4+-cellen was 367 cellen/mm3 en het mediane CD4+-percentage was 18%. De mediane duur van de studietherapie was 181 weken; 16% van de patiënten stopte vóór week 48. Bij gebruik van een ITT-analyse was het totale aandeel patiënten met hiv-RNA
Studie PACTG 382 was een open-label studie om de farmacokinetiek, veiligheid, verdraagbaarheid en antivirale activiteit van SUSTIVA in combinatie met nelfinavir en een NRTI te evalueren bij antiretrovirale-naïeve en NRTI-ervaren pediatrische patiënten. Honderdtwee patiënten in de leeftijd van 3 maanden tot 16 jaar (mediaan 5,7 jaar) werden behandeld met SUSTIVA. Zevenentachtig procent van de patiënten had eerder antiretrovirale therapie gekregen. Bij baseline was het mediane plasma hiv-1-RNA 4,57 log kopieën/ml, het mediane aantal CD4+-cellen was 755 cellen/mm3 en het mediane CD4+-percentage was 30%. De mediane duur van de studietherapie was 118 weken; 25% van de patiënten stopte vóór week 48. Bij gebruik van een ITT-analyse was het totale aandeel patiënten met hiv-RNA
PATIËNT INFORMATIE
SUSTIVA® (sus-TEE-vah) (efavirenz) capsules
SUSTIVA® (sus-TEE-vah) (efavirenz) tabletten
Belangrijk: Vraag uw arts of apotheker naar geneesmiddelen die niet samen met SUSTIVA mogen worden ingenomen. Voor meer informatie, zie de sectie "Wat moet ik mijn arts vertellen voordat ik SUSTIVA inneem?"
Lees deze patiënteninformatie voordat u begint met het innemen van SUSTIVA en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of behandeling.
Wat is SUSTIVA?
SUSTIVA 600 mg is een voorgeschreven geneesmiddel voor hiv-1 (humaan immunodeficiëntievirus type 1) dat samen met andere antiretrovirale geneesmiddelen wordt gebruikt voor de behandeling van hiv-1-infectie bij volwassenen en bij kinderen die minstens 3 maanden oud zijn en minstens 3,5 kg wegen. kg). HIV is het virus dat aids (Acquired Immune Deficiency Syndrome) veroorzaakt.
Het is niet bekend of SUSTIVA veilig en effectief is bij kinderen jonger dan 3 maanden of die minder dan 3,5 kg wegen.
Bij gebruik in combinatie met andere antiretrovirale geneesmiddelen voor de behandeling van hiv-1-infectie, kan SUSTIVA 600 mg helpen:
- de hoeveelheid hiv-1 in uw bloed verlagen. Dit wordt virale belasting genoemd.
- het aantal CD4+ (T)-cellen in uw bloed verhogen die andere infecties helpen bestrijden.
Het verminderen van de hoeveelheid hiv-1 en het verhogen van de CD4+ (T)-cellen in uw bloed kan uw immuunsysteem helpen verbeteren. Dit kan uw risico op overlijden of het krijgen van infecties verminderen die kunnen optreden wanneer uw immuunsysteem zwak is (opportunistische infecties).
SUSTIVA 600 mg geneest geen hiv-1-infectie of aids. U moet hiv-1-geneesmiddelen blijven gebruiken om de hiv-1-infectie onder controle te houden en hiv-gerelateerde ziekten te verminderen.
Vermijd dingen te doen die de HIV-1-infectie naar anderen kunnen verspreiden:
- Deel of hergebruik naalden of andere injectieapparatuur niet.
- Deel geen persoonlijke spullen waar bloed of lichaamsvloeistoffen op kunnen zitten, zoals tandenborstels en scheermesjes.
- Heb geen enkele vorm van seks zonder bescherming. Beoefen altijd veiliger seks door een condoom van latex of polyurethaan te gebruiken om de kans op seksueel contact met lichaamsvloeistoffen zoals sperma, vaginale afscheidingen of bloed te verkleinen.
Vraag uw arts als u vragen heeft over hoe u kunt voorkomen dat u hiv op andere mensen overdraagt.
Wie mag SUSTIVA 600 mg niet gebruiken?
Gebruik SUSTIVA niet als u allergisch bent voor efavirenz of voor één van de bestanddelen van SUSTIVA. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in SUSTIVA.
Gebruik SUSTIVA niet als u momenteel elbasvir en grazoprevir (ZEpatier®) gebruikt.
Wat moet ik mijn arts vertellen voordat ik SUSTIVA 200 mg inneem?
Vertel uw arts voordat u SUSTIVA inneemt als u een medische aandoening heeft en in het bijzonder als u:
- een hartaandoening hebben
- ooit een psychisch probleem hebben gehad
- ooit straatdrugs of grote hoeveelheden alcohol hebben gebruikt
- leverproblemen heeft, waaronder een infectie met het hepatitis B- of C-virus
- een voorgeschiedenis van epileptische aanvallen hebben
- zwanger bent of van plan bent zwanger te worden. SUSTIVA 600 mg kan uw ongeboren baby schaden. Als u zwanger kunt worden, moet uw zorgverlener een zwangerschapstest doen voordat u met SUSTIVA begint. U mag niet zwanger worden tijdens het gebruik van SUSTIVA en gedurende 12 weken na het stoppen van de behandeling met SUSTIVA. Vrouwen die zwanger kunnen worden, moeten 2 effectieve vormen van anticonceptie gebruiken tijdens de behandeling en gedurende 12 weken na het stoppen van de behandeling met SUSTIVA. Een barrièrevorm van anticonceptie moet altijd samen met een ander type anticonceptie worden gebruikt.
- Barrièrevormen van anticonceptie kunnen latex- of polyurethaancondoom, anticonceptiespons, diafragma met zaaddodend middel en cervicale kap zijn.
- Hormonale vormen van anticonceptie, zoals anticonceptiepillen, injecties, vaginale ringen of implantaten werken mogelijk niet tijdens de behandeling met SUSTIVA.
- Praat met uw arts over vormen van anticonceptie die tijdens de behandeling met SUSTIVA kunnen worden gebruikt.
- Zwangerschapsregister. Er is een zwangerschapsregistratie voor vrouwen die antiretrovirale geneesmiddelen gebruiken tijdens de zwangerschap. Het doel van dit register is om informatie te verzamelen over de gezondheid van u en uw baby. Overleg met uw arts hoe u kunt deelnemen aan dit register.
- Geef geen borstvoeding als u SUSTIVA gebruikt.
- U mag geen borstvoeding geven als u hiv heeft vanwege het risico dat u hiv op uw baby overdraagt.
Vertel uw arts en apotheker over alle geneesmiddelen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
SUSTIVA 600 mg kan de werking van andere geneesmiddelen beïnvloeden, en andere geneesmiddelen kunnen de werking van SUSTIVA 600 mg beïnvloeden, en kan ernstige bijwerkingen veroorzaken. Als u bepaalde geneesmiddelen gebruikt met SUSTIVA, kan de hoeveelheid SUSTIVA 600 mg in uw lichaam te laag zijn en werkt het mogelijk niet om uw hiv-infectie onder controle te houden. Het hiv-virus in uw lichaam kan resistent worden tegen SUSTIVA of andere soortgelijke hiv-geneesmiddelen.
U mag SUSTIVA 600 mg niet gebruiken als u ATRIPLA gebruikt (efavirenz, emtricitabine, tenofovirdisoproxilfumaraat), tenzij uw arts u dat zegt.
Vertel uw arts en apotheker over alle geneesmiddelen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Sommige geneesmiddelen hebben een wisselwerking met SUSTIVA.
Houd een lijst bij van uw medicijnen om uw arts en apotheker te laten zien.
- U kunt uw arts of apotheker om een lijst vragen van geneesmiddelen die een wisselwerking hebben met SUSTIVA.
- Begin niet met het innemen van een nieuw geneesmiddel zonder uw arts te informeren. Uw arts kan u vertellen of het veilig is om SUSTIVA samen met andere geneesmiddelen in te nemen.
Hoe moet ik SUSTIVA gebruiken?
- Neem SUSTIVA 600 mg precies in zoals uw arts u dat heeft verteld.
- Verander uw dosis niet en stop niet met het innemen van SUSTIVA tenzij uw arts u dat zegt.
- Blijf tijdens de behandeling met SUSTIVA onder de hoede van uw arts.
- SUSTIVA moet samen met andere antiretrovirale geneesmiddelen worden gebruikt.
- Neem SUSTIVA 1 keer per dag in.
- SUSTIVA wordt geleverd als tabletten of capsules.
- SUSTIVA-tabletten mogen niet worden gebroken.
- SUSTIVA-tabletten of -capsules heel doorslikken met vloeistof.
Hoe en wanneer moet SUSTIVA worden ingenomen.
- U moet SUSTIVA 600 mg voor het slapengaan op een lege maag innemen. Inname van SUSTIVA 200 mg met voedsel verhoogt de hoeveelheid geneesmiddel in uw lichaam. Sommige bijwerkingen kunnen u minder hinderen als u SUSTIVA 600 mg op een lege maag en voor het slapengaan inneemt.
- De arts van uw kind zal de juiste dosis SUSTIVA 200 mg voorschrijven op basis van het gewicht van uw kind.
- Vertel het uw arts als u moeite heeft met het doorslikken van tabletten of capsules. Uw arts kan aanbevelen de SUSTIVA-capsule te openen en de inhoud te mengen met voedsel of zuigelingenvoeding. Zie de gedetailleerde "Gebruiksaanwijzing" aan het einde van deze patiënteninformatie om te leren hoe u SUSTIVA 600 mg op de juiste manier moet innemen met behulp van de capsule-strooimethode.
- Volwassenen en kinderen die SUSTIVA 600 mg innemen met de capsulestrooimethode, mogen 2 uur na inname van een dosis SUSTIVA niet eten.
- Baby's mogen geen zuigelingenvoeding krijgen gedurende 2 uur nadat ze een dosis SUSTIVA hebben ingenomen met behulp van de capsulestrooimethode.
- Sla geen dosis SUSTIVA over. Als u bent vergeten SUSTIVA in te nemen, neem dan de gemiste dosis meteen in, tenzij het bijna tijd is voor uw volgende dosis. Neem geen 2 doses tegelijk. Neem uw volgende dosis gewoon op het geplande tijdstip in. Als u hulp nodig heeft bij het plannen van de beste tijden om uw geneesmiddel in te nemen, vraag dan uw arts of apotheker om advies.
- Als u te veel SUSTIVA heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ga naar de eerste hulpafdeling van het dichtstbijzijnde ziekenhuis.
- Wanneer uw voorraad SUSTIVA 600 mg bijna op raakt, vraag dan meer aan bij uw arts of apotheek. Het is belangrijk dat u niet zonder SUSTIVA komt te zitten. De hoeveelheid hiv-1 in uw bloed kan toenemen als het geneesmiddel ook maar voor een korte tijd wordt stopgezet. Het virus kan resistent worden tegen SUSTIVA 600 mg en moeilijker te behandelen zijn.
Wat zijn de mogelijke bijwerkingen van SUSTIVA?
SUSTIVA 600 mg kan ernstige bijwerkingen veroorzaken, waaronder:
Als u last heeft van duizeligheid, concentratieproblemen of slaperigheid, bestuur dan geen auto, gebruik geen machines of doe iets waarvoor u alert moet zijn.
Sommige symptomen van het zenuwstelsel (bijv. verwardheid, langzame gedachten en fysieke bewegingen, en waanideeën [valse overtuigingen] of hallucinaties [dingen zien of horen die anderen niet zien of horen]) kunnen maanden tot jaren na het begin van de behandeling met SUSTIVA 600 mg optreden. Neem onmiddellijk contact op met uw zorgverzekeraar als een van deze symptomen optreedt.
Vertel het uw arts meteen als u een van de volgende symptomen krijgt:
- Ernstige psychische problemen kan gebeuren bij mensen die SUSTIVA gebruiken. Vertel het uw arts meteen als u een van de volgende symptomen heeft:
- voel me verdrietig of hopeloos vertrouw andere mensen niet
- angstig of rusteloos voelen dingen horen of zien die niet echt zijn
- gedachten heeft om uzelf pijn te doen (zelfmoord) of heeft geprobeerd uzelf of anderen pijn te doen
- kunnen niet normaal bewegen of spreken
- zijn niet in staat om het verschil te zien tussen wat waar of echt is en wat niet waar of onecht is
- Symptomen van het zenuwstelsel komen vaak voor bij mensen die SUSTIVA 200 mg gebruiken en kunnen ernstig zijn. Deze symptomen beginnen gewoonlijk tijdens de eerste of tweede dag van de behandeling met SUSTIVA 200 mg en verdwijnen gewoonlijk na 2 tot 4 weken behandeling. Sommige symptomen kunnen maanden tot jaren na het begin van de behandeling met SUSTIVA optreden. Deze symptomen kunnen erger worden als u alcohol drinkt, een geneesmiddel voor geestelijke gezondheidsproblemen gebruikt of bepaalde straatdrugs gebruikt tijdens de behandeling met SUSTIVA. Symptomen kunnen zijn:
- duizeligheid
- moeite met concentreren
- Moeite met slapen
- slaperigheid
- ongebruikelijke dromen
- gebrek aan coördinatie of moeite met evenwicht
- Huiduitslag komt vaak voor bij SUSTIVA 600 mg, maar kan soms ernstig zijn. Huiduitslag verdwijnt meestal zonder enige verandering in de behandeling. Als u huiduitslag krijgt met een van de volgende symptomen, vertel dit dan onmiddellijk aan uw arts:
- huiduitslag, met of zonder jeuk
- huid vervellen
- koorts
- zweertjes in de mond
- zwelling van uw gezicht
- rode of ontstoken ogen, zoals "roze oog" (conjunctivitis)
- blaren of huidlaesies
- Leverproblemen, waaronder leverfalen en overlijden kan gebeuren bij mensen die SUSTIVA gebruiken. Leverproblemen kunnen optreden bij mensen zonder een voorgeschiedenis van leverproblemen. Uw arts zal bloedonderzoeken doen om uw lever te controleren voordat u start met SUSTIVA 200 mg en tijdens de behandeling.
- uw huid of het witte deel van uw ogen wordt geel (geelzucht)
- je hebt meerdere dagen of langer geen zin om te eten
- je urine wordt donker
- u voelt zich misselijk in uw maag (misselijkheid)
- je stoelgang (ontlasting) wordt licht van kleur
- u heeft pijn in de onderbuik (buik)
- epileptische aanvallen kan gebeuren bij mensen die SUSTIVA gebruiken. Epileptische aanvallen komen vaker voor als u in het verleden epileptische aanvallen heeft gehad. Vertel het uw arts als u een aanval heeft gehad of als u een geneesmiddel gebruikt om epileptische aanvallen te voorkomen.
- Veranderingen in uw immuunsysteem (immuunreconstitutiesyndroom) kan gebeuren als u hiv-1-geneesmiddelen gaat gebruiken. Uw immuunsysteem kan sterker worden en infecties gaan bestrijden die al lang in uw lichaam verborgen zijn. Vertel het uw arts als u nieuwe symptomen krijgt nadat u met uw hiv-1-medicijn bent begonnen.
- Veranderingen in lichaamsvet kan optreden bij mensen die hiv-1-medicijnen gebruiken. Deze veranderingen kunnen bestaan uit een verhoogde hoeveelheid vet in de bovenrug en nek ("buffalo hump"), borst en rond het grootste deel van uw lichaam (romp). Verlies van vet van de benen, armen en gezicht kan ook voorkomen. De oorzaak en gezondheidseffecten op lange termijn van deze aandoeningen zijn niet bekend.
De meest voorkomende bijwerkingen van SUSTIVA 600 mg zijn:
- uitslag
- abnormale dromen
- duizeligheid
- vermoeidheid
- misselijkheid
- Moeite met slapen
- hoofdpijn
- braken
- moeite met concentreren
Sommige patiënten die SUSTIVA gebruiken, hebben verhoogde niveaus van lipiden (cholesterol en triglyceriden) in het bloed ervaren. Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van SUSTIVA. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik SUSTIVA bewaren?
- Bewaar SUSTIVA-capsules en -tabletten bij kamertemperatuur tussen 20 °C en 25 °C (68 °F tot 77 °F).
Houd SUSTIVA en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over SUSTIVA
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een patiëntenbijsluiter. Gebruik SUSTIVA 600 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef SUSTIVA 600 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw apotheker of arts om informatie vragen over SUSTIVA die is geschreven voor gezondheidswerkers. Ga voor meer informatie naar www.sustiva.com of bel 1-800-321-1335.
Wat zijn de ingrediënten in SUSTIVA?
Actief ingrediënt: efavirenz
Inactieve ingredienten:
SUSTIVA 600 mg-capsules: lactosemonohydraat, magnesiumstearaat, natriumlaurylsulfaat en natriumzetmeelglycolaat. Het omhulsel van de capsule bevat gelatine, natriumlaurylsulfaat, titaniumdioxide en/of geel ijzeroxide. Het omhulsel van de capsule kan ook siliciumdioxide bevatten. De capsules zijn bedrukt met inkt die karmijn 40 blauw, FD&C Blue No. 2 en titaniumdioxide bevat.
SUSTIVA-tabletten: croscarmellosenatrium, hydroxypropylcellulose, lactosemonohydraat, magnesiumstearaat, microkristallijne cellulose en natriumlaurylsulfaat. De filmomhulling van de tablet bevat Opadry Yellow en Opadry Clear. De tabletten zijn gepolijst met carnaubawas en bedrukt met paarse inkt, Opacode WB.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
Gebruiksaanwijzing
SUSTIVA® (sus-TEE-vah) (efavirenz) capsules
Een dosis SUSTIVA 600 mg bereiden met behulp van de capsulestrooimethode
Lees deze gebruiksaanwijzing voordat u uw eerste dosis SUSTIVA gemengd met voedsel of zuigelingenvoeding bereidt met behulp van de capsulestrooimethode, elke keer dat u een navulling krijgt en indien nodig. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of behandeling. Vraag uw arts of apotheker als u vragen heeft over het mengen of toedienen van een dosis SUSTIVA 200 mg met behulp van de capsulestrooimethode.
Belangrijke gegevens:
- Zie de bijsluiter voor patiënten voor meer informatie over SUSTIVA 600 mg capsules.
- De capsulestrooimethode voor het mengen van de inhoud van SUSTIVA-capsules met zacht voedsel of zuigelingenvoeding kan worden gebruikt voor volwassenen of kinderen die geen capsules of tabletten kunnen doorslikken.
- U moet SUSTIVA 600 mg voor het slapengaan op een lege maag innemen.
- U mag niet eten gedurende 2 uur nadat u SUSTIVA gemengd met voedsel heeft ingenomen.
- Baby's die oud genoeg zijn om voedsel door te slikken, dienen SUSTIVA toegediend te krijgen volgens de capsulestrooimethode, gemengd met voedsel in plaats van met zuigelingenvoeding.
- Praat met uw arts om te bepalen wat het beste schema is om uw baby SUSTIVA gemengd met zuigelingenvoeding te geven met behulp van de capsulestrooimethode.
Bereid een dosis SUSTIVA 600 mg gemengd met voedsel voor met behulp van de capsulestrooimethode.
Verzamel de volgende benodigdheden voordat u een dosis SUSTIVA 200 mg gemengd met voedsel bereidt met behulp van de capsulestrooimethode:
- papieren handdoeken
- theelepel om te meten
- kleine lepel om te roeren en te voeren
- klein schone container (zoals een klein kopje of kom)
- zacht voedsel zoals appelmoes, druivengelei of yoghurt
Stap 1. Kies een schoon, vlak werkoppervlak. Leg een schone papieren handdoek op het werkoppervlak. Plaats vervolgens de andere benodigdheden op de papieren handdoek.
Stap 2. Was en droog je handen goed.
Stap 3. Doe 1 tot 2 theelepels zacht voedsel zoals appelmoes, druivengelei of yoghurt in het kleine bakje (zie Afbeelding A ). De kleur en dikte van het voedsel kan veranderen wanneer het met het geneesmiddel wordt gemengd.
Afbeelding A
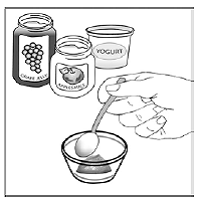
Stap 4. Er zijn 2 delen van de SUSTIVA 200 mg capsule. Kijk naar de SUSTIVA-capsule om te zien welk deel van de capsule het andere deel overlapt (zie Figuur B ).
Figuur B
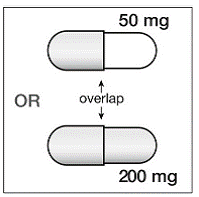
Stap 5. Houd de SUSTIVA-capsule in een zijwaartse (horizontale) positie direct boven de container met voedsel. Houd elk uiteinde van de SUSTIVA-capsule tussen uw duimen en wijsvinger (wijsvinger) (zie Figuur C ).
Figuur C
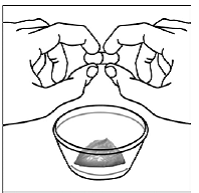
Stap 6. Gebruik uw duim en wijsvinger om dicht bij het uiteinde van het overlappende deel van de SUSTIVA 600 mg capsule te knijpen (zie: Figuur D ).
Figuur D
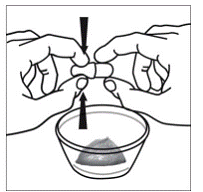
Draai vervolgens beide uiteinden van de SUSTIVA 600 mg capsule voorzichtig in tegengestelde richting om deze te openen (zie Figuur E ). Zorg ervoor dat u de inhoud van de capsule niet morst of in de lucht verspreidt.
Figuur E

Stap 7. Strooi de inhoud van de SUSTIVA-capsule op het voedsel (zie Figuur F ).
- Controleer de capsulehulzen om er zeker van te zijn dat ze leeg zijn.
- Gooi de lege capsulehulzen weg.
Figuur F

Als de totale voorgeschreven dosis meer dan 1 capsule is, volg dan stap 4 tot en met 7 voor elke capsule. Voeg niet meer voedsel toe.
Stap 8 tot en met 11 moeten worden voltooid binnen 30 minuten van het mengen van het geneesmiddel (zie Figuur G ).
Figuur G

Stap 8. Gebruik de kleine lepel om de inhoud van de capsule en het voedsel voorzichtig door elkaar te mengen (zie figuur H ). Hagelslag lost niet op. Het mengsel ziet er korrelig uit, maar mag niet klonterig zijn.
figuur H
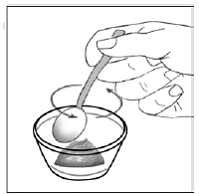
Stap 9. Gebruik de kleine lepel om het mengsel van voedsel en capsule-inhoud te geven of te nemen. Zorg ervoor dat al het mengsel is ingeslikt.
Stap 10. Voeg ongeveer 2 theelepels meer van het voedsel toe aan de lege container en roer voorzichtig met de kleine lepel om te mengen met eventuele capsule-inhoud die zich nog in de container bevindt.
Stap 11. Gebruik de kleine lepel om het mengsel van voedsel en capsule-inhoud te geven of te nemen. Zorg ervoor dat al het mengsel is ingeslikt.
Stap 12. Was de container en lepels. Gooi de papieren handdoek weg en maak het werkoppervlak schoon. Was je handen.
Bereiden van een dosis SUSTIVA 600 mg gemengd met zuigelingenvoeding met behulp van de capsulestrooimethode
Om ervoor te zorgen dat uw baby al het geneesmiddel krijgt, mag u de inhoud van de SUSTIVA-capsule niet in een fles aan uw baby geven.
Verzamel de volgende benodigdheden voordat u een dosis SUSTIVA gemengd met zuigelingenvoeding bereidt met behulp van de capsulestrooimethode:
- papieren handdoeken
- theelepel om te roeren en af te meten
- klein schone container (zoals een klein kopje of kom) (zie Figuur I ).
- 10 ml doseerspuit voor oraal gebruik (vraag hiernaar bij uw apotheker) (zie Figuur I ).
- zuigelingenvoeding op kamertemperatuur.
Figuur I
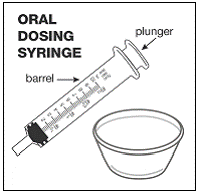
Stap 1. Bereid de zuigelingenvoeding volgens de aanwijzingen op de zuigelingenvoedingsverpakking. U zult ongeveer 1 ounce van de formule gebruiken om het geneesmiddel te geven. De resterende formule mag gedurende 2 uur niet aan het kind worden gegeven.
Stap 2. Kies een schoon, vlak werkoppervlak. Leg een schone papieren handdoek op het werkoppervlak. Leg de benodigdheden die je nodig hebt op de papieren handdoek.
Stap 3. Was en droog je handen goed.
Stap 4. Giet 2 theelepels zuigelingenvoeding op kamertemperatuur in de container (zie figuur J ).
figuur J
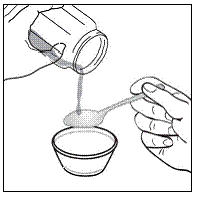
Stap 5. Er zijn 2 delen van de SUSTIVA-capsule. Kijk naar de SUSTIVA-capsule om te zien welk deel van de capsule het andere deel overlapt (zie figuur K ).
figuur K
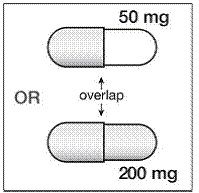
Stap 6. Houd de SUSTIVA-capsule in een zijwaartse (horizontale) positie direct boven de container met de zuigelingenvoeding. Houd elk uiteinde van de SUSTIVA 600 mg capsule tussen uw duimen en wijsvingers (zie .) Figuur L ).
Figuur L
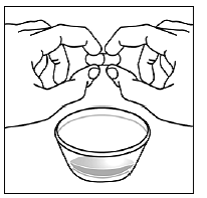
Stap 7. Gebruik uw duim en wijsvinger om dicht bij het uiteinde van het overlappende deel van de SUSTIVA-capsule te knijpen (zie Figuur M ).
Figuur M
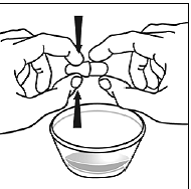
Draai vervolgens beide uiteinden van de SUSTIVA-capsule voorzichtig in tegengestelde richting om deze te openen (zie Figuur nr ). Zorg ervoor dat u de inhoud van de capsule niet morst of in de lucht verspreidt.
Figuur nr
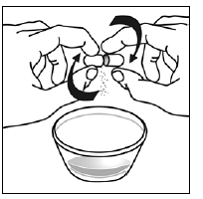
Stap 8. Strooi de inhoud van de SUSTIVA 600 mg capsule op de zuigelingenvoeding (zie Figuur O ).
- Controleer de capsulehulzen om er zeker van te zijn dat ze leeg zijn.
- Gooi de lege capsulehulzen weg.
Figuur O
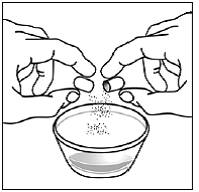
Als de totale voorgeschreven dosis meer dan 1 capsule is, volg dan stap 5 tot en met 8 voor elke capsule. Voeg niet meer zuigelingenvoeding toe.
Stappen 9 tot en met 12 moeten worden voltooid binnen 30 minuten van het mengen van het geneesmiddel (zie Figuur P ).
Figuur P

Stap 9. Houd de container met één hand vast. Gebruik met je andere hand het theelepeltje om de inhoud van de capsule en de zuigelingenvoeding voorzichtig te mengen (zie Figuur Q ). Hagelslag lost niet op. Het mengsel ziet er korrelig uit, maar mag niet klonterig zijn.
Figuur Q
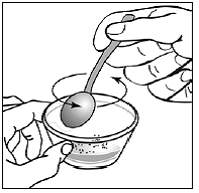
Stap 10. Om al het mengsel in de orale doseerspuit op te zuigen:
Figuur R
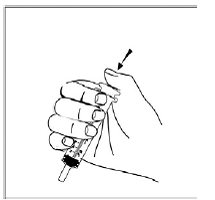
Figuren
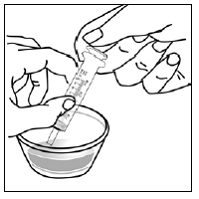
Figuur T
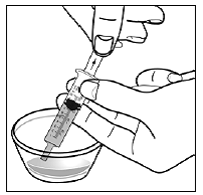
- Controleer of de zuiger volledig in de cilinder van de spuit is geduwd (zie Figuur R ).
- Plaats de punt van de spuit in het mengsel in de container (zie Figuren ).
- Trek de zuiger langzaam terug en zuig al het mengsel op (zie Figuur T ).
Stap 11. Plaats de punt van de spuit in de mond van uw baby langs de binnenkant van de wang (zie Figuur U ). Duw langzaam op de zuiger om uw baby al het mengsel te geven.
Figuur U
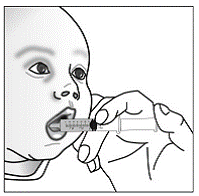
Stap 12. Om er zeker van te zijn dat al het geneesmiddel aan uw baby wordt gegeven:
- Herhaal stap 4 hierboven.
- Roer met een theelepel.
- Herhaal dan Stappen 10 en 11 hierboven (zien Figuur V ).
Figuur V
Stap 13. Verwijder de zuiger van de orale doseerspuit. Was de container, theelepel en orale doseerspuit. Laat de zuiger en de spuitcilinder drogen voordat u ze weer in elkaar zet.
Stap 14. Gooi de papieren handdoek weg en maak het werkoppervlak schoon. Was je handen.
Hoe moet ik SUSTIVA 600 mg capsules bewaren?
- Bewaar SUSTIVA-capsules bij kamertemperatuur tussen 20 °C en 25 °C (68 °F tot 77 °F).
Houd SUSTIVA 600 mg capsules en alle geneesmiddelen buiten het bereik van kinderen.
Deze gebruiksaanwijzing is goedgekeurd door de Amerikaanse Food and Drug Administration.
