Copegus 100mg Ribavirin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Copegus 100 mg en hoe wordt het gebruikt?
Copegus 100 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van chronische hepatitis C te behandelen. Copegus 100 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Copegus behoort tot een klasse geneesmiddelen die Hepatitis B/Hepatitis C-agentia worden genoemd; RSV-agenten.
Wat zijn de mogelijke bijwerkingen van Copegus?
Copegus kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- problemen met uw zicht,
- hevige pijn in uw bovenbuik die zich uitbreidt naar uw rug,
- misselijkheid,
- braken,
- diarree,
- nieuwe of verergerende hoest,
- koorts,
- stekende pijn op de borst,
- piepende ademhaling,
- kortademigheid,
- ernstige depressie,
- gedachten van zelfbeschadiging of het schaden van iemand anders,
- bleke of vergeelde huid,
- donker gekleurde urine,
- verwardheid,
- zwakheid,
- rillingen,
- griepachtige symptomen,
- gezwollen tandvlees,
- zweertjes in de mond,
- huidzweren,
- gemakkelijk blauwe plekken,
- ongewone bloedingen, en
- duizeligheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Copegus zijn:
- misselijkheid,
- braken,
- verlies van eetlust,
- koorts,
- koude rillingen of beven,
- laag aantal bloedcellen,
- Bloedarmoede,
- zwakheid,
- vermoeidheid,
- hoofdpijn,
- spierpijn,
- stemmingswisselingen,
- angst, en
- prikkelbaarheid
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Copegus. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
RISICO OP ERNSTIGE AANDOENINGEN EN RIBAVIRINE-GEASSOCIEERDE EFFECTEN
COPEGUS (ribavirine) monotherapie is niet effectief voor de behandeling van chronische hepatitis C-virusinfectie en mag niet alleen worden gebruikt voor deze indicatie.
De primaire klinische toxiciteit van ribavirine is hemolytische anemie. De anemie die gepaard gaat met behandeling met ribavirine kan leiden tot verergering van hartaandoeningen en leiden tot fatale en niet-fatale myocardinfarcten. Patiënten met een voorgeschiedenis van significante of onstabiele hartziekte mogen niet worden behandeld met COPEGUS (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN, BIJWERKINGEN en DOSERING EN TOEDIENING ).
Significante teratogene en/of embryocidale effecten zijn aangetoond bij alle diersoorten die zijn blootgesteld aan ribavirine. Bovendien heeft ribavirine een halfwaardetijd van meervoudige doses van 12 dagen en kan het tot 6 maanden aanhouden in niet-plasmacompartimenten. Daarom is ribavirine, inclusief COPEGUS 100 mg, gecontra-indiceerd bij vrouwen die zwanger zijn en bij mannelijke partners van vrouwen die zwanger zijn. Zowel bij vrouwelijke patiënten als bij vrouwelijke partners van mannelijke patiënten die een behandeling met ribavirine ondergaan, moet uiterste voorzichtigheid worden betracht om zwangerschap te voorkomen tijdens de behandeling en gedurende 6 maanden na voltooiing van de therapie. Er moeten ten minste twee betrouwbare vormen van effectieve anticonceptie worden gebruikt tijdens de behandeling en tijdens de follow-upperiode van 6 maanden na de behandeling (zie CONTRA-INDICATIES, WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ).
OMSCHRIJVING
COPEGUS 100 mg, ribavirine, is een nucleoside-analoog met antivirale activiteit. De chemische naam van ribavirine is 1-β-Dribofuranosyl-1H-1,2,4-triazool-3-carboxamide en heeft de volgende structuurformule:
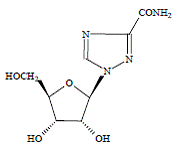
De empirische formule van ribavirine is C8H12N4O5 en het molecuulgewicht is 244,2. Ribavirine is een wit tot gebroken wit poeder. Het is goed oplosbaar in water en slecht oplosbaar in watervrije alcohol.
COPEGUS (ribavirine) is verkrijgbaar als een lichtroze tot roze gekleurde, platte, ovale, filmomhulde tablet voor orale toediening. Elke tablet bevat 200 mg ribavirine en de volgende inactieve ingrediënten: gepregelatineerd zetmeel, microkristallijne cellulose, natriumzetmeelglycolaat, maïszetmeel en magnesiumstearaat. Het omhulsel van de tablet bevat Chromatone-P of Opadry Pink (gemaakt met behulp van hydroxypropylmethylcellulose, talk, titaniumdioxide, synthetisch geel ijzeroxide en synthetisch rood ijzeroxide), ethylcellulose (ECD-30) en triacetine.
INDICATIES
COPEGUS 100 mg in combinatie met PEGASYS (peginterferon alfa-2a) is geïndiceerd voor de behandeling van patiënten van 5 jaar en ouder met chronische hepatitis C (CHC)-virusinfectie die een gecompenseerde leverziekte hebben en die niet eerder zijn behandeld met interferon-alfa.
De volgende punten moeten in overweging worden genomen bij het starten van de combinatietherapie COPEGUS 100 mg met PEGASYS:
- Deze indicatie is gebaseerd op klinische onderzoeken naar combinatietherapie bij patiënten met CHC en gecompenseerde leverziekte, van wie sommigen histologisch bewijs van cirrose hadden (Child-Pugh-klasse A), en bij volwassen patiënten met klinisch stabiele HIV-ziekte en CD4-telling hoger dan 100 cellen/mm³ .
- Deze indicatie is gebaseerd op het bereiken van niet-detecteerbaar HCV-RNA na behandeling gedurende 24 of 48 weken, op basis van het HCV-genotype, en het handhaven van een aanhoudende virologische respons (SVR) 24 weken na de laatste dosis.
- Gegevens over veiligheid en werkzaamheid zijn niet beschikbaar voor een behandeling langer dan 48 weken.
- De veiligheid en werkzaamheid van therapie met COPEGUS 100 mg en PEGASYS zijn niet vastgesteld bij ontvangers van lever- of andere orgaantransplantaties, patiënten met gedecompenseerde leverziekte of eerdere non-responders op interferontherapie.
- De veiligheid en werkzaamheid van COPEGUS-therapie voor de behandeling van adenovirus-, RSV-, para-influenza- of influenza-infecties zijn niet vastgesteld. COPEGUS mag niet worden gebruikt voor deze indicaties. Ribavirine voor inhalatie heeft een aparte bijsluiter, die moet worden geraadpleegd als inhalatietherapie met ribavirine wordt overwogen.
DOSERING EN ADMINISTRATIE
Copegus 100 mg moet met voedsel worden ingenomen. COPEGUS moet in combinatie met PEGASYS worden gegeven; het is belangrijk op te merken dat COPEGUS 100 mg nooit als monotherapie mag worden gegeven. Zien PEGASYS-bijsluiter voor alle instructies met betrekking tot de dosering en toediening van PEGASYS.
Chronische Hepatitis C Mono-infectie
Volwassen patiënten
De aanbevolen dosering van COPEGUS 100 mg tabletten wordt weergegeven in Tabel 1. De aanbevolen behandelingsduur voor patiënten die niet eerder behandeld zijn met ribavirine en interferon is 24 tot 48 weken.
De dagelijkse dosis COPEGUS 100 mg is 800 mg tot 1200 mg, oraal toegediend in twee verdeelde doses. De dosis moet individueel aan de patiënt worden aangepast, afhankelijk van de ziektekenmerken bij aanvang (bijv. genotype), respons op de therapie en verdraagbaarheid van het regime (zie ).
Pediatrische patiënten
PEGASYS wordt eenmaal per week subcutaan toegediend als 180 mcg/1,73 m² x lichaamsoppervlak, tot een maximale dosis van 180 mcg, en moet in combinatie met ribavirine worden gegeven. De aanbevolen behandelingsduur voor patiënten met genotype 2 of 3 is 24 weken en voor andere genotypen 48 weken.
COPEGUS moet in combinatie met PEGASYS worden gegeven. COPEGUS 100 mg is alleen verkrijgbaar als tablet van 200 mg en daarom dient de zorgverlener te bepalen of dit formaat tablet door de pediatrische patiënt kan worden ingeslikt. De aanbevolen doses voor COPEGUS worden weergegeven in Tabel 2. Patiënten die voor hun 18e met de behandeling beginnen, dienen de pediatrische dosering te handhaven tot het einde van de therapie.
Chronische hepatitis C met gelijktijdige HIV-infectie
Volwassen patiënten
De aanbevolen dosis voor de behandeling van chronische hepatitis C bij patiënten die gelijktijdig met HIV zijn geïnfecteerd, is PEGASYS 180 mcg subcutaan eenmaal per week en dagelijks 800 mg COPEGUS via de mond voor een totale duur van 48 weken, ongeacht het HCV-genotype.
Dosisaanpassingen
Volwassen en pediatrische patiënten
Als zich ernstige bijwerkingen of laboratoriumafwijkingen voordoen tijdens de combinatietherapie met COPEGUS/PEGASYS, moet de dosis zo nodig worden aangepast of gestaakt totdat de bijwerkingen verminderen of in ernst afnemen. Als de intolerantie aanhoudt na dosisaanpassing, moet de behandeling met COPEGUS/PEGASYS worden stopgezet. Tabel 3 geeft richtlijnen voor dosisaanpassingen en stopzetting op basis van de hemoglobineconcentratie en hartstatus van de patiënt.
COPEGUS 100 mg dient met voorzichtigheid te worden toegediend aan patiënten met een reeds bestaande hartziekte. Patiënten moeten vóór aanvang van de therapie worden beoordeeld en moeten tijdens de therapie op passende wijze worden gecontroleerd. Als er enige verslechtering van de cardiovasculaire status is, moet de therapie worden stopgezet [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De richtlijnen voor dosisaanpassingen van COPEGUS 100 mg die in deze tabel worden beschreven, zijn ook van toepassing op laboratoriumafwijkingen of andere bijwerkingen dan verlagingen van de hemoglobinewaarden.
Volwassen patiënten
Zodra COPEGUS 100 mg is onthouden vanwege een laboratoriumafwijking of een klinische bijwerking, kan worden geprobeerd om opnieuw te starten met COPEGUS 100 mg met 600 mg per dag en de dosis verder te verhogen tot 800 mg per dag. Het wordt echter niet aanbevolen om COPEGUS te verhogen tot de oorspronkelijk toegewezen dosis (1000 mg tot 1200 mg).
Pediatrische patiënten
Nadat een laboratoriumafwijking of klinische bijwerking is opgelost, kan worden geprobeerd de COPEGUS-dosis van 100 mg te verhogen tot de oorspronkelijke dosis, afhankelijk van het oordeel van de arts. Als COPEGUS is onthouden vanwege een laboratoriumafwijking of klinische bijwerking, kan worden geprobeerd om COPEGUS 100 mg opnieuw te starten met de helft van de volledige dosis.
Nierfunctiestoornis
De totale dagelijkse dosis COPEGUS moet worden verlaagd voor patiënten met een creatinineklaring van minder dan of gelijk aan 50 ml/min; en de wekelijkse dosis PEGASYS moet worden verlaagd voor een creatinineklaring van minder dan 30 ml/min als volgt in tabel 4 [zie Gebruik bij specifieke populaties , Farmacokinetiek , en PEGASYS-bijsluiter ].
De dosis COPEGUS 100 mg mag niet verder worden aangepast bij patiënten met nierinsufficiëntie. Als zich ernstige bijwerkingen of laboratoriumafwijkingen voordoen, moet COPEGUS zo nodig worden gestaakt totdat de bijwerkingen afnemen of in ernst afnemen. Als de intolerantie aanhoudt na het herstarten van COPEGUS 100 mg, moet de behandeling met COPEGUS/PEGASYS worden stopgezet.
Er zijn geen gegevens beschikbaar over pediatrische patiënten met een nierfunctiestoornis.
Stopzetting van de dosering
Stopzetting van de behandeling met PEGASYS/COPEGUS 100 mg dient te worden overwogen als de patiënt na 12 weken therapie geen verlaging van ten minste 2 log10 ten opzichte van baseline in HCV-RNA heeft aangetoond, of niet-detecteerbare HCV-RNA-spiegels na 24 weken therapie.
De behandeling met PEGASYS/COPEGUS 100 mg moet worden gestaakt bij patiënten die tijdens de behandeling leverdecompensatie ontwikkelen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
HOE GELEVERD
Doseringsvormen en sterke punten
COPEGUS (ribavirine) is verkrijgbaar als een lichtroze tot roze gekleurde, platte, ovale, filmomhulde tablet voor orale toediening. Elke tablet bevat 200 mg ribavirine.
COPEGUS® (ribavirine) is verkrijgbaar als tabletten voor orale toediening. Elke tablet bevat 200 mg ribavirine en is lichtroze tot roze gekleurd, plat, ovaal van vorm, filmomhuld en gegraveerd met RIB 200 aan de ene kant en ROCHE aan de andere kant. Ze zijn verpakt in een fles van 168 tabletten ( NDC 0004-0086-94).
Opslag en behandeling
Bewaar de fles COPEGUS®Tablets bij 25°C (77°F); excursies zijn toegestaan tussen 15°C en 30°C (59°F en 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Houd de fles goed gesloten.
Gefabriceerd door: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Een lid van de Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990. Herzien: aug. 2015
BIJWERKINGEN
PEGASYS in combinatie met COPEGUS veroorzaakt een breed scala aan ernstige bijwerkingen [zie: GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. De meest voorkomende ernstige of levensbedreigende bijwerkingen die door COPEGUS/PEGASYS worden veroorzaakt of verergerd, zijn depressie, zelfmoord, terugval van drugsmisbruik/overdosis en bacteriële infecties, elk met een frequentie van minder dan 1%. Leverdecompensatie trad op bij 2% (10/574) CHC/HIV-patiënten [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ervaring in klinische studies
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Volwassen patiënten
In de registratieonderzoeken NV15801 en NV15942 kregen 886 patiënten gedurende 48 weken COPEGUS in doses van 1000/1200 mg op basis van lichaamsgewicht. In deze onderzoeken traden een of meer ernstige bijwerkingen op bij 10% van de personen met een CHC-mono-infectie en bij 19% van de personen met CHC/hiv die PEGASYS alleen of in combinatie met COPEGUS kregen. De meest voorkomende ernstige bijwerking (3% bij CHC en 5% bij CHC/HIV) was bacteriële infectie (bijv. sepsis, osteomyelitis, endocarditis, pyelonefritis, pneumonie).
Andere ernstige bijwerkingen traden op met een frequentie van minder dan 1% en omvatten: zelfmoord, zelfmoordgedachten, psychose, agressie, angst, drugsmisbruik en overdosis drugs, angina, leverdisfunctie, leververvetting, cholangitis, aritmie, diabetes mellitus, auto-immuunverschijnselen (bijv. hyperthyreoïdie, hypothyreoïdie, sarcoïdose, systemische lupus erythematodes, reumatoïde artritis), perifere neuropathie, aplastische anemie, maagzweer, gastro-intestinale bloeding, pancreatitis, colitis, hoornvlieszweer, longembolie, coma, myositis, hersenbloeding, trombotische purpere trombocytopenische psychotische stoornis en hallucinaties.
Het percentage patiënten in klinische onderzoeken dat een of meer bijwerkingen ondervond, was 98%. De meest gemelde bijwerkingen waren psychiatrische reacties, waaronder depressie, slapeloosheid, prikkelbaarheid, angst en griepachtige symptomen zoals vermoeidheid, koorts, spierpijn, hoofdpijn en rigor. Andere vaak voorkomende reacties waren anorexia, misselijkheid en braken, diarree, artralgie, reacties op de injectieplaats, alopecia en pruritus.
toont percentages van bijwerkingen die optreden bij meer dan of gelijk aan 5% van de proefpersonen die een combinatietherapie met gepegyleerd interferon en ribavirine kregen in de CHC Clinical Trial, NV15801.
Tien procent van de CHC-patiënten met mono-infectie die 48 weken behandeling met PEGASYS in combinatie met COPEGUS 100 mg kregen, stopte met de behandeling; 16% van de patiënten met een gelijktijdige CHC/HIV-infectie stopte met de behandeling. De meest voorkomende redenen voor stopzetting van de therapie waren psychiatrisch, griepachtig syndroom (bijv. lethargie, vermoeidheid, hoofdpijn), dermatologische en gastro-intestinale stoornissen en laboratoriumafwijkingen (trombocytopenie, neutropenie en anemie).
In totaal had 39% van de patiënten met CHC of CHC/HIV aanpassing van de PEGASYS- en/of COPEGUS-therapie nodig. De meest voorkomende reden voor dosisaanpassing van PEGASYS bij CHC- en CHC/HIV-patiënten was laboratoriumafwijkingen; neutropenie (respectievelijk 20% en 27%), en trombocytopenie (respectievelijk 4% en 6%). De meest voorkomende reden voor dosisaanpassing van COPEGUS bij CHC- en CHC/HIV-patiënten was anemie (respectievelijk 22% en 16%).
De dosis PEGASYS werd verlaagd bij 12% van de patiënten die gedurende 48 weken 1000 mg tot 1200 mg COPEGUS 100 mg kregen en bij 7% van de patiënten die gedurende 24 weken 800 mg COPEGUS kregen. De dosis COPEGUS werd verlaagd bij 21% van de patiënten die gedurende 48 weken 1000 mg tot 1200 mg COPEGUS 100 mg kregen en bij 12% van de patiënten die gedurende 24 weken 800 mg COPEGUS 100 mg kregen.
Bij patiënten met chronische hepatitis C-mono-infectie die 24 weken werden behandeld met PEGASYS en 800 mg COPEGUS 100 mg werd een lagere incidentie van ernstige bijwerkingen waargenomen (3% vs. 10%), hemoglobine minder dan 10 g/dl (3% vs. 15%) dosisaanpassing van PEGASYS (30% vs. 36%) en COPEGUS (19% vs. 38%) en stopzetting van de behandeling (5% vs. 15%) vergeleken met patiënten die 48 weken werden behandeld met PEGASYS en 1000 mg of 1200 mg Copegus. Aan de andere kant bleek de totale incidentie van bijwerkingen vergelijkbaar te zijn in de twee behandelingsgroepen.
Pediatrische patiënten
In een klinisch onderzoek met 114 pediatrische proefpersonen (5 tot 17 jaar) die werden behandeld met PEGASYS alleen of in combinatie met COPEGUS 100 mg, waren dosisaanpassingen nodig bij ongeveer een derde van de proefpersonen, meestal voor neutropenie en anemie. Over het algemeen was het veiligheidsprofiel dat werd waargenomen bij pediatrische proefpersonen vergelijkbaar met dat bij volwassenen. In het pediatrische onderzoek waren de meest voorkomende bijwerkingen bij proefpersonen die werden behandeld met combinatietherapie PEGASYS en COPEGUS 100 mg gedurende maximaal 48 weken griepachtige ziekte (91%), infectie van de bovenste luchtwegen (60%), hoofdpijn (64%), gastro-intestinale stoornis (56%), huidaandoening (47%) en reactie op de injectieplaats (45%). Zeven proefpersonen die gedurende 48 weken een combinatiebehandeling van PEGASYS en COPEGUS kregen, staakten de behandeling om veiligheidsredenen (depressie, afwijkend psychiatrisch onderzoek, voorbijgaande blindheid, retinale exsudaten, hyperglykemie, type 1 diabetes mellitus en bloedarmoede). Ernstige bijwerkingen werden gemeld bij 2 proefpersonen in de PEGASYS plus COPEGUS 100 mg combinatietherapiegroep (hyperglykemie en cholecystectomie).
Bij pediatrische proefpersonen die waren gerandomiseerd naar combinatietherapie, was de incidentie van de meeste bijwerkingen vergelijkbaar gedurende de gehele behandelingsperiode (tot 48 weken plus 24 weken follow-up) in vergelijking met de eerste 24 weken, en nam slechts licht toe voor hoofdpijn, gastro-intestinale stoornis , prikkelbaarheid en huiduitslag. De meeste bijwerkingen traden op in de eerste 24 weken van de behandeling.
Groeiremming bij pediatrische patiënten
[zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Pediatrische proefpersonen die werden behandeld met combinatietherapie met PEGASYS plus ribavirine vertoonden een vertraging in gewichts- en lengtetoename tot 48 weken behandeling vergeleken met baseline. Zowel gewicht voor leeftijd en lengte voor leeftijd z-scores als de percentielen van de normatieve populatie voor gewicht en lengte van de proefpersoon namen af tijdens de behandeling. Aan het einde van 2 jaar follow-up na de behandeling waren de meeste proefpersonen teruggekeerd naar de normatieve curve-percentielen voor gewicht (64e gemiddelde percentiel bij baseline, 60e gemiddelde percentiel 2 jaar na behandeling) en lengte (54e gemiddelde percentiel bij baseline, 56e gemiddelde percentiel 2 jaar na de behandeling). Aan het einde van de behandeling ervoer 43% (23 van 53) van de proefpersonen een gewichtspercentielafname van meer dan 15 percentielen, en 25% (13 van 53) ervoer een lengtepercentielafname van meer dan 15 percentielen op de normatieve groeicurves. 2 jaar na de behandeling was 16% (6 van de 38) van de proefpersonen meer dan 15 percentielen onder hun baseline gewichtscurve en 11% (4 van 38) meer dan 15 percentielen onder hun baseline lengtecurve.
Achtendertig van de 114 proefpersonen namen deel aan het langetermijnvervolgonderzoek, dat zich uitstrekte tot 6 jaar na de behandeling. Voor de meeste proefpersonen bleef het herstel van de groei na 2 jaar na de behandeling behouden tot 6 jaar na de behandeling.
Vaak voorkomende bijwerkingen bij CHC met gelijktijdige HIV-infectie (volwassenen)
Het bijwerkingenprofiel van gecoïnfecteerde patiënten die werden behandeld met PEGASYS/COPEGUS in onderzoek NR15961 was over het algemeen vergelijkbaar met het profiel dat werd getoond voor mono-geïnfecteerde patiënten in onderzoek NV15801 (tabel 5). Gebeurtenissen die vaker voorkwamen bij gecoïnfecteerde patiënten waren neutropenie (40%), anemie (14%), trombocytopenie (8%), gewichtsafname (16%) en stemmingsverandering (9%).
Afwijkingen in laboratoriumtests
Volwassen patiënten
Anemie als gevolg van hemolyse is de belangrijkste toxiciteit van ribavirinetherapie. Anemie (hemoglobine minder dan 10 g/dl) werd waargenomen bij 13% van alle patiënten die met de combinatie COPEGUS en PEGASYS werden behandeld in klinische onderzoeken. De maximale daling van het hemoglobine deed zich voor tijdens de eerste 8 weken na aanvang van de behandeling met ribavirine [zie: DOSERING EN ADMINISTRATIE ].
Pediatrische patiënten
Verlaging van hemoglobine, neutrofielen en bloedplaatjes kan een dosisverlaging of definitieve stopzetting van de behandeling vereisen (zie DOSERING EN ADMINISTRATIE ]. De meeste laboratoriumafwijkingen die tijdens de klinische studie werden opgemerkt, keerden kort na stopzetting van de behandeling terug naar het uitgangsniveau.
Bij patiënten die waren gerandomiseerd naar combinatietherapie, nam de incidentie van afwijkingen tijdens de gehele behandelingsfase (tot 48 weken plus 24 weken follow-up) in vergelijking met de eerste 24 weken licht toe voor neutrofielen tussen 500 en 1.000 cellen/mm³ en hemoglobinewaarden tussen 8,5 en 10 g/dL. De meeste hematologische afwijkingen traden op in de eerste 24 weken van de behandeling.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld en gemeld tijdens het gebruik van PEGASYS/COPEGUS 100 mg combinatietherapie na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed- en lymfestelselaandoeningen
Zuivere rode-cel-aplasie
Oor- en labyrintaandoeningen
Slechthorendheid, gehoorverlies
Oogaandoeningen
Serieuze netvliesloslating
Immuunstoornissen
Afstoting van lever- en niertransplantaat
Metabolisme en voedingsstoornissen
uitdroging
Huid- en onderhuidaandoeningen
Stevens-Johnson-syndroom (SJS)
Toxische epidermale necrolyse (TEN)
DRUG-INTERACTIES
Resultaten van een farmacokinetische substudie toonden geen farmacokinetische interactie aan tussen PEGASYS (peginterferon alfa-2a) en ribavirine.
Nucleoside reverse transcriptase-remmers (NRTI's)
In vitro-gegevens wijzen erop dat ribavirine de fosforylering van lamivudine, stavudine en zidovudine vermindert. Er werd echter geen farmacokinetische (bijv. plasmaconcentraties of intracellulaire trifosforyleerde concentraties van actieve metabolieten) of farmacodynamische (bijv. verlies van HIV/HCV-virologische onderdrukking) waargenomen wanneer ribavirine en lamivudine (n=18), stavudine (n=10), of zidovudine (n=6) werd gelijktijdig toegediend als onderdeel van een multidrugregime aan patiënten met een co-infectie met HCV/HIV.
In onderzoek NR15961 bij de patiënten met gelijktijdige CHC/HIV-infectie met cirrose die NRTI's kregen, werden gevallen van leverdecompensatie (sommige fataal) waargenomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Patiënten die PEGASYS/COPEGUS 100 mg en NRTI's krijgen, moeten nauwlettend worden gecontroleerd op met de behandeling samenhangende toxiciteiten. Artsen dienen de voorschrijfinformatie voor de respectieve NRTI's te raadplegen voor richtlijnen met betrekking tot het beheer van toxiciteit. Bovendien moet dosisverlaging of stopzetting van PEGASYS, COPEGUS 100 mg of beide ook worden overwogen als verergerende toxiciteiten worden waargenomen, waaronder leverdecompensatie (bijv. Child-Pugh groter dan of gelijk aan 6) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DOSERING EN ADMINISTRATIE ].
Didanosine
Gelijktijdige toediening van COPEGUS en didanosine is gecontra-indiceerd. De concentraties van didanosine of zijn actieve metaboliet (dideoxyadenosine 5'-trifosfaat) zijn verhoogd wanneer didanosine gelijktijdig wordt toegediend met ribavirine, wat klinische toxiciteit kan veroorzaken of verergeren. Meldingen van fataal leverfalen evenals perifere neuropathie, pancreatitis en symptomatische hyperlactatemie/melkzuuracidose zijn gemeld in klinische onderzoeken [zie CONTRA-INDICATIES ].
Zidovudine
In onderzoek NR15961 ontwikkelden patiënten die zidovudine kregen in combinatie met PEGASYS/COPEGUS vaker ernstige neutropenie (ANC minder dan 500) en ernstige anemie (hemoglobine minder dan 8 g/dl) dan vergelijkbare patiënten die geen zidovudine kregen (neutropenie 15% vs. 9%) (bloedarmoede 5% vs. 1%). Stopzetting van zidovudine moet als medisch passend worden beschouwd.
Geneesmiddelen gemetaboliseerd door cytochroom P450
In vitro-onderzoeken geven aan dat ribavirine CYP 2C9, CYP 2C19, CYP 2D6 of CYP 3A4 niet remt.
azathioprine
Van het gebruik van ribavirine voor de behandeling van chronische hepatitis C bij patiënten die azathioprine krijgen, is gemeld dat het ernstige pancytopenie veroorzaakt en het risico op azathioprine-gerelateerde myelotoxiciteit kan verhogen. Inosinemonofosfaatdehydrogenase (IMDH) is vereist voor een van de metabole routes van azathioprine. Van ribavirine is bekend dat het IMDH remt, wat leidt tot accumulatie van een azathioprine-metaboliet, 6-methylthioinosinemonofosfaat (6-MTITP), wat in verband wordt gebracht met myelotoxiciteit (neutropenie, trombocytopenie en anemie). Bij patiënten die azathioprine met ribavirine krijgen, moet het volledige bloedbeeld, inclusief het aantal bloedplaatjes, wekelijks worden gecontroleerd gedurende de eerste maand, tweemaal per maand gedurende de tweede en derde maand van de behandeling, daarna maandelijks of vaker als dosering of andere therapiewijzigingen nodig zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Significante bijwerkingen die verband houden met de combinatietherapie met COPEGUS/PEGASYS zijn onder meer ernstige depressie en zelfmoordgedachten, hemolytische anemie, onderdrukking van de beenmergfunctie, auto-immuunziekten en infectieuze aandoeningen, oftalmologische aandoeningen, cerebrovasculaire aandoeningen, longdisfunctie, colitis, pancreatitis en diabetes.
De bijsluiter van PEGASYS moet in zijn geheel worden doorgenomen voor aanvullende veiligheidsinformatie voordat met de combinatiebehandeling wordt begonnen.
Zwangerschap
COPEGUS 100 mg kan geboorteafwijkingen en/of de dood van de blootgestelde foetus veroorzaken. Ribavirine heeft significante teratogene en/of embryocidale effecten aangetoond bij alle diersoorten waarin adequate studies zijn uitgevoerd. Deze effecten traden op bij doses zo laag als een twintigste van de aanbevolen dosis ribavirine voor de mens.
De therapie met COPEGUS mag niet worden gestart tenzij onmiddellijk voorafgaand aan de geplande start van de therapie een negatieve zwangerschapstest is gemeld. Uiterste zorg moet worden betracht om zwangerschap bij vrouwelijke patiënten en bij vrouwelijke partners van mannelijke patiënten te voorkomen. Patiënten moeten worden geïnstrueerd om ten minste twee vormen van effectieve anticonceptie te gebruiken tijdens de behandeling en gedurende 6 maanden nadat de behandeling is gestopt. Zwangerschapstests moeten maandelijks plaatsvinden tijdens de COPEGUS 100 mg-therapie en gedurende 6 maanden nadat de therapie is gestopt [zie: GEVAARLIJKE WAARSCHUWING: , CONTRA-INDICATIES , Gebruik in specifieke populaties , en PATIËNT INFORMATIE ].
Bloedarmoede
De primaire toxiciteit van ribavirine is hemolytische anemie, die werd waargenomen bij ongeveer 13% van alle met COPEGUS/PEGASYS behandelde proefpersonen in klinische onderzoeken. Anemie geassocieerd met COPEGUS 100 mg treedt op binnen 1 tot 2 weken na aanvang van de therapie. Omdat de initiële daling in hemoglobine aanzienlijk kan zijn, wordt geadviseerd hemoglobine of hematocriet te verkrijgen voor de behandeling en in week 2 en week 4 van de therapie of vaker indien klinisch geïndiceerd. Patiënten moeten dan worden gevolgd zoals klinisch aangewezen. Voorzichtigheid is geboden bij het starten van de behandeling bij elke patiënt met een baselinerisico op ernstige anemie (bijv. sferocytose, voorgeschiedenis van gastro-intestinale bloeding) (zie DOSERING EN ADMINISTRATIE ].
Fatale en niet-fatale myocardinfarcten zijn gemeld bij patiënten met anemie veroorzaakt door COPEGUS. Patiënten moeten worden beoordeeld op onderliggende hartziekte voordat de behandeling met ribavirine wordt gestart. Bij patiënten met een reeds bestaande hartziekte dienen vóór de behandeling elektrocardiogrammen te worden toegediend en dienen deze tijdens de behandeling adequaat te worden gecontroleerd. Als er enige verslechtering van de cardiovasculaire status is, moet de therapie worden gestaakt of stopgezet [zie: DOSERING EN ADMINISTRATIE ]. Omdat hartaandoeningen kunnen verergeren door geneesmiddelgeïnduceerde bloedarmoede, mogen patiënten met een voorgeschiedenis van significante of onstabiele hartaandoeningen COPEGUS niet gebruiken [zie GEVAARLIJKE WAARSCHUWING: en DOSERING EN ADMINISTRATIE ].
Leverfalen
Patiënten met chronische hepatitis C (CHC) met cirrose lopen mogelijk risico op leverdecompensatie en overlijden wanneer ze worden behandeld met alfa-interferonen, waaronder PEGASYS. Cirrotische CHC-patiënten die gelijktijdig met hiv zijn geïnfecteerd en die zeer actieve antiretrovirale therapie (HAART) en interferon-alfa-2a met of zonder ribavirine krijgen, lijken een verhoogd risico te lopen op de ontwikkeling van leverdecompensatie in vergelijking met patiënten die geen HAART krijgen. In studie NR15961 [zie Klinische studies ], van de 129 CHC/HIV-cirrotische patiënten die HAART kregen, ontwikkelden 14 (11%) van deze patiënten in alle behandelarmen leverdecompensatie, resulterend in 6 sterfgevallen. Alle 14 patiënten kregen NRTI's, waaronder stavudine, didanosine, abacavir, zidovudine en lamivudine. Deze kleine aantallen patiënten laten geen onderscheid toe tussen specifieke NRTI's of het bijbehorende risico. Tijdens de behandeling moeten de klinische status en leverfunctie van de patiënt nauwlettend worden gecontroleerd op tekenen en symptomen van leverdecompensatie. De behandeling met PEGASYS/COPEGUS 100 mg moet onmiddellijk worden gestaakt bij patiënten met leverdecompensatie (zie CONTRA-INDICATIES ].
overgevoeligheid
Ernstige acute overgevoeligheidsreacties (bijv. urticaria, angio-oedeem, bronchoconstrictie en anafylaxie) zijn waargenomen tijdens behandeling met alfa-interferon en ribavirine. Als een dergelijke reactie optreedt, moet de behandeling met PEGASYS en COPEGUS 100 mg onmiddellijk worden stopgezet en moet een passende medische behandeling worden ingesteld. Ernstige huidreacties, waaronder vesiculobulleuze erupties, reacties in het spectrum van het Stevens-Johnson-syndroom (erythema multiforme major) met verschillende gradaties van huid- en slijmvliesaantasting en exfoliatieve dermatitis (erytrodermie) zijn gemeld bij patiënten die PEGASYS kregen met en zonder ribavirine. Patiënten die tekenen of symptomen van ernstige huidreacties ontwikkelen, moeten de behandeling stopzetten [zie: ONGEWENSTE REACTIES ].
Longaandoeningen
Dyspneu, longinfiltraten, pneumonitis, pulmonale hypertensie en pneumonie zijn gemeld tijdens behandeling met ribavirine en interferon. Incidentele gevallen van fatale pneumonie zijn opgetreden. Daarnaast is sarcoïdose of de verergering van sarcoïdose gemeld. Als er aanwijzingen zijn voor longinfiltraten of een verminderde longfunctie, moeten patiënten nauwlettend worden gecontroleerd en, indien van toepassing, moet de combinatiebehandeling met COPEGUS/PEGASYS worden stopgezet.
Beenmergsuppressie
In de literatuur is gemeld dat pancytopenie (aanzienlijke afname van rode bloedcellen, neutrofielen en bloedplaatjes) en beenmergsuppressie optreden binnen 3 tot 7 weken na gelijktijdige toediening van gepegyleerd interferon/ribavirine en azathioprine. Bij dit beperkte aantal patiënten (n=8) was myelotoxiciteit reversibel binnen 4 tot 6 weken na stopzetting van zowel antivirale HCV-therapie als gelijktijdige azathioprine en trad niet opnieuw op na herstart van een van beide behandelingen alleen. PEGASYS, COPEGUS 100 mg en azathioprine moeten worden stopgezet voor pancytopenie, en gepegyleerd interferon/ribavirine mag niet opnieuw worden geïntroduceerd met gelijktijdige toediening van azathioprine (zie DRUG-INTERACTIES ].
Pancreatitis
De therapie met COPEGUS en PEGASYS moet worden onderbroken bij patiënten met tekenen en symptomen van pancreatitis en worden stopgezet bij patiënten met bevestigde pancreatitis.
Impact op groei bij pediatrische patiënten
Tijdens combinatietherapie gedurende maximaal 48 weken met PEGASYS plus ribavirine werd groeiremming waargenomen bij pediatrische proefpersonen van 5 tot 17 jaar. Afnames in gewicht voor leeftijd z-score en lengte voor leeftijd z-score tot 48 weken therapie vergeleken met baseline werden waargenomen. Twee jaar na de behandeling was 16% van de pediatrische proefpersonen meer dan 15 percentielen onder hun baseline gewichtscurve en 11% meer dan 15 percentielen onder hun baseline lengtecurve.
De beschikbare gegevens op langere termijn over proefpersonen die tot 6 jaar na de behandeling werden gevolgd, zijn te beperkt om het risico van verminderde volwassen lengte bij sommige patiënten te bepalen [zie Ervaring in klinische studies ].
Laboratorium testen
Voordat met de combinatietherapie met PEGASYS/COPEGUS wordt begonnen, worden voor alle patiënten standaard hematologische en biochemische laboratoriumtests aanbevolen. Zwangerschapsscreening voor vrouwen die zwanger kunnen worden, moet worden uitgevoerd. Bij patiënten met reeds bestaande hartafwijkingen dienen elektrocardiogrammen te worden toegediend vóór de behandeling met PEGASYS/COPEGUS.
Na het starten van de therapie moeten hematologische tests worden uitgevoerd na 2 weken en 4 weken en biochemische tests moeten worden uitgevoerd na 4 weken. Tijdens de therapie moeten periodiek aanvullende tests worden uitgevoerd. In klinische onderzoeken bij volwassenen werden de CBC (inclusief hemoglobinegehalte en aantal witte bloedcellen en bloedplaatjes) en chemie (inclusief leverfunctietesten en urinezuur) gemeten na 1, 2, 4, 6 en 8 weken, en vervolgens elke 4 tot 6 weken of vaker als er afwijkingen werden gevonden. In de pediatrische klinische studie waren hematologische en chemische beoordelingen na 1, 3, 5 en 8 weken, daarna elke 4 weken. Schildklierstimulerend hormoon (TSH) werd elke 12 weken gemeten. Maandelijkse zwangerschapstests moeten worden uitgevoerd tijdens de combinatietherapie en gedurende 6 maanden na het staken van de therapie.
De toelatingscriteria die worden gebruikt voor de klinische onderzoeken naar COPEGUS 100 mg en PEGASYS kunnen worden beschouwd als richtlijn voor aanvaardbare uitgangswaarden voor het starten van de behandeling:
- Aantal bloedplaatjes hoger dan of gelijk aan 90.000 cellen/mm³ (slechts 75.000 cellen/mm³ bij HCV-patiënten met cirrose of 70.000 cellen/mm³ bij patiënten met CHC en HIV)
- Absoluut aantal neutrofielen (ANC) groter dan of gelijk aan 1500 cellen/mm³
- TSH en T4 binnen normale grenzen of adequaat gecontroleerde schildklierfunctie
- Aantal CD4+-cellen groter dan of gelijk aan 200 cellen/mm³ of aantal CD4+-cellen groter dan of gelijk aan 100 cellen/mm³ maar minder dan 200 cellen/mm³ en hiv-1-RNA minder dan 5.000 kopieën/ml bij patiënten die gelijktijdig met hiv zijn geïnfecteerd
- Hemoglobine groter dan of gelijk aan 12 g/dL voor vrouwen en groter dan of gelijk aan 13 g/dL voor mannen bij mono-geïnfecteerde CHC-patiënten
- Hemoglobine groter dan of gelijk aan 11 g/dL voor vrouwen en groter dan of gelijk aan 12 g/dL voor mannen bij patiënten met CHC en HIV
Informatie over patiëntbegeleiding
- Zien Door de FDA goedgekeurde patiëntetikettering (Medicatiegids)
Zwangerschap
Patiënten moeten worden geïnformeerd dat ribavirine geboorteafwijkingen en/of overlijden van de blootgestelde foetus kan veroorzaken. COPEGUS 100 mg-therapie mag niet worden gebruikt door vrouwen die zwanger zijn of door mannen van wie de vrouwelijke partners zwanger zijn. Uiterste zorg moet worden betracht om zwangerschap te voorkomen bij vrouwelijke patiënten en bij vrouwelijke partners van mannelijke patiënten die COPEGUS-therapie krijgen en gedurende 6 maanden na de therapie. Patiënten dienen twee betrouwbare anticonceptiemethoden te gebruiken tijdens de behandeling met COPEGUS en gedurende 6 maanden na de behandeling. De therapie met COPEGUS mag pas worden gestart als er een melding is gemaakt van een negatieve zwangerschapstest vlak voor de start van de therapie. Patiënten moeten maandelijks een zwangerschapstest uitvoeren tijdens de therapie en gedurende 6 maanden na de therapie.
Vrouwelijke patiënten die zwanger kunnen worden en mannelijke patiënten met vrouwelijke partners die zwanger kunnen worden, moeten worden geïnformeerd over de teratogene/embryocidale risico's en moeten worden geïnstrueerd om effectieve anticonceptie te gebruiken tijdens de behandeling met COPEGUS en gedurende 6 maanden na de behandeling. Patiënten moeten worden geadviseerd om de zorgverlener onmiddellijk op de hoogte te stellen in het geval van een zwangerschap [zie: CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bloedarmoede
De meest voorkomende bijwerking die verband houdt met ribavirine is bloedarmoede, die ernstig kan zijn [zie: GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ]. Patiënten moeten erop worden gewezen dat laboratoriumonderzoeken nodig zijn voordat de behandeling met COPEGUS wordt gestart en periodiek daarna [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Het wordt aanbevolen dat patiënten goed gehydrateerd zijn, vooral tijdens de beginfase van de behandeling.
Patiënten die duizeligheid, verwardheid, slaperigheid en vermoeidheid ontwikkelen, moeten worden gewaarschuwd geen auto te rijden of machines te bedienen.
Patiënten dienen te worden geadviseerd COPEGUS 100 mg met voedsel in te nemen.

Patiënten dienen te worden ondervraagd over de voorgeschiedenis van drugsmisbruik voordat met COPEGUS/PEGASYS wordt begonnen, aangezien een terugval van drugsverslaving en overdoses van drugs zijn gemeld bij patiënten die met interferonen werden behandeld.
Patiënten dienen te worden geadviseerd geen alcohol te drinken, aangezien alcohol een chronische hepatitis C-infectie kan verergeren.
Patiënten moeten worden geïnformeerd over wat ze moeten doen als ze een dosis COPEGUS overslaan. De gemiste doses moeten zo snel mogelijk op dezelfde dag worden ingenomen. Patiënten mogen de volgende dosis niet verdubbelen. Patiënten moeten worden geadviseerd om hun zorgverlener te bellen als ze vragen hebben.
Patiënten moeten worden geïnformeerd dat het effect van de behandeling van hepatitis C-infectie met PEGASYS/COPEGUS op de overdracht niet bekend is en dat passende voorzorgsmaatregelen moeten worden genomen om overdracht van het hepatitis C-virus tijdens de behandeling of in het geval van falen van de behandeling te voorkomen.
Patiënten moeten worden geïnformeerd over de mogelijke voordelen en risico's van het gebruik van COPEGUS. Er moeten instructies voor het juiste gebruik worden gegeven, inclusief beoordeling van de inhoud van de bijgevoegde MEDICIJNGIDS , wat geen openbaarmaking is van alle of mogelijke nadelige effecten.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
In een p53 (+/-) carcinogeniteitsonderzoek bij muizen tot de maximaal getolereerde dosis van 100 mg/kg/dag, was ribavirine niet oncogeen. Ribavirine was ook niet oncogeen in een 2 jaar durende carcinogeniteitsstudie bij ratten bij doses tot de maximaal getolereerde dosis van 60 mg/kg/dag. Op basis van het lichaamsoppervlak zijn deze doses respectievelijk ongeveer 0,5 en 0,6 maal de maximaal aanbevolen dagelijkse dosis ribavirine voor de mens.
Mutagenese
Ribavirine vertoonde mutagene activiteit in de in vitro muislymfoomtest. Er werd geen clastogene activiteit waargenomen in een in vivo micronucleustest bij muizen bij doses tot 2000 mg/kg. Resultaten van in de literatuur gepubliceerde onderzoeken tonen echter clastogene activiteit aan in de in vivo micronucleustest bij muizen bij orale doses tot 2000 mg/kg. Een dominante letale test bij ratten was negatief, wat aangeeft dat als mutaties bij ratten optraden, deze niet werden overgedragen via mannelijke gameten.
Aantasting van de vruchtbaarheid
In een vruchtbaarheidsonderzoek bij ratten liet ribavirine een marginale afname van het aantal zaadcellen zien bij een dosis van 100 mg/kg/dag zonder effect op de vruchtbaarheid. Na stopzetting van de behandeling trad volledig herstel op na 1 spermatogenesecyclus. Afwijkingen in het sperma werden waargenomen in onderzoeken bij muizen die waren opgezet om het tijdsverloop en de reversibiliteit van door ribavirine geïnduceerde testiculaire degeneratie te evalueren bij doses van 15 tot 150 mg/kg/dag (ongeveer 0,1 tot 0,8 keer de maximaal aanbevolen dagelijkse dosis ribavirine bij de mens) voor 3 tot 6 maanden. Na stopzetting van de behandeling was binnen 1 of 2 spermatogene cycli vrijwel volledig herstel van door ribavirine geïnduceerde testiculaire toxiciteit zichtbaar.
Vrouwelijke patiënten die zwanger kunnen worden en mannelijke patiënten met vrouwelijke partners die zwanger kunnen worden, mogen geen COPEGUS krijgen tenzij de patiënt en zijn/haar partner effectieve anticonceptie gebruiken (twee betrouwbare vormen). Op basis van een meervoudige halfwaardetijd (t) van ribavirine van 12 dagen, moet effectieve anticonceptie worden gebruikt gedurende 6 maanden na de behandeling (dwz 15 halfwaardetijden van klaring van ribavirine).
Er zijn geen reproductietoxiciteitsstudies uitgevoerd met PEGASYS in combinatie met COPEGUS. Echter, peginterferon alfa-2a en ribavirine hebben, wanneer ze afzonderlijk worden toegediend, elk nadelige effecten op de voortplanting. Aangenomen moet worden dat de effecten die door een van beide middelen alleen worden veroorzaakt, ook worden veroorzaakt door de combinatie van de twee middelen.
Gebruik bij specifieke populaties
Zwangerschap
Categorie X [zien CONTRA-INDICATIES ]. Ribavirine veroorzaakte significante embryocide en/of teratogene effecten bij alle diersoorten waarin adequate studies zijn uitgevoerd. Misvormingen van de schedel, het gehemelte, het oog, de kaak, de ledematen, het skelet en het maagdarmkanaal werden opgemerkt. De incidentie en ernst van teratogene effecten namen toe naarmate de dosis van het geneesmiddel werd verhoogd. Overleving van foetussen en nakomelingen was verminderd [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In conventionele embryotoxiciteits-/teratogeniteitsstudies bij ratten en konijnen waren de dosisniveaus zonder effect duidelijk lager dan die voor het voorgestelde klinische gebruik (0,3 mg/kg/dag voor zowel ratten als konijnen; ongeveer 0,06 maal de aanbevolen dagelijkse dosis ribavirine voor de mens) . Er werden geen maternale toxiciteit of effecten op nakomelingen waargenomen in een peri-/postnatale toxiciteitsstudie bij ratten die oraal werden gedoseerd tot 1 mg/kg/dag (ongeveer 0,01 maal de maximaal aanbevolen dagelijkse dosis ribavirine voor de mens).
Behandeling en nabehandeling: mogelijk risico voor de foetus
Van ribavirine is bekend dat het zich ophoopt in intracellulaire componenten van waaruit het zeer langzaam wordt geklaard. Het is niet bekend of ribavirine in sperma aanwezig is en zo ja, een mogelijk teratogeen effect zal hebben bij de bevruchting van de eicellen. Vanwege de mogelijke teratogene effecten van ribavirine bij de mens, moeten mannelijke patiënten echter worden geadviseerd alle voorzorgsmaatregelen te nemen om het risico op zwangerschap voor hun vrouwelijke partners te voorkomen.
COPEGUS mag niet worden gebruikt door zwangere vrouwen of mannen van wie de vrouwelijke partner zwanger is. Vrouwelijke patiënten die zwanger kunnen worden en mannelijke patiënten met vrouwelijke partners die zwanger kunnen worden, mogen geen COPEGUS krijgen tenzij de patiënt en zijn/haar partner effectieve anticonceptie gebruiken (twee betrouwbare vormen) tijdens de behandeling en gedurende 6 maanden na de behandeling [zie CONTRA-INDICATIES ].
Zwangerschapsregister van ribavirine
Er is een Ribavirine-zwangerschapsregister opgesteld om de maternale-foetale uitkomsten van zwangerschappen van vrouwelijke patiënten en vrouwelijke partners van mannelijke patiënten die zijn blootgesteld aan ribavirine tijdens de behandeling en gedurende 6 maanden na beëindiging van de behandeling, te controleren. Zorgverleners en patiënten worden aangemoedigd om dergelijke gevallen te melden door te bellen naar 1-800-593-2214.
Moeders die borstvoeding geven
Het is niet bekend of ribavirine wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden en om mogelijke ernstige bijwerkingen van ribavirine bij zuigelingen te voorkomen, moet worden besloten om de borstvoeding of de behandeling met COPEGUS 100 mg te staken, op basis van het belang van de therapie voor de moeder.
Pediatrisch gebruik
Farmacokinetische evaluaties bij pediatrische patiënten zijn niet uitgevoerd.
De veiligheid en werkzaamheid van COPEGUS zijn niet vastgesteld bij patiënten jonger dan 5 jaar.
Geriatrisch gebruik
Klinische onderzoeken met COPEGUS 100 mg en PEGASYS omvatten niet voldoende aantallen proefpersonen van 65 jaar of ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Specifieke farmacokinetische evaluaties voor ribavirine bij ouderen zijn niet uitgevoerd. Het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. De dosis COPEGUS 100 mg moet worden verlaagd bij patiënten met een creatinineklaring van minder dan of gelijk aan 50 ml/min; en de dosis PEGASYS moet worden verlaagd bij patiënten met een creatinineklaring van minder dan 30 ml/min [zie: DOSERING EN ADMINISTRATIE ; Gebruik bij specifieke populaties ].
Ras
Een farmacokinetisch onderzoek bij 42 proefpersonen toonde aan dat er geen klinisch significant verschil is in de farmacokinetiek van ribavirine tussen zwarte (n=14), Spaanse (n=13) en blanke (n=15) proefpersonen.
Nierfunctiestoornis
De nierfunctie moet bij alle patiënten worden geëvalueerd voordat met COPEGUS wordt gestart door de creatinineklaring van de patiënt te schatten.
Een klinische studie evalueerde de behandeling met COPEGUS en PEGASYS bij 50 CHC-patiënten met matige (creatinineklaring 30 – 50 ml/min) of ernstige (creatinineklaring minder dan 30 ml/min) nierfunctiestoornis of terminale nierziekte (ESRD) die chronische hemodialyse nodig hadden (HD). Bij 18 proefpersonen met ESRD die chronische ZvH kregen, werd COPEGUS toegediend in een dosis van 200 mg per dag zonder duidelijk verschil in het bijwerkingenprofiel in vergelijking met proefpersonen met een normale nierfunctie. Dosisverlagingen en tijdelijke onderbrekingen van COPEGUS (vanwege COPEGUS-gerelateerde bijwerkingen, voornamelijk anemie) werden waargenomen bij maximaal een derde van de ESRD/HD-patiënten tijdens de behandeling; en slechts een derde van deze proefpersonen kreeg COPEGUS gedurende 48 weken. De plasmablootstelling aan ribavirine was ongeveer 20% lager bij proefpersonen met ESRD op de ZvH in vergelijking met proefpersonen met een normale nierfunctie die de standaard dagelijkse dosis COPEGUS 1000/1200 mg kregen.
Patiënten met een matige (n=17) of ernstige (n=14) nierfunctiestoornis verdroegen respectievelijk geen 600 mg of 400 mg dagelijkse doses COPEGUS vanwege COPEGUS-gerelateerde bijwerkingen, voornamelijk anemie, en vertoonden 20% tot 30% hogere plasmablootstellingen aan ribavirine (ondanks frequente dosisaanpassingen) in vergelijking met proefpersonen met een normale nierfunctie (creatinineklaring hoger dan 80 ml/min) die de standaarddosis COPEGUS kregen. Het aantal stopzettingen was hoger bij proefpersonen met ernstige nierinsufficiëntie in vergelijking met die waargenomen bij proefpersonen met matige nierinsufficiëntie of normale nierfunctie. Farmacokinetische modellen en simulatie geven aan dat een dosis van 200 mg per dag bij patiënten met een ernstige nierfunctiestoornis en een dosis van 200 mg per dag afgewisseld met 400 mg de volgende dag bij patiënten met een matige nierfunctiestoornis, een plasma-ribavirineblootstelling oplevert die vergelijkbaar is met die van patiënten met een normale nierfunctie het ontvangen van het goedgekeurde regime van COPEGUS. Deze doses zijn niet onderzocht bij patiënten [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Op basis van de farmacokinetische en veiligheidsresultaten van dit onderzoek dienen patiënten met een creatinineklaring van minder dan of gelijk aan 50 ml/min een verlaagde dosis COPEGUS te krijgen; en patiënten met een creatinineklaring van minder dan 30 ml/min dienen een verlaagde dosis PEGASYS te krijgen. De klinische en hematologische status van patiënten met een creatinineklaring van minder dan of gelijk aan 50 ml/min die COPEGUS 100 mg krijgen, moet zorgvuldig worden gecontroleerd. Bij patiënten met klinisch significante laboratoriumafwijkingen of bijwerkingen die aanhoudend ernstig zijn of verergeren, moet de behandeling worden stopgezet [zie: DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE , en PEGASYS-bijsluiter ].
Leverfunctiestoornis
Het effect van leverinsufficiëntie op de farmacokinetiek van ribavirine na toediening van COPEGUS is niet onderzocht. De klinische onderzoeken met COPEGUS 100 mg waren beperkt tot patiënten met de ziekte van Child-Pugh klasse A.
Geslacht
Er werden geen klinisch significante verschillen in de farmacokinetiek van ribavirine waargenomen tussen mannelijke en vrouwelijke proefpersonen.
De farmacokinetiek van ribavirine, gecorrigeerd voor gewicht, is vergelijkbaar bij mannelijke en vrouwelijke patiënten.
Ontvangers van orgaantransplantaties
De veiligheid en werkzaamheid van behandeling met PEGASYS en COPEGUS 100 mg zijn niet vastgesteld bij patiënten met lever- en andere transplantaties. Net als bij andere alfa-interferonen zijn afstotingen van lever- en niertransplantaten gemeld bij PEGASYS, alleen of in combinatie met COPEGUS (zie ONGEWENSTE REACTIES ].
OVERDOSERING
Er zijn in klinische onderzoeken geen gevallen van overdosering met COPEGUS gemeld. Hypocalciëmie en hypomagnesiëmie zijn waargenomen bij personen die meer dan de aanbevolen dosering ribavirine kregen toegediend. In de meeste van deze gevallen werd ribavirine intraveneus toegediend in doseringen tot en in sommige gevallen hoger dan viermaal de aanbevolen maximale orale dagelijkse dosis.
CONTRA-INDICATIES
COPEGUS (ribavirine) is gecontra-indiceerd bij:
- Vrouwen die zwanger zijn. COPEGUS kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. COPEGUS is gecontra-indiceerd bij vrouwen die zwanger zijn of kunnen worden. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de foetus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties , en PATIËNT INFORMATIE ].
- Mannen van wie de vrouwelijke partners zwanger zijn.
- Patiënten met hemoglobinopathieën (bijv. thalassemie major of sikkelcelanemie).
- In combinatie met didanosine. Meldingen van fataal leverfalen, evenals perifere neuropathie, pancreatitis en symptomatische hyperlactatemie/melkzuuracidose zijn gemeld in klinische onderzoeken [zie DRUG-INTERACTIES ].
Combinatietherapie met COPEGUS en PEGASYS is gecontra-indiceerd bij patiënten met:
- Auto-immuun hepatitis.
- Leverdecompensatie (Child-Pugh-score hoger dan 6; klasse B en C) bij cirrotische CHC mono-geïnfecteerde patiënten vóór de behandeling [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Leverdecompensatie (Child-Pugh-score groter dan of gelijk aan 6) bij cirrotische CHC-patiënten die vóór de behandeling gelijktijdig met hiv waren geïnfecteerd [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Ribavirine is een antiviraal middel [zie Microbiologie ].
Farmacokinetiek
Er zijn farmacokinetische gegevens van meervoudige doses ribavirine beschikbaar voor HCV-patiënten die ribavirine kregen in combinatie met peginterferon alfa-2a. Na toediening van 1200 mg/dag met voedsel gedurende 12 weken was de gemiddelde ±SD (n=39; lichaamsgewicht hoger dan 75 kg) de AUC0-12u 25.361±7110 ng·u/ml en de Cmax was 2748±818 ng/ml. De gemiddelde tijd om Cmax te bereiken was 2 uur. Dalconcentraties van ribavirine in plasma na 12 weken toediening met voedsel waren 1662±545 ng/ml bij met HCV geïnfecteerde patiënten die 800 mg/dag kregen (n=89), en 2112±810 ng/ml bij patiënten die 1200 mg/dag kregen ( n=75; lichaamsgewicht groter dan 75 kg).
De terminale halfwaardetijd van ribavirine na toediening van een enkelvoudige orale dosis COPEGUS is ongeveer 120 tot 170 uur. De totale schijnbare klaring na toediening van een enkelvoudige orale dosis COPEGUS 100 mg is ongeveer 26 l/u. Er is een uitgebreide accumulatie van ribavirine na meervoudige dosering (tweemaal daags), zodat de Cmax bij steady-state viermaal hoger was dan die van een enkele dosis.
Effect van voedsel op de absorptie van ribavirine
De biologische beschikbaarheid van een enkele orale dosis ribavirine werd verhoogd door gelijktijdige toediening met een vetrijke maaltijd. De absorptie werd vertraagd (Tmax was verdubbeld) en de AUC0-192h en Cmax stegen met respectievelijk 42% en 66% wanneer COPEGUS werd ingenomen met een vetrijke maaltijd in vergelijking met nuchtere omstandigheden (zie DOSERING EN ADMINISTRATIE en PATIËNT INFORMATIE ].
Eliminatie en metabolisme
De bijdrage van de nier- en leverroutes aan de eliminatie van ribavirine na toediening van COPEGUS 100 mg is niet bekend. In vitro-onderzoeken geven aan dat ribavirine geen substraat is van CYP450-enzymen.
Nierfunctiestoornis
Een klinische studie evalueerde 50 CHC-patiënten met ofwel een matige (creatinineklaring 30 tot 50 ml/min) of ernstige (creatinineklaring minder dan 30 ml/min) nierfunctiestoornis of terminale nierziekte (ESRD) die chronische hemodialyse (HD) vereisten. De schijnbare klaring van ribavirine was verminderd bij proefpersonen met een creatinineklaring van minder dan of gelijk aan 50 ml/min, inclusief proefpersonen met ESRD op de ZvH, en vertoonde ongeveer 30% van de waarde die werd gevonden bij proefpersonen met een normale nierfunctie. Farmacokinetische modellering en simulatie geven aan dat een dosis van 200 mg per dag bij patiënten met een ernstige nierfunctiestoornis en een dosis van 200 mg per dag afgewisseld met 400 mg de volgende dag bij patiënten met een matige nierfunctiestoornis, plasma-ribavirineblootstellingen oplevert die vergelijkbaar zijn met die waargenomen bij patiënten met normale nierfunctie die de standaard dagelijkse dosis COPEGUS 1000/1200 mg krijgt. Deze doses zijn niet onderzocht bij patiënten.
Bij 18 proefpersonen met ESRD die chronische ZvH kregen, werd COPEGUS toegediend in een dosis van 200 mg per dag. De plasmablootstelling aan ribavirine bij deze proefpersonen was ongeveer 20% lager in vergelijking met proefpersonen met een normale nierfunctie die de standaard dagelijkse dosis COPEGUS 1000/1200 mg kregen (zie DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ].
Plasma-ribavirine wordt verwijderd door hemodialyse met een extractieverhouding van ongeveer 50%; vanwege het grote distributievolume van ribavirine wordt echter niet verwacht dat de plasmablootstelling verandert bij hemodialyse.
Microbiologie
Werkingsmechanisme
Het mechanisme waarmee ribavirine bijdraagt aan zijn antivirale werkzaamheid in de kliniek is niet volledig begrepen. Ribavirine heeft directe antivirale activiteit in weefselkweek tegen veel RNA-virussen. Ribavirine verhoogt de mutatiefrequentie in de genomen van verschillende RNA-virussen en ribavirinetrifosfaat remt HCV-polymerase in een biochemische reactie.
Antivirale activiteit in celcultuur
In het stabiele HCV-celcultuurmodelsysteem (HCV-replicon) remde ribavirine de autonome HCV-RNA-replicatie met een 50% effectieve concentratie (EC50)-waarde van 11-21 mcM. In hetzelfde model remde PEG-IFN α-2a ook HCV-RNA-replicatie, met een EC50-waarde van 0,1-3 ng/ml. De combinatie van PEG-IFN α-2a en ribavirine was effectiever in het remmen van HCV-RNA-replicatie dan elk middel afzonderlijk.
Weerstand
Verschillende HCV-genotypen vertonen een aanzienlijke klinische variabiliteit in hun respons op PEG-IFN-α- en ribavirinetherapie. Virale genetische determinanten die verband houden met de variabele respons zijn niet definitief geïdentificeerd.
Kruisweerstand
Kruisresistentie tussen IFN α en ribavirine is niet waargenomen.
Dierlijke toxicologie
In een onderzoek bij ratten werd geconcludeerd dat dominante letaliteit niet werd geïnduceerd door ribavirine in doses tot 200 mg/kg gedurende 5 dagen (tot 1,7 maal de maximaal aanbevolen dosis ribavirine voor de mens).
Langdurige onderzoeken bij muizen en ratten (18 tot 24 maanden; dosis respectievelijk 20 tot 75 en 10 tot 40 mg/kg/dag, ongeveer 0,1 tot 0,4 maal de maximale dagelijkse dosis ribavirine voor de mens) hebben een verband aangetoond tussen chronische blootstelling aan ribavirine en een verhoogde incidentie van vasculaire laesies (microscopische bloedingen) bij muizen. Bij ratten trad retinale degeneratie op bij controles, maar de incidentie was verhoogd bij met ribavirine behandelde ratten.
Klinische studies
Chronische hepatitis C-patiënten
Volwassen patiënten
De veiligheid en werkzaamheid van PEGASYS in combinatie met COPEGUS voor de behandeling van hepatitis C-virusinfectie werden beoordeeld in twee gerandomiseerde gecontroleerde klinische onderzoeken. Alle patiënten waren volwassenen, hadden een gecompenseerde leverziekte, detecteerbaar hepatitis C-virus, leverbiopsie diagnose van chronische hepatitis, en waren niet eerder behandeld met interferon. Ongeveer 20% van de patiënten in beide onderzoeken had gecompenseerde cirrose (Child-Pugh-klasse A). Patiënten met een co-infectie met HIV werden uitgesloten van deze onderzoeken.
In onderzoek NV15801 werden patiënten gerandomiseerd om ofwel PEGASYS 180 mcg subcutaan eenmaal per week met een orale placebo, PEGASYS 180 mcg eenmaal per week met COPEGUS 1000 mg oraal (lichaamsgewicht minder dan 75 kg) of 1200 mg oraal (lichaamsgewicht groter dan of gelijk aan 75 kg) of interferon-alfa-2b 3 MIU subcutaan driemaal per week plus ribavirine 1000 mg of 1200 mg oraal. Alle patiënten kregen 48 weken therapie gevolgd door 24 weken behandelingsvrije follow-up. De toewijzing van de COPEGUS- of placebobehandeling was geblindeerd. Aanhoudende virologische respons werd gedefinieerd als niet-detecteerbaar (minder dan 50 IE/ml) HCV-RNA in of na onderzoeksweek 68. PEGASYS in combinatie met COPEGUS 100 mg resulteerde in een hogere SVR vergeleken met PEGASYS alleen of interferon-alfa-2b en ribavirine (Tabel 9) . In alle behandelingsarmen hadden patiënten met viraal genotype 1, ongeacht de virale belasting, een lagere respons op PEGASYS in combinatie met COPEGUS 100 mg in vergelijking met patiënten met andere virale genotypen.
Het verschil in algehele respons op de behandeling (PEGASYS/COPEGUS – Interferon-alfa-2b/ribavirine) was 9% (95% BI 2,3; 15,3).
In onderzoek NV15942 kregen alle patiënten PEGASYS 180 mcg subcutaan eenmaal per week en werden gerandomiseerd naar behandeling gedurende 24 of 48 weken en naar een COPEGUS-dosis van 800 mg of 1000 mg/1200 mg (voor een lichaamsgewicht van minder dan 75 kg/meer dan of gelijk aan 75 kg). De toewijzing aan de vier behandelingsarmen werd gestratificeerd naar viraal genotype en baseline HCV-virale titer. Patiënten met genotype 1 en hoge virale titer (gedefinieerd als meer dan 2 x 106 HCV-RNA-kopieën/ml serum) werden bij voorkeur toegewezen aan een behandeling van 48 weken.
Aanhoudende virologische respons (SVR) en HCV-genotype
HCV 1 en 4 — Ongeacht de virale titer bij aanvang resulteerde behandeling gedurende 48 weken met PEGASYS en 1000 mg of 1200 mg COPEGUS in een hogere SVR (gedefinieerd als niet-detecteerbaar HCV-RNA aan het einde van de 24 weken durende behandelingsvrije follow-upperiode) in vergelijking met een kortere behandeling (24 weken) en/of 800 mg COPEGUS.
HCV 2 en 3 — Ongeacht de virale titer bij aanvang resulteerde behandeling gedurende 24 weken met PEGASYS en 800 mg COPEGUS in een vergelijkbare SVR in vergelijking met een langere behandeling (48 weken) en/of 1000 mg of 1200 mg COPEGUS (zie tabel 10).
Het aantal patiënten met genotype 5 en 6 was te klein om een zinvolle beoordeling mogelijk te maken.
Pediatrische patiënten
Eerder onbehandelde pediatrische patiënten van 5 tot en met 17 jaar (55% jonger dan 12 jaar) met chronische hepatitis C, gecompenseerde leverziekte en detecteerbaar HCV-RNA werden behandeld met COPEGUS 100 mg ongeveer 15 mg/kg/dag plus PEGASYS 180 mcg/1,73 m² x lichaamsoppervlak eenmaal per week gedurende 48 weken. Alle proefpersonen werden 24 weken na de behandeling gevolgd. Aanhoudende virologische respons (SVR) werd gedefinieerd als niet-detecteerbaar (minder dan 50 IE/ml) HCV-RNA in of na studieweek 68. In totaal werden 114 proefpersonen gerandomiseerd om ofwel een combinatiebehandeling van COPEGUS plus PEGASYS of PEGASYS monotherapie te krijgen; proefpersonen bij wie PEGASYS-monotherapie na 24 weken of later faalde, konden open-label COPEGUS plus PEGASYS krijgen. De aanvankelijke gerandomiseerde armen waren gebalanceerd voor demografische factoren; 55 proefpersonen kregen een initiële combinatiebehandeling van COPEGUS 100 mg plus PEGASYS en 59 kregen PEGASYS plus placebo; in de totale intent-to-treat-populatie was 45% vrouw, 80% was blank en 81% was geïnfecteerd met HCV-genotype 1. De SVR-resultaten zijn samengevat in Tabel 11.
Andere voorspellers van behandelingsrespons
De responspercentages op de behandeling zijn lager bij patiënten met slechte prognostische factoren die gepegyleerde interferon-alfatherapie krijgen. In onderzoeken NV15801 en NV15942 waren de responspercentages op de behandeling lager bij patiënten ouder dan 40 jaar (50% vs. 66%), bij patiënten met cirrose (47% vs. 59%), bij patiënten die meer dan 85 kg wogen (49% vs. 60%), en bij patiënten met genotype 1 met hoge vs. lage viral load (43% vs. 56%). Afro-Amerikaanse patiënten hadden lagere responspercentages in vergelijking met blanken.
In onderzoeken NV15801 en NV15942 was het ontbreken van een vroege virologische respons na 12 weken (gedefinieerd als HCV-RNA niet-detecteerbaar of meer dan 2 log10 lager dan de uitgangswaarde) reden voor stopzetting van de behandeling. Van de patiënten die na 12 weken geen vroege virale respons hadden en een aanbevolen behandelingskuur hadden voltooid ondanks een in het protocol gedefinieerde optie om de therapie te beëindigen, bereikte 5/39 (13%) een SVR. Van de patiënten die na 24 weken geen vroege virale respons hadden, voltooiden 19 een volledige therapiekuur en geen enkele bereikte een SVR.
Patiënten met chronische hepatitis C/HIV-coïnfectie
In onderzoek NR15961 werden patiënten met CHC/HIV gerandomiseerd om ofwel PEGASYS 180 mcg subcutaan eenmaal per week plus een orale placebo, PEGASYS 180 mcg eenmaal per week plus COPEGUS 800 mg per dag oraal of interferon alfa-2a, 3 MIU subcutaan driemaal per week te krijgen. plus COPEGUS 800 mg per dag via de mond. Alle patiënten kregen 48 weken therapie en aanhoudende virologische respons (SVR) werd beoordeeld na 24 weken behandelingsvrije follow-up. De behandelingstoewijzing met COPEGUS 100 mg of placebo was geblindeerd in de PEGASYS-behandelingsarmen. Alle patiënten waren volwassenen, hadden een gecompenseerde leverziekte, detecteerbaar hepatitis C-virus, leverbiopsie diagnose van chronische hepatitis C, en waren niet eerder behandeld met interferon. Patiënten hadden ook een CD4+-celtelling van meer dan of gelijk aan 200 cellen/mm³ of een CD4+-celtelling van meer dan of gelijk aan 100 cellen/mm³ maar minder dan 200 cellen/mm³ en hiv-1-RNA van minder dan 5000 kopieën/ml, en stabiele status van hiv. Ongeveer 15% van de patiënten in de studie had cirrose. De resultaten worden getoond in Tabel 12.
De responspercentages op de behandeling waren lager bij CHC/HIV-patiënten met slechte prognostische factoren (waaronder HCV-genotype 1, HCV-RNA groter dan 800.000 IE/ml en cirrose) die gepegyleerde interferon-alfatherapie kregen.
Van de patiënten die geen niet-detecteerbaar HCV-RNA of een verlaging van ten minste 2 log10 ten opzichte van de uitgangswaarde van de HCV-RNA-titer vertoonden na 12 weken combinatietherapie met PEGASYS en COPEGUS, bereikte 2% (2/85) een SVR.
Bij CHC-patiënten met gelijktijdige hiv-infectie die 48 weken PEGASYS alleen of in combinatie met COPEGUS 100 mg behandeling kregen, stegen de gemiddelde en mediane hiv-RNA-titers niet boven de uitgangswaarde tijdens de behandeling of 24 weken na de behandeling.
PATIËNT INFORMATIE
COPEGUS® (Co-PEG-UHS) (ribavirine) tabletten
Lees deze medicatiehandleiding zorgvuldig door voordat u start met het gebruik van COPEGUS 100 mg en lees de medicatiehandleiding elke keer dat u meer COPEGUS krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of uw behandeling.
Lees ook de medicatiehandleiding voor PEGASYS (peginterferon alfa-2a).
Wat is de belangrijkste informatie die ik over COPEGUS moet weten?
- Vrouwen moeten een zwangerschapstest ondergaan voordat ze met COPEGUS beginnen, elke maand tijdens de behandeling met COPEGUS 100 mg, en elke maand gedurende de 6 maanden na de behandeling met COPEGUS.
- Als u of uw vrouwelijke seksuele partner zwanger wordt Vertel het uw zorgverlener meteen terwijl u COPEGUS 100 mg gebruikt of binnen 6 maanden nadat u bent gestopt met het innemen van COPEGUS. U of uw zorgverlener dient contact op te nemen met de Ribavirine Zwangerschapsregister door te bellen naar 1-800-593-2214. Het Ribavirine Zwangerschapsregister verzamelt informatie over wat er met moeders en hun baby's gebeurt als de moeder COPEGUS gebruikt terwijl ze zwanger is.
Wat is Copegus 100 mg?
COPEGUS 100 mg is een receptgeneesmiddel dat samen met een ander geneesmiddel genaamd PEGASYS (peginterferon alfa-2a) wordt gebruikt voor de behandeling van chronische (langdurige) hepatitis C-infectie bij mensen van 5 jaar en ouder bij wie de lever nog normaal werkt en die niet eerder zijn behandeld met een geneesmiddel dat interferon-alfa wordt genoemd. Het is niet bekend of COPEGUS veilig is en zal werken bij kinderen jonger dan 5 jaar.
Wie mag COPEGUS 100 mg niet gebruiken?
Zien "Wat is de belangrijkste informatie die ik moet weten over COPEGUS 100 mg?"
Gebruik COPEGUS niet als u:
- bepaalde vormen van hepatitis hebben veroorzaakt doordat uw immuunsysteem uw lever aanvalt (auto-immuunhepatitis)
- bepaalde bloedaandoeningen heeft, zoals thalassemie major of sikkelcelanemie (hemoglobinopathieën)
- neem didanosine (Videx of Videx EG)
Neem contact op met uw zorgverlener voordat u begint met de behandeling met COPEGUS 100 mg als u een van deze medische aandoeningen heeft.
Wat moet ik mijn zorgverlener vertellen voordat ik Copegus 100 mg inneem?
Vertel uw zorgverlener voordat u Copegus inneemt als u een van de volgende aandoeningen heeft of heeft gehad:
- behandeling voor hepatitis C die bij u niet werkte
- ernstige allergische reacties op COPEGUS of op een van de bestanddelen van COPEGUS. Zie het einde van deze medicatiehandleiding voor een lijst met ingrediënten.
- ademhalingsproblemen. COPEGUS 100 mg kan uw reeds bestaande ademhalingsproblemen veroorzaken of verergeren.
- zichtproblemen. COPEGUS kan oogproblemen veroorzaken of oogproblemen die u al heeft, verergeren. U moet een oogonderzoek ondergaan voordat u begint met de behandeling met Copegus.
- bepaalde bloedaandoeningen zoals bloedarmoede
- hoge bloeddruk, hartproblemen of een hartaanval heeft gehad. Uw zorgverlener moet uw bloed en hart testen voordat u begint met de behandeling met COPEGUS.
- schildklier problemen
- suikerziekte. Combinatietherapie met COPEGUS 100 mg en PEGASYS kan uw diabetes verergeren of moeilijker te behandelen maken.
- leverproblemen anders dan hepatitis C-virusinfectie
- humaan immunodeficiëntievirus (hiv) of andere immuniteitsproblemen
- mentale gezondheidsproblemen, inclusief depressie of zelfmoordgedachten
- nierproblemen
- een orgaantransplantatie
- drugsverslaving of -misbruik
- infectie met hepatitis B-virus
- een andere medische aandoening
- zijn borstvoeding. Het is niet bekend of COPEGUS 100 mg in uw moedermelk terechtkomt. U en uw zorgverlener moeten beslissen of u Copegus of borstvoeding gaat gebruiken.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Sommige geneesmiddelen kunnen ernstige bijwerkingen veroorzaken als ze worden ingenomen terwijl u ook COPEGUS gebruikt. Sommige geneesmiddelen kunnen de werking van COPEGUS 100 mg beïnvloeden of COPEGUS 100 mg kan de werking van uw andere geneesmiddelen beïnvloeden.
Vertel het uw zorgverlener vooral als u geneesmiddelen gebruikt om hiv te behandelen, waaronder didanosine (Videx of Videx EC), of als u azathioprine (Imuran of Azasan) gebruikt.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw zorgverlener of apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik Copegus 100 mg innemen?
- Neem COPEGUS precies in zoals uw zorgverlener u dat vertelt. Uw zorgverlener zal u vertellen hoeveel COPEGUS u moet innemen en wanneer u het moet innemen. Voor kinderen van 5 jaar en ouder zal uw zorgverlener de dosis COPEGUS 100 mg voorschrijven op basis van het gewicht.
- Neem COPEGUS in met voedsel.
- Als u een dosis COPEGUS 100 mg bent vergeten, neem dan de vergeten dosis zo snel mogelijk op dezelfde dag in. Verdubbel de volgende dosis niet. Als u vragen heeft over wat u moet doen, bel dan uw zorgverlener.
- Als u te veel COPEGUS 100 mg heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of het plaatselijke Antigifcentrum, of ga meteen naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis.
- Uw zorgverlener moet bloedonderzoek doen voordat u begint met de behandeling met COPEGUS, in week 2 en 4 van de behandeling, en daarna indien nodig om te zien hoe goed u de behandeling verdraagt en om te controleren op bijwerkingen. Uw zorgverlener kan uw dosis COPEGUS 100 mg wijzigen op basis van bloedtestresultaten of bijwerkingen die u mogelijk heeft.
- Als u hartproblemen heeft, moet uw zorgverlener uw hart controleren door een elektrocardiogram te maken voordat u met de behandeling met COPEGUS begint, en indien nodig tijdens de behandeling.
Wat moet ik vermijden tijdens het gebruik van COPEGUS?
Copegus 100 mg kan u moe, duizelig of verward maken. U mag niet autorijden of machines bedienen als u een van deze symptomen heeft.
Drink geen alcohol, inclusief bier, wijn en sterke drank. Dit kan uw leverziekte verergeren.
Wat zijn de mogelijke bijwerkingen van COPEGUS?
COPEGUS 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
Zie "Wat is de belangrijkste informatie die ik moet weten over COPEGUS 100 mg?"
- Zwelling en irritatie van uw alvleesklier (pancreatitis). U kunt last hebben van maagpijn, misselijkheid, braken of diarree.
- Ernstige allergische reacties. Symptomen kunnen zijn: netelroos, piepende ademhaling, moeite met ademhalen, pijn op de borst, zwelling van uw mond, tong of lippen, of ernstige huiduitslag.
- Ernstige ademhalingsproblemen. Ademhalingsmoeilijkheden kunnen een teken zijn van een ernstige longinfectie (pneumonie) die tot de dood kan leiden.
- Ernstige oogproblemen dat kan leiden tot verlies van gezichtsvermogen of blindheid.
- Lever problemen. Bij sommige mensen kan de leverfunctie verslechteren. Vertel het uw zorgverlener meteen als u een van deze symptomen heeft: opgeblazen gevoel, verwardheid, bruine urine en gele ogen.
- Ernstige depressie
- Suïcidale gedachten en pogingen
- Effect op de groei bij kinderen. Kinderen kunnen een vertraging in gewichtstoename en lengtetoename ervaren tijdens de behandeling met PEGASYS en COPEGUS. Een inhaalslag in de groei vindt plaats nadat de behandeling is gestopt, maar sommige kinderen bereiken mogelijk niet de hoogte die ze vóór de behandeling hadden verwacht. Neem contact op met uw zorgverlener als u zich zorgen maakt over de groei van uw kind tijdens de behandeling met PEGASYS en COPEGUS.
Bel uw zorgverlener of zoek onmiddellijk medische hulp als u een van de hierboven genoemde symptomen heeft. Dit kunnen tekenen zijn van een ernstige bijwerking van de behandeling met COPEGUS 100 mg.
Vaak voorkomende bijwerkingen van COPEGUS in combinatie met PEGASYS zijn onder meer:
- griepachtige symptomen - moe voelen, hoofdpijn, trillen met hoge temperatuur (koorts) en spier- of gewrichtspijn
- stemmingswisselingen, prikkelbaarheid, angst en slaapproblemen
- verlies van eetlust, misselijkheid, braken en diarree
- haaruitval
- jeuk
Vertel uw zorgverlener over elke bijwerking die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van de behandeling met COPEGUS. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
U kunt bijwerkingen ook melden aan Genentech op 1-888-835-2555.
Hoe moet ik COPEGUS 100 mg bewaren?
- Bewaar COPEGUS-tabletten tussen 59 ° F en 86 ° F (15 ° C en 30 ° C).
- Houd de fles goed gesloten.
Houd COPEGUS 100 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van COPEGUS
Het is niet bekend of behandeling met COPEGUS 100 mg in combinatie met PEGASYS zal voorkomen dat een geïnfecteerde persoon het hepatitis C-virus tijdens de behandeling naar een andere persoon verspreidt.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik COPEGUS 100 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef COPEGUS niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiehandleiding vat de belangrijkste informatie over COPEGUS samen. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over COPEGUS die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in COPEGUS 100 mg?
Actief bestanddeel: ribavirine
Inactieve ingrediënten: De kern van de tablet bevat voorgegelatineerd zetmeel, microkristallijne cellulose, natriumzetmeelglycolaat, maïszetmeel en magnesiumstearaat. Het omhulsel van de tablet bevat Chromatone-P of Opadry Pink (gemaakt met behulp van hydroxypropylmethylcellulose, talk, titaniumdioxide, synthetisch geel ijzeroxide en synthetisch rood ijzeroxide), ethylcellulose (ECD-30) en triacetine.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
