Clozaril 25mg, 50mg, 100mg Clozapine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Clozaril en hoe wordt het gebruikt?
Clozaril 100 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van schizofrenie te behandelen. Clozaril 50 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Clozaril 100 mg behoort tot een klasse geneesmiddelen die antipsychotica, 2e generatie wordt genoemd.
Het is niet bekend of Clozapine 25 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Clozaril?
Clozapine kan ernstige bijwerkingen veroorzaken, waaronder:
- zwakheid,
- koorts,
- gezwollen tandvlees,
- keelpijn,
- pijnlijke zweertjes in de mond,
- pijn bij het slikken,
- huidzweren,
- verkoudheids- of griepsymptomen,
- hoesten,
- moeite met ademhalen,
- oncontroleerbare spierbewegingen van uw lippen, tong, ogen, gezicht, armen of benen,
- hoofdpijn met pijn op de borst en ernstige duizeligheid,
- bonzende hartslagen,
- fladderend in je borst,
- duizeligheid,
- plotselinge hoest,
- snel ademhalen,
- bloed ophoesten,
- strak gevoel in uw nek of kaak,
- spiertrekkingen of oncontroleerbare spierbewegingen,
- toevallen (black-out of convulsies),
- weinig of geen plassen,
- zwelling in uw voeten of enkels,
- vermoeidheid,
- kortademigheid,
- misselijkheid,
- pijn in de bovenbuik,
- verlies van eetlust,
- ongewone bloeding,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- zeer stijve (starre) spieren,
- hoge koorts,
- zweten,
- verwardheid,
- snelle of onregelmatige hartslagen,
- trillingen,
- verhoogde dorst,
- meer plassen,
- honger,
- droge mond,
- fruitige ademgeur,
- slaperigheid,
- droge huid,
- wazig zien,
- gewichtsverlies,
- gemakkelijk blauwe plekken of bloedingen,
- ernstige tintelingen of gevoelloosheid,
- spier zwakte,
- pijn in de bovenbuik,
- pijn op de borst,
- nieuwe of verergerende hoest, en
- moeite met ademhalen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Clozaril zijn:
- gewichtstoename,
- tremor,
- duizeligheid,
- ronddraaiend gevoel,
- hoofdpijn,
- slaperigheid,
- misselijkheid,
- constipatie,
- droge mond,
- verhoogde speekselvloed,
- wazig zien,
- snelle hartslag, en
- toegenomen zweten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Clozaril. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
ERNSTIGE NEUTROPENIE; ORTHOSTATISCHE HYPOTENSIE, BRADYCARDIA EN SYNCOOP; HARTINFARCT; MYOCARDITIS EN CARDIOMYOPATHIE; VERHOOGDE STERFTE BIJ OUDEREN PATINTEN MET DEMENTIEGERELATEERDE PSYCHOSE
Ernstige neutropenie
Behandeling met CLOZARIL heeft ernstige neutropenie veroorzaakt, gedefinieerd als een absoluut aantal neutrofielen (ANC) van minder dan 500/μl. Ernstige neutropenie kan leiden tot ernstige infectie en overlijden. Voorafgaand aan het starten van de behandeling met CLOZARIL moet een uitgangs-ANC voor de algemene populatie ten minste 1500/μl zijn; en moet ten minste 1000/μl zijn voor patiënten met gedocumenteerde goedaardige etnische neutropenie (BEN). Tijdens de behandeling moeten patiënten regelmatig ANC-monitoring ondergaan. Adviseer patiënten om onmiddellijk symptomen te melden die overeenkomen met ernstige neutropenie of infectie (bijv. Koorts, zwakte, lethargie of keelpijn) (zie DOSERING EN TOEDIENING en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Vanwege het risico op ernstige neutropenie is CLOZARIL alleen beschikbaar via een beperkt programma in het kader van een Risk Evaluation Mitigation Strategy (REMS), het Clozapine REMS-programma. [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN].
Orthostatische hypotensie, bradycardie, syncope
Orthostatische hypotensie, bradycardie, syncope en hartstilstand zijn opgetreden bij behandeling met CLOZARIL. Het risico is het hoogst tijdens de initiële titratieperiode, vooral bij snelle dosisverhoging. Deze reacties kunnen optreden bij de eerste dosis, met doses van slechts 12,5 mg per dag. Start de behandeling met 12,5 mg een- of tweemaal daags; langzaam titreren; en gebruik verdeelde doseringen. Gebruik CLOZARIL voorzichtig bij patiënten met cardiovasculaire of cerebrovasculaire aandoeningen of aandoeningen die vatbaar zijn voor hypotensie (bijv. Uitdroging, gebruik van antihypertensiva) (zie DOSERING EN TOEDIENING en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
epileptische aanvallen
Er zijn epileptische aanvallen opgetreden bij behandeling met CLOZARIL 25 mg. Het risico is dosisgerelateerd. Start de behandeling met 12,5 mg, titreer geleidelijk en gebruik een verdeelde dosering. Wees voorzichtig bij het toedienen van CLOZARIL 50 mg aan patiënten met een voorgeschiedenis van convulsies of andere predisponerende risicofactoren voor convulsies (CZS-pathologie, medicijnen die de convulsiedrempel verlagen, alcoholmisbruik). Waarschuw patiënten voor het ondernemen van activiteiten waarbij plotseling bewustzijnsverlies een ernstig risico voor zichzelf of anderen kan veroorzaken (zie DOSERING EN TOEDIENING, WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Myocarditis en cardiomyopathie
Fatale myocarditis en cardiomyopathie zijn opgetreden bij behandeling met CLOZARIL. Stop met CLOZARIL 25 mg en laat een hartonderzoek uitvoeren bij verdenking van deze reacties. Over het algemeen dienen patiënten met clozaril-gerelateerde myocarditis of cardiomyopathie niet opnieuw met CLOZARIL te worden behandeld. Overweeg de mogelijkheid van myocarditis of cardiomyopathie als pijn op de borst, tachycardie, hartkloppingen, kortademigheid, koorts, griepachtige symptomen, hypotensie of ECG-veranderingen optreden (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. CLOZARIL is niet goedgekeurd voor gebruik bij patiënten met aan dementie gerelateerde psychose (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
CLOZARIL® (clozapine), een atypisch antipsychoticum, is een tricyclisch dibenzodiazepinederivaat, 8-chloor-11-(4-methyl-1-piperazinyl)-5H-dibenzo [b,e] [1,4] diazepine. De structuurformule is
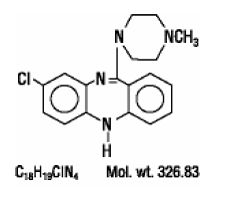
CLOZARIL is verkrijgbaar in lichtgele tabletten van 25 mg en 100 mg voor orale toediening.
Actief ingrediënt: clozapine
Inactieve ingrediënten zijn colloïdaal siliciumdioxide, lactose, magnesiumstearaat, povidon, zetmeel (maïs) en talk.
INDICATIES
Behandelingsresistente schizofrenie
CLOZARIL 50 mg is geïndiceerd voor de behandeling van ernstig zieke patiënten met schizofrenie die niet adequaat reageren op een standaardbehandeling met antipsychotica. Vanwege de risico's van ernstige neutropenie en epileptische aanvallen die verband houden met het gebruik ervan, mag CLOZARIL alleen worden gebruikt bij patiënten die niet adequaat hebben gereageerd op standaard antipsychotica [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
De werkzaamheid van CLOZARIL bij therapieresistente schizofrenie werd aangetoond in een 6 weken durende, gerandomiseerde, dubbelblinde, actief-gecontroleerde studie waarin CLOZARIL en chloorpromazine werden vergeleken bij patiënten bij wie andere antipsychotica hadden gefaald [zie Klinische studies ].
Vermindering van het risico op terugkerend suïcidaal gedrag bij schizofrenie of schizoaffectieve stoornis
CLOZARIL is geïndiceerd voor het verminderen van het risico op recidiverend suïcidaal gedrag bij patiënten met schizofrenie of schizoaffectieve stoornis die op basis van de voorgeschiedenis en recente klinische toestand worden geacht een chronisch risico te lopen om suïcidaal gedrag opnieuw te ervaren. Suïcidaal gedrag verwijst naar acties van een patiënt die zichzelf in gevaar brengen voor overlijden.
De effectiviteit van CLOZARIL bij het verminderen van het risico op recidiverend suïcidaal gedrag werd aangetoond over een behandelingsperiode van twee jaar in de InterSePT™-studie [zie Klinische studies ].
DOSERING EN ADMINISTRATIE
Vereiste laboratoriumtests voorafgaand aan de start en tijdens de therapie
Voordat de behandeling met CLOZARIL wordt gestart, moet een baseline ANC worden verkregen. De baseline ANC moet minimaal 1500/μl zijn voor de algemene populatie en minimaal 1000/μl voor patiënten met gedocumenteerde benigne etnische neutropenie (BEN). Om de behandeling voort te zetten, moet het ANC regelmatig worden gecontroleerd [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Doseringsinformatie
De startdosering is 12,5 mg eenmaal daags of tweemaal daags. De totale dagelijkse dosis kan worden verhoogd in stappen van 25 mg tot 50 mg per dag, indien goed verdragen, om een streefdosis van 300 mg tot 450 mg per dag (toegediend in verdeelde doses) tegen het einde van 2 weken te bereiken. Vervolgens kan de dosis eenmaal per week of tweemaal per week worden verhoogd in stappen van maximaal 100 mg. De maximale dosis is 900 mg per dag. Om het risico op orthostatische hypotensie, bradycardie en syncope te minimaliseren, is het noodzakelijk om deze lage startdosis, geleidelijk titratieschema en verdeelde doseringen te gebruiken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CLOZARIL kan met of zonder voedsel worden ingenomen [zie Farmacokinetiek ].
Onderhoudsbehandeling
Over het algemeen moeten patiënten die reageren op CLOZARIL de onderhoudsbehandeling voortzetten op hun effectieve dosis na de acute episode.
Stopzetting van de behandeling
De wijze van stopzetting van de behandeling hangt af van het laatste ANC van de patiënt:
- Zie Tabellen 2 of 3 voor geschikte ANC-monitoring op basis van het niveau van neutropenie als abrupte stopzetting van de behandeling noodzakelijk is vanwege matige tot ernstige neutropenie.
- Verlaag de dosis geleidelijk over een periode van 1 tot 2 weken als beëindiging van de behandeling met CLOZARIL 50 mg gepland is en er geen aanwijzingen zijn voor matige tot ernstige neutropenie.
- Voor abrupte stopzetting van clozapine om een reden die geen verband houdt met neutropenie, wordt voortzetting van de bestaande ANC-monitoring aanbevolen voor patiënten in de algemene populatie tot hun ANC ≥1500/μl is en voor BEN-patiënten tot hun ANC ≥1000/μl of boven hun baseline is.
- Aanvullende ANC-monitoring is vereist voor elke patiënt die begin van koorts meldt (temperatuur van 38,5 ° C of 101,3 ° F of hoger) gedurende de 2 weken na stopzetting [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Controleer alle patiënten zorgvuldig op terugkeer van psychotische symptomen en symptomen die verband houden met cholinerge rebound, zoals overvloedig zweten, hoofdpijn, misselijkheid, braken en diarree.
Herstart van de behandeling
Bij herstart van CLOZARIL bij patiënten die gestopt zijn met CLOZARIL (dwz 2 dagen of langer sinds de laatste dosis), herstart dan met 12,5 mg eenmaal daags of tweemaal daags. Dit is nodig om het risico op hypotensie, bradycardie en syncope te minimaliseren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Als die dosis goed wordt verdragen, kan de dosis sneller worden verhoogd tot de eerder therapeutische dosis dan aanbevolen voor de initiële behandeling.
Dosisaanpassingen bij gelijktijdig gebruik van CYP1A2-, CYP2D6-, CYP3A4-remmers of CYP1A2-, CYP3A4-inductoren
Dosisaanpassingen kunnen nodig zijn bij patiënten met gelijktijdig gebruik van: sterke CYP1A2-remmers (bijv. fluvoxamine, ciprofloxacine of enoxacine); matige of zwakke CYP1A2-remmers (bijv. orale anticonceptiva of cafeïne); CYP2D6- of CYP3A4-remmers (bijv. cimetidine, escitalopram, erytromycine, paroxetine, bupropion, fluoxetine, kinidine, duloxetine, terbinafine of sertraline); CYP3A4-inductoren (bijv. fenytoïne, carbamazepine, sint-janskruid en rifampicine); of CYP1A2-inductoren (bijv. roken van tabak) (Tabel 1) [zie DRUG-INTERACTIES ].
Nier- of leverfunctiestoornis of CYP2D6 slechte metaboliseerders
Het kan nodig zijn om de dosis CLOZARIL 50 mg te verlagen bij patiënten met een significante nier- of leverfunctiestoornis, of bij CYP2D6 trage metaboliseerders [zie Gebruik bij specifieke populaties ].
HOE GELEVERD
Doseringsvormen en sterke punten
CLOZARIL (clozapine) is verkrijgbaar als ronde, lichtgele, niet-omhulde tabletten van 25 mg, 50 mg en 100 mg met een breukstreep aan één kant. Clozaril (clozapine) 200 mg tabletten zijn capsulevormige, lichtgele, niet-omhulde tabletten met een breukstreep aan één kant.
CLOZARIL® (clozapine) tabletten
25 mg
Ronde, lichtgele, niet-omhulde tablet. Inscriptie "CLOZARIL" eenmaal aan de omtrek van één kant. Ingeslagen met een vereenvoudigde score en "25" eenmaal aan de andere kant. Fles van 100 .......... NDC 69809-0126-05
50 mg
Ronde, lichtgele, niet-omhulde tablet. Inscriptie "CLOZARIL" eenmaal aan de omtrek van één kant. Ingeslagen "50", een gefaciliteerde score en "mg" aan de andere kant. Fles van 100 .......... NDC 69809-0130-05
100 mg
Ronde, lichtgele, niet-omhulde tablet. Inscriptie "CLOZARIL" eenmaal aan de omtrek van één kant. Ingeslagen met een gefaciliteerde score en "100" eenmaal aan de andere kant. Fles van 100 .......... NDC 69809-0127-05
200 mg
Capsulevormige, lichtgele, niet-omhulde tablet. Op één zijde is eenmaal "CLOZARIL" gegraveerd. Ingeslagen met "200", een gefaciliteerde score en "mg" aan de andere kant. Fles van 100 .......... NDC 69809-0135-05
Opslag en behandeling
De opslagtemperatuur mag niet hoger zijn dan 30°C (86°F).
Buiten bereik van kinderen houden.
Gedistribueerd door: HLS Therapeutics (VS), Inc., Rosemont, PA 19010, (844) 457-8721. Herzien : februari 2021
BIJWERKINGEN
De volgende bijwerkingen worden in meer detail besproken in andere secties van de etikettering:
- Ernstige neutropenie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Orthostatische hypotensie, bradycardie en syncope [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- valt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- aanvallen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Myocarditis, cardiomyopathie en mitralisklepinsufficiëntie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Gastro-intestinale hypomotiliteit met ernstige complicaties [Zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- eosinofilie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verlenging van het QT-interval [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Metabole veranderingen (hyperglykemie en diabetes mellitus, dyslipidemie en gewichtstoename) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Maligne neurolepticasyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hepatotoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Koorts [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Longembolie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Anticholinerge toxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Interferentie met cognitieve en motorische prestaties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Tardieve dyskinesie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cerebrovasculaire bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Herhaling van psychose en cholinerge rebound na abrupte stopzetting [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
De meest gemelde bijwerkingen (≥5%) in klinische onderzoeken met CLOZARIL waren: reacties op het centraal zenuwstelsel, waaronder sedatie, duizeligheid/draaierigheid, hoofdpijn en tremor; cardiovasculaire reacties, waaronder tachycardie, hypotensie en syncope; reacties van het autonome zenuwstelsel, waaronder speekselvloed, zweten, droge mond en visuele stoornissen; gastro-intestinale reacties, waaronder constipatie en misselijkheid; en koorts. Tabel 9 geeft een samenvatting van de meest gemelde bijwerkingen (≥5%) bij met CLOZARIL behandelde patiënten (vergeleken met met chloorpromazine behandelde patiënten) in het centrale, 6 weken durende, gecontroleerde onderzoek naar therapieresistente schizofrenie.
Tabel 10 geeft een samenvatting van de bijwerkingen die zijn gemeld bij met CLOZARIL behandelde patiënten met een frequentie van 2% of meer in alle CLOZARIL-onderzoeken (met uitzondering van het 2-jarige InterSePT™-onderzoek). Deze tarieven zijn niet aangepast voor de duur van de blootstelling.
Tabel 11 geeft een overzicht van de meest gemelde bijwerkingen (>10% van de CLOZARIL- of olanzapinegroep) in de InterSePT™-studie. Dit was een adequate en goed gecontroleerde studie van twee jaar waarin de werkzaamheid van CLOZARIL in vergelijking met olanzapine werd geëvalueerd bij het verminderen van het risico op suïcidaal gedrag bij patiënten met schizofrenie of schizoaffectieve stoornis. De tarieven zijn niet aangepast voor de duur van de blootstelling.
Dystonie
Klasse-effect
Symptomen van dystonie, langdurige abnormale samentrekkingen van spiergroepen, kunnen optreden bij gevoelige personen tijdens de eerste paar dagen van de behandeling. Dystonische symptomen zijn onder meer: spasmen van de nekspieren, soms overgaand in een beklemmend gevoel in de keel, moeite met slikken, ademhalingsmoeilijkheden en/of uitpuilende tong. Hoewel deze symptomen bij lage doses kunnen optreden, komen ze vaker en ernstiger voor bij een hoge potentie en bij hogere doses antipsychotica van de eerste generatie. Een verhoogd risico op acute dystonie wordt waargenomen bij mannen en jongere leeftijdsgroepen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van clozapine na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Centraal zenuwstelsel
Delirium, EEG abnormaal, myoclonus, paresthesie, mogelijke kataplexie, status epilepticus, obsessieve compulsieve symptomen, rustelozebenensyndroom en cholinerge rebound-bijwerkingen na stopzetting.
Cardiovasculair systeem
Atriale of ventriculaire fibrillatie, ventriculaire tachycardie, hartkloppingen, verlenging van het QT-interval, torsades de pointes, mitralisklepinsufficiëntie geassocieerd met clozapine-gerelateerde cardiomyopathie, myocardinfarct, hartstilstand, myocarditis en periorbitaal oedeem.
Endocrien systeem
pseudofeochromocytoom
Maagdarmstelsel
Acute pancreatitis, dysfagie, zwelling van de speekselklieren, colitis, megacolon, intestinale ischemie of infarct.
Lever- en galsysteem
Cholestase, hepatitis, geelzucht, hepatotoxiciteit, leversteatose, levernecrose, leverfibrose, levercirrose, leverbeschadiging (lever, cholestatisch en gemengd) en leverfalen.
Immuunsysteemaandoeningen
Angio-oedeem, leukocytoclastische vasculitis.
Urogenitaal systeem
Acute interstitiële nefritis, nachtelijke enuresis, priapisme, nierfalen en retrograde ejaculatie.
Huid- en onderhuidaandoeningen
Overgevoeligheidsreacties: lichtgevoeligheid, vasculitis, erythema multiforme, huidpigmentatiestoornis en Stevens-Johnson-syndroom.
Musculoskeletaal systeem en bindweefselaandoeningen
Myasthenisch syndroom, rabdomyolyse en systemische lupus erythematosus.
Ademhalingssysteem
Aspiratie, pleurale effusie, longontsteking, infectie van de onderste luchtwegen, slaapapneu.
Hemic en lymfatisch systeem
Milde, matige of ernstige leukopenie, agranulocytose, granulocytopenie, verlaagd WBC, diep-veneuze trombose, verhoogd hemoglobine/hematocriet, verhoogde erytrocytsedimentatiesnelheid (ESR), sepsis, trombocytose en trombocytopenie.
Visiestoornissen
Smallehoekglaucoom.
Diversen
Verhoogde creatinefosfokinase, hyperurikemie, hyponatriëmie, polyserositis en gewichtsverlies.
DRUG-INTERACTIES
Potentieel voor andere geneesmiddelen om CLOZARIL . te beïnvloeden
Clozapine is een substraat voor veel cytochroom P450-isozymen, met name CYP1A2, CYP3A4 en CYP2D6. Wees voorzichtig bij het gelijktijdig toedienen van CLOZARIL 100 mg met geneesmiddelen die deze enzymen induceren of remmen.
CYP1A2-remmers
Gelijktijdig gebruik van CLOZARIL en CYP1A2-remmers kan de plasmaspiegels van clozapine verhogen, wat mogelijk kan leiden tot bijwerkingen. Verlaag de dosis CLOZARIL tot een derde van de oorspronkelijke dosis wanneer CLOZARIL gelijktijdig wordt toegediend met sterke CYP1A2-remmers (bijv. fluvoxamine, ciprofloxacine of enoxacine). De dosis CLOZARIL moet worden verhoogd tot de oorspronkelijke dosis wanneer gelijktijdige toediening van sterke CYP1A2-remmers wordt stopgezet (zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
Matige of zwakke CYP1A2-remmers omvatten orale anticonceptiva en cafeïne. Houd patiënten nauwlettend in de gaten wanneer CLOZARIL gelijktijdig met deze remmers wordt toegediend. Overweeg indien nodig de dosering van CLOZARIL 25 mg te verlagen [zie: DOSERING EN ADMINISTRATIE ].
CYP2D6- en CYP3A4-remmers
Gelijktijdige behandeling met CLOZARIL en CYP2D6- of CYP3A4-remmers (bijv. cimetidine, escitalopram, erytromycine, paroxetine, bupropion, fluoxetine, kinidine, duloxetine, terbinafine of sertraline) kan de clozapinespiegels verhogen en leiden tot bijwerkingen (zie KLINISCHE FARMACOLOGIE ]. Wees voorzichtig en volg patiënten nauwlettend bij het gebruik van dergelijke remmers. Overweeg de dosis CLOZARIL 100 mg te verlagen [zie DOSERING EN ADMINISTRATIE ].
CYP1A2- en CYP3A4-inductoren
Gelijktijdige behandeling met geneesmiddelen die CYP1A2 of CYP3A4 induceren, kan de plasmaconcentratie van clozapine verlagen, wat resulteert in een verminderde werkzaamheid van CLOZARIL. Tabaksrook is een matige inductor van CYP1A2. Sterke CYP3A4-inductoren zijn onder meer carbamazepine, fenytoïne, sint-janskruid en rifampicine. Het kan nodig zijn om de dosis CLOZARIL 50 mg te verhogen bij gelijktijdig gebruik met inductoren van deze enzymen. Gelijktijdig gebruik van CLOZARIL en sterke CYP3A4-inductoren wordt echter niet aanbevolen [zie DOSERING EN ADMINISTRATIE ].
Overweeg om de dosering van CLOZARIL 50 mg te verlagen wanneer gelijktijdig toegediende enzyminductoren worden stopgezet; omdat stopzetting van inductoren kan leiden tot verhoogde plasmaspiegels van clozapine en een verhoogd risico op bijwerkingen [zie: DOSERING EN ADMINISTRATIE ].
Anticholinergica
Gelijktijdige behandeling met clozapine en andere geneesmiddelen met anticholinerge activiteit (bijv. benztropine, cyclobenzaprine, difenhydramine) kan het risico op anticholinerge toxiciteit en ernstige gastro-intestinale bijwerkingen gerelateerd aan hypomotiliteit verhogen. Vermijd indien mogelijk gelijktijdig gebruik van CLOZARIL met anticholinergica [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelen die verlenging van het QT-interval veroorzaken
Wees voorzichtig bij gelijktijdige toediening van geneesmiddelen die het QT-interval verlengen of het metabolisme van clozapine remmen. Geneesmiddelen die QT-verlenging veroorzaken, zijn onder meer: specifieke antipsychotica (bijv. ziprasidon, iloperidon, chloorpromazine, thioridazine, mesoridazine, droperidol en pimozide), specifieke antibiotica (bijv. erytromycine, gatifloxacine, moxifloxacine, sparfloxacine), klasse 1A procaïnamide) of klasse III antiaritmica (bijv. amiodaron, sotalol) en andere (bijv. pentamidine, levomethadylacetaat, methadon, halofantrine, mefloquine, dolasetronmesylaat, probucol of tacrolimus) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Potentieel voor CLOZARIL om andere geneesmiddelen te beïnvloeden
Gelijktijdig gebruik van CLOZARIL 25 mg met andere geneesmiddelen die door CYP2D6 worden gemetaboliseerd, kan de spiegels van deze CYP2D6-substraten verhogen. Wees voorzichtig bij gelijktijdige toediening van CLOZARIL 50 mg met andere geneesmiddelen die worden gemetaboliseerd door CYP2D6. Het kan nodig zijn om lagere doses van dergelijke geneesmiddelen te gebruiken dan gewoonlijk wordt voorgeschreven. Dergelijke geneesmiddelen omvatten specifieke antidepressiva, fenothiazinen, carbamazepine en type 1C-antiaritmica (bijv. propafenon, flecaïnide en encaïnide).
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Ernstige neutropenie
Achtergrond
CLOZARIL kan neutropenie (een laag absoluut aantal neutrofielen (ANC)) veroorzaken, gedefinieerd als een verlaging van het aantal neutrofielen in het bloed tot onder het normale niveau van vóór de behandeling. Het ANC is meestal beschikbaar als onderdeel van het volledige bloedbeeld (CBC), inclusief differentieel, en is relevanter voor door geneesmiddelen geïnduceerde neutropenie dan het aantal witte bloedcellen (WBC). De ANC kan ook worden berekend met behulp van de volgende formule: ANC is gelijk aan het totale aantal WBC vermenigvuldigd met het totale percentage neutrofielen verkregen uit de differentiële (neutrofiele "segs" plus neutrofiele "banden"). Andere granulocyten (basofielen en eosinofielen) dragen minimaal bij aan neutropenie en hun meting is niet nodig [zie ONGEWENSTE REACTIES ]. Neutropenie kan licht, matig of ernstig zijn (zie tabellen 2 en 3). Om het begrip te verbeteren en te standaardiseren, vervangt "ernstige neutropenie" de eerdere termen ernstige leukopenie, ernstige granulocytopenie of agranulocytose.
Ernstige neutropenie, ANC minder dan (
Hieronder worden twee afzonderlijke managementalgoritmen gegeven, de eerste voor patiënten in de algemene populatie en de tweede voor patiënten bij wie bij aanvang neutropenie is vastgesteld.
CLOZARIL Behandeling en monitoring bij de algemene patiëntenpopulatie (zie tabel 2)
Verkrijg een CBC, inclusief de ANC-waarde, voorafgaand aan het starten van de behandeling met CLOZARIL 25 mg om de aanwezigheid van een normaal aantal neutrofielen bij aanvang (gelijk aan of groter dan 1500/μL) te verzekeren en om latere vergelijkingen mogelijk te maken. Patiënten in de algemene populatie met een ANC gelijk aan of groter dan (≥)1500/μl worden beschouwd als binnen het normale bereik (tabel 2) en komen in aanmerking om de behandeling te starten. Wekelijkse ANC-monitoring is vereist voor alle patiënten tijdens de eerste 6 maanden van de behandeling. Als het ANC van een patiënt gelijk blijft aan of groter is dan 1500/μl gedurende de eerste 6 maanden van de behandeling, kan de controlefrequentie worden verlaagd tot elke 2 weken gedurende de volgende 6 maanden. Als het ANC gelijk blijft aan of groter is dan 1500/μl gedurende de tweede 6 maanden van continue therapie, kan de frequentie van de ANC-controle worden verlaagd tot eenmaal per 4 weken daarna.
Behandeling en monitoring met CLOZARIL bij patiënten met goedaardige etnische neutropenie (zie tabel 3)
Goedaardige etnische neutropenie (BEN) is een aandoening die wordt waargenomen bij bepaalde etnische groepen waarvan de gemiddelde ANC-waarden lager zijn dan de "standaard" laboratoriumwaarden voor neutrofielen. Het wordt het meest waargenomen bij personen van Afrikaanse afkomst (geschatte prevalentie van 25-50%), sommige etnische groepen uit het Midden-Oosten en bij andere niet-Kaukasische etnische groepen met een donkerdere huid. BEN komt vaker voor bij mannen. Patiënten met BEN hebben een normaal aantal hematopoëtische stamcellen en myeloïde rijping, zijn gezond en lijden niet aan herhaalde of ernstige infecties. Ze lopen geen verhoogd risico op het ontwikkelen van door CLOZARIL geïnduceerde neutropenie. Aanvullende evaluatie kan nodig zijn om te bepalen of baseline neutropenie te wijten is aan BEN. Overweeg zo nodig een hematologisch consult voordat u begint of tijdens de behandeling met CLOZARIL 50 mg.
Patiënten met BEN hebben een ander ANC-algoritme nodig voor CLOZARIL-behandeling vanwege hun lagere baseline-ANC-niveaus. Tabel 3 geeft richtlijnen voor het beheer van de behandeling met CLOZARIL 100 mg en ANC-monitoring bij patiënten met BEN.
Algemene richtlijnen voor de behandeling van alle patiënten met koorts of met neutropenie
- Koorts: Onderbreek CLOZARIL als voorzorgsmaatregel bij elke patiënt die koorts ontwikkelt, gedefinieerd als een temperatuur van 38,5 ° C [101,3 ° F] of hoger, en verkrijg een ANC-niveau. Koorts is vaak het eerste teken van een neutropenische infectie.
- ANC minder dan 1000/μl: als koorts optreedt bij een patiënt met een ANC van minder dan 1000/μl, start dan de juiste opwerking en behandeling voor infectie en raadpleeg tabel 2 of 3 voor behandeling.
- Overweeg een hematologisch consult.
- Zie Maligne Neurolepticasyndroom [MNS] en Koorts onder WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en instructies voor patiënten, onder PATIËNT INFORMATIE .
Opnieuw uitdagen na een ANC van minder dan 500/μL (ernstige neutropenie)
Voor sommige patiënten die ernstige CLOZARIL-gerelateerde neutropenie ervaren, kan het risico op een ernstige psychiatrische aandoening door het stopzetten van de behandeling met CLOZARIL groter zijn dan het risico op hernieuwde behandeling (bijv. patiënten met een ernstige schizofrene aandoening die geen andere behandelingsopties hebben dan CLOZARIL). Een hematologisch consult kan nuttig zijn bij de beslissing om een patiënt opnieuw uit te dagen. Over het algemeen moet u patiënten die ernstige neutropenie ontwikkelen echter niet opnieuw uitdagen met CLOZARIL of een clozapineproduct.
Als een patiënt opnieuw wordt uitgedaagd, moet de arts rekening houden met de drempelwaarden die in tabellen 2 en 3 worden vermeld, de medische en psychiatrische voorgeschiedenis van de patiënt, een gesprek met de patiënt en zijn/haar verzorger over de voordelen en risico's van een nieuwe behandeling met CLOZARIL 50 mg, en de ernst en kenmerken van de neutropenische episode.
CLOZARIL gebruiken met andere geneesmiddelen die verband houden met neutropenie
Het is onduidelijk of gelijktijdig gebruik van andere geneesmiddelen waarvan bekend is dat ze neutropenie veroorzaken, het risico of de ernst van door CLOZARIL geïnduceerde neutropenie verhoogt. Er is geen sterke wetenschappelijke reden om behandeling met CLOZARIL te vermijden bij patiënten die gelijktijdig met deze geneesmiddelen worden behandeld. Als CLOZARIL 100 mg gelijktijdig wordt gebruikt met een middel waarvan bekend is dat het neutropenie veroorzaakt (bijv. sommige chemotherapeutische middelen), overweeg dan om patiënten nauwlettender te volgen dan de behandelrichtlijnen in tabellen 2 en 3. Overleg met de behandelend oncoloog bij patiënten die gelijktijdig chemotherapie krijgen.
Clozapine REMS-programma
CLOZARIL is vanwege het risico op ernstige neutropenie alleen beschikbaar via een beperkt programma onder een REMS, het Clozapine REMS-programma.
Opmerkelijke vereisten van het Clozapine REMS-programma zijn onder meer:
- Beroepsbeoefenaren in de gezondheidszorg die CLOZARIL 25 mg voorschrijven, moeten gecertificeerd zijn voor het programma door zich in te schrijven en een opleiding te volgen
- Patiënten die CLOZARIL 100 mg krijgen, moeten worden ingeschreven in het programma en voldoen aan de ANC-test- en monitoringvereisten
- Apotheken die CLOZARIL 50 mg afleveren, moeten gecertificeerd zijn voor het programma door zich in te schrijven en een opleiding te volgen en mogen alleen afleveren aan patiënten die in aanmerking komen voor CLOZARIL
Meer informatie is beschikbaar op www.clozapinerems.com of 1-844-267-8678.
Orthostatische hypotensie, bradycardie en syncope
Hypotensie, bradycardie, syncope en hartstilstand zijn opgetreden bij behandeling met clozapine. Het risico is het hoogst tijdens de initiële titratieperiode, vooral bij snelle dosisverhoging. Deze reacties kunnen optreden bij de eerste dosis, bij doses van slechts 12,5 mg. Deze reacties kunnen dodelijk zijn. Het syndroom is consistent met neuraal gemedieerde reflex bradycardie (NMRB).
De behandeling moet beginnen met een maximale dosis van 12,5 mg eenmaal daags of tweemaal daags. De totale dagelijkse dosis kan worden verhoogd in stappen van 25 mg tot 50 mg per dag, indien goed verdragen, tot een streefdosis van 300 mg tot 450 mg per dag (toegediend in verdeelde doses) tegen het einde van 2 weken. Vervolgens kan de dosis wekelijks of tweemaal per week worden verhoogd in stappen van maximaal 100 mg. De maximale dosis is 900 mg per dag. Pas voorzichtige titratie en een verdeeld doseringsschema toe om het risico op ernstige cardiovasculaire reacties te minimaliseren [zie: DOSERING EN ADMINISTRATIE ]. Overweeg de dosis te verlagen als hypotensie optreedt. Bij het herstarten van patiënten die zelfs maar een korte pauze van CLOZARIL hebben gehad (dwz 2 dagen of meer sinds de laatste dosis), herstart de behandeling met 12,5 mg eenmaal daags of tweemaal daags [zie DOSERING EN ADMINISTRATIE ].
Gebruik CLOZARIL voorzichtig bij patiënten met cardiovasculaire aandoeningen (voorgeschiedenis van myocardinfarct of ischemie, hartfalen of geleidingsstoornissen), cerebrovasculaire aandoeningen en aandoeningen die patiënten vatbaar kunnen maken voor hypotensie (bijv. gelijktijdig gebruik van antihypertensiva, uitdroging en hypovolemie).
Watervallen
CLOZARIL 25 mg kan slaperigheid, orthostatische hypotensie, motorische en sensorische instabiliteit veroorzaken, wat kan leiden tot vallen en bijgevolg tot fracturen of ander letsel. Voor patiënten met ziekten, aandoeningen of medicijnen die deze effecten kunnen verergeren, volledige valrisicobeoordelingen bij het starten van een antipsychotische behandeling en herhaaldelijk voor patiënten die langdurige antipsychotische therapie ondergaan.
epileptische aanvallen
Er wordt geschat dat epileptische aanvallen optreden in samenhang met het gebruik van clozapine met een cumulatieve incidentie na één jaar van ongeveer 5%, gebaseerd op het optreden van één of meer aanvallen bij 61 van de 1743 patiënten die werden blootgesteld aan clozapine tijdens klinische testen voorafgaand aan binnenlandse marketing (dwz , een ruw tarief van 3,5%). Het risico op een aanval is dosisafhankelijk. Start de behandeling met een lage dosis (12,5 mg), titreer langzaam en gebruik een verdeelde dosering.
Wees voorzichtig bij het toedienen van CLOZARIL 50 mg aan patiënten met een voorgeschiedenis van convulsies of andere predisponerende risicofactoren voor convulsies (bijv. hoofdtrauma of andere CZS-pathologie, gebruik van medicijnen die de drempel voor convulsies verlagen of alcoholmisbruik). Vanwege het aanzienlijke risico op epileptische aanvallen dat gepaard gaat met het gebruik van CLOZARIL, moeten patiënten worden gewaarschuwd voor het ondernemen van activiteiten waarbij plotseling bewustzijnsverlies een ernstig risico voor henzelf of anderen kan veroorzaken (bijv. autorijden, complexe machines bedienen, zwemmen, klimmen).
Myocarditis, cardiomyopathie en mitralisklepinsufficiëntie
Myocarditis en cardiomyopathie zijn opgetreden bij het gebruik van CLOZARIL. Deze reacties kunnen dodelijk zijn. Stop met CLOZARIL 25 mg en laat een hartonderzoek uitvoeren bij verdenking van myocarditis of cardiomyopathie. Over het algemeen dienen patiënten met een voorgeschiedenis van clozapine-geassocieerde myocarditis of cardiomyopathie niet opnieuw met CLOZARIL te worden behandeld. Als echter wordt geoordeeld dat het voordeel van een behandeling met CLOZARIL 25 mg opweegt tegen de mogelijke risico's van terugkerende myocarditis of cardiomyopathie, kan de arts overwegen om in overleg met een cardioloog, na een volledige hartevaluatie en onder nauwlettende controle, opnieuw met CLOZARIL te starten.
Overweeg de mogelijkheid van myocarditis of cardiomyopathie bij patiënten die CLOZARIL krijgen en die zich presenteren met pijn op de borst, kortademigheid, aanhoudende tachycardie in rust, hartkloppingen, koorts, griepachtige symptomen, hypotensie, andere tekenen of symptomen van hartfalen, of elektrocardiografische bevindingen (lage spanningen, ST-T-afwijkingen, aritmieën, afwijking van de rechteras en slechte progressie van de R-golf). Myocarditis komt het vaakst voor binnen de eerste 2 maanden van de behandeling met clozapine. Symptomen van cardiomyopathie treden over het algemeen later op dan clozapine-geassocieerde myocarditis en meestal na 8 weken behandeling. Myocarditis en cardiomyopathie kunnen echter in elke periode tijdens de behandeling met CLOZARIL optreden. Het is gebruikelijk dat niet-specifieke griepachtige symptomen zoals malaise, spierpijn, pleuritische pijn op de borst en lichte koorts voorafgaan aan meer openlijke tekenen van hartfalen. Typische laboratoriumbevindingen zijn onder meer verhoogd troponine I of T, verhoogd creatininekinase-MB, perifere eosinofilie en verhoogd C-reactief proteïne (CRP). Röntgenfoto van de borst kan vergroting van het hartsilhouet aantonen, en beeldvorming van het hart (echocardiogram, radionucleotide-onderzoeken of hartkatheterisatie) kan bewijs van linkerventrikeldisfunctie aan het licht brengen. Bij patiënten bij wie cardiomyopathie is vastgesteld tijdens het gebruik van CLOZARIL 50 mg is mitralisklepinsufficiëntie gemeld. Deze gevallen meldden milde of matige mitralisinsufficiëntie op tweedimensionale echocardiografie. Overweeg bij patiënten met verdenking op cardiomyopathie een 2D-echo Doppler-onderzoek om mitralisklepinsufficiëntie te identificeren.
Verhoogde mortaliteit bij oudere patiënten met aan dementie gerelateerde psychose
Oudere patiënten met aan dementie gerelateerde psychose die met antipsychotica worden behandeld, lopen een verhoogd risico op overlijden. Analyses van 17 placebogecontroleerde onderzoeken (modale duur van 10 weken), grotendeels bij patiënten die atypische antipsychotica gebruikten, lieten een risico op overlijden zien bij met geneesmiddelen behandelde patiënten van 1,6 tot 1,7 keer het risico op overlijden bij met placebo behandelde patiënten. In de loop van een typische 10 weken durende gecontroleerde studie was het sterftecijfer bij met geneesmiddelen behandelde patiënten ongeveer 4,5%, vergeleken met een percentage van ongeveer 2,6% in de placebogroep. Hoewel de doodsoorzaken uiteenliepen, bleken de meeste sterfgevallen van cardiovasculaire (bijv. hartfalen, plotselinge dood) of infectieuze (bijv. longontsteking) van aard te zijn. Observationele studies suggereren dat, net als bij atypische antipsychotica, behandeling met conventionele antipsychotica de mortaliteit bij deze populatie kan verhogen. Het is niet duidelijk in hoeverre de bevindingen van verhoogde mortaliteit in observationele onderzoeken kunnen worden toegeschreven aan het antipsychoticum in tegenstelling tot bepaalde kenmerken van de patiënten. CLOZARIL is niet goedgekeurd voor de behandeling van patiënten met aan dementie gerelateerde psychose [zie: GEVAARLIJKE WAARSCHUWING: ].
Gastro-intestinale hypomotiliteit met ernstige complicaties
Ernstige gastro-intestinale bijwerkingen zijn opgetreden bij het gebruik van CLOZARIL, voornamelijk vanwege de krachtige anticholinerge effecten en de daaruit voortvloeiende gastro-intestinale hypomotiliteit. In postmarketingervaring variëren de gerapporteerde effecten van constipatie tot paralytische ileus. Verhoogde frequentie van constipatie en vertraagde diagnose en behandeling verhoogden het risico op ernstige complicaties van gastro-intestinale hypomotiliteit, resulterend in darmobstructie, fecale impactie, megacolon en intestinale ischemie of -infarct [zie TEGENGESTELDE REACTIE ]. Deze reacties hebben geleid tot ziekenhuisopname, operatie en overlijden. Het risico op ernstige bijwerkingen wordt verder verhoogd met anticholinergica (en andere medicijnen die de gastro-intestinale peristaltiek verminderen); daarom moet gelijktijdig gebruik indien mogelijk worden vermeden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Voordat u met CLOZARIL 50 mg begint, moet u controleren op constipatie en zo nodig behandelen. Subjectieve symptomen van constipatie geven mogelijk niet nauwkeurig de mate van gastro-intestinale hypomotiliteit weer bij patiënten die met CLOZARIL worden behandeld. Evalueer daarom regelmatig de darmfunctie met zorgvuldige aandacht voor eventuele veranderingen in de frequentie of het karakter van de stoelgang, evenals tekenen en symptomen van complicaties van hypomotiliteit (bijv. misselijkheid, braken, opgezette buik, buikpijn). Als constipatie of gastro-intestinale hypomotiliteit wordt vastgesteld, moet u deze nauwlettend volgen en zo nodig onmiddellijk behandelen met geschikte laxeermiddelen om ernstige complicaties te voorkomen. Overweeg profylactische laxeermiddelen bij hoogrisicopatiënten.
eosinofilie
Eosinofilie, gedefinieerd als een aantal eosinofielen in het bloed van meer dan 700/μl, is opgetreden bij behandeling met CLOZARIL 100 mg. In klinische onderzoeken ontwikkelde ongeveer 1% van de patiënten eosinofilie. Clozapine-gerelateerde eosinofilie treedt meestal op tijdens de eerste maand van de behandeling. Bij sommige patiënten is het in verband gebracht met myocarditis, pancreatitis, hepatitis, colitis en nefritis. Dergelijke orgaanbetrokkenheid zou consistent kunnen zijn met een geneesmiddelreactie met eosinofilie en systemische symptomensyndroom (DRESS), ook bekend als geneesmiddelgeïnduceerd overgevoeligheidssyndroom (DIHS). Als zich eosinofilie ontwikkelt tijdens de behandeling met CLOZARIL, evalueer dan onmiddellijk op tekenen en symptomen van systemische reacties, zoals huiduitslag of andere allergische symptomen, myocarditis of een andere orgaanspecifieke ziekte die verband houdt met eosinofilie. Als CLOZARIL-gerelateerde systemische ziekte wordt vermoed, stop dan onmiddellijk met CLOZARIL 50 mg.
Als een oorzaak van eosinofilie wordt vastgesteld die geen verband houdt met CLOZARIL 50 mg (bijv. astma, allergieën, collageenvaatziekte, parasitaire infecties en specifieke neoplasmata), behandel dan de onderliggende oorzaak en ga door met CLOZARIL.
Clozapine-gerelateerde eosinofilie is ook opgetreden zonder orgaanbetrokkenheid en kan zonder tussenkomst verdwijnen. Er zijn meldingen van succesvolle herbehandeling na stopzetting van clozapine, zonder herhaling van eosinofilie. Als er geen orgaanbetrokkenheid is, ga dan door met CLOZARIL onder zorgvuldige controle. Als het totale aantal eosinofielen gedurende meerdere weken blijft stijgen zonder systemische ziekte, moet de beslissing om de behandeling met CLOZARIL 25 mg te onderbreken en opnieuw te starten nadat het aantal eosinofielen is gedaald, gebaseerd zijn op de algehele klinische beoordeling, in overleg met een internist of hematoloog.
Verlenging QT-interval
QT-verlenging, torsade de pointes en andere levensbedreigende ventriculaire aritmieën, hartstilstand en plotselinge dood zijn opgetreden bij behandeling met CLOZARIL 100 mg. Houd bij het voorschrijven van CLOZARIL rekening met de aanwezigheid van aanvullende risicofactoren voor QT-verlenging en ernstige cardiovasculaire reacties. Aandoeningen die deze risico's verhogen, zijn onder meer: voorgeschiedenis van QT-verlenging, lang QT-syndroom, familiegeschiedenis van lang QT-syndroom of plotselinge hartdood, significante hartritmestoornissen, recent myocardinfarct, niet-gecompenseerd hartfalen, behandeling met andere medicijnen die QT-verlenging veroorzaken, behandeling met medicijnen die het metabolisme van clozapine remmen, en elektrolytafwijkingen.
Voordat u begint met de behandeling met CLOZARIL 25 mg, dient u een zorgvuldig lichamelijk onderzoek, medische voorgeschiedenis en gelijktijdige medicatiegeschiedenis uit te voeren. Overweeg het verkrijgen van een baseline ECG en serumchemiepaneel. Corrigeer elektrolytafwijkingen. Stop met CLOZARIL 25 mg als het QTc-interval langer is dan 500 msec. Als patiënten symptomen ervaren die overeenkomen met torsades de pointes of andere aritmieën (bijv. syncope, presyncope, duizeligheid of hartkloppingen), laat dan een hartonderzoek uitvoeren en stop met CLOZARIL.
Wees voorzichtig bij gelijktijdige toediening van geneesmiddelen die het QT-interval verlengen of het metabolisme van CLOZARIL remmen. Geneesmiddelen die QT-verlenging veroorzaken, zijn onder meer: specifieke antipsychotica (bijv. ziprasidon, iloperidon, chloorpromazine, thioridazine, mesoridazine, droperidol, pimozide), specifieke antibiotica (bijv. erytromycine, gatifloxacine, moxifloxacine, sparfloxacine), klasse 1A anti-aritmica, procaïnamide) of klasse III antiaritmica (bijv. amiodaron, sotalol) en andere (bijv. pentamidine, levomethadylacetaat, methadon, halofantrine, mefloquine, dolasetronmesylaat, probucol of tacrolimus). Clozapine wordt voornamelijk gemetaboliseerd door de CYP-iso-enzymen 1A2, 2D6 en 3A4. Gelijktijdige behandeling met remmers van deze enzymen kan de concentratie van CLOZARIL verhogen (zie: DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Hypokaliëmie en hypomagnesiëmie verhogen het risico op QT-verlenging. Hypokaliëmie kan het gevolg zijn van diuretische therapie, diarree en andere oorzaken. Wees voorzichtig bij de behandeling van patiënten met een risico op een significante verstoring van de elektrolytenbalans, met name hypokaliëmie. Verkrijg basislijnmetingen van serumkalium- en magnesiumspiegels en controleer periodiek de elektrolyten. Corrigeer elektrolytafwijkingen voordat u begint met de behandeling met CLOZARIL.
Metabolische veranderingen
Atypische antipsychotica, waaronder CLOZARIL 50 mg, zijn in verband gebracht met metabole veranderingen die het cardiovasculaire en cerebrovasculaire risico kunnen verhogen. Deze metabole veranderingen omvatten hyperglykemie, dyslipidemie en gewichtstoename. Hoewel atypische antipsychotica enige metabole veranderingen kunnen veroorzaken, heeft elk medicijn in de klasse zijn eigen specifieke risicoprofiel.
Hyperglykemie en diabetes mellitus
Hyperglykemie, in sommige gevallen extreem en geassocieerd met ketoacidose of hyperosmolair coma of overlijden, is gemeld bij patiënten die werden behandeld met atypische antipsychotica, waaronder CLOZARIL. De beoordeling van de relatie tussen atypisch antipsychoticagebruik en glucoseafwijkingen wordt bemoeilijkt door de mogelijkheid van een verhoogd achtergrondrisico op diabetes mellitus bij patiënten met schizofrenie en de toenemende incidentie van diabetes mellitus in de algemene bevolking. Gezien deze confounders wordt de relatie tussen atypisch antipsychoticagebruik en hyperglykemiegerelateerde bijwerkingen niet volledig begrepen. Epidemiologische onderzoeken wijzen echter op een verhoogd risico op tijdens de behandeling optredende, hyperglykemiegerelateerde bijwerkingen bij patiënten die worden behandeld met de atypische antipsychotica. Precieze risicoschattingen voor aan hyperglykemie gerelateerde bijwerkingen bij patiënten die worden behandeld met atypische antipsychotica zijn niet beschikbaar.
Patiënten met een vastgestelde diagnose van diabetes mellitus die beginnen met CLOZARIL 100 mg, moeten regelmatig worden gecontroleerd op verslechtering van de glucoseregulatie. Patiënten met risicofactoren voor diabetes mellitus (bijv. obesitas, familiegeschiedenis van diabetes) die beginnen met een behandeling met atypische antipsychotica, moeten aan het begin van de behandeling en periodiek tijdens de behandeling een nuchtere bloedglucosetest ondergaan. Elke patiënt die met atypische antipsychotica wordt behandeld, moet worden gecontroleerd op symptomen van hyperglykemie, waaronder polydipsie, polyurie, polyfagie en zwakte. Patiënten die symptomen van hyperglykemie ontwikkelen tijdens behandeling met atypische antipsychotica, moeten een nuchtere bloedglucosetest ondergaan. In sommige gevallen is de hyperglykemie verdwenen toen het atypische antipsychoticum werd stopgezet; bij sommige patiënten was het echter nodig om de antidiabetische behandeling voort te zetten ondanks het stopzetten van het verdachte geneesmiddel.
In een gepoolde gegevensanalyse van 8 onderzoeken bij volwassen proefpersonen met schizofrenie waren de gemiddelde veranderingen in nuchtere glucoseconcentratie in de CLOZARIL 50 mg- en chloorpromazine-groepen respectievelijk +11 mg/dL en +4 mg/dL. Een groter deel van de CLOZARIL-groep vertoonde categorische verhogingen vanaf baseline in nuchtere glucoseconcentraties, vergeleken met de chloorpromazine-groep (Tabel 4). De doses CLOZARIL 25 mg waren 100-900 mg per dag (gemiddelde modale dosis: 512 mg per dag). De maximale dosis chloorpromazine was 1800 mg per dag (gemiddelde modale dosis: 1029 mg per dag). De mediane blootstellingsduur was 42 dagen voor CLOZARIL en chloorpromazine.
dyslipidemie
Bij patiënten die werden behandeld met atypische antipsychotica, waaronder CLOZARIL, zijn ongewenste veranderingen in de lipiden opgetreden. Klinische monitoring, inclusief baseline- en periodieke follow-up-lipidenevaluaties bij patiënten die CLOZARIL gebruiken, wordt aanbevolen.
In een gepoolde gegevensanalyse van 10 onderzoeken bij volwassen proefpersonen met schizofrenie, werd behandeling met CLOZARIL in verband gebracht met verhogingen van het totale serumcholesterol. Er werden geen gegevens verzameld over LDL- en HDL-cholesterol. De gemiddelde toename van het totale cholesterol was 13 mg/dL in de CLOZARIL 25 mg-groep en 15 mg/dL in de chloorpromazine-groep. In een gepoolde gegevensanalyse van 2 onderzoeken bij volwassen proefpersonen met schizofrenie, werd behandeling met CLOZARIL 50 mg in verband gebracht met verhogingen van nuchter serumtriglyceride. De gemiddelde toename van nuchtere triglyceride was 71 mg/dL (54%) in de CLOZARIL 100 mg-groep en 39 mg/dL (35%) in de chloorpromazine-groep (Tabel 5). Bovendien ging de behandeling met CLOZARIL gepaard met categorische verhogingen van totaal cholesterol en triglyceride in serum, zoals geïllustreerd in Tabel 6. Het aantal patiënten met categorische verhogingen van totaal cholesterol of nuchtere triglyceride nam toe met de duur van de blootstelling. De mediane duur van blootstelling aan CLOZARIL 50 mg en chloorpromazine was respectievelijk 45 dagen en 38 dagen. Het doseringsbereik van CLOZARIL was 100 mg tot 900 mg per dag; de maximale dosis chloorpromazine was 1800 mg per dag.
Gewichtstoename
Gewichtstoename is opgetreden bij het gebruik van antipsychotica, waaronder CLOZARIL. Controleer het gewicht tijdens de behandeling met CLOZARIL. Tabel 7 geeft een samenvatting van de gegevens over gewichtstoename per blootstellingsduur, verzameld uit 11 onderzoeken met CLOZARIL en actieve comparatoren. De mediane blootstellingsduur was respectievelijk 609, 728 en 42 dagen in de groep van CLOZARIL 25 mg, olanzapine en chloorpromazine.
Tabel 8 geeft een samenvatting van de gepoolde gegevens van 11 onderzoeken bij volwassen proefpersonen met schizofrenie die een gewichtstoename van ≥7% van het lichaamsgewicht ten opzichte van baseline aantoonden. De mediane blootstellingsduur was respectievelijk 609, 728 en 42 dagen in de CLOZARIL-, olanzapine- en chloorpromazinegroep.
Maligne neurolepticasyndroom
Antipsychotica, waaronder CLOZARIL 50 mg, kunnen een potentieel fataal symptoomcomplex veroorzaken, dat wordt aangeduid als Maligne Neurolepticasyndroom (MNS). Klinische manifestaties van MNS omvatten hyperpyrexie, spierstijfheid, veranderde mentale toestand en autonome instabiliteit (onregelmatige pols of bloeddruk, tachycardie, diaforese en hartritmestoornissen). Geassocieerde bevindingen kunnen zijn: verhoogde creatinefosfokinase (CPK), myoglobinurie, rabdomyolyse en acuut nierfalen.
De diagnostische evaluatie van patiënten met dit syndroom is gecompliceerd. Het is belangrijk om rekening te houden met de aanwezigheid van andere ernstige medische aandoeningen (bijv. ernstige neutropenie, infectie, hitteberoerte, primaire CZS-pathologie, centrale anticholinerge toxiciteit, extrapiramidale symptomen en medicijnkoorts).
De behandeling van MNS dient te omvatten (1) onmiddellijke stopzetting van antipsychotica en andere geneesmiddelen die niet essentieel zijn voor gelijktijdige therapie, (2) intensieve symptomatische behandeling en medische controle, en (3) behandeling van comorbide medische aandoeningen. Er is geen algemene overeenstemming over specifieke farmacologische behandelingen voor NMS.
Als een patiënt behandeling met antipsychotica nodig heeft na herstel van MNS, moet de mogelijke herintroductie van medicamenteuze therapie zorgvuldig worden overwogen. NMS kan terugkeren. Controleer nauwlettend bij het hervatten van de behandeling met antipsychotica.
NMS is opgetreden bij monotherapie met CLOZARIL en bij gelijktijdige CZS-actieve medicatie, waaronder lithium.
Hepatotoxiciteit
Ernstige, levensbedreigende en in sommige gevallen fatale levertoxiciteit waaronder leverfalen, levernecrose en hepatitis zijn gemeld in postmarketingonderzoeken bij patiënten die met clozapine werden behandeld [zie ONGEWENSTE REACTIES ]. Controleer op het optreden van tekenen en symptomen van hepatotoxiciteit zoals vermoeidheid, malaise, anorexia, misselijkheid, geelzucht, bilirubinemie, coagulopathie en hepatische encefalopathie. Voer serumtests uit op leverbeschadiging en overweeg om de behandeling definitief te staken als hepatitis of transaminaseverhogingen in combinatie met andere systemische symptomen te wijten zijn aan clozapine.
Koorts
Tijdens de behandeling met clozapine hebben patiënten voorbijgaande, clozapine-gerelateerde koorts ervaren. De piekincidentie is binnen de eerste 3 weken van de behandeling. Hoewel deze koorts over het algemeen goedaardig en zelflimiterend is, kan het nodig zijn de behandeling te staken. De koorts kan gepaard gaan met een toename of afname van het aantal leukocyten. Beoordeel patiënten met koorts zorgvuldig om ernstige neutropenie of infectie uit te sluiten. Overweeg de mogelijkheid van NMS [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Longembolie
Longembolie en diep-veneuze trombose zijn opgetreden bij patiënten die met CLOZARIL werden behandeld. Overweeg de mogelijkheid van longembolie bij patiënten die zich presenteren met diepveneuze trombose, acute dyspneu, pijn op de borst of met andere respiratoire tekenen en symptomen. Of longembolie en diep-veneuze trombose kunnen worden toegeschreven aan clozapine of aan bepaalde kenmerken van patiënten is niet duidelijk.
Anticholinerge toxiciteit
CLOZARIL 50 mg heeft krachtige anticholinerge effecten. Behandeling met CLOZARIL kan leiden tot CZS en perifere anticholinerge toxiciteit, vooral bij hogere doseringen, of in situaties van overdosering (zie OVERDOSERING ]. Voorzichtig gebruiken bij patiënten met een huidige diagnose of voorgeschiedenis van constipatie, urineretentie, klinisch significante prostaathypertrofie of andere aandoeningen waarbij anticholinerge effecten kunnen leiden tot significante bijwerkingen. Vermijd indien mogelijk gelijktijdig gebruik met andere anticholinerge geneesmiddelen omdat het risico op anticholinerge toxiciteit of ernstige gastro-intestinale bijwerkingen is verhoogd (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Interferentie met cognitieve en motorische prestaties
CLOZARIL kan sedatie en verslechtering van cognitieve en motorische prestaties veroorzaken. Waarschuw patiënten voor het bedienen van gevaarlijke machines, inclusief auto's, totdat ze er redelijk zeker van zijn dat CLOZARIL hen niet nadelig beïnvloedt. Deze reacties kunnen dosisgerelateerd zijn. Overweeg de dosis te verlagen als ze zich voordoen.
Tardieve dyskinesie
Tardieve dyskinesie (TD) is opgetreden bij patiënten die werden behandeld met antipsychotica, waaronder CLOZARIL. Het syndroom bestaat uit potentieel onomkeerbare, onwillekeurige, dyskinetische bewegingen. Aangenomen wordt dat het risico op TD en de waarschijnlijkheid dat het onomkeerbaar wordt, toenemen naarmate de behandeling langer duurt en de totale cumulatieve doses hoger zijn. Het syndroom kan zich echter ontwikkelen na relatief korte behandelingsperioden bij lage doses. Schrijf CLOZARIL voor op een manier die het risico op het ontwikkelen van TD het meest waarschijnlijk minimaliseert. Gebruik de laagste effectieve dosis en de kortste duur die nodig is om de symptomen onder controle te houden. Beoordeel regelmatig de noodzaak van voortzetting van de behandeling. Overweeg de behandeling te staken als TD optreedt. Sommige patiënten kunnen echter ondanks de aanwezigheid van het syndroom behandeling met CLOZARIL 100 mg nodig hebben.
Er is geen bekende behandeling voor TD. Het syndroom kan echter gedeeltelijk of volledig verdwijnen als de behandeling wordt stopgezet. Behandeling met antipsychotica kan zelf de tekenen en symptomen onderdrukken (of gedeeltelijk onderdrukken) en kan het onderliggende proces maskeren. Het effect van symptoomonderdrukking op het lange termijn beloop van TD is onbekend.
Cerebrovasculaire bijwerkingen
In gecontroleerde onderzoeken hadden oudere patiënten met aan dementie gerelateerde psychose die werden behandeld met sommige atypische antipsychotica een verhoogd risico (vergeleken met placebo) op cerebrovasculaire bijwerkingen (bijv. beroerte, voorbijgaande ischemische aanval), inclusief dodelijke afloop. Het mechanisme voor dit verhoogde risico is niet bekend. Een verhoogd risico kan niet worden uitgesloten voor CLOZARIL of andere antipsychotica of andere patiëntenpopulaties. CLOZARIL 50 mg moet met voorzichtigheid worden gebruikt bij patiënten met risicofactoren voor cerebrovasculaire bijwerkingen.
Herhaling van psychose en cholinerge rebound na abrupte stopzetting van CLOZARIL
Als abrupt stoppen met CLOZARIL noodzakelijk is (bijvoorbeeld vanwege ernstige neutropenie of een andere medische aandoening) (zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], controleer zorgvuldig op het opnieuw optreden van psychotische symptomen en bijwerkingen gerelateerd aan cholinerge rebound, zoals overvloedig zweten, hoofdpijn, misselijkheid, braken en diarree.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Er werd geen carcinogeen potentieel aangetoond in langetermijnstudies bij muizen en ratten bij doses tot respectievelijk 0,3 keer en 0,4 keer de maximaal aanbevolen dosis voor de mens (MRHD) van 900 mg/dag op basis van mg/m² lichaamsoppervlak.
Mutagenese
Clozapine was niet genotoxisch bij testen in de volgende genmutatie- en chromosomale aberratietests: de bacteriële Ames-test, de in vitro zoogdier V79 in Chinese hamstercellen, de in vitro ongeplande DNA-synthese in rattenhepatocyten of de in vivo micronucleustest bij muizen.
Aantasting van de vruchtbaarheid
Clozapine had geen effect op parameters van vruchtbaarheid, zwangerschap, foetaal gewicht of postnatale ontwikkeling bij orale toediening aan mannelijke ratten 70 dagen vóór het paren en aan vrouwelijke ratten gedurende 14 dagen vóór het paren in doses tot 0,4 maal de MRHD van 900 mg/dag op op basis van mg/m² lichaamsoppervlak.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie B
Risico Samenvatting
Er zijn geen adequate of goed gecontroleerde onderzoeken naar clozapine bij zwangere vrouwen.
Er zijn reproductieonderzoeken uitgevoerd bij ratten en konijnen met doses tot respectievelijk 0,4 en 0,9 maal de maximaal aanbevolen dosis voor de mens (MRHD) van 900 mg/dag op basis van mg/m² lichaamsoppervlak. De onderzoeken brachten geen bewijs aan het licht van verminderde vruchtbaarheid of schade aan de foetus als gevolg van clozapine. Omdat reproductiestudies bij dieren niet altijd een voorspellende waarde hebben voor de respons bij de mens, mag CLOZARIL alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Klinische overwegingen
Houd rekening met het risico op verergering van psychose bij het stopzetten of wijzigen van de behandeling met antipsychotica tijdens de zwangerschap en postpartum. Overweeg vroege screening op zwangerschapsdiabetes voor patiënten die worden behandeld met antipsychotica [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Pasgeborenen die tijdens het derde trimester van de zwangerschap aan antipsychotica zijn blootgesteld, lopen risico op extrapiramidale en/of ontwenningsverschijnselen na de bevalling. Controleer pasgeborenen op symptomen van agitatie, hypertonie, hypotonie, tremor, slaperigheid, ademnood en voedingsproblemen. De ernst van de complicaties kan variëren van zelfbeperkende symptomen tot sommige pasgeborenen die ondersteuning op de intensive care en langdurige ziekenhuisopname nodig hebben.
Dierlijke gegevens
In embryofoetale ontwikkelingsstudies had clozapine geen effect op maternale parameters, worpgroottes of foetale parameters bij orale toediening aan drachtige ratten en konijnen tijdens de periode van organogenese in doses tot respectievelijk 0,4 en 0,9 maal de MRHD van 900 mg/dag op basis van mg/m² lichaamsoppervlak.
In peri/postnatale ontwikkelingsstudies kregen zwangere vrouwelijke ratten clozapine toegediend gedurende het laatste derde deel van de zwangerschap en tot dag 21 postpartum. Er werden waarnemingen gedaan bij foetussen bij de geboorte en tijdens de postnatale periode; de nakomelingen mochten geslachtsrijp worden en paren. Clozapine veroorzaakte een afname van het lichaamsgewicht van de moeder, maar had geen effect op de worpgrootte of het lichaamsgewicht van de F1- of F2-generaties bij doses tot 0,4 keer de MRHD van 900 mg/dag op basis van mg/m² lichaamsoppervlak.
Moeders die borstvoeding geven
CLOZARIL 50 mg is aanwezig in de moedermelk. Vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen van CLOZARIL, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Er zijn in klinische onderzoeken onvoldoende geriatrische patiënten geweest die CLOZARIL 50 mg gebruikten om te bepalen of personen ouder dan 65 jaar verschillen van jongere proefpersonen in hun reactie op CLOZARIL.
Orthostatische hypotensie en tachycardie kunnen optreden bij behandeling met CLOZARIL 50 mg [zie GEVAARLIJKE WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Oudere patiënten, met name patiënten met een verminderd cardiovasculair functioneren, kunnen vatbaarder zijn voor deze effecten.
Oudere patiënten kunnen bijzonder gevoelig zijn voor de anticholinerge effecten van CLOZARIL, zoals urineretentie en constipatie (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Selecteer zorgvuldig doses CLOZARIL 50 mg bij oudere patiënten, rekening houdend met hun grotere frequentie van verminderde lever-, nier- of hartfunctie, evenals andere gelijktijdige ziekte en andere medicamenteuze behandeling. Klinische ervaring suggereert dat de prevalentie van tardieve dyskinesie het hoogst lijkt te zijn bij ouderen; vooral oudere vrouwen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Patiënten met nier- of leverinsufficiëntie
Dosisverlaging kan nodig zijn bij patiënten met een significante nier- of leverfunctiestoornis. Clozapineconcentraties kunnen bij deze patiënten verhoogd zijn, omdat clozapine bijna volledig wordt gemetaboliseerd en vervolgens wordt uitgescheiden [zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
CYP2D6 slechte metaboliseerders
Dosisverlaging kan nodig zijn bij patiënten die trage CYP2D6-metaboliseerders zijn. Clozapineconcentraties kunnen bij deze patiënten verhoogd zijn, omdat clozapine bijna volledig wordt gemetaboliseerd en vervolgens wordt uitgescheiden [zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
Hospice-patiënten
Voor hospicepatiënten (dwz terminaal zieke patiënten met een geschatte levensverwachting van zes maanden of minder), kan de voorschrijver de ANC-monitoringfrequentie verlagen tot eenmaal per 6 maanden, na overleg met de patiënt en zijn/haar verzorger. Individuele behandelbeslissingen moeten het belang van monitoring van ANC afwegen in de context van de noodzaak om psychiatrische symptomen en de terminale ziekte van de patiënt onder controle te houden.
OVERDOSERING
Overdosering Ervaring
De meest gemelde tekenen en symptomen geassocieerd met een overdosis clozapine zijn: sedatie, delirium, coma, tachycardie, hypotensie, ademhalingsdepressie of falen; en hypersalivatie. Er zijn meldingen van aspiratiepneumonie, hartritmestoornissen en toevallen. Fatale overdoses zijn gemeld met clozapine, in het algemeen bij doses hoger dan 2500 mg. Er zijn ook meldingen geweest van patiënten die herstelden van een overdosis van meer dan 4 g.
Beheer van overdosering
Er is geen specifiek antidotum beschikbaar voor een overdosis CLOZARIL. Een luchtweg tot stand brengen en onderhouden; zorg voor voldoende zuurstofvoorziening en ventilatie. Controleer de hartstatus en vitale functies. Gebruik algemene symptomatische en ondersteunende maatregelen. Overweeg de mogelijkheid van betrokkenheid van meerdere geneesmiddelen.
Neem contact op met een gecertificeerd antigifcentrum voor de meest actuele informatie over het beheer van overdosering (1-800-222-1222).
CONTRA-INDICATIES
CLOZARIL is gecontra-indiceerd bij patiënten met een voorgeschiedenis van ernstige overgevoeligheid voor clozapine (bijv. fotosensitiviteit, vasculitis, erythema multiforme of Stevens-Johnson-syndroom) of enig ander bestanddeel van CLOZARIL (zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van clozapine is niet bekend. Er is echter voorgesteld dat de therapeutische werkzaamheid van clozapine bij schizofrenie wordt gemedieerd door antagonisme van de dopamine type 2 (D2) en de serotonine type 2A (5ÂHT2A) receptoren. CLOZARIL werkt ook als een antagonist bij adrenerge, cholinerge, histaminerge en andere dopaminerge en serotonerge receptoren.
farmacodynamiek
Clozapine vertoonde bindingsaffiniteit voor de volgende receptoren: histamine H1 (Ki 1,1 nM), adrenerge α1A (Ki 1,6 nM), serotonine 5-HT6 (Ki 4 nM), serotonine 5-HT2A (Ki 5,4 nM), muscarine M1 (Ki 6,2 nM), serotonine 5-HT7 (Ki 6,3 nM), serotonine 5-HT2C (Ki 9,4 nM), dopamine D4 (Ki 24 nM), adrenerge α2A (Ki 90 nM), serotonine 5-HT3 (Ki 95 nM), serotonine 5-HT1A (Ki 120 nM), dopamine D2 (Ki 160 nM), dopamine D1 (Ki 270 nM), dopamine D5 (Ki 454 nM) en dopamine D3 (Ki 555 nM).
Clozapine veroorzaakt weinig of geen prolactineverhoging.
Klinische elektro-encefalogram (EEG) studies hebben aangetoond dat clozapine de delta- en theta-activiteit verhoogt en de dominante alfafrequenties vertraagt. Er vindt verbeterde synchronisatie plaats. Er kunnen zich ook scherpe golfactiviteit en piek- en golfcomplexen ontwikkelen. Patiënten hebben een intensivering van de droomactiviteit gemeld tijdens de behandeling met clozapine. De REM-slaap bleek te worden verlengd tot 85% van de totale slaaptijd. Bij deze patiënten begon de REM-slaap bijna onmiddellijk na het inslapen.
Farmacokinetiek
Absorptie
Bij mensen zijn CLOZARIL-tabletten (25 mg en 100 mg) even biologisch beschikbaar als een CLOZARIL-oplossing. Na orale toediening van tweemaal daags 100 mg CLOZARIL was de gemiddelde steady-state piekplasmaconcentratie 319 ng/ml (bereik: 102 tot 771 ng/ml), optredend na gemiddeld 2,5 uur (bereik: 1 tot 6 uur) na dosering. De gemiddelde minimale concentratie bij steady-state was 122 ng/ml (bereik: 41 tot 343 ng/ml), na een dosering van tweemaal daags 100 mg. Voedsel lijkt de systemische biologische beschikbaarheid van CLOZARIL niet te beïnvloeden. CLOZARIL 50 mg kan dus met of zonder voedsel worden toegediend.
Verdeling
Clozapine is voor ongeveer 97% gebonden aan serumeiwitten. De interactie tussen clozapine en andere sterk eiwitgebonden geneesmiddelen is niet volledig onderzocht, maar kan belangrijk zijn [zie: DRUG-INTERACTIES ].
Metabolisme en uitscheiding
Clozapine wordt bijna volledig gemetaboliseerd voorafgaand aan excretie, en alleen sporen van onveranderd geneesmiddel worden gedetecteerd in de urine en feces. Clozapine is een substraat voor veel cytochroom P450-isozymen, met name CYP1A2, CYP2D6 en CYP3A4. Ongeveer 50% van de toegediende dosis wordt uitgescheiden in de urine en 30% in de feces. De gedemethyleerde, gehydroxyleerde en N-oxidederivaten zijn componenten in zowel urine als ontlasting. Farmacologische testen hebben aangetoond dat de desmethylmetaboliet (norclozapine) slechts een beperkte activiteit heeft, terwijl de gehydroxyleerde en N-oxidederivaten inactief waren. De gemiddelde eliminatiehalfwaardetijd van clozapine na een enkelvoudige dosis van 75 mg was 8 uur (bereik: 4 tot 12 uur), vergeleken met een gemiddelde eliminatiehalfwaardetijd van 12 uur (bereik: 4 tot 66 uur), na het bereiken van steady-state met een dosering van tweemaal daags 100 mg.
Een vergelijking van enkelvoudige en meervoudige doseringen van clozapine toonde aan dat de eliminatiehalfwaardetijd significant toenam na meervoudige dosering ten opzichte van die na enkelvoudige dosering, wat wijst op de mogelijkheid van concentratieafhankelijke farmacokinetiek. Bij steady state werden echter ongeveer dosisproportionele veranderingen met betrekking tot de AUC (area under the curve), piek- en minimale clozapine-plasmaconcentraties waargenomen na toediening van 37,5, 75 en 150 mg tweemaal daags.
Onderzoek naar interactie tussen geneesmiddelen
Fluvoxamine
Er is een farmacokinetisch onderzoek uitgevoerd bij 16 schizofrene patiënten die clozapine kregen onder steady-state-omstandigheden. Na gelijktijdige toediening van fluvoxamine gedurende 14 dagen waren de gemiddelde dalconcentraties van clozapine en zijn metabolieten, N-desmethylclozapine en clozapine N-oxide, ongeveer drievoudig verhoogd in vergelijking met baseline steady-state concentraties.
Paroxetine, Fluoxetine en Sertraline
In een onderzoek bij schizofrene patiënten (n=14) die clozapine kregen onder steady-state-omstandigheden, veroorzaakte gelijktijdige toediening van paroxetine slechts kleine veranderingen in de spiegels van clozapine en zijn metabolieten. Andere gepubliceerde rapporten beschrijven echter bescheiden verhogingen (minder dan twee keer zo hoog) van clozapine- en metabolietconcentraties wanneer clozapine werd ingenomen met paroxetine, fluoxetine en sertraline.
Specifieke bevolkingsonderzoeken
Nier- of leverfunctiestoornis
Er zijn geen specifieke farmacokinetische onderzoeken uitgevoerd om de effecten van nier- of leverinsufficiëntie op de farmacokinetiek van clozapine te onderzoeken. Hogere plasmaconcentraties van clozapine zijn waarschijnlijk bij patiënten met een significante nier- of leverfunctiestoornis bij toediening van de gebruikelijke doses.
CYP2D6 slechte metaboliseerders
Een subgroep (3%-10%) van de bevolking heeft een verminderde activiteit van CYP2D6 (slechte metaboliseerders van CYP2D6). Deze personen kunnen hogere dan verwachte plasmaconcentraties van clozapine ontwikkelen wanneer ze de gebruikelijke doses krijgen.
Klinische studies
Behandelingsresistente schizofrenie
De werkzaamheid van CLOZARIL 100 mg bij therapieresistente schizofrenie werd vastgesteld in een multicenter, gerandomiseerde, dubbelblinde, actief gecontroleerde (chloorpromazine) studie bij patiënten met een DSM-III-diagnose van schizofrenie die onvoldoende reageerden op ten minste 3 verschillende antipsychotica ( uit ten minste 2 verschillende chemische klassen) gedurende de voorafgaande 5 jaar. De antipsychotica-onderzoeken moeten adequaat zijn beoordeeld; de doseringen van de antipsychotica moeten gedurende een periode van ten minste 6 weken gelijk zijn aan of hoger zijn dan 1000 mg chloorpromazine per dag, elk zonder significante vermindering van symptomen. Er mag in de afgelopen 5 jaar geen periode van goed functioneren zijn geweest. Patiënten moeten een baselinescore van ten minste 45 hebben gehad op de door de onderzoeker beoordeelde Brief Psychiatric Rating Scale (BPRS). Op de BPRS met 18 items geeft 1 de afwezigheid van symptomen aan en 7 geeft ernstige symptomen aan; de maximale potentiële totale BPRS-score is 126. Bij aanvang was de gemiddelde BPRS-score 61. Bovendien moeten patiënten een score van ten minste 4 hebben gehad op ten minste twee van de volgende vier individuele BPRS-items: conceptuele desorganisatie, achterdocht, hallucinatoire gedrag en ongewone gedachteninhoud. Patiënten moeten een Clinical Global Impressions-Severity Scale-score van ten minste 4 (matig ziek) hebben gehad.
In de prospectieve, inleidende fase van het onderzoek kregen alle patiënten (N=305) aanvankelijk een enkelblinde behandeling met haloperidol (de gemiddelde dosis was 61 mg per dag) gedurende 6 weken. Meer dan 80% van de patiënten voltooide de proef van 6 weken. Patiënten met een onvoldoende respons op haloperidol (n=268) werden gerandomiseerd voor dubbelblinde behandeling met CLOZARIL (N=126) of chloorpromazine (N=142). De maximale dagelijkse dosis CLOZARIL was 900 mg; de gemiddelde dagelijkse dosis was >600 mg. De maximale dagelijkse dosis chloorpromazine was 1800 mg; de gemiddelde dagelijkse dosis was >1200 mg.
Het primaire eindpunt was de respons op de behandeling, vooraf gedefinieerd als een afname van de BPRS-score van ten minste 20% en ofwel (1) een CGI-S-score van
Terugkerend suïcidaal gedrag bij schizofrenie of schizoaffectieve stoornis
De effectiviteit van CLOZARIL bij het verminderen van het risico op recidiverend suïcidaal gedrag werd beoordeeld in de International Suicide Prevention Trial (InterSePT™, een handelsmerk van Novartis Pharmaceuticals Corporation). Dit was een prospectieve, gerandomiseerde, open-label, actief gecontroleerde, multicenter, internationale vergelijking in parallelle groepen van CLOZARIL versus olanzapine (*Zyprexa®, een geregistreerd handelsmerk van Eli Lilly and Company) bij 956 patiënten met schizofrenie of schizoaffectieve stoornis ( DSM-IV) die werden beoordeeld als een risico op recidiverend suïcidaal gedrag. Slechts ongeveer een vierde van deze patiënten (27%) werd als resistent beschouwd tegen de standaardbehandeling met antipsychotica. Om deel te nemen aan de studie, moeten patiënten aan 1 van de volgende criteria hebben voldaan:
- Ze hadden geprobeerd zelfmoord te plegen in de drie jaar voorafgaand aan hun baseline-evaluatie.
- Ze waren in de drie jaar voorafgaand aan hun baseline-evaluatie opgenomen in het ziekenhuis om een zelfmoordpoging te voorkomen.
- Ze vertoonden matige tot ernstige zelfmoordgedachten met een depressieve component binnen een week voorafgaand aan hun baseline-evaluatie.
- Ze vertoonden matige tot ernstige zelfmoordgedachten, vergezeld van hallucinaties van het commando om zichzelf te beschadigen binnen een week voorafgaand aan hun baseline-evaluatie.
Doseringsschema's voor elke behandelingsgroep werden bepaald door individuele onderzoekers en werden door de patiënt geïndividualiseerd. De dosering was flexibel, met een doseringsbereik van 200-900 mg/dag voor CLOZARIL en 5-20 mg/dag voor olanzapine. Bij de 956 patiënten die in dit onderzoek CLOZARIL of olanzapine kregen, was er uitgebreid gelijktijdig gebruik van psychotrope middelen: 84% met antipsychotica, 65% met anxiolytica, 53% met antidepressiva en 28% met stemmingsstabilisatoren. Er was significant meer gebruik van gelijktijdige psychotrope medicatie bij de patiënten in de olanzapinegroep.
De primaire werkzaamheidsmaatstaf was de tijd tot (1) een significante zelfmoordpoging, inclusief een voltooide zelfmoord; (2) ziekenhuisopname vanwege dreigend zelfmoordrisico, inclusief verhoogd toezicht op suïcidaliteit voor patiënten die al in het ziekenhuis zijn opgenomen; of (3) verergering van de ernst van suïcidaliteit zoals aangetoond door "veel verslechtering" of "zeer veel verslechtering" vanaf baseline in de Clinical Global Impression of Severity of Suicidality zoals beoordeeld door de schaal van de Blinded Psychiatrist  (CGI-SS-BP). De Suicide Monitoring Board (SMB), een groep deskundigen die blind was voor patiëntgegevens, heeft bepaald of een gemelde gebeurtenis al dan niet aan criterium 1 of 2 hierboven voldeed.
In totaal werden 980 patiënten gerandomiseerd voor de studie en 956 kregen studiemedicatie. Tweeënzestig procent van de patiënten werd gediagnosticeerd met schizofrenie, en de rest (38%) werd gediagnosticeerd met een schizoaffectieve stoornis. Slechts ongeveer een vierde van de totale patiëntenpopulatie (27%) werd bij baseline geïdentificeerd als 'behandelingsresistent'. Er waren meer mannen dan vrouwen in de studie (61% van alle patiënten was man). De gemiddelde leeftijd van de patiënten die deelnamen aan het onderzoek was 37 jaar (bereik 18-69). De meeste patiënten waren blank (71%), 15% was zwart, 1% was Aziatisch en 13% was geclassificeerd als van "andere" rassen.
Patiënten die werden behandeld met CLOZARIL 100 mg hadden een statistisch significant langere vertraging in de tijd tot recidiverend suïcidaal gedrag in vergelijking met olanzapine. Dit resultaat mag alleen worden geïnterpreteerd als bewijs van de effectiviteit van CLOZARIL bij het uitstellen van de tijd tot recidiverend suïcidaal gedrag en niet als een demonstratie van de superieure werkzaamheid van CLOZARIL 50 mg ten opzichte van olanzapine.
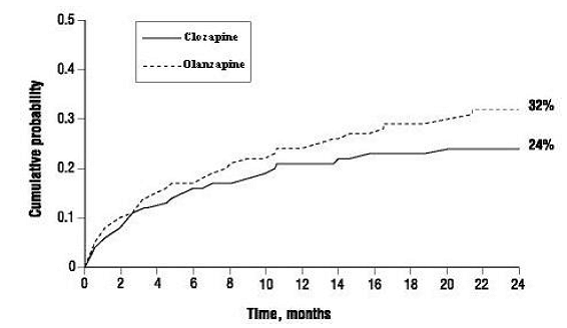
De kans op het ervaren van (1) een significante zelfmoordpoging, inclusief een voltooide zelfmoord, of (2) ziekenhuisopname vanwege een dreigend zelfmoordrisico, inclusief verhoogd toezicht op suïcidaliteit voor patiënten die al in het ziekenhuis waren opgenomen, was lager voor CLOZARIL-patiënten dan voor olanzapinepatiënten op Week 104: CLOZARIL 24% versus olanzapine 32%; 95% BI van het verschil: 2%, 14% (Figuur 1).
Figuur 1: Cumulatieve kans op een significante zelfmoordpoging of ziekenhuisopname om zelfmoord te voorkomen bij patiënten met schizofrenie of schizoaffectieve stoornis met een hoog risico op suïcidaliteit
PATIËNT INFORMATIE
Bespreek de volgende problemen met patiënten en zorgverleners:
- Ernstige neutropenie:
- Instrueer patiënten (en zorgverleners) die beginnen met de behandeling met CLOZARIL over het risico op het ontwikkelen van ernstige neutropenie en infectie.
- Instrueer patiënten om elk symptoom of teken van infectie onmiddellijk aan hun arts te melden (bijv. griepachtige ziekte; koorts; lethargie; algemene zwakte of malaise; ulceratie van slijmvliezen; huid, faryngeale, vaginale, urine- of longinfectie; of extreme zwakte of lethargie) optredend op enig moment tijdens de behandeling met CLOZARIL 100 mg, om te helpen bij de evaluatie van neutropenie en om snel en passend beheer in te stellen. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Informeer patiënten en zorgverleners CLOZARIL 25 mg is alleen beschikbaar via een beperkt programma, het Clozapine REMS-programma genaamd, dat is ontworpen om de vereiste bloedcontrole te garanderen om het risico op het ontwikkelen van ernstige neutropenie te verminderen. Adviseer patiënten en zorgverleners als volgt over het belang van bloedonderzoek:
- Gedurende de eerste 6 maanden is wekelijks bloedonderzoek vereist.
- Een ANC is elke 2 weken vereist gedurende de volgende 6 maanden als een aanvaardbare ANC wordt gehandhaafd tijdens de eerste 6 maanden van continue therapie,
- Een ANC is daarna eenmaal per 4 weken vereist als een acceptabel ANC wordt gehandhaafd tijdens de tweede 6 maanden van continue therapie.
- CLOZARIL 50 mg is alleen verkrijgbaar bij gecertificeerde apotheken die deelnemen aan het programma. Geef patiënten (en zorgverleners) website-informatie en het telefoonnummer voor het verkrijgen van het product (www.clozapinerems.com of 1-844-267-8678) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Orthostatische hypotensie, bradycardie en syncope: Informeer patiënten en zorgverleners over het risico van orthostatische hypotensie en syncope, vooral tijdens de periode van initiële dosistitratie. Instrueer hen om de instructies van de arts voor dosering en toediening strikt op te volgen. Adviseer patiënten om onmiddellijk hun arts te raadplegen als ze zich flauw voelen, het bewustzijn verliezen of tekenen of symptomen hebben die wijzen op bradycardie of aritmie [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Epileptische aanvallen: Informeer patiënten en zorgverleners over het significante risico op epileptische aanvallen tijdens de behandeling met CLOZARIL 100 mg. Waarschuw hen voor autorijden en andere mogelijk gevaarlijke activiteiten tijdens het gebruik van CLOZARIL [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Gastro-intestinale hypomotiliteit met ernstige complicaties: Informeer patiënten en zorgverleners over de risico's, preventie en behandeling van door clozapine veroorzaakte constipatie, inclusief medicijnen die indien mogelijk moeten worden vermeden (bijv. geneesmiddelen met anticholinerge activiteit). Moedig passende hydratatie, fysieke activiteit en vezelinname aan en benadruk dat snelle aandacht en behandeling van de ontwikkeling van constipatie of andere gastro-intestinale symptomen van cruciaal belang is bij het voorkomen van ernstige complicaties. Adviseer patiënten en zorgverleners om contact op te nemen met hun zorgverlener als ze symptomen van constipatie ervaren (bijv. moeite met ontlasting, onvolledige ontlasting, verminderde stoelgangfrequentie) of andere symptomen die verband houden met gastro-intestinale hypomotiliteit (bijv. misselijkheid, opgezette buik of pijn, braken) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- Verlenging van het QT-interval: Adviseer patiënten om onmiddellijk hun arts te raadplegen als ze zich flauw voelen, het bewustzijn verliezen of tekenen of symptomen hebben die wijzen op aritmie. Instrueer patiënten om CLOZARIL niet te gebruiken met andere geneesmiddelen die verlenging van het QT-interval veroorzaken. Instrueer patiënten om hun artsen te informeren dat ze CLOZARIL 25 mg gebruiken voordat ze een nieuw medicijn gebruiken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
- Metabole veranderingen (hyperglykemie en diabetes mellitus, dyslipidemie, gewichtstoename): Informeer patiënten en zorgverleners over het risico van metabole veranderingen en de noodzaak van specifieke monitoring. De risico's omvatten hyperglykemie en diabetes mellitus, dyslipidemie, gewichtstoename en cardiovasculaire reacties. Informeer patiënten en zorgverleners over de symptomen van hyperglykemie (hoge bloedsuikerspiegel) en diabetes mellitus (bijv. polydipsie, polyurie, polyfagie en zwakte). Controleer alle patiënten op deze symptomen. Bij patiënten bij wie diabetes is vastgesteld of bij wie risicofactoren voor diabetes (obesitas, familiale voorgeschiedenis van diabetes) zijn vastgesteld, moet hun nuchtere bloedglucose worden gecontroleerd voordat met de behandeling wordt begonnen en periodiek tijdens de behandeling. Bij patiënten die symptomen van hyperglykemie ontwikkelen, moet de nuchtere glucose worden beoordeeld. Klinische controle van het gewicht wordt aanbevolen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Interferentie met cognitieve en motorische prestaties: omdat CLOZARIL het beoordelingsvermogen, het denken of de motoriek kan aantasten, moeten patiënten worden gewaarschuwd voor het bedienen van gevaarlijke machines, inclusief auto's, totdat ze redelijk zeker zijn dat de behandeling met CLOZARIL geen nadelige gevolgen voor hen heeft [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Gemiste doses en herstarten van de behandeling: Informeer patiënten en zorgverleners dat als de patiënt het gebruik van CLOZARIL 50 mg gedurende meer dan 2 dagen overslaat, ze hun medicatie niet met dezelfde dosering mogen hervatten, maar contact moeten opnemen met hun arts voor doseringsinstructies [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Zwangerschap: Patiënten en zorgverleners moeten de arts op de hoogte stellen als de patiënte zwanger wordt of van plan is zwanger te worden tijdens de behandeling [zie Gebruik bij specifieke populaties ].
- Verpleegkunde: adviseer patiënten en zorgverleners dat de patiënt geen borstvoeding mag geven aan een baby als ze CLOZARIL gebruiken (zie Gebruik bij specifieke populaties ].
- Gelijktijdige medicatie: Adviseer patiënten om hun zorgverlener te informeren als ze geneesmiddelen op recept of vrij verkrijgbare medicijnen gebruiken of van plan zijn te gebruiken; er is een potentieel voor significante interacties tussen geneesmiddelen [zie DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES ].
