Buspar 5mg, 10mg Buspirone Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Buspar en hoe wordt het gebruikt?
Buspar 5 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van angststoornissen te behandelen. Buspar 5 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Buspar behoort tot een klasse geneesmiddelen die anti-angstmiddelen, anxiolytica en niet-benzodiazepinen worden genoemd.
Wat zijn de mogelijke bijwerkingen van Buspar?
Wat zijn de mogelijke bijwerkingen van Buspar 5 mg?
Buspar kan ernstige bijwerkingen veroorzaken, waaronder:
- pijn op de borst,
- kortademigheid, en
- duizeligheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Buspar zijn:
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- slaapprobleem (slapeloosheid),
- misselijkheid,
- maagklachten, en
- nerveus of opgewonden voelen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Buspar. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Buspironhydrochloride-tabletten, USP zijn een anti-angstmiddel dat niet chemisch of farmacologisch verwant is aan de benzodiazepinen, barbituraten of andere kalmerende / anxiolytische geneesmiddelen.
Buspironhydrochloride, USP is een wit kristallijn poeder. Het is zeer oplosbaar in water; goed oplosbaar in methanol en in methyleenchloride; slecht oplosbaar in ethanol en in acetonitril; zeer slecht oplosbaar in ethylacetaat en praktisch onoplosbaar in hexanen. Het molecuulgewicht is 422. Chemisch gezien is buspironhydrochloride 8-[4-[4-(2-pyrimidinyl)-1-piperazinyl]butyl]-8-azaspiro[4.5]decaan-7,9-dionmonohydrochloride. De molecuulformule C21H31N5O2•HCl wordt weergegeven door de volgende structuurformule:
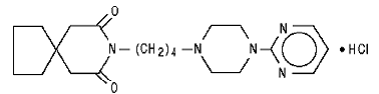
Elke buspironhydrochloride-tablet bedoeld voor orale toediening bevat 5 mg of 10 mg of 15 mg of 30 mg buspironhydrochloride (overeenkomend met respectievelijk 4,6 mg, 9,1 mg, 13,7 mg en 27,4 mg vrije base buspiron). Bovendien bevat elke tablet de volgende inactieve ingrediënten: colloïdaal siliciumdioxide, lactosemonohydraat, magnesiumstearaat, microkristallijne cellulose en natriumzetmeelglycolaat. De tabletten van 5 mg en 10 mg hebben een breukstreep zodat ze in tweeën kunnen worden gesneden. De tablet van 5 mg kan dus ook een dosis van 2,5 mg opleveren en de tablet van 10 mg kan een dosis van 5 mg opleveren. De tabletten van 15 mg en 30 mg hebben een breukstreep, zodat ze in twee of in drieën kunnen worden gesneden. Zo kan een enkele tablet van 15 mg de volgende doses opleveren: 15 mg (hele tablet), 10 mg (twee derde van een tablet), 7,5 mg (een halve tablet) of 5 mg (een derde van een tablet) . Een enkele tablet van 30 mg kan de volgende doses opleveren: 30 mg (hele tablet), 20 mg (twee derde van een tablet), 15 mg (een halve tablet) of 10 mg (een derde van een tablet).
INDICATIES
Buspironhydrochloride-tabletten zijn geïndiceerd voor de behandeling van angststoornissen of de kortetermijnverlichting van de symptomen van angst. Angst of spanning in verband met de stress van het dagelijks leven vereist meestal geen behandeling met een anxiolyticum.
De werkzaamheid van buspironhydrochloride-tabletten is aangetoond in gecontroleerde klinische onderzoeken met poliklinische patiënten bij wie de diagnose ruwweg overeenkomt met gegeneraliseerde angststoornis (GAD). Veel van de patiënten die deelnamen aan deze onderzoeken hadden ook naast elkaar bestaande depressieve symptomen en buspironhydrochloride-tabletten verlichtten de angst in de aanwezigheid van deze naast elkaar bestaande depressieve symptomen. De patiënten die in deze onderzoeken werden geëvalueerd, hadden symptomen ervaren gedurende perioden van 1 maand tot meer dan 1 jaar voorafgaand aan het onderzoek, met een gemiddelde symptoomduur van 6 maanden. Gegeneraliseerde angststoornis (300.02) wordt als volgt beschreven in de Diagnostic and Statistical Manual van de American Psychiatric Association, III1:
Gegeneraliseerde, aanhoudende angst (van ten minste 1 maand aaneengesloten), gemanifesteerd door symptomen uit drie van de vier volgende categorieën:
Motorspanning
Beverigheid, zenuwachtigheid, springerigheid, beven, spanning, spierpijn, vermoeidheid, onvermogen om te ontspannen, ooglidtrekkingen, gefronste wenkbrauwen, gespannen gezicht, friemelen, rusteloosheid, gemakkelijk schrikken.
Autonome hyperactiviteit
Zweten, hartkloppingen of racen, koude, klamme handen, droge mond, duizeligheid, licht gevoel in het hoofd, paresthesieën (tintelingen in handen of voeten), maagklachten, warme of koude perioden, vaak urineren, diarree, ongemak in de put van de maag, knobbel in de keel, blozen, bleekheid, hoge rustpols en ademhalingsfrequentie.
Angstige verwachting
Angst, zorgen, angst, piekeren en anticiperen op ongeluk voor zichzelf of anderen.
Waakzaamheid en scannen
Hyperoplettendheid resulterend in afleidbaarheid, concentratieproblemen, slapeloosheid, zich "op scherp" voelen, prikkelbaarheid, ongeduld.
Bovenstaande symptomen zouden niet te wijten zijn aan een andere psychische stoornis, zoals een depressieve stoornis of schizofrenie. Milde depressieve symptomen komen echter vaak voor bij GAS.
De werkzaamheid van buspironhydrochloride-tabletten bij langdurig gebruik, dat wil zeggen gedurende meer dan 3 tot 4 weken, is niet aangetoond in gecontroleerde onderzoeken. Er is geen bewijsmateriaal beschikbaar dat systematisch ingaat op de juiste behandelingsduur voor GAS. In een onderzoek naar langdurig gebruik werden echter 264 patiënten behandeld met buspironhydrochloride-tabletten gedurende 1 jaar zonder nadelige gevolgen. Daarom moet de arts die ervoor kiest om buspironhydrochloride-tabletten gedurende langere perioden te gebruiken, periodiek het nut van het geneesmiddel voor de individuele patiënt opnieuw beoordelen.
DOSERING EN ADMINISTRATIE
De aanbevolen aanvangsdosis is 15 mg per dag (7,5 mg tweemaal daags). Om een optimale therapeutische respons te bereiken, kan de dosering met tussenpozen van 2 tot 3 dagen worden verhoogd met 5 mg per dag, indien nodig. De maximale dagelijkse dosering mag niet hoger zijn dan 60 mg per dag. In klinische onderzoeken die dosistitratie mogelijk maakten, werden gewoonlijk verdeelde doses van 20 mg tot 30 mg per dag gebruikt.
De biologische beschikbaarheid van buspiron is verhoogd bij toediening met voedsel in vergelijking met nuchtere toestand (zie: KLINISCHE FARMACOLOGIE ). Bijgevolg moeten patiënten buspiron op een consistente manier innemen met betrekking tot de timing van de dosering; ofwel altijd met of altijd zonder voedsel.
Wanneer buspiron moet worden gegeven met een krachtige remmer van CYP3A4, zijn de doseringsaanbevelingen beschreven in de DRUG-INTERACTIES sectie moet worden gevolgd.
HOE GELEVERD
Buspirone Hydrochloride-tabletten USP, 5 mg zijn witte tot gebroken witte, capsulevormige, platte tabletten met afgeschuinde randen met aan één kant de inscriptie in tweeën; de ene kant van het middendeel is ingeslagen met 'ZE' en een andere is ingeslagen met '36' en de andere kant is effen
Details fabrikant: n.v.t. Herzien: mei 2016
BIJWERKINGEN
Geen informatie verstrekt.
DRUG-INTERACTIES
Psychotrope middelen
MAO-remmers
Het wordt aanbevolen buspironhydrochloridetabletten niet gelijktijdig met MAO-remmers te gebruiken (zie: WAARSCHUWINGEN ).
Amitriptyline
Na toevoeging van buspiron aan het amitriptyline-doseringsschema werden geen statistisch significante verschillen waargenomen in de farmacokinetische parameters bij steady-state (Cmax, AUC en Cmin) van amitriptyline of zijn metaboliet nortriptyline.
diazepam
Na toevoeging van buspiron aan het diazepam-doseringsschema werden geen statistisch significante verschillen in de farmacokinetische parameters bij steady-state (Cmax, AUC en Cmin) waargenomen voor diazepam, maar er werden stijgingen van ongeveer 15% gezien voor nordiazepam en kleine klinische bijwerkingen (duizeligheid, hoofdpijn en misselijkheid) werden waargenomen.
Haloperidol
In een onderzoek bij normale vrijwilligers resulteerde gelijktijdige toediening van buspiron en haloperidol in verhoogde serumconcentraties van haloperidol. De klinische betekenis van deze bevinding is niet duidelijk.
Nefazodon
[zien Remmers en inductoren van cytochroom P450 3A4 (CYP3A4) ].
Trazodon
Er is één rapport dat suggereert dat het gelijktijdige gebruik van Desyrel®# (trazodonhydrochloride) en buspiron bij enkele patiënten 3- tot 6-voudige verhogingen van de SGPT (ALT) kan hebben veroorzaakt. In een soortgelijk onderzoek dat deze bevinding probeerde te repliceren, werd geen interactief effect op levertransaminasen vastgesteld.
Triazolam/Flurazepam
Gelijktijdige toediening van buspiron met triazolam of flurazepam leek de sedatieve effecten van beide benzodiazepines niet te verlengen of te versterken.
Andere psychotropen
Omdat de effecten van gelijktijdige toediening van buspiron met de meeste andere psychotrope geneesmiddelen niet zijn onderzocht, moet het gelijktijdige gebruik van buspiron met andere CZS-actieve geneesmiddelen met voorzichtigheid worden benaderd.
Remmers en inductoren van cytochroom P450 3A4 (CYP3A4)
In vitro is aangetoond dat buspiron wordt gemetaboliseerd door CYP3A4. Deze bevinding is consistent met de in vivo interacties die zijn waargenomen tussen buspiron en het volgende:
Diltiazem en verapamil
In een onderzoek met negen gezonde vrijwilligers verhoogde gelijktijdige toediening van buspiron (10 mg als een enkele dosis) met verapamil (80 mg driemaal daags) of diltiazem (60 mg driemaal daags) de plasmaconcentraties van buspiron (verapamil verhoogde de AUC en Cmax van buspiron met een factor 3,4 terwijl diltiazem verhoogde AUC en Cmax respectievelijk 5,5- en 4-voudig.) Bijwerkingen die kunnen worden toegeschreven aan buspiron kunnen waarschijnlijker zijn bij gelijktijdige toediening met diltiazem of verapamil. Daaropvolgende dosisaanpassing kan nodig zijn en moet gebaseerd zijn op klinische beoordeling.
Erytromycine
In een onderzoek bij gezonde vrijwilligers verhoogde gelijktijdige toediening van buspiron (10 mg als enkelvoudige dosis) met erytromycine (1,5 g/dag gedurende 4 dagen) de plasmaconcentraties van buspiron (5-voudige toename van Cmax en 6-voudige toename van AUC). Deze farmacokinetische interacties gingen gepaard met een verhoogde incidentie van bijwerkingen die toe te schrijven zijn aan buspiron. Als de twee geneesmiddelen in combinatie moeten worden gebruikt, wordt een lage dosis buspiron (bijv. 2,5 mg tweemaal daags) aanbevolen. Daaropvolgende dosisaanpassing van een van beide geneesmiddelen moet gebaseerd zijn op klinische beoordeling.
Grapefruit SAP
In een onderzoek bij gezonde vrijwilligers verhoogde gelijktijdige toediening van buspiron (10 mg als een enkele dosis) met grapefruitsap (200 ml driemaal daags met dubbele sterkte gedurende 2 dagen) de plasmaconcentraties van buspiron (4,3-voudige toename van Cmax; 9,2-voudige toename van AUC ). Patiënten die buspiron krijgen, dienen te worden geadviseerd dergelijke grote hoeveelheden grapefruitsap niet te drinken.
Itraconazol
In een onderzoek bij gezonde vrijwilligers verhoogde gelijktijdige toediening van buspiron (10 mg als enkelvoudige dosis) met itraconazol (200 mg/dag gedurende 4 dagen) de plasmaconcentraties van buspiron (13-voudige toename van Cmax en 19-voudige toename van AUC). Deze farmacokinetische interacties gingen gepaard met een verhoogde incidentie van bijwerkingen die toe te schrijven zijn aan buspiron. Als de twee geneesmiddelen in combinatie moeten worden gebruikt, wordt een lage dosis buspiron (bijv. 2,5 mg per dag) aanbevolen. Daaropvolgende dosisaanpassing van een van beide geneesmiddelen moet gebaseerd zijn op klinische beoordeling.
Nefazodon
In een onderzoek naar de farmacokinetiek bij steady-state bij gezonde vrijwilligers resulteerde gelijktijdige toediening van buspiron (2,5 of 5 mg tweemaal daags) met nefazodon (250 mg tweemaal daags) in duidelijke verhogingen van de plasmaconcentraties van buspiron (verhogingen tot 20 maal in Cmax en tot 50 -voudig in AUC) en statistisch significante verlagingen (ongeveer 50%) van de plasmaconcentraties van de buspironmetaboliet 1-PP. Met 5 mg bid-doses buspiron werden lichte verhogingen van de AUC waargenomen voor nefazodon (23%) en zijn metabolieten hydroxynefazodon (HO-NEF) (17%) en meta-chloorfenylpiperazine (9%). Er werden lichte verhogingen van de Cmax waargenomen voor nefazodon (8%) en zijn metaboliet HO-NEF (11%).
Proefpersonen die buspiron 5 mg tweemaal daags en nefazodon 250 mg tweemaal ontvingen, ondervonden een licht gevoel in het hoofd, asthenie, duizeligheid en slaperigheid, bijwerkingen die ook werden waargenomen met elk geneesmiddel alleen. Als de twee geneesmiddelen in combinatie moeten worden gebruikt, wordt een lage dosis buspiron (bijv. 2,5 mg per dag) aanbevolen. Daaropvolgende dosisaanpassing van een van beide geneesmiddelen moet gebaseerd zijn op klinische beoordeling.
rifampicijn
In een onderzoek bij gezonde vrijwilligers verminderde gelijktijdige toediening van buspiron (30 mg als een enkele dosis) met rifampicine (600 mg/dag gedurende 5 dagen) de plasmaconcentraties (83,7% afname in Cmax; 89,6% afname in AUC) en farmacodynamische effecten van buspiron. Als de twee geneesmiddelen in combinatie moeten worden gebruikt, moet de dosering van buspiron mogelijk worden aangepast om het anxiolytische effect te behouden.
Andere remmers en inductoren van CYP3A4
Stoffen die CYP3A4 remmen, zoals ketoconazol of ritonavir, kunnen het buspironmetabolisme remmen en de plasmaconcentraties van buspiron verhogen, terwijl stoffen die CYP3A4 induceren, zoals dexamethason of bepaalde anti-epileptica (fenytoïne, fenobarbital, carbamazepine), de snelheid van het buspironmetabolisme kunnen verhogen. Als een patiënt is getitreerd tot een stabiele dosering van buspiron, kan een dosisaanpassing van buspiron nodig zijn om bijwerkingen die kunnen worden toegeschreven aan buspiron of verminderde anxiolytische activiteit te voorkomen. Daarom wordt bij toediening met een krachtige remmer van CYP3A4 een lage dosis buspiron met voorzichtigheid aanbevolen. Bij gebruik in combinatie met een krachtige inductor van CYP3A4 moet de dosering van buspiron mogelijk worden aangepast om het anxiolytische effect te behouden.
Andere medicijnen
cimetidine
Gelijktijdige toediening van buspiron met cimetidine bleek de Cmax (40%) en Tmax (2-voudig) te verhogen, maar had minimale effecten op de AUC van buspiron.
Eiwitbinding
In vitro verdringt buspiron nauw gebonden geneesmiddelen zoals fenytoïne, propranolol en warfarine niet van serumeiwitten. Er is echter één melding geweest van verlengde protrombinetijd wanneer buspiron werd toegevoegd aan het regime van een patiënt die werd behandeld met warfarine. De patiënt kreeg ook chronisch fenytoïne, fenobarbital, digoxine en Synthroid®*. In vitro kan buspiron minder stevig gebonden geneesmiddelen zoals digoxine verdringen. De klinische betekenis van deze eigenschap is niet bekend.
Therapeutische spiegels van aspirine, desipramine, diazepam, flurazepam, ibuprofen, propranolol, thioridazine en tolbutamide hadden slechts een beperkt effect op de mate van binding van buspiron aan plasma-eiwitten (zie KLINISCHE FARMACOLOGIE ).
Geneesmiddel-/laboratoriumtestinteracties
Buspironhydrochloride kan interfereren met de metanefrine/catecholamine-test in de urine. Het is ten onrechte gelezen als metanefrine tijdens routinetests voor feochromocytoom, wat resulteert in een vals-positief laboratoriumresultaat. Buspironhydrochloride moet daarom worden gestaakt gedurende ten minste 48 uur voordat urine wordt afgenomen voor catecholamines.
Drugsmisbruik en afhankelijkheid
Klasse gereguleerde stof
Buspironhydrochloride is geen gereguleerde stof.
Lichamelijke en psychologische afhankelijkheid
In studies bij mensen en dieren heeft buspiron geen potentieel voor misbruik of misbruik aangetoond en er is geen bewijs dat het tolerantie of fysieke of psychologische afhankelijkheid veroorzaakt. Menselijke vrijwilligers met een geschiedenis van recreatief drugs- of alcoholgebruik werden bestudeerd in twee dubbelblinde klinische onderzoeken. Geen van de proefpersonen kon onderscheid maken tussen buspironhydrochloridetabletten en placebo. Daarentegen vertoonden proefpersonen een statistisch significante voorkeur voor methaqualon en diazepam. Studies bij apen, muizen en ratten hebben aangetoond dat buspiron geen potentieel voor misbruik heeft. Na chronische toediening aan ratten resulteerde abrupte stopzetting van buspiron niet in het verlies van lichaamsgewicht dat vaak wordt waargenomen bij stoffen die lichamelijke afhankelijkheid veroorzaken.
Hoewel er geen direct bewijs is dat buspironhydrochloride-tabletten fysieke afhankelijkheid of drugszoekgedrag veroorzaken, is het moeilijk om uit experimenten te voorspellen in hoeverre een op het CZS actief geneesmiddel zal worden misbruikt, omgeleid en/of misbruikt zodra het op de markt is gebracht. Daarom dienen artsen patiënten zorgvuldig te evalueren op een voorgeschiedenis van drugsmisbruik en dergelijke patiënten nauwlettend te volgen, hen te observeren op tekenen van misbruik of misbruik van buspironhydrochloride (bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar medicijnen).
Klasse gereguleerde stof
Buspironhydrochloride is geen gereguleerde stof.
Lichamelijke en psychologische afhankelijkheid
In studies bij mensen en dieren heeft buspiron geen potentieel voor misbruik of misbruik aangetoond en er is geen bewijs dat het tolerantie of fysieke of psychologische afhankelijkheid veroorzaakt. Menselijke vrijwilligers met een geschiedenis van recreatief drugs- of alcoholgebruik werden bestudeerd in twee dubbelblinde klinische onderzoeken. Geen van de proefpersonen kon onderscheid maken tussen buspironhydrochloridetabletten en placebo. Daarentegen vertoonden proefpersonen een statistisch significante voorkeur voor methaqualon en diazepam. Studies bij apen, muizen en ratten hebben aangetoond dat buspiron geen potentieel voor misbruik heeft. Na chronische toediening aan ratten resulteerde abrupte stopzetting van buspiron niet in het verlies van lichaamsgewicht dat vaak wordt waargenomen bij stoffen die lichamelijke afhankelijkheid veroorzaken.
Hoewel er geen direct bewijs is dat buspironhydrochloride-tabletten fysieke afhankelijkheid of drugszoekgedrag veroorzaken, is het moeilijk om uit experimenten te voorspellen in hoeverre een op het CZS actief geneesmiddel zal worden misbruikt, omgeleid en/of misbruikt zodra het op de markt is gebracht. Daarom dienen artsen patiënten zorgvuldig te evalueren op een voorgeschiedenis van drugsmisbruik en dergelijke patiënten nauwlettend te volgen, hen te observeren op tekenen van misbruik of misbruik van buspironhydrochloride (bijv. ontwikkeling van tolerantie, verhoging van de dosis, gedrag bij het zoeken naar medicijnen).
WAARSCHUWINGEN
De toediening van buspironhydrochloridetabletten aan een patiënt die een monoamineoxidaseremmer (MAOI) gebruikt, kan een gevaar opleveren. Er zijn meldingen geweest van het optreden van verhoogde bloeddruk wanneer buspironhydrochloride-tabletten zijn toegevoegd aan een regime dat een MAO-remmer bevat. Daarom wordt aanbevolen buspironhydrochloridetabletten niet gelijktijdig met een MAO-remmer te gebruiken.
Omdat buspironhydrochloride-tabletten geen bewezen antipsychotische activiteit hebben, mag het niet worden gebruikt in plaats van een geschikte antipsychotische behandeling.
PREVENTIEVE MAATREGELEN
Algemeen
Interferentie met cognitieve en motorische prestaties
Studies tonen aan dat buspironhydrochloride-tabletten minder sederend zijn dan andere anxiolytica en dat het geen significante functionele beperkingen veroorzaakt. Het is echter mogelijk dat de effecten op het CZS bij een individuele patiënt niet voorspelbaar zijn. Daarom moeten patiënten worden gewaarschuwd voor het besturen van een auto of het gebruik van complexe machines totdat ze er redelijk zeker van zijn dat de behandeling met buspiron geen nadelige gevolgen voor hen heeft.
Hoewel formele onderzoeken naar de interactie van buspironhydrochloride met alcohol aangeven dat buspiron de door alcohol veroorzaakte verslechtering van motorische en mentale prestaties niet verhoogt, is het verstandig om gelijktijdig gebruik van alcohol en buspiron te vermijden.
Potentieel voor ontwenningsreacties bij sedatieve/hypnotische/anxiolytische geneesmiddelafhankelijke patiënten
Omdat buspironhydrochloride-tabletten geen kruistolerantie vertonen met benzodiazepines en andere veel voorkomende sedativa/hypnotica, zal het het ontwenningssyndroom dat vaak wordt gezien bij stopzetting van de behandeling met deze geneesmiddelen niet blokkeren. Daarom is het raadzaam om, voordat de behandeling met buspironhydrochloride-tabletten wordt gestart, patiënten, met name patiënten die chronisch een CZS-depressivum hebben gebruikt, geleidelijk te stoppen met hun eerdere behandeling. Rebound- of ontwenningsverschijnselen kunnen optreden gedurende verschillende tijdsperioden, gedeeltelijk afhankelijk van het type geneesmiddel en de effectieve eliminatiehalfwaardetijd.
Het ontwenningssyndroom van sedativa/hypnotica/anxiolytica kan zich voordoen als elke combinatie van prikkelbaarheid, angst, opwinding, slapeloosheid, tremor, buikkrampen, spierkrampen, braken, zweten, griepachtige symptomen zonder koorts, en soms zelfs als toevallen .
Mogelijke zorgen met betrekking tot de binding van buspirone aan dopaminereceptoren
Omdat buspiron kan binden aan centrale dopaminereceptoren, is er een vraag gerezen over het potentieel ervan om acute en chronische veranderingen in dopamine-gemedieerde neurologische functie te veroorzaken (bijv. dystonie, pseudoparkinsonisme, acathisie en tardieve dyskinesie). Klinische ervaring in gecontroleerde onderzoeken heeft geen significante neuroleptica-achtige activiteit kunnen identificeren; bij een kleine fractie van de met buspiron behandelde patiënten is echter een syndroom van rusteloosheid gemeld, dat kort na het begin van de behandeling optrad. Het syndroom kan op verschillende manieren worden verklaard. Buspiron kan bijvoorbeeld de centrale noradrenerge activiteit verhogen; als alternatief kan het effect worden toegeschreven aan dopaminerge effecten (dwz acathisie vertegenwoordigen). Zien ONGEWENSTE REACTIES : Postmarketingervaring .
Informatie voor patiënten
Om een veilig en effectief gebruik van buspironhydrochloride-tabletten te garanderen, moeten de volgende informatie en instructies aan patiënten worden gegeven:
Informeer uw arts over eventuele medicijnen, al dan niet op recept verkrijgbare, alcohol of medicijnen die u nu gebruikt of van plan bent te gebruiken tijdens uw behandeling met buspironhydrochloride-tabletten.
Informeer uw arts als u zwanger bent, of van plan bent zwanger te worden, of als u zwanger wordt terwijl u buspironhydrochloride tabletten gebruikt.
Informeer uw arts als u een baby borstvoeding geeft.
Rijd geen auto of bedien geen potentieel gevaarlijke machines totdat u ervaart welke invloed dit medicijn op u heeft.
U moet buspironhydrochloride consequent innemen, altijd met of altijd zonder voedsel.
Vermijd tijdens uw behandeling met buspironhydrochloridetabletten het drinken van grote hoeveelheden grapefruitsap.
Laboratorium testen
Er worden geen specifieke laboratoriumtests aanbevolen.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen bewijs van carcinogeen potentieel waargenomen bij ratten tijdens een onderzoek van 24 maanden bij ongeveer 133 maal de maximaal aanbevolen orale dosis voor de mens; of bij muizen, tijdens een onderzoek van 18 maanden bij ongeveer 167 keer de maximaal aanbevolen orale dosis voor de mens.
Met of zonder metabole activering induceerde buspiron geen puntmutaties in vijf stammen van Salmonella typhimurium (Ames-test) of muizenlymfoom L5178YTK+ celculturen, en er werd ook geen DNA-schade waargenomen met buspiron in menselijke Wi-38-cellen. Chromosomale afwijkingen of afwijkingen kwamen niet voor in beenmergcellen van muizen die één of vijf dagelijkse doses buspiron kregen.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie B
Er werd geen verminderde vruchtbaarheid of schade aan de foetus waargenomen in reproductieonderzoeken uitgevoerd bij ratten en konijnen bij buspirondoses van ongeveer 30 maal de maximaal aanbevolen dosis voor de mens. Bij mensen zijn er echter geen adequate en goed gecontroleerde onderzoeken tijdens de zwangerschap uitgevoerd. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Bevalling
Het effect van buspironhydrochloride op de bevalling en bevalling bij vrouwen is niet bekend. Er werden geen nadelige effecten opgemerkt in reproductiestudies bij ratten.
Moeders die borstvoeding geven
De mate van uitscheiding in de moedermelk van buspiron of zijn metabolieten is niet bekend. Bij ratten worden buspiron en zijn metabolieten echter uitgescheiden in de melk. De toediening van buspironhydrochloride-tabletten aan vrouwen die borstvoeding geven, moet worden vermeden indien klinisch mogelijk.
Pediatrisch gebruik
De veiligheid en werkzaamheid van buspiron werden geëvalueerd in twee placebogecontroleerde onderzoeken van 6 weken waarbij in totaal 559 pediatrische patiënten (in de leeftijd van 6 tot 17 jaar) met GAD betrokken waren. De onderzochte doses waren 7,5 mg tot 30 mg tweemaal daags (15 tot 60 mg/dag). Er waren geen significante verschillen tussen buspiron en placebo met betrekking tot de symptomen van GAS na de aanbevolen doses voor de behandeling van GAS bij volwassenen. Farmacokinetische studies hebben aangetoond dat, voor identieke doses, de plasmablootstelling aan buspiron en zijn actieve metaboliet, 1-PP, gelijk is aan of hoger is bij pediatrische patiënten dan bij volwassenen. In deze onderzoeken werden geen onverwachte veiligheidsbevindingen geassocieerd met buspiron. Er zijn geen gegevens over de veiligheid of werkzaamheid op lange termijn bij deze populatie.
Geriatrisch gebruik
In één onderzoek onder 6632 patiënten die buspiron kregen voor de behandeling van angst, waren 605 patiënten ≥ 65 jaar oud en 41 waren ≥ 75 jaar oud; de veiligheids- en werkzaamheidsprofielen voor deze 605 oudere patiënten (gemiddelde leeftijd = 70,8 jaar) waren vergelijkbaar met die in de jongere populatie (gemiddelde leeftijd = 43,3 jaar). Beoordeling van spontaan gemelde ongewenste klinische voorvallen heeft geen verschillen tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere patiënten kan niet worden uitgesloten.
Er waren geen effecten van leeftijd op de farmacokinetiek van buspiron (zie: KLINISCHE FARMACOLOGIE , Speciale populaties ).
Gebruik bij patiënten met een verminderde lever- of nierfunctie
Buspiron wordt gemetaboliseerd door de lever en uitgescheiden door de nieren. Een farmacokinetisch onderzoek bij patiënten met een gestoorde lever- of nierfunctie toonde verhoogde plasmaspiegels en een verlengde halfwaardetijd van buspiron aan. Daarom kan de toediening van buspironhydrochloridetabletten aan patiënten met een ernstige lever- of nierfunctiestoornis niet worden aanbevolen (zie: KLINISCHE FARMACOLOGIE ).
OVERDOSERING
Geen informatie verstrekt.
CONTRA-INDICATIES
Buspironhydrochloride-tabletten zijn gecontra-indiceerd bij patiënten die overgevoelig zijn voor buspironhydrochloride.
KLINISCHE FARMACOLOGIE
Het werkingsmechanisme van buspiron is niet bekend. Buspiron verschilt van typische benzodiazepine-anxiolytica doordat het geen anticonvulsieve of spierverslappende effecten heeft. Het mist ook het prominente kalmerende effect dat wordt geassocieerd met meer typische anxiolytica. In vitro preklinische onderzoeken hebben aangetoond dat buspiron een hoge affiniteit heeft voor serotonine (5-HT1A)-receptoren. Buspiron heeft geen significante affiniteit voor benzodiazepinereceptoren en heeft geen invloed op de GABA-binding in vitro of in vivo wanneer getest in preklinische modellen.
Buspiron heeft een matige affiniteit voor D2-dopaminereceptoren in de hersenen. Sommige onderzoeken suggereren dat buspiron indirecte effecten kan hebben op andere neurotransmittersystemen.
Buspironhydrochloride wordt snel geabsorbeerd door de mens en ondergaat een uitgebreid first-pass-metabolisme. In een radioactief gelabeld onderzoek was onveranderd buspiron in het plasma slechts verantwoordelijk voor ongeveer 1% van de radioactiviteit in het plasma. Na orale toediening zijn de plasmaconcentraties van onveranderd buspiron erg laag en variabel tussen proefpersonen. Piekplasmaspiegels van 1 ng/ml tot 6 ng/ml zijn waargenomen 40 tot 90 minuten na enkelvoudige orale doses van 20 mg. De biologische beschikbaarheid van onveranderd buspiron voor eenmalig gebruik als tablet is gemiddeld ongeveer 90% van een equivalente dosis oplossing, maar er is een grote variabiliteit.
De effecten van voedsel op de biologische beschikbaarheid van buspironhydrochloridetabletten zijn bij acht proefpersonen onderzocht. Ze kregen een dosis van 20 mg met en zonder voedsel; het gebied onder de plasmaconcentratie-tijdcurve (AUC) en piekplasmaconcentratie (Cmax) van onveranderd buspiron namen toe met respectievelijk 84% en 116%, maar de totale hoeveelheid immunoreactief buspironmateriaal veranderde niet. Dit suggereert dat voedsel de mate van presystemische klaring van buspiron kan verminderen (zie: DOSERING EN ADMINISTRATIE ).
Een onderzoek met meerdere doses bij 15 proefpersonen suggereert dat buspiron een niet-lineaire farmacokinetiek heeft. Dosisverhogingen en herhaalde dosering kunnen dus leiden tot iets hogere bloedspiegels van onveranderd buspiron dan zou worden voorspeld op basis van de resultaten van onderzoeken met enkelvoudige doses.
Een in vitro eiwitbindingsonderzoek wees uit dat ongeveer 86% van buspiron aan plasma-eiwitten wordt gebonden. Er werd ook waargenomen dat aspirine de plasmaspiegels van vrij buspiron met 23% verhoogde, terwijl flurazepam de plasmaspiegels van vrij buspiron met 20% verlaagde. Het is echter niet bekend of deze geneesmiddelen vergelijkbare effecten hebben op de plasmaspiegels van vrij buspiron in vivo, of dat dergelijke veranderingen, als ze zich voordoen, klinisch significante verschillen in behandelresultaat veroorzaken. Een in vitro-onderzoek gaf aan dat buspiron sterk eiwitgebonden geneesmiddelen zoals fenytoïne, warfarine en propranolol niet uit plasma-eiwit verdrong, en dat buspiron digoxine kan verdringen.
Buspiron wordt voornamelijk gemetaboliseerd door oxidatie, waarvan in vitro is aangetoond dat het wordt gemedieerd door cytochroom P450 3A4 (CYP3A4) (zie DRUG-INTERACTIES ). Er worden verschillende gehydroxyleerde derivaten en een farmacologisch actieve metaboliet, 1-pyrimidinylpiperazine (1-PP), geproduceerd. In diermodellen die anxiolytisch potentieel voorspellen, heeft 1-PP ongeveer een kwart van de activiteit van buspiron, maar is aanwezig in tot 20 keer grotere hoeveelheden. Dit is echter waarschijnlijk niet belangrijk bij mensen: bloedmonsters van mensen die chronisch zijn blootgesteld aan buspironhydrochloride vertonen geen hoge niveaus van 1-PP; gemiddelde waarden zijn ongeveer 3 ng/ml en het hoogste niveau in menselijk bloed dat werd geregistreerd bij 108 chronisch gedoseerde patiënten was 17 ng/ml, minder dan 1/200ste van 1-PP-waarden gevonden bij dieren die grote doses buspiron kregen zonder tekenen van toxiciteit.
In een onderzoek met een enkelvoudige dosis waarbij 14C-gelabeld buspiron werd gebruikt, werd 29% tot 63% van de dosis binnen 24 uur in de urine uitgescheiden, voornamelijk als metabolieten; fecale excretie was goed voor 18% tot 38% van de dosis. De gemiddelde eliminatiehalfwaardetijd van onveranderd buspiron na enkelvoudige doses van 10 mg tot 40 mg is ongeveer 2 tot 3 uur.
Speciale populaties
Leeftijd en geslachtseffecten
Na enkelvoudige of meervoudige doses bij volwassenen werden geen significante verschillen in de farmacokinetiek van buspiron (AUC en Cmax) waargenomen tussen oudere en jongere proefpersonen of tussen mannen en vrouwen.
Leverfunctiestoornis
Na toediening van meerdere doses buspiron aan patiënten met een leverfunctiestoornis, nam de steady-state AUC van buspiron 13-voudig toe in vergelijking met gezonde proefpersonen (zie PREVENTIEVE MAATREGELEN ).
Nierfunctiestoornis
Na meervoudige toediening van buspiron aan patiënten met een nierfunctiestoornis (Clcr = 10 tot 70 ml/min/1,73 m2), nam de steady-state AUC van buspiron 4-voudig toe in vergelijking met gezonde (Clcr ≥ 80 ml/min/1,73 m2) proefpersonen (zien PREVENTIEVE MAATREGELEN ).
Race-effecten
De effecten van ras op de farmacokinetiek van buspiron zijn niet onderzocht.
PATIËNT INFORMATIE
Buspironhydrochloride Tabletten, USP Voor tabletten van 15 mg en 30 mg
HOE TE GEBRUIKEN
De reactie op buspiron varieert van persoon tot persoon. Uw arts kan het nodig vinden om uw dosering aan te passen om de juiste reactie te krijgen.
Elke tablet heeft een breukstreep en kan nauwkeurig worden gebroken.
Om een tablet nauwkeurig en gemakkelijk te breken, houdt u de tablet tussen uw duimen en wijsvingers dicht bij de juiste tabletbreuk (groef). Oefen vervolgens, met de tabletbreuk naar u toe, druk uit en klik de tabletsegmenten uit elkaar (segmenten die op de verkeerde manier breken, mogen niet worden gebruikt).
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
