Anafranil 10mg, 25mg, 50mg Clomipramine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Anafranil 10 mg en hoe wordt het gebruikt?
Anafranil 50 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van een obsessieve-compulsieve stoornis te behandelen. Anafranil 50 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Anafranil behoort tot een klasse geneesmiddelen die antidepressiva, TCA's, worden genoemd.
Het is niet bekend of Anafranil 50 mg veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat zijn de mogelijke bijwerkingen van Anafranil 25 mg?
Anafranil 50 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- huiduitslag,
- koorts,
- opgezwollen klieren,
- griepachtige symptomen,
- spierpijn,
- ernstige zwakte,
- ongebruikelijke blauwe plekken,
- geel worden van uw huid en ogen (geelzucht),
- gedragsveranderingen,
- ongerustheid,
- paniekaanvallen,
- Moeite met slapen,
- impulsief gedrag,
- prikkelbaarheid,
- agitatie,
- vijandigheid,
- agressiviteit,
- hyperactief (mentaal of fysiek),
- depressie,
- zelfmoordgedachten,
- wazig zien,
- tunnelvisie,
- oogpijn of zwelling,
- halo's rond lichten zien,
- snelle hartslag,
- trillingen of beven,
- verwardheid,
- extreme angst,
- pijnlijk of moeilijk plassen,
- hartinfarct,
- koorts,
- hallucinaties,
- zweten,
- rillend,
- snelle hartslag,
- Spierstijfheid,
- spiertrekkingen,
- coördinatieverlies,
- misselijkheid,
- braken, en
- diarree
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Anafranil zijn:
- droge mond,
- misselijkheid,
- maagklachten,
- verlies van eetlust,
- constipatie,
- angst voelen,
- duizelig,
- slaperigheid,
- moe,
- slaapproblemen,
- eetlust of gewichtsveranderingen,
- geheugen problemen,
- moeite met concentreren,
- toegenomen zweten,
- gevoelloosheid of tintelingen,
- visie verandert,
- verminderde zin in seks,
- impotentie, en
- moeite met een orgasme
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Anafranil. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
Suïcidaliteit en antidepressiva
Antidepressiva verhoogden het risico op suïcidaal denken en gedrag (suïcidaliteit) bij kinderen, adolescenten en jonge volwassenen in kortdurende onderzoeken naar depressieve stoornis (MDD) en andere psychiatrische stoornissen, vergeleken met placebo. Iedereen die het gebruik van clomipraminehydrochloride of een ander antidepressivum bij een kind, adolescent of jongvolwassene overweegt, moet dit risico afwegen tegen de klinische noodzaak. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een vermindering van het risico met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder. Depressie en bepaalde andere psychiatrische stoornissen zijn zelf geassocieerd met een verhoogd risico op zelfmoord. Patiënten van alle leeftijden die beginnen met een behandeling met antidepressiva, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit of ongewone gedragsveranderingen. Families en zorgverleners moeten worden geïnformeerd over de noodzaak van nauwgezette observatie en communicatie met de voorschrijver. Clomipraminehydrochloride is niet goedgekeurd voor gebruik bij pediatrische patiënten, behalve voor patiënten met een obsessieve-compulsieve stoornis (OCS) (zie WAARSCHUWINGEN , Klinische verslechtering en zelfmoordrisico ; PATIËNT INFORMATIE ; en PREVENTIEVE MAATREGELEN , Pediatrisch gebruik ).
OMSCHRIJVING
Anafranil ™ (clomipramine hydrochloride) Capsules USP is een anti-obsessief medicijn dat behoort tot de klasse (dibenzazepine) van farmacologische middelen die bekend staat als tricyclische antidepressiva. Anafranil is verkrijgbaar in capsules van 25, 50 en 75 mg voor orale toediening.
Clomipramine hydrochloride USP is 3-chloor-5-[3-(dimethylamino)propyl]-10,11-dihydro5H-dibenz[b,f]azepine monohydrochloride, en de structuurformule is:
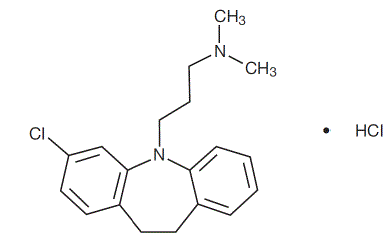
C19H23ClN2 • HCl MW = 351,31
Clomipramine hydrochloride USP is een wit tot gebroken wit kristallijn poeder. Het is vrij oplosbaar in water, in methanol en in methyleenchloride en onoplosbaar in ethylether en hexaan.
Inactieve ingredienten. D&C Red No. 33 (alleen 25 mg capsules), D&C Yellow No. 10, FD&C Blue No. 1 (alleen 50 mg capsules), FD&C Yellow No. 6, gelatine, magnesiumstearaat, methylparaben, propylparaben, zetmeel (maïs), en titaandioxide.
INDICATIES
Anafranil ™ (clomipramine hydrochloride) Capsules USP is geïndiceerd voor de behandeling van obsessies en dwanghandelingen bij patiënten met een obsessieve-compulsieve stoornis (OCS). De obsessies of dwanghandelingen moeten duidelijk leed veroorzaken, tijdrovend zijn of het sociaal of beroepsmatig functioneren aanzienlijk verstoren om te voldoen aan de DSM-III-R (circa 1989) diagnose van OCS.
Obsessies zijn terugkerende, aanhoudende ideeën, gedachten, beelden of impulsen die ego-dystonisch zijn. Compulsies zijn repetitieve, doelgerichte en opzettelijke gedragingen die worden uitgevoerd als reactie op een obsessie of op een stereotiepe manier, en worden door de persoon als buitensporig of onredelijk erkend.
De werkzaamheid van Anafranil 25 mg voor de behandeling van OCS werd aangetoond in multicenter, placebogecontroleerde onderzoeken met parallelle groepen, waaronder twee onderzoeken van 10 weken bij volwassenen en een onderzoek van 8 weken bij kinderen en adolescenten van 10 tot 17 jaar. Patiënten in alle onderzoeken hadden matige tot ernstige OCS (DSM-III), met gemiddelde baselinescores op de Yale-Brown Obsessive Compulsive Scale (YBOCS) variërend van 26 tot 28 en een gemiddelde baselinescore van 10 op de NIMH Clinical Global Obsessive Dwangmatige schaal (NIMH-OC). Patiënten die CMI gebruikten, vertoonden een gemiddelde afname van ongeveer 10 op de YBOCS, wat een gemiddelde verbetering op deze schaal van 35% tot 42% bij volwassenen en 37% bij kinderen en adolescenten betekent. Met CMI behandelde patiënten ondervonden een afname van 3,5 eenheden op de NIMH-OC. Patiënten op placebo vertoonden geen belangrijke klinische respons op beide schalen. De maximale dosis was 250 mg/dag voor de meeste volwassenen en 3 mg/kg/dag (tot 200 mg) voor alle kinderen en adolescenten.
De werkzaamheid van Anafranil 25 mg bij langdurig gebruik (dwz gedurende meer dan 10 weken) is niet systematisch geëvalueerd in placebogecontroleerde onderzoeken. De arts die ervoor kiest om Anafranil 10 mg gedurende langere perioden te gebruiken, moet periodiek de bruikbaarheid van het geneesmiddel op de lange termijn voor de individuele patiënt opnieuw evalueren (zie DOSERING EN ADMINISTRATIE ).
DOSERING EN ADMINISTRATIE
De hieronder beschreven behandelingsschema's zijn gebaseerd op die gebruikt in gecontroleerde klinische onderzoeken met Anafranil 50 mg bij 520 volwassenen en 91 kinderen en adolescenten met OCS. Tijdens de initiële titratie moet Anafranil in verdeelde doses bij de maaltijd worden gegeven om gastro-intestinale bijwerkingen te verminderen. Het doel van deze initiële titratiefase is het minimaliseren van bijwerkingen door tolerantie voor bijwerkingen toe te staan of de patiënt de tijd te geven zich aan te passen als er zich geen tolerantie ontwikkelt.
Omdat zowel CMI als zijn actieve metaboliet, DMI, een lange eliminatiehalfwaardetijd hebben, dient de voorschrijver er rekening mee te houden dat de steady-state plasmaspiegels mogelijk pas 2 tot 3 weken na de wijziging van de dosering worden bereikt (zie KLINISCHE FARMACOLOGIE ). Daarom kan het na de eerste titratie aangewezen zijn om 2 tot 3 weken te wachten tussen verdere dosisaanpassingen.
Initiële behandeling/dosisaanpassing (volwassenen)
Behandeling met Anafranil 25 mg dient te worden gestart met een dosering van 25 mg per dag en geleidelijk te worden verhoogd, indien getolereerd, tot ongeveer 100 mg gedurende de eerste 2 weken. Tijdens de initiële titratie moet Anafranil 50 mg in verdeelde doses bij de maaltijd worden gegeven om gastro-intestinale bijwerkingen te verminderen. Daarna kan de dosering in de loop van de volgende weken geleidelijk worden verhoogd tot een maximum van 250 mg per dag. Na titratie kan de totale dagelijkse dosis eenmaal daags voor het slapengaan worden gegeven om sedatie overdag tot een minimum te beperken.
Initiële behandeling/dosisaanpassing (kinderen en adolescenten)
Net als bij volwassenen is de startdosering 25 mg per dag en moet deze gedurende de eerste 2 weken geleidelijk worden verhoogd (ook in verdeelde doses bij de maaltijd gegeven om gastro-intestinale bijwerkingen te verminderen) tot een dagelijks maximum van 3 mg/kg of 100 mg, welke kleiner is. Daarna kan de dosering in de loop van de volgende weken geleidelijk worden verhoogd tot een dagelijks maximum van 3 mg/kg of 200 mg, afhankelijk van welke van beide het kleinst is (zie PREVENTIEVE MAATREGELEN , Pediatrisch gebruik ). Net als bij volwassenen kan na titratie de totale dagelijkse dosis eenmaal daags voor het slapengaan worden gegeven om sedatie overdag tot een minimum te beperken.
Onderhouds-/voortzettingsbehandeling (volwassenen, kinderen en adolescenten)
Hoewel er geen systematische onderzoeken zijn die de vraag beantwoorden hoe lang Anafranil 10 mg moet worden voortgezet, is OCS een chronische aandoening en is het redelijk om voortzetting te overwegen voor een patiënt die reageert. Hoewel de werkzaamheid van Anafranil 50 mg na 10 weken niet is gedocumenteerd in gecontroleerde onderzoeken, werden patiënten gedurende maximaal 1 jaar onder dubbelblinde omstandigheden behandeld zonder verlies van voordeel. Dosisaanpassingen moeten echter worden gemaakt om de patiënt op de laagst effectieve dosering te houden, en patiënten moeten periodiek opnieuw worden beoordeeld om de noodzaak van behandeling te bepalen. Tijdens onderhoud mag de totale dagelijkse dosis eenmaal daags voor het slapengaan worden gegeven.
Overschakelen van een patiënt naar of van een monoamineoxidaseremmer (MAOI) bedoeld voor de behandeling van psychiatrische stoornissen
Er moeten ten minste 14 dagen verstrijken tussen het stopzetten van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen en het starten van de behandeling met Anafranil. Omgekeerd moet er ten minste 14 dagen worden gewacht na het stoppen met Anafranil voordat wordt gestart met een MAO-remmer die bedoeld is voor de behandeling van psychiatrische stoornissen (zie CONTRA-INDICATIES ).
Gebruik van anafranil 25 mg met andere MAO-remmers, zoals linezolid of methyleenblauw
Begin niet met Anafranil 50 mg bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw, omdat er een verhoogd risico is op het serotoninesyndroom. Bij een patiënt die een meer dringende behandeling van een psychiatrische aandoening nodig heeft, moeten andere interventies, waaronder ziekenhuisopname, worden overwogen (zie: CONTRA-INDICATIES ).
In sommige gevallen kan een patiënt die al wordt behandeld met Anafranil 25 mg dringend worden behandeld met linezolid of intraveneus methyleenblauw. Als aanvaardbare alternatieven voor linezolid of intraveneuze behandeling met methyleenblauw niet beschikbaar zijn en de mogelijke voordelen van linezolid of intraveneuze behandeling met methyleenblauw opwegen tegen de risico's van het serotoninesyndroom bij een bepaalde patiënt, moet Anafranil onmiddellijk worden gestopt en linezolid of intraveneuze methyleenblauw kan worden toegediend. De patiënt moet gedurende twee weken of tot 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw, afhankelijk van wat zich het eerst voordoet, worden gecontroleerd op symptomen van het serotoninesyndroom. De therapie met Anafranil kan worden hervat 24 uur na de laatste dosis linezolid of intraveneus methyleenblauw (zie WAARSCHUWINGEN ).
Het risico van toediening van methyleenblauw via niet-intraveneuze routes (zoals orale tabletten of door lokale injectie) of in intraveneuze doses die veel lager zijn dan 1 mg/kg met Anafranil 50 mg is onduidelijk. De arts moet zich niettemin bewust zijn van de mogelijkheid van optredende symptomen van het serotoninesyndroom bij dergelijk gebruik (zie: WAARSCHUWINGEN ).
HOE GELEVERD
Anafranil ™ (clomipraminehydrochloride) Capsules USP
Capsules 25 mg - ivoren lichaam bedrukt in zwart met "M" en meloengele dop bedrukt in zwart met "ANAFRANIL 25 mg"
Flessen van 30â€â€¦â€¦....………...……….....……… … NDC 0406-9906-03
Capsules 50 mg - ivoren lichaam bedrukt in zwart met "M" en aquablauwe dop bedrukt in zwart met "ANAFRANIL 50 mg"
Flessen van 30â€â€¦â€¦..………....………...………... ..…NDC 0406-9907-03
Capsules 75 mg - ivoren lichaam bedrukt in zwart met "M" en gele dop bedrukt in zwart met "ANAFRANIL 75 mg"
Flessen van 30â€â€¦â€¦..………...……….....……….. ..…NDC 0406-9908-03
Opslag
Bewaren bij 20° tot 25°C (68° tot 77°F) [zie USP-gecontroleerde kamertemperatuur ].
Doseer in goed gesloten containers met een kindveilige sluiting. Beschermen tegen vocht.
Dierlijke toxicologie
Fosfolipidose en veranderingen in de testikels, vaak geassocieerd met tricyclische verbindingen, zijn waargenomen met Anafranil. In chronische studies bij ratten bestonden de veranderingen met betrekking tot Anafranil 50 mg uit systemische fosfolipidose, veranderingen in de testikels (atrofie, mineralisatie) en secundaire veranderingen in andere weefsels. Bovendien werden harttrombose en dermatitis/keratitis waargenomen bij ratten die gedurende 2 jaar werden behandeld met doses die respectievelijk 24 en 10 maal de maximaal aanbevolen dagelijkse dosis voor de mens (MRHD) waren, op basis van mg/kg, en 4 en 1,5 maal de MRHD. respectievelijk op basis van mg/m².
Mallinckrodt, het merk "M", het Mallinckrodt Pharmaceuticals-logo, M Â en andere merken zijn handelsmerken van een Mallinckrodt-bedrijf.
Gefabriceerd door: Patheon Inc., Whitby, Ontario, Canada, L1N 5Z5 voor SpecGx LLC, Webster Groves, MO 63119 VS. Herzien: maart 2019
BIJWERKINGEN
algemeen waargenomen
De vaakst waargenomen bijwerkingen die verband houden met het gebruik van Anafranil 10 mg en die niet met een equivalente incidentie werden gezien bij met placebo behandelde patiënten waren maagdarmklachten, waaronder droge mond, constipatie, misselijkheid, dyspepsie en anorexia; klachten van het zenuwstelsel, waaronder slaperigheid, tremor, duizeligheid, nervositeit en myoclonus; urogenitale klachten, waaronder veranderd libido, falen van de ejaculatie, impotentie en mictiestoornis; en andere diverse klachten, waaronder vermoeidheid, zweten, verhoogde eetlust, gewichtstoename en visuele veranderingen.
Leidt tot stopzetting van de behandeling
Ongeveer 20% van de 3616 patiënten die Anafranil kregen in klinische premarketingonderzoeken in de VS stopten met de behandeling vanwege een bijwerking. Ongeveer de helft van de patiënten die stopten (9% van het totaal) had meerdere klachten, waarvan geen enkele als primair kon worden aangemerkt. Waar een primaire reden voor stopzetting kon worden geïdentificeerd, stopten de meeste patiënten vanwege klachten aan het zenuwstelsel (5,4%), voornamelijk slaperigheid. De op één na meest voorkomende reden om te stoppen waren spijsverteringsklachten (1,3%), voornamelijk braken en misselijkheid.
Er was geen duidelijk verband tussen de bijwerkingen en verhoogde plasmaconcentraties van het geneesmiddel.
Incidentie in gecontroleerde klinische onderzoeken
De volgende tabel somt bijwerkingen op die optraden met een incidentie van 1% of meer bij patiënten met OCS die Anafranil 10 mg kregen in placebogecontroleerde klinische onderzoeken bij volwassenen of kinderen. De frequenties zijn verkregen uit gepoolde gegevens van klinische onderzoeken waarbij volwassenen betrokken waren die Anafranil (N=322) of placebo (N=319) kregen of kinderen die werden behandeld met Anafranil (N=46) of placebo (N=44). De voorschrijver dient zich ervan bewust te zijn dat deze cijfers niet kunnen worden gebruikt om de incidentie van bijwerkingen in de loop van de normale medische praktijk te voorspellen, waarbij patiëntkenmerken en andere factoren verschillen van die in de klinische onderzoeken. Evenzo kunnen de genoemde frequenties niet worden vergeleken met cijfers die zijn verkregen uit andere klinische onderzoeken met verschillende behandelingen, toepassingen en onderzoekers. De aangehaalde cijfers bieden de arts echter een basis voor het schatten van de relatieve bijdrage van medicamenteuze en niet-medicamenteuze factoren aan het optreden van bijwerkingen in de onderzochte populaties.
Incidentie van tijdens de behandeling optredende bijwerkingen in placebogecontroleerde klinische onderzoeken (percentage patiënten dat voorval meldt)
Andere gebeurtenissen waargenomen tijdens de premarketing-evaluatie van anafranil
Tijdens klinische testen in de VS werden meerdere doses Anafranil 50 mg toegediend aan ongeveer 3600 proefpersonen. Ongewenste gebeurtenissen in verband met deze blootstelling werden geregistreerd door klinische onderzoekers met behulp van terminologie naar eigen keuze. Bijgevolg is het niet mogelijk om een zinvolle schatting te geven van het aantal personen dat bijwerkingen ervaart zonder eerst soortgelijke soorten ongewenste voorvallen te groeperen in een kleiner aantal gestandaardiseerde gebeurteniscategorieën.
In de volgende tabellen is een aangepast terminologisch woordenboek van de Wereldgezondheidsorganisatie gebruikt om gerapporteerde bijwerkingen te classificeren. De gepresenteerde frequenties vertegenwoordigen daarom het aandeel van de 3525 personen die zijn blootgesteld aan Anafranil en die een gebeurtenis van het genoemde type hebben meegemaakt bij ten minste één gelegenheid tijdens het ontvangen van Anafranil. Alle gebeurtenissen zijn inbegrepen, behalve die welke al in de vorige tabel zijn vermeld, die gerapporteerd in termen die zo algemeen zijn dat ze weinig informatief zijn, en die waarbij een verband met het medicijn ver weg was. Het is belangrijk om te benadrukken dat hoewel de gemelde voorvallen tijdens de behandeling met Anafranil optraden, ze er niet noodzakelijk door werden veroorzaakt.
Gebeurtenissen worden verder gecategoriseerd per lichaamssysteem en gerangschikt in afnemende frequentie volgens de volgende definities: frequente bijwerkingen zijn bijwerkingen die zich bij een of meer gevallen voordoen bij ten minste 1/100 patiënten; zeldzame bijwerkingen zijn die voorkomen bij 1/100 tot 1/1000 patiënten; zeldzame voorvallen zijn die voorkomen bij minder dan 1/1000 patiënten.
Lichaam als geheel - Onregelmatig - algemeen oedeem, verhoogde vatbaarheid voor infecties, malaise. Zelden - afhankelijk oedeem, ontwenningssyndroom.
Cardiovasculair systeem - Onregelmatig - abnormaal ECG, aritmie, bradycardie, hartstilstand, extrasystolen, bleekheid. Zelden - aneurysma, atriale flutter, bundeltakblok, hartfalen, hersenbloeding, hartblok, myocardinfarct, myocardischemie, perifere ischemie, tromboflebitis, vasospasme, ventriculaire tachycardie.
Spijsverteringsstelsel - Onregelmatig - abnormale leverfunctie, bloed in de ontlasting, colitis, duodenitis, maagzweer, gastritis, gastro-oesofageale reflux, gingivitis, glossitis, aambeien, hepatitis, verhoogd speeksel, prikkelbare darmsyndroom, maagzweer, rectale bloeding, tongzweren, tandcariës. Zelden - cheilitis, chronische enteritis, verkleurde ontlasting, maagdilatatie, tandvleesbloeding, hik, darmobstructie, oraal/farynxoedeem, paralytische ileus, vergroting van de speekselklier.
Endocrien systeem - Onregelmatig - hypothyreoïdie. Zelden - struma, gynaecomastie, hyperthyreoïdie.
Hemic en lymfatisch systeem - Onregelmatig - lymfadenopathie. Zelden - leukemoïde reactie, lymfoom-achtige aandoening, beenmergdepressie.
Metabole en voedingsstoornis - Onregelmatig - uitdroging, diabetes mellitus, jicht, hypercholesterolemie, hyperglykemie, hyperurikemie, hypokaliëmie. Zeldzaam - vetintolerantie, glycosurie.
Musculoskeletaal systeem - Onregelmatig - artrose. Zelden - dystonie, exostose, lupus erythematosus uitslag, blauwe plekken, myopathie, myositis, polyarteritis nodosa, torticollis.
Zenuwstelsel - Frequent - abnormaal denken, duizeligheid. Onregelmatig - abnormale coördinatie, abnormaal EEG, abnormaal lopen, apathie, ataxie, coma, convulsies, delirium, waanvoorstellingen, dyskinesie, dysfonie, encefalopathie, euforie, extrapiramidale stoornis, hallucinaties, vijandigheid, hyperkinesie, hypnagogische hallucinaties, hypokinesie, krampen in de benen, manische reactie , neuralgie, paranoia, fobische stoornis, psychose, sensorische stoornis, somnambulisme, stimulatie, zelfmoordgedachten, zelfmoordpoging, tandenknarsen. Zelden - anticholinergisch syndroom, afasie, apraxie, katalepsie, cholinerge syndroom, choreoathetose, gegeneraliseerde spasmen, hemiparese, hyperesthesie, hyperreflexie, hypesthesie, illusie, verminderde impulscontrole, besluiteloosheid, mutisme, neuropathie, nystagmus, oculogyorische zenuwcrisis, ocullogyrische zenuwcrisis , verdoving, zelfmoord.
Ademhalingssysteem - Onregelmatig - bronchitis, hyperventilatie, verhoogd sputum, longontsteking. Zelden - cyanose, bloedspuwing, hypoventilatie, laryngisme.
Huid en aanhangsels - Onregelmatig - alopecia, cellulitis, cyste, eczeem, erythemateuze uitslag, genitale pruritus, maculopapulaire uitslag, fotosensitiviteitsreactie, psoriasis, pustuleuze uitslag, huidverkleuring. Zelden - chloasma, folliculitis, hypertrichose, pilo-erectie, seborrhea, huidhypertrofie, huidulceratie.
Speciale zintuigen - Onregelmatig - abnormale accommodatie, doofheid, diplopie, oorpijn, oogpijn, gevoel van vreemd lichaam, hyperacusis, parosmie, fotofobie, scleritis, smaakverlies. Zelden - blefaritis, chromatopsie, conjunctivale bloeding, exophthalmus, glaucoom, keratitis, labyrintaandoening, nachtblindheid, netvliesaandoening, scheelzien, gezichtsvelddefect.
Urogenitaal systeem - Onregelmatig - endometriose, epididymitis, hematurie, nocturie, oligurie, cyste van de eierstokken, perineale pijn, polyurie, prostaataandoening, niersteen, nierpijn, urethrale aandoening, urine-incontinentie, baarmoederbloeding, vaginale bloeding. Zelden - albuminurie, anorgasmie, stuwing van de borst, borstfibroadenose, cervicale dysplasie, endometriumhyperplasie, premature ejaculatie, pyelonefritis, pyurie, niercyste, baarmoederontsteking, vulvaire aandoening.
Postmarketingervaring
De volgende bijwerking is gemeld tijdens het gebruik van Anafranil na goedkeuring. Omdat deze reactie vrijwillig wordt gerapporteerd vanuit een populatie van onbekende grootte, is het niet altijd mogelijk om de frequentie betrouwbaar te schatten.
Oogaandoeningen - Hoekglaucoom.
Immuunsysteemaandoeningen - Geneesmiddeluitslag met eosinofilie en systemische symptomen (JURK).
Metabolisme en voedingsstoornissen - Hyponatriëmie.
Endocriene aandoeningen - Syndroom van ongepaste secretie van antidiuretisch hormoon (SIADH).
DRUG-INTERACTIES
De risico's van het gebruik van Anafranil in combinatie met andere geneesmiddelen zijn niet systematisch geëvalueerd. Gezien de primaire CZS-effecten van Anafranil, is voorzichtigheid geboden bij gelijktijdig gebruik met andere CZS-actieve geneesmiddelen (zie GEDULDIG INFORMATIE ). Anafranil mag niet worden gebruikt met MAO-remmers (zie: CONTRA-INDICATIES ).
Nauwlettend toezicht en zorgvuldige aanpassing van de dosering zijn vereist wanneer Anafranil wordt toegediend met anticholinergica of sympathicomimetica.
Van verschillende tricyclische antidepressiva is gemeld dat ze de farmacologische effecten van guanethidine, clonidine of soortgelijke middelen blokkeren, en een dergelijk effect kan worden verwacht bij CMI vanwege de structurele gelijkenis met andere tricyclische antidepressiva.
Er is gemeld dat de plasmaconcentratie van CMI verhoogd is bij gelijktijdige toediening van haloperidol; Er is gemeld dat plasmaspiegels van verschillende nauw verwante tricyclische antidepressiva verhoogd zijn door gelijktijdige toediening van methylfenidaat of leverenzymremmers (bijv. cimetidine, fluoxetine) en verlaagd door gelijktijdige toediening van leverenzyminductoren (bijv. barbituraten, fenytoïne), en een dergelijk effect kan ook met CMI worden verwacht. Er is gemeld dat toediening van CMI de plasmaspiegels van fenobarbital verhoogt, indien gelijktijdig gegeven (zie KLINISCHE FARMACOLOGIE , Interacties ).
Geneesmiddelen gemetaboliseerd door P450 2D6
De biochemische activiteit van het geneesmiddel metaboliserende isozym cytochroom P450 2D6 (debrisoquin hydroxylase) is verminderd in een subgroep van de blanke populatie (ongeveer 7% tot 10% van de blanken zijn zogenaamde "slechte metaboliseerders"); betrouwbare schattingen van de prevalentie van verminderde P450 2D6-isozymactiviteit onder Aziatische, Afrikaanse en andere populaties zijn nog niet beschikbaar. Slechte metaboliseerders hebben hoger dan verwachte plasmaconcentraties van tricyclische antidepressiva (TCA's) wanneer ze de gebruikelijke doses krijgen. Afhankelijk van de fractie van het geneesmiddel die door P450 2D6 wordt gemetaboliseerd, kan de toename van de plasmaconcentratie klein of vrij groot zijn (8-voudige toename van de plasma-AUC van de TCA). Bovendien remmen bepaalde geneesmiddelen de activiteit van dit isozym en zorgen ervoor dat normale metaboliseerders lijken op slechte metaboliseerders. Een persoon die stabiel is op een bepaalde dosis TCA kan abrupt toxisch worden wanneer een van deze remmende geneesmiddelen als gelijktijdige therapie wordt gegeven. De geneesmiddelen die cytochroom P450 2D6 remmen, omvatten enkele die niet door het enzym worden gemetaboliseerd (kinidine; cimetidine) en vele die substraten zijn voor P450 2D6 (veel andere antidepressiva, fenothiazinen en de type 1C-antiaritmica propafenon en flecaïnide). Hoewel alle selectieve serotonineheropnameremmers (SSRI's), bijv. fluoxetine, sertraline, paroxetine en fluvoxamine, P450 2D6 remmen, kunnen ze variëren in de mate van remming. Van fluvoxamine is ook aangetoond dat het P450 1A2 remt, een isovorm die ook betrokken is bij het TCA-metabolisme. De mate waarin SSRI-TCA-interacties klinische problemen kunnen opleveren, hangt af van de mate van remming en de farmacokinetiek van de betrokken SSRI. Niettemin is voorzichtigheid geboden bij gelijktijdige toediening van TCA's met een van de SSRI's en ook bij het overschakelen van de ene klasse naar de andere. Van bijzonder belang is dat er voldoende tijd moet verstrijken voordat de TCA-behandeling wordt gestart bij een patiënt die wordt gestopt met fluoxetine, gezien de lange halfwaardetijd van de ouder en de actieve metaboliet (minimaal 5 weken kan nodig zijn). Gelijktijdig gebruik van middelen uit de klasse van tricyclische antidepressiva (waaronder anafranil) met geneesmiddelen die cytochroom P450 2D6 kunnen remmen, kan lagere doses vereisen dan gewoonlijk wordt voorgeschreven voor het tricyclische antidepressivum of het andere geneesmiddel. Bovendien kan, wanneer een van deze geneesmiddelen uit de gelijktijdige therapie wordt gestaakt, een verhoogde dosis tricyclisch antidepressivum nodig zijn. Het is wenselijk om de TCA-plasmaspiegels te controleren wanneer een middel van de klasse van tricyclische antidepressiva, waaronder Anafranil, gelijktijdig zal worden toegediend met een ander geneesmiddel waarvan bekend is dat het een remmer van P450 2D6 (en/of P450 1A2) is.
Omdat Anafranil sterk gebonden is aan serumeiwitten, kan de toediening van Anafranil aan patiënten die andere geneesmiddelen gebruiken die sterk aan eiwitten gebonden zijn (bijv. warfarine, digoxine) een verhoging van de plasmaconcentraties van deze geneesmiddelen veroorzaken, wat mogelijk kan leiden tot bijwerkingen. Omgekeerd kunnen bijwerkingen het gevolg zijn van verdringing van eiwitgebonden anafranil door andere sterk gebonden geneesmiddelen (zie: KLINISCHE FARMACOLOGIE , Verdeling ).
Monoamineoxidaseremmers (MAO-remmers)
(Zien CONTRA-INDICATIES , WAARSCHUWINGEN , en DOSERING EN ADMINISTRATIE .)
Serotonerge geneesmiddelen
(Zien CONTRA-INDICATIES , WAARSCHUWINGEN , en DOSERING EN ADMINISTRATIE .)
Drugsmisbruik en afhankelijkheid
Anafranil is niet systematisch onderzocht bij dieren of mensen vanwege het potentieel voor misbruik, tolerantie of fysieke afhankelijkheid. Hoewel er verschillende ontwenningsverschijnselen zijn beschreven in verband met stopzetting van Anafranil 50 mg (zie: PREVENTIEVE MAATREGELEN , Ontwenningsverschijnselen ), is er geen bewijs voor drugszoekgedrag, behalve een enkele melding van mogelijk anafranil-misbruik door een patiënt met een voorgeschiedenis van afhankelijkheid van codeïne, benzodiazepinen en meerdere psychoactieve drugs. De patiënt kreeg Anafranil voor depressie en paniekaanvallen en bleek na ontslag uit het ziekenhuis afhankelijk te worden.
Ondanks het gebrek aan bewijs dat suggereert dat Anafranil aansprakelijk is voor misbruik in buitenlandse marketing, is het niet mogelijk om te voorspellen in hoeverre Anafranil kan worden misbruikt of misbruikt zodra het in de VS op de markt is gebracht. Daarom moeten artsen patiënten zorgvuldig evalueren op een voorgeschiedenis van drugsmisbruik en volg dergelijke patiënten op de voet.
WAARSCHUWINGEN
Klinische verslechtering en zelfmoordrisico
Patiënten met een depressieve stoornis (MDD), zowel volwassenen als kinderen, kunnen een verergering van hun depressie ervaren en/of het optreden van zelfmoordgedachten en -gedrag (suïcidaliteit) of ongewone gedragsveranderingen, ongeacht of ze antidepressiva gebruiken of niet, en dit risico kan aanhouden totdat significante remissie optreedt. Zelfmoord is een bekend risico op depressie en bepaalde andere psychiatrische stoornissen, en deze stoornissen zelf zijn de sterkste voorspellers van zelfmoord. Er bestaat echter al lang de bezorgdheid dat antidepressiva een rol kunnen spelen bij het veroorzaken van verergering van depressie en het optreden van suïcidaliteit bij bepaalde patiënten tijdens de vroege fasen van de behandeling. Gepoolde analyses van kortdurende placebogecontroleerde onderzoeken met antidepressiva (SSRI's en andere) toonden aan dat deze geneesmiddelen het risico op zelfmoordgedachten en -gedrag (suïcidaliteit) verhogen bij kinderen, adolescenten en jonge volwassenen (18 tot 24 jaar) met depressieve stoornis (MDD) en andere psychiatrische stoornissen. Kortdurende onderzoeken lieten geen toename zien van het risico op suïcidaliteit bij gebruik van antidepressiva in vergelijking met placebo bij volwassenen ouder dan 24 jaar; er was een afname met antidepressiva vergeleken met placebo bij volwassenen van 65 jaar en ouder.
De gepoolde analyses van placebogecontroleerde onderzoeken bij kinderen en adolescenten met MDD, obsessieve compulsieve stoornis (OCS) of andere psychiatrische stoornissen omvatten in totaal 24 kortetermijnonderzoeken met 9 antidepressiva bij meer dan 4400 patiënten. De gepoolde analyses van placebogecontroleerde onderzoeken bij volwassenen met MDD of andere psychiatrische stoornissen omvatten in totaal 295 kortetermijnonderzoeken (mediane duur van 2 maanden) van 11 antidepressiva bij meer dan 77.000 patiënten. Er was een aanzienlijke variatie in het risico op suïcidaliteit tussen geneesmiddelen, maar een tendens naar een toename bij de jongere patiënten voor bijna alle onderzochte geneesmiddelen. Er waren verschillen in absoluut risico op suïcidaliteit tussen de verschillende indicaties, met de hoogste incidentie bij MDD. De risicoverschillen (geneesmiddel versus placebo) waren echter relatief stabiel binnen leeftijdscategorieën en tussen indicaties. Deze risicoverschillen (drugplacebo-verschil in het aantal gevallen van suïcidaliteit per 1000 behandelde patiënten) worden weergegeven in tabel 1.
In geen van de pediatrische onderzoeken kwamen zelfmoorden voor. Er waren zelfmoorden in de onderzoeken bij volwassenen, maar het aantal was niet voldoende om enige conclusie te trekken over het effect van het medicijn op zelfmoord.
Het is niet bekend of het suïcidaliteitsrisico zich uitstrekt tot langdurig gebruik, dat wil zeggen langer dan enkele maanden. Er is echter substantieel bewijs uit placebogecontroleerde onderhoudsonderzoeken bij volwassenen met depressie dat het gebruik van antidepressiva het opnieuw optreden van depressie kan vertragen.
Alle patiënten die voor welke indicatie dan ook met antidepressiva worden behandeld, moeten op de juiste manier worden gecontroleerd en nauwlettend worden geobserveerd op klinische verergering, suïcidaliteit en ongewone gedragsveranderingen, vooral tijdens de eerste paar maanden van een medicamenteuze behandeling, of op tijdstippen van dosisveranderingen, ofwel verhogingen of afneemt.
De volgende symptomen, angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie en manie, zijn gemeld bij volwassen en pediatrische patiënten die ook werden behandeld met antidepressiva voor depressieve stoornis evenals voor andere indicaties, zowel psychiatrisch als niet-psychiatrisch. Hoewel er geen oorzakelijk verband is tussen het ontstaan van dergelijke symptomen en ofwel de verergering van depressie en/of het ontstaan van suïcidale impulsen, bestaat er bezorgdheid dat dergelijke symptomen een voorbode kunnen zijn van opkomende suïcidaliteit.
Bij patiënten bij wie de depressie aanhoudend erger is, of die opkomende suïcidaliteit ervaren of symptomen die een voorbode kunnen zijn van een verergering van depressie of suïcidaliteit, moet worden overwogen om het therapeutische regime te veranderen, met inbegrip van het mogelijk stopzetten van de medicatie, vooral als deze symptomen ernstig en abrupt zijn. bij aanvang, of maakten geen deel uit van de symptomen van de patiënt.
Families en verzorgers van patiënten die worden behandeld met antidepressiva voor depressieve stoornis of andere indicaties, zowel psychiatrische als niet-psychiatrische, moeten worden gewaarschuwd voor de noodzaak om patiënten te controleren op het optreden van agitatie, prikkelbaarheid, ongebruikelijke gedragsveranderingen en de andere hierboven beschreven symptomen , evenals de opkomst van suïcidaliteit, en om dergelijke symptomen onmiddellijk aan zorgverleners te melden. Dergelijke monitoring moet dagelijkse observatie door families en zorgverleners omvatten. Voorschriften voor clomipraminehydrochloride dienen te worden geschreven voor de kleinste hoeveelheid capsules in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.

Patiënten screenen op bipolaire stoornis
Een depressieve episode kan de eerste presentatie van een bipolaire stoornis zijn. Over het algemeen wordt aangenomen (hoewel niet vastgesteld in gecontroleerde onderzoeken) dat de behandeling van een dergelijke episode met alleen een antidepressivum de kans op neerslag van een gemengde/manische episode kan vergroten bij patiënten met een risico op een bipolaire stoornis. Of een van de hierboven beschreven symptomen een dergelijke conversie vertegenwoordigen, is niet bekend. Echter, voordat de behandeling met een antidepressivum wordt gestart, moeten patiënten met depressieve symptomen adequaat worden gescreend om te bepalen of ze een risico lopen op een bipolaire stoornis; een dergelijke screening moet een gedetailleerde psychiatrische geschiedenis omvatten, inclusief een familiegeschiedenis van zelfmoord, bipolaire stoornis en depressie. Opgemerkt moet worden dat clomipraminehydrochloride niet is goedgekeurd voor gebruik bij de behandeling van bipolaire depressie.
serotonine syndroom
De ontwikkeling van een mogelijk levensbedreigend serotoninesyndroom is gemeld met SNRI's en SSRI's, waaronder Anafranil 50 mg, alleen maar vooral bij gelijktijdig gebruik van andere serotonerge geneesmiddelen (waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, tryptofaan, buspiron en sint-janskruid) en met geneesmiddelen die het metabolisme van serotonine aantasten (met name MAO-remmers, zowel die bedoeld voor de behandeling van psychiatrische stoornissen als andere, zoals linezolid en intraveneus methyleenblauw).
Symptomen van het serotoninesyndroom kunnen zijn: veranderingen in de mentale toestand (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie), neuromusculaire veranderingen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen en/of gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom.
Gelijktijdig gebruik van Anafranil 10 mg met MAO-remmers bedoeld voor de behandeling van psychiatrische stoornissen is gecontra-indiceerd. Anafranil 50 mg mag ook niet worden gestart bij een patiënt die wordt behandeld met MAO-remmers zoals linezolid of intraveneus methyleenblauw. Alle rapporten met methyleenblauw die informatie verschaften over de toedieningsweg, hadden betrekking op intraveneuze toediening in het dosisbereik van 1 mg/kg tot 8 mg/kg. Er zijn geen meldingen geweest van toediening van methyleenblauw via andere routes (zoals orale tabletten of lokale weefselinjectie) of in lagere doses. Er kunnen omstandigheden zijn waarin het nodig is om een behandeling met een MAO-remmer zoals linezolid of intraveneus methyleenblauw te starten bij een patiënt die Anafranil gebruikt. Anafranil moet worden stopgezet voordat de behandeling met de MAO-remmer wordt gestart (zie: CONTRA-INDICATIES en DOSERING EN ADMINISTRATIE ).
Als gelijktijdig gebruik van Anafranil 10 mg met andere serotonerge geneesmiddelen, waaronder triptanen, tricyclische antidepressiva, fentanyl, lithium, tramadol, buspiron, tryptofaan en sint-janskruid klinisch gerechtvaardigd is, moeten patiënten bewust worden gemaakt van een mogelijk verhoogd risico op serotoninesyndroom, vooral tijdens de start van de behandeling en bij dosisverhogingen.
Behandeling met Anafranil 10 mg en alle gelijktijdig gebruikte serotonerge middelen dienen onmiddellijk te worden gestaakt als de bovenstaande gebeurtenissen optreden en ondersteunende symptomatische behandeling moet worden gestart.
Hoeksluiting glaucoom
De pupilverwijding die optreedt na het gebruik van veel antidepressiva, waaronder anafranil, kan een aanval van hoeksluiting veroorzaken bij een patiënt met anatomisch nauwe hoeken die geen patente iridectomie heeft.
epileptische aanvallen
Tijdens de evaluatie voorafgaand aan het op de markt brengen, werd inbeslagneming geïdentificeerd als het belangrijkste risico van het gebruik van anafranil.
De waargenomen cumulatieve incidentie van aanvallen bij patiënten blootgesteld aan Anafranil 25 mg in doses tot 300 mg/dag was 0,64% na 90 dagen, 1,12% na 180 dagen en 1,45% na 365 dagen. De cumulatieve percentages corrigeren het ruwe percentage van 0,7% (25 van de 3519 patiënten) voor de variabele blootstellingsduur in klinische onderzoeken.
Hoewel de dosis een voorspeller van een aanval lijkt te zijn, is er een verstoring van de dosis en de duur van de blootstelling, waardoor het moeilijk is om onafhankelijk het effect van een van beide factoren afzonderlijk te beoordelen. Het vermogen om het optreden van aanvallen te voorspellen bij proefpersonen die zijn blootgesteld aan doses CMI van meer dan 250 mg, is beperkt, aangezien de plasmaconcentratie van CMI dosisafhankelijk kan zijn en kan variëren tussen proefpersonen die dezelfde dosis krijgen. Desalniettemin wordt voorschrijvers geadviseerd om de dagelijkse dosis te beperken tot maximaal 250 mg bij volwassenen en 3 mg/kg (of 200 mg) bij kinderen en adolescenten (zie DOSERING EN ADMINISTRATIE ).
Voorzichtigheid is geboden bij het toedienen van Anafranil 50 mg aan patiënten met een voorgeschiedenis van convulsies of andere predisponerende factoren, bijv. hersenbeschadiging van verschillende etiologie, alcoholisme en gelijktijdig gebruik met andere geneesmiddelen die de drempel voor convulsies verlagen.
Zeldzame meldingen van sterfgevallen in verband met epileptische aanvallen zijn gemeld door buitenlandse postmarketingsurveillance, maar niet in klinische onderzoeken in de VS. In sommige van deze gevallen was Anafranil toegediend met andere epileptogene middelen; in andere hadden de betrokken patiënten mogelijk predisponerende medische aandoeningen. Er is dus geen causaal verband tussen de behandeling met Anafranil 25 mg en deze sterfgevallen vastgesteld.
Artsen moeten met patiënten het risico bespreken van het gebruik van Anafranil tijdens activiteiten waarbij plotseling bewustzijnsverlies kan leiden tot ernstig letsel bij de patiënt of anderen, bijv. de bediening van complexe machines, autorijden, zwemmen, klimmen.
JURK
Zeldzame gevallen van geneesmiddeluitslag met eosinofilie en systemische symptomen (DRESS) zijn gemeld bij het gebruik van clomipramine. In het geval van ernstige acute reacties, zoals DRESS, moet de behandeling met clomipramine onmiddellijk worden gestaakt en moet een geschikte behandeling worden ingesteld.
PREVENTIEVE MAATREGELEN
Algemeen
Zelfmoord
Aangezien depressie een vaak geassocieerd kenmerk van OCS is, moet rekening worden gehouden met het risico op zelfmoord. Voorschriften voor Anafranil moeten worden geschreven voor de kleinste hoeveelheid capsules in overeenstemming met goed patiëntenbeheer, om het risico op overdosering te verminderen.
Cardiovasculaire effecten
Bescheiden orthostatische verlagingen van de bloeddruk en matige tachycardie werden elk gezien bij ongeveer 20% van de patiënten die Anafranil 10 mg gebruikten in klinische onderzoeken; maar patiënten waren vaak asymptomatisch. Van de ongeveer 1400 patiënten die in de premarketingervaring met CMI werden behandeld en ECG's hadden, ontwikkelde 1,5% afwijkingen tijdens de behandeling, vergeleken met 3,1% van de patiënten die actieve controlemedicijnen kregen en 0,7% van de patiënten die placebo kregen. De meest voorkomende ECG-veranderingen waren PVC's, ST-T-golfveranderingen en intraventriculaire geleidingsafwijkingen. Deze veranderingen gingen zelden gepaard met significante klinische symptomen. Niettemin is voorzichtigheid geboden bij de behandeling van patiënten met bekende cardiovasculaire aandoeningen, en geleidelijke dosistitratie wordt aanbevolen.
Psychose, verwarring en andere neuropsychiatrische verschijnselen
Van patiënten die werden behandeld met Anafranil 10 mg is gemeld dat ze een verscheidenheid aan neuropsychiatrische tekenen en symptomen vertonen, waaronder wanen, hallucinaties, psychotische episodes, verwardheid en paranoia. Vanwege het ongecontroleerde karakter van veel van de onderzoeken is het onmogelijk om een nauwkeurige schatting te geven van de omvang van het risico dat de behandeling met Anafranil met zich meebrengt. Zoals met tricyclische antidepressiva waaraan het nauw verwant is, kan Anafranil 25 mg een acute psychotische episode uitlokken bij patiënten met niet-herkende schizofrenie.
Manie/hypomanie
Tijdens premarketingtests van Anafranil 10 mg bij patiënten met een affectieve stoornis werd hypomanie of manie bij verschillende patiënten versneld. Activering van manie of hypomanie is ook gemeld bij een klein deel van de patiënten met een affectieve stoornis die werden behandeld met in de handel verkrijgbare tricyclische antidepressiva, die nauw verwant zijn aan Anafranil.
Leververanderingen
Tijdens premarketingtests werd Anafranil af en toe geassocieerd met verhogingen van SGOT en SGPT (gepoolde incidentie van respectievelijk ongeveer 1% en 3%) van potentieel klinisch belang (dwz waarden groter dan 3 keer de bovengrens van normaal). In de overgrote meerderheid van de gevallen waren deze enzymverhogingen niet geassocieerd met andere klinische bevindingen die wijzen op leverbeschadiging; bovendien was niemand geelzuchtig. Zeldzame meldingen van ernstiger leverletsel, waarvan sommige fataal, zijn geregistreerd tijdens postmarketingervaring in het buitenland. Voorzichtigheid is geboden bij de behandeling van patiënten met een bekende leverziekte en bij dergelijke patiënten wordt een periodieke controle van de leverenzymspiegels aanbevolen.
Hematologische veranderingen
Hoewel er tijdens de premarketingervaring met Anafranil 25 mg geen gevallen van ernstige hematologische toxiciteit werden gezien, zijn er postmarketingmeldingen geweest van leukopenie, agranulocytose, trombocytopenie, anemie en pancytopenie in verband met het gebruik van Anafranil 50 mg. Zoals het geval is met tricyclische antidepressiva waaraan Anafranil 25 mg nauw verwant is, moeten leukocyten en differentiële bloedtellingen worden verkregen bij patiënten die koorts en keelpijn krijgen tijdens de behandeling met Anafranil.
Centraal zenuwstelsel
Er zijn meer dan 30 gevallen van hyperthermie geregistreerd door niet-huishoudelijke postmarketingsurveillancesystemen. De meeste gevallen deden zich voor wanneer Anafranil werd gebruikt in combinatie met andere geneesmiddelen. Wanneer Anafranil 25 mg en een neurolepticum gelijktijdig werden gebruikt, werden de gevallen soms beschouwd als voorbeelden van een maligne neurolepticasyndroom.
Seksuele disfunctie
Het percentage seksuele disfunctie bij mannelijke patiënten met OCS die in de premarketingervaring met Anafranil werden behandeld, was aanzienlijk verhoogd in vergelijking met placebo-controles (dwz 42% ervoer ejaculatiefalen en 20% ervoer impotentie, vergeleken met respectievelijk 2,0% en 2,6%, in de placebogroep). Ongeveer 85% van de mannen met seksuele disfunctie koos ervoor om de behandeling voort te zetten.
Hyponatriëmie
Hyponatriëmie is opgetreden als gevolg van behandeling met clomipramine. In veel gevallen lijkt hyponatriëmie het gevolg te zijn van het syndroom van ongepaste antidiuretisch hormoonsecretie (SIADH). Oudere patiënten lopen mogelijk een groter risico op het ontwikkelen van hyponatriëmie met een serotonerge antidepressivum. Ook kunnen patiënten die diuretica gebruiken of anderszins een volumedepletie hebben een groter risico lopen. Stopzetting van Anafranil bij patiënten met symptomatische hyponatriëmie en passende medische interventie moet worden ingesteld. Tekenen en symptomen van hyponatriëmie zijn onder meer hoofdpijn, concentratieproblemen, geheugenstoornissen, verwardheid, zwakte en onvastheid, wat kan leiden tot vallen. Ernstigere en/of acute gevallen omvatten hallucinaties, syncope, toevallen, coma, ademstilstand en overlijden.
Gewichtsveranderingen
In gecontroleerde onderzoeken naar OCS werd gewichtstoename gemeld bij 18% van de patiënten die Anafranil kregen, vergeleken met 1% van de patiënten die placebo kregen. In deze onderzoeken had 28% van de patiënten die Anafranil 25 mg kregen een gewichtstoename van ten minste 7% van hun oorspronkelijke lichaamsgewicht, vergeleken met 4% van de patiënten die placebo kregen. Verschillende patiënten hadden een gewichtstoename van meer dan 25% van hun oorspronkelijke lichaamsgewicht. Omgekeerd had 5% van de patiënten die Anafranil kregen en 1% die placebo kregen een gewichtsverlies van ten minste 7% van hun oorspronkelijke lichaamsgewicht.
Elektroconvulsietherapie
Zoals met nauw verwante tricyclische antidepressiva, kan gelijktijdige toediening van Anafranil met elektroconvulsietherapie de risico's verhogen; een dergelijke behandeling moet worden beperkt tot die patiënten voor wie het essentieel is, aangezien er beperkte klinische ervaring is.
Chirurgie
Voorafgaand aan electieve chirurgie met algemene anesthetica moet de behandeling met Anafranil 50 mg worden gestaakt zolang als klinisch haalbaar is, en moet de anesthesist worden geadviseerd.
Gebruik bij gelijktijdige ziekte
Patiënten met een significant verminderde nierfunctie.
Ontwenningsverschijnselen
Een verscheidenheid aan ontwenningsverschijnselen is gemeld in verband met abrupte stopzetting van Anafranil 50 mg, waaronder duizeligheid, misselijkheid, braken, hoofdpijn, malaise, slaapstoornissen, hyperthermie en prikkelbaarheid. Bovendien kunnen dergelijke patiënten een verslechtering van de psychiatrische status ervaren. Hoewel de ontwenningseffecten van Anafranil 10 mg niet systematisch zijn geëvalueerd in gecontroleerde onderzoeken, zijn ze welbekend bij nauw verwante tricyclische antidepressiva, en het wordt aanbevolen de dosering geleidelijk af te bouwen en de patiënt zorgvuldig te controleren tijdens het stoppen (zie Drugsmisbruik en afhankelijkheid ).
Informatie voor patiënten
Voorschrijvers of andere gezondheidswerkers moeten patiënten, hun families en hun verzorgers informeren over de voordelen en risico's van behandeling met clomipraminehydrochloride en hen adviseren bij het juiste gebruik ervan. Er is een medicatiehandleiding voor patiënten over "Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -handelingen" beschikbaar voor clomipraminehydrochloride. De voorschrijver of gezondheidswerker moet patiënten, hun families en hun zorgverleners instrueren om de medicatiehandleiding te lezen en moet hen helpen de inhoud ervan te begrijpen. Patiënten moeten de kans krijgen om de inhoud van de medicatiehandleiding te bespreken en om antwoord te krijgen op eventuele vragen. De volledige tekst van de medicatiehandleiding is herdrukt aan het einde van dit document.
Patiënten moeten op de hoogte worden gebracht van de volgende problemen en moeten worden gevraagd hun voorschrijver te waarschuwen als deze optreden tijdens het gebruik van clomipraminehydrochloride.
Klinische verslechtering en zelfmoordrisico
Patiënten, hun families en hun verzorgers moeten worden aangemoedigd alert te zijn op het optreden van angst, agitatie, paniekaanvallen, slapeloosheid, prikkelbaarheid, vijandigheid, agressiviteit, impulsiviteit, acathisie (psychomotorische rusteloosheid), hypomanie, manie, andere ongewone gedragsveranderingen verergering van depressie en zelfmoordgedachten, vooral in het begin van de behandeling met antidepressiva en wanneer de dosis omhoog of omlaag wordt aangepast. Families en verzorgers van patiënten moeten worden geadviseerd om dagelijks te kijken naar het optreden van dergelijke symptomen, aangezien veranderingen abrupt kunnen zijn. Dergelijke symptomen moeten aan de voorschrijver van de patiënt of gezondheidswerker worden gemeld, vooral als ze ernstig zijn, abrupt beginnen of geen deel uitmaken van de symptomen die de patiënt vertoont. Symptomen zoals deze kunnen in verband worden gebracht met een verhoogd risico op zelfmoordgedachten en -gedrag en duiden op een noodzaak tot zeer nauwgezette monitoring en mogelijk wijzigingen in de medicatie.
Artsen wordt geadviseerd om de volgende zaken te bespreken met patiënten voor wie zij Anafranil voorschrijven:
- Het risico op een aanval (zie WAARSCHUWINGEN );
- De relatief hoge incidentie van seksuele disfunctie bij mannen (zie: Seksuele disfunctie );
- Aangezien Anafranil 50 mg de mentale en/of fysieke vermogens die nodig zijn voor het uitvoeren van complexe taken kan aantasten, en aangezien Anafranil 25 mg in verband wordt gebracht met een risico op epileptische aanvallen, moeten patiënten worden gewaarschuwd voor het uitvoeren van complexe en gevaarlijke taken (zie WAARSCHUWINGEN );
- Patiënten moeten worden gewaarschuwd voor het gelijktijdig gebruik van alcohol, barbituraten of andere CZS-depressiva, aangezien Anafranil 50 mg hun reactie op deze geneesmiddelen kan versterken;
- Patiënten moeten hun arts op de hoogte stellen als ze zwanger worden of van plan zijn zwanger te worden tijdens de therapie;
- Patiënten moeten hun arts op de hoogte stellen als ze borstvoeding geven.
Patiënten moeten erop worden gewezen dat het gebruik van Anafranil lichte pupilverwijding kan veroorzaken, wat bij daarvoor gevoelige personen kan leiden tot een episode van geslotenhoekglaucoom. Reeds bestaand glaucoom is bijna altijd openhoekglaucoom omdat geslotenhoekglaucoom, indien gediagnosticeerd, definitief kan worden behandeld met iridectomie. Openhoekglaucoom is geen risicofactor voor geslotenhoekglaucoom. Patiënten willen mogelijk worden onderzocht om te bepalen of ze vatbaar zijn voor hoeksluiting en een profylactische procedure ondergaan (bijv. iridectomie), als ze vatbaar zijn.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen bewijs van carcinogeniteit gevonden in twee 2-jarige bioassays bij ratten met doses tot 100 mg/kg, wat 24 en 4 keer de maximale aanbevolen dagelijkse dosis voor de mens (MRHD) is op respectievelijk mg/kg en mg/m² basis , of in een 2-jarige bioassay bij muizen met doses tot 80 mg/kg, wat respectievelijk 20 en 1,5 keer de MRHD is op basis van mg/kg en mg/m².
In reproductiestudies werden geen effecten op de vruchtbaarheid gevonden bij ratten die tot 24 mg/kg kregen toegediend, wat 6 keer en ongeveer gelijk is aan de MRHD op respectievelijk mg/kg en mg/m² basis.
Zwangerschap Categorie C
Er zijn geen teratogene effecten waargenomen in onderzoeken uitgevoerd bij ratten en muizen bij doses tot 100 mg/kg, wat 24 maal de maximaal aanbevolen dagelijkse dosis voor de mens (MRHD) is op basis van mg/kg en 4 maal (ratten) en 2 maal ( muizen) de MRHD op basis van mg/m². Er werden lichte niet-specifieke embryo-/foetotoxische effecten waargenomen bij de nakomelingen van behandelde ratten die 50 en 100 mg/kg kregen en van behandelde muizen die 100 mg/kg kregen.
Er zijn geen adequate of goed gecontroleerde onderzoeken bij zwangere vrouwen. Ontwenningsverschijnselen, waaronder zenuwachtigheid, tremor en toevallen, zijn gemeld bij pasgeborenen van wie de moeder tot aan de bevalling 50 mg Anafranil had ingenomen. Anafranil 10 mg mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Moeders die borstvoeding geven
Anafranil is aangetroffen in moedermelk. Vanwege de kans op bijwerkingen moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij de pediatrische populatie anders dan pediatrische patiënten met OCS zijn niet vastgesteld (zie: DOOS WAARSCHUWING: en WAARSCHUWINGEN , Klinische verslechtering en zelfmoordrisico ). Iedereen die het gebruik van Anafranil bij een kind of adolescent overweegt, moet de mogelijke risico's afwegen tegen de klinische noodzaak.
In een gecontroleerd klinisch onderzoek bij kinderen en adolescenten (10 tot 17 jaar) kregen 46 poliklinische patiënten Anafranil 50 mg gedurende maximaal 8 weken. Daarnaast hebben 150 adolescente patiënten Anafranil 10 mg gekregen in open-label protocollen gedurende een periode van enkele maanden tot meerdere jaren. Van de 196 onderzochte adolescenten waren er 50 van 13 jaar of jonger en 146 van 14 tot 17 jaar. Het bijwerkingenprofiel in deze leeftijdsgroep (zie: ONGEWENSTE REACTIES ) is vergelijkbaar met die waargenomen bij volwassenen.
De eventuele risico's die gepaard kunnen gaan met langdurig gebruik van Anafranil bij kinderen en adolescenten met OCS zijn niet systematisch beoordeeld. Het bewijs dat de conclusie ondersteunt dat Anafranil 50 mg veilig is voor gebruik bij kinderen en adolescenten, is afgeleid van klinische onderzoeken op relatief korte termijn en uit extrapolatie van ervaring die is opgedaan met volwassen patiënten. Er zijn met name geen onderzoeken die de effecten van langdurig gebruik van Anafranil 25 mg op de groei, ontwikkeling en rijping van kinderen en adolescenten direct evalueren. Hoewel er geen aanwijzingen zijn dat Anafranil 10 mg de groei, ontwikkeling of rijping nadelig beïnvloedt, is de afwezigheid van dergelijke bevindingen niet voldoende om de mogelijkheid van dergelijke effecten bij chronisch gebruik uit te sluiten.
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 10 jaar zijn niet vastgesteld. Daarom kunnen er geen specifieke aanbevelingen worden gedaan voor het gebruik van Anafranil bij pediatrische patiënten jonger dan 10 jaar.
Geriatrisch gebruik
Klinische onderzoeken met Anafranil 50 mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen; 152 patiënten van ten minste 60 jaar die deelnamen aan verschillende klinische onderzoeken in de VS kregen Anafranil gedurende een periode van enkele maanden tot meerdere jaren. Bij deze populatie werden geen ongebruikelijke leeftijdgerelateerde bijwerkingen vastgesteld. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Anafranil is in verband gebracht met gevallen van klinisch significante hyponatriëmie. Oudere patiënten lopen mogelijk een groter risico op deze bijwerking (zie: PREVENTIEVE MAATREGELEN , Hyponatriëmie ).
OVERDOSERING
Sterfgevallen kunnen optreden door overdosering met deze klasse geneesmiddelen. Inname van meerdere geneesmiddelen (inclusief alcohol) komt vaak voor bij opzettelijke tricyclische overdosering. Aangezien de behandeling complex en veranderlijk is, wordt aanbevolen dat de arts contact opneemt met een antigifcentrum voor actuele informatie over de behandeling. Tekenen en symptomen van toxiciteit ontwikkelen zich snel na tricyclische overdosering. Daarom is ziekenhuisbewaking zo snel mogelijk vereist.
Menselijke ervaring
In klinische onderzoeken in de VS kwamen 2 sterfgevallen voor in 12 gemelde gevallen van acute overdosering met Anafranil, alleen of in combinatie met andere geneesmiddelen. Eén overlijden betrof een patiënt die verdacht werd van het innemen van een dosis van 7000 mg. Het tweede overlijden betrof een patiënt die verdacht werd van het innemen van een dosis van 5750 mg. De 10 niet-fatale gevallen betroffen doses tot 5000 mg, vergezeld van plasmaspiegels tot 1010 ng/ml. Alle 10 patiënten herstelden volledig. Van de meldingen uit andere landen van een overdosis Anafranil was de laagste dosis die gepaard ging met een dodelijke afloop 750 mg. Op basis van postmarketingrapporten in het Verenigd Koninkrijk wordt de letaliteit van CMI bij overdosering geacht vergelijkbaar te zijn met die gerapporteerd voor nauw verwante tricyclische verbindingen die als antidepressiva op de markt worden gebracht.
manifestaties
Tekenen en symptomen variëren in ernst, afhankelijk van factoren zoals de hoeveelheid geabsorbeerd geneesmiddel, de leeftijd van de patiënt en de tijd die is verstreken sinds de inname van het geneesmiddel. Kritische manifestaties van overdosering zijn onder meer hartritmestoornissen, ernstige hypotensie, convulsies en depressie van het CZS inclusief coma. Veranderingen in het elektrocardiogram, met name in de QRS-as of -breedte, zijn klinisch significante indicatoren van tricyclische toxiciteit. Andere manifestaties van het CZS kunnen slaperigheid, stupor, ataxie, rusteloosheid, agitatie, delirium, ernstige transpiratie, hyperactieve reflexen, spierstijfheid en athetoïde en choreiforme bewegingen omvatten. Hartafwijkingen kunnen tachycardie, tekenen van congestief hartfalen en in zeer zeldzame gevallen hartstilstand omvatten. Ademhalingsdepressie, cyanose, shock, braken, hyperpyrexie, mydriasis en oligurie of anurie kunnen ook aanwezig zijn.
Beheer
Maak een ECG en start onmiddellijk hartbewaking. Bescherm de luchtwegen van de patiënt, breng een intraveneuze lijn aan en start maagdecontaminatie. Minimaal 6 uur observatie met hartbewaking en observatie op tekenen van CZS of ademhalingsdepressie, hypotensie, hartritmestoornissen en/of geleidingsblokkades en toevallen is noodzakelijk.
Als er tijdens deze periode tekenen van toxiciteit optreden, is uitgebreide monitoring vereist. Er zijn casusrapporten van patiënten die bezwijken aan fatale ritmestoornissen laat na een overdosis; deze patiënten hadden klinisch bewijs van significante vergiftiging voorafgaand aan de dood en de meeste kregen onvoldoende gastro-intestinale decontaminatie. Controle van de geneesmiddelspiegels in plasma mag geen leidraad zijn voor de behandeling van de patiënt.
Gastro-intestinale decontaminatie
Alle patiënten die verdacht worden van een tricyclische overdosis, moeten maagdarmontsmetting krijgen. Dit moet een maagspoeling met een groot volume omvatten, gevolgd door actieve kool. Als het bewustzijn verminderd is, moet de luchtweg worden afgesloten voordat er wordt gespoeld. Emesis is gecontra-indiceerd.
Cardiovasculair
Een maximale ledemaat-lead QRS-duur van ≥ 0,10 seconden kan de beste indicatie zijn voor de ernst van de overdosis. Intraveneus natriumbicarbonaat moet worden gebruikt om de serum-pH tussen 7,45 en 7,55 te houden. Als de pH-respons onvoldoende is, kan ook hyperventilatie worden toegepast. Gelijktijdig gebruik van hyperventilatie en natriumbicarbonaat moet met uiterste voorzichtigheid gebeuren, met frequente pH-controle. Een pH >7,60 of een pCO2
In zeldzame gevallen kan hemoperfusie gunstig zijn bij acute refractaire cardiovasculaire instabiliteit bij patiënten met acute toxiciteit. Van hemodialyse, peritoneale dialyse, wisseltransfusies en geforceerde diurese is echter in het algemeen gemeld dat ze niet effectief zijn bij tricyclische vergiftiging.
CNS
Bij patiënten met CZS-depressie wordt vroege intubatie geadviseerd vanwege het potentieel voor abrupte verslechtering. Epileptische aanvallen moeten onder controle worden gehouden met benzodiazepinen, of, als deze niet effectief zijn, andere anti-epileptica (bijv. fenobarbital, fenytoïne). Fysostigmine wordt niet aanbevolen, behalve voor de behandeling van levensbedreigende symptomen die niet reageerden op andere therapieën, en dan alleen in overleg met een antigifcentrum.
Psychiatrische follow-up
Aangezien overdosering vaak opzettelijk is, kunnen patiënten tijdens de herstelfase op andere manieren zelfmoord proberen te plegen. Psychiatrische verwijzing kan passend zijn.
Pediatrisch management
De principes voor het beheer van overdoseringen bij kinderen en volwassenen zijn vergelijkbaar. Het wordt sterk aanbevolen dat de arts contact opneemt met het plaatselijke antigifcentrum voor specifieke pediatrische behandeling.
CONTRA-INDICATIES
Anafranil is gecontra-indiceerd bij patiënten met een voorgeschiedenis van overgevoeligheid voor Anafranil 25 mg of andere tricyclische antidepressiva.
Monoamineoxidaseremmers (MAO-remmers)
Het gebruik van MAO-remmers bedoeld voor de behandeling van psychiatrische stoornissen met Anafranil of binnen 14 dagen na het stoppen van de behandeling met Anafranil is gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom. Het gebruik van Anafranil 10 mg binnen 14 dagen na het stoppen van een MAO-remmer bedoeld voor de behandeling van psychiatrische stoornissen is ook gecontra-indiceerd (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
Het starten van Anafranil bij een patiënt die wordt behandeld met linezolid of intraveneus methyleenblauw is ook gecontra-indiceerd vanwege een verhoogd risico op het serotoninesyndroom (zie WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE ).
Myocardinfarct
Anafranil is gecontra-indiceerd tijdens de acute herstelperiode na een hartinfarct.
KLINISCHE FARMACOLOGIE
farmacodynamiek
Clomipramine (CMI) wordt verondersteld obsessief en compulsief gedrag te beïnvloeden door zijn effecten op serotonerge neuronale transmissie. Het eigenlijke neurochemische mechanisme is onbekend, maar het vermogen van CMI om de heropname van serotonine (5-HT) te remmen wordt belangrijk geacht.
Farmacokinetiek
Absorptie/biologische beschikbaarheid
CMI van Anafranil 25 mg capsules is net zo biologisch beschikbaar als CMI uit een oplossing. De biologische beschikbaarheid van CMI uit capsules wordt niet significant beïnvloed door voedsel.
In een dosisproportionaliteitsonderzoek met meerdere CMI-doses waren de steady-state plasmaconcentraties (Css) en de oppervlakte-onder-plasma-concentratie-tijdcurves (AUC) van CMI en de belangrijkste actieve metaboliet van CMI, desmethylclomipramine (DMI), niet evenredig met de dosis. over de geëvalueerde bereiken, dwz tussen 25 en 100 mg/dag en tussen 25 en 150 mg/dag, hoewel Css en AUC ongeveer lineair gerelateerd zijn aan een dosis tussen 100 en 150 mg/dag. De relatie tussen dosis en CMI/DMI-concentraties bij hogere dagelijkse doses is niet systematisch beoordeeld, maar als er een significante dosisafhankelijkheid is bij doses boven 150 mg/dag, bestaat de kans op dramatisch hogere Css en AUC, zelfs voor patiënten die binnen de aanbevolen bereik. Dit kan een potentieel risico vormen voor sommige patiënten (zie: WAARSCHUWINGEN en DRUG-INTERACTIES ).
Na een enkelvoudige orale dosis van 50 mg treden maximale plasmaconcentraties van CMI op binnen 2 tot 6 uur (gemiddeld 4,7 uur) en variëren van 56 ng/ml tot 154 ng/ml (gemiddelde, 92 ng/ml). Na meerdere dagelijkse doses van 150 mg Anafranil 25 mg, variëren de maximale plasmaconcentraties bij steady-state van 94 ng/ml tot 339 ng/ml (gemiddeld 218 ng/ml) voor CMI en van 134 ng/ml tot 532 ng/ml ( gemiddelde, 274 ng/ml) voor DMI. Aanvullende informatie uit een studie met stijgende doses van doses tot 250 mg suggereert dat DMI een niet-lineaire farmacokinetiek kan vertonen binnen het gebruikelijke doseringsbereik. Bij een dosis Anafranil 200 mg hadden proefpersonen bij wie een enkel bloedmonster werd genomen ongeveer 9 tot 22 uur (mediaan 16 uur), na de dosis plasmaconcentraties tot 605 ng/ml voor CMI, 781 ng/ml voor DMI en 1386 ng/ml voor beide.
Verdeling
CMI wordt verdeeld in cerebrospinale vloeistof (CSF) en hersenen en in moedermelk. DMI verdeelt zich ook in CSF, met een gemiddelde CSF/plasma-verhouding van 2,6. De eiwitbinding van CMI is ongeveer 97%, voornamelijk aan albumine, en is onafhankelijk van de CMI-concentratie. De interactie tussen CMI en andere sterk eiwitgebonden geneesmiddelen is niet volledig geëvalueerd, maar kan belangrijk zijn (zie: DRUG-INTERACTIES ).
Metabolisme
CMI wordt uitgebreid gebiotransformeerd tot DMI en andere metabolieten en hun glucuronideconjugaten. DMI is farmacologisch actief, maar de effecten op OCS-gedrag zijn onbekend. Deze metabolieten worden uitgescheiden in de urine en feces, na eliminatie via de gal. Na een radioactief gemerkte dosis CMI van 25 mg bij twee proefpersonen, werd respectievelijk 60% en 51% van de dosis teruggevonden in de urine en respectievelijk 32% en 24% in de feces. In hetzelfde onderzoek was de gecombineerde terugwinning van CMI en DMI in de urine slechts ongeveer 0,8% tot 1,3% van de toegediende dosis. CMI induceert geen geneesmiddelmetaboliserende enzymen, zoals gemeten aan de hand van de antipyrinehalfwaardetijd.
Eliminatie
Bewijs dat de Css en AUC voor CMI en DMI onevenredig kunnen toenemen met toenemende orale doses, suggereert dat het metabolisme van CMI en DMI mogelijk beperkt is. Met dit feit moet rekening worden gehouden bij het beoordelen van de schattingen van de hieronder weergegeven farmacokinetische parameters, aangezien deze zijn verkregen bij personen die zijn blootgesteld aan doses van 150 mg. Als de farmacokinetiek van CMI en DMI niet-lineair is bij doses boven 150 mg, kan hun eliminatiehalfwaardetijd aanzienlijk worden verlengd bij doses aan de bovenkant van het aanbevolen doseringsbereik (dwz 200 mg/dag tot 250 mg/dag). Dientengevolge kunnen CMI en DMI accumuleren, en deze accumulatie kan de incidentie van dosis- of plasmaconcentratie-afhankelijke bijwerkingen verhogen, in het bijzonder convulsies (zie WAARSCHUWINGEN ).
Na een dosis van 150 mg varieert de halfwaardetijd van CMI van 19 uur tot 37 uur (gemiddeld 32 uur) en die van DMI van 54 uur tot 77 uur (gemiddeld 69 uur). Steady-state niveaus na meerdere doseringen worden doorgaans binnen 7 tot 14 dagen bereikt voor CMI. Plasmaconcentraties van de metaboliet overschrijden het oorspronkelijke geneesmiddel bij meervoudige dosering. Na meervoudige dosering van 150 mg/dag is de accumulatiefactor voor CMI ongeveer 2,5 en voor DMI 4,6. Belangrijk is dat het twee weken of langer kan duren om deze mate van accumulatie te bereiken bij constante dosering vanwege de relatief lange eliminatiehalfwaardetijden van CMI en DMI (zie DOSERING EN ADMINISTRATIE ). De effecten van lever- en nierinsufficiëntie op de beschikbaarheid van Anafranil zijn niet vastgesteld.
Interacties
Gelijktijdige toediening van haloperidol met CMI verhoogt de plasmaconcentraties van CMI. Gelijktijdige toediening van CMI met fenobarbital verhoogt de plasmaconcentraties van fenobarbital (zie: DRUG-INTERACTIES ). Jongere proefpersonen (18 tot 40 jaar) verdroegen CMI beter en hadden significant lagere steady-state plasmaconcentraties, vergeleken met proefpersonen ouder dan 65 jaar. Kinderen jonger dan 15 jaar hadden significant lagere plasmaconcentraties/dosisverhoudingen in vergelijking met volwassenen. Plasmaconcentraties van CMI waren significant lager bij rokers dan bij niet-rokers.
PATIËNT INFORMATIE
Anafranil™ (clomipraminehydrochloride) Capsules USP
Antidepressiva, depressie en andere ernstige psychische aandoeningen en zelfmoordgedachten of -acties
Lees de medicatiehandleiding die bij u of het antidepressivum van uw familielid wordt geleverd. Deze medicatiehandleiding gaat alleen over het risico op zelfmoordgedachten en -acties met antidepressiva. Praat met uw zorgverlener of die van uw gezinslid over:
- alle risico's en voordelen van behandeling met antidepressiva
- alle behandelingskeuzes voor depressie of andere ernstige psychische aandoeningen
Wat is de belangrijkste informatie die ik moet weten over antidepressiva, depressie en andere ernstige psychische aandoeningen, en zelfmoordgedachten of -acties?
1. Antidepressiva kunnen bij sommige kinderen, tieners en jonge volwassenen zelfmoordgedachten of zelfmoordacties doen toenemen in de eerste paar maanden van de behandeling.
2. Depressie en andere ernstige psychische aandoeningen zijn de belangrijkste oorzaken van zelfmoordgedachten en -acties. Sommige mensen lopen een bijzonder hoog risico op zelfmoordgedachten of -acties. Deze omvatten mensen met (of een familiegeschiedenis van) een bipolaire stoornis (ook wel manisch-depressieve stoornis genoemd) of zelfmoordgedachten of zelfmoordacties.
3. Hoe kan ik zelfmoordgedachten en -acties bij mezelf of een familielid voorkomen en proberen te voorkomen?
- Besteed veel aandacht aan eventuele veranderingen, vooral plotselinge veranderingen, in stemming, gedrag, gedachten of gevoelens. Dit is erg belangrijk wanneer een antidepressivum wordt gestart of wanneer de dosis wordt gewijzigd.
- Bel de zorgverlener meteen om nieuwe of plotselinge veranderingen in stemming, gedrag, gedachten of gevoelens te melden.
- Houd alle vervolgbezoeken aan de zorgverlener zoals gepland. Bel indien nodig de zorgverlener tussen bezoeken, vooral als u zich zorgen maakt over symptomen.
Bel onmiddellijk een zorgverlener als u of uw gezinslid een van de volgende symptomen heeft, vooral als ze nieuw zijn, erger zijn of u zorgen baren:
- gedachten over zelfmoord of doodgaan
- pogingen om zelfmoord te plegen
- nieuwe of ergere depressie
- nieuwe of ergere angst
- zich erg geagiteerd of rusteloos voelen
- paniekaanvallen
- moeite met slapen (slapeloosheid)
- nieuwe of ergere prikkelbaarheid
- agressief handelen, boos of gewelddadig zijn
- handelen op gevaarlijke impulsen
- een extreme toename van activiteit en praten (manie)
- andere ongewone veranderingen in gedrag of stemming
Laag zoutgehalte (natrium) in het bloed. Ouderen lopen hier mogelijk een groter risico op. Symptomen kunnen zijn:
- hoofdpijn
- zwakte of onvast gevoel
- verwarring, concentratie- of denkproblemen of geheugenproblemen
Visuele problemen
- oogpijn
- veranderingen in het gezichtsvermogen
- zwelling of roodheid in of rond het oog
Slechts enkele mensen lopen risico op deze problemen. Misschien wilt u een oogonderzoek ondergaan om te zien of u een risico loopt en als dat zo is, een preventieve behandeling krijgen.
Wie mag Anafranil niet gebruiken?
Gebruik Anafranil niet als u:
- neem een monoamineoxidaseremmer (MAOI). Vraag uw zorgverlener of apotheker als u niet zeker weet of u een MAO-remmer gebruikt, inclusief het antibioticum linezolid.
- Neem geen MAO-remmer binnen 2 weken na het stoppen van Anafranil 25 mg, tenzij uw arts u heeft gevraagd dit te doen.
- Begin niet met Anafranil als u de afgelopen 2 weken bent gestopt met het gebruik van een MAO-remmer, tenzij uw arts u heeft gevraagd dit te doen.
Wat moet ik nog meer weten over antidepressiva?
- Stop nooit met een antidepressivum zonder eerst met een zorgverlener te overleggen. Plotseling stoppen met een antidepressivum kan andere symptomen veroorzaken.
- Antidepressiva zijn geneesmiddelen die worden gebruikt om depressie en andere ziekten te behandelen. Het is belangrijk om alle risico's van het behandelen van depressie te bespreken en ook de risico's van het niet behandelen ervan. Patiënten en hun families of andere zorgverleners moeten alle behandelkeuzes met de zorgverlener bespreken, niet alleen het gebruik van antidepressiva.
- Antidepressiva hebben andere bijwerkingen. Praat met de zorgverlener over de bijwerkingen van het geneesmiddel dat aan u of uw gezinslid is voorgeschreven.
- Antidepressiva kunnen een wisselwerking hebben met andere geneesmiddelen. Ken alle medicijnen die u of uw familielid gebruikt. Houd een lijst bij van alle medicijnen die u aan de zorgverlener kunt laten zien. Begin niet met nieuwe medicijnen zonder eerst met uw zorgverlener te overleggen.
- Niet alle antidepressiva die voor kinderen worden voorgeschreven, zijn door de FDA goedgekeurd voor gebruik bij kinderen. Praat met de zorgverlener van uw kind voor meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
