Symbicort 160/4.5mcg Budesonide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Symbicort 4.5mcg en hoe wordt het gebruikt?
Symbicort 4,5 mcg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van astma en chronische obstructieve longziekte. Symbicort kan alleen of in combinatie met andere medicijnen worden gebruikt.
Symbicort behoort tot een klasse geneesmiddelen die respiratoire inhalatiecombinaties worden genoemd.
Het is niet bekend of Symbicort 4,5 mcg veilig en effectief is bij kinderen jonger dan 6 jaar.
Wat zijn de mogelijke bijwerkingen van Symbicort 4.5mcg?
Symbicort kan ernstige bijwerkingen veroorzaken, waaronder:
- verergering van ademhalingsproblemen,
- zweren of witte vlekken in uw mond of keel,
- pijn bij het slikken,
- trillingen,
- nervositeit,
- pijn op de borst,
- snelle of bonzende hartslagen,
- hoesten met slijm,
- kortademig voelen,
- piepende ademhaling,
- verstikking,
- andere ademhalingsproblemen,
- wazig zien,
- tunnelvisie,
- oogpijn of roodheid,
- halo's rond lichten zien,
- koorts,
- rillingen,
- pijn in het lichaam,
- ongebruikelijke vermoeidheid,
- verhoogde dorst,
- meer plassen,
- droge mond,
- fruitige ademgeur,
- beenkrampen,
- constipatie,
- onregelmatige hartslagen,
- fladderend in je borst,
- gevoelloosheid of tintelingen,
- spier zwakte,
- slap gevoel,
- vermoeidheid,
- zwakheid,
- duizeligheid,
- misselijkheid, en
- braken
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Symbicort zijn onder meer:
- keelpijn of irritatie,
- witte vlekken in uw mond of keel,
- maagklachten,
- braken,
- rugpijn,
- hoofdpijn,
- griepsymptomen, en
- verkoudheidsverschijnselen (verstopte neus of loopneus, niezen, sinuspijn of keelpijn)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Symbicort. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
SYMBICORT 80/4.5 en SYMBICORT 160/4.5 bevatten elk gemicroniseerd budesonide en gemicroniseerd formoterolfumaraatdihydraat, uitsluitend voor orale inhalatie.
Elke SYMBICORT 80/4.5 en SYMBICORT 160/4.5 bus is geformuleerd als een hydrofluoralkaan (HFA 227; 1,1,1,2,3,3,3-heptafluorpropaan) aangedreven inhalator met afgemeten dosis en 60 of 120 verstuivingen [zie Doseringsvormen en sterke punten en HOE GELEVERD / Opslag en behandeling ]. Na het vullen meet elke verstuiving 91/5,1 mcg of 181/5.1 mcg vanaf de klep en levert 80/4,5 mcg of 160/4,5 mcg (gemicroniseerd budesonide/formoterolfumaraatdihydraat gemicroniseerd) vanaf de actuator. De werkelijke hoeveelheid geneesmiddel die aan de long wordt afgegeven, kan afhangen van patiëntfactoren, zoals de coördinatie tussen activering van het apparaat en inspiratie via het toedieningssysteem. SYMBICORT 160 mg bevat ook povidon K25 USP als suspensiemiddel en polyethyleenglycol 1000 NF als smeermiddel.
SYMBICORT 160 mg moet voor het eerste gebruik worden geprimed door twee testsprays in de lucht te verspreiden, weg van het gezicht, en goed te schudden gedurende 5 seconden voor elke spray. In gevallen waarin de inhalator langer dan 7 dagen niet is gebruikt of wanneer deze is gevallen, dient u de inhalator opnieuw te vullen door vóór elke verstuiving 5 seconden goed te schudden en twee testverstuivingen in de lucht los te laten, weg van het gezicht.
Een actief bestanddeel van SYMBICORT 4,5 mcg is budesonide, een corticosteroïde die chemisch wordt aangeduid als (RS)11β, 16α, 17,21-Tetrahydroxypregna-1,4-dieen-3,20-dion cyclisch 16,17-acetaal met butyraldehyde. Budesonide wordt geleverd als een mengsel van twee epimeren (22R en 22S). De empirische formule van budesonide is C25H34O6 en het molecuulgewicht is 430,5. De structuurformule is:
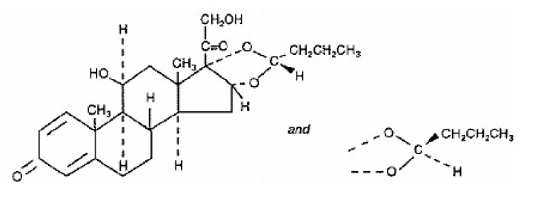
Budesonide is een wit tot gebroken wit, smaakloos, geurloos poeder dat praktisch onoplosbaar is in water en in heptaan, matig oplosbaar in ethanol en vrij oplosbaar in chloroform. De verdelingscoëfficiënt tussen octanol en water bij pH 7,4 is 1,6 x 103.
Het andere actieve bestanddeel van SYMBICORT 160 mg is formoterolfumaraatdihydraat, een selectieve bèta2-agonist die chemisch wordt aangeduid als (R*,R*)-(±)-N-[2-hydroxy-5-[1-hydroxy-2-[[ 2-(4-methoxyfenyl)-1-methylethyl]amino]ethyl]fenyl]formamide, (E)-2-butendioaat (2:1), dihydraat. De empirische formule van formoterol is C42H56N4O14 en het molecuulgewicht is 840,9. De structuurformule is:
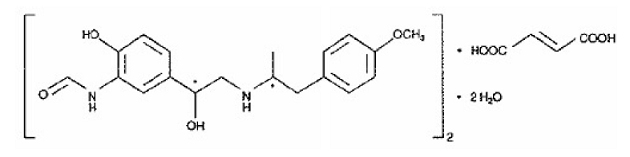
Formoterolfumaraatdihydraat is een poeder dat slecht oplosbaar is in water. De verdelingscoëfficiënt octanol-water bij pH 7,4 is 2,6. De pKa van formoterolfumaraatdihydraat bij 25°C is 7,9 voor de fenolgroep en 9,2 voor de aminogroep.
INDICATIES
Behandeling van astma
SYMBICORT 4,5 mcg is geïndiceerd voor de behandeling van astma bij patiënten van 6 jaar en ouder.
SYMBICORT moet worden gebruikt voor patiënten die niet voldoende onder controle zijn met een langdurig astma-controlemedicatie zoals een inhalatiecorticosteroïd (ICS) of bij wie de ziekte het starten van een behandeling met zowel een inhalatiecorticosteroïd als een langwerkende bèta-2-adrenerge agonist (LABA) rechtvaardigt.
Belangrijke gebruiksbeperkingen
- SYMBICORT is NIET geïndiceerd voor de verlichting van acute bronchospasmen.
Onderhoudsbehandeling van chronische obstructieve longziekte
SYMBICORT 160/4.5 is geïndiceerd voor de onderhoudsbehandeling van luchtwegobstructie bij patiënten met chronische obstructieve longziekte (COPD), waaronder chronische bronchitis en/of emfyseem. SYMBICORT 160/4.5 is ook geïndiceerd om exacerbaties van COPD te verminderen. SYMBICORT 160/4,5 is de enige sterkte die is geïndiceerd voor de behandeling van COPD.
Belangrijke gebruiksbeperkingen
- SYMBICORT 4,5 mcg is NIET geïndiceerd voor de verlichting van acute bronchospasmen.
DOSERING EN ADMINISTRATIE
Administratie Informatie
SYMBICORT 160 mg dient tweemaal daags te worden toegediend als 2 inhalaties ('s morgens en' s avonds, met een tussenpoos van ongeveer 12 uur), elke dag alleen via orale inhalatie. Na inhalatie moet de patiënt de mond spoelen met water zonder te slikken.
Prime SYMBICORT 4.5mcg voor het eerste gebruik door twee testsprays in de lucht te laten komen, weg van het gezicht, en goed te schudden gedurende 5 seconden voor elke spray. In gevallen waarin de inhalator langer dan 7 dagen niet is gebruikt of wanneer deze is gevallen, dient u de inhalator opnieuw te vullen door goed te schudden voor elke verstuiving en twee testverstuivingen in de lucht los te laten, weg van het gezicht.
Frequentere toediening of een groter aantal inhalaties (meer dan 2 inhalaties tweemaal daags) van de voorgeschreven sterkte van SYMBICORT wordt niet aanbevolen, aangezien sommige patiënten meer kans hebben op bijwerkingen bij hogere doses formoterol. Patiënten die SYMBICORT gebruiken, mogen om welke reden dan ook geen extra LABA gebruiken [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Astma
Als astmasymptomen optreden in de periode tussen doses, moet voor onmiddellijke verlichting een geïnhaleerde, kortwerkende bèta-2-agonist worden ingenomen.
Volwassen en adolescente patiënten van 12 jaar en ouder
Voor patiënten van 12 jaar en ouder is de dosering tweemaal daags 2 inhalaties SYMBICORT 80/4,5 of SYMBICORT 160/4,5.
De aanbevolen startdoseringen voor SYMBICORT voor patiënten van 12 jaar en ouder zijn gebaseerd op de ernst van de astma van de patiënt of de mate van beheersing van de astmasymptomen, en het risico op exacerbaties bij gebruik van huidige inhalatiecorticosteroïden.
De maximale aanbevolen dosering bij volwassen en adolescente patiënten van 12 jaar en ouder is SYMBICORT 160/4,5, tweemaal daags twee inhalaties.
Verbetering van de astmacontrole na toediening van SYMBICORT via inhalatie kan optreden binnen 15 minuten na het begin van de behandeling, hoewel het maximale voordeel mogelijk niet wordt bereikt gedurende 2 weken of langer na het begin van de behandeling. Individuele patiënten zullen een variabele tijd tot aanvang en mate van symptoomverlichting ervaren.
Voor patiënten die niet adequaat reageren op de startdosis na 1-2 weken behandeling met SYMBICORT 80/4.5, kan vervanging door SYMBICORT 160/4.5 zorgen voor extra astmacontrole.
Als een eerder effectief doseringsschema van SYMBICORT 4,5 mcg er niet in slaagt om astma adequaat onder controle te houden, moet het therapeutische regime opnieuw worden geëvalueerd en moeten aanvullende therapeutische opties worden overwogen (bijv. corticosteroïden of het starten met orale corticosteroïden) moeten worden overwogen.
Pediatrische patiënten van 6 tot minder dan 12 jaar
Voor patiënten van 6 tot jonger dan 12 jaar is de dosering tweemaal daags 2 inhalaties SYMBICORT 80/4,5.
Chronische obstructieve longziekte
Voor patiënten met COPD is de aanbevolen dosis SYMBICORT 160/4,5, tweemaal daags twee inhalaties.
Als kortademigheid optreedt in de periode tussen doses, moet voor onmiddellijke verlichting een geïnhaleerde, kortwerkende bèta-2-agonist worden ingenomen.
HOE GELEVERD
Doseringsvormen en sterke punten
SYMBICORT is verkrijgbaar als inhalator met afgemeten dosis die een combinatie van budesonide (80 of 160 mcg) en formoterol (4,5 mcg) als inhalatie-aerosol bevat in de volgende twee sterktes: 80/4,5 en 160/4,5. Elke doseringssterkte bevat 60 of 120 verstuivingen per bus. Elke sterkte van SYMBICORT 160 mg wordt geleverd met een rode plastic actuator met een grijze stofkap.
Opslag en behandeling
SYMBICORT is verkrijgbaar in twee sterktes en wordt geleverd in de volgende verpakkingsgrootten:
Doseringsvormen en sterke punten
Elke sterkte wordt geleverd als een aluminium bus onder druk met een aangesloten telapparaat, een rode plastic actuatorbehuizing met een wit mondstuk en een bevestigde grijze stofkap. Elke 120 inhalatiebus heeft een netto vulgewicht van 10,2 gram en elke 60 inhalatiebus heeft een netto vulgewicht van 6,9 gram (SYMBICORT 80/4,5) of 6 gram (SYMBICORT 160/4,5). Elke bus is verpakt in een foliezakje met een zakje met droogmiddel en in een doos geplaatst. Elke doos bevat één bus en een patiëntenbijsluiter.
De SYMBICORT 4,5 mcg-bus mag alleen worden gebruikt met de SYMBICORT 4,5 mcg-actuator en de SYMBICORT-actuator mag niet worden gebruikt met enig ander inhalatiegeneesmiddel.
De juiste hoeveelheid medicatie in elke inhalatie kan niet worden gegarandeerd nadat het aangegeven aantal inhalaties uit de bus is gebruikt, ook al voelt de inhalator misschien niet helemaal leeg aan en kan hij blijven werken. De inhalator moet worden weggegooid wanneer het aangegeven aantal inhalaties is gebruikt of binnen 3 maanden na verwijdering uit het foliezakje. Dompel de canister nooit onder in water om de resterende hoeveelheid in de canister te bepalen (“floattest”).
Bewaren bij een gecontroleerde kamertemperatuur van 20 ° C tot 25 ° C (68 ° F tot 77 ° F) (zie USP). Bewaar de inhalator met het mondstuk naar beneden.
Voor de beste resultaten moet de bus voor gebruik op kamertemperatuur zijn. Goed schudden gedurende 5 seconden voor gebruik.
Buiten bereik van kinderen bewaren. Vermijd spuiten in de ogen.
INHOUD ONDER DRUK.
Niet doorboren of verbranden. Niet bewaren in de buurt van hitte of open vuur. Blootstelling aan temperaturen boven 120 ° F kan barsten veroorzaken. Gooi de container nooit in het vuur of in de verbrandingsoven.
Gefabriceerd voor: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 Door: AstraZeneca Dunkerque Production, Dunkerque, Frankrijk. Herzien: december 2017
BIJWERKINGEN
LABA-gebruik kan leiden tot het volgende:
- Ernstige astma-gerelateerde gebeurtenissen - ziekenhuisopnames, intubaties, overlijden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Cardiovasculaire en centrale zenuwstelsel effecten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Systemisch gebruik en gebruik van inhalatiecorticosteroïden kan het volgende tot gevolg hebben:
- Candida albicans-infectie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Longontsteking of lagere luchtweginfecties bij patiënten met COPD [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Immunosuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypercorticisme en bijniersuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Groei-effecten bij pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Glaucoom en staar [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Ervaring met klinische proeven bij astma
Volwassen en adolescente patiënten van 12 jaar en ouder
De algemene veiligheidsgegevens bij volwassenen en adolescenten zijn gebaseerd op 10 actieve en placebogecontroleerde klinische onderzoeken waarin 3393 patiënten van 12 jaar en ouder (2052 vrouwen en 1341 mannen) met astma van verschillende ernst werden behandeld met SYMBICORT 80/4,5 of 160 /4.5 eenmaal of tweemaal per dag 2 inhalaties ingenomen gedurende 12 tot 52 weken. In deze onderzoeken hadden de patiënten die SYMBICORT kregen een gemiddelde leeftijd van 38 jaar en waren ze overwegend blank (82%).
De incidentie van vaak voorkomende bijwerkingen in tabel 2 hieronder is gebaseerd op gepoolde gegevens van drie 12 weken durende, dubbelblinde, placebogecontroleerde klinische onderzoeken waarin 401 volwassen en adolescente patiënten (148 mannen en 253 vrouwen) van 12 jaar en ouder behandeld met 2 inhalaties van SYMBICORT 80/4.5 of SYMBICORT 160/4.5 tweemaal daags. De SYMBICORT-groep bestond uit voornamelijk blanke (84%) patiënten met een gemiddelde leeftijd van 38 jaar en een gemiddeld percentage voorspelde FEV1 bij baseline van 76 en 68 voor respectievelijk de 80/4,5 mcg- en 160/4,5 mcg-behandelingsgroepen. Controle-armen ter vergelijking omvatten 2 inhalaties van budesonide HFA-doseringsinhalator (MDI) 80 of 160 mcg, formoterol droogpoederinhalator (DPI) 4,5 mcg of placebo (MDI en DPI) tweemaal daags. Tabel 2 bevat alle bijwerkingen die optraden met een incidentie van >3% in een SYMBICORT-groep en vaker dan in de placebogroep met een tweemaal daagse dosering. Bij het overwegen van deze gegevens moet rekening worden gehouden met de langere gemiddelde duur van de blootstelling van de patiënt voor SYMBICORT-patiënten, aangezien de incidenties niet worden gecorrigeerd voor een onbalans in de behandelingsduur.
Veiligheid op lange termijn - klinische onderzoeken naar astma bij patiënten van 12 jaar en ouder
Langdurige veiligheidsstudies bij adolescente en volwassen patiënten van 12 jaar en ouder, die tot 1 jaar werden behandeld met doses tot 1280/36 mcg/dag (640/18 mcg tweemaal daags), brachten geen klinisch belangrijke veranderingen in de incidentie aan het licht. noch nieuwe soorten bijwerkingen die opduiken na langere behandelingsperioden. Evenzo werden gedurende maximaal 1 jaar geen significante of onverwachte patronen van afwijkingen waargenomen in veiligheidsmaatregelen, waaronder chemie, hematologie, ECG, Holter-monitor en HPA-asbeoordelingen.
Pediatrische patiënten van 6 tot minder dan 12 jaar oud
De veiligheidsgegevens voor pediatrische patiënten in de leeftijd van 6 tot jonger dan 12 jaar zijn gebaseerd op 1 onderzoek met een behandelingsduur van 12 weken. Patiënten (79 vrouwen en 105 mannen) die bij deelname aan het onderzoek inhalatiecorticosteroïden kregen, werden gerandomiseerd naar SYMBICORT 80/4,5 (n=92) of budesonide pMDI 80 mcg (n=92), 2 inhalaties tweemaal daags. Het algehele veiligheidsprofiel van deze patiënten was vergelijkbaar met dat waargenomen bij patiënten van 12 jaar en ouder die tweemaal daags SYMBICORT 80/4,5 kregen in onderzoeken met een vergelijkbare opzet. Vaak voorkomende bijwerkingen die optraden bij patiënten die werden behandeld met SYMBICORT 80/4,5 met een frequentie van ≥3% en vaker dan patiënten die alleen met budesonide pMDI 80 mcg werden behandeld, waren infectie van de bovenste luchtwegen, faryngitis, hoofdpijn en rhinitis.
Ervaring met klinische onderzoeken bij chronische obstructieve longziekte
De hieronder beschreven veiligheidsgegevens weerspiegelen de blootstelling aan SYMBICORT 160/4,5 bij 1783 patiënten. SYMBICORT 160/4.5 werd onderzocht in twee placebogecontroleerde longfunctieonderzoeken (duur 6 en 12 maanden) en twee actief gecontroleerde exacerbatieonderzoeken (duur 6 en 12 maanden) bij patiënten met COPD.
De incidentie van vaak voorkomende bijwerkingen in onderstaande tabel 3 is gebaseerd op gepoolde gegevens van twee dubbelblinde, placebogecontroleerde klinische onderzoeken naar de longfunctie (duur 6 en 12 maanden) waarbij 771 volwassen COPD-patiënten (496 mannen en 275 vrouwen) 40 jaar en ouder werden behandeld met SYMBICORT 160/4,5, tweemaal daags twee inhalaties. Van deze patiënten werden 651 gedurende 6 maanden behandeld en 366 gedurende 12 maanden. De SYMBICORT-groep bestond uit voornamelijk blanke (93%) patiënten met een gemiddelde leeftijd van 63 jaar en een gemiddeld percentage voorspelde FEV1 bij baseline van 33%. Controle-armen ter vergelijking omvatten 2 inhalaties van budesonide HFA (MDI) 160 mcg, formoterol (DPI) 4,5 mcg of placebo (MDI en DPI) tweemaal daags. Tabel 3 bevat alle bijwerkingen die optraden met een incidentie van ≥3% in de SYMBICORT-groep en vaker dan in de placebogroep. Bij het overwegen van deze gegevens moet rekening worden gehouden met de langere gemiddelde duur van de blootstelling van de patiënt aan SYMBICORT 4,5 mcg, aangezien de incidenties niet worden gecorrigeerd voor een onbalans in de behandelingsduur.
Andere longinfecties dan pneumonie (voornamelijk bronchitis) kwamen voor bij een groter percentage proefpersonen die met SYMBICORT 160/4,5 werden behandeld in vergelijking met placebo (respectievelijk 7,9% vs. 5,1%). Er werden gedurende maximaal 1 jaar geen klinisch belangrijke of onverwachte patronen van afwijkingen waargenomen bij chemie, hematologie, ECG, ECG (Holter) monitoring, HPA-as, botmineraaldichtheid en oogheelkundige beoordelingen.
De veiligheidsbevindingen van de twee dubbelblinde, actief-gecontroleerde exacerbatiesstudies (duur 6 en 12 maanden) waarin 1012 volwassen COPD-patiënten (616 mannen en 396 vrouwen) van 40 jaar en ouder werden behandeld met SYMBICORT 160/4,5, twee inhalaties tweemaal daags kwamen overeen met de longfunctiestudies.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van SYMBICORT na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. Sommige van deze bijwerkingen zijn mogelijk ook waargenomen in klinische onderzoeken met SYMBICORT.
Hartaandoeningen: angina pectoris, tachycardie, atriale en ventriculaire tachyaritmieën, atriale fibrillatie, extrasystolen, hartkloppingen
Endocriene aandoeningen: hypercorticisme, verlaging van de groeisnelheid bij pediatrische patiënten
Oogaandoeningen: cataract, glaucoom, verhoogde intraoculaire druk
Maagdarmstelselaandoeningen: orofaryngeale candidiasis, misselijkheid
Immuunsysteemaandoeningen: onmiddellijke en vertraagde overgevoeligheidsreacties, zoals anafylactische reactie, angio-oedeem, bronchospasme, urticaria, exantheem, dermatitis, pruritus
Stofwisselings- en voedingsstoornissen: hyperglykemie, hypokaliëmie
Skeletspierstelsel-, bindweefsel- en botaandoeningen: spierkrampen
Zenuwstelselaandoeningen: tremor, duizeligheid
Psychische stoornissen: gedragsstoornissen, slaapstoornissen, nervositeit, opwinding, depressie, rusteloosheid
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: dysfonie, hoesten, keelirritatie
Huid- en onderhuidaandoeningen: huid kneuzingen
Bloedvataandoeningen: hypotensie, hypertensie
DRUG-INTERACTIES
In klinische onderzoeken heeft gelijktijdige toediening van SYMBICORT en andere geneesmiddelen, zoals kortwerkende bèta2-agonisten, intranasale corticosteroïden en antihistaminica/decongestiva, niet geleid tot een verhoogde frequentie van bijwerkingen. Er zijn geen formele onderzoeken naar geneesmiddelinteracties uitgevoerd met SYMBICORT.
Remmers van cytochroom P4503A4
De belangrijkste metabolische route van corticosteroïden, waaronder budesonide, een bestanddeel van SYMBICORT, is via cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4). Na orale toediening van ketoconazol, een sterke remmer van CYP3A4, nam de gemiddelde plasmaconcentratie van oraal toegediend budesonide toe. Gelijktijdige toediening van CYP3A4 kan het metabolisme van budesonide remmen en de systemische blootstelling verhogen. Voorzichtigheid is geboden wanneer gelijktijdige toediening van SYMBICORT 4,5 mcg met langdurig ketoconazol en andere bekende sterke CYP3A4-remmers (bijv. ritonavir, atazanavir, claritromycine, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, telithromycine) wordt overwogen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Monoamineoxidaseremmers en tricyclische antidepressiva
SYMBICORT moet met voorzichtigheid worden toegediend aan patiënten die worden behandeld met monoamineoxidaseremmers of tricyclische antidepressiva, of binnen 2 weken na stopzetting van dergelijke middelen, omdat de werking van formoterol, een bestanddeel van SYMBICORT 160 mg, op het vaatstelsel kan worden versterkt door deze middelen. . In klinische onderzoeken met SYMBICORT kreeg een beperkt aantal COPD- en astmapatiënten tricyclische antidepressiva en daarom kunnen geen klinisch relevante conclusies over bijwerkingen worden getrokken.
Bèta-adrenerge receptorblokkerende middelen
Bètablokkers (inclusief oogdruppels) kunnen niet alleen het pulmonale effect van bèta-agonisten, zoals formoterol, een bestanddeel van SYMBICORT, blokkeren, maar kunnen ook ernstige bronchospasmen veroorzaken bij patiënten met astma. Daarom dienen patiënten met astma normaal gesproken niet met bètablokkers te worden behandeld. Onder bepaalde omstandigheden kunnen er echter geen aanvaardbare alternatieven zijn voor het gebruik van bèta-adrenerge blokkers bij patiënten met astma. In deze setting kunnen cardioselectieve bètablokkers worden overwogen, hoewel deze met de nodige voorzichtigheid moeten worden toegediend.
diuretica
De ECG-veranderingen en/of hypokaliëmie die het gevolg kunnen zijn van de toediening van niet-kaliumsparende diuretica (zoals lis- of thiazidediuretica) kunnen acuut verergeren door bèta-agonisten, vooral wanneer de aanbevolen dosis van de bèta-agonist wordt overschreden. Hoewel de klinische significantie van deze effecten niet bekend is, is voorzichtigheid geboden bij gelijktijdige toediening van SYMBICORT met niet-kaliumsparende diuretica.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Ernstige astma-gerelateerde gebeurtenissen – ziekenhuisopnames, intubaties en overlijden
Het gebruik van LABA als monotherapie (zonder ICS) voor astma is geassocieerd met een verhoogd risico op astma-gerelateerd overlijden (zie Salmeterol Multicenter Astma Research Trial (SMART)). Beschikbare gegevens uit gecontroleerde klinische onderzoeken suggereren ook dat het gebruik van LABA als monotherapie het risico op astma-gerelateerde ziekenhuisopname bij pediatrische en adolescente patiënten verhoogt. Deze bevindingen worden beschouwd als een klasse-effect van LABA. Wanneer LABA wordt gebruikt in een vaste-dosiscombinatie met ICS, laten gegevens uit grote klinische onderzoeken geen significante toename zien van het risico op ernstige astma-gerelateerde voorvallen (ziekenhuisopnames, intubaties, overlijden) in vergelijking met alleen ICS (zie Ernstige astma-gerelateerde voorvallen). met ICS/LABA).
Ernstige astma-gerelateerde gebeurtenissen met ICS/LABA
Er werden vier grote, 26 weken durende, gerandomiseerde, geblindeerde, actief-gecontroleerde klinische veiligheidsonderzoeken uitgevoerd om het risico op ernstige astma-gerelateerde voorvallen te evalueren wanneer LABA werd gebruikt in een vaste dosiscombinatie met ICS in vergelijking met alleen ICS bij patiënten met astma. Drie onderzoeken omvatten volwassen en adolescente patiënten van ≥12 jaar: één onderzoek vergeleek budesonide/formoterol (SYMBICORT) met budesonide (zie Klinische studies ]; één proef vergeleek fluticasonpropionaat/salmeterol-inhalatiepoeder met fluticasonpropionaat-inhalatiepoeder; en één studie vergeleek mometasonfuroaat/formoterol met mometasonfuroaat. De vierde studie omvatte pediatrische patiënten van 4 tot 11 jaar oud en vergeleek fluticasonpropionaat/salmeterol-inhalatiepoeder met fluticasonpropionaat-inhalatiepoeder. Het primaire veiligheidseindpunt voor alle vier de onderzoeken was ernstige astma-gerelateerde voorvallen (hospitalisaties, intubaties en overlijden). Een geblindeerde beoordelingscommissie bepaalde of gebeurtenissen astma-gerelateerd waren.
De drie onderzoeken bij volwassenen en adolescenten waren ontworpen om een risicomarge van 2,0 uit te sluiten, en de pediatrische studie was ontworpen om een risico van 2,7 uit te sluiten. Elke afzonderlijke studie voldeed aan de vooraf gespecificeerde doelstelling en toonde non-inferioriteit van ICS/LABA aan alleen ICS. Een meta-analyse van de drie onderzoeken bij volwassenen en adolescenten toonde geen significante toename van het risico op een ernstig astma-gerelateerd voorval met ICS/LABA vaste-dosiscombinatie in vergelijking met ICS alleen (Tabel 1). Deze onderzoeken waren niet bedoeld om alle risico's op ernstige astma-gerelateerde voorvallen met ICS/LABA uit te sluiten in vergelijking met ICS.
De pediatrische veiligheidsstudie omvatte 6208 pediatrische patiënten van 4 tot 11 jaar die ICS/LABA (fluticasonpropionaat/salmeterol-inhalatiepoeder) of ICS (fluticasonpropionaatinhalatiepoeder) kregen. In deze studie ondervonden 27/3107 (0,9%) patiënten gerandomiseerd naar ICS/LABA en 21/3101 (0,7%) patiënten gerandomiseerd naar ICS een ernstige astma-gerelateerde gebeurtenis. Er waren geen astma-gerelateerde sterfgevallen of intubaties. ICS/LABA vertoonde geen significant verhoogd risico op een ernstige astma-gerelateerde gebeurtenis in vergelijking met ICS op basis van de vooraf gespecificeerde risicomarge (2,7), met een geschatte hazard ratio van tijd tot eerste gebeurtenis van 1,29 (95% BI: 0,73 , 2.27).
Salmeterol Multicenter Astma Research Trial (SMART)
Een 28 weken durende, placebogecontroleerde Amerikaanse studie waarin de veiligheid van salmeterol werd vergeleken met placebo, elk toegevoegd aan de gebruikelijke astmatherapie, toonde een toename van astma-gerelateerde sterfgevallen aan bij patiënten die salmeterol kregen (13/13.176 bij patiënten behandeld met salmeterol vs. 3 /13.179 bij patiënten behandeld met placebo; relatief risico: 4,37 [95% BI 1,25, 15,34]). Het gebruik van achtergrond-ICS was niet vereist in SMART. Het verhoogde risico op astma-gerelateerd overlijden wordt beschouwd als een klasse-effect van LABA-monotherapie.
Formoterol monotherapie studies
Klinische onderzoeken met formoterol als monotherapie suggereerden een hogere incidentie van ernstige astma-exacerbatie bij patiënten die formoterol kregen dan bij degenen die placebo kregen. De omvang van deze onderzoeken was niet voldoende om het verschil in ernstige astma-exacerbaties tussen behandelingsgroepen nauwkeurig te kwantificeren.
Verslechtering van ziekte en acute episodes
SYMBICORT 4,5 mcg mag niet worden gestart bij patiënten tijdens snel verslechterende of mogelijk levensbedreigende episodes van astma of COPD. SYMBICORT is niet onderzocht bij patiënten met acuut verslechterende astma of COPD. Het starten van SYMBICORT 4.5mcg in deze instelling is niet geschikt.
Toenemend gebruik van geïnhaleerde, kortwerkende bèta2-agonisten is een marker van verslechtering van astma. In deze situatie moet de patiënt onmiddellijk opnieuw worden geëvalueerd met herbeoordeling van het behandelingsschema, waarbij speciale aandacht moet worden besteed aan de mogelijke noodzaak om de huidige sterkte van SYMBICORT te vervangen door een hogere sterkte, extra inhalatiecorticosteroïden toe te voegen of systemische corticosteroïden te starten. Patiënten mogen niet meer dan 2 inhalaties tweemaal daags (ochtend en avond) SYMBICORT gebruiken.
SYMBICORT 160 mg mag niet worden gebruikt voor de verlichting van acute symptomen, dwz als noodbehandeling voor de behandeling van acute episodes van bronchospasme. Een geïnhaleerde, kortwerkende bèta2-agonist, niet SYMBICORT, moet worden gebruikt om acute symptomen zoals kortademigheid te verlichten.
Bij aanvang van de behandeling met SYMBICORT 4,5 mcg moeten patiënten die regelmatig orale of ingeademde kortwerkende bèta2-agonisten hebben ingenomen (bijv. 4 keer per dag) worden geïnstrueerd om het regelmatige gebruik van deze geneesmiddelen te staken.
Overmatig gebruik van SYMBICORT 4,5 mcg en gebruik met andere langwerkende bèta2-agonisten
Zoals met andere inhalatiegeneesmiddelen die bèta-2-adrenerge middelen bevatten, mag SYMBICORT 4,5 mcg niet vaker worden gebruikt dan aanbevolen, in hogere doses dan aanbevolen, of in combinatie met andere geneesmiddelen die LABA bevatten, aangezien een overdosis kan leiden. Klinisch significante cardiovasculaire effecten en sterfgevallen zijn gemeld in verband met overmatig gebruik van sympathicomimetica voor inhalatie. Patiënten die SYMBICORT gebruiken, mogen om welke reden dan ook geen aanvullende LABA (bijv. salmeterol, formoterolfumaraat, arformoteroltartraat) gebruiken, inclusief preventie van inspanningsbronchospasme (EIB) of de behandeling van astma of COPD.
Lokale effecten
In klinische onderzoeken is de ontwikkeling van gelokaliseerde infecties van mond en keelholte met Candida albicans opgetreden bij patiënten die met SYMBICORT werden behandeld. Wanneer zich een dergelijke infectie ontwikkelt, moet deze worden behandeld met geschikte lokale of systemische (dwz orale antischimmel) therapie terwijl de behandeling met SYMBICORT 160 mg wordt voortgezet, maar soms moet de behandeling met SYMBICORT 4,5 mcg worden onderbroken. Adviseer de patiënt om zijn/haar mond met water te spoelen zonder te slikken na inhalatie om het risico op orofaryngeale candidiasis te helpen verminderen.
Longontsteking en andere lagere luchtweginfecties
Artsen moeten waakzaam blijven voor de mogelijke ontwikkeling van pneumonie bij patiënten met COPD, aangezien de klinische kenmerken van pneumonie en exacerbaties elkaar vaak overlappen. Infecties van de lagere luchtwegen, waaronder pneumonie, zijn gemeld na toediening van corticosteroïden via inhalatie.
In een longfunctieonderzoek van 6 maanden onder 1704 patiënten met COPD was er een hogere incidentie van andere longinfecties dan pneumonie (bijv. bronchitis, virale lagere luchtweginfecties, enz.) bij patiënten die SYMBICORT 160/4,5 kregen (7,6%) dan bij degenen die SYMBICORT 80/4,5 (3,2%) kregen, formoterol 4,5 mcg (4,6%) of placebo (3,3%). Longontsteking kwam niet met een hogere incidentie voor in de SYMBICORT 160/4,5-groep (1,1%) in vergelijking met placebo (1,3%). In een 12 maanden durende longfunctiestudie van 1964 patiënten met COPD was er ook een hogere incidentie van andere longinfecties dan pneumonie bij patiënten die SYMBICORT 160/4,5 (8,1%) kregen dan bij degenen die SYMBICORT 80/4,5 (6,9%) kregen, formoterol 4,5 mcg (7,1%) of placebo (6,2%). Net als bij de 6 maanden durende studie trad pneumonie niet op met een hogere incidentie in de SYMBICORT 160/4,5-groep (4,0%) in vergelijking met placebo (5,0%).
Immunosuppressie
Patiënten die medicijnen gebruiken die het immuunsysteem onderdrukken, zijn vatbaarder voor infecties dan gezonde personen. Waterpokken en mazelen kunnen bijvoorbeeld een ernstiger of zelfs fataal verloop hebben bij gevoelige kinderen of volwassenen die corticosteroïden gebruiken. Bij dergelijke kinderen of volwassenen die deze ziekten niet hebben gehad of niet goed zijn geïmmuniseerd, moet bijzondere aandacht worden besteed aan het vermijden van blootstelling. Hoe de dosis, route en duur van de toediening van corticosteroïden het risico op het ontwikkelen van een gedissemineerde infectie beïnvloedt, is niet bekend. De bijdrage van de onderliggende ziekte en/of eerdere behandeling met corticosteroïden aan het risico is ook niet bekend. Indien blootgesteld, kan therapie met varicella zoster-immunoglobuline (VZIG) of gepoold intraveneus immunoglobuline (IVIG), naargelang het geval, geïndiceerd zijn. Bij blootstelling aan mazelen kan profylaxe met gepoolde intramusculaire immunoglobuline (IG) geïndiceerd zijn (zie de respectievelijke bijsluiters voor volledige VZIG- en IG-voorschrijfinformatie). Als zich waterpokken ontwikkelen, kan behandeling met antivirale middelen worden overwogen. De immuunrespons op het varicellavaccin werd geëvalueerd bij pediatrische patiënten met astma in de leeftijd van 12 maanden tot 8 jaar met budesonide-inhalatiesuspensie.
Een open-label, niet-gerandomiseerde klinische studie onderzocht de immuunrespons op het varicellavaccin bij 243 astmapatiënten van 12 maanden tot 8 jaar oud die werden behandeld met budesonide-inhalatiesuspensie van 0,25 mg tot 1 mg per dag (n=151) of niet-corticosteroïd astmatherapie (n =92) (dwz bèta2-agonisten, leukotrieenreceptorantagonisten, cromonen). Het percentage patiënten dat een seroprotectieve antilichaamtiter van >5,0 (gpELISA-waarde) ontwikkelde als reactie op de vaccinatie was vergelijkbaar bij patiënten die werden behandeld met budesonide-inhalatiesuspensie (85%), vergeleken met patiënten die werden behandeld met astma zonder corticosteroïden (90%). Geen enkele patiënt die werd behandeld met budesonide-inhalatiesuspensie ontwikkelde waterpokken als gevolg van vaccinatie.
Inhalatiecorticosteroïden moeten met voorzichtigheid of helemaal niet worden gebruikt bij patiënten met actieve of latente tuberculose-infecties van de luchtwegen; onbehandelde systemische schimmel-, bacteriële, virale of parasitaire infecties; of oculaire herpes simplex.
Patiënten overzetten van systemische corticosteroïdtherapie
Bijzondere zorg is nodig voor patiënten die zijn overgestapt van systemisch actieve corticosteroïden op inhalatiecorticosteroïden, omdat er bij patiënten met astma overlijden als gevolg van bijnierinsufficiëntie is opgetreden tijdens en na de overgang van systemische corticosteroïden naar minder systemisch beschikbare inhalatiecorticosteroïden. Na stopzetting van systemische corticosteroïden is een aantal maanden nodig voor herstel van de hypothalamus-hypofyse-bijnierfunctie (HPA).
Patiënten die eerder 20 mg of meer prednison (of het equivalent daarvan) per dag bleven gebruiken, kunnen het meest vatbaar zijn, vooral wanneer hun systemische corticosteroïden bijna volledig zijn stopgezet. Tijdens deze periode van HPA-suppressie kunnen patiënten tekenen en symptomen van bijnierinsufficiëntie vertonen wanneer ze worden blootgesteld aan trauma, chirurgie of infectie (met name gastro-enteritis) of andere aandoeningen die gepaard gaan met ernstig elektrolytenverlies. Hoewel SYMBICORT de astmasymptomen tijdens deze episoden onder controle kan houden, levert het in de aanbevolen doseringen systemisch minder dan normale fysiologische hoeveelheden glucocorticoïden en levert het NIET de mineralocorticoïde activiteit die nodig is om met deze noodsituaties om te gaan.
Tijdens perioden van stress, een ernstige astma-aanval of een ernstige COPD-exacerbatie, moeten patiënten die gestopt zijn met systemische corticosteroïden worden geïnstrueerd om de orale corticosteroïden (in grote doses) onmiddellijk te hervatten en contact op te nemen met hun arts voor verdere instructies. Deze patiënten moeten ook worden geïnstrueerd om een waarschuwingskaart bij zich te hebben die aangeeft dat ze mogelijk aanvullende systemische corticosteroïden nodig hebben tijdens perioden van stress, een ernstige astma-aanval of een ernstige COPD-exacerbatie.
Patiënten die orale corticosteroïden nodig hebben, moeten na overschakeling op SYMBICORT langzaam worden afgebouwd van het gebruik van systemische corticosteroïden. Vermindering van prednison kan worden bereikt door de dagelijkse dosis prednison te verlagen met 2,5 mg per week tijdens de behandeling met SYMBICORT. De longfunctie (gemiddeld geforceerd expiratoir volume in 1 seconde [FEV1] of morning peak expiratory flow [PEF]), het gebruik van bèta-agonisten en astma- of COPD-symptomen moeten zorgvuldig worden gecontroleerd tijdens het stoppen met orale corticosteroïden. Bovendien moeten patiënten worden geobserveerd op tekenen en symptomen van bijnierinsufficiëntie, zoals vermoeidheid, lusteloosheid, zwakte, misselijkheid en braken en hypotensie.
Overgang van patiënten van systemische corticosteroïdtherapie naar inhalatiecorticosteroïden of SYMBICORT kan aandoeningen die voorheen onderdrukt waren door de systemische corticosteroïdtherapie (bijv. rhinitis, conjunctivitis, eczeem, artritis, eosinofiele aandoeningen) aan het licht brengen. Sommige patiënten kunnen symptomen van systemisch actieve ontwenning van corticosteroïden ervaren (bijv. gewrichts- en/of spierpijn, vermoeidheid, depressie) ondanks onderhoud of zelfs verbetering van de ademhalingsfunctie.
Hypercorticisme en bijniersuppressie
Budesonide, een bestanddeel van SYMBICORT, zal vaak helpen de astma- en COPD-symptomen onder controle te houden met minder onderdrukking van de HPA-functie dan therapeutisch equivalente orale doses prednison. Aangezien budesonide in de bloedsomloop wordt geabsorbeerd en bij hogere doses systemisch actief kan zijn, kunnen de gunstige effecten van SYMBICORT bij het minimaliseren van HPA-disfunctie alleen worden verwacht wanneer de aanbevolen doseringen niet worden overschreden en individuele patiënten worden getitreerd naar de laagste effectieve dosis.
Vanwege de mogelijkheid van systemische absorptie van inhalatiecorticosteroïden, moeten patiënten die worden behandeld met SYMBICORT 160 mg zorgvuldig worden geobserveerd op aanwijzingen voor systemische effecten van corticosteroïden. Bijzondere aandacht moet worden besteed aan het observeren van patiënten postoperatief of tijdens perioden van stress op tekenen van onvoldoende respons van de bijnieren.
Het is mogelijk dat systemische effecten van corticosteroïden zoals hypercorticisme en bijniersuppressie (inclusief bijniercrisis) optreden bij een klein aantal patiënten, vooral wanneer budesonide gedurende langere tijd in hogere dan aanbevolen doses wordt toegediend. Als dergelijke effecten optreden, moet de dosering van SYMBICORT langzaam worden verlaagd, in overeenstemming met de geaccepteerde procedures voor het verminderen van systemische corticosteroïden en voor de behandeling van astmasymptomen.
Geneesmiddelinteracties met sterke cytochroom P450 3A4-remmers
Voorzichtigheid is geboden wanneer gelijktijdige toediening van SYMBICORT 4,5 mcg met ketoconazol en andere bekende sterke CYP3A4-remmers (bijv. ritonavir, atazanavir, claritromycine, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, telitromycine) aan budesonide kan optreden [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Paradoxale bronchospasmen en symptomen van de bovenste luchtwegen
Net als bij andere inhalatiemedicatie kan SYMBICORT 160 mg paradoxale bronchospasmen veroorzaken, die levensbedreigend kunnen zijn. Als paradoxale bronchospasmen optreden na toediening van SYMBICORT 160 mg, moet het onmiddellijk worden behandeld met een kortwerkende inhalatiebronchodilatator, moet SYMBICORT onmiddellijk worden stopgezet en moet een alternatieve therapie worden ingesteld.
Onmiddellijke overgevoeligheidsreacties
Onmiddellijke overgevoeligheidsreacties kunnen optreden na toediening van SYMBICORT 160 mg, zoals blijkt uit gevallen van urticaria, angio-oedeem, huiduitslag en bronchospasmen.
Cardiovasculaire en centrale zenuwstelsel effecten
Overmatige bèta-adrenerge stimulatie is in verband gebracht met toevallen, angina, hypertensie of hypotensie, tachycardie met snelheden tot 200 slagen/min, aritmieën, nervositeit, hoofdpijn, tremor, hartkloppingen, misselijkheid, duizeligheid, vermoeidheid, malaise en slapeloosheid [zie OVERDOSERING ]. Daarom moet SYMBICORT 160 mg, zoals alle producten die sympathicomimetische amines bevatten, met voorzichtigheid worden gebruikt bij patiënten met cardiovasculaire aandoeningen, met name coronaire insufficiëntie, hartritmestoornissen en hypertensie.
Formoterol, een bestanddeel van SYMBICORT, kan bij sommige patiënten een klinisch significant cardiovasculair effect veroorzaken, gemeten aan de hand van polsslag, bloeddruk en/of symptomen. Hoewel dergelijke effecten soms voorkomen na toediening van formoterol in de aanbevolen doseringen, kan het nodig zijn om het geneesmiddel te staken als ze optreden. Bovendien is gemeld dat bèta-agonisten ECG-veranderingen veroorzaken, zoals afvlakking van de T-golf, verlenging van het QTc-interval en ST-segmentdepressie. De klinische betekenis van deze bevindingen is niet bekend. Er zijn sterfgevallen gemeld in verband met overmatig gebruik van sympathicomimetica via inhalatie.
Vermindering van botmineraaldichtheid
Een afname van de botmineraaldichtheid (BMD) is waargenomen bij langdurige toediening van producten die inhalatiecorticosteroïden bevatten. De klinische betekenis van kleine veranderingen in BMD met betrekking tot gevolgen op lange termijn, zoals fracturen, is niet bekend. Patiënten met belangrijke risicofactoren voor verlaagd botmineraalgehalte, zoals langdurige immobilisatie, familiegeschiedenis van osteoporose, postmenopauzale status, tabaksgebruik, hoge leeftijd, slechte voeding of chronisch gebruik van geneesmiddelen die de botmassa kunnen verminderen (bijv. anticonvulsiva, orale corticosteroïden) ) moeten worden gecontroleerd en behandeld met vastgestelde zorgstandaarden. Aangezien patiënten met COPD vaak meerdere risicofactoren hebben voor een verminderde BMD, wordt aanbevolen de BMD te beoordelen voordat met SYMBICORT 160 mg wordt gestart en daarna periodiek. Als significante verlagingen van de BMD worden waargenomen en SYMBICORT nog steeds als medisch belangrijk wordt beschouwd voor de COPD-therapie van die patiënt, moet het gebruik van medicatie voor de behandeling of preventie van osteoporose sterk worden overwogen.
De effecten van behandeling met SYMBICORT 160/4.5, SYMBICORT 80/4.5, formoterol 4,5 mcg of placebo op de BMD werden geëvalueerd bij een subgroep van 326 patiënten (vrouwen en mannen in de leeftijd van 41 tot 88 jaar) met COPD in de longfunctie van 12 maanden. studie. BMD-evaluaties van de heup- en lumbale wervelkolomregio's werden uitgevoerd bij baseline en 52 weken met behulp van dual energy x-ray absorptiometry (DEXA)-scans. De gemiddelde veranderingen in BMD vanaf baseline tot het einde van de behandeling waren klein (gemiddelde veranderingen varieerden van -0,01 -0,01 g/cm²). ANCOVA-resultaten voor totale wervelkolom en totale heup-BMD op basis van het einde van de behandelingstijdstip toonden aan dat alle geometrische LS Mean-ratio's voor de paarsgewijze behandelingsgroepvergelijkingen dicht bij 1 lagen, wat aangeeft dat de algehele BMD voor totale heup- en totale wervelkolomregio's voor de 12 -maand tijdspunt waren stabiel over de gehele behandelingsperiode.
Effect op groei
Oraal geïnhaleerde corticosteroïden kunnen een vermindering van de groeisnelheid veroorzaken bij toediening aan pediatrische patiënten. Volg de groei van pediatrische patiënten die SYMBICORT routinematig krijgen (bijv. via stadiometrie). Om de systemische effecten van orale inhalatiecorticosteroïden, waaronder SYMBICORT, te minimaliseren, moet de dosis van elke patiënt worden getitreerd tot de laagste dosering die zijn/haar symptomen effectief onder controle houdt (zie DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Glaucoom en staar
Glaucoom, verhoogde intraoculaire druk en cataract zijn gemeld bij patiënten met astma en COPD na langdurige toediening van inhalatiecorticosteroïden, waaronder budesonide, een bestanddeel van SYMBICORT. Daarom is nauwlettende controle geboden bij patiënten met een veranderd gezichtsvermogen of met een voorgeschiedenis van verhoogde intraoculaire druk, glaucoom en/of cataracten.
De effecten van behandeling met SYMBICORT 160/4.5, SYMBICORT 80/4.5, formoterol 4,5 mcg of placebo op de ontwikkeling van cataract of glaucoom werden geëvalueerd bij een subgroep van 461 patiënten met COPD in het 12 maanden durende longfunctieonderzoek. Oogonderzoeken werden uitgevoerd bij baseline, 24 weken en 52 weken. Er waren 26 proefpersonen (6%) met een verhoging van de posterieure subcapsulaire score van baseline tot maximale waarde (>0,7) tijdens de gerandomiseerde behandelingsperiode. Veranderingen in posterieure subcapsulaire scores van >0,7 vanaf de uitgangswaarde tot het behandelingsmaximum traden op bij 11 patiënten (9,0%) in de SYMBICORT 160/4,5-groep, 4 patiënten (3,8%) in de SYMBICORT 80/4,5-groep, 5 patiënten (4,2%) in de formoterolgroep en 6 patiënten (5,2%) in de placebogroep.
Eosinofiele aandoeningen en Churg-Strauss-syndroom
In zeldzame gevallen kunnen patiënten die inhalatiecorticosteroïden gebruiken systemische eosinofiele aandoeningen vertonen. Sommige van deze patiënten hebben klinische kenmerken van vasculitis die passen bij het syndroom van Churg-Strauss, een aandoening die vaak wordt behandeld met systemische therapie met corticosteroïden. Deze voorvallen zijn gewoonlijk, maar niet altijd, in verband gebracht met de verlaging en/of stopzetting van de behandeling met orale corticosteroïden na de introductie van inhalatiecorticosteroïden. Artsen dienen alert te zijn op eosinofilie, vasculitische uitslag, verergering van longsymptomen, hartcomplicaties en/of neuropathie bij hun patiënten. Een causaal verband tussen budesonide en deze onderliggende aandoeningen is niet vastgesteld.
Naast elkaar bestaande voorwaarden
SYMBICORT 4,5 mcg moet, zoals alle geneesmiddelen die sympathicomimetische amines bevatten, met voorzichtigheid worden gebruikt bij patiënten met convulsieve stoornissen of thyreotoxicose en bij patiënten die ongewoon reageren op sympathicomimetische amines. Van doses van de verwante bèta-2-adrenoceptoragonist albuterol is gemeld dat ze bij intraveneuze toediening reeds bestaande diabetes mellitus en ketoacidose verergeren.
Hypokaliëmie en hyperglykemie
Bèta-adrenerge agonistische medicijnen kunnen bij sommige patiënten significante hypokaliëmie veroorzaken, mogelijk door intracellulair rangeren, wat mogelijk nadelige cardiovasculaire effecten kan veroorzaken [zie KLINISCHE FARMACOLOGIE ]. De verlaging van het serumkalium is meestal van voorbijgaande aard en vereist geen suppletie. Klinisch significante veranderingen in bloedglucose en/of serumkalium werden niet vaak gezien tijdens klinische onderzoeken met SYMBICORT in de aanbevolen doses.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATINTINFORMATIE en gebruiksaanwijzing ).
Ernstige astma-gerelateerde gebeurtenissen
Informeer patiënten met astma dat LABA, wanneer het alleen wordt gebruikt, het risico op astma-gerelateerde ziekenhuisopname of astma-gerelateerde sterfte verhoogt. Beschikbare gegevens tonen aan dat wanneer ICS en LABA samen worden gebruikt, zoals met SYMBICORT, er geen significante toename is van het risico op deze voorvallen.
Niet voor acute symptomen
Informeer patiënten dat SYMBICORT 160 mg niet bedoeld is om acute symptomen van astma of COPD te verlichten en dat extra doses niet voor dat doel mogen worden gebruikt. Adviseer patiënten om acute symptomen te behandelen met een geïnhaleerde, kortwerkende bèta2-agonist zoals albuterol. Geef patiënten dergelijke medicatie en instrueer de patiënt hoe deze moet worden gebruikt.
Instrueer patiënten om onmiddellijk medische hulp in te roepen als ze een van de volgende verschijnselen krijgen:
- Afnemende werkzaamheid van geïnhaleerde, kortwerkende bèta2-agonisten
- Behoefte aan meer inhalaties dan normaal van geïnhaleerde, kortwerkende bèta2-agonisten
- Aanzienlijke afname van de longfunctie zoals beschreven door de arts
Vertel patiënten dat ze de behandeling met SYMBICORT niet mogen stoppen zonder begeleiding van een arts/leverancier, aangezien de symptomen na stopzetting kunnen terugkeren.
Gebruik geen extra langwerkende bèta2-agonisten
Instrueer patiënten om geen andere LABA te gebruiken voor astma en COPD.
Lokale effecten
Informeer patiënten dat bij sommige patiënten gelokaliseerde infecties met Candida albicans in de mond en keelholte zijn opgetreden. Als zich orofaryngeale candidiasis ontwikkelt, moet deze worden behandeld met geschikte lokale of systemische (dwz orale) antischimmeltherapie terwijl de behandeling met SYMBICORT 4,5 mcg wordt voortgezet, maar soms moet de behandeling met SYMBICORT mogelijk tijdelijk worden onderbroken onder strikt medisch toezicht. De mond spoelen met water zonder te slikken na inademing wordt aangeraden om het risico op spruw te verminderen.
Longontsteking
Patiënten met COPD hebben een hoger risico op longontsteking; instrueer hen om contact op te nemen met hun zorgverlener als ze symptomen van longontsteking krijgen.
Immunosuppressie
Waarschuw patiënten die immunosuppressieve doses corticosteroïden gebruiken om blootstelling aan waterpokken of mazelen te vermijden en, indien blootgesteld, hun arts onmiddellijk te raadplegen. Informeer patiënten over mogelijke verergering van bestaande tuberculose, schimmel-, bacteriële, virale of parasitaire infecties of oculaire herpes simplex.
Hypercorticisme en bijniersuppressie
Adviseer patiënten dat SYMBICORT systemische corticosteroïd-effecten van hypercorticisme en bijniersuppressie kan veroorzaken. Informeer patiënten bovendien dat sterfgevallen als gevolg van bijnierinsufficiëntie zijn opgetreden tijdens en na de overdracht van systemische corticosteroïden. Patiënten moeten langzaam afbouwen van systemische corticosteroïden als ze overstappen op SYMBICORT.
Vermindering van botmineraaldichtheid
Adviseer patiënten met een verhoogd risico op een verlaagde BMD dat het gebruik van corticosteroïden een extra risico kan vormen.
Verminderde groeisnelheid
Informeer patiënten dat orale inhalatiecorticosteroïden, een bestanddeel van SYMBICORT, een vermindering van de groeisnelheid kunnen veroorzaken bij toediening aan pediatrische patiënten. Artsen dienen de groei van kinderen en adolescenten die langs welke weg dan ook corticosteroïden gebruiken, nauwlettend te volgen.
Oculaire effecten
Langdurig gebruik van inhalatiecorticosteroïden kan het risico op bepaalde oogproblemen (cataract of glaucoom) verhogen; overweeg regelmatig oogonderzoek.
Risico's verbonden aan bèta-agonisttherapie
Informeer patiënten over bijwerkingen die verband houden met bèta2-agonisten, zoals hartkloppingen, pijn op de borst, snelle hartslag, tremor of nervositeit.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Budesonide
Er zijn langetermijnstudies uitgevoerd bij ratten en muizen met orale toediening om het carcinogene potentieel van budesonide te evalueren.
In een 2 jaar durend onderzoek bij Sprague-Dawley-ratten veroorzaakte budesonide een statistisch significante toename van de incidentie van gliomen bij mannelijke ratten bij een orale dosis van 50 mcg/kg (ongeveer gelijk aan de MRHDID bij volwassenen en kinderen op een mcg/m² basis). Er werd geen tumorigeniciteit waargenomen bij mannelijke en vrouwelijke ratten bij respectievelijke orale doses tot 25 en 50 mcg/kg (ongeveer equivalent aan de MRHDID bij volwassenen en kinderen op basis van mcg/m²). In twee aanvullende onderzoeken van 2 jaar bij mannelijke Fischer- en Sprague-Dawley-ratten veroorzaakte budesonide geen gliomen bij een orale dosis van 50 mcg/kg (ongeveer equivalent aan de MRHDID bij volwassenen en kinderen op basis van mcg/m²). Bij de mannelijke Sprague-Dawley-ratten veroorzaakte budesonide echter een statistisch significante toename van de incidentie van hepatocellulaire tumoren bij een orale dosis van 50 mcg/kg (ongeveer equivalent aan de MRHDID bij volwassenen en kinderen op basis van mcg/m²). De gelijktijdige referentie-corticosteroïden (prednisolon en triamcinolonacetonide) in deze twee onderzoeken lieten vergelijkbare bevindingen zien.
In een 91 weken durende studie bij muizen veroorzaakte budesonide geen behandelingsgerelateerde carcinogeniteit bij orale doses tot 200 mcg/kg (ongeveer 2 keer de MRHDID bij volwassenen en kinderen op basis van mcg/m²).
Budesonide was niet mutageen of clastogeen in zes verschillende testsystemen: Ames Salmonella/microsoomplaattest, muismicronucleustest, muislymfoomtest, chromosoomafwijkingstest in menselijke lymfocyten, geslachtsgebonden recessieve letale test in Drosophila melanogaster en DNA-reparatieanalyse bij ratten hepatocyten cultuur.
De vruchtbaarheid en reproductieprestaties werden niet beïnvloed bij ratten bij subcutane doses tot 80 mcg/kg (ongeveer gelijk aan de MRHDID op basis van mcg/m²). Het veroorzaakte echter een afname van de prenatale levensvatbaarheid en levensvatbaarheid van de pups bij de geboorte en tijdens de lactatie, samen met een afname van de gewichtstoename van de moeder, bij subcutane doses van 20 mcg/kg en hoger (minder dan de MRHDID op basis van mcg/m²). ). Dergelijke effecten werden niet waargenomen bij 5 mcg/kg (minder dan de MRHDID op basis van mcg/m²).
Formoterol
Er zijn langetermijnstudies uitgevoerd bij muizen die orale toediening gebruikten en ratten die toediening via inhalatie gebruikten om het carcinogene potentieel van formoterolfumaraat te evalueren.
In een carcinogeniteitsonderzoek van 24 maanden bij CD-1-muizen veroorzaakte formoterol bij orale doses van 100 mcg/kg en hoger (ongeveer 30 en 15 keer de MRHDID bij respectievelijk volwassenen en kinderen, op basis van mcg/m²) een dosis- gerelateerde toename van de incidentie van uteriene leiomyomen.
In een carcinogeniteitsonderzoek van 24 maanden bij Sprague-Dawley-ratten werd een verhoogde incidentie van mesovarieel leiomyoom en uterien leiomyosarcoom waargenomen bij een geïnhaleerde dosis van 130 mcg/kg (ongeveer 70 en 35 maal de MRHDID bij respectievelijk volwassenen en kinderen op een mcg/m² basis). Er werden geen tumoren gezien bij 22 mcg/kg (ongeveer 12 en 6 keer de MRHDID bij respectievelijk volwassenen en kinderen, op basis van mcg/m²).
Andere bèta-agonisten hebben op vergelijkbare wijze een toename van leiomyomen van het genitaal kanaal aangetoond bij vrouwelijke knaagdieren. De relevantie van deze bevindingen voor menselijk gebruik is niet bekend.
Formoterol was niet mutageen of clastogeen in de Ames Salmonella/microsoomplaattest, muislymfoomtest, chromosoomafwijkingstest in menselijke lymfocyten en micronucleustest bij ratten.
Bij mannelijke ratten die werden behandeld met formoterol in een orale dosis van 15.000 mcg/kg (ongeveer 2200 maal de MRHDID op AUC-basis) werd een vermindering van de vruchtbaarheid en/of reproductieve prestatie vastgesteld. Een dergelijk effect werd niet gezien bij 3000 mcg/kg (ongeveer 1600 keer de MRHDID op basis van mcg/m²). In een afzonderlijke studie met mannelijke ratten die werden behandeld met een orale dosis van 15.000 mcg/kg (ongeveer 8000 maal de MRHDID op basis van mcg/m²), werden bevindingen gedaan van testiculaire tubulaire atrofie en spermatisch afval in de teelballen en oligospermie in de epididymiden. Er werd geen effect op de vruchtbaarheid waargenomen bij vrouwelijke ratten bij doses tot 15.000 mcg/kg (ongeveer 1100 keer de MRHDID op AUC-basis).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Er zijn geen adequate en goed gecontroleerde onderzoeken met SYMBICORT 160 mg of een van de afzonderlijke componenten ervan, formoterolfumaraat, bij zwangere vrouwen; er zijn echter studies beschikbaar voor de andere component budesonide. In reproductiestudies bij dieren was SYMBICORT 4,5 mcg, toegediend via inhalatie, teratogeen, embryocide en verminderd foetaal gewicht bij ratten bij minder dan de maximaal aanbevolen dagelijkse inhalatiedosis voor de mens (MRHDID) op basis van mcg/m². Budesonide alleen, subcutaan toegediend, was teratogeen, embryocide en verminderde foetale gewichten bij ratten en konijnen bij minder dan de MRHDID, maar deze effecten werden niet gezien bij ratten die geïnhaleerde doses tot 4 keer de MRHDID kregen. Studies bij zwangere vrouwen hebben niet aangetoond dat alleen budesonide via inhalatie het risico op afwijkingen verhoogt bij toediening tijdens de zwangerschap. Ervaring met orale corticosteroïden suggereert dat knaagdieren vatbaarder zijn voor teratogene effecten van blootstelling aan corticosteroïden dan mensen. Alleen formoterolfumaraat, oraal toegediend, was teratogeen bij ratten en konijnen bij respectievelijk 1600 en 65.000 maal de MRHDID. Formoterolfumaraat was ook embryocide, verhoogde het verlies van jongen bij de geboorte en tijdens de lactatie, en verlaagde het gewicht van de jongen bij ratten bij 110 keer de MRHDID. Deze bijwerkingen traden over het algemeen op bij grote veelvouden van de MRHDID wanneer formoterolfumaraat oraal werd toegediend om hoge systemische blootstellingen te bereiken. Er werden geen teratogene, embryocidale of ontwikkelingseffecten waargenomen bij ratten die inhalatiedoses tot 375 maal de MRHDID kregen.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam van de aangegeven populaties is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Bij vrouwen met astma die slecht of matig onder controle is, is er een verhoogd risico op verschillende perinatale bijwerkingen, zoals pre-eclampsie bij de moeder en vroeggeboorte, een laag geboortegewicht en een lage zwangerschapsduur bij de pasgeborene. Zwangere vrouwen met astma moeten nauwlettend worden gecontroleerd en de medicatie moet zo nodig worden aangepast om de astma optimaal onder controle te houden.
Arbeid of levering
Er zijn geen goed gecontroleerde onderzoeken bij mensen die de effecten van SYMBICORT 4,5 mcg tijdens de bevalling en de bevalling hebben onderzocht. Vanwege de mogelijke interferentie van bèta-agonisten met de contractiliteit van de baarmoeder, moet het gebruik van SYMBICORT 4,5 mcg tijdens de bevalling worden beperkt tot die patiënten bij wie de voordelen duidelijk opwegen tegen het risico.
Gegevens
Menselijke gegevens
Studies bij zwangere vrouwen hebben niet aangetoond dat budesonide via inhalatie het risico op afwijkingen verhoogt bij toediening tijdens de zwangerschap. De resultaten van een groot populatiegebaseerd prospectief cohort epidemiologisch onderzoek waarin gegevens zijn beoordeeld uit drie Zweedse registers die ongeveer 99% van de zwangerschappen van 1995-1997 bestrijken (dwz het Zweedse medische geboorteregister; het register van aangeboren misvormingen; het kindercardiologieregister) duiden niet op een verhoogd risico voor aangeboren afwijkingen door het gebruik van inhalatie budesonide tijdens de vroege zwangerschap. Congenitale misvormingen werden onderzocht bij zuigelingen van 2014 van moeders die melding maakten van het gebruik van inhalatiebudesonide voor astma tijdens de vroege zwangerschap (meestal 10-12 weken na de laatste menstruatie), de periode waarin de meeste ernstige orgaanmisvormingen optreden. Het aantal geregistreerde aangeboren afwijkingen was vergelijkbaar met het percentage in de algemene bevolking (respectievelijk 3,8% versus 3,5%). Bovendien was het aantal zuigelingen geboren met orofaciale spleten na blootstelling aan geïnhaleerd budesonide vergelijkbaar met het verwachte aantal in de normale populatie (respectievelijk 4 kinderen vs. 3,3).
Dezelfde gegevens werden gebruikt in een tweede onderzoek, waarmee het totaal op 2534 zuigelingen kwam van wie de moeder was blootgesteld aan budesonide via inhalatie. In deze studie was het percentage aangeboren afwijkingen bij zuigelingen van wie de moeder tijdens de vroege zwangerschap werd blootgesteld aan budesonide voor inhalatie niet verschillend van het percentage voor alle pasgeboren baby's in dezelfde periode (3,6%).
Dierlijke gegevens
SYMBICORT
In een embryo-foetale ontwikkelingsstudie bij zwangere ratten die werden gedoseerd tijdens de periode van organogenese vanaf dag 6-16 van de dracht, veroorzaakte SYMBICORT 160 mg navelstrenghernia bij foetussen bij doses lager dan de MRHDID (op basis van mcg/m² bij maternale geïnhaleerde doses van 12/ 0,66 mcg/kg/dag en hoger). Het foetale gewicht was verminderd met respectievelijk ongeveer 5 en 3 keer de MRHDID (op AUC-basis bij een maternale inhalatiedosis van 80/4,4 mcg/kg (budesonide/formoterol)). Er werden geen teratogene of embryocidale effecten waargenomen bij doses lager dan de MRHDID (op basis van mcg/m² bij een maternale inhalatiedosis van 2,5/0,14 mcg/kg/dag).
Budesonide
In een vruchtbaarheids- en reproductieonderzoek werden mannelijke ratten gedurende 9 weken subcutaan gedoseerd en vrouwtjes gedurende 2 weken voorafgaand aan het paren en tijdens de paringsperiode. Vrouwtjes werden gedoseerd tot het spenen van hun nakomelingen. Budesonide veroorzaakte een afname van de prenatale levensvatbaarheid en levensvatbaarheid van de pups bij de geboorte en tijdens de lactatie, samen met een afname van de gewichtstoename van de moeder, bij doses lager dan de MRHDID (op basis van mcg/m² bij subcutane doses van 20 mcg/ kg/dag en meer). Dergelijke effecten werden niet waargenomen bij een dosis lager dan de MRHDID (op basis van mcg/m² bij een maternale subcutane dosis van 5 mcg/kg/dag).
In een embryo-foetale ontwikkelingsstudie bij drachtige konijnen die werden gedoseerd tijdens de periode van organogenese vanaf dag 6-18 van de dracht, veroorzaakte budesonide foetaal verlies, verminderd foetaal gewicht en skeletafwijkingen bij doses lager dan de MRHDID (op basis van mcg/m² bij een maternale subcutane dosis van 25 mcg/kg/dag). In een embryo-foetale ontwikkelingsstudie bij zwangere ratten die werden gedoseerd tijdens de periode van organogenese vanaf dag 6-15 van de dracht, veroorzaakte budesonide vergelijkbare nadelige foetale effecten bij doses van ongeveer 8 keer de MRHDID (op een mcg/m²-basis bij een maternale subcutane dosis van 500 mcg/kg/dag). In een ander embryo-foetaal ontwikkelingsonderzoek bij drachtige ratten werden geen teratogene of embryocidale effecten waargenomen bij doses tot 4 keer de MRHDID (op basis van mcg/m² bij maternale inhalatiedoses tot 250 mcg/kg/dag).
In een peri- en postnatale ontwikkelingsstudie, waarbij ratten vanaf dag 15 van de dracht tot dag 21 postpartum werden gedoseerd, had budesonide geen effect op de bevalling, maar wel op de groei en ontwikkeling van het nageslacht. De overleving van de nakomelingen was verminderd en de overlevende nakomelingen hadden een lager gemiddeld lichaamsgewicht bij de geboorte en tijdens de lactatie bij doses lager dan de MRHDID en hoger (op basis van mcg/m² bij maternale subcutane doses van 20 mcg/kg/dag en hoger). Deze bevindingen deden zich voor in aanwezigheid van maternale toxiciteit.
Formoterol
In een vruchtbaarheids- en reproductieonderzoek werden mannelijke ratten oraal toegediend gedurende 9 weken en vrouwtjes gedurende 2 weken voorafgaand aan het paren en tijdens de paringsperiode. Vrouwtjes werden ofwel gedoseerd tot dag 19 van de dracht of tot het spenen van hun nakomelingen. Mannetjes werden gedoseerd tot 25 weken. Navelstrenghernia werd waargenomen bij rattenfoetussen bij orale doses van 1600 keer en hoger dan de MRHDID (op basis van mcg/m² bij orale doses van 3000 mcg/kg/dag en hoger). Brachygnathia werd waargenomen bij rattenfoetussen in een dosis van 8000 maal de MRHDID (op basis van mcg/m² bij een orale dosis van 15.000 mcg/kg/dag bij de moeder). De zwangerschap werd verlengd bij een dosis van 8000 maal de MRHDID (op basis van mcg/m² bij een orale dosis voor de moeder van 15.000 mcg/kg/dag). Sterfgevallen van foetussen en jongen kwamen voor bij doses van ongeveer 1600 keer de MRHDID en hoger (op basis van mcg/m² bij orale doses van 3000 mcg/kg/dag en hoger) tijdens de dracht.
In een embryo-foetale ontwikkelingsstudie bij zwangere ratten die werden gedoseerd tijdens de periode van organogenese vanaf dag 6-15, werden geen teratogene, embryocidale of ontwikkelingseffecten waargenomen bij doses tot 375 maal de MRHDID (op een mcg/m²-basis met maternale inhalatie doses tot 690 mcg/kg/dag).
In een embryo-foetale ontwikkelingsstudie bij zwangere konijnen die werden gedoseerd tijdens de periode van organogenese vanaf dag 6-18 van de dracht, werden subcapsulaire cysten op de lever waargenomen bij de foetussen in een dosis van 65.000 maal de MRHDID (op een mcg/m²-basis met een maternale orale dosis van 60.000 mcg/kg/dag). Er werden geen teratogene effecten waargenomen bij doses tot 3800 maal de MRHDID (op basis van mcg/m² bij orale doses van de moeder tot 3500 mcg/kg/dag).
In een pre- en postnataal ontwikkelingsonderzoek kregen zwangere vrouwelijke ratten formoterol in orale doses van 0, 210, 840 en 3400 mcg/kg/dag vanaf dag 6 van de dracht tot en met de lactatieperiode. De overleving van de pups was afgenomen vanaf de geboorte tot dag 26 postpartum bij doses van 110 keer de MRHDID en hoger (op basis van mcg/m² bij orale doses van 210 mcg/kg/dag en hoger), hoewel er geen bewijs was van een dosis-respons relatie. Er waren geen behandelingsgerelateerde effecten op de fysieke, functionele en gedragsontwikkeling van rattenjongen.
Borstvoeding
Risico Samenvatting
Er zijn geen gegevens beschikbaar over de effecten van SYMBICORT 4,5 mcg, budesonide of formoterolfumaraat op het kind dat borstvoeding krijgt of op de melkproductie. Budesonide is, net als andere inhalatiecorticosteroïden, aanwezig in de moedermelk [zie Gegevens ]. Er zijn geen gegevens beschikbaar over de aanwezigheid van formoterolfumaraat in moedermelk. Formoterolfumaraat is aanwezig in rattenmelk [zie Gegevens ]. Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan SYMBICORT 4,5 mcg en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van SYMBICORT 160 mg of van de onderliggende maternale aandoening.
Gegevens
Gegevens bij mensen met budesonide toegediend via een inhalator voor droog poeder geven aan dat de totale dagelijkse orale dosis budesonide die beschikbaar is in de moedermelk voor de zuigeling ongeveer 0,3% tot 1% is van de dosis die door de moeder wordt geïnhaleerd [zie KLINISCHE FARMACOLOGIE ]. Voor SYMBICORT 4,5 mcg zou de dosis budesonide die beschikbaar is voor de zuigeling in de moedermelk, als percentage van de maternale dosis, naar verwachting vergelijkbaar zijn.
In het vruchtbaarheids- en reproductieonderzoek bij ratten werden plasmaspiegels van formoterol gemeten bij pups op postnatale dag 15 [zie Gebruik bij specifieke populaties ]. Er werd geschat dat de maximale plasmaconcentratie die de pups kregen van het moederdier, bij de hoogste dosis van 15 mg/kg, na borstvoeding 4,4% was (0,24 nmol/L voor een nest vs. 5,5 nmol/L voor de moeder) .
Pediatrisch gebruik
De veiligheid en werkzaamheid van SYMBICORT bij astmapatiënten van 12 jaar en ouder zijn vastgesteld in onderzoeken tot 12 maanden. In de twee 12 weken durende, dubbelblinde, placebogecontroleerde Amerikaanse hoofdonderzoeken werden 25 patiënten van 12 tot 17 jaar behandeld met SYMBICORT tweemaal daags [zie Klinische studies ]. De werkzaamheidsresultaten in deze leeftijdsgroep waren vergelijkbaar met die waargenomen bij patiënten van 18 jaar en ouder. Er waren geen duidelijke verschillen in het type of de frequentie van gemelde bijwerkingen in deze leeftijdsgroep in vergelijking met patiënten van 18 jaar en ouder.
De veiligheid en werkzaamheid van SYMBICORT 80/4.5 bij astmapatiënten van 6 tot jonger dan 12 jaar zijn vastgesteld in onderzoeken met een duur van maximaal 12 weken [zie Klinische studies ]. Het veiligheidsprofiel bij deze patiënten kwam overeen met dat waargenomen bij patiënten van 12 jaar en ouder die ook SYMBICORT kregen (zie ONGEWENSTE REACTIES ].
De veiligheid en werkzaamheid van SYMBICORT 160 mg bij astmapatiënten jonger dan 6 jaar zijn niet vastgesteld.
Gecontroleerde klinische onderzoeken hebben aangetoond dat orale inhalatiecorticosteroïden, waaronder budesonide, een bestanddeel van SYMBICORT, een vermindering van de groeisnelheid bij pediatrische patiënten kunnen veroorzaken. Dit effect is waargenomen bij afwezigheid van laboratoriumgegevens van HPA-asonderdrukking, wat suggereert dat groeisnelheid een gevoeligere indicator is voor systemische blootstelling aan corticosteroïden bij pediatrische patiënten dan sommige veelgebruikte tests van de HPA-asfunctie. Het langetermijneffect van deze vermindering van de groeisnelheid geassocieerd met orale inhalatiecorticosteroïden, inclusief het effect op de uiteindelijke lengte, is niet bekend. Het potentieel voor "inhaalgroei" na stopzetting van de behandeling met orale inhalatiecorticosteroïden is niet voldoende onderzocht.
In een onderzoek bij astmatische kinderen van 5 tot 12 jaar hadden degenen die werden behandeld met budesonide DPI 200 mcg tweemaal daags (n=311) een groeivermindering van 1,1 centimeter vergeleken met degenen die placebo kregen (n=418) aan het einde van een jaar. ; het verschil tussen deze twee behandelingsgroepen nam niet verder toe gedurende drie jaar aanvullende behandeling. Tegen het einde van 4 jaar hadden kinderen die werden behandeld met budesonide DPI en kinderen die werden behandeld met placebo vergelijkbare groeisnelheden. De conclusies die uit deze studie worden getrokken, kunnen worden vertroebeld door het ongelijke gebruik van corticosteroïden in de behandelingsgroepen en de opname van gegevens van patiënten die in de loop van de studie de puberteit bereikten.
De groei van pediatrische patiënten die orale inhalatiecorticosteroïden krijgen, waaronder SYMBICORT, moet worden gecontroleerd. Als een kind of adolescent die een corticosteroïd gebruikt een groeisuppressie lijkt te hebben, moet de mogelijkheid worden overwogen dat hij/zij bijzonder gevoelig is voor dit effect. De mogelijke groei-effecten van langdurige behandeling moeten worden afgewogen tegen de verkregen klinische voordelen. Om de systemische effecten van orale inhalatiecorticosteroïden, waaronder SYMBICORT, te minimaliseren, moet elke patiënt worden getitreerd tot de laagste sterkte die zijn/haar astma effectief onder controle houdt (zie DOSERING EN ADMINISTRATIE ].
Geriatrisch gebruik
Van het totale aantal astmapatiënten dat werd behandeld met SYMBICORT 160 mg tweemaal daags in twee onderzoeken van 12 weken en een postmarketingonderzoek van 26 weken, waren er 791 65 jaar of ouder, van wie 141 75 jaar of ouder.
In de COPD-onderzoeken met een duur van 6 tot 12 maanden waren 810 patiënten behandeld met SYMBICORT 160/4.5, twee inhalaties tweemaal daags 65 jaar en ouder en daarvan waren 177 patiënten 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere patiënten, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond.
Net als bij andere producten die bèta2-agonisten bevatten, is bijzondere voorzichtigheid geboden bij het gebruik van SYMBICORT bij geriatrische patiënten met gelijktijdige cardiovasculaire aandoeningen die nadelig kunnen worden beïnvloed door bèta2-agonisten.
Op basis van beschikbare gegevens voor SYMBICORT of de actieve componenten ervan, is een aanpassing van de dosering van SYMBICORT 4,5 mcg bij geriatrische patiënten niet gerechtvaardigd.
Leverfunctiestoornis
Er zijn geen formele farmacokinetische onderzoeken met SYMBICORT uitgevoerd bij patiënten met leverinsufficiëntie. Aangezien echter zowel budesonide als formoterolfumaraat voornamelijk door levermetabolisme worden geklaard, kan een leverfunctiestoornis leiden tot accumulatie van budesonide en formoterolfumaraat in plasma. Daarom moeten patiënten met een leveraandoening nauwlettend worden gecontroleerd.
Nierfunctiestoornis
Er zijn geen formele farmacokinetische onderzoeken met SYMBICORT uitgevoerd bij patiënten met een nierfunctiestoornis.
OVERDOSERING
SYMBICORT
SYMBICORT bevat zowel budesonide als formoterol; daarom zijn de risico's die gepaard gaan met overdosering voor de afzonderlijke componenten die hieronder worden beschreven, van toepassing op SYMBICORT. In farmacokinetische onderzoeken werden enkelvoudige doses van 960/54 mcg (12 verstuivingen van SYMBICORT 80/4,5) en 1280/36 mcg (8 verstuivingen van 160/4,5) toegediend aan patiënten met COPD. In totaal werd 1920/54 mcg (12 verstuivingen van SYMBICORT 160/4,5) toegediend als een enkele dosis aan zowel gezonde proefpersonen als patiënten met astma. In een langdurig actief gecontroleerd veiligheidsonderzoek bij adolescente en volwassen astmapatiënten van 12 jaar en ouder, werd SYMBICORT 160/4.5 gedurende maximaal 12 maanden toegediend in doses tot tweemaal de hoogste aanbevolen dagelijkse dosis. In geen van deze onderzoeken werden klinisch significante bijwerkingen waargenomen.
Budesonide
De kans op acute toxische effecten na overdosering van budesonide is laag. Bij langdurig gebruik in overmatige doses kunnen systemische corticosteroïd-effecten zoals hypercorticisme optreden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Budesonide, vijfmaal de hoogste aanbevolen dosis (3200 mcg per dag), toegediend aan mensen gedurende 6 weken, veroorzaakte een significante vermindering (27%) van de plasmacortisolrespons op een 6 uur durende infusie van ACTH in vergelijking met placebo (+1%). Het overeenkomstige effect van 10 mg prednison per dag was een afname van 35% in de plasmacortisolrespons op ACTH.
Formoterol
Een overdosis formoterol zou waarschijnlijk leiden tot een versterking van de effecten die typisch zijn voor bèta2-agonisten: toevallen, angina, hypertensie, hypotensie, tachycardie, atriale en ventriculaire tachyaritmieën, nervositeit, hoofdpijn, tremor, hartkloppingen, spierkrampen, misselijkheid, duizeligheid, slaapstoornissen , metabole acidose, hyperglykemie, hypokaliëmie. Zoals met alle sympathicomimetische medicatie, kunnen hartstilstand en zelfs overlijden in verband worden gebracht met misbruik van formoterol. Er werden geen klinisch significante bijwerkingen waargenomen bij toediening van formoterol aan volwassen patiënten met acute bronchoconstrictie in een dosis van 90 mcg/dag gedurende 3 uur of aan stabiele astmapatiënten 3 keer per dag bij een totale dosis van 54 mcg/dag gedurende 3 dagen.
Behandeling van overdosering met formoterol bestaat uit het staken van de medicatie samen met het instellen van een geschikte symptomatische en/of ondersteunende therapie. Het oordeelkundig gebruik van een cardioselectieve bètablokker kan worden overwogen, rekening houdend met het feit dat dergelijke medicatie bronchospasmen kan veroorzaken. Er is onvoldoende bewijs om te bepalen of dialyse gunstig is voor overdosering van formoterol. In geval van overdosering wordt hartbewaking aanbevolen.
CONTRA-INDICATIES
Het gebruik van SYMBICORT is gecontra-indiceerd onder de volgende omstandigheden:
- Primaire behandeling van status astmaticus of andere acute episodes van astma of COPD waarbij intensieve maatregelen nodig zijn.
- Overgevoeligheid voor een van de bestanddelen van SYMBICORT.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
SYMBICORT
SYMBICORT bevat zowel budesonide als formoterol; daarom zijn de hieronder beschreven werkingsmechanismen voor de afzonderlijke componenten van toepassing op SYMBICORT. Deze geneesmiddelen vertegenwoordigen twee klassen medicijnen (een synthetische corticosteroïde en een langwerkende selectieve bèta2-adrenoceptoragonist) die verschillende effecten hebben op klinische, fysiologische en inflammatoire indices van COPD en astma.
Budesonide
Budesonide is een ontstekingsremmend corticosteroïd dat een krachtige glucocorticoïde activiteit en een zwakke mineralocorticoïde activiteit vertoont. In standaard in vitro- en diermodellen heeft budesonide een ongeveer 200 keer hogere affiniteit voor de glucocorticoïdereceptor en een 1000 keer hogere lokale ontstekingsremmende potentie dan cortisol (test op crotonolie-ooroedeem bij ratten). Als maat voor de systemische activiteit is budesonide 40 keer krachtiger dan cortisol bij subcutane toediening en 25 keer krachtiger bij orale toediening in de thymus-involutietest bij ratten.
In onderzoeken naar de affiniteit van de glucocorticoïdreceptor was de 22R-vorm van budesonide twee keer zo actief als het 22S-epimeer. In vitro-onderzoeken wezen uit dat de twee vormen van budesonide niet in elkaar overgaan.
Ontsteking is een belangrijk onderdeel in de pathogenese van COPD en astma. Corticosteroïden hebben een breed scala aan remmende activiteiten tegen meerdere celtypen (bijv. mestcellen, eosinofielen, neutrofielen, macrofagen en lymfocyten) en mediatoren (bijv. histamine, eicosanoïden, leukotriënen en cytokinen) die betrokken zijn bij allergische en niet-allergische gemedieerde ontsteking. Deze ontstekingsremmende werking van corticosteroïden kan bijdragen aan hun werkzaamheid bij COPD en astma.
Studies bij astmapatiënten hebben een gunstige verhouding aangetoond tussen lokale ontstekingsremmende activiteit en systemische effecten van corticosteroïden over een breed scala aan doses budesonide. Dit wordt verklaard door een combinatie van een relatief hoog lokaal ontstekingsremmend effect, uitgebreide first-pass leverafbraak van oraal geabsorbeerd geneesmiddel (85%-95%) en de lage potentie van gevormde metabolieten.
Formoterol
Formoterolfumaraat is een langwerkende selectieve bèta-2-adrenerge agonist (bèta2-agonist) met een snel intredende werking. Geïnhaleerd formoterolfumaraat werkt lokaal in de long als een luchtwegverwijder. In vitro-onderzoeken hebben aangetoond dat formoterol een meer dan 200 keer grotere agonistische activiteit heeft op bèta2-receptoren dan op bèta1-receptoren. De in vitro bindingsselectiviteit voor bèta2- over bèta1-adrenoceptoren is hoger voor formoterol dan voor albuterol (5 keer), terwijl salmeterol een hogere (3 keer) bèta2-selectiviteitsverhouding heeft dan formoterol.
Hoewel bèta2-receptoren de belangrijkste adrenerge receptoren zijn in bronchiale gladde spieren en bèta1-receptoren de belangrijkste receptoren in het hart, zijn er ook bèta2-receptoren in het menselijk hart die 10% tot 50% van de totale bèta-adrenerge receptoren uitmaken. De precieze functie van deze receptoren is niet vastgesteld, maar ze verhogen de mogelijkheid dat zelfs zeer selectieve bèta2-agonisten cardiale effecten kunnen hebben.
De farmacologische effecten van bèta2-adrenoceptoragonisten, waaronder formoterol, zijn ten minste gedeeltelijk toe te schrijven aan de stimulatie van intracellulair adenylcyclase, het enzym dat de omzetting van adenosinetrifosfaat (ATP) in cyclisch-3',5'-adenosinemonofosfaat katalyseert ( cyclisch AMP). Verhoogde cyclische AMP-niveaus veroorzaken ontspanning van bronchiale gladde spieren en remming van de afgifte van mediatoren van directe overgevoeligheid uit cellen, vooral uit mestcellen.
In vitro-tests tonen aan dat formoterol een remmer is van de afgifte van mestcelmediatoren, zoals histamine en leukotriënen, uit de menselijke long. Formoterol remt ook de door histamine geïnduceerde extravasatie van plasma-albumine bij verdoofde cavia's en remt de door allergeen geïnduceerde instroom van eosinofielen bij honden met hyperreactiviteit van de luchtwegen. De relevantie van deze bevindingen in vitro en bij dieren voor de mens is niet bekend.
farmacodynamiek
Astma
Cardiovasculaire effecten
In een cross-over-onderzoek met een enkelvoudige dosis waarbij 201 patiënten met persisterend astma betrokken waren, werden behandelingen met een enkelvoudige dosis van 4,5, 9 en 18 mcg formoterol in combinatie met 320 mcg budesonide toegediend via SYMBICORT vergeleken met budesonide 320 mcg alleen. Vergeleken met budesonide werden dosis-geordende verbeteringen in FEV1 aangetoond. ECG's en bloedmonsters voor glucose en kalium werden na de dosis verkregen. Voor SYMBICORT 4,5 mcg werden kleine gemiddelde verhogingen van serumglucose en verlagingen van serumkalium (respectievelijk +0,44 mmol/l en -0,18 mmol/l bij de hoogste dosis) waargenomen bij toenemende doses formoterol, in vergelijking met budesonide. In ECG's produceerde SYMBICORT kleine dosisgerelateerde gemiddelde verhogingen van de hartslag (ongeveer 3 bpm bij de hoogste dosis) en QTc-intervallen (3-6 msec) in vergelijking met alleen budesonide. Geen enkele proefpersoon had een QT- of QTc-waarde 500 msec.
In de Verenigde Staten werden in vijf 12 weken durende, actief- en placebogecontroleerde onderzoeken en één 6 maanden durende actief-gecontroleerde studie 2976 patiënten van 6 jaar en ouder met astma geëvalueerd. Systemische farmacodynamische effecten van formoterol (hart-/polsslag, bloeddruk, QTc-interval, kalium en glucose) waren vergelijkbaar bij patiënten die werden behandeld met SYMBICORT, vergeleken met patiënten die werden behandeld met droog inhalatiepoeder van formoterol 4,5 mcg, 2 inhalaties tweemaal daags. Geen enkele patiënt had tijdens de behandeling een QT- of QTc-waarde ≥ 500 msec.
In drie placebogecontroleerde onderzoeken bij adolescenten en volwassenen met astma, in de leeftijd van 12 jaar en ouder, hadden in totaal 1232 patiënten (553 patiënten in de SYMBICORT 160 mg-groep) evalueerbare continue 24-uurs elektrocardiografische monitoring. Over het algemeen waren er geen belangrijke verschillen in het optreden van ventriculaire of supraventriculaire ectopie en geen bewijs van een verhoogd risico op klinisch significante dysritmie in de SYMBICORT 160 mg-groep in vergelijking met placebo.
HPA-as effecten
Over het algemeen werden er geen klinisch belangrijke effecten op de HPA-as waargenomen, gemeten aan de hand van 24-uurs urinecortisol, voor met SYMBICORT behandelde volwassen of adolescente patiënten bij doses tot 640/18 mcg/dag in vergelijking met budesonide.
Chronische obstructieve longziekte
Cardiovasculaire effecten
In twee COPD-longfunctieonderzoeken, met een duur van 6 maanden en 12 maanden met 3668 COPD-patiënten, werden geen klinisch belangrijke verschillen gezien in polsslag, bloeddruk, kalium en glucose tussen SYMBICORT, de afzonderlijke componenten van SYMBICORT 160 mg en placebo [zie Klinische studies ].
ECG's opgenomen tijdens meerdere kliniekbezoeken tijdens de behandeling in beide onderzoeken toonden geen klinisch belangrijke verschillen voor hartslag, PR-interval, QRS-duur, hartslag, tekenen van cardiale ischemie of aritmieën tussen SYMBICORT 160/4.5 de monoproducten en placebo, alle toegediend als 2 inhalaties tweemaal daags. Op basis van ECG's ondervonden 6 patiënten behandeld met SYMBICORT 160/4,5, 6 patiënten behandeld met formoterol 4,5 mcg en 6 patiënten in de placebogroep atriale fibrillatie of flutter die niet aanwezig was bij baseline. Er waren geen gevallen van niet-aanhoudende ventriculaire tachycardie in de SYMBICORT 160/4.5-, formoterol 4.5 mcg- of placebogroepen.
In de 12 maanden durende studie hadden 520 patiënten een evalueerbare continue 24-uurs ECG (Holter) monitoring voorafgaand aan de eerste dosis en na ongeveer 1 en 4 maanden behandeling. Er werden geen klinisch belangrijke verschillen waargenomen in ventriculaire of supraventriculaire aritmieën, ventriculaire of supraventriculaire ectopische slagen of hartslag tussen de groepen die werden behandeld met SYMBICORT 160/4.5, formoterol of placebo, ingenomen als 2 inhalaties tweemaal daags. Gebaseerd op ECG (Holter)-monitoring, ondervonden één patiënt op SYMBICORT 160/4,5, geen patiënten op formoterol 4,5 mcg en drie patiënten in de placebogroep atriumfibrilleren of flutter die niet aanwezig was bij baseline.
HPA-as effecten
Vierentwintig uur urinecortisolmetingen werden verzameld in een gepoolde subset (n=616) van patiënten uit twee COPD-longfunctiestudies. De gegevens wezen op ongeveer 30% lagere gemiddelde 24-uurs urinaire vrije cortisolwaarden na chronische toediening (> 6 maanden) van SYMBICORT in vergelijking met placebo. SYMBICORT 4,5 mcg leek een vergelijkbare cortisolsuppressie te vertonen als budesonide 160 mcg alleen of gelijktijdige toediening van budesonide 160 mcg en formoterol 4,5 mcg. Voor patiënten die tot 12 maanden met SYMBICORT 160 mg of placebo werden behandeld, was het percentage patiënten dat voor deze maatregel van normaal naar laag verschoof, over het algemeen vergelijkbaar.
Andere Budesonide-producten
Om te bevestigen dat systemische absorptie geen significante factor is in de klinische werkzaamheid van budesonide voor inhalatie, werd een klinisch onderzoek uitgevoerd bij patiënten met astma waarin 400 mcg budesonide, toegediend via een inhalator met afgemeten dosis onder druk, werd vergeleken met 1400 mcg oraal budesonide en placebo. . De studie toonde de werkzaamheid aan van budesonide voor inhalatie, maar niet van oraal ingenomen budesonide, ondanks vergelijkbare systemische niveaus. Het therapeutische effect van conventionele doses oraal geïnhaleerde budesonide wordt dus grotendeels verklaard door zijn directe werking op de luchtwegen.
Van geïnhaleerd budesonide is aangetoond dat het de luchtwegreactiviteit op verschillende challenge-modellen, waaronder histamine, methacholine, natriummetabisulfiet en adenosinemonofosfaat, vermindert bij patiënten met hyperreactieve luchtwegen. De klinische relevantie van deze modellen is niet zeker.
Voorbehandeling met budesonide voor inhalatie, 1600 mcg per dag (800 mcg tweemaal per dag) gedurende 2 weken verminderde de acute (vroege-fase reactie) en vertraagde (late-fase reactie) afname van FEV1 na blootstelling aan geïnhaleerde allergenen.
De systemische effecten van inhalatiecorticosteroïden houden verband met de systemische blootstelling aan dergelijke geneesmiddelen. Farmacokinetische studies hebben aangetoond dat bij zowel volwassenen als kinderen met astma de systemische blootstelling aan budesonide lager is met SYMBICORT 160 mg in vergelijking met budesonide voor inhalatie toegediend in dezelfde afgegeven dosis via een inhalator voor droog poeder [zie KLINISCHE FARMACOLOGIE ]. Daarom wordt verwacht dat de systemische effecten (HPA-as en groei) van budesonide afgegeven door SYMBICORT niet groter zijn dan wat is gemeld voor geïnhaleerd budesonide bij toediening in vergelijkbare doses via de droogpoederinhalator [zie Gebruik bij specifieke populaties ].
HPA-as effecten
De effecten van geïnhaleerd budesonide toegediend via een droge poederinhalator op de HPA-as werden onderzocht bij 905 volwassenen en 404 pediatrische patiënten met astma. Voor de meeste patiënten bleef het vermogen om de cortisolproductie te verhogen als reactie op stress, zoals beoordeeld met een cosyntropine (ACTH)-stimulatietest, intact bij behandeling met budesonide in de aanbevolen doses. Bij volwassen patiënten die werden behandeld met 100, 200, 400 of 800 mcg tweemaal daags gedurende 12 weken, hadden respectievelijk 4%, 2%, 6% en 13% een abnormale gestimuleerde cortisolrespons (piekcortisol
Andere Formoterol-producten
Hoewel het farmacodynamische effect plaatsvindt via stimulatie van bèta-adrenerge receptoren, leidt overmatige activering van deze receptoren gewoonlijk tot skeletspiertrillingen en -krampen, slapeloosheid, tachycardie, verlaging van plasmakalium en verhoging van plasmaglucose. Geïnhaleerde formoterol kan, net als andere bèta-2-adrenerge agonisten, dosisgerelateerde cardiovasculaire effecten en effecten op bloedglucose en/of serumkalium veroorzaken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Voor SYMBICORT 160 mg worden deze effecten gedetailleerd beschreven in de rubriek Klinische farmacologie, farmacodynamiek, SYMBICORT (12.2).
Het gebruik van LABA-medicijnen kan leiden tot tolerantie voor bronchoprotectieve en bronchusverwijdende effecten.
Rebound bronchiale hyperreactiviteit na stopzetting van chronische langwerkende bèta-agonisttherapie is niet waargenomen.
Farmacokinetiek
SYMBICORT
Absorptie
Budesonide
Gezonde onderwerpen
Oraal geïnhaleerd budesonide wordt snel in de longen geabsorbeerd en de piekconcentratie wordt doorgaans binnen 20 minuten bereikt. Na orale toediening van budesonide werd de piekplasmaconcentratie bereikt in ongeveer 1 tot 2 uur en de absolute systemische beschikbaarheid was 6%-13% vanwege het uitgebreide first-pass-metabolisme. Daarentegen werd het grootste deel van het budesonide dat in de longen werd afgegeven, systemisch geabsorbeerd. Bij gezonde proefpersonen werd 34% van de afgemeten dosis in de longen afgezet (zoals bepaald door middel van de plasmaconcentratiemethode en met behulp van een budesonide-bevattende droge poederinhalator) met een absolute systemische beschikbaarheid van 39% van de afgemeten dosis.
Na toediening van SYMBICORT 160/4.5, tweemaal daags twee of vier inhalaties gedurende 5 dagen bij gezonde proefpersonen, nam de plasmaconcentratie van budesonide over het algemeen evenredig met de dosis toe. De accumulatie-index voor de groep die tweemaal daags 2 inhalaties kreeg, was 1,32 voor budesonide.
Astmapatiënten
In een onderzoek met een enkelvoudige dosis werden hogere dan aanbevolen doses SYMBICORT (12 inhalaties van SYMBICORT 160/4,5) toegediend aan patiënten met matige astma. Een piekplasmaconcentratie van budesonide van 4,5 nmol/L trad op 20 minuten na toediening. Deze studie toonde aan dat de totale systemische blootstelling aan budesonide van SYMBICORT 4,5 mcg ongeveer 30% lager was dan van geïnhaleerde budesonide via een droogpoederinhalator (DPI) bij dezelfde afgegeven dosis. Na toediening van SYMBICORT was de halfwaardetijd van de budesonidecomponent 4,7 uur.
In een onderzoek met herhaalde doses werd de hoogste aanbevolen dosis SYMBICORT (160/4,5, twee inhalaties tweemaal daags) toegediend aan patiënten met matige astma en gezonde proefpersonen gedurende 1 week. Een piekplasmaconcentratie van budesonide van 1,2 nmol/L trad op na 21 minuten bij astmapatiënten. De piekplasmaconcentratie van budesonide was 27% lager bij astmapatiënten dan bij gezonde proefpersonen. De totale systemische blootstelling aan budesonide was echter vergelijkbaar met die bij astmapatiënten.
Piek steady-state plasmaconcentraties van budesonide toegediend via DPI bij volwassenen met astma waren gemiddeld 0,6 en 1,6 nmol/l bij doses van respectievelijk 180 mcg en 360 mcg tweemaal daags. Bij astmatische patiënten vertoonde budesonide een lineaire toename van de AUC en Cmax met toenemende dosis na zowel enkelvoudige als herhaalde toediening van budesonide voor inhalatie.
COPD-patiënten
In een onderzoek met een enkelvoudige dosis werden 12 inhalaties van SYMBICORT 80/4,5 (totale dosis 960/54 mcg) toegediend aan patiënten met COPD. De gemiddelde piekplasmaconcentratie van budesonide van 3,3 nmol/L trad 30 minuten na toediening op. De systemische blootstelling aan budesonide was vergelijkbaar tussen SYMBICORT pMDI en gelijktijdige toediening van budesonide via een inhalator met afgemeten dosis en formoterol via een inhalator voor droog poeder (budesonide 960 mcg en formoterol 54 mcg). In hetzelfde onderzoek kreeg een open-label groep van patiënten met matige astma ook dezelfde hogere dosis SYMBICORT. Voor budesonide vertoonden COPD-patiënten een 12% hogere AUC en 10% lagere Cmax in vergelijking met astmapatiënten.
In het 6 maanden durende klinische hoofdonderzoek naar de longfunctie werden steady-state farmacokinetische gegevens van budesonide verkregen bij een subgroep van COPD-patiënten met behandelingsarmen van SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, budesonide 160 mcg, budesonide 160 mcg en formoterol 4,5 mcg samen gegeven, allemaal toegediend als 2 inhalaties tweemaal daags. De systemische blootstelling aan budesonide (AUC en Cmax) nam proportioneel toe met doses van 80 mcg tot 160 mcg en was over het algemeen vergelijkbaar tussen de 3 behandelingsgroepen die dezelfde dosis budesonide kregen (SYMBICORT 4,5 mcg pMDI 160/4,5, budesonide 160 mcg, budesonide 160 mcg en formoterol 4,5 mcg samen toegediend).
Formoterol
Formoterol via inhalatie wordt snel geabsorbeerd; piekplasmaconcentraties worden doorgaans bereikt bij de eerste plasmabemonsteringstijd, binnen 5-10 minuten na toediening. Zoals met veel geneesmiddelen voor orale inhalatie, is het waarschijnlijk dat het grootste deel van het toegediende geïnhaleerde formoterol wordt ingeslikt en vervolgens wordt geabsorbeerd uit het maagdarmkanaal.
Gezonde onderwerpen
Na toediening van SYMBICORT (160/4,5, twee of vier inhalaties tweemaal daags) gedurende 5 dagen bij gezonde proefpersonen, nam de plasmaconcentratie van formoterol over het algemeen evenredig met de dosis toe. De accumulatie-index voor de groep die tweemaal daags 2 inhalaties kreeg, was 1,77 voor formoterol.
Astmapatiënten
In een onderzoek met een enkelvoudige dosis werden hogere dan aanbevolen doses SYMBICORT (12 inhalaties van SYMBICORT 160/4,5) toegediend aan patiënten met matige astma. Piekplasmaconcentratie voor formoterol van 136 pmol trad op 10 minuten na toediening. Ongeveer 8% van de afgegeven dosis formoterol werd als onveranderd geneesmiddel in de urine teruggevonden.
In een onderzoek met herhaalde doses werd de hoogste aanbevolen dosis SYMBICORT (160/4,5, twee inhalaties tweemaal daags) toegediend aan patiënten met matige astma en gezonde proefpersonen gedurende 1 week. Bij astmapatiënten trad na 10 minuten een piekformoterolplasmaconcentratie van 28 pmol/l op. De piekplasmaconcentratie van formoterol was ongeveer 42% lager bij astmapatiënten dan bij gezonde proefpersonen. De totale systemische blootstelling aan formoterol was echter vergelijkbaar met die bij astmapatiënten.
COPD-patiënten
Na toediening van een enkelvoudige dosis van 12 inhalaties SYMBICORT 80/4,5, werd 15 minuten na toediening snel een gemiddelde piekplasmaconcentratie van formoterol van 167 pmol/L bereikt. De blootstelling aan formoterol was iets hoger (~16-18%) van SYMBICORT 160 mg pMDI in vergelijking met gelijktijdige toediening van budesonide via een inhalator met afgemeten dosis en formoterol via een inhalator voor droog poeder (totale dosis budesonide 960 mcg en formoterol 54 mcg). In hetzelfde onderzoek kreeg een open-labelgroep van patiënten met matige astma dezelfde dosis SYMBICORT. COPD-patiënten vertoonden 12-15% hogere AUC en Cmax voor formoterol in vergelijking met astmapatiënten.
In het 6 maanden durende klinische hoofdonderzoek naar de longfunctie werden steady-state farmacokinetische gegevens van formoterol verkregen bij een subgroep van COPD-patiënten met behandelingsarmen van SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, formoterol 4,5 mcg, budesonide 160 mcg en formoterol 4,5 mcg samen gegeven, allemaal toegediend als 2 inhalaties tweemaal daags. De systemische blootstelling aan formoterol, zoals aangetoond door de AUC, was ongeveer 30% en 16% hoger in de behandelarm met SYMBICORT pMDI in vergelijking met de behandelarm met alleen formoterol en gelijktijdige toediening van respectievelijk de afzonderlijke componenten van budesonide en de behandelarm met formoterol.
Verdeling
Budesonide
Het distributievolume van budesonide was ongeveer 3 l/kg. Het was voor 85% -90% gebonden aan plasma-eiwitten. Eiwitbinding was constant over het concentratiebereik (1-100 nmol/L) dat werd bereikt met, en overschreed, de aanbevolen inhalatiedoses. Budesonide vertoonde weinig of geen binding aan corticosteroïdbindend globuline. Budesonide kwam snel in evenwicht met rode bloedcellen op een concentratieonafhankelijke manier met een bloedplasmaverhouding van ongeveer 0,8.
Formoterol
Over het concentratiebereik van 10-500 nmol/L was de plasma-eiwitbinding voor de RR- en SS-enantiomeren van formoterol respectievelijk 46% en 58%. De concentraties van formoterol die werden gebruikt om de plasma-eiwitbinding te beoordelen, waren hoger dan de concentraties die in plasma werden bereikt na inhalatie van een enkele dosis van 54 mcg.
Metabolisme
Budesonide
In vitro-onderzoeken met humane leverhomogenaten hebben aangetoond dat budesonide snel en uitgebreid werd gemetaboliseerd. Twee belangrijke metabolieten gevormd via door cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4) gekatalyseerde biotransformatie zijn geïsoleerd en geïdentificeerd als 16α-hydroxyprednisolon en 6ß-hydroxybudesonide. De corticosteroïdactiviteit van elk van deze twee metabolieten was minder dan 1% van die van de moederverbinding. Er werden geen kwalitatieve verschillen tussen de in vitro en in vivo metabole patronen gedetecteerd. Verwaarloosbare metabole inactivatie werd waargenomen in humane long- en serumpreparaten.
Formoterol
Het primaire metabolisme van formoterol vindt plaats door directe glucuronidering en door O-demethylering gevolgd door conjugatie aan inactieve metabolieten. Secundaire metabole routes omvatten deformylering en sulfaatconjugatie. Van CYP2D6 en CYP2C is vastgesteld dat ze primair verantwoordelijk zijn voor odemethylering.
Eliminatie
Budesonide
Budesonide werd uitgescheiden in de urine en feces in de vorm van metabolieten. Ongeveer 60% van een intraveneuze radioactief gelabelde dosis werd teruggevonden in de urine.
Er werd geen onveranderd budesonide in de urine aangetroffen. De 22R-vorm van budesonide werd bij voorkeur geklaard door de lever met een systemische klaring van 1,4 l/min versus 1,0 l/min voor de 22S-vorm. De terminale halfwaardetijd, 2 tot 3 uur, was hetzelfde voor beide epimeren en was onafhankelijk van de dosis.
Formoterol
De uitscheiding van formoterol werd onderzocht bij vier gezonde proefpersonen na gelijktijdige toediening van radioactief gelabeld formoterol via de orale en IV-route. In die studie werd 62% van het radioactief gelabelde formoterol uitgescheiden in de urine, terwijl 24% werd uitgescheiden in de feces.
Speciale populaties
geriatrische
De farmacokinetiek van SYMBICORT 4,5 mcg bij geriatrische patiënten is niet specifiek onderzocht.
pediatrisch
De plasmaconcentraties van budesonide werden gemeten na toediening van vier inhalaties van SYMBICORT 160/4.5 in een onderzoek met een enkele dosis bij pediatrische patiënten met astma in de leeftijd van 6 tot jonger dan 12 jaar. Piekconcentraties van budesonide van 1,4 nmol/L traden op 20 minuten na de dosis op. Deze studie toonde ook aan dat de totale systemische blootstelling aan budesonide van SYMBICORT 4,5 mcg ongeveer 30% lager was dan van geïnhaleerde budesonide via een inhalator voor droog poeder die ook werd beoordeeld bij dezelfde afgegeven dosis. De dosisgenormaliseerde Cmax en AUC0-inf van budesonide na inhalatie van een enkelvoudige dosis bij kinderen van 6 tot 12 jaar waren numeriek lager dan die waargenomen bij volwassenen.
Na 2 inhalaties van SYMBICORT 160/4,5 tweemaal daags behandeling waren de Cmax en AUC0-6 van formoterol bij steady state bij kinderen van 6 tot jonger dan 12 jaar vergelijkbaar met die waargenomen bij volwassenen.
Geslacht/ras
Er zijn geen specifieke onderzoeken uitgevoerd om de effecten van geslacht en ras op de farmacokinetiek van SYMBICORT te onderzoeken. Populatie-farmacokinetische analyse van de SYMBICORT-gegevens van 4,5 mcg geeft aan dat geslacht geen invloed heeft op de farmacokinetiek van budesonide en formoterol. Er kunnen geen conclusies worden getrokken over het effect van ras vanwege het lage aantal niet-blanken dat op PK is beoordeeld.
Moeders die borstvoeding geven
De dispositie van budesonide bij toediening door inhalatie van een droogpoederinhalator in doses van 200 of 400 mcg tweemaal daags gedurende ten minste 3 maanden werd bestudeerd bij acht zogende vrouwen met astma van 1 tot 6 maanden postpartum. De systemische blootstelling aan budesonide bij deze vrouwen lijkt vergelijkbaar te zijn met die bij niet-lacterende vrouwen met astma uit andere onderzoeken. Moedermelk die meer dan acht uur na de dosis werd verkregen, toonde aan dat de maximale concentratie budesonide voor de totale dagelijkse doses van 400 en 800 mcg respectievelijk 0,39 en 0,78 nmol/L was en binnen 45 minuten na toediening optrad. De geschatte orale dagelijkse dosis budesonide uit de moedermelk voor de zuigeling is ongeveer 0,007 en 0,014 mcg/kg/dag voor de twee doseringsschema's die in dit onderzoek zijn gebruikt, wat overeenkomt met ongeveer 0,3% tot 1% van de dosis die door de moeder wordt geïnhaleerd. Budesonidespiegels in plasmamonsters verkregen van vijf zuigelingen ongeveer 90 minuten na borstvoeding (en ongeveer 140 minuten na toediening van het geneesmiddel aan de moeder) waren lager dan kwantificeerbare niveaus ( Gebruik bij specifieke populaties ].
Nier- of leverinsufficiëntie
Er zijn geen gegevens over het specifieke gebruik van SYMBICORT bij patiënten met lever- of nierinsufficiëntie. Een verminderde leverfunctie kan de eliminatie van corticosteroïden beïnvloeden. De farmacokinetiek van budesonide werd beïnvloed door een gecompromitteerde leverfunctie, zoals blijkt uit een verdubbelde systemische beschikbaarheid na orale inname. De intraveneuze farmacokinetiek van budesonide was echter vergelijkbaar bij cirrosepatiënten en bij gezonde proefpersonen. Specifieke gegevens met formoterol zijn niet beschikbaar, maar omdat formoterol voornamelijk wordt geëlimineerd via levermetabolisme, kan een verhoogde blootstelling worden verwacht bij patiënten met ernstige leverinsufficiëntie.
Geneesmiddel-geneesmiddelinteracties
Er is een cross-overonderzoek met een enkelvoudige dosis uitgevoerd om de farmacokinetiek van acht inhalaties van de volgende te vergelijken: budesonide, formoterol en budesonide plus formoterol gelijktijdig toegediend. De resultaten van het onderzoek gaven aan dat er geen bewijs was van een farmacokinetische interactie tussen de twee componenten van SYMBICORT.
Remmers van cytochroom P450-enzymen
Ketoconazol
Ketoconazol, een sterke remmer van cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4), het belangrijkste metabolische enzym voor corticosteroïden, verhoogde de plasmaspiegels van oraal ingenomen budesonide.
cimetidine
Bij de aanbevolen doses had cimetidine, een niet-specifieke remmer van CYP-enzymen, een licht maar klinisch onbeduidend effect op de farmacokinetiek van oraal budesonide.
Er zijn geen specifieke geneesmiddelinteractiestudies met formoterol uitgevoerd.
Dierlijke toxicologie en/of farmacologie
preklinisch
Onderzoek bij laboratoriumdieren (minivarkens, knaagdieren en honden) heeft het optreden van hartritmestoornissen en plotselinge dood (met histologisch bewijs van myocardiale necrose) aangetoond wanneer bèta-agonisten en methylxanthinen gelijktijdig worden toegediend. De klinische betekenis van deze bevindingen is niet bekend.
Klinische studies
Astma
Patiënten met astma van 12 jaar en ouder
In twee klinische onderzoeken waarin SYMBICORT 4,5 mcg werd vergeleken met de afzonderlijke componenten, waren de verbeteringen in de meeste werkzaamheidseindpunten groter met SYMBICORT dan met het gebruik van budesonide of formoterol alleen. Bovendien liet één klinisch onderzoek vergelijkbare resultaten zien tussen SYMBICORT en het gelijktijdig gebruik van budesonide en formoterol in overeenkomstige doses uit afzonderlijke inhalatoren.
De veiligheid en werkzaamheid van SYMBICORT 160 mg werden aangetoond in twee gerandomiseerde, dubbelblinde, placebogecontroleerde klinische onderzoeken in de VS met 1076 patiënten van 12 jaar en ouder. Vaste SYMBICORT-doseringen van 160/9 mcg en 320/9 mcg tweemaal daags (elke dosis toegediend als 2 inhalaties van respectievelijk de sterktes 80/4,5 en 160/4,5 mcg) werden vergeleken met de monocomponenten (budesonide en formoterol) en placebo om informatie verstrekken over de juiste dosering om een reeks astma-ernst te dekken.
Studie 1: Klinische studie met SYMBICORT 160/4,5
In deze 12 weken durende studie werden 596 patiënten van 12 jaar en ouder geëvalueerd door SYMBICORT 160/4,5, de vrije combinatie van budesonide 160 mcg plus formoterol 4,5 mcg in afzonderlijke inhalatoren, budesonide 160 mcg, formoterol 4,5 mcg en placebo te vergelijken; elk toegediend als 2 inhalaties tweemaal daags. De studie omvatte een aanloopperiode van 2 weken met budesonide 80 mcg, 2 inhalaties tweemaal daags. De meeste patiënten hadden matige tot ernstige astma en gebruikten matige tot hoge doses inhalatiecorticosteroïden voorafgaand aan deelname aan het onderzoek. Randomisatie werd gestratificeerd naar eerdere behandeling met inhalatiecorticosteroïden (71,6% bij matige en 28,4% bij hooggedoseerde inhalatiecorticosteroïden). Het gemiddelde percentage voorspelde FEV1 bij baseline was 68,1% en was vergelijkbaar in alle behandelingsgroepen. De co-primaire eindpunten voor werkzaamheid waren het gemiddelde van 12 uur na de dosis FEV1 in week 2 en het gemiddelde van de FEV1 vóór de dosis in de loop van het onderzoek. De studie vereiste ook dat patiënten die voldeden aan een vooraf gedefinieerd astma-verergerend criterium, moesten worden teruggetrokken. De vooraf gedefinieerde astmaverergerende criteria waren een klinisch belangrijke afname van FEV1 of PEF, toename van het gebruik van albuterol als noodmedicatie, 's nachts wakker worden vanwege astma, noodinterventie of ziekenhuisopname vanwege astma, of behoefte aan astmamedicatie die niet is toegestaan door het protocol. Voor het criterium 's nachts wakker worden als gevolg van astma, mochten patiënten naar goeddunken van de onderzoeker in het onderzoek blijven als aan geen van de andere astmaverergerende criteria was voldaan. Het percentage patiënten dat zich terugtrekt vanwege of voldoet aan vooraf gedefinieerde criteria voor verergering van astma wordt weergegeven in Tabel 4.
De gemiddelde procentuele verandering ten opzichte van de uitgangswaarde in FEV1 gemeten direct voorafgaand aan de dosering (pre-dosis) gedurende 12 weken wordt weergegeven in figuur 1. Omdat deze studie vooraf gedefinieerde ontwenningscriteria gebruikte voor verergering van astma, wat een differentieel ontwenningspercentage in de behandelingsgroepen veroorzaakte, dosis FEV1-resultaten bij het laatst beschikbare studiebezoek (einde van de behandeling, EOT) worden ook verstrekt. Patiënten die SYMBICORT 160/4,5 kregen, hadden aan het einde van de behandeling significant grotere gemiddelde verbeteringen ten opzichte van baseline in FEV1 vóór de dosis (0,19 l, 9,4%), vergeleken met budesonide 160 mcg (0,10 l, 4,9%), formoterol 4,5 mcg (-0,12). L, -4,8% en placebo (-0,17 L, -6,9%).
Figuur 1: Gemiddelde procentuele verandering vanaf baseline in FEV1 vóór dosis gedurende 12 weken (onderzoek 1)
PATIËNT INFORMATIE
SYMBICORT (SIM-bi-kort) (budesonide 80 mcg en formoterolfumaraat dihydraat 4,5 mcg) Inademing Aerosol
SYMBICORT (SIM-bi-kort) (budesonide 160 mcg en formoterolfumaraat dihydraat 4,5 mcg) Inademing Aerosol
Wat is SYMBICORT?
SYMBICORT combineert een geneesmiddel voor inhalatiecorticosteroïden (ICS), budesonide en een langwerkend geneesmiddel voor bèta-2-adrenerge agonisten (LABA), formoterol.
- Inhalatiecorticosteroïden helpen ontstekingen in de longen te verminderen. Ontsteking in de longen kan leiden tot ademhalingsproblemen.
- LABA-geneesmiddelen worden gebruikt bij mensen met chronische obstructieve longziekte (COPD) en astma. LABA-medicijnen helpen de spieren rond de luchtwegen in uw longen ontspannen te blijven om symptomen zoals piepende ademhaling, hoesten, beklemming op de borst en kortademigheid te voorkomen. Deze symptomen kunnen optreden wanneer de spieren rond de luchtwegen zich aanspannen. Dit maakt het moeilijk om te ademen. In ernstige gevallen kan piepende ademhaling uw ademhaling stoppen en tot de dood leiden als het niet meteen wordt behandeld.
SYMBICORT 4,5mcg wordt niet gebruikt om plotselinge ademhalingsproblemen te verlichten en is geen vervanging voor een noodinhalator. SYMBICORT wordt als volgt gebruikt voor astma en COPD:
- Astma: SYMBICORT wordt gebruikt om de symptomen van astma onder controle te houden en om symptomen zoals piepende ademhaling te voorkomen bij volwassenen en kinderen van 6 jaar en ouder. SYMBICORT 4,5 mcg bevat formoterol. LABA-geneesmiddelen zoals formoterol verhogen, wanneer ze alleen worden gebruikt, het risico op overlijden en ziekenhuisopnames door astmaproblemen. SYMBICORT bevat een ICS en een LABA. Wanneer een ICS en LABA samen worden gebruikt, is er geen significant verhoogd risico op ziekenhuisopnames en overlijden door astmaproblemen. SYMBICORT 160 mg is niet voor volwassenen en kinderen met astma die goed onder controle zijn met een astma-controlegeneesmiddel, zoals een lage tot gemiddelde dosis van een ICS. SYMBICORT 160 mg is voor volwassenen en kinderen met astma die zowel een ICS- als een LABA-medicijn nodig hebben. Het is niet bekend of SYMBICORT veilig en effectief is bij kinderen jonger dan 6 jaar met astma.
- COPD: COPD is een langdurige (chronische) longziekte die chronische bronchitis, emfyseem of beide omvat. SYMBICORT 160/4,5 mcg wordt langdurig gebruikt, als 2 inhalaties 2 keer per dag, om de symptomen van COPD te verbeteren voor een betere ademhaling en om het aantal opflakkeringen te verminderen (de verergering van uw COPD-symptomen gedurende meerdere dagen).
Gebruik SYMBICORT niet:
- om plotselinge ernstige symptomen van astma of COPD te behandelen.
- als u allergisch bent voor een van de bestanddelen van SYMBICORT. Zie het einde van deze bijsluiter voor een lijst van ingrediënten in SYMBICORT.
Vertel uw zorgverlener voordat u SYMBICORT gebruikt over al uw medische aandoeningen, ook als u:
- hartproblemen hebben.
- hoge bloeddruk hebben.
- epileptische aanvallen hebben.
- schildklierproblemen hebben.
- suikerziekte hebben.
- leverproblemen hebben.
- osteoporose hebben.
- een probleem met het immuunsysteem hebben.
- oogproblemen heeft zoals verhoogde druk in het oog, glaucoom of staar.
- zijn allergisch voor medicijnen.
- elk type virale, bacteriële, schimmel- of parasitaire infectie heeft.
- worden blootgesteld aan waterpokken of mazelen.
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of SYMBICORT 4,5 mcg schadelijk kan zijn voor uw ongeboren baby.
- zijn borstvoeding. Budesonide, een van de actieve ingrediënten in SYMBICORT, gaat over in de moedermelk. U en uw zorgverlener moeten beslissen of u SYMBICORT 160 mg inneemt terwijl u borstvoeding geeft.
Vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. SYMBICORT en bepaalde andere geneesmiddelen kunnen met elkaar interageren. Dit kan ernstige bijwerkingen veroorzaken. Vertel het vooral aan uw zorgverlener als u antischimmel- of hiv-geneesmiddelen gebruikt.
Ken alle medicijnen die u gebruikt. Houd een lijst bij en toon deze aan uw zorgverlener en apotheker elke keer dat u een nieuw geneesmiddel krijgt.
Hoe moet ik SYMBICORT gebruiken?
Zie de stapsgewijze instructies voor het gebruik van SYMBICORT aan het einde van deze bijsluiter voor patiënten. Gebruik SYMBICORT 4,5mcg niet tenzij uw zorgverlener u dat heeft geleerd en u alles begrijpt. Vraag uw zorgverlener of apotheker om advies als u vragen heeft.
- Gebruik SYMBICORT precies zoals voorgeschreven. Gebruik SYMBICORT 160 mg niet vaker dan is voorgeschreven. SYMBICORT wordt geleverd in 2 sterktes. Uw zorgverlener heeft de sterkte voorgeschreven die voor u het beste is. Let op de verschillen tussen SYMBICORT en uw andere inhalatiemedicatie, inclusief de verschillen in voorgeschreven gebruik en fysieke verschijning.
- Kinderen moeten SYMBICORT gebruiken met de hulp van een volwassene, volgens de instructies van de zorgverlener van het kind.
- SYMBICORT 160 mg moet elke dag worden ingenomen als 2 pufjes 's ochtends en 2 pufjes 's avonds met een tussenpoos van ongeveer 12 uur.
- Als u een dosis SYMBICORT 160 mg overslaat, moet u uw volgende dosis op hetzelfde tijdstip innemen als u normaal doet.
- Spoel uw mond met water en spuug het water uit na elke dosis (2 pufjes) SYMBICORT. Slik het water niet door. Dit zal helpen om de kans op het krijgen van een schimmelinfectie (spruw) in de mond en keel te verkleinen.
- Als u te veel SYMBICORT heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ga naar de eerstehulpafdeling van het dichtstbijzijnde ziekenhuis als u ongebruikelijke symptomen heeft, zoals verergering van kortademigheid, pijn op de borst, verhoogde hartslag of beverigheid.
- Spuit SYMBICORT 4,5 mcg niet in uw ogen. Als u per ongeluk SYMBICORT 160 mg in uw ogen krijgt, spoel uw ogen dan met water en raadpleeg uw arts als de roodheid of irritatie aanhoudt.
- Verander of stop geen geneesmiddelen die worden gebruikt om uw ademhalingsproblemen onder controle te houden of te behandelen. Uw zorgverlener zal uw medicijnen wijzigen als dat nodig is.
- Terwijl u SYMBICORT 2 keer per dag gebruikt, mag u om welke reden dan ook geen andere geneesmiddelen gebruiken die een LABA bevatten. Vraag uw zorgverlener of apotheker of een van uw andere geneesmiddelen LABA-geneesmiddelen zijn.
- SYMBICORT 4,5 mcg verlicht geen plotselinge symptomen. Zorg dat u altijd een reddingsinhalator bij u heeft om plotselinge symptomen te behandelen. Als u geen noodinhalator heeft, neem dan contact op met uw zorgverlener om er een voor u voorgeschreven te krijgen.
- Bel uw zorgverlener of zoek meteen medische hulp als:
- uw ademhalingsproblemen verergeren met SYMBICORT.
- u moet uw rescue-inhalator vaker gebruiken dan normaal.
- uw rescue-inhalatorgeneesmiddel werkt niet zo goed voor u bij het verlichten van symptomen.
- uw piekdebietmeterresultaten nemen af. Uw zorgverlener zal u de nummers vertellen die bij u passen.
- uw symptomen verbeteren niet na regelmatig gebruik van SYMBICORT 160 mg gedurende 1 week.
Wat zijn de mogelijke bijwerkingen van SYMBICORT?
SYMBICORT 4.5mcg kan ernstige bijwerkingen veroorzaken, waaronder:
- Het gebruik van te veel van een LABA-medicijn kan leiden tot:
- pijn op de borst
- verhoogde bloeddruk
- een snelle en onregelmatige hartslag
- hoofdpijn
- tremor
- nervositeit
- Schimmelinfectie in uw mond of keel (spruw). Spoel uw mond met water zonder te slikken na gebruik van SYMBICORT 4.5mcg om uw kans op spruw te verminderen.
- Longontsteking en andere lagere luchtweginfecties. Mensen met COPD hebben een grotere kans op longontsteking en andere longinfecties. Inhalatiecorticosteroïden kunnen de kans op longontsteking vergroten. Bel uw zorgverlener als u een van deze symptomen opmerkt:
- toename van de productie van slijm (sputum)
- verandering in slijmkleur
- koorts
- rillingen
- verhoogde hoest
- verhoogde ademhalingsproblemen
- Effecten op het immuunsysteem en een grotere kans op infecties. Vertel uw zorgverlener over tekenen van infectie, zoals:
- koorts
- pijn
- pijn in het lichaam
- rillingen
- zich moe voelen
- misselijkheid
- braken
- Bijnierinsufficiëntie. Bijnierinsufficiëntie is een aandoening waarbij de bijnieren niet genoeg steroïde hormonen aanmaken. Dit kan gebeuren als u stopt met het gebruik van orale corticosteroïden en start met inhalatiecorticosteroïden.
- Verhoogde piepende ademhaling direct na inname van SYMBICORT. Zorg dat u altijd een reddingsinhalator bij u heeft om plotselinge piepende ademhaling te behandelen.
- Ernstige allergische reacties, waaronder huiduitslag, netelroos, zwelling van het gezicht, de mond en de tong, en ademhalingsproblemen. Bel uw zorgverlener of zoek medische noodhulp als u symptomen van een ernstige allergische reactie krijgt.
- Lagere botmineraaldichtheid. Dit kan gebeuren bij mensen met een grote kans op een lage botmineraaldichtheid (osteoporose). Uw zorgverlener dient u hierop te controleren tijdens de behandeling met SYMBICORT.
- Vertraagde groei bij kinderen. De groei van een kind moet regelmatig worden gecontroleerd tijdens het gebruik van SYMBICORT.
- Oogproblemen waaronder glaucoom en staar. U moet regelmatig oogonderzoeken ondergaan tijdens het gebruik van SYMBICORT.
- Zwelling van uw bloedvaten. Dit kan gebeuren bij mensen met astma. Vertel het uw zorgverlener meteen als u:
- een gevoel van spelden en naalden of
- griepachtige symptomen gevoelloosheid van uw armen of benen
- pijn en zwelling van de sinussen
- uitslag
- Verlaging van het kaliumgehalte in het bloed (hypokaliëmie).
- Verhoging van de bloedsuikerspiegel (hyperglykemie).
De meest voorkomende bijwerkingen van SYMBICORT zijn onder meer:
Mensen met astma:
- irritatie van de keel
- hoofdpijn
- bovenste luchtweginfectie
- keelpijn
- ontsteking van de slijmvliezen van de sinussen
- griep (sinusitis)
- verstopte neus
- rugpijn
- braken
- maagklachten
- spruw in de mond en keel. Spoel uw mond na gebruik met water zonder te slikken om spruw te voorkomen
Mensen met COPD:
- irritatie van de keel.
- spruw in de mond en keel. Spoel na gebruik uw mond met water zonder te slikken om spruw te voorkomen.
- infectie en ontsteking van de slijmvliezen van de luchtwegen (bronchitis).
- ontsteking van de slijmvliezen in de sinussen (sinusitis).
- bovenste luchtweginfectie.
Vertel uw zorgverlener over elke bijwerking die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van SYMBICORT.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
U kunt bijwerkingen ook melden aan AstraZeneca op 1-800-236-9933.
Hoe moet ik SYMBICORT bewaren?
- Bewaar SYMBICORT bij kamertemperatuur tussen 20 ° C en 25 ° C (68 ° F tot 77 ° F).
- Bewaar SYMBICORT met het mondstuk naar beneden.
- De inhoud van uw SYMBICORT-bus staat onder druk. De bus niet doorboren of in het vuur of de verbrandingsoven gooien. Gebruik of bewaar het niet in de buurt van hitte of open vuur. Bij opslag boven 120 °F kan de bus barsten.
- Gooi SYMBICORT 160 mg weg wanneer de teller op nul staat (“0”) of 3 maanden nadat u SYMBICORT uit het foliezakje heeft gehaald, afhankelijk van wat zich het eerst voordoet.
- Houd SYMBICORT 4,5 mcg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van SYMBICORT.
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een patiëntenbijsluiter. Gebruik SYMBICORT 4,5 mcg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef SYMBICORT niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
U kunt uw zorgverlener of apotheker om informatie vragen over SYMBICORT 4.5mcg dat is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in SYMBICORT 4.5mcg?
Actieve ingrediënten: gemicroniseerd budesonide en gemicroniseerd formoterolfumaraatdihydraat
Inactieve ingrediënten: hydrofluoralkaan (HFA 227), povidon K25 USP en polyethyleenglycol 1000 NF
Gebruiksaanwijzing
SYMBICORT (SIM-bi-kort)(budesonide 80 mcg en formoterolfumaraat dihydraat 4,5 mcg) Inademing Aerosol
SYMBICORT (SIM-bi-kort) (budesonide 160 mcg en formoterolfumaraat dihydraat 4,5 mcg) Inademing Aerosol
Figuur 1  Rechtop
Rechtop
Hoe SYMBICORT te gebruiken?
Volg de onderstaande instructies voor het gebruik van SYMBICORT. U zult het geneesmiddel inademen (inademen). Als u vragen heeft, raadpleeg dan uw arts of apotheker.
Uw SYMBICORT-inhalator klaarmaken voor gebruik
Figuur 2 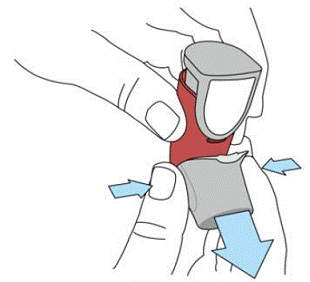
5. Uw SYMBICORT-inhalator klaarmaken
Voordat u SYMBICORT voor de eerste keer gebruikt, moet u het primen. Om SYMBICORT 160 mg te primen, houdt u het rechtop. Zie afbeelding 1. Schud de SYMBICORT 4,5 mcg-inhalator 5 seconden goed. Houd uw SYMBICORT 160 mg inhalator van u af gericht en druk stevig en volledig op de bovenkant van het aanrecht op de SYMBICORT 160 mg inhalator om een testspray vrij te geven. Schud het vervolgens opnieuw gedurende 5 seconden en laat een tweede testspray los. Uw SYMBICORT 160 mg inhalator is nu klaar voor gebruik. Nadat u de SYMBICORT-inhalator voor de eerste keer heeft geprimed, staat de teller op 120 of 60, afhankelijk van de maat die u heeft gekregen.
Als u uw SYMBICORT-inhalator langer dan 7 dagen niet gebruikt of als u hem laat vallen, moet u opnieuw primen.
Manieren om de SYMBICORT 160 mg inhalator vast te houden voor gebruik
figuur 3 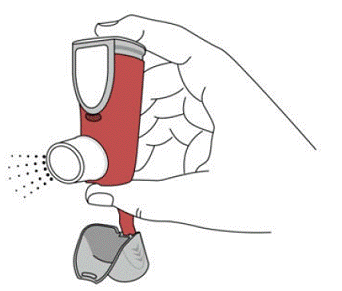
OF
Figuur 4 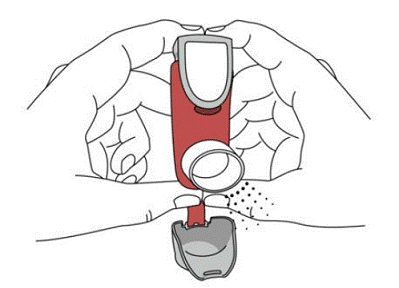
Uw SYMBICORT-inhalator gebruiken
6. Schud uw SYMBICORT 160 mg inhalator 5 seconden goed. Verwijder het beschermkapje van het mondstuk. Controleer het mondstuk op vreemde voorwerpen.
7. Adem volledig uit (uitademen). Houd de SYMBICORT-inhalator tegen uw mond. Plaats het witte mondstuk volledig in uw mond en sluit uw lippen eromheen. Zorg ervoor dat de SYMBICORT 4,5 mcg-inhalator rechtop staat en dat de opening van het mondstuk naar de achterkant van uw keel wijst (zie afbeelding 5).
Figuur 5 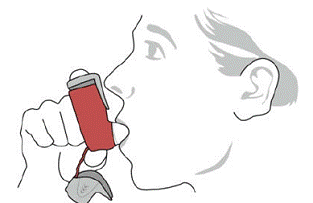
8. Adem diep en langzaam in (adem in) door je mond. Druk stevig en volledig op de bovenkant van het aanrecht op de SYMBICORT-inhalator om het geneesmiddel vrij te geven (zie afbeeldingen 3 en 4).
9. Blijf inademen (inademen) en houd je adem ongeveer 10 seconden vast, of zo lang als comfortabel is. Voordat u uitademt (uitademt), laat u uw vinger los van de bovenkant van het aanrecht. Houd de SYMBICORT-inhalator rechtop en haal hem uit uw mond.
10. Schud de SYMBICORT-inhalator nogmaals 5 seconden en herhaal stap 7 tot 9.
Na gebruik van uw SYMBICORT-inhalator
11. Sluit na gebruik het kapje van het mondstuk door erop te duwen totdat het op zijn plaats klikt.
12. Nadat u klaar bent met het innemen van SYMBICORT (2 pufjes), spoelt u uw mond met water. Spuug het water uit. Slik het niet door.
De teller lezen
- De pijl op de teller aan de bovenkant van de SYMBICORT-inhalator wijst naar het aantal inhalaties (puffen) dat nog in uw inhalator zit.
BALIE 
- De teller telt af elke keer dat u een pufje geneesmiddel afgeeft (ofwel bij het vullen van uw SYMBICORT-inhalator of bij het innemen van het geneesmiddel).
- Wanneer de pijl op de teller de 20 nadert, ziet u het begin van een geel gebied om u te laten weten dat het tijd is om uw zorgverlener te bellen voor een vulling.
BALIE 
- Het is belangrijk dat u let op het aantal inhalaties (trekjes) dat nog in uw SYMBICORT 160 mg-inhalator zit door de teller af te lezen. Gooi SYMBICORT weg wanneer de teller nul (“0”) aangeeft of 3 maanden nadat u uw SYMBICORT 160 mg inhalator uit het foliezakje heeft gehaald, afhankelijk van wat zich het eerst voordoet. Uw SYMBICORT-inhalator voelt misschien niet leeg aan en hij kan blijven werken, maar u krijgt niet de juiste hoeveelheid geneesmiddel als u hem blijft gebruiken. Gebruik een nieuwe SYMBICORT-inhalator en volg de instructies voor het primen (zie instructie 5 hierboven).
Hoe reinigt u uw SYMBICORT-inhalator?
Reinig het witte mondstuk van uw SYMBICORT 4,5 mcg-inhalator om de 7 dagen. Om het mondstuk schoon te maken:
- Verwijder het grijze mondstukkapje
- Veeg de binnen- en buitenkant van de opening van het witte mondstuk schoon met een schone, droge doek
- Vervang het mondstukkapje
- Plaats de SYMBICORT-inhalator niet in water
- Probeer uw niet uit elkaar te halen SYMBICORT inhalator
Deze patiënteninformatie en gebruiksaanwijzing zijn goedgekeurd door de Amerikaanse Food and Drug Administration.
