Spiriva 9mcg Tiotropium Bromide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Spiriva 9mcg HandiHaler en hoe wordt het gebruikt?
Spiriva HandiHaler (tiotropiumbromide) inhalatiepoeder is een anticholinergicum dat wordt gebruikt om bronchospasmen (vernauwing van de luchtwegen in de longen) te voorkomen bij mensen met bronchitis, emfyseem of COPD (chronische obstructieve longziekte).
Wat zijn bijwerkingen van Spiriva 9mcg HandiHaler?
Vaak voorkomende bijwerkingen van Spiriva 9mcg HandiHaler zijn onder meer:
- droge mond,
- constipatie,
- maagklachten,
- braken,
- verkoudheidsverschijnselen (verstopte neus, niezen, keelpijn),
- bloedneus, of
- spierpijn.
Vertel het uw arts als u ernstige bijwerkingen van Spiriva 9mcg HandiHaler heeft, waaronder:
- moeilijk of pijnlijk urineren, of
- snelle hartslag.
OMSCHRIJVING
SPIRIVA 9mcg HANDIHALER bestaat uit SPIRIVA capsules en een HANDIHALER apparaat. Elke lichtgroene, harde gelatine SPIRIVA 9 mcg capsule bevat een droog poeder bestaande uit 18 mcg tiotropium (overeenkomend met 22,5 mcg tiotropiumbromide monohydraat) gemengd met lactosemonohydraat (dat melkeiwitten kan bevatten).
De inhoud van SPIRIVA-capsules is alleen bedoeld voor orale inhalatie en is alleen bedoeld voor toediening met het HANDIHALER-apparaat.
Het actieve bestanddeel van SPIRIVA HANDIHALER is tiotropium. De geneesmiddelsubstantie, tiotropiumbromide-monohydraat, is een anticholinergicum met specificiteit voor muscarinereceptoren. Het wordt chemisch beschreven als (1α, 2β, 4β, 5α, 7β)-7-[(Hydroxydi-2-thienylacetyl)oxy]-9,9-dimethyl-3-oxa-9-azoniatricyclo[3.3.1.02,4] nonaanbromide monohydraat. Het is een synthetische, niet-chirale, quaternaire ammoniumverbinding. Tiotropiumbromide is een wit of geelachtig wit poeder. Het is matig oplosbaar in water en oplosbaar in methanol.
De structuurformule is:
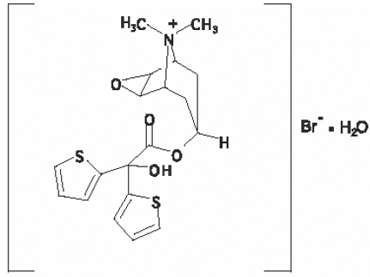
Tiotropiumbromide (monohydraat) heeft een molecuulmassa van 490,4 en de molecuulformule C19H22NO4S2Br • H2O.
Het HANDIHALER-apparaat is een inhalatieapparaat dat wordt gebruikt om het droge poeder in de SPIRIVA 9mcg-capsule te inhaleren. Het droge poeder wordt geleverd door het HANDIHALER-apparaat met een stroomsnelheid van slechts 20 l/min. Bij gestandaardiseerde in-vitrotests levert het HANDIHALER-apparaat gemiddeld 10,4 mcg tiotropium bij testen met een stroomsnelheid van 39 l/min gedurende 3,1 seconden (2 l in totaal). In een onderzoek onder 26 volwassen patiënten met COPD en ernstig aangetaste longfunctie [gemiddelde FEV1 1,02 l (bereik 0,45 tot 2,24 l); 37,6% van de voorspelde (bereik 16% tot 65%)], was de mediane piekinademingsflow (PIF) door het HANDIHALER-apparaat 30,0 l/min (bereik 20,4 tot 45,6 l/min). De hoeveelheid geneesmiddel die in de longen wordt afgegeven, is afhankelijk van patiëntfactoren zoals inademingsstroom en piekinademingsstroom door het HANDIHALER-apparaat, die van patiënt tot patiënt kan verschillen en kan variëren met de blootstellingstijd van de SPIRIVA 9mcg-capsule buiten de blisterverpakking pak.
INDICATIES
SPIRIVA HANDIHALER (tiotropiumbromide-inhalatiepoeder) is geïndiceerd voor de langdurige, eenmaal daagse, onderhoudsbehandeling van bronchospasmen geassocieerd met chronische obstructieve longziekte (COPD), waaronder chronische bronchitis en emfyseem. SPIRIVA 9mcg HANDIHALER is geïndiceerd om exacerbaties bij COPD-patiënten te verminderen.
DOSERING EN ADMINISTRATIE
Alleen voor orale inhalatie. SPIRIVA 9mcg capsules niet doorslikken, omdat de beoogde effecten op de longen dan niet worden bereikt. De inhoud van de SPIRIVA-capsules mag alleen worden gebruikt met het HANDIHALER-apparaat [zien OVERDOSERING ].
De aanbevolen dosis SPIRIVA HANDIHALER is twee inhalaties van de poederinhoud van één SPIRIVA-capsule, eenmaal daags, met het HANDIHALER-apparaat [zie PATIËNT INFORMATIE ]. Neem niet meer dan één dosis in 24 uur.
Voor toediening van SPIRIVA HANDIHALER wordt een SPIRIVA 9mcg capsule in de middelste kamer van het HANDIHALER-apparaat geplaatst. De SPIRIVA 9mcg-capsule wordt doorboord door de groene doorsteekknop aan de zijkant van het HANDIHALER-apparaat in te drukken en los te laten. De tiotropiumformulering wordt in de luchtstroom verspreid wanneer de patiënt door het mondstuk inhaleert [zie PATIËNT INFORMATIE ].
Er is geen dosisaanpassing nodig voor geriatrische, lever- of nierfunctiestoornissen. Patiënten met een matige tot ernstige nierfunctiestoornis die SPIRIVA 9mcg HANDIHALER krijgen, moeten echter nauwlettend worden gecontroleerd op anticholinerge effecten (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , Gebruik bij specifieke populaties , en KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
Inhalatie Poeder
SPIRIVA 9mcg HANDIHALER bestaat uit SPIRIVA-capsules met tiotropiumpoeder voor orale inhalatie en een HANDIHALER-apparaat. SPIRIVA 9mcg-capsules bevatten 18 mcg tiotropium in een lichtgroene, harde gelatinecapsule met aan de ene kant TI 01 bedrukt en aan de andere kant het bedrijfslogo van Boehringer Ingelheim. Het HANDIHALER-apparaat is alleen bedoeld voor gebruik met de SPIRIVA-capsules.
Opslag en behandeling
SPIRIVA HANDIHALER bestaat uit SPIRIVA 9mcg capsules en het HANDIHALER apparaat. SPIRIVA 9mcg-capsules bevatten 18 mcg tiotropium en zijn lichtgroen, met het bedrijfslogo van Boehringer Ingelheim op de SPIRIVA-capsuledop en TI 01 op de SPIRIVA-capsule, of omgekeerd.
Het HANDIHALER-apparaat is grijs gekleurd met een groene piercing-knop. Het is bedrukt met SPIRIVA HANDIHALER (tiotropiumbromide-inhalatiepoeder), het bedrijfslogo van Boehringer Ingelheim. Het is ook bedrukt om aan te geven dat SPIRIVA-capsules niet in het HANDIHALER-apparaat mogen worden bewaard en dat het HANDIHALER-apparaat alleen mag worden gebruikt met SPIRIVA 9mcg-capsules.
SPIRIVA 9mcg capsules zijn verpakt in een aluminium/aluminium blisterkaart en verbonden langs een geperforeerde lijn. SPIRIVA 9mcg-capsules moeten altijd in de blister worden bewaard en alleen onmiddellijk voor gebruik worden verwijderd. Het medicijn moet onmiddellijk worden gebruikt nadat de verpakking over een individuele SPIRIVA-capsule is geopend.
De volgende pakketten zijn beschikbaar:
- doos met 5 SPIRIVA 9mcg capsules (1 eenheidsdosis blisterkaart) en 1 HANDIHALER-inhalatieapparaat ( NDC 0597-0075-75) (instellingspakket)
- doos met 30 SPIRIVA 9mcg-capsules (3 blisterkaarten met eenheidsdosis) en 1 HANDIHALER-inhalatieapparaat ( NDC 0597-0075-41)
- doos met 90 SPIRIVA-capsules (9 blisterkaarten met eenheidsdosis) en 1 HANDIHALER-inhalatieapparaat ( NDC 0597-0075-47)
Buiten bereik van kinderen houden. Zorg dat er geen poeder in de ogen komt.
Opslag
Bewaren bij 25°C (77°F); excursies toegestaan tot 15 ° tot 30 ° C (59 ° tot 86 ° F) [zie USP-gecontroleerde kamertemperatuur].
De SPIRIVA-capsules mogen niet worden blootgesteld aan extreme temperaturen of vocht. Bewaar SPIRIVA 9mcg capsules niet in het HANDIHALER-apparaat.
Gedistribueerd door: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 VS. Herzien: februari 2018
BIJWERKINGEN
De volgende bijwerkingen worden beschreven, of in meer detail beschreven, in andere rubrieken:
- Onmiddellijke overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Paradoxaal bronchospasme [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verergering van nauwekamerhoekglaucoom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verslechtering van urineretentie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kan de incidentie van bijwerkingen die zijn waargenomen in de klinische onderzoeken van een geneesmiddel niet direct worden vergeleken met de incidenties in de klinische onderzoeken van een ander geneesmiddel en komt deze mogelijk niet overeen met de incidenties die in de praktijk zijn waargenomen.
Proefperiode van 6 maanden tot 1 jaar
De hieronder beschreven gegevens weerspiegelen de blootstelling aan SPIRIVA 9mcg HANDIHALER bij 2663 patiënten. SPIRIVA 9mcg HANDIHALER werd onderzocht in twee 1-jarige placebogecontroleerde onderzoeken, twee 1-jarige actief-gecontroleerde onderzoeken en twee 6-maanden placebogecontroleerde onderzoeken bij patiënten met COPD. In deze onderzoeken werden 1308 patiënten behandeld met SPIRIVA HANDIHALER in de aanbevolen dosis van 18 mcg eenmaal per dag. De populatie had een leeftijd variërend van 39 tot 87 jaar met 65% tot 85% mannen, 95% blank, en had COPD met een gemiddeld pre-bronchodilatator geforceerd expiratoir volume in één seconde (FEV1), voorspeld van 39% tot 43%. Patiënten met nauwekamerhoekglaucoom, of symptomatische prostaathypertrofie of obstructie van de blaasuitgang werden uitgesloten van deze onderzoeken. Een extra proef van 6 maanden, uitgevoerd in een Veteran's Affairs-omgeving, is niet opgenomen in deze veiligheidsdatabase omdat alleen ernstige ongewenste voorvallen werden verzameld.
De meest gemelde bijwerking was een droge mond. Een droge mond was gewoonlijk mild en verdween vaak tijdens voortgezette behandeling. Andere reacties gemeld bij individuele patiënten en consistent met mogelijke anticholinerge effecten waren onder meer constipatie, tachycardie, wazig zien, glaucoom (nieuwe aanvang of verergering), dysurie en urineretentie.
Vier multicenter, 1-jarige, placebogecontroleerde en actief-gecontroleerde onderzoeken evalueerden SPIRIVA HANDIHALER bij patiënten met COPD. Tabel 1 toont alle bijwerkingen die voorkwamen met een frequentie van ≥3% in de SPIRIVA 9mcg HANDIHALER-groep in de 1-jarige placebogecontroleerde onderzoeken waarbij de percentages in de SPIRIVA HANDIHALER-groep de placebo met ≥1% overtroffen. De frequentie van overeenkomstige reacties in de ipratropium-gecontroleerde onderzoeken is ter vergelijking opgenomen.
Artritis, hoesten en griepachtige symptomen kwamen voor met een snelheid van ≥3% in de SPIRIVA 9mcg HANDIHALER-behandelingsgroep, maar waren
Andere reacties die optraden in de SPIRIVA HANDIHALER-groep met een frequentie van 1% tot 3% in de placebogecontroleerde onderzoeken, waarbij de percentages hoger waren dan die in de placebogroep, zijn onder meer:
Lichaam als geheel: allergische reactie, pijn in de benen;
Centraal en perifeer zenuwstelsel: dysfonie, paresthesie;
Maagdarmstelselaandoeningen: gastro-intestinale aandoening niet anderszins gespecificeerd (NOS), gastro-oesofageale reflux, stomatitis (inclusief ulceratieve stomatitis);
Metabole en voedingsstoornissen: hypercholesterolemie, hyperglykemie;
Aandoeningen van het bewegingsapparaat: skeletpijn;
Hartgebeurtenissen: angina pectoris (inclusief verergerde angina pectoris);
Psychiatrische stoornis: depressie; Infecties: herpes zoster;
Ademhalingsstelselaandoening (bovenste): keelontsteking;
Visiestoornis: staar.
Bovendien waren onder de bijwerkingen die werden waargenomen in de klinische onderzoeken met een incidentie van
In de 1-jarige onderzoeken nam de incidentie van droge mond, constipatie en urineweginfectie toe met de leeftijd [zie Gebruik bij specifieke populaties ].
Twee multicenter, 6 maanden durende, gecontroleerde onderzoeken evalueerden SPIRIVA 9mcg HANDIHALER bij patiënten met COPD. De bijwerkingen en de incidentiecijfers waren vergelijkbaar met die in de 1 jaar durende gecontroleerde onderzoeken.
Proefperiode van 4 jaar
De hieronder beschreven gegevens weerspiegelen de blootstelling aan SPIRIVA 9mcg HANDIHALER bij 5992 COPD-patiënten in een 4 jaar durende placebogecontroleerde studie. In deze studie werden 2986 patiënten behandeld met SPIRIVA 9mcg HANDIHALER in de aanbevolen dosis van 18 mcg eenmaal per dag. De populatie had een leeftijd van 40 tot 88 jaar, was 75% man, 90% blank en had COPD met een voorspeld gemiddeld pre-bronchodilatator FEV1-percentage van 40%. Patiënten met nauwekamerhoekglaucoom, of symptomatische prostaathypertrofie of obstructie van de blaasuitgang werden uitgesloten van deze onderzoeken. Toen de bijwerkingen werden geanalyseerd met een frequentie van ≥3% in de SPIRIVA 9mcg HANDIHALER-groep, waar de percentages in de SPIRIVA 9mcg HANDIHALER-groep ≥1% hoger waren dan placebo, inclusief bijwerkingen (SPIRIVA 9mcg HANDIHALER, placebo): faryngitis (12,5%) , 10,8%), sinusitis (6,5%, 5,3%), hoofdpijn (5,7%, 4,5%), constipatie (5,1%, 3,7%), droge mond (5,1%, 2,7%), depressie (4,4%, 3,3%) , slapeloosheid (4,4%, 3,0%) en artralgie (4,2%, 3,1%).
Aanvullende bijwerkingen
Andere niet eerder genoemde bijwerkingen die vaker werden gemeld bij COPD-patiënten die werden behandeld met SPIRIVA 9mcg HANDIHALER dan met placebo, zijn onder meer: uitdroging, huidzweer, stomatitis, gingivitis, orofaryngeale candidiasis, droge huid, huidinfectie en gewrichtszwelling.
Postmarketingervaring
Bijwerkingen zijn vastgesteld tijdens het wereldwijde gebruik van SPIRIVA HANDIHALER na de goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. Deze bijwerkingen zijn: irritatie op de toedieningsplaats (glossitis, mondzweren en faryngolaryngeale pijn), duizeligheid, dysfagie, heesheid, darmobstructie inclusief paralytische ileus, verhoogde intraoculaire druk, orale candidiasis, hartkloppingen, pruritus, tachycardie, keelirritatie en urticaria.
DRUG-INTERACTIES
Sympathicomimetica, methylxanthinen, steroïden
SPIRIVA 9mcg HANDIHALER is gelijktijdig gebruikt met kortwerkende en langwerkende sympathicomimetische (bèta-agonisten) luchtwegverwijders, methylxanthinen en orale en inhalatiesteroïden zonder toename van bijwerkingen.
Anticholinergica
Er is kans op een additieve interactie met gelijktijdig gebruikte anticholinergica. Vermijd daarom gelijktijdige toediening van SPIRIVA 9mcg HANDIHALER met andere anticholinergica-bevattende geneesmiddelen, aangezien dit kan leiden tot een toename van anticholinerge bijwerkingen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Niet voor acuut gebruik
SPIRIVA 9mcg HANDIHALER is bedoeld als een eenmaal daagse onderhoudsbehandeling voor COPD en mag niet worden gebruikt voor verlichting van acute symptomen, dwz als noodbehandeling voor de behandeling van acute episodes van bronchospasme.
Onmiddellijke overgevoeligheidsreacties
Onmiddellijke overgevoeligheidsreacties, waaronder urticaria, angio-oedeem (inclusief zwelling van de lippen, tong of keel), huiduitslag, bronchospasme, anafylaxie of jeuk, kunnen optreden na toediening van SPIRIVA 9mcg HANDIHALER. Als een dergelijke reactie optreedt, moet de behandeling met SPIRIVA 9mcg HANDIHALER onmiddellijk worden stopgezet en moeten alternatieve behandelingen worden overwogen. Gezien de vergelijkbare structuurformule van atropine als tiotropium, moeten patiënten met een voorgeschiedenis van overgevoeligheidsreacties op atropine of zijn derivaten nauwlettend worden gecontroleerd op vergelijkbare overgevoeligheidsreacties op SPIRIVA HANDIHALER. Bovendien moet SPIRIVA HANDIHALER met voorzichtigheid worden gebruikt bij patiënten met ernstige overgevoeligheid voor melkeiwitten.
Paradoxaal bronchospasme
Geneesmiddelen voor inhalatie, waaronder SPIRIVA HANDIHALER, kunnen paradoxale bronchospasmen veroorzaken. Als dit gebeurt, moet het onmiddellijk worden behandeld met een kortwerkende bèta2-agonist voor inhalatie, zoals albuterol. De behandeling met SPIRIVA HANDIHALER moet worden stopgezet en andere behandelingen moeten worden overwogen.
Verergering van smalhoekglaucoom
SPIRIVA 9mcg HANDIHALER moet met voorzichtigheid worden gebruikt bij patiënten met nauwekamerhoekglaucoom. Voorschrijvers en patiënten moeten alert zijn op tekenen en symptomen van acuut nauwekamerhoekglaucoom (bijv. oogpijn of ongemak, wazig zien, visuele halo's of gekleurde beelden in combinatie met rode ogen door conjunctivale congestie en cornea-oedeem). Instrueer patiënten om onmiddellijk een arts te raadplegen als zich een van deze tekenen of symptomen ontwikkelt.
Verslechtering van urineretentie
SPIRIVA HANDIHALER moet met voorzichtigheid worden gebruikt bij patiënten met urineretentie. Voorschrijvers en patiënten dienen alert te zijn op tekenen en symptomen van urineretentie (bijv. moeite met plassen, pijnlijk urineren), vooral bij patiënten met prostaathyperplasie of blaashalsobstructie. Instrueer patiënten om onmiddellijk een arts te raadplegen als zich een van deze tekenen of symptomen ontwikkelt.
Nierfunctiestoornis
Als geneesmiddel dat voornamelijk via de nieren wordt uitgescheiden, moeten patiënten met een matige tot ernstige nierfunctiestoornis (creatinineklaring KLINISCHE FARMACOLOGIE ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATINTINFORMATIE en gebruiksaanwijzing ).
Niet voor acuut gebruik
Instrueer patiënten dat SPIRIVA HANDIHALER een bronchodilatator voor eenmaal daags onderhoud is en niet mag worden gebruikt voor onmiddellijke verlichting van ademhalingsproblemen (dwz als noodmedicatie).
Onmiddellijke overgevoeligheidsreacties
Informeer patiënten dat anafylaxie, angio-oedeem (inclusief zwelling van de lippen, tong of keel), urticaria, huiduitslag, bronchospasme of jeuk kunnen optreden na toediening van SPIRIVA 9mcg HANDIHALER. Adviseer de patiënt om de behandeling onmiddellijk te staken en een arts te raadplegen als zich een van deze tekenen of symptomen ontwikkelt.
Paradoxaal bronchospasme
Informeer patiënten dat SPIRIVA HANDIHALER paradoxale bronchospasmen kan veroorzaken. Adviseer patiënten dat als zich paradoxale bronchospasmen voordoen, patiënten moeten stoppen met SPIRIVA HANDIHALER.
Verergering van smalhoekglaucoom
Instrueer patiënten alert te zijn op tekenen en symptomen van nauwekamerhoekglaucoom (bijv. oogpijn of ongemak, wazig zien, visuele halo's of gekleurde beelden in combinatie met rode ogen door conjunctivale congestie en cornea-oedeem). Instrueer patiënten om onmiddellijk een arts te raadplegen als zich een van deze tekenen en symptomen ontwikkelt.
Informeer patiënten dat ervoor moet worden gezorgd dat het poeder niet in de ogen komt, omdat dit wazig zien en pupilverwijding kan veroorzaken.
Aangezien duizeligheid en wazig zien kunnen optreden bij het gebruik van SPIRIVA HANDIHALER, moeten patiënten worden gewaarschuwd voor activiteiten zoals het besturen van een voertuig of het bedienen van apparaten of machines.
Verslechtering van urineretentie
Instrueer patiënten om alert te zijn op tekenen en symptomen van urineretentie (bijv. moeite met plassen, pijnlijk urineren). Instrueer patiënten om onmiddellijk een arts te raadplegen als zich een van deze tekenen of symptomen ontwikkelt.
Instructies voor het toedienen van SPIRIVA HANDIHALER
Instrueer patiënten hoe ze SPIRIVA 9mcg-capsules correct moeten toedienen met behulp van het HANDIHALER-apparaat [zie PATIËNT INFORMATIE ]. Instrueer patiënten dat SPIRIVA 9mcg-capsules alleen via het HANDIHALER-apparaat mogen worden toegediend en dat het HANDIHALER-apparaat niet mag worden gebruikt voor het toedienen van andere medicijnen. Herinner patiënten eraan dat de inhoud van SPIRIVA 9mcg-capsules alleen voor orale inhalatie zijn en niet mogen worden ingeslikt.
Instrueer patiënten om SPIRIVA 9mcg-capsules altijd in verzegelde blisterverpakkingen te bewaren en om slechts één SPIRIVA-capsule onmiddellijk voor gebruik te verwijderen, anders kan de effectiviteit ervan afnemen. Instrueer patiënten om ongebruikte extra SPIRIVA-capsules die zijn blootgesteld aan lucht weg te gooien (dwz niet bedoeld voor onmiddellijk gebruik).
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen bewijs van tumorigeniciteit waargenomen in een 104 weken durende inhalatiestudie bij ratten bij doses tiotropium tot 59 mcg/kg/dag, in een 83 weken durende inhalatiestudie bij vrouwelijke muizen bij doses tot 145 mcg/kg/dag, en in een inhalatieonderzoek van 101 weken bij mannelijke muizen met doses tot 2 mcg/kg/dag. Deze doses komen overeen met respectievelijk ongeveer 30, 40 en 0,5 maal de aanbevolen dagelijkse inhalatiedosis voor de mens (MRHDID) op basis van mcg/m2.
Tiotropiumbromide vertoonde geen bewijs van mutageniteit of clastogeniteit in de volgende tests: de bacteriële genmutatietest, de V79 Chinese hamstercelmutagenesetest, de chromosomale aberratietests in menselijke lymfocyten in vitro en micronucleusvorming bij muizen in vivo, en de ongeplande DNA-synthese in primaire rattenhepatocyten in vitro test.
Bij ratten werden afnames in het aantal corpora lutea en het percentage implantaten waargenomen bij inhalatiedoses tiotropium van 78 mcg/kg/dag of hoger (ongeveer 40 maal de MRHDID op basis van mcg/m2). Dergelijke effecten werden niet waargenomen bij 9 mcg/kg/dag (ongeveer 5 keer de MRHDID op basis van mcg/m2). De vruchtbaarheidsindex werd echter niet beïnvloed bij inhalatiedoses tot 1689 mcg/kg/dag (ongeveer 910 maal de MRHDID op basis van mcg/m2).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
De beperkte gegevens bij mensen over het gebruik van SPIRIVA 9mcg HANDIHALER tijdens de zwangerschap zijn onvoldoende om een geneesmiddelgerelateerd risico op nadelige zwangerschapsgerelateerde uitkomsten te melden. Op basis van reproductiestudies bij dieren werden geen structurele afwijkingen waargenomen wanneer tiotropium door inhalatie werd toegediend aan zwangere ratten en konijnen tijdens de periode van organogenese in doses van respectievelijk 790 en 8 keer de maximaal aanbevolen dagelijkse inhalatiedosis voor de mens (MRHDID). Verhoogd verlies na implantatie werd waargenomen bij ratten en konijnen die tiotropium kregen toegediend in maternale toxische doses van respectievelijk 430 keer en 40 keer de MRHDID [zie Gegevens ].
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Gegevens
Dierlijke gegevens
In 2 afzonderlijke embryo-foetale ontwikkelingsstudies kregen zwangere ratten en konijnen tiotropium tijdens de periode van organogenese in doses tot respectievelijk ongeveer 790 en 8 maal de MRHDID (op basis van mcg/m2 bij inhalatiedoses van 1471 en 7 mcg/kg). /dag bij respectievelijk ratten en konijnen). Er werden geen aanwijzingen voor structurele afwijkingen waargenomen bij ratten of konijnen. Bij ratten veroorzaakte tiotropium echter foetale resorptie, verlies van nest, afname van het aantal levende jongen bij de geboorte en het gemiddelde gewicht van de jongen, en een vertraging in de seksuele rijping van de jongen bij doses tiotropium van ongeveer 40 maal de MRHDID (op een mcg/m2 basis bij een maternale inhalatiedosis van 78 mcg/kg/dag). Bij konijnen veroorzaakte tiotropium een toename van post-implantatieverlies bij een tiotropiumdosis van ongeveer 430 maal de MRHDID (op basis van mcg/m2 bij een maternale inhalatiedosis van 400 mcg/kg/dag). Dergelijke effecten werden niet waargenomen bij respectievelijk ongeveer 5 en 95 keer de MRHDID (op een mcg/m2 basis bij inhalatiedoses van respectievelijk 9 en 88 mcg/kg/dag bij ratten en konijnen).
Borstvoeding
Risico Samenvatting
Er zijn geen gegevens over de aanwezigheid van tiotropium in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Tiotropium is aanwezig in melk van zogende ratten; vanwege soortspecifieke verschillen in lactatiefysiologie is de klinische relevantie van deze gegevens echter niet duidelijk [zie Gegevens ]. Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan SPIRIVA 9mcg HANDIHALER en eventuele nadelige effecten op het kind dat borstvoeding krijgt van SPIRIVA HANDIHALER of van de onderliggende maternale aandoening.
Gegevens
De verdeling van tiotropiumbromide in melk werd onderzocht na een eenmalige intraveneuze toediening van 10 mg/kg aan zogende ratten. Tiotropium en/of zijn metabolieten zijn aanwezig in de melk van zogende ratten in concentraties boven die in plasma.
Pediatrisch gebruik
SPIRIVA HANDIHALER is niet geïndiceerd voor gebruik bij kinderen. De veiligheid en werkzaamheid van SPIRIVA 9mcg HANDIHALER bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Op basis van de beschikbare gegevens is een aanpassing van de dosering van SPIRIVA HANDIHALER bij geriatrische patiënten niet gerechtvaardigd [zie: KLINISCHE FARMACOLOGIE ].
Van het totale aantal patiënten dat SPIRIVA 9mcg HANDIHALER kreeg in de 1-jarige klinische onderzoeken, waren 426
Nierfunctiestoornis
Patiënten met een matige tot ernstige nierfunctiestoornis (creatinineklaring DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
De effecten van leverinsufficiëntie op de farmacokinetiek van tiotropium zijn niet onderzocht.
OVERDOSERING
Hoge doses tiotropium kunnen leiden tot anticholinerge tekenen en symptomen. Er waren echter geen systemische anticholinerge bijwerkingen na een enkelvoudige inhalatiedosis van maximaal 282 mcg tiotropium bij 6 gezonde vrijwilligers. In een onderzoek met 12 gezonde vrijwilligers werden bilaterale conjunctivitis en droge mond waargenomen na herhaalde eenmaaldaagse inhalatie van 141 mcg tiotropium.
Behandeling van overdosering bestaat uit het staken van SPIRIVA HANDIHALER samen met het instellen van geschikte symptomatische en/of ondersteunende therapie.
Per ongeluk inslikken
Acute intoxicatie door onbedoelde orale inname van SPIRIVA-capsules is onwaarschijnlijk, aangezien het systemisch niet goed wordt geabsorbeerd.
Uit postmarketingervaring is een geval van overdosering gemeld. Van een vrouwelijke patiënt werd gemeld dat ze 30 capsules had ingeademd gedurende een periode van 2,5 dag en een veranderde mentale toestand, tremoren, buikpijn en ernstige constipatie ontwikkelde. De patiënt werd opgenomen in het ziekenhuis, de behandeling met SPIRIVA HANDIHALER werd stopgezet en de constipatie werd behandeld met een klysma. De patiënt herstelde en werd dezelfde dag ontslagen.
CONTRA-INDICATIES
SPIRIVA 9mcg HANDIHALER is gecontra-indiceerd bij patiënten met een overgevoeligheid voor tiotropium, ipratropium of enig bestanddeel van dit product [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. In klinische onderzoeken en postmarketingervaring met SPIRIVA 9mcg HANDIHALER zijn onmiddellijke overgevoeligheidsreacties gemeld, waaronder angio-oedeem (inclusief zwelling van de lippen, tong of keel), jeuk of uitslag (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Tiotropium is een langwerkend, antimuscarinemiddel, dat vaak een anticholinergicum wordt genoemd. Het heeft een vergelijkbare affiniteit met de subtypes van muscarinereceptoren, M1 tot M5. In de luchtwegen vertoont het farmacologische effecten door remming van M3-receptoren op de gladde spieren, wat leidt tot bronchodilatatie. De competitieve en omkeerbare aard van antagonisme werd aangetoond met receptoren van menselijke en dierlijke oorsprong en geïsoleerde orgaanpreparaten. In preklinische in vitro- en in vivo-onderzoeken was de preventie van methacholine-geïnduceerde bronchoconstrictie-effecten dosisafhankelijk en duurde deze langer dan 24 uur. De bronchodilatatie na inhalatie van tiotropium is voornamelijk een plaatsspecifiek effect.
farmacodynamiek
Cardiale elektrofysiologie
In een multicenter, gerandomiseerde, dubbelblinde studie met tiotropium droog poeder voor inhalatie waaraan 198 patiënten met COPD deelnamen, was het aantal proefpersonen met veranderingen ten opzichte van het basislijn-gecorrigeerde QT-interval van 30 tot 60 msec hoger in de SPIRIVA 9mcg HANDIHALER-groep in vergelijking met met placebo. Dit verschil was duidelijk bij gebruik van zowel de Bazett (QTcB) [20 (20%) patiënten vs. 12 (12%) patiënten] als Fredericia (QTcF) [16 (16%) patiënten vs. 1 (1%) patiënt] correcties van QT voor hartslag. Geen van de patiënten in beide groepen had QTcB of QTcF van >500 msec. Andere klinische onderzoeken met SPIRIVA HANDIHALER hebben geen effect van het geneesmiddel op de QTc-intervallen gedetecteerd.
Het effect van tiotropium droog poeder voor inhalatie op het QT-interval werd ook geëvalueerd in een gerandomiseerde, placebo- en positief-gecontroleerde cross-over studie bij 53 gezonde vrijwilligers. De proefpersonen kregen tiotropium droog poeder voor inhalatie 18 mcg, 54 mcg (3 maal de aanbevolen dosis) of placebo gedurende 12 dagen. ECG-beoordelingen werden uitgevoerd bij baseline en gedurende het doseringsinterval na de eerste en laatste dosis onderzoeksmedicatie. Ten opzichte van placebo was de maximale gemiddelde verandering ten opzichte van baseline in onderzoeksspecifieke QTc-interval 3,2 msec en 0,8 msec voor tiotropium droog poeder voor inhalatie 18 mcg en 54 mcg, respectievelijk. Geen enkele proefpersoon vertoonde een nieuw begin van QTc >500 msec of QTc-veranderingen vanaf baseline van ≥60 msec.
Farmacokinetiek
Tiotropium wordt toegediend door inhalatie van droog poeder. Sommige van de hieronder beschreven farmacokinetische gegevens werden verkregen met hogere doses dan aanbevolen voor therapie. Een specifiek farmacokinetisch onderzoek bij patiënten met COPD, waarbij eenmaal daags tiotropium werd geëvalueerd dat werd toegediend uit de RESPIMAT-inhalator (5 mcg) en als inhalatiepoeder (18 mcg) uit het HANDIHALER-apparaat, resulteerde in een vergelijkbare systemische blootstelling tussen de twee producten.
Absorptie
Na inhalatie van droog poeder door jonge gezonde vrijwilligers, suggereert de absolute biologische beschikbaarheid van 19,5% dat de fractie die de longen bereikt in hoge mate biologisch beschikbaar is. Orale oplossingen van tiotropium hebben een absolute biologische beschikbaarheid van 2-3%. Voedsel heeft naar verwachting geen invloed op de absorptie van tiotropium. Maximale tiotropium plasmaconcentraties werden 7 minuten na inhalatie waargenomen.
Verdeling
Tiotropium is voor 72% gebonden aan plasma-eiwit en had een distributievolume van 32 l/kg na intraveneuze toediening aan jonge gezonde vrijwilligers. Lokale concentraties in de longen zijn niet bekend, maar de wijze van toediening suggereert aanzienlijk hogere concentraties in de long. Studies bij ratten hebben aangetoond dat tiotropium niet gemakkelijk door de bloed-hersenbarrière dringt.
Eliminatie
De terminale halfwaardetijd van tiotropium bij COPD-patiënten na eenmaal daagse inhalatie van 5 mcg tiotropium was ongeveer 25 uur. De totale klaring was 880 ml/min na intraveneuze toediening bij jonge gezonde vrijwilligers. Na chronische eenmaal daagse inhalatie van droog poeder door COPD-patiënten, werd de farmacokinetische steady-state bereikt op dag 7 zonder accumulatie daarna.
Metabolisme
De mate van metabolisme is klein. Dit blijkt uit een urinaire excretie van 74% onveranderde stof na een intraveneuze dosis aan jonge gezonde vrijwilligers. Tiotropium, een ester, wordt niet-enzymatisch gesplitst in de alcohol N-methylscopine en dithienylglycolzuur, die geen van beide binden aan muscarinereceptoren.
In vitro-experimenten met humane levermicrosomen en humane hepatocyten suggereren dat een fractie van de toegediende dosis (74% van een intraveneuze dosis wordt onveranderd in de urine uitgescheiden, waarbij 25% overblijft voor metabolisme) wordt gemetaboliseerd door cytochroom P450-afhankelijke oxidatie en daaropvolgende glutathionconjugatie tot een verscheidenheid aan Fase II-metabolieten. Deze enzymatische route kan worden geremd door CYP450 2D6- en 3A4-remmers, zoals kinidine, ketoconazol en gestodeen. Zo zijn CYP450 2D6 en 3A4 betrokken bij de metabole route die verantwoordelijk is voor de eliminatie van een klein deel van de toegediende dosis. In vitro-onderzoeken met humane levermicrosomen toonden aan dat tiotropium in supratherapeutische concentraties CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 of 3A4 niet remde.
uitscheiding
Intraveneus toegediend tiotropiumbromide wordt voornamelijk onveranderd in de urine uitgescheiden (74%). Na inhalatie van droog poeder aan COPD-patiënten bij steady-state was de excretie via de urine 7% (1,3 mcg) van de onveranderde dosis gedurende 24 uur. De renale klaring van tiotropium overschrijdt de creatinineklaring, wat wijst op secretie in de urine.
Specifieke populaties
Geriatrische patiënten
Zoals verwacht voor alle geneesmiddelen die voornamelijk via de nieren worden uitgescheiden, werd het ouder worden geassocieerd met een afname van de renale klaring van tiotropium (365 ml/min bij COPD-patiënten
Nierfunctiestoornis
Na 4 weken SPIRIVA 9mcg HANDIHALER of SPIRIVA 9mcg RESPIMAT eenmaal daagse dosering bij patiënten met COPD, resulteerde een lichte nierfunctiestoornis (creatinineklaring 60-
Leverfunctiestoornis
De effecten van leverinsufficiëntie op de farmacokinetiek van tiotropium zijn niet onderzocht.
Geneesmiddelinteracties
Er is een interactieonderzoek uitgevoerd met tiotropium (14,4 mcg intraveneuze infusie gedurende 15 minuten) en cimetidine 400 mg driemaal daags of ranitidine 300 mg eenmaal daags. Gelijktijdige toediening van cimetidine met tiotropium resulteerde in een toename van 20% in de AUC0-4h, een afname van 28% in de renale klaring van tiotropium en geen significante verandering in de Cmax en de hoeveelheid uitgescheiden in de urine gedurende 96 uur. Gelijktijdige toediening van tiotropium met ranitidine had geen invloed op de farmacokinetiek van tiotropium.
Gebruikelijke gelijktijdige medicatie (langwerkende bèta-2-adrenerge agonisten (LABA), inhalatiecorticosteroïden (ICS)) die door patiënten met COPD worden gebruikt, bleken de blootstelling aan tiotropium niet te veranderen.
Klinische studies
Het klinische ontwikkelingsprogramma van SPIRIVA 9mcg HANDIHALER (tiotropiumbromide-inhalatiepoeder) bestond uit zes fase 3-onderzoeken bij 2663 COPD-patiënten (1308 kregen SPIRIVA 9mcg HANDIHALER): twee placebogecontroleerde onderzoeken van 1 jaar, twee placebogecontroleerde onderzoeken van 6 maanden studies en twee 1-jarige, ipratropium-gecontroleerde studies. Aan deze onderzoeken namen patiënten deel die een klinische diagnose COPD hadden, 40 jaar of ouder waren, een voorgeschiedenis hadden van roken van meer dan 10 pakjaren, een geforceerd expiratoir volume in één seconde (FEV1) hadden van minder dan of gelijk aan 60% of 65% van de voorspelde, en een verhouding van FEV1/FVC van minder dan of gelijk aan 0,7.
In deze onderzoeken gaf SPIRIVA HANDIHALER, eenmaal daags 's ochtends toegediend, een verbetering van de longfunctie (FEV1), met een piekeffect binnen 3 uur na de eerste dosis.
Twee aanvullende onderzoeken evalueerden exacerbaties: een 6 maanden durende, gerandomiseerde, dubbelblinde, placebo-gecontroleerde, multicenter klinische studie van 1829 COPD-patiënten in een setting van US Veterans Affairs en een 4-jarige, gerandomiseerde, dubbelblinde, placebo-gecontroleerde, multicenter, klinische studie van 5992 COPD-patiënten. Langetermijneffecten op de longfunctie en andere uitkomsten werden ook geëvalueerd in de 4-jarige multicenterstudie.
Effecten van 6 maanden tot 1 jaar op de longfunctie
In de 1 jaar durende, placebogecontroleerde onderzoeken was de gemiddelde verbetering in FEV1 na 30 minuten 0,13 liter (13%) met een piekverbetering van 0,24 liter (24%) ten opzichte van de uitgangswaarde na de eerste dosis (dag 1). Verdere verbeteringen in FEV1 en geforceerde vitale capaciteit (FVC) werden waargenomen bij een farmacodynamische steady-state die op dag 8 werd bereikt met een eenmaal daagse behandeling. De gemiddelde piekverbetering in FEV1 ten opzichte van baseline was 0,28 tot 0,31 liter (28% tot 31%), na 1 week (dag 8) eenmaal daagse behandeling. De verbetering van de longfunctie hield 24 uur aan na een enkele dosis en bleef consistent gehandhaafd gedurende de behandelperiode van 1 jaar zonder tekenen van tolerantie.
In de twee placebogecontroleerde onderzoeken van 6 maanden werden seriële spirometrische evaluaties uitgevoerd gedurende de daguren in proef A (12 uur) en beperkt tot 3 uur in proef B. De seriële FEV1-waarden gedurende 12 uur (proef A) worden weergegeven in Figuur 1. Deze onderzoeken ondersteunen verder de verbetering van de longfunctie (FEV1) met SPIRIVA 9mcg HANDIHALER, die aanhield gedurende de spirometrische observatieperiode. De werkzaamheid bleef gedurende 24 uur na toediening behouden gedurende de behandelingsperiode van 6 maanden.
Afbeelding 1: Gemiddelde FEV1 in de loop van de tijd (vóór en na toediening van onderzoeksgeneesmiddel) op dag 1 en 169 voor proef A (een placebogecontroleerd onderzoek van zes maanden)* 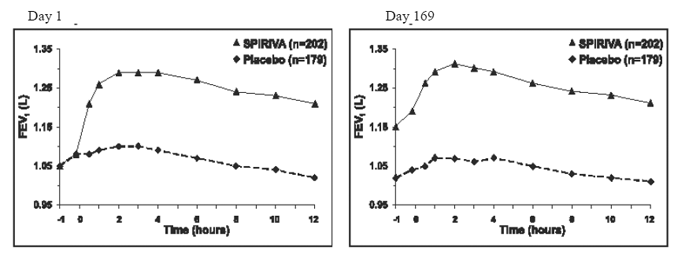
*Betekent aangepast voor centrum, behandeling en baseline-effect. Op dag 169 voltooiden in totaal 183 en 149 patiënten in respectievelijk de SPIRIVA HANDIHALER- en placebogroep de studie. De gegevens voor de overige patiënten werden geïmputeerd met behulp van de laatste observatie of de minst gunstige overgedragen observatie.
De resultaten van elk van de 1-jarige ipratropium-gecontroleerde onderzoeken waren vergelijkbaar met de resultaten van de 1-jarige placebo-gecontroleerde onderzoeken. De resultaten van een van deze proeven worden getoond in figuur 2.
Afbeelding 2: Gemiddelde FEV1 in de loop van de tijd (0 tot 6 uur na dosis) op dag 1 en 92, respectievelijk voor een van de twee door Ipratropium gecontroleerde onderzoeken* 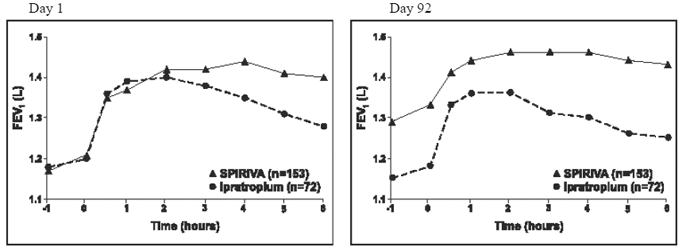
*Betekent aangepast voor centrum, behandeling en baseline-effect. Op dag 92 (primair eindpunt) voltooiden in totaal 151 en 69 patiënten in respectievelijk de SPIRIVA HANDIHALER- en ipratropium-groepen gedurende 3 maanden observatie. De gegevens voor de overige patiënten werden geïmputeerd met behulp van de laatste observatie of de minst gunstige overgedragen observatie.
Een gerandomiseerde, placebogecontroleerde klinische studie bij 105 patiënten met COPD toonde aan dat bronchodilatatie gedurende het 24-uurs doseringsinterval gehandhaafd bleef in vergelijking met placebo, ongeacht of SPIRIVA 9mcg HANDIHALER 's ochtends of' s avonds werd toegediend.
Gedurende elke week van de behandelperiode van 1 jaar in de twee placebogecontroleerde onderzoeken, hadden patiënten die SPIRIVA 9mcg HANDIHALER gebruikten een verminderde behoefte aan het gebruik van kortwerkende bèta2-agonisten. In een van de twee onderzoeken van 6 maanden werd een vermindering van het gebruik van kortwerkende bèta2-agonisten als noodoplossing aangetoond in vergelijking met placebo.
4-jarige effecten op de longfunctie
Een 4 jaar durende, gerandomiseerde, dubbelblinde, placebogecontroleerde, multicenter klinische studie met 5992 COPD-patiënten werd uitgevoerd om de langetermijneffecten van SPIRIVA HANDIHALER op de ziekteprogressie (snelheid van afname van FEV1) te evalueren. Patiënten mochten alle ademhalingsmedicatie gebruiken (inclusief kortwerkende en langwerkende bèta-agonisten, inhalatie- en systemische steroïden en theofyllines) behalve geïnhaleerde anticholinergica. De patiënten waren 40 tot 88 jaar oud, 75% man en 90% blank met een diagnose van COPD en een gemiddelde pre-bronchodilaterende FEV1 van 39% voorspeld (spreiding = 9% tot 76%) bij aanvang van het onderzoek. Er was geen verschil tussen de groepen wat betreft de co-primaire werkzaamheidseindpunten, de jaarlijkse afname van de pre- en post-bronchodilaterende FEV1, zoals aangetoond door vergelijkbare hellingen van de FEV1-afname in de tijd (Figuur 3).
SPIRIVA HANDIHALER handhaafde verbeteringen in dal (pre-dosis) FEV1 (aangepaste gemiddelden in de tijd: 87 tot 103 ml) gedurende de 4 jaar van het onderzoek (Figuur 3).
Afbeelding 3: Gemiddelde dalwaarden (pre-dosis) FEV1 op elk tijdstip 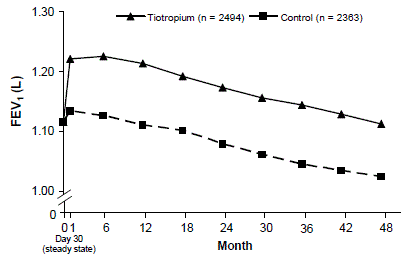
Herhaalde meting ANOVA werd gebruikt om de gemiddelden te schatten. De gemiddelden worden aangepast voor nulmetingen. Baseline dal-FEV1 (waargenomen gemiddelde) = 1,12. Patiënten met ≥ 3 acceptabele longfunctietesten na dag 30 en een niet-ontbrekende baselinewaarde werden in de analyse opgenomen.
exacerbaties
Het effect van SPIRIVA 9mcg HANDIHALER op COPD-exacerbaties werd geëvalueerd in twee klinische onderzoeken: een hierboven beschreven 4 jaar durende klinische studie en een 6 maanden durende klinische studie met 1829 COPD-patiënten in een Veterans Affairs-setting. In het 6 maanden durende onderzoek werden COPD-exacerbaties gedefinieerd als een complex van ademhalingssymptomen (toename of nieuwe aanvang) van meer dan een van de volgende: hoesten, sputum, piepende ademhaling, kortademigheid of beklemd gevoel op de borst met een duur van ten minste 3 dagen behandeling met antibiotica, systemische steroïden of ziekenhuisopname vereist. De populatie had een leeftijd variërend van 40 tot 90 jaar met 99% mannen, 91% blank, en had COPD met een gemiddeld prebronchodilaterend FEV1-percentage van 36% (bereik = 8% tot 93%). Patiënten mochten andere ademhalingsmedicatie (inclusief kortwerkende en langwerkende bèta-agonisten, inhalatie- en systemische steroïden en theofyllines) gebruiken dan anticholinergica voor inhalatie. In de 6 maanden durende studie waren de co-primaire eindpunten het percentage patiënten met COPD-exacerbatie en het percentage patiënten met ziekenhuisopname als gevolg van COPD-exacerbatie. SPIRIVA 9mcg HANDIHALER verminderde significant het aandeel COPD-patiënten dat exacerbaties ervoer in vergelijking met placebo (respectievelijk 27,9% vs. 32,3%; Odds Ratio (OR) (tiotropium/placebo) = 0,81; 95% BI = 0,66, 0,99; p = 0,037 ). Het percentage patiënten met ziekenhuisopname als gevolg van COPD-exacerbaties bij patiënten die SPIRIVA 9mcg HANDIHALER gebruikten in vergelijking met placebo was respectievelijk 7,0% vs. 9,5%; OF = 0,72; 95% BI = 0,51, 1,01; p = 0,056.
Exacerbaties werden geëvalueerd als een secundaire uitkomst in de 4-jarige multicenter-studie. In dit onderzoek werden COPD-exacerbaties gedefinieerd als een toename of nieuwe aanvang van meer dan een van de volgende ademhalingssymptomen (hoesten, sputum, sputumpurulentie, piepende ademhaling, kortademigheid) met een duur van drie of meer dagen die behandeling met antibiotica en/of systemische (orale, intramusculaire of intraveneuze) steroïden. SPIRIVA HANDIHALER verminderde het risico op een exacerbatie significant met 14% (Hazard Ratio (HR) = 0,86; 95% BI = 0,81, 0,91; p
Mortaliteit door alle oorzaken
In de hierboven beschreven 4-jarige placebogecontroleerde longfunctiestudie werd de mortaliteit door alle oorzaken vergeleken met placebo beoordeeld. Er waren geen significante verschillen in mortaliteit door alle oorzaken tussen SPIRIVA 9mcg HANDIHALER en placebo.
De mortaliteit door alle oorzaken van SPIRIVA HANDIHALER werd ook vergeleken met tiotropium-inhalatiespray 5 mcg (SPIRIVA RESPIMAT 5 mcg) in een aanvullend langdurig, gerandomiseerd, dubbelblind, dubbel-dummy actief-gecontroleerd onderzoek met een observatieperiode tot 3 jaar. De mortaliteit door alle oorzaken was vergelijkbaar tussen SPIRIVA 9mcg HANDIHALER en SPIRIVA RESPIMAT.
PATIËNT INFORMATIE
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (tiotropiumbromide) Inhalatiepoeder, voor orale inhalatie
SPIRIVA-capsules NIET doorslikken.
Belangrijke gegevens: SPIRIVA-capsules niet doorslikken. SPIRIVA 9mcg-capsules mogen alleen met het HANDIHALER-apparaat worden gebruikt en via uw mond worden ingeademd (orale inhalatie).
Lees de informatie die bij uw SPIRIVA HANDIHALER wordt geleverd voordat u hem gaat gebruiken en elke keer dat u uw recept bijvult. Mogelijk is er nieuwe informatie. Deze bijsluiter vervangt niet het praten met uw arts over uw medische toestand of uw behandeling.
Wat is SPIRIVA HANDIHALER?
- SPIRIVA HANDIHALER is een receptgeneesmiddel dat elke dag wordt gebruikt (een onderhoudsgeneesmiddel) om de symptomen van chronische obstructieve longziekte (COPD), waaronder chronische bronchitis en emfyseem, onder controle te houden.
- SPIRIVA HANDIHALER helpt uw longen 24 uur lang beter te laten werken. SPIRIVA 9mcg HANDIHALER ontspant uw luchtwegen en helpt ze open te houden. Het kan zijn dat u de eerste dag het gevoel krijgt dat u gemakkelijker kunt ademen, maar het kan langer duren voordat u de volledige effecten van het geneesmiddel voelt. SPIRIVA HANDIHALER werkt het beste en kan het gemakkelijker maken om te ademen als u het elke dag gebruikt.
- SPIRIVA 9mcg HANDIHALER vermindert de kans op opflakkeringen en verergering van COPD-symptomen (COPD-exacerbaties). Een COPD-exacerbatie wordt gedefinieerd als een toename of nieuwe aanvang van meer dan één COPD-symptoom, zoals hoesten, slijm, kortademigheid en piepende ademhaling, waarvoor medicijnen nodig zijn die verder gaan dan uw reddingsmedicijn.
SPIRIVA 9mcg HANDIHALER is geen noodmedicijn en mag niet worden gebruikt voor de behandeling van plotselinge ademhalingsproblemen. Uw arts kan u andere medicijnen geven om te gebruiken bij plotselinge ademhalingsproblemen.
Het is niet bekend of SPIRIVA 9mcg HANDIHALER veilig en effectief is bij kinderen.
Wie mag SPIRIVA 9mcg HANDIHALER niet gebruiken?
Gebruik SPIRIVA 9mcg HANDIHALER niet als u:
- allergisch bent voor tiotropium, ipratropium (Atrovent®) of voor één van de ingrediënten in SPIRIVA 9mcg HANDIHALER. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in SPIRIVA 9mcg HANDIHALER.
Symptomen van een ernstige allergische reactie op SPIRIVA 9mcg HANDIHALER kunnen zijn:
- verheven rode vlekken op uw huid (netelroos)
- jeuk
- uitslag
- zwelling van het gezicht, de lippen, de tong en de keel die ademhalings- of slikproblemen kan veroorzaken
Als u deze symptomen van een allergische reactie heeft, stop dan met het innemen van SPIRIVA HANDIHALER en bel onmiddellijk uw arts of ga naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis.
Wat moet ik mijn arts vertellen voordat ik SPIRIVA HANDIHALER gebruik?
Vertel uw arts voordat u SPIRIVA HANDIHALER gebruikt over al uw medische aandoeningen, ook als u:
- nierproblemen hebben.
- glaucoom hebben. SPIRIVA HANDIHALER kan uw glaucoom verergeren.
- een vergrote prostaat, problemen met plassen of een verstopping in uw blaas heeft. SPIRIVA 9mcg HANDIHALER kan deze problemen verergeren.
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of SPIRIVA HANDIHALER schadelijk kan zijn voor uw ongeboren baby.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of SPIRIVA HANDIHALER in de moedermelk terechtkomt. U en uw arts zullen beslissen of SPIRIVA 9mcg HANDIHALER geschikt is voor u terwijl u borstvoeding geeft.
- een ernstige allergie heeft voor melkeiwitten. Vraag uw arts als u het niet zeker weet.
Vertel uw arts over alle medicijnen die u gebruikt, inclusief geneesmiddelen op recept en zonder recept en oogdruppels, vitamines en kruidensupplementen. Sommige van uw andere geneesmiddelen of supplementen kunnen de werking van SPIRIVA HANDIHALER beïnvloeden. SPIRIVA 9mcg HANDIHALER is een anticholinergicum. U mag geen andere anticholinergica gebruiken tijdens het gebruik van SPIRIVA 9mcg HANDIHALER, waaronder ipratropium. Vraag uw arts of apotheker als u niet zeker weet of een van uw geneesmiddelen een anticholinergicum is.
Weet welke medicijnen u gebruikt. Houd een lijst van uw geneesmiddelen bij u, zodat u uw arts en apotheker kunt laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik SPIRIVA 9mcg HANDIHALER gebruiken?
- Gebruik SPIRIVA 9mcg HANDIHALER precies zoals voorgeschreven. Gebruik SPIRIVA HANDIHALER één keer per dag.
- Lees de “Gebruiksaanwijzing” aan het einde van deze bijsluiter voordat u SPIRIVA HANDIHALER gebruikt. Praat met uw arts als u de instructies niet begrijpt.
- SPIRIVA 9mcg capsules niet doorslikken.
- Gebruik alleen SPIRIVA 9mcg capsules met het HANDIHALER-apparaat.
- Gebruik het HANDIHALER-apparaat niet om een ander geneesmiddel in te nemen.
- SPIRIVA 9mcg HANDIHALER wordt geleverd als poeder in een SPIRIVA 9mcg capsule die op het HANDIHALER-apparaat past. Elke SPIRIVA-capsule, die slechts een kleine hoeveelheid SPIRIVA-poeder bevat, is één volledige dosis geneesmiddel.
- Scheid één blister van de blisterkaart. Haal dan vlak voor gebruik een van de SPIRIVA 9mcg capsules uit de blisterverpakking.
- Nadat de capsule is doorboord, neemt u een volledige dosis SPIRIVA HANDIHALER door het poeder tweemaal via de mond in te ademen met behulp van het HANDIHALER-apparaat (neem 2 inhalaties van één SPIRIVA-capsule). Zie de "Gebruiksaanwijzing" aan het einde van deze bijsluiter.
- Gooi elke SPIRIVA-capsule die niet meteen wordt gebruikt weg nadat deze uit de blisterverpakking is gehaald. Laat de SPIRIVA-capsules niet aan de lucht staan; ze werken misschien niet zo goed.
- Als u een dosis bent vergeten, neem deze dan in zodra u eraan denkt. Gebruik SPIRIVA HANDIHALER niet vaker dan één keer per 24 uur. ? Als u meer dan uw voorgeschreven dosis SPIRIVA HANDIHALER heeft gebruikt, neem dan contact op met uw arts of een antigifcentrum.
Wat moet ik vermijden bij het gebruik van SPIRIVA 9mcg HANDIHALER?
- Laat het poeder uit de SPIRIVA-capsule niet in uw ogen komen. Uw zicht kan wazig worden en de pupil in uw oog kan groter worden (verwijden). Als dit gebeurt, neem dan contact op met uw arts.
- SPIRIVA 9mcg HANDIHALER kan duizeligheid en wazig zien veroorzaken. Als u deze symptomen ervaart, moet u voorzichtig zijn bij activiteiten zoals autorijden of het bedienen van apparaten of andere machines.
Wat zijn de mogelijke bijwerkingen van SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER kan ernstige bijwerkingen veroorzaken, waaronder: Allergische reactie. Symptomen kunnen zijn:
- verheven rode vlekken op uw huid (netelroos)
- jeuk
- uitslag
- zwelling van de lippen, tong of keel die ademhalings- of slikproblemen kan veroorzaken
Als u deze symptomen van een allergische reactie heeft, stop dan met het innemen van SPIRIVA HANDIHALER en bel onmiddellijk uw arts of ga naar de dichtstbijzijnde spoedeisende hulp van het ziekenhuis.
- Plotselinge vernauwing en verstopping van de luchtwegen naar de longen (bronchospasme) . Je ademhaling wordt plotseling slechter.
Als u deze symptomen van bronchospasme heeft, stop dan met het innemen van SPIRIVA 9mcg HANDIHALER en bel onmiddellijk uw arts of ga naar de dichtstbijzijnde eerstehulpafdeling van het ziekenhuis.
- Nieuwe of verergerde verhoogde druk in de ogen (acuut nauwekamerhoekglaucoom). Symptomen van acuut nauwekamerhoekglaucoom kunnen zijn:
- oogpijn
- wazig zien
- halo's (visuele halo's) of gekleurde afbeeldingen zien samen met rode ogen
Het is mogelijk dat het niet werkt om alleen oogdruppels te gebruiken om deze symptomen te behandelen. Als u deze symptomen heeft, stop dan met het innemen van SPIRIVA HANDIHALER en bel onmiddellijk uw arts.
- Nieuwe of verslechterde urineretentie. Symptomen van een verstopping in uw blaas en/of vergrote prostaat kunnen zijn: moeite met plassen, pijnlijk urineren.
Als u deze symptomen van urineretentie heeft, stop dan met het gebruik van SPIRIVA HANDIHALER en bel onmiddellijk uw arts.
Andere bijwerkingen van SPIRIVA 9mcg HANDIHALER zijn onder meer:
- bovenste luchtweginfectie
- droge mond
- sinus infectie
- keelpijn
- niet-specifieke pijn op de borst
- urineweginfectie
- indigestie
- loopneus
- constipatie
- verhoogde hartslag
- wazig zien
Dit zijn niet alle mogelijke bijwerkingen van SPIRIVA HANDIHALER. Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe bewaar ik SPIRIVA HANDIHALER?
- Bewaar SPIRIVA-capsules niet in het HANDIHALER-apparaat.
- Bewaar SPIRIVA-capsules in de verzegelde blisterverpakking bij kamertemperatuur 20 ° C tot 25 ° C (68 ° F tot 77 ° F).
- Houd SPIRIVA-capsules uit de buurt van warmte en kou (niet invriezen).
- Bewaar SPIRIVA 9mcg capsules op een droge plaats. Gooi alle ongebruikte SPIRIVA 9mcg-capsules weg die in de lucht zijn geweest.
Vraag uw arts of apotheker om advies als u vragen heeft over het bewaren van uw SPIRIVA 9mcg capsules.
Houd SPIRIVA HANDIHALER, SPIRIVA 9mcg-capsules en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over SPIRIVA HANDIHALER
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in de patiëntenbijsluiters. Gebruik SPIRIVA 9mcg HANDIHALER niet voor een doel waarvoor het niet is voorgeschreven. Geef SPIRIVA HANDIHALER niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Neem voor meer informatie over SPIRIVA HANDIHALER contact op met uw arts. U kunt uw arts of apotheker om informatie vragen over SPIRIVA 9mcg HANDIHALER die is geschreven voor gezondheidswerkers.
Ga voor meer informatie over SPIRIVA 9mcg HANDIHALER naar www.SPIRIVA.com, scan de onderstaande code of bel Boehringer Ingelheim Pharmaceuticals, Inc. op 1-800-542-6257 of (TTY) 1-800-459-9906.
Wat zijn de ingrediënten in SPIRIVA 9mcg HANDIHALER?
Actief ingrediënt: tiotropium
Inactief ingrediënt: lactose monohydraat
Wat is COPD (chronische obstructieve longziekte)?
COPD is een ernstige longziekte die chronische bronchitis, emfyseem of beide omvat. De meeste COPD wordt veroorzaakt door roken. Als u COPD heeft, worden uw luchtwegen smal. Dus de lucht stroomt langzamer uit je longen. Dit maakt het moeilijk om te ademen.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
GEBRUIKSAANWIJZINGSPIRIVA® (speh REE vah) HANDIHALER® (tiotropiumbromide) inhalatiepoeder, voor orale inhalatie
SPIRIVA-capsules niet doorslikken.
Belangrijke informatie over het gebruik van uw SPIRIVA HANDIHALER
- SPIRIVA 9mcg capsules niet doorslikken.
- SPIRIVA-capsules mogen alleen met het HANDIHALER-apparaat worden gebruikt en via uw mond worden ingeademd (orale inhalatie).
- Gebruik uw HANDIHALER-apparaat niet om een ander geneesmiddel in te nemen.
Lees eerst de patiënteninformatie en lees vervolgens deze gebruiksaanwijzing voordat u SPIRIVA HANDIHALER gaat gebruiken en elke keer dat u uw recept opnieuw vult. Mogelijk is er nieuwe informatie.
Vertrouwd raken met uw HANDIHALER-apparaat en SPIRIVA-capsules:
Uw SPIRIVA HANDIHALER wordt geleverd met SPIRIVA 9mcg capsules in blisterverpakking en een HANDIHALER apparaat. Gebruik het nieuwe HANDIHALER-apparaat dat bij uw geneesmiddel is geleverd.
De onderdelen van uw HANDIHALER-apparaat omvatten:
(Zie afbeelding A)
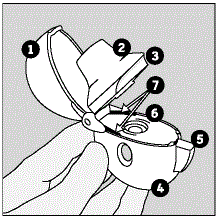
Afbeelding A
Elke SPIRIVA 9mcg capsule is verpakt in een blisterverpakking. (Zie afbeelding B)
Figuur B
- Elke SPIRIVA-capsule bevat slechts een kleine hoeveelheid poeder. (Zie afbeelding C) Dit is 1 volledige dosis.
- Open de SPIRIVA 9mcg-capsule niet of het kan niet werken.

Figuur C
Het nemen van uw volledige dagelijkse dosis geneesmiddel vereist 4 hoofdstappen.
Stap 1. Uw HANDIHALER-apparaat openen:
Nadat u uw HANDIHALER-apparaat uit het zakje heeft gehaald:
- Open de stofkap (deksel) door op de groene doorsteekknop te drukken. (Zie afbeelding D)
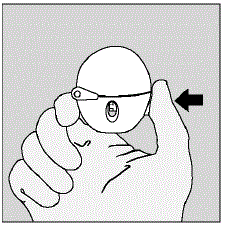
Figuur D
- Trek de stofkap (deksel) omhoog weg van de basis om het mondstuk bloot te leggen. (Zie afbeelding E)
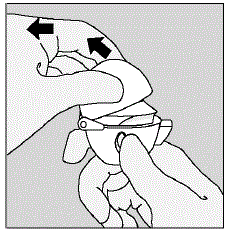
Figuur E
- Open het mondstuk door de rand van het mondstuk omhoog en weg van de basis te trekken, zodat de middelste kamer zichtbaar is. (Zie afbeelding F)

Figuur F
Stap 2. De SPIRIVA 9mcg-capsule in uw HANDIHALER-apparaat plaatsen:
Scheid elke dag slechts 1 van de blisterverpakkingen van de blisterkaart door langs de geperforeerde lijn te scheuren. (Zie afbeelding G)
Figuur G
Haal de SPIRIVA-capsule uit de blisterverpakking:
- Niet doen knip de folie door of gebruik scherpe instrumenten om de SPIRIVA-capsule uit de blisterverpakking te halen.
- Buig 1 van de blisterhoeken om met een pijl en scheid de aluminiumfolielagen.
- Trek de bedrukte folie los totdat u de hele SPIRIVA-capsule ziet. (Zie afbeelding H)
- Als u meer dan 1 blisterverpakking aan de lucht heeft geopend, mag de extra SPIRIVA 9mcg-capsule niet worden gebruikt en moet deze worden weggegooid.
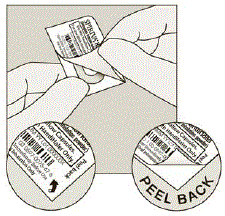
figuur H
Plaats de SPIRIVA 9mcg-capsule in de middelste kamer van uw HANDIHALER-apparaat. (Zie afbeelding I)
Figuur I
Sluit het mondstuk stevig tegen de grijze basis totdat u een klik hoort. Laat de stofkap (deksel) open staan. (Zie afbeelding J)
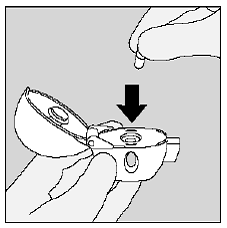
figuur J
Stap 3. Piercing van de SPIRIVA 9mcg capsule:
- Houd uw HANDIHALER-apparaat met het mondstuk naar boven gericht. (Zie afbeelding K)
- Druk eenmaal op de groene doorsteekknop totdat deze plat (flush) tegen de basis ligt en laat dan los. Zo maak je gaatjes in de SPIRIVA capsule zodat je je medicijn krijgt als je inademt.
- Niet doen druk meer dan één keer op de groene knop.
- Niet doen schud uw HANDIHALER-apparaat.
- De piercing van de SPIRIVA 9mcg capsule kan kleine produceren gelatine stukjes. Sommige van deze kleine stukjes kunnen door het scherm van uw HANDIHALER-apparaat in uw mond of keel terechtkomen wanneer u uw geneesmiddel inademt. Dit is normaal. De kleine stukjes gelatine mogen u geen kwaad doen.
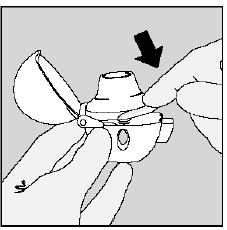
figuur K
Stap 4. Uw volledige dagelijkse dosis innemen (2 inhalaties van dezelfde SPIRIVA 9mcg-capsule):
Adem volledig uit in 1 ademhaling, je longen leegmaken van alle lucht. (Zie afbeelding L)
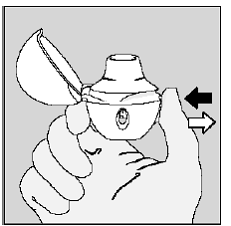
Figuur L
Belangrijk: niet doen adem in uw HANDIHALER-apparaat.
Neem bij uw volgende ademhaling uw medicijn in:
- Houd uw hoofd rechtop terwijl u recht vooruit kijkt. (Zie afbeelding M)
- Breng uw HANDIHALER-apparaat in horizontale positie naar uw mond. Niet doen de luchtinlaatopeningen blokkeren.
- Sluit uw lippen stevig rond het mondstuk.
- Adem diep in totdat je longen vol zijn. Je zou moeten hoor of voel de SPIRIVA-capsule trillen (rammelaar). (Zie afbeelding M)
- Houd uw adem enkele seconden in en haal tegelijkertijd uw HANDIHALER uit uw mond.
- Adem weer normaal.
Figuur M
De rammelaar vertelt je dat je goed hebt ingeademd. Als u geen rammelaar hoort of voelt, raadpleeg dan de rubriek “Als u de SPIRIVA-capsule niet hoort of voelt rammelen terwijl u uw geneesmiddel inademt.”
Figuur nr
Om uw volledige dagelijkse dosis te krijgen, moet u opnieuw volledig uitademen (zie afbeelding N) en voor een tweede keer inademen (zie afbeelding O) uit dezelfde SPIRIVA-capsule.
Belangrijk: niet doen druk nogmaals op de groene piercing-knop.
Figuur O
Herinneren: Om elke dag uw volledige medicijndosis te krijgen, moet u 2 keer inademen uit dezelfde SPIRIVA 9mcg-capsule. Zorg ervoor dat u elke keer volledig uitademt voordat u inademt via uw HANDIHALER-apparaat.
Onderhoud en opslag van uw SPIRIVA HANDIHALER:
Figuur P
- Open na het innemen van uw dagelijkse dosis het mondstuk en gooi de gebruikte SPIRIVA 9mcg-capsule in uw vuilnisbak, zonder deze aan te raken.
- Verwijder eventuele stukjes SPIRIVA 9mcg capsule of SPIRIVA 9mcg poederopbouw door uw HANDIHALER ondersteboven te draaien en er voorzichtig maar stevig op te tikken. (Zie afbeelding P) Sluit vervolgens het mondstuk en de stofkap om ze op te bergen.
- Niet doen bewaar uw HANDIHALER-apparaat en SPIRIVA 9mcg capsules (blisters) op een vochtige, vochtige plaats. Bewaar SPIRIVA capsules altijd in de verzegelde blisterverpakkingen.
Als u de SPIRIVA 9mcg capsule niet hoort of voelt rammelen terwijl u uw geneesmiddel inademt:
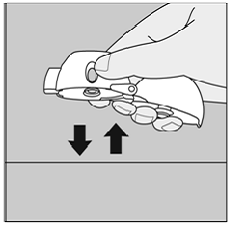
Figuur Q
Niet doen druk nogmaals op de groene piercing-knop.
Houd uw HANDIHALER-apparaat met het mondstuk naar boven gericht en tik uw HANDIHALER-apparaat zachtjes op een tafel. (Zie afbeelding Q)
Controleer of het mondstuk volledig gesloten is. Adem volledig uit voordat u weer diep inademt met het mondstuk in uw mond. (Zie afbeelding O)
Als u de SPIRIVA-capsule nog steeds niet hoort of voelt rammelen na het herhalen van de bovenstaande stappen:
- Gooi de SPIRIVA-capsule weg.
- Open de basis door de groene piercing-knop op te tillen en controleer de middelste kamer op stukjes van de SPIRIVA 9mcg-capsule. SPIRIVA 9mcg capsulestukjes in de middelste kamer kunnen ervoor zorgen dat een SPIRIVA 9mcg capsule niet rammelt.
- Draai uw HANDIHALER-apparaat ondersteboven en tik zachtjes maar stevig om de stukjes SPIRIVA-capsule te verwijderen. Bel uw arts voor instructies.
Uw HANDIHALER-apparaat reinigen:
Reinig uw HANDIHALER-apparaat indien nodig. (Zie afbeelding R)
- Het duurt 24 uur om uw HANDIHALER-apparaat aan de lucht te drogen nadat u het hebt schoongemaakt.
- Niet doen gebruik reinigingsmiddelen of wasmiddelen.
- Niet doen plaats uw HANDIHALER-apparaat in de vaatwasser voor reiniging.
Reinigingsstappen:
- Open de stofkap en het mondstuk.
- Open de basis door de groene piercing-knop op te tillen.
- Kijk in de middelste kamer naar SPIRIVA 9mcg capsulestukjes of poederopbouw. Tik uit als je het ziet.
- Spoel uw HANDIHALER-apparaat af met warm water en druk een paar keer op de groene prikknop zodat de middelste kamer en de priknaald onder stromend water staan. Controleer of eventuele poederophopingen of stukjes SPIRIVA-capsule zijn verwijderd.
- Droog uw HANDIHALER-apparaat goed af door het overtollige water op een papieren handdoek te laten vallen. Droog daarna aan de lucht, laat de stofkap, het mondstuk en de basis open door het volledig uit te spreiden zodat het volledig droogt.
- Niet doen gebruik een föhn om uw HANDIHALER-apparaat te drogen.
- Niet doen gebruik uw HANDIHALER-apparaat als het nat is. Indien nodig kunt u de buitenkant van het mondstuk reinigen met een schone, vochtige doek.
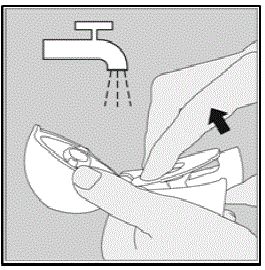
Figuur R
Handige tips om ervoor te zorgen dat u uw volledige dagelijkse dosis SPIRIVA 9mcg HANDIHALER op de juiste manier inneemt:
- druk op de groene piercing knop keer; Adem 2 keer in; Adem volledig uit vóór elk van de 2 inhalaties.
- Gebruik altijd het nieuwe HANDIHALER-apparaat dat bij uw geneesmiddel is geleverd.
- Houd uw HANDIHALER-apparaat met het mondstuk naar boven gericht wanneer u op de groene piercing-knop drukt.
- Druk 1 keer op de groene piercing-knop om de SPIRIVA-capsule te doorboren.
- Adem niet uit in uw HANDIHALER-apparaat.
- Houd uw HANDIHALER-apparaat horizontaal en houd uw hoofd rechtop, recht vooruit kijkend, wanneer u inademt.
- Controleer de middelste kamer van uw HANDIHALER-apparaat op SPIRIVA 9mcg-capsules of poederophoping. Als er stukjes of poeder worden gezien, voor gebruik uitkloppen.
- Reinig uw HANDIHALER indien nodig en droog hem grondig af.
Vraag uw arts of apotheker om meer informatie, ga naar www.spiriva.com, scan de onderstaande code of bel 1-800-542-6257 of (TTY) 1-800-459-9906.
Deze gebruiksaanwijzing is goedgekeurd door de Amerikaanse Food and Drug Administration.
