Pulmicort 100mcg, 200mcg Budesonide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Pulmicort 100mcg Turbuhaler en hoe wordt het gebruikt?
Pulmicort 100mcg Turbuhaler is een receptgeneesmiddel dat wordt gebruikt om de symptomen van astma te behandelen. Pulmicort 100mcg Turbuhaler kan alleen of in combinatie met andere medicijnen worden gebruikt.
Pulmicort Turbuhaler behoort tot een klasse geneesmiddelen die corticosteroïden, inhalatiemiddelen worden genoemd.
Het is niet bekend of Pulmicort Turbuhaler veilig en effectief is bij kinderen jonger dan 1 jaar.
Wat zijn de mogelijke bijwerkingen van Pulmicort 200mcg Turbuhaler?
Pulmicort 100mcg Turbuhaler kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- ongebruikelijke vermoeidheid,
- zichtproblemen,
- gemakkelijk blauwe plekken of bloedingen,
- opgezwollen gezicht,
- ongebruikelijke haargroei,
- stemmingswisselingen,
- depressie,
- stemmingswisselingen,
- agitatie,
- spierzwakte of pijn,
- dunner wordende huid,
- langzame wondgenezing, en
- verhoogde dorst of plassen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Pulmicort 100mcg Turbuhaler zijn:
- droge, geïrriteerde of zere keel,
- heesheid,
- stem verandert,
- slechte smaak in de mond,
- loopneus of verstopte neus, en
- neusbloedingen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Pulmicort Turbuhaler. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Alleen voor orale inhalatie.
OMSCHRIJVING
Budesonide, het actieve bestanddeel van PULMICORT TURBUHALER (budesonide) 200 mcg, is een corticosteroïde die chemisch wordt aangeduid als (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-dieen-3,20-dion cyclisch 16,17- acetaal met butyraldehyd. Budesonide wordt geleverd als een mengsel van twee epimeren (22R en 22S). De empirische formule van budesonide is C25H34O6 en het molecuulgewicht is 430,5. De structuurformule is:
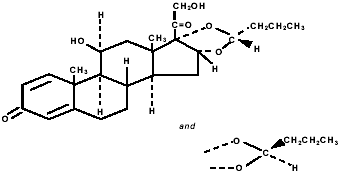
Budesonide is een wit tot gebroken wit, smaakloos, geurloos poeder dat praktisch onoplosbaar is in water en heptaan, matig oplosbaar in ethanol en vrij oplosbaar in chloroform. De verdelingscoëfficiënt tussen octanol en water bij pH 7,4 is 1,6 x 103.
PULMICORT 100mcg TURBUHALER (budesonide) is een inhalatie-aangedreven multidosis droogpoederinhalator die alleen gemicroniseerd budesonide bevat. Elke verstuiving van PULMICORT 100 mcg TURBUHALER levert 200 mcg budesonide per afgemeten dosis, wat ongeveer 160 mcg budesonide uit het mondstuk levert (gebaseerd op in vitro testen bij 60 l/min gedurende 2 seconden).
In-vitrotests hebben aangetoond dat de dosisafgifte voor PULMICORT 100mcg TURBUHALER (budesonide) in hoge mate afhankelijk is van de luchtstroom door het apparaat. Patiëntfactoren zoals inspiratoire stroomsnelheden zullen ook van invloed zijn op de dosis die bij daadwerkelijk gebruik aan de longen van patiënten wordt afgegeven (zie: Instructies voor gebruik van de patiënt ). Bij volwassen patiënten met astma (gemiddelde FEV1 2,9 l [0,8-5,1 l]) was de gemiddelde piekinademingsflow (PIF) door PULMICORT TURBUHALER (budesonide) 78 (40-111) l/min. Vergelijkbare resultaten (gemiddelde PIF 82 [43-125] l/min) werden verkregen bij astmatische kinderen (6 tot 15 jaar, gemiddelde FEV1 2,1 l [0,9-5,4 l]). Patiënten moeten zorgvuldig worden geïnstrueerd over het gebruik van dit geneesmiddel om een optimale dosisafgifte te garanderen.
INDICATIES
PULMICORT TURBUHALER (budesonide) is geïndiceerd voor de onderhoudsbehandeling van astma als profylactische therapie bij volwassen en pediatrische patiënten van zes jaar of ouder. Het is ook geïndiceerd voor patiënten die behandeling met orale corticosteroïden nodig hebben voor astma. Veel van die patiënten kunnen in de loop van de tijd hun behoefte aan orale corticosteroïden verminderen of elimineren.
PULMICORT 100mcg TURBUHALER (budesonide) is NIET geïndiceerd voor de verlichting van acute bronchospasmen.
DOSERING EN ADMINISTRATIE
PULMICORT 200mcg TURBUHALER (budesonide) moet worden toegediend via orale inhalatie bij astmatische patiënten van 6 jaar en ouder. Individuele patiënten zullen een variabel begin en mate van symptoomverlichting ervaren. Over het algemeen heeft PULMICORT TURBUHALER (budesonide) een relatief snelle werking voor een inhalatiecorticosteroïd. Verbetering van de astmacontrole na inhalatie van PULMICORT 200mcg TURBUHALER (budesonide) kan optreden binnen 24 uur na aanvang van de behandeling, hoewel het maximale voordeel mogelijk niet wordt bereikt gedurende 1 tot 2 weken of langer. De veiligheid en werkzaamheid van PULMICORT TURBUHALER (budesonide) bij toediening boven de aanbevolen doses zijn niet vastgesteld.
De aanbevolen startdosis en de hoogste aanbevolen dosis PULMICORT TURBUHALER (budesonide), gebaseerd op eerdere astmatherapie, worden vermeld in de volgende tabel.
*Bij patiënten met lichte tot matige astma die goed onder controle zijn met inhalatiecorticosteroïden, kan een dosering van PULMICORT 100 mcg TURBUHALER (budesonide) 200 mcg of 400 mcg eenmaal daags worden overwogen. PULMICORT 200mcg TURBUHALER (budesonide) kan eenmaal daags 's morgens of' s avonds worden toegediend.
Als de eenmaaldaagse behandeling met PULMICORT 200mcg TURBUHALER (budesonide) niet voldoende controle geeft over de astmasymptomen, moet de totale dagelijkse dosis worden verhoogd en/of als een verdeelde dosis worden toegediend.
Patiënten onderhouden op chronische orale corticosteroïden
Aanvankelijk moet PULMICORT TURBUHALER (budesonide) gelijktijdig worden gebruikt met de gebruikelijke onderhoudsdosis systemische corticosteroïden van de patiënt. Na ongeveer een week wordt begonnen met het geleidelijk afbouwen van de systemische corticosteroïde door de dagelijkse of alternatieve dagelijkse dosis te verlagen. De volgende verlaging vindt plaats na een interval van één of twee weken, afhankelijk van de respons van de patiënt. Over het algemeen mogen deze verlagingen niet groter zijn dan 2,5 mg prednison of het equivalent daarvan. Een langzame ontwenningssnelheid wordt sterk aanbevolen. Tijdens de vermindering van orale corticosteroïden moeten patiënten zorgvuldig worden gecontroleerd op astma-instabiliteit, inclusief objectieve metingen van de luchtwegfunctie, en op bijnierinsufficiëntie (zie WAARSCHUWINGEN ). Tijdens de ontwenning kunnen sommige patiënten symptomen van systemische ontwenning van corticosteroïden ervaren, bijv. gewrichts- en/of spierpijn, vermoeidheid en depressie, ondanks handhaving of zelfs verbetering van de longfunctie. Dergelijke patiënten moeten worden aangemoedigd om door te gaan met PULMICORT TURBUHALER (budesonide), maar moeten worden gecontroleerd op objectieve tekenen van bijnierinsufficiëntie. Als er aanwijzingen zijn voor bijnierinsufficiëntie, moeten de systemische doses corticosteroïden tijdelijk worden verhoogd en daarna moet de stopzetting langzamer worden voortgezet. Tijdens perioden van stress of een ernstige astma-aanval kunnen transferpatiënten een aanvullende behandeling met systemische corticosteroïden nodig hebben.
OPMERKING: Bij alle patiënten is het wenselijk om te titreren tot de laagste effectieve dosis zodra astma-stabiliteit is bereikt.
Gebruiksaanwijzingen
Geïllustreerde instructies voor de patiënt voor gebruik vergezel elke verpakking van PULMICORT 200mcg TURBUHALER (budesonide).
Patiënten moeten worden geïnstrueerd om PULMICORT TURBUHALER (budesonide) voor het eerste gebruik te primen en moeten worden geïnstrueerd diep en krachtig te inhaleren telkens wanneer het apparaat wordt gebruikt. Het spoelen van de mond na inademing wordt ook aanbevolen.
HOE GELEVERD
PULMICORT TURBUHALER (budesonide) bestaat uit een aantal geassembleerde plastic details, met als belangrijkste onderdelen het doseermechanisme, de opslageenheid voor de medicijnsubstantie en het mondstuk. De inhalator wordt beschermd door een witte buitenste buisvormige dop die op de inhalator is geschroefd. Het lichaam van de inhalator is wit en de draaigreep is bruin. De volgende tekst is in verhoogde letters op de handgreep gedrukt, "Pulmicort™ 200 mcg". De TURBUHALER-inhalator kan niet worden bijgevuld en moet worden weggegooid als hij leeg is.
PULMICORT TURBUHALER (budesonide) is verkrijgbaar als 200 mcg / dosis, 200 doses ( NDC 0186-0915-42) en heeft een streefgewicht van 104 mg.
Als er nog 20 doses over zijn in PULMICORT 200mcg TURBUHALER (budesonide), verschijnt er een rode markering in het indicatorvenster. Als het apparaat wordt gebruikt voorbij het punt waarop de rode markering onder in het venster verschijnt, wordt mogelijk niet de juiste hoeveelheid medicatie verkregen. Het apparaat moet worden weggegooid.
Bewaren met het deksel vastgedraaid op een droge plaats bij een gecontroleerde kamertemperatuur van 20-25 ° C (68-77 ° F) [zie USP]. Buiten bereik van kinderen bewaren.
Alle handelsmerken zijn eigendom van de AstraZeneca-bedrijvengroep. ©AstraZeneca 2001, 2006. Gefabriceerd voor: AstraZeneca LP, Wilmington, DE 19850 Door: AstraZeneca AB, Sodertalje, Zweden 33020-00. Rev. 10/06. FDA Rev-datum: 20-8-2007
BIJWERKINGEN
De volgende bijwerkingen werden gemeld bij patiënten die werden behandeld met PULMICORT 100mcg TURBUHALER (budesonide).
De incidentie van vaak voorkomende bijwerkingen is gebaseerd op dubbelblinde, placebogecontroleerde klinische onderzoeken in de VS waarin 1116 volwassen en pediatrische patiënten in de leeftijd van 6-70 jaar (472 vrouwen en 644 mannen) werden behandeld met PULMICORT TURBUHALER (budesonide) (200 tot 800 mcg tweemaal daags gedurende 12 tot 20 weken) of placebo.
De volgende tabel toont de incidentie van bijwerkingen bij patiënten die eerder bronchusverwijders en/of inhalatiecorticosteroïden kregen in gecontroleerde klinische onderzoeken in de VS. Deze populatie omvatte 232 mannelijke en 62 vrouwelijke pediatrische patiënten (leeftijd 6 tot 17 jaar) en 332 mannelijke en 331 vrouwelijke volwassen patiënten (leeftijd 18 jaar en ouder).
Bijwerkingen met ≥ 3% incidentie gemeld door patiënten op PULMICORT 100mcg TURBUHALER (budesonide)
De bovenstaande tabel bevat alle voorvallen (of ze door de onderzoekers als geneesmiddelgerelateerd of niet-geneesmiddelgerelateerd werden beschouwd) die met een snelheid van ≥ 3% optraden in een PULMICORT TURBUHALER (budesonide) -groep en die vaker voorkwamen dan in de placebogroep. Bij het overwegen van deze gegevens moet rekening worden gehouden met de verhoogde gemiddelde blootstellingsduur voor patiënten met PULMICORT 200mcg TURBUHALER (budesonide).
De volgende andere bijwerkingen traden op in deze klinische onderzoeken met PULMICORT 100mcg TURBUHALER (budesonide) met een incidentie van 1 tot 3% en kwamen vaker voor op PULMICORT 200mcg TURBUHALER (budesonide) dan op placebo.
Lichaam als geheel: nek pijn
Cardiovasculair: syncope
spijsvertering: buikpijn, droge mond, braken
Metabool en voedingswaarde: gewichtstoename
Musculoskeletaal: breuk, spierpijn
Zenuwachtig: hypertonie, migraine
Bloedplaatjes, bloedingen en stolling: ecchymose
Psychiatrisch: slapeloosheid
Weerstandsmechanismen: infectie
Speciale zintuigen: smaak perversie
In een 20 weken durend onderzoek bij volwassen astmapatiënten die eerder orale corticosteroïden nodig hadden, werden de effecten van PULMICORT TURBUHALER (budesonide) 400 mcg tweemaal daags (N=53) en 800 mcg tweemaal daags (N=53) vergeleken met placebo (N=53). ) over de frequentie van gemelde bijwerkingen. Bijwerkingen, ongeacht of ze door de onderzoekers als geneesmiddelgerelateerd of niet-geneesmiddelgerelateerd werden beschouwd, gemeld bij meer dan vijf patiënten in de PULMICORT 200mcg TURBUHALER (budesonide)-groep en die vaker voorkwamen met PULMICORT TURBUHALER (budesonide) dan placebo, worden hieronder weergegeven ( % PULMICORT TURBUHALER (budesonide) en % placebo). Bij het overwegen van deze gegevens moet rekening worden gehouden met de verhoogde gemiddelde blootstellingsduur voor patiënten met PULMICORT 200 mcg TURBUHALER (budesonide) (78 dagen voor PULMICORT TURBUHALER (budesonide) versus 41 dagen voor placebo).
Patiënten die eenmaal daags PULMICORT TURBUHALER (budesonide) krijgen
Het bijwerkingenprofiel van eenmaal daagse toediening van PULMICORT 100 mcg TURBUHALER (budesonide) 200 mcg en 400 mcg en placebo werd geëvalueerd bij 309 volwassen astmatische patiënten in een 18 weken durende studie. De onderzoekspopulatie omvatte zowel patiënten die eerder werden behandeld met inhalatiecorticosteroïden als patiënten die niet eerder werden behandeld met corticosteroïden. Er was geen klinisch relevant verschil in het patroon van bijwerkingen na eenmaaldaagse toediening van PULMICORT 200mcg TURBUHALER (budesonide) in vergelijking met tweemaaldaagse dosering.
Pediatrische studies: In een 12 weken durende placebogecontroleerde studie bij 404 pediatrische patiënten van 6 tot 18 jaar die eerder inhalatiecorticosteroïden kregen, was de frequentie van bijwerkingen voor elke leeftijdscategorie (6 tot 12 jaar, 13 tot 18 jaar) vergelijkbaar voor PULMICORT TURBUHALER (budesonide) (bij 100, 200 en 400 mcg tweemaal daags) en placebo. Er waren geen klinisch relevante verschillen in het patroon of de ernst van bijwerkingen bij kinderen in vergelijking met die bij volwassenen.
Rapporten over bijwerkingen van andere bronnen: Zeldzame bijwerkingen die zijn gemeld in de gepubliceerde literatuur of uit wereldwijde marketingervaringen met een formulering van budesonide voor inhalatie zijn: onmiddellijke en vertraagde overgevoeligheidsreacties waaronder huiduitslag, contactdermatitis, urticaria, angio-oedeem en bronchospasme; symptomen van hypocorticisme en hypercorticisme; glaucoom, staar; psychiatrische symptomen waaronder depressie, agressieve reacties, prikkelbaarheid, angst en psychose.
DRUG-INTERACTIES
In klinische onderzoeken heeft gelijktijdige toediening van budesonide en andere geneesmiddelen die vaak worden gebruikt bij de behandeling van astma niet geleid tot een verhoogde frequentie van bijwerkingen. De belangrijkste metabolische route van budesonide, evenals van andere corticosteroïden, is via cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4). Na orale toediening van ketoconazol, een krachtige remmer van CYP3A4, nam de gemiddelde plasmaconcentratie van oraal toegediend budesonide toe. Gelijktijdige toediening van andere bekende remmers van CYP3A4 (bijv. itraconazol, claritromycine, erytromycine, enz.) kan het metabolisme van budesonide remmen en de systemische blootstelling verhogen. Voorzichtigheid is geboden wanneer budesonide gelijktijdig wordt toegediend met langdurig ketoconazol en andere bekende CYP3A4-remmers.
WAARSCHUWINGEN
Bijzondere zorg is nodig voor patiënten die worden overgezet van systemisch actieve corticosteroïden op PULMICORT 200mcg TURBUHALER (budesonide), omdat er bij astmatische patiënten sterfgevallen zijn opgetreden als gevolg van bijnierinsufficiëntie tijdens en na de overgang van systemische corticosteroïden naar minder systemisch beschikbare inhalatiecorticosteroïden. Na stopzetting van systemische corticosteroïden is een aantal maanden nodig voor herstel van de hypothalamus-hypofyse-bijnierfunctie (HPA).
Patiënten die eerder 20 mg of meer prednison (of het equivalent daarvan) per dag bleven gebruiken, kunnen het meest vatbaar zijn, vooral wanneer hun systemische corticosteroïden bijna volledig zijn stopgezet. Tijdens deze periode van HPA-suppressie kunnen patiënten tekenen en symptomen van bijnierinsufficiëntie vertonen wanneer ze worden blootgesteld aan trauma, chirurgie of infectie (met name gastro-enteritis) of andere aandoeningen die gepaard gaan met ernstig elektrolytenverlies. Hoewel PULMICORT TURBUHALER (budesonide) tijdens deze episodes de astmasymptomen onder controle kan houden, levert het in de aanbevolen doses systemisch minder dan normale fysiologische hoeveelheden glucocorticoïde en biedt het NIET de mineralocorticoïde activiteit die nodig is om met deze noodsituaties om te gaan.
Tijdens perioden van stress of een ernstige astma-aanval moeten patiënten die gestopt zijn met systemische corticosteroïden worden geïnstrueerd om de orale corticosteroïden (in grote doses) onmiddellijk te hervatten en om contact op te nemen met hun arts voor verdere instructies. Deze patiënten moeten ook worden geïnstrueerd om een medische identificatiekaart bij zich te hebben die aangeeft dat ze mogelijk aanvullende systemische corticosteroïden nodig hebben tijdens perioden van stress of een ernstige astma-aanval.
Patiënten die orale corticosteroïden nodig hebben, moeten langzaam worden afgebouwd van het gebruik van systemische corticosteroïden na overschakeling op PULMICORT 100 mcg TURBUHALER (budesonide). De longfunctie (FEV1 of AM PEF), het gebruik van bèta-agonisten en astmasymptomen moeten zorgvuldig worden gecontroleerd tijdens het stoppen met orale corticosteroïden. Naast het controleren van tekenen en symptomen van astma, moeten patiënten worden geobserveerd op tekenen en symptomen van bijnierinsufficiëntie, zoals vermoeidheid, lusteloosheid, zwakte, misselijkheid en braken en hypotensie.
Overdracht van patiënten van systemische therapie met corticosteroïden naar PULMICORT 200mcg TURBUHALER (budesonide) kan allergische aandoeningen ontmaskeren die voorheen werden onderdrukt door de systemische therapie met corticosteroïden, bijv. rhinitis, conjunctivitis, artritis, eosinofiele aandoeningen en eczeem (zie DOSERING EN ADMINISTRATIE ).
Patiënten die medicijnen gebruiken die het immuunsysteem onderdrukken, zijn vatbaarder voor infecties dan gezonde personen. Waterpokken en mazelen kunnen bijvoorbeeld een ernstiger of zelfs fataal verloop hebben bij gevoelige pediatrische patiënten of volwassenen die immunosuppressieve doses corticosteroïden gebruiken. Bij pediatrische of volwassen patiënten die deze ziekten niet hebben gehad, dient bijzondere aandacht te worden besteed aan het vermijden van blootstelling. Hoe de dosis, route en duur van de toediening van corticosteroïden het risico op het ontwikkelen van een gedissemineerde infectie beïnvloedt, is niet bekend. De bijdrage van de onderliggende ziekte en/of eerdere behandeling met corticosteroïden aan het risico is ook niet bekend. Indien blootgesteld, kan therapie met varicella zoster-immunoglobuline (VZIG) of gepoold intraveneus immunoglobuline (IVIG), naargelang het geval, geïndiceerd zijn. Bij blootstelling aan mazelen kan profylaxe met gepoolde intramusculaire immunoglobuline (IG) geïndiceerd zijn. (Zie de respectievelijke bijsluiters voor volledige VZIG- en IG-voorschrijfinformatie.) Als zich waterpokken ontwikkelen, kan behandeling met antivirale middelen worden overwogen.
PULMICORT 200mcg TURBUHALER (budesonide) is geen bronchodilatator en is niet geïndiceerd voor snelle verlichting van bronchospasmen of andere acute episodes van astma.
Net als bij andere astmamedicatie voor inhalatie, kan bronchospasme, met een onmiddellijke toename van piepende ademhaling, optreden na toediening. Als bronchospasme optreedt na toediening van PULMICORT TURBUHALER (budesonide), moet dit onmiddellijk worden behandeld met een snelwerkende inhalatiebronchodilatator. Behandeling met PULMICORT TURBUHALER (budesonide) moet worden stopgezet en een alternatieve therapie moet worden ingesteld.
Patiënten moeten worden geïnstrueerd om onmiddellijk contact op te nemen met hun arts wanneer zich tijdens de behandeling met PULMICORT TURBUHALER (budesonide) episodes van astma voordoen die niet reageren op hun gebruikelijke doses luchtwegverwijders. Tijdens dergelijke episodes kunnen patiënten therapie met orale corticosteroïden nodig hebben.
PREVENTIEVE MAATREGELEN
Algemeen
Tijdens het stoppen met orale corticosteroïden kunnen sommige patiënten symptomen van systemisch actieve ontwenning van corticosteroïden ervaren, bijv. gewrichts- en/of spierpijn, vermoeidheid en depressie, ondanks behoud of zelfs verbetering van de ademhalingsfunctie (zie DOSERING EN ADMINISTRATIE ).
Bij responsieve patiënten kan PULMICORT TURBUHALER (budesonide) de astmasymptomen onder controle houden met minder onderdrukking van de HPA-asfunctie dan therapeutisch equivalente orale doses prednison. Aangezien budesonide in de bloedsomloop wordt opgenomen en systemisch actief kan zijn, kunnen de gunstige effecten van PULMICORT 100mcg TURBUHALER (budesonide) bij het minimaliseren van HPA-disfunctie alleen worden verwacht als de aanbevolen doseringen niet worden overschreden en individuele patiënten worden getitreerd naar de laagste effectieve dosis. Aangezien er individuele gevoeligheid voor effecten op de cortisolproductie bestaat, moeten artsen deze informatie in overweging nemen bij het voorschrijven van PULMICORT 100mcg TURBUHALER (budesonide).
Vanwege de mogelijkheid van systemische absorptie van inhalatiecorticosteroïden, moeten patiënten die worden behandeld met PULMICORT 200mcg TURBUHALER (budesonide) zorgvuldig worden geobserveerd op enig bewijs van systemische effecten van corticosteroïden. Bijzondere aandacht moet worden besteed aan het observeren van patiënten postoperatief of tijdens perioden van stress op tekenen van onvoldoende respons van de bijnieren.
Het is mogelijk dat systemische effecten van corticosteroïden zoals hypercorticisme, verminderde botmineraaldichtheid en bijniersuppressie optreden bij een klein aantal patiënten, vooral bij hogere doses. Als dergelijke veranderingen optreden, moet PULMICORT 100mcg TURBUHALER (budesonide) langzaam worden afgebouwd, in overeenstemming met geaccepteerde procedures voor de behandeling van astmasymptomen en voor het afbouwen van systemische steroïden.
Oraal geïnhaleerde corticosteroïden, waaronder budesonide, kunnen een vermindering van de groeisnelheid veroorzaken bij toediening aan pediatrische patiënten. Een afname van de groeisnelheid kan optreden als gevolg van onvoldoende controle van astma of door het gebruik van corticosteroïden voor de behandeling. De mogelijke effecten van langdurige behandeling op de groeisnelheid moeten worden afgewogen tegen de klinische voordelen die worden verkregen en de risico's van alternatieve therapieën. Om de systemische effecten van orale inhalatiecorticosteroïden, waaronder PULMICORT 200mcg TURBUHALER (budesonide), te minimaliseren, moet elke patiënt worden getitreerd naar zijn/haar laagste effectieve dosis (zie VOORZORGSMAATREGELEN, pediatrisch gebruik ).
Hoewel patiënten in klinische onderzoeken PULMICORT TURBUHALER (budesonide) continu gedurende een periode van 1 tot 2 jaar hebben gekregen, zijn de lokale en systemische effecten op lange termijn van PULMICORT 200mcg TURBUHALER (budesonide) bij mensen niet volledig bekend. Met name de effecten als gevolg van chronisch gebruik van PULMICORT TURBUHALER (budesonide) op ontwikkelings- of immunologische processen in de mond, keelholte, luchtpijp en long zijn onbekend.
In klinische onderzoeken met PULMICORT TURBUHALER (budesonide) traden bij sommige patiënten gelokaliseerde infecties met Candida albicans op in de mond en keelholte. Deze infecties kunnen behandeling met geschikte antischimmeltherapie en / of stopzetting van de behandeling met PULMICORT TURBUHALER (budesonide) vereisen.
Inhalatiecorticosteroïden moeten met voorzichtigheid of helemaal niet worden gebruikt bij patiënten met actieve of latente tuberculose-infectie van de luchtwegen, onbehandelde systemische schimmel-, bacteriële, virale of parasitaire infecties of oculaire herpes simplex.
Zeldzame gevallen van glaucoom, verhoogde intraoculaire druk en cataract zijn gemeld na toediening van corticosteroïden via inhalatie.
Informatie voor patiënten
Patiënten die worden behandeld met PULMICORT TURBUHALER (budesonide) dienen de volgende informatie en instructies te ontvangen. Deze informatie is bedoeld om de patiënt te helpen bij een veilig en effectief gebruik van de medicatie. Het is geen onthulling van alle mogelijke nadelige of beoogde effecten. Voor een juist gebruik van PULMICORT 200mcg TURBUHALER (budesonide) en om maximale verbetering te bereiken, moet de patiënt de bijgevoegde Instructies van de patiënt voor Gebruik zorgvuldig.
- Patiënten moeten PULMICORT 200mcg TURBUHALER (budesonide) met regelmatige tussenpozen gebruiken zoals voorgeschreven, omdat de effectiviteit ervan afhangt van regelmatig gebruik. De patiënt mag de voorgeschreven dosering niet wijzigen, tenzij de arts dit adviseert.
- Patiënten moeten erop worden gewezen dat PULMICORT 100 mcg TURBUHALER (budesonide) geen bronchodilatator is en niet bedoeld is voor de behandeling van acute of levensbedreigende episodes van astma.
- Patiënten moeten erop worden gewezen dat de werkzaamheid van PULMICORT 100 mcg TURBUHALER (budesonide) afhankelijk is van het juiste gebruik van het apparaat en de inhalatie-toedieningstechniek:
- 1. PULMICORT TURBUHALER (budesonide) moet tijdens het laden rechtop staan (mondstuk bovenop) om de juiste dosis te geven.
- 2. PULMICORT 100mcg TURBUHALER (budesonide) moet worden geprimed wanneer het apparaat voor het eerst wordt gebruikt. Om het apparaat voor te bereiden, moet het rechtop worden gehouden en moet de bruine greep volledig naar rechts worden gedraaid en vervolgens volledig naar links worden gedraaid totdat deze klikt. Herhalen.
- 3. Om de eerste dosis te laden, moet de greep volledig naar rechts en volledig naar links worden gedraaid totdat deze klikt.
- 4. Na de eerste dosis is het niet nodig om het apparaat te vullen. Het moet echter onmiddellijk voor gebruik rechtop worden geladen, zoals hierboven beschreven.
- 5. Patiënten dienen te worden geadviseerd de inhalator niet te schudden.
- Patiënten moeten het mondstuk tussen de lippen plaatsen en krachtig en diep inademen. Het poeder wordt vervolgens naar de longen gebracht.
- Patiënten mogen niet uitademen door PULMICORT TURBUHALER (budesonide).
- Vanwege de kleine hoeveelheid poeder kan de patiënt de aanwezigheid van medicijnen die de longen binnendringen niet proeven of voelen bij het inhaleren via de TURBUHALER-inhalator. Dit gebrek aan gevoel geeft niet aan dat de patiënt geen baat heeft bij PULMICORT TURBUHALER (budesonide).
- Patiënten moeten erop worden gewezen dat het spoelen van de mond met water zonder te slikken na elke dosering het risico op de ontwikkeling van orale candidiasis kan verminderen.
- Patiënten moeten worden geïnstrueerd dat ze elke keer dat ze hun recept opnieuw vullen, een nieuwe PULMICORT TURBUHALER (budesonide) -eenheid zullen ontvangen. Patiënten moeten worden geadviseerd het hele hulpmiddel weg te gooien nadat het aangegeven aantal inhalaties is gebruikt. Als er nog 20 doses over zijn in PULMICORT TURBUHALER (budesonide), verschijnt er een rode markering in het indicatorvenster.
- PULMICORT TURBUHALER (budesonide) mag niet worden gebruikt met een spacer.
- Het mondstuk mag niet worden gebeten of gekauwd.
- Het deksel moet na elke opening veilig worden teruggeplaatst.
- Patiënten moeten PULMICORT TURBUHALER (budesonide) te allen tijde schoon en droog houden.
- Patiënten moeten erop worden gewezen dat verbetering van de astmacontrole na inhalatie van PULMICORT TURBUHALER (budesonide) kan optreden binnen 24 uur na het begin van de behandeling, hoewel het maximale voordeel mogelijk niet wordt bereikt gedurende 1 tot 2 weken of langer. Als de symptomen in die tijd niet verbeteren of als de toestand verslechtert, moet de patiënt worden geïnstrueerd de dosering niet te verhogen, maar contact op te nemen met de arts.
- Patiënten bij wie systemische corticosteroïden zijn verminderd of gestaakt, moeten worden geïnstrueerd om een waarschuwingskaart bij zich te hebben die aangeeft dat ze mogelijk aanvullende systemische corticosteroïden nodig hebben tijdens perioden van stress of een astma-aanval die niet reageert op luchtwegverwijders.
- Patiënten moeten worden geadviseerd het gebruik van PULMICORT TURBUHALER (budesonide) niet abrupt te stoppen.
- Patiënten moeten worden gewaarschuwd om blootstelling aan waterpokken of mazelen te vermijden en, als ze worden blootgesteld, onmiddellijk hun arts te raadplegen.
- Langdurig gebruik van inhalatiecorticosteroïden, waaronder budesonide, kan het risico op bepaalde oogproblemen (cataract of glaucoom) verhogen. Regelmatige oogonderzoeken moeten worden overwogen.
- Vrouwen die het gebruik van PULMICORT TURBUHALER (budesonide) overwegen, moeten hun arts raadplegen als ze zwanger zijn of van plan zijn zwanger te worden, of als ze borstvoeding geven.
- Patiënten die overwegen om PULMICORT TURBUHALER (budesonide) te gebruiken, moeten hun arts raadplegen als ze allergisch zijn voor budesonide of een ander oraal inhalatiecorticosteroïde.
- Patiënten moeten hun arts informeren over andere medicijnen die ze gebruiken, aangezien PULMICORT 100mcg TURBUHALER (budesonide) in sommige omstandigheden mogelijk niet geschikt is en de arts mogelijk een ander geneesmiddel wil gebruiken.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn langetermijnstudies uitgevoerd bij ratten en muizen met orale toediening om het carcinogene potentieel van budesonide te evalueren.
In een oraal onderzoek van 104 weken bij Sprague-Dawley-ratten werd een statistisch significante toename van de incidentie van gliomen waargenomen bij mannelijke ratten die een orale dosis van 50 mcg/kg/dag kregen (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en kinderen op mcg/m2 basis). Er werd geen tumorigeniciteit waargenomen bij mannelijke en vrouwelijke ratten bij respectievelijke orale doses tot 25 en 50 mcg/kg (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en kinderen op basis van mcg/m2). In twee aanvullende onderzoeken van twee jaar bij mannelijke Fischer- en Sprague-Dawley-ratten veroorzaakte budesonide geen gliomen bij een orale dosis van 50 mcg/kg (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en kinderen op basis van mcg/m2). Bij mannelijke Sprague-Dawley-ratten veroorzaakte budesonide echter een statistisch significante toename van de incidentie van hepatocellulaire tumoren bij een orale dosis van 50 mcg/kg (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en kinderen op basis van mcg/m2 ). De gelijktijdige referentie-corticosteroïden (prednison en triamcinolonacetonide) in deze twee onderzoeken lieten vergelijkbare bevindingen zien.
Er waren geen aanwijzingen voor een carcinogeen effect wanneer budesonide gedurende 91 weken oraal werd toegediend aan muizen in doses tot 200 mcg/kg/dag (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en kinderen op basis van mcg/m2).
Budesonide was niet mutageen of clastogeen in zes verschillende testsystemen: Ames Salmonella/microsoomplaattest, muismicronucleustest, muislymfoomtest, chromosoomafwijkingstest in menselijke lymfocyten, geslachtsgebonden recessieve letale test in Drosophila melanogaster en DNA-reparatieanalyse bij ratten hepatocyten cultuur.
Bij ratten had budesonide geen effect op de vruchtbaarheid bij subcutane doses tot 80 mcg/kg (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij de mens op basis van mcg/m2).
Bij 20 mcg/kg/dag (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij de mens op basis van mcg/m2) werden afnames in maternale lichaamsgewichtstoename, prenatale levensvatbaarheid en levensvatbaarheid van de jongen bij de geboorte en tijdens het geven van borstvoeding waargenomen. Dergelijke effecten werden niet waargenomen bij 5 mcg/kg (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen op basis van mcg/m2).
Zwangerschap: teratogene effecten
Zwangerschap Categorie B: Zoals met andere glucocorticoïden, veroorzaakte budesonide foetaal verlies, verminderd gewicht van de jongen en skeletafwijkingen bij subcutane doses van 25 mcg/kg/dag bij konijnen (minder dan de maximaal aanbevolen dagelijkse inhalatiedosis bij de mens op basis van mcg/m2) en 500 mcg/kg/dag bij ratten (ongeveer 3 maal de maximaal aanbevolen dagelijkse inhalatiedosis voor de mens op basis van mcg/m2).
Er werden geen teratogene of embryocidale effecten waargenomen bij ratten wanneer budesonide werd toegediend via inhalatie in doses tot 250 mcg/kg/dag (equivalent aan de maximaal aanbevolen dagelijkse inhalatiedosis voor de mens op basis van mcg/m2).
Ervaring met orale corticosteroïden sinds hun introductie in farmacologische in tegenstelling tot fysiologische doses suggereert dat knaagdieren vatbaarder zijn voor teratogene effecten van corticosteroïden dan mensen.
Studies bij zwangere vrouwen hebben echter niet aangetoond dat PULMICORT TURBUHALER (budesonide) het risico op afwijkingen verhoogt bij toediening tijdens de zwangerschap. De resultaten van een groot populatiegebaseerd prospectief cohort epidemiologisch onderzoek waarin gegevens zijn beoordeeld uit drie Zweedse registers die ongeveer 99% van de zwangerschappen van 1995-1997 bestrijken (dwz het Zweedse medische geboorteregister; het register van aangeboren misvormingen; het kindercardiologieregister) duiden niet op een verhoogd risico voor aangeboren afwijkingen door het gebruik van inhalatie budesonide tijdens de vroege zwangerschap. Congenitale misvormingen werden onderzocht bij 2.014 zuigelingen van moeders die melding maakten van het gebruik van inhalatiebudesonide voor astma tijdens de vroege zwangerschap (meestal 10-12 weken na de laatste menstruatie), de periode waarin de meeste ernstige orgaanmisvormingen optreden. Het aantal geregistreerde aangeboren afwijkingen was vergelijkbaar met het percentage in de algemene bevolking (respectievelijk 3,8% versus 3,5%). Bovendien was het aantal zuigelingen geboren met orofaciale spleten na blootstelling aan geïnhaleerd budesonide vergelijkbaar met het verwachte aantal in de normale populatie (respectievelijk 4 kinderen vs. 3,3).
Dezelfde gegevens werden gebruikt in een tweede onderzoek, waarmee het totaal op 2.534 zuigelingen kwam van wie de moeder was blootgesteld aan budesonide via inhalatie. In deze studie was het percentage aangeboren afwijkingen bij zuigelingen van wie de moeder tijdens de vroege zwangerschap werd blootgesteld aan budesonide voor inhalatie niet verschillend van het percentage voor alle pasgeboren baby's in dezelfde periode (3,6%).
Ondanks de bevindingen bij dieren, lijkt het erop dat de mogelijkheid van schade aan de foetus klein is als het medicijn tijdens de zwangerschap wordt gebruikt. Desalniettemin, omdat de onderzoeken bij mensen de mogelijkheid van schade niet kunnen uitsluiten, mag PULMICORT TURBUHALER (budesonide) alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.

Nietteratogene effecten
Hypoadrenalisme kan optreden bij baby's die zijn geboren uit moeders die tijdens de zwangerschap corticosteroïden krijgen. Dergelijke baby's moeten zorgvuldig worden geobserveerd.
Moeders die borstvoeding geven
Corticosteroïden worden uitgescheiden in de moedermelk. Vanwege de mogelijkheid van bijwerkingen bij zuigelingen van corticosteroïden, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder. Actuele gegevens voor budesonide ontbreken.
Pediatrisch gebruik
De veiligheid en werkzaamheid van PULMICORT 100mcg TURBUHALER (budesonide) bij pediatrische patiënten jonger dan 6 jaar zijn niet vastgesteld.
Bij pediatrische astmapatiënten was de frequentie van bijwerkingen die werden waargenomen met PULMICORT 100mcg TURBUHALER (budesonide) vergelijkbaar tussen de 6- tot 12-jarige leeftijdsgroep (N=172) vergeleken met de 13- tot 17-jarige leeftijdsgroep (N=124) .
Gecontroleerde klinische onderzoeken hebben aangetoond dat orale inhalatiecorticosteroïden een vermindering van de groeisnelheid bij pediatrische patiënten kunnen veroorzaken. Dit effect is waargenomen bij gebrek aan laboratoriumgegevens van onderdrukking van de hypothalamus-hypofyse-bijnieras (HPA-as), wat suggereert dat groeisnelheid een gevoeligere indicator is voor systemische blootstelling aan corticosteroïden bij pediatrische patiënten dan sommige veelgebruikte tests van de HPA-asfunctie. De langetermijneffecten van deze verlaging van de groeisnelheid die gepaard gaat met orale inhalatiecorticosteroïden, inclusief de impact op de uiteindelijke volwassen lengte, zijn niet bekend. Het potentieel voor "inhaalgroei" na stopzetting van de behandeling met orale inhalatiecorticosteroïden is niet voldoende onderzocht.
In een onderzoek bij astmatische kinderen van 5-12 jaar hadden degenen die werden behandeld met PULMICORT 200 mcg TURBUHALER (budesonide) 200 mcg tweemaal daags (n=311) een groeivermindering van 1,1 centimeter vergeleken met degenen die placebo kregen (n=418) het einde van een jaar; het verschil tussen deze twee behandelingsgroepen nam niet verder toe gedurende drie jaar aanvullende behandeling. Tegen het einde van vier jaar hadden kinderen die werden behandeld met PULMICORT TURBUHALER (budesonide) en kinderen die werden behandeld met placebo vergelijkbare groeisnelheden. De conclusies die uit deze studie worden getrokken, kunnen worden vertroebeld door het ongelijke gebruik van corticosteroïden in de behandelingsgroepen en de opname van gegevens van patiënten die in de loop van de studie de puberteit bereikten.
De groei van pediatrische patiënten die orale inhalatiecorticosteroïden krijgen, waaronder PULMICORT TURBUHALER (budesonide), moet routinematig worden gecontroleerd (bijv. via stadiometrie). De mogelijke groei-effecten van langdurige behandeling moeten worden afgewogen tegen de verkregen klinische voordelen en de risico's en voordelen die verband houden met alternatieve therapieën. Om de systemische effecten van inhalatiecorticosteroïden, waaronder PULMICORT 100mcg TURBUHALER (budesonide), te minimaliseren, moet elke patiënt worden getitreerd naar zijn/haar laagste effectieve dosis.
Geriatrisch gebruik
Honderd patiënten van 65 jaar of ouder werden opgenomen in de Amerikaanse en niet-Amerikaanse gecontroleerde klinische onderzoeken met PULMICORT 100mcg TURBUHALER (budesonide). Er waren geen verschillen in de veiligheid en werkzaamheid van het geneesmiddel in vergelijking met die bij jongere patiënten.
Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
OVERDOSERING
De kans op acute toxische effecten na een overdosis PULMICORT 100mcg TURBUHALER (budesonide) is laag. Bij langdurig gebruik in overmatige doses kunnen systemische corticosteroïd-effecten zoals hypercorticisme optreden (zie: PREVENTIEVE MAATREGELEN ). PULMICORT TURBUHALER bij tweemaal de hoogste aanbevolen dosis (3200 mcg per dag) toegediend gedurende 6 weken veroorzaakte een significante vermindering (27%) van de plasmacortisolrespons op een 6 uur durende infusie van ACTH in vergelijking met placebo (+1%). Het overeenkomstige effect van 10 mg prednison per dag was een afname van 35% in de plasmacortisolrespons op ACTH.
De minimale dodelijke inhalatiedosis bij muizen was 100 mg/kg (ongeveer 320 maal de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en ongeveer 380 maal de maximaal aanbevolen dagelijkse inhalatiedosis bij kinderen op basis van mcg/m2). Er waren geen sterfgevallen na toediening van een inhalatiedosis van 68 mg/kg bij ratten (ongeveer 430 maal de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en ongeveer 510 maal de maximaal aanbevolen dagelijkse inhalatiedosis bij kinderen op basis van mcg/m2). De minimale dodelijke orale dosis was 200 mg/kg bij muizen (ongeveer 630 maal de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en ongeveer 750 maal de maximaal aanbevolen dagelijkse inhalatiedosis bij kinderen op basis van mcg/m2) en minder dan 100 mg/kg bij ratten (ongeveer 630 keer de maximaal aanbevolen dagelijkse inhalatiedosis bij volwassenen en ongeveer 750 keer de maximaal aanbevolen dagelijkse inhalatiedosis bij kinderen op basis van mcg/m2).
Uit postmarketingervaring bleek dat patiënten die een acute overdosering van budesonide voor inhalatie kregen, gewoonlijk asymptomatisch bleven. Het gebruik van overmatige doses (tot 6400 mcg per dag) gedurende langere perioden vertoonde systemische effecten van corticosteroïden, zoals hypercorticisme.
CONTRA-INDICATIES
PULMICORT TURBUHALER (budesonide) is gecontra-indiceerd bij de primaire behandeling van status astmaticus of andere acute episodes van astma waarbij intensieve maatregelen vereist zijn.
Overgevoeligheid voor budesonide is een contra-indicatie voor het gebruik van PULMICORT TURBUHALER (budesonide).
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Budesonide is een ontstekingsremmend corticosteroïd dat een krachtige glucocorticoïde activiteit en een zwakke mineralocorticoïde activiteit vertoont. In standaard in vitro- en diermodellen heeft budesonide een ongeveer 200 keer hogere affiniteit voor de glucocorticoïde receptor en een 1000 keer hogere lokale ontstekingsremmende potentie dan cortisol (test crotonolie-ooroedeem bij ratten). Als maat voor de systemische activiteit is budesonide 40 keer krachtiger dan cortisol bij subcutane toediening en 25 keer krachtiger bij orale toediening in de thymus-involutietest bij ratten.
De activiteit van PULMICORT 100mcg TURBUHALER is te danken aan het moedergeneesmiddel, budesonide. In onderzoeken naar de affiniteit van de glucocorticoïdreceptor was de 22R-vorm twee keer zo actief als de 22S-epimeer. In vitro-onderzoeken wezen uit dat de twee vormen van budesonide niet in elkaar overgaan.
Het precieze mechanisme van de werking van corticosteroïden op ontsteking bij astma is niet bekend. Ontsteking is een belangrijke component in de pathogenese van astma. Van corticosteroïden is aangetoond dat ze een breed scala aan remmende activiteiten hebben tegen meerdere celtypen (bijv. mestcellen, eosinofielen, neutrofielen, macrofagen en lymfocyten) en mediatoren (bijv. histamine, eicosanoïden, leukotriënen en cytokinen) die betrokken zijn bij allergische en niet -allergie-gemedieerde ontsteking. Deze ontstekingsremmende werking van corticosteroïden kan bijdragen aan hun werkzaamheid bij astma.
Studies bij astmatische patiënten hebben een gunstige verhouding aangetoond tussen lokale ontstekingsremmende activiteit en systemische corticosteroïd-effecten over een breed scala aan doses van PULMICORT 200mcg TURBUHALER (budesonide). Dit wordt verklaard door een combinatie van een relatief hoog lokaal ontstekingsremmend effect, uitgebreide first-pass leverafbraak van oraal geabsorbeerd geneesmiddel (85-95%) en de lage potentie van gevormde metabolieten (zie hieronder).
Farmacokinetiek
Absorptie:
Na orale toediening van budesonide werd de piekplasmaconcentratie bereikt in ongeveer 1 tot 2 uur en de absolute systemische beschikbaarheid was 6-13%. Daarentegen wordt het grootste deel van budesonide dat in de longen wordt afgegeven, systemisch geabsorbeerd. Bij gezonde proefpersonen werd 34% van de afgemeten dosis afgezet in de longen (zoals bepaald met de plasmaconcentratiemethode) met een absolute systemische beschikbaarheid van 39% van de afgemeten dosis. De farmacokinetiek van budesonide verschilt niet significant bij gezonde vrijwilligers en astmapatiënten. De piekplasmaconcentraties van budesonide traden op binnen 30 minuten na inhalatie van PULMICORT 200mcg TURBUHALER.Bij astmatische patiënten vertoonde budesonide een lineaire toename van de AUC en Cmax met toenemende dosis na zowel een enkele dosis als herhaalde dosering van PULMICORT 200mcg TURBUHALER (budesonide).
Verdeling:
Het distributievolume van budesonide was ongeveer 3 l/kg. Het was voor 85-90% gebonden aan plasma-eiwitten. Eiwitbinding was constant over het concentratiebereik (1-100 nmol/L) dat werd bereikt met, en overschreed, de aanbevolen doses PULMICORT TURBUHALER. Budesonide vertoonde weinig of geen binding aan corticosteroïdbindend globuline. Budesonide kwam snel in evenwicht met rode bloedcellen op een concentratieonafhankelijke manier met een bloed/plasmaverhouding van ongeveer 0,8.Metabolisme:
In vitro-onderzoeken met humane leverhomogenaten hebben aangetoond dat budesonide snel en uitgebreid wordt gemetaboliseerd. Twee belangrijke metabolieten gevormd via door cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4) gekatalyseerde biotransformatie zijn geïsoleerd en geïdentificeerd als 16α-hydroxyprednisolon en 6β-hydroxybudesonide. De corticosteroïdactiviteit van elk van deze twee metabolieten is minder dan 1% van die van de moederverbinding. Er zijn geen kwalitatieve verschillen gevonden tussen de in vitro en in vivo metabole patronen. Verwaarloosbare metabole inactivatie werd waargenomen in humane long- en serumpreparaten.Uitscheiding/eliminatie:
De 22R-vorm van budesonide werd bij voorkeur geklaard door de lever met een systemische klaring van 1,4 l/min versus 1,0 l/min voor de 22S-vorm. De terminale halfwaardetijd, 2 tot 3 uur, was hetzelfde voor beide epimeren en was onafhankelijk van de dosis. Budesonide werd uitgescheiden in de urine en feces in de vorm van metabolieten. Ongeveer 60% van een intraveneuze radioactief gelabelde dosis werd teruggevonden in de urine. Er werd geen onveranderd budesonide in de urine aangetroffen.Speciale populaties:
Er zijn geen farmacokinetische verschillen vastgesteld vanwege ras, geslacht of hoge leeftijd.pediatrisch:
Na intraveneuze toediening bij pediatrische patiënten in de leeftijd van 10-14 jaar was de plasmahalfwaardetijd korter dan bij volwassenen (1,5 uur versus 2,0 uur bij volwassenen). In dezelfde populatie na inhalatie van budesonide via een inhalator met afgemeten dosis onder druk, was de absolute systemische beschikbaarheid vergelijkbaar met die bij volwassenen.Leverinsufficiëntie:
Een verminderde leverfunctie kan de eliminatie van corticosteroïden beïnvloeden. De farmacokinetiek van budesonide werd beïnvloed door een verminderde leverfunctie, zoals blijkt uit een verdubbelde systemische beschikbaarheid na orale inname. De intraveneuze farmacokinetiek van budesonide was echter vergelijkbaar bij cirrosepatiënten en bij gezonde proefpersonen.Geneesmiddel-geneesmiddelinteracties:
Ketoconazol, een krachtige remmer van cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4), het belangrijkste metabolische enzym voor corticosteroïden, verhoogde de plasmaspiegels van oraal ingenomen budesonide. Bij de aanbevolen doses had cimetidine een licht maar klinisch onbeduidend effect op de farmacokinetiek van oraal budesonide.farmacodynamiek
Om te bevestigen dat systemische absorptie geen significante factor is in de klinische werkzaamheid van budesonide voor inhalatie, werd een klinische studie uitgevoerd bij patiënten met astma waarin 400 mcg budesonide, toegediend via een inhalator met afgemeten dosis en een tube spacer, werd vergeleken met 1400 mcg orale budesonide en placebo. De studie toonde de werkzaamheid aan van budesonide voor inhalatie, maar niet van oraal ingenomen budesonide, ondanks vergelijkbare systemische niveaus. Het therapeutische effect van conventionele doses oraal geïnhaleerde budesonide wordt dus grotendeels verklaard door zijn directe werking op de luchtwegen.
Over het algemeen heeft PULMICORT TURBUHALER (budesonide) een relatief snelle werking voor een inhalatiecorticosteroïd. Verbetering van de astmacontrole na inhalatie van PULMICORT TURBUHALER (budesonide) kan optreden binnen 24 uur na het begin van de behandeling, hoewel het maximale voordeel mogelijk niet wordt bereikt gedurende 1 tot 2 weken of langer.
Van PULMICORT TURBUHALER (budesonide) is aangetoond dat het de luchtwegreactiviteit verlaagt in verschillende challenge-modellen, waaronder histamine, methacholine, natriummetabisulfiet en adenosinemonofosfaat bij patiënten met hyperreactieve luchtwegen. De klinische relevantie van deze modellen is niet zeker.
Voorbehandeling met PULMICORT 200 mcg TURBUHALER (budesonide) 1600 mcg dagelijks (800 mcg tweemaal daags) gedurende 2 weken verminderde de acute (vroege-fase reactie) en vertraagde (laat-fase reactie) afname van FEV1 na blootstelling aan geïnhaleerde allergenen.
De effecten van PULMICORT 200mcg TURBUHALER (budesonide) op de hypothalamus-hypofyse-bijnieras (HPA) werden onderzocht bij 905 volwassenen en 404 pediatrische patiënten met astma. Voor de meeste patiënten bleef het vermogen om de cortisolproductie te verhogen als reactie op stress, zoals beoordeeld door cosyntropine (ACTH) stimulatietest, intact met behandeling met PULMICORT TURBUHALER (budesonide) in de aanbevolen doses. Bij volwassen patiënten die werden behandeld met 100, 200, 400 of 800 mcg tweemaal daags gedurende 12 weken, hadden respectievelijk 4%, 2%, 6% en 13% een abnormale gestimuleerde cortisolrespons (piekcortisol
De toediening van budesonide via PULMICORT 200 mcg TURBUHALER (budesonide) in doses tot 800 mcg/dag (gemiddelde dagelijkse dosis 445 mcg/dag) of via een inhalator met afgemeten dosis onder druk in doses tot 1200 mcg/dag (gemiddelde dagelijkse dosis 620 mcg /dag) tot 216 pediatrische patiënten (leeftijd 3 tot 11 jaar) gedurende 2 tot 6 jaar had geen significant effect op de groei van de lichaamsbouw in vergelijking met therapie zonder corticosteroïden bij 62 gematchte controlepatiënten. Het langetermijneffect van PULMICORT TURBUHALER (budesonide) op de groei is echter niet volledig bekend.
Klinische paden
De therapeutische werkzaamheid van PULMICORT 100mcg TURBUHALER (budesonide) is geëvalueerd in gecontroleerde klinische onderzoeken met meer dan 1300 patiënten (6 jaar en ouder) met astma van variërende ziekteduur (20 jaar) en ernst.
Dubbelblinde, parallelle, placebogecontroleerde klinische onderzoeken met een duur van 12 weken en langer hebben aangetoond dat, vergeleken met placebo, PULMICORT TURBUHALER (budesonide) de longfunctie significant verbeterde (gemeten aan de hand van PEF en FEV1), en de ochtend- en avondsymptomen van astma significant verminderde en verminderde de behoefte aan zo nodig geïnhaleerd β2-agonistgebruik in doses van 400 mcg tot 1600 mcg per dag (200 mcg tot 800 mcg tweemaal daags) bij volwassenen en 400 mcg tot 800 mcg per dag (200 mcg tot 400 mcg tweemaal daags) bij pediatrische patiënten van 6 jaar en ouder.
Verbeterde longfunctie (ochtend-PEF) werd waargenomen binnen 24 uur na aanvang van de behandeling bij zowel volwassen als pediatrische patiënten van 6 jaar en ouder, hoewel het maximale voordeel niet werd bereikt binnen 1 tot 2 weken of langer na het starten van de behandeling. De verbeterde longfunctie bleef gedurende de 12 weken van het dubbelblinde deel van de onderzoeken behouden.
Patiënten die geen corticosteroïdtherapie krijgen
In een 12 weken durende klinische studie bij 273 patiënten met milde tot matige astma (gemiddelde FEV1 2,27 l bij aanvang) die niet goed onder controle waren met alleen luchtwegverwijders, werd PULMICORT 200 mcg TURBUHALER (budesonide) geëvalueerd in doses van 200 mcg tweemaal daags en 400 mcg tweemaal daags. dagelijks versus placebo. De FEV1-resultaten van deze proef zijn weergegeven in de onderstaande afbeelding. De longfunctie verbeterde significant bij beide doses PULMICORT 100mcg TURBUHALER (budesonide) in vergelijking met placebo.
Een proef van 12 weken bij patiënten die geen corticosteroïdtherapie ondergaan voorafgaand aan hun deelname aan het onderzoek
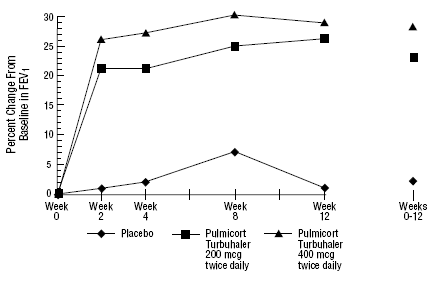
In een 12 maanden durende gecontroleerde studie bij 75 patiënten die niet eerder corticosteroïden kregen, resulteerde PULMICORT TURBUHALER (budesonide) van 200 mcg tweemaal daags in een verbeterde longfunctie (gemeten aan de hand van PEF) en verminderde bronchiale hyperreactiviteit in vergelijking met placebo.
Patiënten die eerder geïnhaleerde corticosteroïden kregen
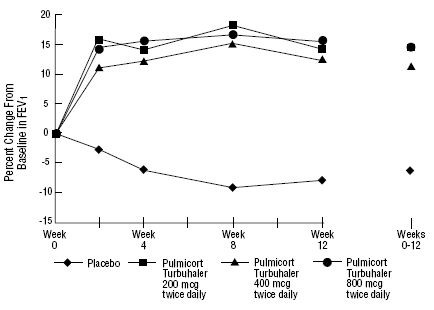
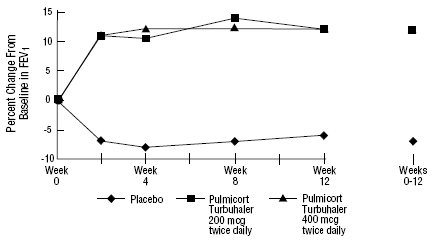
De veiligheid en werkzaamheid van PULMICORT 200mcg TURBUHALER (budesonide) werd ook geëvalueerd bij volwassen en pediatrische patiënten (leeftijd 6 tot 18 jaar) die eerder inhalatiecorticosteroïden kregen (volwassenen: N=473, gemiddelde uitgangswaarde FEV1 2,04 l, uitgangsdoses beclomethasondipropionaat 126 -1008 mcg/dag, kindergeneeskunde: N=404, gemiddelde uitgangswaarde FEV1 2,09 l, uitgangsdoses beclomethasondipropionaat 126-672 mcg/dag of triamcinolonacetonide 300-1800 mcg/dag). De FEV1-resultaten van deze twee onderzoeken, die beide 12 weken duren, worden weergegeven in de volgende figuren. De longfunctie verbeterde significant met alle doses PULMICORT TURBUHALER (budesonide) in vergelijking met placebo in beide onderzoeken.
Volwassen patiënten die eerder geïnhaleerde corticosteroïden kregen
Pediatrische patiënten van 6 tot 18 jaar die eerder inhalatiecorticosteroïden kregen
Patiënten die eenmaal daags PULMICORT TURBUHALER (budesonide) krijgen
De werkzaamheid en veiligheid van eenmaal daagse toediening van PULMICORT 100 mcg TURBUHALER (budesonide) 200 mcg en 400 mcg en placebo werden ook geëvalueerd bij 309 volwassen astmatische patiënten (gemiddelde baseline FEV1 2,7 l) in een 18 weken durende studie. Vergeleken met placebo vertoonden patiënten die eenmaal daags 200 of 400 mcg Pulmicort kregen een significant betere astmastabiliteit zoals beoordeeld door PEF en FEV1 gedurende een initiële behandelingsperiode van 6 weken, die werd gehandhaafd met een dagelijkse dosis van 200 mcg gedurende de daaropvolgende 12 weken. Hoewel de onderzoekspopulatie zowel patiënten omvatte die eerder werden behandeld met inhalatiecorticosteroïden, als patiënten die niet eerder werden behandeld met corticosteroïden, toonden de resultaten aan dat een eenmaal daagse dosering het duidelijkst effectief was voor die patiënten die eerder orale inhalatiecorticosteroïden bleven gebruiken (zie DOSERING EN ADMINISTRATIE ).
Patiënten die eerder orale corticosteroïden kregen
In een klinisch onderzoek bij 159 patiënten met ernstige astma die chronische orale prednisontherapie nodig hadden (gemiddelde prednisondosis bij aanvang 19,3 mg/dag) werd PULMICORT TURBUHALER (budesonide) in doses van 400 mcg tweemaal daags en 800 mcg tweemaal daags vergeleken met placebo gedurende een periode van 20 weken. periode. Ongeveer tweederde (68% op 400 mcg tweemaal daags en 64% op 800 mcg tweemaal daags) van de met PULMICORT TURBUHALER (budesonide) behandelde patiënten was in staat om aanhoudende (ten minste 2 weken) stopzetting van orale corticosteroïden te bereiken (vergeleken met 8% van met placebo behandelde patiënten) en verbeterde astmacontrole. De gemiddelde dosis orale corticosteroïden werd verlaagd met 83% op 400 mcg tweemaal daags en 79% op 800 mcg tweemaal daags voor met PULMICORT TURBUHALER (budesonide) behandelde patiënten versus 27% voor placebo. Bovendien bleven 58 van de 64 patiënten (91%) die orale corticosteroïden volledig elimineerden tijdens de dubbelblinde fase van de studie, gedurende nog eens 12 maanden geen orale corticosteroïden gebruiken terwijl ze PULMICORT 200mcg TURBUHALER (budesonide) kregen.
PATIËNT INFORMATIE
Instructies voor gebruik van de patiënt
Lees deze bijsluiter zorgvuldig door voordat u begint met het innemen van uw geneesmiddel. Het geeft een samenvatting van informatie over uw geneesmiddel. Door deze instructies op te volgen, kunt u ervoor zorgen dat u de medicatie op de juiste manier inhaleert.
VRAAG VOOR MEER INFORMATIE UW ARTS OF APOTHEKER.
WAT U MOET WETEN OVER PULMICORT TURBUHALER (budesonide)
Uw arts heeft PULMICORT TURBUHALER 200 mcg voorgeschreven. Het bevat een medicijn genaamd budesonide, een synthetische corticosteroïde. Corticosteroïden zijn natuurlijke stoffen die in het lichaam worden aangetroffen en die ontstekingen helpen bestrijden. Ze worden gebruikt om astma te behandelen omdat ze de zwelling en irritatie in de wanden van de kleine luchtwegen in de longen verminderen en ademhalingsproblemen verlichten. Bij regelmatige inademing helpen corticosteroïden ook om astma-aanvallen te voorkomen.
PULMICORT TURBUHALER (budesonide) behandelt de ontsteking - het "stille deel" van astma dat u niet kunt horen, zien of voelen. Wanneer de ontsteking onbehandeld blijft, kunnen uw astmasymptomen en -aanvallen toenemen. PULMICORT 200mcg TURBUHALER (budesonide) werkt om uw astmasymptomen en -aanvallen te voorkomen en te verminderen.
BELANGRIJKE PUNTEN OM TE ONTHOUDEN OVER PULMICORT TURBUHALER (budesonide)
ZORG ERVOOR dat dit geneesmiddel voor u geschikt is (zie “VOOR GEBRUIK VAN UW PULMICORT TURBUHALER (budesonide)”).
Het is belangrijk dat u elke dosis inhaleert zoals uw arts heeft geadviseerd.
Gebruik uw Turbuhaler zoals voorgeschreven door uw arts. STOP DE BEHANDELING NIET OF VERLAAG UW DOSIS NIET, ZELFS ALS U ZICH BETER voelt, tenzij uw arts u dit heeft verteld.
NIET DOEN inhaleer meer doses of gebruik uw Turbuhaler vaker dan uw arts heeft voorgeschreven.
Dit medicijn is NIET bedoeld om uw ademhalingsmoeilijkheden tijdens een astma-aanval snel te verlichten. Het moet met regelmatige tussenpozen worden ingenomen, zoals aanbevolen door uw arts, en niet als noodmaatregel.
Uw arts kan aanvullende medicatie voorschrijven (zoals luchtwegverwijders) voor noodhulp als een acute
Als u ook een ander geneesmiddel via inhalatie gebruikt, dient u uw arts te raadplegen voor instructies over wanneer u het moet gebruiken in verband met het gebruik van uw PULMICORT 100mcg TURBUHALER (budesonide).
VOORDAT U UW PULMICORT TURBUHALER (budesonide) GEBRUIKT
VERTEL UW ARTS VOORDAT U DIT GENEESMIDDEL BEGINT INDIEN U:
- zwanger bent (of van plan bent zwanger te worden),
- een baby borstvoeding geeft,
- allergisch bent voor budesonide of een ander oraal inhalatiecorticosteroïd,
- infecties hebben,
- tuberculose hebben of hebben gehad,
- osteoporose hebben,
- onlangs in de buurt bent geweest van iemand met waterpokken of mazelen,
- zijn van plan een operatie te ondergaan,
- een oraal corticosteroïd zoals prednison heeft gebruikt. Het kan zijn dat u specifieke instructies moet volgen om gezondheidsrisico's te vermijden die samenhangen met het stoppen met het gebruik van dit soort geneesmiddelen.
In sommige gevallen kan dit geneesmiddel niet geschikt zijn en kan uw arts u een ander geneesmiddel voorschrijven. Zorg ervoor dat uw arts weet welke andere geneesmiddelen u gebruikt, inclusief geneesmiddelen op recept en zonder recept, evenals eventuele vitamines of voedings- en kruidensupplementen.
WAT ZIJN DE MOGELIJKE BIJWERKINGEN VAN PULMICORT TURBUHALER (budesonide)?
Zoals bij alle inhalatiecorticosteroïden, moet u op de hoogte zijn van de volgende bijwerkingen:
- Verhoogde piepende ademhaling direct na inname van PULMICORT 100 mcg TURBUHALER (budesonide). Zorg dat u altijd een kortwerkend luchtwegverwijdersmedicijn bij u heeft om plotselinge piepende ademhaling te behandelen. Kortwerkende luchtwegverwijders helpen de spieren rond de luchtwegen in uw longen te ontspannen. Piepende ademhaling treedt op wanneer de spieren rond de luchtwegen zich aanspannen. Dit maakt het moeilijk om te ademen. In ernstige gevallen kan piepende ademhaling uw ademhaling stoppen en de dood veroorzaken als het niet meteen wordt behandeld.
- Effecten op het immuunsysteem en een grotere kans op infecties.
- Oogproblemen waaronder glaucoom en staar. Oogonderzoek moet worden overwogen tijdens het gebruik van PULMICORT TURBUHALER (budesonide).
- De groei van een kind moet regelmatig worden gecontroleerd tijdens het gebruik van PULMICOR TURBUHALER vanwege de mogelijkheid van vertraagde groei.
Op basis van klinische onderzoeken zijn de meest voorkomende bijwerkingen die zijn gemeld door patiënten die PULMICORT 100mcg TURBUHALER (budesonide) gebruiken:
- luchtweginfectie
- hoofdpijn
- griep symptomen
- keelpijn
- sinusitis
Dit zijn niet alle mogelijke bijwerkingen van PULMICORT TURBUHALER (budesonide). Vraag uw arts, beroepsbeoefenaar in de gezondheidszorg of apotheker om meer informatie.
GEBRUIK VAN UW PULMICORT TURBUHALER (budesonide)
- Volg de instructies die worden getoond in de sectie "HOE GEBRUIKT U UW PULMICORT 200mcg TURBUHALER". Als u problemen heeft, vertel dit dan aan uw arts of apotheker.
- Het is belangrijk dat u elke dosis inhaleert zoals voorgeschreven door uw arts. Op het etiket van de apotheek staat meestal welke dosis u moet nemen en hoe vaak. Als dit niet het geval is, of als u het niet zeker weet, raadpleeg dan uw arts of apotheker.
DOSERING
- Gebruik zoals voorgeschreven door uw arts.
- Het is ERG BELANGRIJK dat u de instructies van uw arts opvolgt over hoeveel inhalaties u moet nemen en hoe vaak u uw PULMICORT TURBUHALER (budesonide) moet gebruiken.
- NIET DOEN inhaleer meer doses of gebruik uw PULMICORT TURBUHALER (budesonide) vaker dan uw arts adviseert.
- Het kan 1 tot 2 weken of langer duren voordat u maximale verbetering voelt, dus HET IS ZEER BELANGRIJK DAT U PULMICORT 100mcg TURBUHALER (budesonide) REGELMATIG GEBRUIKT. STOP DE BEHANDELING NIET OF VERLAAG UW DOSIS NIET, ZELFS ALS U JE BETER VOELT, tenzij uw arts u dit heeft verteld.
- Als u een dosis overslaat, neem dan gewoon uw geplande volgende dosis wanneer het moet. VERDUBBEL de dosis NIET.
HOE GEBRUIKT U UW PULMICORT TURBUHALER (budesonide)
Lees de volledige instructies aandachtig door en gebruik het alleen zoals aangegeven.
PRIMING INSTRUCTIES:
Voordat u een nieuwe PULMICORT 200mcg TURBUHALER (budesonide) voor de eerste keer gebruikt, moet u deze primen. Draai hiervoor het deksel om en til het op. Houd de PULMICORT TURBUHALER (budesonide) rechtop (met het mondstuk omhoog), draai vervolgens de bruine greep volledig naar rechts en weer terug naar links. Herhalen. Nu bent u klaar om uw eerste dosis in te nemen (zie de instructies voor “DOSERING INNEMEN”). hoeft hem daarna niet meer voor te bereiden, ook niet als u hem voor langere tijd aan de kant zet.
EEN DOSIS INNEMEN:
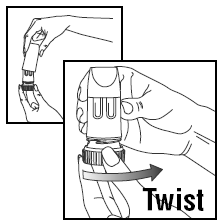
EEN DOSIS LADEN
- Draai het deksel en til het op.
- Om de juiste dosis te geven, PULMICORT TURBUHALER (budesonide) moet rechtop worden gehouden (mondstuk omhoog) wanneer een dosis medicatie wordt geladen.
- Draai de bruine greep zo ver mogelijk naar rechts. Draai hem weer helemaal naar links.
- U hoort een klik.
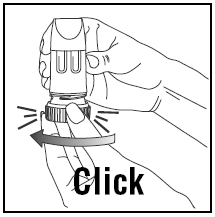
DE DOSIS INADEMEN
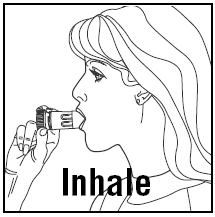
- Wanneer u inhaleert, moet PULMICORT 200mcg TURBUHALER (budesonide) rechtop (mondstuk omhoog) of horizontaal worden gehouden.
- Draai uw hoofd weg van de inhalator en adem uit. Schud de inhalator niet na het laden.
- Plaats het mondstuk tussen uw lippen en adem diep en krachtig in. Het kan zijn dat u de medicatie niet proeft of voelt.
- Kauw of bijt niet op het mondstuk.
- Haal de inhalator uit uw mond en adem uit. Blaas of adem niet in het mondstuk.
- Als er meer dan één dosis nodig is, herhaalt u gewoon de bovenstaande stappen.
- Als u klaar bent, plaatst u het deksel terug op de inhalator en draait u het dicht. Spoel uw mond met water. Niet doorslikken.
- Houd uw PULMICORT TURBUHALER (budesonide) te allen tijde schoon en droog.
- Gebruik PULMICORT TURBUHALER (budesonide) niet als deze is beschadigd of als het mondstuk is losgeraakt.
UW PULMICORT TURBUHALER BEWAREN (budesonide)
- Plaats na elk gebruik het witte deksel terug en draai het stevig op zijn plaats.
- Bewaar PULMICORT TURBUHALER (budesonide) op een droge plaats bij een gecontroleerde kamertemperatuur, 68-77 ° F (20-25 ° C).
- Bewaar uw PULMICORT TURBUHALER (budesonide) op een veilige plaats buiten de bereik van jonge kinderen.
- NIET DOEN gebruik na de datum die op de romp van uw Turbuhaler staat vermeld.
HOE WEET U WANNEER UW PULMICORT TURBUHALER (budesonide) LEEG IS
Het etiket op de doos of het deksel geeft aan hoeveel doses uw PULMICORT TURBUHALER bevat. Uw PULMICORT TURBUHALER (budesonide) heeft een handig dosisindicatievenster net onder het mondstuk.
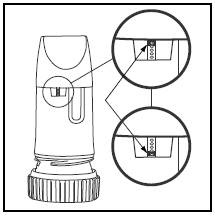
- Als er een rode markering boven aan het venster verschijnt, zijn er nog 20 doses geneesmiddel over. Dit is het moment om uw volgende PULMICORT 100mcg TURBUHALER (budesonide) aan te schaffen.
- Wanneer de rode markering de onderkant van het venster bereikt, moet uw inhalator worden weggegooid omdat deze mogelijk niet langer de juiste hoeveelheid medicatie afgeeft. (U kunt nog steeds een geluid horen als u ermee schudt - dit geluid is niet het medicijn. Dit geluid wordt geproduceerd door het droogmiddel in de Turbuhaler.)
- Vergeet niet dat u elke keer dat u uw recept bijvult een nieuwe inhalator krijgt.
- Dompel het niet onder in water om te zien of het leeg is. Controleer eenvoudig uw dosisindicatorvenster.
AANVULLENDE INFORMATIE OVER PULMICORT TURBUHALER (budesonide)
- PULMICORT 200mcg TURBUHALER (budesonide) levert uw geneesmiddel af als een zeer fijn poeder. Hierdoor mag je niet proeven, ruiken of voelen eventuele medicatie die in uw longen terechtkomt bij inademing van PULMICORT TURBUHALER (budesonide) Dit betekent niet dat u uw medicatie niet krijgt.
- PULMICORT 100mcg TURBUHALER (budesonide) mag niet worden gebruikt met een spacer.
- PULMICORT 100mcg TURBUHALER bevat alleen budesonide en bevat geen inactieve ingrediënten.
- PULMICORT TURBUHALER (budesonide) is speciaal ontworpen om slechts één dosis tegelijk toe te dienen, ongeacht hoe vaak u op de bruine greep klikt. Als u per ongeluk in uw inhalator blaast na het laden van een dosis, volg dan gewoon de instructies voor het laden van een nieuwe dosis.
Deze bijsluiter bevat niet de volledige informatie over uw geneesmiddel. Als u vragen heeft of ergens niet zeker van bent, neem dan contact op met uw arts of apotheker.
Misschien wilt u deze bijsluiter nog eens lezen. Gooi het alstublieft NIET WEG totdat u klaar bent met uw medicijn.
DENK ERAAN: dit geneesmiddel is aan u voorgeschreven door uw arts. Geef dit geneesmiddel NIET aan iemand anders.
GEBRUIK DIT PRODUCT ZOALS BESCHREVEN, TENZIJ UW ARTS ANDERS INSTRUCTIES HEEFT.
Als u nog vragen heeft over het gebruik van PULMICORT 100mcg TURBUHALER (budesonide), bel dan: 1-800-236-9933.
