Singulair 10mg, 4mg, 5mg Montelukast Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Singulair en hoe wordt het gebruikt?
Singulair 5 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van astma, door inspanning veroorzaakte bronchospasmen en allergische of het hele jaar door (langdurige) rhinitis. Singulair kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Singulair behoort tot een klasse geneesmiddelen die leukotrieenreceptorantagonisten worden genoemd.
- Het is niet bekend of Singulair veilig en effectief is bij kinderen jonger dan 1 jaar.
Wat zijn de mogelijke bijwerkingen van Singulair?
Singulair kan ernstige bijwerkingen veroorzaken, waaronder:
- ongewone veranderingen in stemming of gedrag,
- huiduitslag,
- blauwe plekken,
- ernstige tintelingen,
- doof gevoel,
- pijn,
- spier zwakte,
- oorpijn,
- zwelling,
- warmte,
- koorts,
- keelpijn,
- zwelling in uw gezicht of tong,
- branden in je ogen, en
- huidpijn, gevolgd door een rode of paarse uitslag die zich uitbreidt naar uw bovenlichaam en blaarvorming en vervelling veroorzaakt
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Singulair zijn:
- buikpijn,
- diarree,
- koorts,
- griep symptomen,
- verkoudheidsverschijnselen (verstopte neus, sinuspijn, hoesten, keelpijn),
- hoofdpijn, en
- bedplassen of verlies van controle over de blaas bij kinderen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Singulair. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Montelukast-natrium, het werkzame bestanddeel in SINGULAIR 4 mg, is een selectieve en oraal actieve leukotrieenreceptorantagonist die de cysteïnylleukotrieen-CysLT1-receptor remt.
Montelukast-natrium wordt chemisch beschreven als [R-(E)]-1-[[[1-[3-[2-(7-chloor-2-chinolinyl)ethenyl]fenyl]-3-[2-(1-hydroxy). -1-methylethyl)fenyl]propyl]thio]methyl]cyclopropaanazijnzuur, mononatriumzout.
De empirische formule is C35H35ClNNaO3S en het molecuulgewicht is 608,18. De structuurformule is:
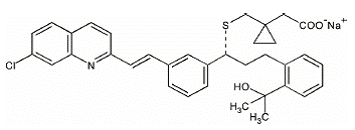
Montelukastnatrium is een hygroscopisch, optisch actief, wit tot gebroken wit poeder. Montelukast-natrium is goed oplosbaar in ethanol, methanol en water en praktisch onoplosbaar in acetonitril.
Elke filmomhulde SINGULAIR-tablet van 10 mg bevat 10,4 mg montelukast-natrium, wat overeenkomt met 10 mg montelukast, en de volgende inactieve ingrediënten: microkristallijne cellulose, lactosemonohydraat, croscarmellosenatrium, hydroxypropylcellulose en magnesiumstearaat. De filmcoating bestaat uit hydroxypropylmethylcellulose, hydroxypropylcellulose, titaniumdioxide, rood ijzeroxide, geel ijzeroxide en carnaubawas.
Elke kauwtablet van 4 mg en 5 mg SINGULAIR bevat respectievelijk 4,2 en 5,2 mg montelukast-natrium, wat overeenkomt met respectievelijk 4 en 5 mg montelukast. Beide kauwtabletten bevatten de volgende inactieve ingrediënten: mannitol, microkristallijne cellulose, hydroxypropylcellulose, rood ijzeroxide, croscarmellosenatrium, kersensmaakstof, aspartaam en magnesiumstearaat.
Elke verpakking van SINGULAIR 4 mg granulaat voor oraal gebruik bevat 4,2 mg montelukastnatrium, wat overeenkomt met 4 mg montelukast. De orale granulaatformulering bevat de volgende inactieve ingrediënten: mannitol, hydroxypropylcellulose en magnesiumstearaat.
INDICATIES
Astma
SINGULAIR® is geïndiceerd voor de profylaxe en chronische behandeling van astma bij volwassenen en pediatrische patiënten van 12 maanden en ouder.
Door inspanning geïnduceerde bronchoconstrictie (EIB)
SINGULAIR is geïndiceerd voor de preventie van door inspanning veroorzaakte bronchoconstrictie (EIB) bij patiënten van 6 jaar en ouder.
Allergische rhinitis
SINGULAIR 10 mg is geïndiceerd voor de verlichting van symptomen van seizoensgebonden allergische rhinitis bij patiënten van 2 jaar en ouder en niet-seizoensgebonden allergische rhinitis bij patiënten van 6 maanden en ouder. Omdat de voordelen van SINGULAIR 4 mg mogelijk niet opwegen tegen het risico op neuropsychiatrische symptomen bij patiënten met allergische rhinitis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ], reserveer gebruik voor patiënten die een ontoereikende respons of intolerantie hebben voor alternatieve therapieën.
Beperkingen van gebruik
SINGULAIR is niet geïndiceerd voor de behandeling van een acute astma-aanval.
DOSERING EN ADMINISTRATIE
Astma
Bij astma SINGULAIR eenmaal daags 's avonds oraal toedienen, met of zonder voedsel. Er zijn geen klinische onderzoeken uitgevoerd bij patiënten met astma om de relatieve werkzaamheid van ochtend- versus avonddosering te evalueren.
De volgende doseringen worden aanbevolen:
Patiënten die een dosis overslaan, moeten de volgende dosis op hun normale tijdstip innemen en mogen geen 2 doses tegelijk innemen.
Door inspanning geïnduceerde bronchoconstrictie (EIB)
Om EIB te voorkomen, dient u ten minste 2 uur voor het sporten een enkele dosis SINGULAIR 10 mg oraal toe te dienen. De volgende doseringen worden aanbevolen:
Een extra dosis SINGULAIR mag niet binnen 24 uur na een eerdere dosis worden ingenomen. Patiënten die SINGULAIR al dagelijks gebruiken voor een andere indicatie (waaronder chronische astma), mogen geen extra dosis nemen om EIB te voorkomen. Alle patiënten moeten een kortwerkende -agonist beschikbaar hebben voor redding.
Dagelijkse toediening van SINGULAIR voor de chronische behandeling van astma is niet vastgesteld om acute episodes van EIB te voorkomen.
Allergische rhinitis
Bij allergische rinitis dient u SINGULAIR 5 mg eenmaal daags oraal toe te dienen, ongeacht het tijdstip van inname van voedsel. Het tijdstip van toediening bij patiënten met allergische rhinitis kan worden aangepast aan de behoeften van de patiënt.
De volgende doses worden aanbevolen voor de behandeling van symptomen van seizoensgebonden allergische rhinitis:
Tabel 3: Aanbevolen dosering bij seizoensgebonden allergische rhinitis
Patiënten die een dosis overslaan, moeten de volgende dosis op hun normale tijdstip innemen en mogen geen 2 doses tegelijk innemen.
Astma en allergische rhinitis
Bij patiënten met zowel astma als allergische rhinitis, slechts eenmaal daags 's avonds één SINGULAIR-dosis oraal toedienen.
Patiënten die een dosis overslaan, moeten de volgende dosis op hun normale tijdstip innemen en mogen geen 2 doses tegelijk innemen.
Instructies voor toediening van orale korrels
SINGULAIR 4-mg granulaat voor oraal gebruik kan direct in de mond worden toegediend, opgelost in 1 theelepel (5 ml) koude of kamertemperatuur babyvoeding of moedermelk, of gemengd met een lepel koud of kamertemperatuur zacht voedsel; op basis van stabiliteitsstudies mogen alleen appelmoes, wortelen, rijst of ijs worden gebruikt. Het pakket mag pas worden geopend als het klaar is voor gebruik. Na het openen van de verpakking moet de volledige dosis (met of zonder vermenging met flesvoeding, moedermelk of voeding) binnen 15 minuten worden toegediend. Indien gemengd met babyvoeding, moedermelk of voedsel, mag SINGULAIR 4 mg granulaat voor oraal gebruik niet worden bewaard voor toekomstig gebruik. Gooi elk ongebruikt deel weg. SINGULAIR granulaat voor oraal gebruik is niet bedoeld om te worden opgelost in een andere vloeistof dan flesvoeding of moedermelk voor toediening. Na toediening kunnen echter vloeistoffen worden ingenomen. SINGULAIR granulaat voor oraal gebruik kan worden toegediend zonder rekening te houden met het tijdstip van de maaltijd.
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten
10 mg, beige, ronde, vierkante, filmomhulde tabletten, met aan de ene kant de code MSD 117 en aan de andere kant SINGULAIR 4 mg.
Kauwbare tabletten
5 mg, roze, rond, biconvex van vorm, met code MSD 275 aan de ene kant en SINGULAIR aan de andere.
Kauwbare tabletten
4 mg, roze, ovaal, biconvex van vorm, met aan de ene kant de code MSD 711 en aan de andere kant SINGULAIR.
Orale korrels
4 mg, wit granulaat met een nettogewicht van 500 mg, verpakt in een kindveilige folieverpakking.
Opslag en behandeling
SINGULAIR 4 mg granulaat voor oraal gebruik : witte korrels met een netto gewicht van 500 mg, verpakt in een kindveilige folieverpakking.
NDC 0006-3841-30 gebruikseenheid doos met 30 pakjes.
SINGULAIR 4 mg tabletten : roze, ovale, biconvexe kauwtabletten, met aan de ene kant de code MSD 711 en aan de andere kant SINGULAIR 10 mg.
NDC 0006-1711-31 gebruikseenheid hoge dichtheid polyethyleen (HDPE) flessen van 30 met een polypropyleen kindveilige dop, een aluminiumfolie inductieafdichting en silicagel droogmiddel.
SINGULAIR 5 mg tabletten roze, ronde, bi-convexe kauwtabletten, met aan de ene kant code MSD 275 en aan de andere kant SINGULAIR.
NDC 0006-9275-31 gebruikseenheid hoge dichtheid polyethyleen (HDPE) flessen van 30 met een polypropyleen kindveilige dop, een aluminiumfolie inductieafdichting en silicagel droogmiddel.
SINGULAIR 10 mg tabletten : beige, ronde, vierkante, filmomhulde tabletten, met aan de ene kant de code MSD 117 en aan de andere kant SINGULAIR 4 mg.
NDC 0006-9117-31 gebruikseenheid hoge dichtheid polyethyleen (HDPE) flessen van 30 met een polypropyleen kindveilige dop, een aluminiumfolie inductieafdichting en silicagel droogmiddel
NDC 0006-9117-54 gebruikseenheid hoge dichtheid polyethyleen (HDPE) flessen van 90 met een polypropyleen kindveilige dop, een aluminiumfolie inductieafdichting en silicagel droogmiddel.
Opslag
Bewaar SINGULAIR 4 mg granulaat voor oraal gebruik, 4 mg kauwtabletten, 5 mg kauwtabletten en 10 mg filmomhulde tabletten bij 20°C tot 25°C (68°F tot 77°F), excursies toegestaan tot 15° C tot 30 ° C (59 ° F tot 86 ° F) [zie USP-gecontroleerde kamertemperatuur]. Beschermen tegen vocht en licht. Bewaren in originele verpakking.
Gedistribueerd door: Merck Sharp & Dohme Corp., een dochteronderneming van MERCK & CO., INC., Whitehouse Station, VS. Herzien: februari 2021
BIJWERKINGEN
De volgende klinisch significante bijwerkingen worden elders in de etikettering beschreven:
- Neuropsychiatrische gebeurtenissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen. In de volgende beschrijving van ervaringen uit klinische onderzoeken worden bijwerkingen vermeld, ongeacht de beoordeling van de causaliteit.
De meest voorkomende bijwerkingen (incidentie ≥ 5% en meer dan placebo; vermeld in afnemende volgorde van frequentie) in gecontroleerde klinische onderzoeken waren: infectie van de bovenste luchtwegen, koorts, hoofdpijn, faryngitis, hoesten, buikpijn, diarree, middenoorontsteking, griep, rinorroe, sinusitis, otitis.
Volwassenen en adolescenten van 15 jaar en ouder met astma
De veiligheid van SINGULAIR 10 mg is in klinische onderzoeken onderzocht bij ongeveer 2950 volwassen en adolescente patiënten van 15 jaar en ouder. In placebogecontroleerde klinische onderzoeken kwamen de volgende bijwerkingen die zijn gemeld met SINGULAIR 4 mg voor bij meer dan of gelijk aan 1% van de patiënten en met een incidentie die groter was dan die bij patiënten die met placebo werden behandeld:
De frequentie van minder vaak voorkomende bijwerkingen was vergelijkbaar tussen SINGULAIR en placebo.
Het veiligheidsprofiel van SINGULAIR 10 mg, indien toegediend als een enkele dosis ter preventie van EIB bij volwassen en adolescente patiënten van 15 jaar en ouder, kwam overeen met het veiligheidsprofiel dat eerder voor SINGULAIR is beschreven.
In klinische onderzoeken werden in totaal 569 patiënten gedurende ten minste 6 maanden behandeld met SINGULAIR 10 mg, 480 gedurende één jaar en 49 gedurende twee jaar. Bij langdurige behandeling veranderde het bijwerkingenprofiel niet significant.
Pediatrische patiënten van 6 tot 14 jaar met astma
De veiligheid van SINGULAIR 10 mg is onderzocht bij 476 pediatrische patiënten van 6 tot 14 jaar. In klinische onderzoeken werden in totaal 289 pediatrische patiënten gedurende ten minste 6 maanden behandeld met SINGULAIR 10 mg en 241 gedurende een jaar of langer. Het veiligheidsprofiel van SINGULAIR in de 8 weken durende, dubbelblinde, pediatrische werkzaamheidsstudie was over het algemeen vergelijkbaar met het veiligheidsprofiel voor volwassenen. Bij pediatrische patiënten van 6 tot 14 jaar die SINGULAIR 5 mg kregen, traden de volgende reacties op met een frequentie 2% en vaker dan bij pediatrische patiënten die placebo kregen: faryngitis, griep, koorts, sinusitis, misselijkheid, diarree, dyspepsie, otitis, virale infectie en laryngitis. De frequentie van minder vaak voorkomende bijwerkingen was vergelijkbaar tussen SINGULAIR 4 mg en placebo. Bij langdurige behandeling veranderde het bijwerkingenprofiel niet significant.
Het veiligheidsprofiel van SINGULAIR 4 mg, indien toegediend als een enkele dosis ter preventie van EIB bij pediatrische patiënten van 6 jaar en ouder, kwam overeen met het veiligheidsprofiel dat eerder is beschreven voor SINGULAIR.
In onderzoeken naar de groeisnelheid was het veiligheidsprofiel bij deze pediatrische patiënten consistent met het eerder beschreven veiligheidsprofiel voor SINGULAIR. In een 56 weken durende, dubbelblinde studie waarin de groeisnelheid werd geëvalueerd bij pediatrische patiënten van 6 tot 8 jaar die SINGULAIR kregen, traden de volgende, niet eerder waargenomen reacties bij het gebruik van SINGULAIR in deze leeftijdsgroep op met een frequentie van ≥2% en vaker dan bij pediatrische patiënten die placebo kregen: hoofdpijn, rhinitis (infectieus), varicella, gastro-enteritis, atopische dermatitis, acute bronchitis, tandinfectie, huidinfectie en bijziendheid.
Pediatrische patiënten van 2 tot 5 jaar met astma
De veiligheid van SINGULAIR is beoordeeld op veiligheid bij 573 pediatrische patiënten van 2 tot 5 jaar in onderzoeken met enkelvoudige en meervoudige doses. In klinische onderzoeken werden in totaal 426 pediatrische patiënten van 2 tot 5 jaar behandeld met SINGULAIR 10 mg gedurende ten minste 3 maanden, 230 gedurende 6 maanden of langer en 63 patiënten gedurende een jaar of langer. Bij pediatrische patiënten van 2 tot 5 jaar die SINGULAIR kregen, traden de volgende reacties op met een frequentie ≥2% en vaker dan bij pediatrische patiënten die placebo kregen: koorts, hoesten, buikpijn, diarree, hoofdpijn, rinorroe, sinusitis, otitis, griep, huiduitslag, oorpijn, gastro-enteritis, eczeem, urticaria, varicella, longontsteking, dermatitis en conjunctivitis.
Pediatrische patiënten van 6 tot 23 maanden oud met astma
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 12 maanden met astma zijn niet vastgesteld.
De veiligheid van SINGULAIR 4 mg is onderzocht bij 175 pediatrische patiënten van 6 tot 23 maanden oud. Het veiligheidsprofiel van SINGULAIR in een 6 weken durende, dubbelblinde, placebogecontroleerde klinische studie was over het algemeen vergelijkbaar met het veiligheidsprofiel bij volwassenen en pediatrische patiënten van 2 tot 14 jaar. Bij pediatrische patiënten van 6 tot 23 maanden die SINGULAIR 5 mg kregen, traden de volgende reacties op met een frequentie 2% en vaker dan bij pediatrische patiënten die placebo kregen: infectie van de bovenste luchtwegen, piepende ademhaling; middenoorontsteking; faryngitis, tonsillitis, hoesten; en rinitis. De frequentie van minder vaak voorkomende bijwerkingen was vergelijkbaar tussen SINGULAIR en placebo.
Volwassenen en adolescenten van 15 jaar en ouder met seizoensgebonden allergische rhinitis
De veiligheid van SINGULAIR is in klinische onderzoeken onderzocht bij 2199 volwassen en adolescente patiënten van 15 jaar en ouder. SINGULAIR 10 mg eenmaal daags 's ochtends of' s avonds toegediend, had een veiligheidsprofiel dat vergelijkbaar was met dat van placebo. In placebogecontroleerde klinische onderzoeken werd de volgende reactie gemeld met SINGULAIR 5 mg met een frequentie ≥1% en met een incidentie hoger dan bij placebo: infectie van de bovenste luchtwegen, 1,9% van de patiënten die SINGULAIR 4 mg kregen versus 1,5% van de patiënten die placebo kregen. In een 4 weken durende, placebogecontroleerde klinische studie was het veiligheidsprofiel consistent met dat waargenomen in 2 weken durende onderzoeken. De incidentie van slaperigheid was in alle onderzoeken vergelijkbaar met die van placebo.
Pediatrische patiënten van 2 tot 14 jaar met seizoensgebonden allergische rhinitis
SINGULAIR 5 mg is geëvalueerd bij 280 pediatrische patiënten van 2 tot 14 jaar in een 2 weken durende, multicenter, dubbelblinde, placebogecontroleerde veiligheidsstudie met parallelle groepen. SINGULAIR eenmaal daags 's avonds toegediend had een veiligheidsprofiel dat vergelijkbaar was met dat van placebo. In deze studie traden de volgende reacties op met een frequentie ≥2% en met een incidentie groter dan bij placebo: hoofdpijn, middenoorontsteking, faryngitis en infectie van de bovenste luchtwegen.
Volwassenen en adolescenten van 15 jaar en ouder met niet-seizoensgebonden allergische rhinitis
De veiligheid van SINGULAIR is beoordeeld op veiligheid bij 3357 volwassen en adolescente patiënten van 15 jaar en ouder met niet-seizoensgebonden allergische rhinitis van wie er 1632 SINGULAIR kregen in twee klinische onderzoeken van 6 weken. SINGULAIR 10 mg eenmaal daags toegediend had een veiligheidsprofiel dat consistent was met dat waargenomen bij patiënten met seizoensgebonden allergische rhinitis en vergelijkbaar met dat van placebo. In deze twee onderzoeken werden de volgende reacties gemeld met SINGULAIR met een frequentie ≥1% en met een incidentie hoger dan bij placebo: sinusitis, infectie van de bovenste luchtwegen, sinushoofdpijn, hoesten, epistaxis en verhoogd ALAT. De incidentie van slaperigheid was vergelijkbaar met die van placebo.
Pediatrische patiënten van 6 maanden tot 14 jaar met niet-seizoensgebonden allergische rhinitis
De veiligheid bij patiënten van 2 tot 14 jaar met niet-seizoensgebonden allergische rhinitis wordt ondersteund door de veiligheid bij patiënten van 2 tot 14 jaar met seizoensgebonden allergische rhinitis. De veiligheid bij patiënten van 6 tot 23 maanden oud wordt ondersteund door gegevens uit farmacokinetische en veiligheids- en werkzaamheidsstudies bij astma bij deze pediatrische populatie en uit farmacokinetische studies bij volwassenen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van SINGULAIR na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed- en lymfestelselaandoeningen verhoogde bloedingsneiging, trombocytopenie
Immuunsysteemaandoeningen overgevoeligheidsreacties waaronder anafylaxie, hepatische eosinofiele infiltratie
Psychische stoornissen waaronder, maar niet beperkt tot, agitatie, agressief gedrag of vijandigheid, angst, depressie, desoriëntatie, aandachtsstoornis, droomafwijkingen, dysfemie (stotteren), hallucinaties, slapeloosheid, prikkelbaarheid, geheugenstoornis, obsessief-compulsieve symptomen, rusteloosheid, somnambulisme, zelfmoordgedachten en -gedrag (inclusief zelfmoord), tic en tremor [zie GEVAARLIJKE WAARSCHUWING: , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Zenuwstelselaandoeningen slaperigheid, paresthesie/hypo-esthesie, toevallen
Hartaandoeningen hartkloppingen
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen epistaxis, pulmonale eosinofilie
Maagdarmstelselaandoeningen diarree, dyspepsie, misselijkheid, pancreatitis, braken
Lever- en galaandoeningen Gevallen van cholestatische hepatitis, hepatocellulair leverletsel en leverletsel met een gemengd patroon zijn gemeld bij patiënten die met SINGULAIR werden behandeld. De meeste hiervan traden op in combinatie met andere verstorende factoren, zoals het gebruik van andere medicijnen, of wanneer SINGULAIR werd toegediend aan patiënten met een onderliggende kans op een leveraandoening, zoals alcoholgebruik of andere vormen van hepatitis.
Huid- en onderhuidaandoeningen angio-oedeem, blauwe plekken, erythema multiforme, erythema nodosum, pruritus, Stevens-Johnson-syndroom/toxische epidermale necrolyse, urticaria
Skeletspierstelsel- en bindweefselaandoeningen artralgie, myalgie inclusief spierkrampen
Nier- en urinewegaandoeningen enuresis bij kinderen
Algemene aandoeningen en toedieningsplaatsstoornissen oedeem
Patiënten met astma die met SINGULAIR worden behandeld, kunnen systemische eosinofilie vertonen, soms met klinische kenmerken van vasculitis die passen bij het syndroom van Churg-Strauss, een aandoening die vaak wordt behandeld met systemische therapie met corticosteroïden. Deze reacties zijn soms in verband gebracht met de verlaging van de behandeling met orale corticosteroïden. Artsen moeten alert zijn op eosinofilie, vasculitische uitslag, verergering van longsymptomen, hartcomplicaties en/of neuropathie die zich bij hun patiënten voordoen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
DRUG-INTERACTIES
Er is geen dosisaanpassing nodig wanneer SINGULAIR 5 mg gelijktijdig wordt toegediend met theofylline, prednison, prednisolon, orale anticonceptiva, fexofenadine, digoxine, warfarine, gemfibrozil, itraconazol, schildklierhormonen, sedatieve hypnotica, niet-steroïde anti-inflammatoire middelen, benzodiazepinen, en cytochroom P450 (CYP) enzyminductoren [zie KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Neuropsychiatrische gebeurtenissen
Ernstige neuropsychiatrische (NP) voorvallen zijn gemeld bij het gebruik van SINGULAIR. Deze postmarketingmeldingen waren zeer variabel en omvatten, maar waren niet beperkt tot, agitatie, agressief gedrag of vijandigheid, angstgevoelens, depressie, desoriëntatie, aandachtsstoornis, droomafwijkingen, dysfemie (stotteren), hallucinaties, slapeloosheid, prikkelbaarheid, geheugenstoornis, obsessief-compulsieve symptomen, rusteloosheid, somnambulisme, zelfmoordgedachten en -gedrag (inclusief zelfmoord), tic en tremor. Voorvallen van NP zijn gemeld bij volwassen, adolescente en pediatrische patiënten met en zonder een voorgeschiedenis van psychiatrische stoornis. NP-gebeurtenissen zijn meestal gemeld tijdens behandeling met SINGULAIR 10 mg, maar sommige werden gemeld na stopzetting van SINGULAIR 5 mg. Dierstudies hebben aangetoond dat montelukast zich bij ratten in de hersenen verspreidt [zie KLINISCHE FARMACOLOGIE ]; de mechanismen die ten grondslag liggen aan SINGULAIR-geassocieerde NP-gebeurtenissen worden momenteel echter niet goed begrepen. Op basis van de beschikbare gegevens is het moeilijk om risicofactoren te identificeren voor of het risico op NP-gebeurtenissen te kwantificeren bij gebruik van SINGULAIR 10 mg.
Vanwege het risico op NP-gebeurtenissen wegen de voordelen van SINGULAIR bij sommige patiënten mogelijk niet op tegen de risico's, met name wanneer de symptomen van de ziekte mild kunnen zijn en adequaat kunnen worden behandeld met alternatieve therapieën. Reserveer het gebruik van SINGULAIR 4 mg voor patiënten met allergische rhinitis die onvoldoende reageren op of intolerant zijn voor alternatieve therapieën [zie INDICATIES ]. Overweeg bij patiënten met astma of door inspanning veroorzaakte bronchoconstrictie de voordelen en risico's voordat SINGULAIR wordt voorgeschreven.
Bespreek de voordelen en risico's van het gebruik van SINGULAIR 10 mg met patiënten en zorgverleners bij het voorschrijven van SINGULAIR. Adviseer patiënten en/of zorgverleners alert te zijn op gedragsveranderingen of nieuwe NP-symptomen bij het gebruik van SINGULAIR. Als gedragsveranderingen worden waargenomen, of als nieuwe NP-symptomen of zelfmoordgedachten en/of -gedrag optreden, adviseer patiënten dan om te stoppen met SINGULAIR 10 mg en onmiddellijk contact op te nemen met een zorgverlener. In veel gevallen verdwenen de symptomen na stopzetting van de behandeling met SINGULAIR; in sommige gevallen hielden de symptomen echter aan na stopzetting van SINGULAIR. Blijf daarom controleren en ondersteunende zorg verlenen totdat de symptomen zijn verdwenen. Evalueer opnieuw de voordelen en risico's van het hervatten van de behandeling met SINGULAIR 10 mg als dergelijke gebeurtenissen zich voordoen.
Acuut astma
SINGULAIR is niet geïndiceerd voor gebruik bij het omkeren van bronchospasmen bij acute astma-aanvallen, waaronder status astmaticus. Patiënten moeten worden geadviseerd om geschikte noodmedicatie beschikbaar te hebben. De therapie met SINGULAIR 4 mg kan worden voortgezet tijdens acute exacerbaties van astma. Patiënten die astma-exacerbaties hebben na inspanning, moeten een kortwerkende inhalatie-β-agonist ter beschikking hebben.
Gelijktijdig gebruik van corticosteroïden
Hoewel de dosis inhalatiecorticosteroïden onder medisch toezicht geleidelijk kan worden verlaagd, mag SINGULAIR niet abrupt worden vervangen door inhalatie- of orale corticosteroïden.
Aspirinegevoeligheid
Patiënten met een bekende gevoeligheid voor aspirine moeten aspirine of niet-steroïde anti-inflammatoire middelen blijven vermijden tijdens het gebruik van SINGULAIR. Hoewel SINGULAIR effectief is in het verbeteren van de luchtwegfunctie bij astmapatiënten met gedocumenteerde gevoeligheid voor aspirine, is niet aangetoond dat het de bronchoconstrictorrespons op aspirine en andere niet-steroïde anti-inflammatoire geneesmiddelen afknijpt bij aspirine-gevoelige astmapatiënten [zie Klinische studies ].
Eosinofiele aandoeningen
Patiënten met astma die met SINGULAIR worden behandeld, kunnen systemische eosinofilie vertonen, soms met klinische kenmerken van vasculitis die passen bij het syndroom van Churg-Strauss, een aandoening die vaak wordt behandeld met systemische therapie met corticosteroïden. Deze voorvallen zijn soms in verband gebracht met de verlaging van de behandeling met orale corticosteroïden. Artsen dienen alert te zijn op eosinofilie, vasculitische uitslag, verergering van longsymptomen, hartcomplicaties en/of neuropathie bij hun patiënten. Een oorzakelijk verband tussen SINGULAIR 10 mg en deze onderliggende aandoeningen is niet vastgesteld [zie ONGEWENSTE REACTIES ].
Risico bij patiënten met fenylketonurie
SINGULAIR 4 mg bevat aspartaam, een bron van fenylalanine. Fenylalanine kan schadelijk zijn voor patiënten met fenylketonurie (PKU). Elke kauwtablet van 4 mg en 5 mg bevat respectievelijk 0,674 mg en 0,842 mg fenylalanine. Overweeg voordat u SINGULAIR aan een patiënt met PKU voorschrijft de gecombineerde dagelijkse hoeveelheid fenylalanine uit alle bronnen, inclusief SINGULAIR.
Informatie over patiëntbegeleiding
Adviseer de patiënt en/of zorgverlener voor de tabletten en kauwtabletten om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Adviseer de patiënt en/of zorgverlener voor het orale granulaat om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids en gebruiksaanwijzing ).
- Adviseer patiënten over het mogelijke risico op ernstige neuropsychiatrische symptomen en gedragsveranderingen bij gebruik van SINGULAIR [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Bespreek de voordelen en risico's van SINGULAIR met patiënten bij het voorschrijven of voortzetten van de behandeling met SINGULAIR [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Adviseer patiënten om te controleren op gedragsveranderingen of neuropsychiatrische symptomen bij patiënten die SINGULAIR gebruiken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Instrueer patiënten om te stoppen met SINGULAIR en onmiddellijk contact op te nemen met een zorgverlener als er veranderingen in gedrag of denken optreden die niet typisch zijn voor de patiënt, of als de patiënt suïcidale gedachten of suïcidaal gedrag ontwikkelt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Adviseer patiënten om SINGULAIR dagelijks in te nemen zoals voorgeschreven, zelfs als ze asymptomatisch zijn, en tijdens perioden van verergering van astma, en om contact op te nemen met hun arts als hun astma niet goed onder controle is.
- Adviseer patiënten dat orale SINGULAIR niet bedoeld is voor de behandeling van acute astma-aanvallen. Zij moeten over geschikte kortwerkende geïnhaleerde bèta-agonistenmedicatie beschikken om astma-exacerbaties te behandelen. Patiënten die astma-exacerbaties hebben na inspanning, dienen te worden geïnstrueerd om een kortwerkende inhalatie-β-agonist ter beschikking te hebben als redding. Dagelijkse toediening van SINGULAIR voor de chronische behandeling van astma is niet vastgesteld om acute episodes van EIB te voorkomen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Adviseer patiënten om medische hulp in te roepen als kortwerkende inhalatieluchtwegverwijders vaker dan normaal nodig zijn, of als meer dan het maximale aantal inhalaties van kortwerkende luchtwegverwijders nodig is, voorgeschreven voor een periode van 24 uur.
- Instrueer patiënten om andere anti-astmamedicatie voort te zetten zoals voorgeschreven, tenzij geïnstrueerd door een arts.
- Instrueer patiënten met een bekende gevoeligheid voor aspirine om aspirine of niet-steroïde anti-inflammatoire middelen te blijven vermijden terwijl ze SINGULAIR gebruiken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Informeer patiënten met fenylketonurie dat de kauwtabletten van 4 mg en 5 mg fenylalanine (een bron van aspartaam) bevatten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er werd geen bewijs van tumorigeniciteit waargenomen in carcinogeniteitsonderzoeken van ofwel 2 jaar bij Sprague-Dawley-ratten of 92 weken bij muizen bij orale gavagedoses tot respectievelijk 200 mg/kg/dag of 100 mg/kg/dag. De geschatte blootstelling bij ratten was respectievelijk ongeveer 120 en 75 keer de AUC voor volwassenen en kinderen bij de maximaal aanbevolen dagelijkse orale dosis. De geschatte blootstelling bij muizen was respectievelijk ongeveer 45 en 25 keer de AUC voor volwassenen en kinderen bij de maximaal aanbevolen dagelijkse orale dosis.
Montelukast toonde geen bewijs van mutagene of clastogene activiteit in de volgende testen: de microbiële mutagenesetest, de V-79 zoogdiercelmutagenesetest, de alkalische elutietest in rattenhepatocyten, de chromosomale aberratietest in ovariumcellen van Chinese hamsters en in de vivo muis beenmerg chromosomale aberratie-assay.
In vruchtbaarheidsonderzoeken bij vrouwelijke ratten veroorzaakte montelukast verlagingen van de vruchtbaarheids- en vruchtbaarheidsindexen bij een orale dosis van 200 mg/kg (geschatte blootstelling was ongeveer 70 maal de AUC voor volwassenen bij de maximaal aanbevolen dagelijkse orale dosis). Er werden geen effecten op de vrouwelijke vruchtbaarheid of vruchtbaarheid waargenomen bij een orale dosis van 100 mg/kg (geschatte blootstelling was ongeveer 20 maal de AUC voor volwassenen bij de maximaal aanbevolen dagelijkse orale dosis). Montelukast had geen effect op de vruchtbaarheid bij mannelijke ratten bij orale doses tot 800 mg/kg (geschatte blootstelling was ongeveer 160 maal de AUC voor volwassenen bij de maximaal aanbevolen dagelijkse orale dosis).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beschikbare gegevens van gepubliceerde prospectieve en retrospectieve cohortstudies over decennia met het gebruik van montelukast bij zwangere vrouwen hebben geen geneesmiddel-geassocieerd risico op ernstige geboorteafwijkingen aangetoond [zie Gegevens ]. In reproductiestudies bij dieren werden geen nadelige ontwikkelingseffecten waargenomen bij orale toediening van montelukast aan drachtige ratten en konijnen tijdens de organogenese in doses van respectievelijk ongeveer 100 en 110 maal de maximaal aanbevolen dagelijkse orale dosis voor de mens (MRHDOD) op basis van de AUC's (zie Gegevens ].
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de
In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Slecht of matig gecontroleerd astma tijdens de zwangerschap verhoogt het maternale risico op perinatale bijwerkingen zoals pre-eclampsie en vroeggeboorte, een laag geboortegewicht en klein voor de zwangerschapsduur.
Gegevens
Menselijke gegevens
Gepubliceerde gegevens van prospectieve en retrospectieve cohortonderzoeken hebben geen verband aangetoond met het gebruik van SINGULAIR tijdens de zwangerschap en ernstige geboorteafwijkingen. Beschikbare onderzoeken hebben methodologische beperkingen, waaronder een kleine steekproefomvang, in sommige gevallen retrospectieve gegevensverzameling en inconsistente vergelijkingsgroepen.
Dierlijke gegevens
In embryo-foetale ontwikkelingsstudies veroorzaakte montelukast toegediend aan drachtige ratten en konijnen tijdens de organogenese (draagtijd 6 tot 17 bij ratten en 6 tot 18 bij konijnen) geen nadelige ontwikkelingseffecten bij orale doses van de moeder tot 400 en 300 mg/kg /dag bij respectievelijk ratten en konijnen (respectievelijk ongeveer 100 en 110 keer de AUC bij mensen bij de MRHDOD).
Borstvoeding
Risico Samenvatting
Een gepubliceerde klinische lactatiestudie meldt de aanwezigheid van montelukast in moedermelk. Gegevens beschikbaar over de effecten van het geneesmiddel op zuigelingen, hetzij direct [zie Pediatrisch gebruik of via moedermelk, duiden niet op een significant risico op bijwerkingen door blootstelling aan SINGULAIR. De effecten van het medicijn op de melkproductie zijn onbekend. Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan SINGULAIR 5 mg en eventuele bijwerkingen op de zuigeling die borstvoeding krijgt van SINGULAIR 10 mg of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van SINGULAIR voor astma zijn vastgesteld bij pediatrische patiënten van 6 tot 14 jaar. Het gebruik van SINGULAIR 4 mg voor deze indicatie wordt ondersteund door bewijs uit goed gecontroleerde onderzoeken. Gegevens over veiligheid en werkzaamheid in deze leeftijdsgroep zijn vergelijkbaar met die bij volwassenen [zie: ONGEWENSTE REACTIES , KLINISCHE FARMACOLOGIE , Specifieke populaties , en Klinische studies ].
De werkzaamheid van SINGULAIR voor de behandeling van seizoensgebonden allergische rhinitis bij pediatrische patiënten van 2 tot 14 jaar en voor de behandeling van niet-seizoensgebonden allergische rhinitis bij pediatrische patiënten van 6 maanden tot 14 jaar is vastgesteld en wordt ondersteund door extrapolatie van de aangetoonde werkzaamheid bij patiënten van 15 jaar en ouder met allergische rhinitis, evenals de veronderstelling dat het ziekteverloop, de pathofysiologie en het effect van het geneesmiddel in deze populaties nagenoeg gelijk zijn.
De veiligheid van SINGULAIR 4 mg kauwtabletten bij pediatrische patiënten van 2 tot 5 jaar met astma is aangetoond door adequate en goed gecontroleerde gegevens [zie ONGEWENSTE REACTIES ]. De werkzaamheid van SINGULAIR 5 mg in deze leeftijdsgroep is geëxtrapoleerd van de aangetoonde werkzaamheid bij patiënten van 6 jaar en ouder met astma en is gebaseerd op vergelijkbare farmacokinetische gegevens, evenals op de veronderstelling dat het ziekteverloop, de pathofysiologie en het effect van het geneesmiddel nagenoeg hetzelfde zijn onder deze bevolkingsgroepen. De effectiviteit in deze leeftijdsgroep wordt ondersteund door verkennende werkzaamheidsbeoordelingen van een groot, goed gecontroleerd veiligheidsonderzoek dat is uitgevoerd bij patiënten van 2 tot 5 jaar.
De veiligheid van SINGULAIR 4 mg granulaat voor oraal gebruik bij pediatrische patiënten van 12 tot 23 maanden met astma is aangetoond in een analyse van 172 pediatrische patiënten, van wie 124 werden behandeld met SINGULAIR, in een 6 weken durende, dubbelblinde placebo -gecontroleerde studie [zie ONGEWENSTE REACTIES ]. De werkzaamheid van SINGULAIR in deze leeftijdsgroep is geëxtrapoleerd van de aangetoonde werkzaamheid bij patiënten van 6 jaar en ouder met astma op basis van een vergelijkbare gemiddelde systemische blootstelling (AUC), en dat het ziekteverloop, de pathofysiologie en het effect van het geneesmiddel in deze populaties nagenoeg gelijk zijn. , ondersteund door werkzaamheidsgegevens van een veiligheidsonderzoek waarin de werkzaamheid een verkennende beoordeling was.
De veiligheid van SINGULAIR 4 mg en 5 mg kauwtabletten bij pediatrische patiënten van 2 tot 14 jaar met allergische rhinitis wordt ondersteund door gegevens uit onderzoeken die zijn uitgevoerd bij pediatrische patiënten van 2 tot 14 jaar met astma. Een veiligheidsonderzoek bij pediatrische patiënten van 2 tot 14 jaar met seizoensgebonden allergische rhinitis toonde een vergelijkbaar veiligheidsprofiel aan [zie: ONGEWENSTE REACTIES ]. De veiligheid van SINGULAIR 4 mg granulaat voor oraal gebruik bij pediatrische patiënten vanaf 6 maanden met niet-seizoensgebonden allergische rhinitis wordt ondersteund door extrapolatie van veiligheidsgegevens verkregen uit onderzoeken uitgevoerd bij pediatrische patiënten van 6 maanden tot 23 maanden met astma en uit farmacokinetische gegevens het vergelijken van systemische blootstellingen bij patiënten van 6 maanden tot 23 maanden oud met systemische blootstellingen bij volwassenen.
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 12 maanden met astma, 6 maanden met niet-seizoensgebonden allergische rhinitis en 6 jaar met door inspanning geïnduceerde bronchoconstrictie zijn niet vastgesteld.
Groeisnelheid bij pediatrische patiënten
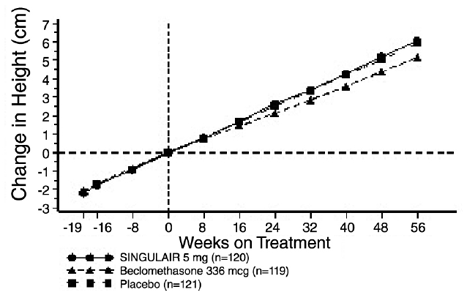
Een 56 weken durende, multicenter, dubbelblinde, gerandomiseerde, actieve en placebogecontroleerde studie met parallelle groepen werd uitgevoerd om het effect van SINGULAIR 4 mg op de groeisnelheid te beoordelen bij 360 patiënten met milde astma in de leeftijd van 6 tot 8 jaar. De behandelingsgroepen omvatten SINGULAIR 5 mg eenmaal daags, placebo en beclomethasondipropionaat toegediend als 168 mcg tweemaal daags met een voorzetapparaat. Voor elke proefpersoon werd een groeisnelheid gedefinieerd als de helling van een lineaire regressielijn die past bij de lengtemetingen gedurende 56 weken. De primaire vergelijking was het verschil in groeisnelheid tussen SINGULAIR- en placebogroepen. De groeipercentages, uitgedrukt als het kleinste-kwadratengemiddelde (LS) (95% BI) in cm/jaar, voor de behandelingsgroepen met SINGULAIR, placebo en beclomethason waren 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) en 4,86 ( 4,64, 5,08), respectievelijk. De verschillen in groeisnelheid, uitgedrukt als kleinste kwadraten (LS) gemiddelde (95% BI) in cm/jaar, voor de behandelingsgroepen SINGULAIR 5 mg minus placebo, beclomethason minus placebo en SINGULAIR 5 mg minus beclomethason waren 0,03 (-0,26; 0,31) , -0,78 (-1,06, -0,49); en 0,81 (0,53, 1,09), respectievelijk. De groeisnelheid (uitgedrukt als gemiddelde verandering in lengte in de loop van de tijd) voor elke behandelingsgroep wordt weergegeven in AFBEELDING 1.
Figuur 1: Verandering in hoogte (cm) van randomisatiebezoek per geplande week (gemiddelde behandelingsgroep ± standaardfout* van het gemiddelde)
Geriatrisch gebruik
Van het totale aantal proefpersonen in klinische onderzoeken met montelukast was 3,5% 65 jaar en ouder en 0,4% was 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten. Het farmacokinetische profiel en de orale biologische beschikbaarheid van een enkelvoudige orale dosis van 10 mg montelukast zijn vergelijkbaar bij oudere en jongere volwassenen. De plasmahalfwaardetijd van montelukast is iets langer bij ouderen. Bij ouderen is geen dosisaanpassing nodig.
Leverfunctiestoornis
Er wordt geen dosisaanpassing aanbevolen bij patiënten met milde tot matige leverinsufficiëntie [zie: KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Er wordt geen dosisaanpassing aanbevolen bij patiënten met nierinsufficiëntie [zie: KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Er is geen specifieke informatie beschikbaar over de behandeling van overdosering met SINGULAIR. In geval van overdosering is het redelijk om de gebruikelijke ondersteunende maatregelen te nemen; verwijder bijvoorbeeld niet-geabsorbeerd materiaal uit het maagdarmkanaal, pas klinische controle toe en stel zo nodig ondersteunende therapie in. Het is niet bekend of montelukast wordt verwijderd door peritoneale dialyse of hemodialyse.
CONTRA-INDICATIES
SINGULAIR is gecontra-indiceerd bij patiënten met overgevoeligheid voor een van de componenten.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
De cysteïnylleukotriënen (LTC4, LTD4, LTE4) zijn producten van het arachidonzuurmetabolisme en komen vrij uit verschillende cellen, waaronder mestcellen en eosinofielen. Deze eicosanoïden binden aan cysteïnylleukotriene (CysLT) -receptoren. De CysLT type-1 (CysLT1)-receptor wordt aangetroffen in de menselijke luchtwegen (inclusief gladde spiercellen van de luchtwegen en macrofagen van de luchtwegen) en op andere pro-inflammatoire cellen (inclusief eosinofielen en bepaalde myeloïde stamcellen). CysLT's zijn gecorreleerd met de pathofysiologie van astma en allergische rhinitis. Bij astma omvatten leukotrieen-gemedieerde effecten luchtwegoedeem, contractie van gladde spieren en veranderde cellulaire activiteit geassocieerd met het ontstekingsproces. Bij allergische rhinitis komen CysLT's vrij uit het neusslijmvlies na blootstelling aan allergenen tijdens zowel vroege als late fase reacties en worden geassocieerd met symptomen van allergische rhinitis.
Montelukast is een oraal werkzame stof die met hoge affiniteit en selectiviteit bindt aan de CysLT1-receptor (in plaats van andere farmacologisch belangrijke luchtwegreceptoren, zoals de prostanoïde, cholinerge of β-adrenerge receptor). Montelukast remt de fysiologische werking van LTD4 op de CysLT1-receptor zonder enige agonistische activiteit.
farmacodynamiek
Montelukast veroorzaakt remming van cysteïnylleukotrieenreceptoren in de luchtwegen, zoals aangetoond door het vermogen om bronchoconstrictie als gevolg van geïnhaleerde LTD4 bij astmapatiënten te remmen. Doses zo laag als 5 mg veroorzaken een aanzienlijke blokkering van LTD4-geïnduceerde bronchoconstrictie. In een placebogecontroleerd, cross-over onderzoek (n=12) remde SINGULAIR 4 mg bronchoconstrictie in de vroege en late fase als gevolg van antigeenprovocatie met respectievelijk 75% en 57%.
Het effect van SINGULAIR 5 mg op eosinofielen in het perifere bloed is in klinische onderzoeken onderzocht. Bij patiënten met astma van 2 jaar en ouder die SINGULAIR 10 mg kregen, werd een daling van het gemiddelde aantal eosinofielen in het perifere bloed van 9% tot 15% waargenomen, vergeleken met placebo, gedurende de dubbelblinde behandelingsperioden. Bij patiënten met seizoensgebonden allergische rinitis van 15 jaar en ouder die SINGULAIR 4 mg kregen, werd een gemiddelde toename van 0,2% van het aantal eosinofielen in het perifere bloed waargenomen, vergeleken met een gemiddelde toename van 12,5% bij met placebo behandelde patiënten, ten opzichte van de dubbelblinde behandeling periodes; dit weerspiegelt een gemiddeld verschil van 12,3% in het voordeel van SINGULAIR. De relatie tussen deze waarnemingen en de klinische voordelen van montelukast die in klinische onderzoeken werden opgemerkt, is niet bekend [zie: Klinische studies ].
Farmacokinetiek
Absorptie
Montelukast wordt snel geabsorbeerd na orale toediening. Na toediening van de 10 mg filmomhulde tablet aan nuchtere volwassenen, wordt de gemiddelde piekplasmaconcentratie (Cmax) van montelukast bereikt in 3 tot 4 uur (Tmax). De gemiddelde orale biologische beschikbaarheid is 64%. De orale biologische beschikbaarheid en Cmax worden niet beïnvloed door een standaardmaaltijd in de ochtend.
Voor de kauwtablet van 5 mg wordt de gemiddelde Cmax bereikt in 2 tot 2,5 uur na toediening aan nuchtere volwassenen. De gemiddelde orale biologische beschikbaarheid is 73% in nuchtere toestand versus 63% bij toediening bij een standaardmaaltijd in de ochtend.
Voor de kauwtablet van 4 mg wordt de gemiddelde Cmax 2 uur na toediening bereikt bij pediatrische patiënten van 2 tot 5 jaar in nuchtere toestand.
De formulering van 4 mg granulaat voor oraal gebruik is bio-equivalent aan de kauwtablet van 4 mg indien toegediend aan volwassenen in nuchtere toestand. Gelijktijdige toediening van de orale granulaatformulering met appelmoes had geen klinisch significant effect op de farmacokinetiek van montelukast. Een vetrijke maaltijd in de ochtend had geen invloed op de AUC van montelukast granulaat voor oraal gebruik; de maaltijd verlaagde echter de Cmax met 35% en verlengde de Tmax van 2,3 ± 1,0 uur tot 6,4 ± 2,9 uur.
De veiligheid en werkzaamheid van SINGULAIR bij patiënten met astma zijn aangetoond in klinische onderzoeken waarbij de filmomhulde tablet van 10 mg en de kauwtablet van 5 mg 's avonds werden toegediend zonder rekening te houden met het tijdstip van inname van voedsel. De veiligheid van SINGULAIR 4 mg bij patiënten met astma is ook aangetoond in klinische onderzoeken waarin de kauwtabletten van 4 mg en de orale granulaatformulering van 4 mg 's avonds werden toegediend zonder rekening te houden met het tijdstip van inname van voedsel. De veiligheid en werkzaamheid van SINGULAIR bij patiënten met seizoensgebonden allergische rhinitis zijn aangetoond in klinische onderzoeken waarbij de filmomhulde tablet van 10 mg 's morgens of' s avonds werd toegediend, ongeacht het tijdstip van inname van voedsel.
De vergelijkende farmacokinetiek van montelukast bij toediening als twee kauwtabletten van 5 mg versus één filmomhulde tablet van 10 mg is niet onderzocht.
Verdeling
Montelukast is voor meer dan 99% gebonden aan plasma-eiwitten. Het steady-state distributievolume van montelukast is gemiddeld 8 tot 11 liter. Oraal toegediende montelukast verspreidt zich in de hersenen bij ratten.
Eliminatie
De plasmaklaring van montelukast is gemiddeld 45 ml/min bij gezonde volwassenen. Na een orale dosis radioactief gelabeld montelukast werd 86% van de radioactiviteit teruggevonden in fecale verzamelingen van 5 dagen en
In verschillende onderzoeken varieerde de gemiddelde plasmahalfwaardetijd van montelukast van 2,7 tot 5,5 uur bij gezonde jonge volwassenen. De farmacokinetiek van montelukast is bijna lineair voor orale doses tot 50 mg. Tijdens een eenmaaldaagse dosering van 10 mg montelukast is er weinig accumulatie van het oorspronkelijke geneesmiddel in het plasma (14%).
Metabolisme
Montelukast wordt uitgebreid gemetaboliseerd. In onderzoeken met therapeutische doses zijn plasmaconcentraties van metabolieten van montelukast bij volwassenen en pediatrische patiënten niet detecteerbaar bij steady-state.
In vitro-onderzoeken met humane levermicrosomen geven aan dat CYP3A4, 2C8 en 2C9 betrokken zijn bij het metabolisme van montelukast. Bij klinisch relevante concentraties lijkt 2C8 een belangrijke rol te spelen in het metabolisme van montelukast.
Specifieke populaties
Patiënten met leverinsufficiëntie
Bij patiënten met milde tot matige leverinsufficiëntie en klinisch bewijs van cirrose was er bewijs van een verminderd metabolisme van montelukast, resulterend in een 41% (90% BI=7%, 85%) hogere gemiddelde AUC van montelukast na een enkelvoudige dosis van 10 mg. De eliminatie van montelukast was enigszins verlengd in vergelijking met die bij gezonde proefpersonen (gemiddelde halfwaardetijd 7,4 uur). Er is geen dosisaanpassing nodig bij patiënten met milde tot matige leverinsufficiëntie. De farmacokinetiek van SINGULAIR bij patiënten met een ernstiger leverfunctiestoornis of met hepatitis is niet onderzocht.
Patiënten met nierinsufficiëntie
Aangezien montelukast en zijn metabolieten niet in de urine worden uitgescheiden, is de farmacokinetiek van montelukast niet geëvalueerd bij patiënten met nierinsufficiëntie. Bij deze patiënten wordt geen dosisaanpassing aanbevolen.
Mannelijke en vrouwelijke patiënten
De farmacokinetiek van montelukast is vergelijkbaar bij mannen en vrouwen.
Raciale groepen
Farmacokinetische verschillen als gevolg van ras zijn niet onderzocht.
Adolescenten en pediatrische patiënten
Farmacokinetische studies evalueerden de systemische blootstelling van de orale granulaatformule van 4 mg bij pediatrische patiënten van 6 tot 23 maanden, de kauwtabletten van 4 mg bij pediatrische patiënten van 2 tot 5 jaar, de kauwtabletten van 5 mg bij pediatrische patiënten 6 tot 14 jaar en de filmomhulde tabletten van 10 mg bij jonge volwassenen en adolescenten ≥ 15 jaar.
Het plasmaconcentratieprofiel van montelukast na toediening van de 10 mg filmomhulde tablet is vergelijkbaar bij adolescenten ≥ 15 jaar en jonge volwassenen. De filmomhulde tablet van 10 mg wordt aanbevolen voor gebruik bij patiënten 15 jaar.
De gemiddelde systemische blootstelling van de 4 mg kauwtablet bij pediatrische patiënten van 2 tot 5 jaar en de 5 mg kauwtabletten bij pediatrische patiënten van 6 tot 14 jaar is vergelijkbaar met de gemiddelde systemische blootstelling van de 10 mg film- omhulde tablet bij volwassenen. De kauwtablet van 5 mg moet worden gebruikt bij pediatrische patiënten van 6 tot 14 jaar en de kauwtablet van 4 mg moet worden gebruikt bij pediatrische patiënten van 2 tot 5 jaar.
Bij kinderen van 6 tot 11 maanden oud waren de systemische blootstelling aan montelukast en de variabiliteit van de plasmaconcentraties van montelukast hoger dan die waargenomen bij volwassenen. Op basis van populatieanalyses was de gemiddelde AUC (4296 ng•uur/ml [bereik 1200 tot 7153]) 60% hoger en de gemiddelde Cmax (667 ng/ml [bereik 201 tot 1058]) 89% hoger dan die waargenomen in volwassenen (gemiddelde AUC 2689 ng•uur/ml [bereik 1521 tot 4595]) en gemiddelde Cmax (353 ng/ml [bereik 180 tot 548]). De systemische blootstelling bij kinderen van 12 tot 23 maanden was minder variabel, maar was nog steeds hoger dan die waargenomen bij volwassenen. De gemiddelde AUC (3574 ng•uur/ml [bereik 2229 tot 5408]) was 33% hoger en de gemiddelde Cmax (562 ng/ml [bereik 296 tot 814]) was 60% hoger dan die waargenomen bij volwassenen. De veiligheid en verdraagbaarheid van montelukast in een farmacokinetisch onderzoek met een enkelvoudige dosis bij 26 kinderen van 6 tot 23 maanden oud waren vergelijkbaar met die van patiënten van twee jaar en ouder [zie ONGEWENSTE REACTIES ]. De orale granulaatformulering van 4 mg moet worden gebruikt voor pediatrische patiënten van 12 tot 23 maanden voor de behandeling van astma, of voor pediatrische patiënten van 6 tot 23 maanden voor de behandeling van niet-seizoensgebonden allergische rhinitis. Aangezien de formulering van orale granulaat van 4 mg bio-equivalent is aan de kauwtablet van 4 mg, kan het ook worden gebruikt als een alternatieve formulering voor de kauwtablet van 4 mg bij pediatrische patiënten van 2 tot 5 jaar.
Geneesmiddelinteractiestudies
Theofylline, prednison en prednisolon
SINGULAIR is toegediend met andere therapieën die routinematig worden gebruikt bij de profylaxe en chronische behandeling van astma zonder duidelijke toename van bijwerkingen. In geneesmiddelinteractiestudies had de aanbevolen klinische dosis montelukast geen klinisch belangrijke effecten op de farmacokinetiek van de volgende geneesmiddelen: theofylline, prednison en prednisolon.
Montelukast in een dosis van 10 mg eenmaal daags, gedoseerd tot farmacokinetische steady-state, veroorzaakte geen klinisch significante veranderingen in de kinetiek van een enkelvoudige intraveneuze dosis theofylline [voornamelijk een cytochroom P450 (CYP) 1A2-substraat]. Montelukast in doses van ≥ 100 mg per dag gedoseerd tot farmacokinetische steady-state, veroorzaakte geen klinisch significante verandering in plasmaprofielen van prednison of prednisolon na toediening van oraal prednison of intraveneus prednisolon.
Orale anticonceptiva, fexofenadine, digoxine en warfarine
In geneesmiddelinteractiestudies had de aanbevolen klinische dosis montelukast geen klinisch belangrijke effecten op de farmacokinetiek van de volgende geneesmiddelen: orale anticonceptiva (norethindron 1 mg/ethinylestradiol 35 mcg), digoxine en warfarine. Montelukast in doses van ≥ 100 mg per dag gedoseerd tot farmacokinetische steady-state veranderde de plasmaconcentraties van geen van beide componenten van een oraal anticonceptivum dat norethindron 1 mg/ethinylestradiol 35 mcg bevat. Montelukast in een dosis van 10 mg eenmaal daags gedoseerd tot farmacokinetische steady-state veranderde het plasmaconcentratieprofiel van fexofenadine niet, veranderde het farmacokinetische profiel of de urinaire excretie van immunoreactief digoxine niet; veranderde het farmacokinetische profiel van warfarine (voornamelijk een substraat van CYP2C9, 3A4 en 1A2) niet en had geen invloed op het effect van een enkele orale dosis van 30 mg warfarine op de protrombinetijd of de International Normalised Ratio (INR).
Schildklierhormonen, kalmerende hypnotica, niet-steroïde anti-inflammatoire middelen, benzodiazepinen en decongestiva
Hoewel er geen aanvullende specifieke interactieonderzoeken zijn uitgevoerd, werd SINGULAIR in klinische onderzoeken gelijktijdig gebruikt met een breed scala aan vaak voorgeschreven geneesmiddelen zonder aanwijzingen voor klinische nadelige interacties. Deze medicijnen omvatten schildklierhormonen, sedatieve hypnotica, niet-steroïde anti-inflammatoire middelen, benzodiazepinen en decongestiva.
Cytochroom P450 (CYP) enzyminductoren
Fenobarbital, dat het levermetabolisme induceert, verminderde de oppervlakte onder de plasmaconcentratiecurve (AUC) van montelukast met ongeveer 40% na een enkelvoudige dosis van 10 mg montelukast. Er wordt geen dosisaanpassing voor SINGULAIR aanbevolen. Het is redelijk om passende klinische controle toe te passen wanneer krachtige CYP-enzyminductoren, zoals fenobarbital of rifampicine, gelijktijdig worden toegediend met SINGULAIR.
Effect van montelukast op cytochroom P450 (CYP) enzymen
Montelukast is in vitro een krachtige remmer van CYP2C8. Gegevens van een klinisch geneesmiddelinteractieonderzoek met montelukast en rosiglitazon (een probesubstraat dat representatief is voor geneesmiddelen die voornamelijk worden gemetaboliseerd door CYP2C8) bij 12 gezonde personen toonden echter aan dat de farmacokinetiek van rosiglitazon niet verandert wanneer de geneesmiddelen gelijktijdig worden toegediend, wat aangeeft dat montelukast CYP2C8 in vivo niet remmen. Daarom wordt niet verwacht dat montelukast het metabolisme verandert van geneesmiddelen die door dit enzym worden gemetaboliseerd (bijv. paclitaxel, rosiglitazon en repaglinide). Op basis van verdere in vitro resultaten in humane levermicrosomen, remmen therapeutische plasmaconcentraties van montelukast CYP 3A4, 2C9, 1A2, 2A6, 2C19 of 2D6 niet.
Cytochroom P450 (CYP)-enzymremmers
In vitro-onderzoeken hebben aangetoond dat montelukast een substraat is van CYP 2C8, 2C9 en 3A4. Gelijktijdige toediening van montelukast met itraconazol, een sterke CYP 3A4-remmer, resulteerde niet in een significante toename van de systemische blootstelling aan montelukast. Gegevens uit een klinisch geneesmiddelinteractieonderzoek met montelukast en gemfibrozil (een remmer van zowel CYP 2C8 als 2C9) toonden aan dat gemfibrozil, bij een therapeutische dosis, de systemische blootstelling aan montelukast met een factor 4,4 verhoogde. Gelijktijdige toediening van itraconazol, gemfibrozil en montelukast verhoogde de systemische blootstelling aan montelukast niet verder. Op basis van beschikbare klinische ervaring is er geen dosisaanpassing van montelukast nodig bij gelijktijdige toediening met gemfibrozil (zie OVERDOSERING ].
Klinische studies
Astma
Volwassenen en adolescenten van 15 jaar en ouder met astma
Klinische onderzoeken bij volwassenen en adolescenten van 15 jaar en ouder hebben aangetoond dat er geen extra klinisch voordeel is bij doses montelukast hoger dan 10 mg eenmaal daags.
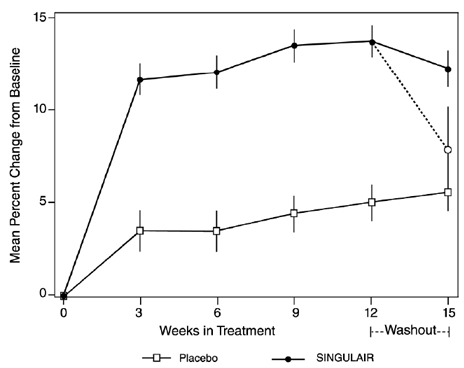
De werkzaamheid van SINGULAIR voor de chronische behandeling van astma bij volwassenen en adolescenten van 15 jaar en ouder werd aangetoond in twee (VS en multinationale) gelijkaardige, gerandomiseerde, 12 weken durende, dubbelblinde, placebogecontroleerde onderzoeken bij 1576 patiënten ( 795 behandeld met SINGULAIR, 530 behandeld met placebo en 251 behandeld met actieve controle). De mediane leeftijd was 33 jaar (bereik 15 tot 85); 56,8% was vrouw en 43,2% was man. De etnische/raciale verdeling in deze onderzoeken was 71,6% blank, 17,7% Spaans, 7,2% andere origine en 3,5% zwart. De patiënten hadden lichte of matige astma en waren niet-rokers die ongeveer 5 pufjes geïnhaleerde bèta-agonist per dag nodig hadden, indien nodig. De patiënten hadden een gemiddeld baselinepercentage van het voorspelde geforceerde expiratoire volume in 1 seconde (FEV1) van 66% (geschat bereik, 40 tot 90%). De co-primaire eindpunten in deze onderzoeken waren FEV1 en astmasymptomen overdag. In beide onderzoeken werd na 12 weken een willekeurige subgroep van patiënten die SINGULAIR 5 mg kregen overgezet op placebo voor nog eens 3 weken dubbelblinde behandeling om mogelijke rebound-effecten te evalueren.
De resultaten van het Amerikaanse onderzoek op het primaire eindpunt, ochtend-FEV1, uitgedrukt als gemiddelde procentuele verandering ten opzichte van baseline, gemiddeld over de behandelperiode van 12 weken, worden weergegeven in AFBEELDING 2. In vergelijking met placebo, behandeling met één SINGULAIR 10 mg tablet per dag in de avond resulteerde in een statistisch significante toename in FEV1-percentage verandering ten opzichte van baseline (13,0% verandering in de groep behandeld met SINGULAIR 4 mg vs. 4,2% verandering in de placebogroep, p
Figuur 2: FEV1 gemiddelde procentuele verandering ten opzichte van baseline (VS-onderzoek: SINGULAIR 5 mg N=406; Placebo N=270) (ANOVA-model)
Het effect van SINGULAIR 5 mg op andere primaire en secundaire eindpunten, weergegeven door de multinationale studie, wordt weergegeven in TABEL 6. De resultaten op deze eindpunten waren vergelijkbaar in de Amerikaanse studie.
Beide onderzoeken evalueerden het effect van SINGULAIR 4 mg op secundaire uitkomsten, waaronder astma-aanval (gebruik van middelen in de gezondheidszorg zoals een ongepland bezoek aan een dokterspraktijk, eerste hulp of ziekenhuis; of behandeling met orale, intraveneuze of intramusculaire corticosteroïden) en het gebruik van orale corticosteroïden voor astma-redding. In de multinationale studie kregen significant minder patiënten (15,6% van de patiënten) die SINGULAIR kregen astma-aanvallen dan patiënten die placebo kregen (27,3%, p
Aanvang van actie en behoud van effecten
In elk placebogecontroleerd onderzoek bij volwassenen werd het behandelingseffect van SINGULAIR 4 mg, gemeten aan de hand van dagelijkse dagboekkaartparameters, waaronder symptoomscores, gebruik van -agonisten 'naar behoefte' en PEFR-metingen, bereikt na de eerste dosis en werd gehandhaafd. gedurende het doseringsinterval (24 uur). Er werd geen significante verandering in het behandeleffect waargenomen tijdens continue eenmaaldaagse toediening in de avond in niet-placebogecontroleerde verlengingsonderzoeken gedurende maximaal één jaar. Stoppen met SINGULAIR 4 mg bij astmapatiënten na 12 weken continu gebruik veroorzaakte geen rebound-verergering van astma.
Pediatrische patiënten van 6 tot 14 jaar met astma
De werkzaamheid van SINGULAIR 5 mg bij pediatrische patiënten van 6 tot 14 jaar werd aangetoond in een 8 weken durende, dubbelblinde, placebogecontroleerde studie bij 336 patiënten (201 behandeld met SINGULAIR en 135 behandeld met placebo) die een inhalatie-β-agonist gebruikten. op basis van "naar behoefte". De patiënten hadden een gemiddelde baseline-percentage voorspelde FEV1 van 72% (geschat bereik, 45 tot 90%) en een gemiddelde dagelijkse behoefte aan geïnhaleerde bèta-agonisten van 3,4 pufjes albuterol. Ongeveer 36% van de patiënten gebruikte inhalatiecorticosteroïden. De mediane leeftijd was 11 jaar (bereik 6 tot 15); 35,4% was vrouw en 64,6% was man. De etnische/raciale verdeling in deze studie was 80,1% blank, 12,8% zwart, 4,5% Spaans en 2,7% van andere afkomst.
Vergeleken met placebo resulteerde behandeling met één 5 mg SINGULAIR 4 mg kauwtablet per dag in een significante verbetering van de gemiddelde FEV1 procent verandering in de ochtend ten opzichte van baseline (8,7% in de groep behandeld met SINGULAIR 4 mg vs. 4,2% verandering ten opzichte van baseline in de placebogroep, p
Net als bij de onderzoeken bij volwassenen, werd er geen significante verandering in het behandelingseffect waargenomen tijdens continue eenmaaldaagse toediening in één open-label verlengingsonderzoek zonder een gelijktijdige placebogroep gedurende maximaal 6 maanden.
Pediatrische patiënten van 2 tot 5 jaar met astma
De werkzaamheid van SINGULAIR voor de chronische behandeling van astma bij pediatrische patiënten van 2 tot 5 jaar werd onderzocht in een 12 weken durende, placebogecontroleerde veiligheids- en verdraagbaarheidsstudie bij 689 patiënten, van wie 461 werden behandeld met SINGULAIR. De mediane leeftijd was 4 jaar (bereik 2 tot 6); 41,5% was vrouw en 58,5% was man. De etnische/raciale verdeling in deze studie was 56,5% blank, 20,9% Spaans, 14,4% andere origine en 8,3% zwart.
Hoewel het primaire doel was om de veiligheid en verdraagbaarheid van SINGULAIR 10 mg in deze leeftijdsgroep te bepalen, omvatte het onderzoek verkennende evaluaties van de werkzaamheid, waaronder astmasymptoomscores overdag en 's nachts, gebruik van β-agonisten, redding van orale corticosteroïden en de algemene evaluatie door de arts. De bevindingen van deze verkennende evaluaties van de werkzaamheid, samen met de farmacokinetiek en extrapolatie van werkzaamheidsgegevens van oudere patiënten, ondersteunen de algemene conclusie dat SINGULAIR werkzaam is bij de onderhoudsbehandeling van astma bij patiënten van 2 tot 5 jaar.
Effecten bij patiënten op gelijktijdige geïnhaleerde corticosteroïden
Afzonderlijke onderzoeken bij volwassenen evalueerden het vermogen van SINGULAIR 10 mg om het klinische effect van inhalatiecorticosteroïden te vergroten en om de inhalatiecorticosteroïden af te bouwen bij gelijktijdig gebruik.
Een gerandomiseerde, placebogecontroleerde studie met parallelle groepen (n=226) omvatte volwassenen met stabiel astma met een gemiddelde FEV1 van ongeveer 84% van de voorspelde patiënten die eerder verschillende inhalatiecorticosteroïden kregen (geleverd door een afgemeten dosis aërosol of droogpoederinhalatoren) ). De mediane leeftijd was 41,5 jaar (bereik 16 tot 70); 52,2% was vrouw en 47,8% was man. De etnische/raciale verdeling in deze studie was 92,0% blank, 3,5% zwart, 2,2% Spaans en 2,2% Aziatisch. De typen inhalatiecorticosteroïden en hun gemiddelde basisbehoefte omvatten beclomethasondipropionaat (gemiddelde dosis, 1203 mcg/dag), triamcinolonacetonide (gemiddelde dosis, 2004 mcg/dag), flunisolide (gemiddelde dosis, 1971 mcg/dag), fluticasonpropionaat (gemiddelde dosis, dosis, 1083 mcg/dag), of budesonide (gemiddelde dosis, 1192 mcg/dag). Sommige van deze inhalatiecorticosteroïden waren niet door de VS goedgekeurde formuleringen en de uitgedrukte doses zijn mogelijk niet ex-actuator. De behoefte aan inhalatiecorticosteroïden voorafgaand aan het onderzoek was met ongeveer 37% verminderd tijdens een aanloopperiode van 5 tot 7 weken die was ontworpen om patiënten te titreren naar hun laagste effectieve dosis inhalatiecorticosteroïden. Behandeling met SINGULAIR 4 mg resulteerde in een verdere verlaging van 47% van de gemiddelde dosis inhalatiecorticosteroïden vergeleken met een gemiddelde verlaging van 30% in de placebogroep gedurende de actieve behandelingsperiode van 12 weken (p≤0,05). Het is niet bekend of de resultaten van deze studie kunnen worden gegeneraliseerd naar patiënten met astma die hogere doses inhalatiecorticosteroïden of systemische corticosteroïden nodig hebben.
In een ander gerandomiseerd, placebogecontroleerd onderzoek met parallelle groepen (n=642) bij een vergelijkbare populatie van volwassen patiënten die voorheen inhalatiecorticosteroïden (beclomethason 336 mcg/dag) kregen, maar niet voldoende onder controle waren, resulteerde de toevoeging van SINGULAIR aan beclomethason in in statistisch significante verbeteringen in FEV1 vergeleken met die patiënten die werden voortgezet met alleen beclomethason of die patiënten die waren gestopt met beclomethason en die werden behandeld met alleen montelukast of placebo gedurende de laatste 10 weken van de 16 weken durende, geblindeerde behandelingsperiode. Patiënten die waren gerandomiseerd naar behandelingsarmen die beclomethason bevatten, hadden een statistisch significant betere astmacontrole dan patiënten die waren gerandomiseerd naar alleen SINGULAIR of alleen placebo, zoals aangegeven door FEV1, astmasymptomen overdag, PEFR, nachtelijk ontwaken als gevolg van astma en "indien nodig" β- agonistische vereisten.
Bij volwassen patiënten met astma met gedocumenteerde gevoeligheid voor aspirine, die bijna allemaal gelijktijdig inhalatie- en/of orale corticosteroïden kregen, toonde een 4 weken durende, gerandomiseerde studie met parallelle groepen (n=80) aan dat SINGULAIR 10 mg, vergeleken met placebo, resulteerde in in significante verbetering in parameters van astmacontrole. De grootte van het effect van SINGULAIR 4 mg bij aspirinegevoelige patiënten was vergelijkbaar met het effect dat werd waargenomen bij de algemene populatie van onderzochte astmapatiënten. Het effect van SINGULAIR op de bronchoconstrictorrespons op aspirine of andere niet-steroïde anti-inflammatoire geneesmiddelen bij aspirine-gevoelige astmapatiënten is niet onderzocht [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Door inspanning geïnduceerde bronchoconstrictie (EIB)
Door inspanning veroorzaakte bronchoconstrictie (volwassenen, adolescenten en pediatrische patiënten van 6 jaar en ouder)
De werkzaamheid van SINGULAIR 5 mg, 10 mg, toegediend als een enkele dosis 2 uur vóór inspanning ter preventie van EIB, werd onderzocht in drie (VS en multinationale), gerandomiseerde, dubbelblinde, placebogecontroleerde cross-over-onderzoeken met in totaal 160 volwassen en adolescente patiënten van 15 jaar en ouder met EIB. De inspanningstest werd uitgevoerd 2 uur, 8,5 of 12 uur en 24 uur na toediening van een enkele dosis onderzoeksgeneesmiddel (SINGULAIR 10 mg of placebo). Het primaire eindpunt was de gemiddelde maximale procentuele daling van FEV1 na de inspanningstest van 2 uur na de dosis in alle drie de onderzoeken (onderzoek A, onderzoek B en onderzoek C). In onderzoek A vertoonde een enkele dosis SINGULAIR 10 mg een statistisch significant beschermend voordeel tegen EIB wanneer het 2 uur vóór de inspanning werd ingenomen. Sommige patiënten werden 8,5 en 24 uur na toediening beschermd tegen EIB; sommige patiënten waren dat echter niet. De resultaten voor het gemiddelde maximale percentage daling op elk tijdstip in onderzoek A worden getoond in TABEL 7 en zijn representatief voor de resultaten van de andere twee onderzoeken.
De werkzaamheid van SINGULAIR 5 mg kauwtabletten, indien gegeven als een enkele dosis 2 uur vóór inspanning ter preventie van EIB, werd onderzocht in een multinationale, gerandomiseerde, dubbelblinde, placebogecontroleerde cross-over studie met in totaal 64 pediatrische patiënten van 6 tot 14 jaar met EIB. Inspanningsuitdagingstesten werden uitgevoerd 2 uur en 24 uur na toediening van een enkele dosis onderzoeksgeneesmiddel (SINGULAIR 5 mg of placebo). Het primaire eindpunt was de gemiddelde maximale procentuele daling van FEV1 na de inspanningstest van 2 uur na de dosis. Een enkele dosis SINGULAIR 5 mg toonde een statistisch significant beschermend voordeel tegen EIB wanneer het 2 uur voor de inspanning werd ingenomen (TABEL 8). Gelijkaardige resultaten werden 24 uur na de dosis getoond (een secundair eindpunt). Sommige patiënten werden 24 uur na toediening beschermd tegen EIB; sommige patiënten waren dat echter niet. Er werden geen tijdstippen vastgesteld tussen 2 en 24 uur na de dosis.
De werkzaamheid van SINGULAIR 5 mg voor de preventie van EIB bij patiënten jonger dan 6 jaar is niet vastgesteld.
Dagelijkse toediening van SINGULAIR 4 mg voor de chronische behandeling van astma is niet vastgesteld om acute episodes van EIB te voorkomen.
In een 12 weken durende, gerandomiseerde, dubbelblinde studie met parallelle groepen onder 110 volwassen en adolescente astmapatiënten van 15 jaar en ouder, met een gemiddelde baseline FEV1-percentage van voorspeld van 83% en met gedocumenteerde inspannings-geïnduceerde exacerbatie van astma, behandeling met SINGULAIR 10 mg, eenmaal daags 's avonds, resulteerde in een statistisch significante afname van de gemiddelde maximale procentuele daling van de FEV1 en de gemiddelde tijd tot herstel tot binnen 5% van de FEV1 vóór de inspanning. De inspanningstest werd uitgevoerd aan het einde van het doseringsinterval (dwz 20 tot 24 uur na de voorgaande dosis). Dit effect hield aan gedurende de behandelingsperiode van 12 weken, wat aangeeft dat er geen tolerantie optrad. SINGULAIR 4 mg voorkwam echter geen klinisch significante verslechtering van de maximale procentuele daling van de FEV1 na inspanning (dwz ≥20% afname ten opzichte van de uitgangswaarde vóór de training) bij 52% van de onderzochte patiënten. In een afzonderlijke cross-overstudie bij volwassenen werd een vergelijkbaar effect waargenomen na twee eenmaal daagse doses van 10 mg SINGULAIR.
Bij pediatrische patiënten van 6 tot 14 jaar oud, die de 5 mg kauwtablet gebruikten, toonde een tweedaagse cross-over studie effecten aan die vergelijkbaar waren met die waargenomen bij volwassenen wanneer inspanningstest werd uitgevoerd aan het einde van het doseringsinterval (dwz 20 tot 24 uur). uur na de voorgaande dosis).
Allergische rhinitis (seizoensgebonden en meerjarig)
Seizoensgebonden allergische rhinitis
De werkzaamheid van SINGULAIR-tabletten voor de behandeling van seizoensgebonden allergische rhinitis is onderzocht in 5 vergelijkbaar ontworpen, gerandomiseerde, dubbelblinde, placebo- en actief-gecontroleerde (loratadine) onderzoeken met parallelle groepen, uitgevoerd in Noord-Amerika. Aan de 5 onderzoeken namen in totaal 5029 patiënten deel, van wie er 1799 werden behandeld met SINGULAIR-tabletten. De patiënten waren 15 tot 82 jaar oud met een voorgeschiedenis van seizoensgebonden allergische rhinitis, een positieve huidtest voor ten minste één relevant seizoensgebonden allergeen en actieve symptomen van seizoensgebonden allergische rhinitis bij deelname aan het onderzoek.
De periode van gerandomiseerde behandeling was 2 weken in 4 onderzoeken en 4 weken in één onderzoek. De primaire uitkomstvariabele was de gemiddelde verandering ten opzichte van baseline in de score voor neussymptomen overdag (het gemiddelde van individuele scores van verstopte neus, rinorroe, jeukende neus, niezen) zoals beoordeeld door patiënten op een categorische schaal van 0-3.
Vier van de vijf onderzoeken lieten een significante afname zien van de scores voor neussymptomen overdag met SINGULAIR 10 mg tabletten in vergelijking met placebo. De resultaten van één proef zijn hieronder weergegeven. De mediane leeftijd in deze studie was 35,0 jaar (bereik 15 tot 81); 65,4% was vrouw en 34,6% was man. De etnische/raciale verdeling in deze studie was 83,1% blank, 6,4% andere origine, 5,8% zwart en 4,8% Hispanic. De gemiddelde veranderingen ten opzichte van de uitgangswaarde in de score voor neussymptomen overdag in de behandelingsgroepen die SINGULAIR 4 mg tabletten, loratadine en placebo kregen, worden weergegeven in TABEL 9. De overige drie onderzoeken die werkzaamheid aantoonden, vertoonden vergelijkbare resultaten. De werkzaamheid werd aangetoond voor seizoensgebonden allergische rhinitis wanneer montelukast 's ochtends of' s avonds werd toegediend.
Meerjarige allergische rhinitis
De werkzaamheid van SINGULAIR 5 mg tabletten voor de behandeling van niet-seizoensgebonden allergische rhinitis is onderzocht in 2 gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken in Noord-Amerika en Europa. Aan de twee onderzoeken namen in totaal 3357 patiënten deel, van wie er 1632 SINGULAIR 10-mg-tabletten kregen. Patiënten van 15 tot 82 jaar met niet-seizoensgebonden allergische rhinitis, zoals bevestigd door de geschiedenis en een positieve huidtest voor ten minste één relevant overblijvend allergeen (huisstofmijt, huidschilfers van dieren en/of schimmelsporen), die op het moment van onderzoek actieve symptomen hadden binnenkomst, waren ingeschreven.
In het onderzoek waarin de werkzaamheid werd aangetoond, was de mediane leeftijd 35 jaar (bereik 15 tot 81); 64,1% was vrouw en 35,9% was man. De etnische/raciale verdeling in deze studie was 83,2% blank, 8,1% zwart, 5,4% Spaans, 2,3% Aziatisch en 1,0% andere afkomst. SINGULAIR 10 mg tabletten eenmaal daags bleken de symptomen van niet-seizoensgebonden allergische rhinitis significant te verminderen gedurende een behandelingsperiode van 6 weken (TABEL 10); in deze studie was de primaire uitkomstvariabele de gemiddelde verandering ten opzichte van baseline in de score voor neussymptomen overdag (het gemiddelde van individuele scores van verstopte neus, rinorroe en niezen).
De andere 6 weken durende studie evalueerde SINGULAIR 10 mg (n=626), placebo (n=609) en een actieve controle (cetirizine 10 mg; n=120). De primaire analyse vergeleek de gemiddelde verandering ten opzichte van baseline in de score voor neussymptomen overdag voor SINGULAIR versus placebo gedurende de eerste 4 weken van de behandeling; het onderzoek was niet bedoeld voor statistische vergelijking tussen SINGULAIR en de actieve controle. De primaire uitkomstvariabele omvatte jeuk in de neus naast verstopte neus, rinorroe en niezen. Het geschatte verschil tussen SINGULAIR en placebo was -0,04 met een 95%-BI van (-0,09; 0,01). Het geschatte verschil tussen de actieve controle en placebo was -0,10 met een 95% BI van (-0,19, -0,01).
PATIËNT INFORMATIE
SINGULAIR® (SING-u-lair)(montelukast-natrium) kauwtabletten
Wat is de belangrijkste informatie die ik over SINGULAIR 4 mg moet weten?Er zijn ernstige psychische problemen opgetreden bij mensen die SINGULAIR® gebruikten of zelfs nadat de behandeling is gestopt.
Dit kan gebeuren bij mensen met of zonder een voorgeschiedenis van psychische problemen. Stop met het innemen van SINGULAIR en vertel het uw zorgverlener meteen als u of uw kind ongewone veranderingen in gedrag of denken heeft, waaronder een van deze symptomen:
- agitatie, inclusief agressief gedrag of vijandigheid
- aandachtsproblemen
- slechte of levendige dromen
- depressie
- desoriëntatie (verwarring)
- angstig voelen
- prikkelbaarheid
- hallucinaties (dingen zien of horen die er niet echt zijn)
- geheugenproblemen
- obsessief-compulsieve symptomen
- rusteloosheid
- slaapwandelen
- stotteren
- zelfmoordgedachten en -acties (inclusief zelfmoord)
- tremor
- Moeite met slapen
- ongecontroleerde spierbewegingen
Wat is SINGULAIR 10 mg?
SINGULAIR 4 mg is een receptgeneesmiddel dat stoffen in het lichaam, leukotriënen genaamd, blokkeert. Dit kan de symptomen van astma en ontsteking van het neusslijmvlies (allergische rhinitis) helpen verbeteren. SINGULAIR bevat geen steroïde. SINGULAIR wordt gebruikt om:
- buitenallergieën die een deel van het jaar voorkomen (seizoensgebonden allergische rhinitis) bij volwassenen en kinderen van 2 jaar en ouder, en
- allergieën binnenshuis die het hele jaar voorkomen (langdurige allergische rhinitis) bij volwassenen en kinderen van 6 maanden en ouder.
Niet doen neem SINGULAIR in als u allergisch bent voor een van de ingrediënten. Zie het einde van deze medicatiehandleiding voor een volledige lijst van de ingrediënten van SINGULAIR.
Vertel uw zorgverlener over al uw medische aandoeningen voordat u SINGULAIR 4 mg inneemt, ook als u:
- zijn allergisch voor aspirine.
- fenylketonurie hebben. SINGULAIR kauwtabletten bevatten aspartaam, een bron van fenylalanine.
- psychische problemen heeft of heeft gehad.
- zwanger bent of van plan bent zwanger te worden. Neem contact op met uw arts als u zwanger bent of van plan bent zwanger te worden. Het kan zijn dat SINGULAIR 4 mg niet geschikt voor u is.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of SINGULAIR in uw moedermelk terechtkomt. Praat met uw zorgverlener over de beste manier om uw baby te voeden terwijl u SINGULAIR gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Sommige geneesmiddelen kunnen de werking van SINGULAIR beïnvloeden, of SINGULAIR 4 mg kan de werking van uw andere geneesmiddelen beïnvloeden.
Hoe moet ik SINGULAIR 10 mg innemen?
Voor iedereen wie neemt SINGULAIR:
- Lees de gedetailleerde Gebruiksaanwijzing dat wordt geleverd met SINGULAIR oraal granulaat.
- Neem SINGULAIR 4 mg precies zoals voorgeschreven door uw zorgverlener. Uw zorgverlener zal u vertellen hoeveel SINGULAIR u moet innemen, en wanneer te nemen.
- Stop met het innemen van SINGULAIR 5 mg en vertel het uw zorgverlener meteen als u of uw kind ongewone veranderingen in gedrag of denken heeft.
- U kunt SINGULAIR 5 mg met of zonder voedsel innemen. Zie de sectie "Hoe kan ik SINGULAIR granulaat voor oraal gebruik aan mijn kind geven?" in de Gebruiksaanwijzing voor informatie over welke voedingsmiddelen en vloeistoffen kunnen worden ingenomen met SINGULAIR 10 mg granulaat voor oraal gebruik.
- Als u of uw kind een dosis SINGULAIR heeft overgeslagen, neem dan gewoon de volgende dosis op het normale tijdstip. Neem geen 2 doses tegelijk.
- Als u te veel SINGULAIR heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener.
Voor volwassenen en kinderen van 12 maanden en ouder met astma:
- Neem SINGULAIR 1 keer per dag, 's avonds. Blijf SINGULAIR 5 mg elke dag innemen zolang uw zorgverlener het voorschrijft, ook als u geen astmasymptomen heeft.
- Vertel het uw zorgverlener meteen als uw astmasymptomen erger worden, of als u uw noodmedicijn vaker moet gebruiken voor astma-aanvallen.
- Houd altijd uw reddingsinhalatormedicijn bij u voor astma-aanvallen.
- Ga door met het innemen van uw andere astmageneesmiddelen zoals voorgeschreven, tenzij uw zorgverlener u vertelt dat u de manier waarop u deze geneesmiddelen gebruikt moet veranderen.
Voor mensen van 6 jaar en ouder ter preventie van inspanningsastma:
- Neem SINGULAIR minimaal 2 uur voor het sporten in.
- Houd altijd uw reddingsinhalatormedicijn bij u voor astma-aanvallen.
- Als u SINGULAIR 10 mg per dag inneemt voor chronische astma of allergische rinitis, Niet doen neem nog een dosis om inspanningsastma te voorkomen. Praat met uw zorgverlener over uw behandeling voor inspanningsastma.
- Neem geen 2 doses SINGULAIR 5 mg binnen 24 uur (1 dag).
Voor iedereen van 2 jaar en ouder met seizoensgebonden allergische rhinitis, of voor iedereen van 6 maanden en ouder met niet-seizoensgebonden allergische rhinitis:
- Neem SINGULAIR 1 keer per dag in, elke dag op ongeveer hetzelfde tijdstip.
Wat moet ik vermijden tijdens het gebruik van SINGULAIR 10 mg?
Als u astma heeft en aspirine uw astmasymptomen verergert, moet u tijdens het gebruik van SINGULAIR het gebruik van aspirine of andere geneesmiddelen die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) worden genoemd, blijven vermijden.
Wat zijn de mogelijke bijwerkingen van SINGULAIR?
SINGULAIR kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien “Wat is de belangrijkste informatie die ik moet weten over SINGULAIR 4 mg?”
- Toename van bepaalde witte bloedcellen (eosinofielen) en mogelijk ontstoken bloedvaten door het hele lichaam (systemische vasculitis). In zeldzame gevallen kan dit gebeuren bij mensen met astma die SINGULAIR gebruiken. Dit gebeurt soms bij mensen die ook een steroïde geneesmiddel via de mond innemen en dat wordt gestopt of de dosis wordt verlaagd.
Vertel het uw zorgverlener meteen als u een of meer van deze symptomen krijgt:
- een gevoel van pinnen en naalden of gevoelloosheid van armen of benen
- een griepachtige ziekte
- uitslag
- ernstige ontsteking (pijn en zwelling) van de sinussen (sinusitis)
De meest voorkomende bijwerkingen van SINGULAIR zijn:
- bovenste luchtweginfectie
- koorts
- hoofdpijn
- keelpijn
- hoesten
- buikpijn
- diarree
- oorpijn of oorontsteking
- griep
- loopneus
- sinus infectie
Dit zijn niet alle mogelijke bijwerkingen van SINGULAIR. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik SINGULAIR bewaren?
- Bewaar SINGULAIR 10 mg bij kamertemperatuur tussen 20 °C en 25 °C (68 °F tot 77 °F).
- Bewaar SINGULAIR 4 mg in de verpakking waarin het wordt geleverd.
- Bewaar SINGULAIR 4 mg op een droge plaats en uit de buurt van licht.
- Houd SINGULAIR en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van SINGULAIR.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik SINGULAIR niet voor een aandoening waarvoor het niet is voorgeschreven. Geef SINGULAIR niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
U kunt uw apotheker of zorgverlener om informatie vragen over SINGULAIR 10 mg die is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in SINGULAIR?
Actief ingrediënt: montelukast natrium
Inactieve ingredienten:
- 4 mg oraal granulaat: mannitol, hydroxypropylcellulose en magnesiumstearaat.
- 4 mg en 5 mg kauwtabletten: mannitol, microkristallijne cellulose, hydroxypropylcellulose, rood ijzeroxide, croscarmellosenatrium, kersensmaakstof, aspartaam en magnesiumstearaat.
- Mensen met fenylketonurie: SINGULAIR 4 mg kauwtabletten bevatten 0,674 mg fenylalanine en SINGULAIR 5 mg kauwtabletten bevatten 0,842 mg fenylalanine.
- Tabletten van 10 mg: microkristallijne cellulose, lactosemonohydraat, croscarmellosenatrium, hydroxypropylcellulose en magnesiumstearaat. De filmcoating bevat: hydroxypropylmethylcellulose, hydroxypropylcellulose, titaniumdioxide, rood ijzeroxide, geel ijzeroxide en carnaubawas.
Gebruiksaanwijzing
SINGULAIR® (SING-u-lair)(montelukast-natrium) oraal granulaat
Deze gebruiksaanwijzing bevat informatie over het gebruik van SINGULAIR 10 mg granulaat voor oraal gebruik.
Belangrijke gegevens:
- Lees voordat u een dosis SINGULAIR granulaat voor oraal gebruik toedient, deze gebruiksaanwijzing om er zeker van te zijn dat u het granulaat voor oraal gebruik op de juiste manier klaarmaakt en toedient.
- Geef uw kind SINGULAIR granulaat voor oraal gebruik precies volgens de instructies van uw zorgverlener.
- Stop met het geven van SINGULAIR 5 mg en vertel het uw arts onmiddellijk als uw kind ongewone gedrags- of denkveranderingen heeft.
- Blijf uw kind astmamedicijnen geven zoals voorgeschreven, tenzij uw zorgverlener u vertelt dat u de manier waarop u deze geneesmiddelen toedient, moet veranderen.
- U kunt SINGULAIR 5 mg granulaat voor oraal gebruik met of zonder voedsel geven.
Hoe kan ik SINGULAIR 4 mg granulaat voor oraal gebruik aan mijn kind geven?
- Niet doen open het pakket tot het klaar is voor gebruik.
- U kunt SINGULAIR 4 mg granulaat voor oraal gebruik op verschillende manieren toedienen. U moet de beste methode voor uw kind kiezen:
- recht in de mond
- opgelost in 1 theelepel (5 ml) koude of kamertemperatuur babyvoeding of moedermelk
- gemengd met 1 lepel van een van de volgende zachte voedingsmiddelen op koude of kamertemperatuur: appelmoes, wortelpuree, rijst of ijs.
- Geef het kind al het mengsel binnen 15 minuten.
- Bewaar geen overgebleven SINGULAIR-mengsel (oraal granulaat gemengd met voedsel, babyvoeding of moedermelk) voor later gebruik. Gooi het ongebruikte deel weg.
- Meng SINGULAIR granulaat voor oraal gebruik niet met een andere vloeibare drank dan flesvoeding of moedermelk. Uw kind kan andere vloeistoffen drinken na het doorslikken van het mengsel.
Hoe moet ik SINGULAIR 5 mg bewaren?
- Bewaar SINGULAIR 4 mg bij kamertemperatuur tussen 20 °C en 25 °C (68 °F tot 77 °F).
- Bewaar SINGULAIR in de verpakking waarin het wordt geleverd.
- Bewaar SINGULAIR 5 mg op een droge plaats en uit de buurt van licht.
- Houd SINGULAIR en alle geneesmiddelen buiten het bereik van kinderen.
Deze gebruiksaanwijzing is goedgekeurd door de Amerikaanse Food and Drug Administration
