Protonix 20mg, 40mg Pantoprazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Protonix 40 mg en hoe wordt het gebruikt?
Protonix 40 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van oesofagitis veroorzaakt door maagzuur als gevolg van gastro-oesofageale refluxziekte of GERD en het Zollinger-Ellison-syndroom of andere aandoeningen die overmatig maagzuur veroorzaken. Protonix 40 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Protonix behoort tot een klasse geneesmiddelen die protonpompremmers (PPI's) worden genoemd.
Het is niet bekend of Protonix veilig en effectief is bij kinderen jonger dan 5 jaar.
Wat zijn de mogelijke bijwerkingen van Protonix?
Protonix kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree die waterig is of bloed bevat,
- plotselinge pijn of moeite met het bewegen van uw heup, pols of rug,
- blauwe plekken of zwelling op de injectieplaats,
- weinig of geen plassen,
- bloed in de urine,
- zwelling,
- snelle gewichtstoename,
- duizeligheid,
- snelle of onregelmatige hartslag,
- tremoren (trillen) of schokkerige bewegingen,
- zenuwachtig voelen,
- spierkrampen of spasmen in uw handen of voeten,
- hoesten,
- verstikkend gevoel,
- gewrichtspijn, en
- huiduitslag op uw wangen of armen die 's nachts erger wordt
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Protonix zijn:
- hoofdpijn,
- duizeligheid,
- buikpijn,
- gas,
- misselijkheid,
- braken,
- diarree,
- gewrichtspijn,
- koorts,
- uitslag, en
- verkoudheidsverschijnselen (meest voorkomend bij kinderen)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Prometrium. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Het werkzame bestanddeel in PROTONIX (pantoprazol-natrium) voor orale suspensie met vertraagde afgifte en PROTONIX (pantoprazol-natrium) Tabletten met vertraagde afgifte, een PPI, is een gesubstitueerd benzimidazool, natrium 5-(difluormethoxy)-2-[[(3,4- dimethoxy-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazoolsesquihydraat, een verbinding die de maagzuursecretie remt. De empirische formule is C16H14F2N3NaO4S x 1,5 H2O, met een molecuulgewicht van 432,4. De structuurformule is:
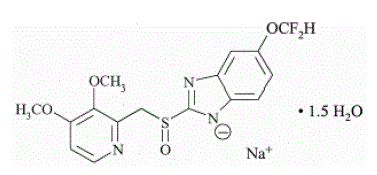
Pantoprazol-natriumsesquihydraat is een wit tot gebroken wit kristallijn poeder en is racemisch. Pantoprazol heeft zwak basische en zure eigenschappen. Pantoprazol-natriumsesquihydraat is goed oplosbaar in water, zeer slecht oplosbaar in fosfaatbuffer bij pH 7,4 en praktisch onoplosbaar in n-hexaan.
De stabiliteit van de verbinding in waterige oplossing is pH-afhankelijk. De afbraaksnelheid neemt toe met afnemende pH. Bij omgevingstemperatuur is de afbraakhalfwaardetijd ongeveer 2,8 uur bij pH 5 en ongeveer 220 uur bij pH 7,8.
PROTONIX 40 mg wordt geleverd als orale suspensie voor vertraagde afgifte in eenheidsdosisverpakkingen, verkrijgbaar in één sterkte (40 mg) pantoprazol, (overeenkomend met 45,1 mg pantoprazol-natrium), en als tablet met vertraagde afgifte, verkrijgbaar in twee sterktes. mg pantoprazol (overeenkomend met 22,56 mg pantoprazol-natrium) en 40 mg pantoprazol (overeenkomend met 45,1 mg pantoprazol-natrium).
PROTONIX-tabletten met vertraagde afgifte bevatten de volgende inactieve ingrediënten: calciumstearaat, crospovidon, hypromellose, ijzeroxide, mannitol, methacrylzuurcopolymeer, polysorbaat 80, povidon, propyleenglycol, natriumcarbonaat, natriumlaurylsulfaat, titaniumdioxide en triethylcitraat. PROTONIX tabletten met vertraagde afgifte (40 mg en 20 mg) voldoen aan USP-oplostest 2.
PROTONIX 40 mg voor orale suspensie met vertraagde afgifte bevat de volgende inactieve ingrediënten: crospovidon, hypromellose, methacrylzuurcopolymeer, microkristallijne cellulose, polysorbaat 80, povidon, natriumcarbonaat, natriumlaurylsulfaat, talk, titaniumdioxide, triethylcitraat en geel ijzeroxide.
INDICATIES
PROTONIX voor orale suspensie met vertraagde afgifte en PROTONIX 40 mg tabletten met vertraagde afgifte zijn geïndiceerd voor:
Kortdurende behandeling van erosieve oesofagitis geassocieerd met gastro-oesofageale refluxziekte (GERD)
PROTONIX 20 mg is geïndiceerd bij volwassenen en pediatrische patiënten van vijf jaar en ouder voor de kortdurende behandeling (tot 8 weken) voor de genezing en symptomatische verlichting van erosieve oesofagitis (EE). Voor die volwassen patiënten die na 8 weken behandeling nog niet zijn genezen, kan een extra 8-weekse kuur met PROTONIX worden overwogen. De veiligheid van de behandeling na 8 weken bij pediatrische patiënten is niet vastgesteld.
Onderhoud van genezing van erosieve oesofagitis
PROTONIX is geïndiceerd voor het behoud van de genezing van EE en het verminderen van de terugvalpercentages van symptomen van brandend maagzuur overdag en 's nachts bij volwassen patiënten met GERD. Gecontroleerde studies duurden niet langer dan 12 maanden.
Pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom
PROTONIX 20 mg is geïndiceerd voor de langdurige behandeling van pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison (ZE)-syndroom.
DOSERING EN ADMINISTRATIE
Aanbevolen doseringsschema
PROTONIX wordt geleverd als granulaat met vertraagde afgifte in pakketten voor de bereiding van orale suspensies of als tabletten met vertraagde afgifte. De aanbevolen doseringen staan vermeld in Tabel 1.
Beheer instructies
Aanwijzingen voor de wijze van toediening voor elke doseringsvorm zijn weergegeven in Tabel 2.
Neem een vergeten dosis zo snel mogelijk in. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem de volgende dosis op het normale geplande tijdstip. Neem geen 2 doses tegelijk.
PROTONIX tabletten met vertraagde afgifte
Slik PROTONIX tabletten met vertraagde afgifte heel door, met of zonder voedsel in de maag. Voor patiënten die niet in staat zijn een tablet van 40 mg door te slikken, kunnen twee tabletten van 20 mg worden ingenomen. Gelijktijdige toediening van antacida heeft geen invloed op de absorptie van PROTONIX tabletten met vertraagde afgifte.
PROTONIX voor orale suspensie met vertraagde afgifte
Dien PROTONIX voor orale suspensie met vertraagde afgifte ongeveer 30 minuten voor een maaltijd toe via orale toediening in appelsap of appelmoes of alleen een maagsonde in appelsap. Omdat een juiste pH noodzakelijk is voor stabiliteit, mag u PROTONIX 20 mg voor orale suspensie met vertraagde afgifte niet toedienen in andere vloeistoffen dan appelsap of ander voedsel dan appelmoes.
Verdeel het pakket van 40 mg PROTONIX 20 mg voor orale suspensie met vertraagde afgifte niet om een dosering van 20 mg te creëren voor pediatrische patiënten die de tabletformulering niet kunnen innemen.
PROTONIX voor orale suspensie met vertraagde afgifte - orale toediening in appelmoes
- Pakje openen.
- Strooi korrels op een theelepel appelmoes. GEBRUIK GEEN ANDERE VOEDINGSMIDDELEN OF VERPLET OF KAUW DE KORRELS.
- Binnen 10 minuten na bereiding innemen.
- Neem slokjes water om ervoor te zorgen dat de korrels in de maag worden weggespoeld. Herhaal waterslokjes indien nodig.
PROTONIX voor orale suspensie met vertraagde afgifte - orale toediening in appelsap
- Pakje openen.
- Leeg korrels in een klein kopje of theelepel met een theelepel appelsap.
- Roer 5 seconden (korrels lossen niet op) en slik onmiddellijk door.
- Om er zeker van te zijn dat de volledige dosis is ingenomen, spoelt u de container een of twee keer met appelsap om eventuele resterende korrels te verwijderen. Onmiddellijk doorslikken.
PROTONIX 40 mg voor orale suspensie met vertraagde afgifte - toediening van nasogastrische (NG) buis of gastrostomiebuis
Voor patiënten die een neussonde of gastrostomiesonde hebben, kan PROTONIX 40 mg voor orale suspensie met vertraagde afgifte als volgt worden gegeven:
- Verwijder de zuiger uit de cilinder van een 2 ounce (60 ml) kathetertipspuit. Gooi de zuiger weg.
- Sluit de kathetertip van de spuit aan op een buis van 16 French (of groter).
- Houd de spuit zo hoog mogelijk aan de slang bevestigd terwijl u PROTONIX voor orale suspensie met vertraagde afgifte toedient om te voorkomen dat de slang buigt.
- Leeg de inhoud van het pakket in de cilinder van de spuit.
- Voeg 10 ml (2 theelepels) appelsap toe en tik en/of schud zachtjes op de cilinder van de spuit om de spuit en het buisje te spoelen. Herhaal dit nog minstens twee keer met telkens dezelfde hoeveelheid appelsap (10 ml of 2 theelepels). Er mogen geen korrels in de spuit achterblijven.
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten met vertraagde afgifte:
- 40 mg pantoprazol, gele ovale biconvexe tabletten aan één kant bedrukt met PROTONIX (bruine inkt)
- 20 mg pantoprazol, gele ovale biconvexe tabletten bedrukt met P20 (bruine inkt) aan één kant
Voor orale suspensie met vertraagde afgifte:
- 40 mg pantoprazol, lichtgeel tot donkerbruin, maagsapresistent granulaat in een eenheidsdosispakket
Opslag en behandeling
PROTONIX (pantoprazol-natrium) Tabletten met vertraagde afgifte worden geleverd als gele, ovale biconvexe tabletten met vertraagde afgifte bedrukt met PROTONIX (bruine inkt) aan één kant met 40 mg pantoprazol en zijn als volgt verkrijgbaar:
NDC 0008-0841-81, flessen van 90
PROTONIX (pantoprazol-natrium) Tabletten met vertraagde afgifte worden geleverd als gele ovale biconvexe tabletten met vertraagde afgifte bedrukt met P20 (bruine inkt) aan één kant met 20 mg pantoprazol en zijn als volgt verkrijgbaar:
NDC 0008-0843-81, flessen van 90
PROTONIX (pantoprazol-natrium) voor orale suspensie met vertraagde afgifte wordt geleverd als lichtgele tot donkerbruine, maagsapresistente korrels die 40 mg pantoprazol bevatten in een eenheidsdosisverpakking en zijn als volgt verkrijgbaar:
NDC 0008-0844-02, eenheidsdosisdoos van 30
Opslag
Bewaar PROTONIX 40 mg voor orale suspensie met vertraagde afgifte en PROTONIX 20 mg tabletten met vertraagde afgifte bij 20 ° tot 25 ° C (68 ° tot 77 ° F); excursies toegestaan tot 15° tot 30°C (59° tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Gedistribueerd door: Wyeth Pharmaceuticals LLC, een dochteronderneming van Pfizer Inc., Philadelphia, PA 19101. Herzien: nov 2020
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Botbreuk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cutane en systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cyanocobalamine (vitamine B-12)-tekort [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypomagnesiëmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Fundische klierpoliepen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
De bijwerkingenprofielen voor PROTONIX (pantoprazol-natrium) voor orale suspensie met vertraagde afgifte en PROTONIX (pantoprazol-natrium) tabletten met vertraagde afgifte zijn vergelijkbaar.
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
volwassenen
Veiligheid in negen gerandomiseerde vergelijkende Amerikaanse klinische onderzoeken bij patiënten met GERD omvatten 1.473 patiënten op orale PROTONIX (20 mg of 40 mg), 299 patiënten op een H2-receptorantagonist, 46 patiënten op een andere PPI en 82 patiënten op placebo. De meest voorkomende bijwerkingen staan vermeld in tabel 3.
Bijkomende bijwerkingen die werden gemeld voor PROTONIX 20 mg in klinische onderzoeken met een frequentie van ≤2% worden hieronder vermeld per lichaamssysteem:
Lichaam als geheel: allergische reactie, koorts, fotosensitiviteitsreactie, gezichtsoedeem
Gastro-intestinaal: constipatie, droge mond, hepatitis
Hematologische: leukopenie, trombocytopenie
Metabool/voeding: verhoogd CK (creatinekinase), gegeneraliseerd oedeem, verhoogd triglyceriden, leverenzymen verhoogd
Musculoskeletaal: spierpijn
Zenuwachtig: depressie, duizeligheid
Huid en aanhangsels: urticaria, uitslag, pruritus
Speciale zintuigen: wazig zien
Pediatrische patiënten
De veiligheid van PROTONIX bij de behandeling van EE geassocieerd met GERD werd geëvalueerd bij pediatrische patiënten van 1 jaar tot 16 jaar in drie klinische onderzoeken. Veiligheidsonderzoeken hadden betrekking op pediatrische patiënten met EE; omdat EE echter soms voorkomt bij pediatrische patiënten, werden ook 249 pediatrische patiënten met endoscopisch bewezen of symptomatische GORZ geëvalueerd. Alle volwassen bijwerkingen van PROTONIX 20 mg worden relevant geacht voor pediatrische patiënten. Bij patiënten in de leeftijd van 1 jaar tot 16 jaar zijn de meest gemelde (>4%) bijwerkingen: URI, hoofdpijn, koorts, diarree, braken, huiduitslag en buikpijn.
Voor veiligheidsinformatie bij patiënten jonger dan 1 jaar zie: Gebruik bij specifieke populaties .
Bijkomende bijwerkingen die werden gemeld voor PROTONIX 20 mg bij pediatrische patiënten in klinische onderzoeken met een frequentie van ≤ 4% worden hieronder vermeld per lichaamssysteem:
Lichaam als geheel: allergische reactie, gezichtsoedeem
Gastro-intestinaal: constipatie, winderigheid, misselijkheid
Metabool/voeding: verhoogde triglyceriden, verhoogde leverenzymen, verhoogde CK (creatinekinase)
Musculoskeletaal: artralgie, spierpijn
Zenuwachtig: duizeligheid, draaierigheid
Huid en aanhangsels: netelroos
De volgende bijwerkingen die in klinische onderzoeken bij volwassenen zijn waargenomen, zijn niet gemeld bij pediatrische patiënten in klinische onderzoeken, maar worden relevant geacht voor pediatrische patiënten: fotosensitiviteitsreactie, droge mond, hepatitis, trombocytopenie, gegeneraliseerd oedeem, depressie, pruritus, leukopenie en wazig zien .
Zollinger-Ellison (ZE) syndroom
In klinische onderzoeken naar het ZE-syndroom waren de bijwerkingen die werden gemeld bij 35 patiënten die PROTONIX 80 mg/dag tot 240 mg/dag gebruikten gedurende maximaal 2 jaar vergelijkbaar met de bijwerkingen die werden gemeld bij volwassen patiënten met GORZ.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van PROTONIX na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Deze bijwerkingen worden hieronder per lichaamssysteem opgesomd:
Maagdarmstelselaandoeningen: fundische klierpoliepen
Algemene aandoeningen en administratievoorwaarden: asthenie, vermoeidheid, malaise
Hematologische: pancytopenie, agranulocytose
Lever- en galaandoeningen: hepatocellulaire schade die leidt tot geelzucht en leverfalen
Immuunsysteemaandoeningen: anafylaxie (inclusief anafylactische shock), systemische lupus erythematodes
Infecties en parasitaire aandoeningen: Clostridium difficile geassocieerde diarree
onderzoeken: gewichtsveranderingen
Metabolisme en voedingsstoornissen: hyponatriëmie, hypomagnesiëmie
Musculoskeletale aandoeningen: rabdomyolyse, botbreuk
Zenuwachtig: ageusie, dysgeusie
Psychische stoornissen: hallucinatie, verwardheid, slapeloosheid, slaperigheid
Nier- en urinewegaandoeningen: acute tubulo-interstitiële nefritis
Huid- en onderhuidaandoeningen: ernstige dermatologische reacties (sommige fataal), waaronder erythema multiforme, Stevens-Johnson-syndroom, toxische epidermale necrolyse (TEN, sommige fataal), angio-oedeem (Quinckes-oedeem) en cutane lupus erythematosus
DRUG-INTERACTIES
Tabel 4 bevat geneesmiddelen met klinisch belangrijke geneesmiddelinteracties en interactie met diagnostiek bij gelijktijdige toediening met PROTONIX en instructies om deze te voorkomen of te behandelen.
Raadpleeg de etikettering van gelijktijdig gebruikte geneesmiddelen voor meer informatie over interacties met PPI's.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Aanwezigheid van maagmaligniteit
Bij volwassenen sluit de symptomatische respons op behandeling met PROTONIX de aanwezigheid van maagkanker niet uit. Overweeg aanvullende follow-up en diagnostische tests bij volwassen patiënten met een suboptimale respons of een vroege symptomatische terugval na voltooiing van de behandeling met een PPI. Overweeg bij oudere patiënten ook een endoscopie.
Acute tubulo-interstitiële nefritis
Acute tubulo-interstitiële nefritis (TIN) is waargenomen bij patiënten die PPI's gebruiken en kan op elk moment tijdens PPI-therapie optreden. Patiënten kunnen verschillende tekenen en symptomen vertonen, van symptomatische overgevoeligheidsreacties tot niet-specifieke symptomen van verminderde nierfunctie (bijv. malaise, misselijkheid, anorexia). In gerapporteerde casusreeksen werd bij sommige patiënten de diagnose gesteld op basis van biopsie en bij afwezigheid van extrarenale manifestaties (bijv. koorts, huiduitslag of artralgie). Stop met PROTONIX 20 mg en evalueer patiënten met verdenking op acute TIN [zie CONTRA-INDICATIES ].
Clostridium difficile-geassocieerde diarree
Gepubliceerde observationele studies suggereren dat PPI-therapie zoals PROTONIX 20 mg gepaard kan gaan met een verhoogd risico op Clostridium difficile-gerelateerde diarree, vooral bij gehospitaliseerde patiënten. Deze diagnose moet worden overwogen voor diarree die niet verbetert [zie ONGEWENSTE REACTIES ].
Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld.
Bot fractuur
Verschillende gepubliceerde observationele studies suggereren dat PPI-therapie geassocieerd kan zijn met een verhoogd risico op osteoporose-gerelateerde fracturen van de heup, pols of wervelkolom. Het risico op fracturen was verhoogd bij patiënten die een hoge dosis kregen, gedefinieerd als meerdere dagelijkse doses, en langdurige PPI-therapie (een jaar of langer). Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld. Patiënten met een risico op osteoporose-gerelateerde fracturen moeten worden behandeld volgens vastgestelde behandelrichtlijnen [zie: DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES ].
Cutane en systemische lupus erythematosus
Cutane lupus erythematodes (CLE) en systemische lupus erythematodes (SLE) zijn gemeld bij patiënten die PPI's gebruikten, waaronder pantoprazolnatrium. Deze voorvallen zijn opgetreden als zowel nieuw begin als een verergering van een bestaande auto-immuunziekte. De meerderheid van de PPI-geïnduceerde lupus erythemateuze gevallen waren CLE.
De meest voorkomende vorm van CLE die werd gemeld bij patiënten die met PPI's werden behandeld, was subacute CLE (SCLE) en trad op binnen weken tot jaren na continue medicamenteuze behandeling bij patiënten variërend van zuigelingen tot ouderen. Over het algemeen werden histologische bevindingen waargenomen zonder orgaanbetrokkenheid.
Systemische lupus erythematosus (SLE) wordt minder vaak gemeld dan CLE bij patiënten die PPI's krijgen. PPI-geassocieerde SLE is meestal milder dan niet-medicamenteuze SLE. Het begin van SLE trad meestal op binnen enkele dagen tot jaren na het starten van de behandeling, voornamelijk bij patiënten variërend van jongvolwassenen tot ouderen. De meerderheid van de patiënten vertoonde huiduitslag; er werden echter ook artralgie en cytopenie gemeld.
Vermijd toediening van PPI's langer dan medisch geïndiceerd. Als er tekenen of symptomen zijn die overeenkomen met CLE of SLE bij patiënten die PROTONIX 40 mg krijgen, stop dan met het medicijn en verwijs de patiënt naar de juiste specialist voor evaluatie. De meeste patiënten verbeteren na stopzetting van de PPI alleen in 4 tot 12 weken. Serologische testen (bijv. ANA) kunnen positief zijn en verhoogde serologische testresultaten kunnen langer duren om op te lossen dan klinische manifestaties.
Cyanocobalamine (vitamine B-12)-tekort
Over het algemeen kan een dagelijkse behandeling met zuurremmende medicijnen gedurende een lange periode (bijv. langer dan 3 jaar) leiden tot malabsorptie van cyanocobalamine (vitamine B-12) veroorzaakt door hypo- of achloorhydrie. In de literatuur zijn zeldzame meldingen van cyanocobalaminedeficiëntie die optreden bij zuuronderdrukkende therapie gemeld. Deze diagnose moet worden overwogen als klinische symptomen worden waargenomen die overeenkomen met cyanocobalaminedeficiëntie.
Hypomagnesiëmie
Hypomagnesiëmie, symptomatisch en asymptomatisch, is zelden gemeld bij patiënten die gedurende ten minste drie maanden met PPI's werden behandeld, en in de meeste gevallen na een jaar therapie. Ernstige bijwerkingen zijn onder meer tetanie, aritmieën en toevallen. Bij de meeste patiënten vereiste de behandeling van hypomagnesiëmie magnesiumvervanging en stopzetting van de PPI.
Voor patiënten die naar verwachting langdurig worden behandeld of die PPI's gebruiken met medicijnen zoals digoxine of geneesmiddelen die hypomagnesiëmie kunnen veroorzaken (bijv. Diuretica), kunnen beroepsbeoefenaren in de gezondheidszorg overwegen om de magnesiumspiegels te controleren voorafgaand aan de start van de PPI-behandeling en periodiek [zie ONGEWENSTE REACTIES ].
Tumorigeniteit
Vanwege de chronische aard van GERD kan er een kans zijn op langdurige toediening van PROTONIX. In langetermijnstudies bij knaagdieren was pantoprazol carcinogeen en veroorzaakte het zeldzame soorten gastro-intestinale tumoren. De relevantie van deze bevindingen voor de ontwikkeling van tumoren bij mensen is niet bekend [zie Niet-klinische toxicologie ].
Fundische klierpoliepen
Het gebruik van PPI wordt in verband gebracht met een verhoogd risico op poliepen van de fundusklier dat toeneemt bij langdurig gebruik, vooral na een jaar. De meeste PPI-gebruikers die fundusklierpoliepen ontwikkelden, waren asymptomatisch en fundusklierpoliepen werden incidenteel vastgesteld op endoscopie. Gebruik de kortste duur van PPI-therapie die geschikt is voor de aandoening die wordt behandeld.
Interferentie met onderzoeken naar neuro-endocriene tumoren
Serum chromogranine A (CgA) niveaus stijgen secundair aan geneesmiddel-geïnduceerde dalingen in maagzuur. Het verhoogde CgA-niveau kan vals-positieve resultaten veroorzaken bij diagnostisch onderzoek naar neuro-endocriene tumoren. Zorgverleners moeten de behandeling met PROTONIX 20 mg tijdelijk stopzetten ten minste 14 dagen voordat de CgA-spiegels worden beoordeeld en overwegen de test te herhalen als de initiële CgA-spiegels hoog zijn. Als seriële tests worden uitgevoerd (bijv. voor monitoring), moet hetzelfde commerciële laboratorium worden gebruikt voor het testen, aangezien de referentiebereiken tussen tests kunnen variëren [zie KLINISCHE FARMACOLOGIE ].
Interferentie met urinescherm voor THC
Er zijn meldingen geweest van vals-positieve urinescreeningtests voor tetrahydrocannabinol (THC) bij patiënten die PPI's kregen, waaronder PROTONIX (zie DRUG-INTERACTIES ].
Gelijktijdig gebruik van PROTONIX met methotrexaat
De literatuur suggereert dat gelijktijdig gebruik van PPI's met methotrexaat (voornamelijk in hoge doseringen; zie voorschrijfinformatie voor methotrexaat) de serumspiegels van methotrexaat en/of zijn metaboliet kan verhogen en verlengen, wat mogelijk kan leiden tot methotrexaattoxiciteit. Bij toediening van een hoge dosis methotrexaat kan bij sommige patiënten een tijdelijke stopzetting van de PPI worden overwogen [zie: DRUG-INTERACTIES ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids en gebruiksaanwijzing ).
Maagkanker
Adviseer patiënten om terug te keren naar hun zorgverlener als ze een suboptimale respons of een vroege symptomatische terugval hebben [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Acute tubulo-interstitiële nefritis
Adviseer patiënten om onmiddellijk hun zorgverlener te bellen als ze tekenen en/of symptomen ervaren die verband houden met acute tubulo-interstitiële nefritis [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Clostridium Difficile-geassocieerde diarree
Adviseer patiënten om onmiddellijk hun zorgverlener te bellen als ze diarree krijgen die niet verbetert [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bot fractuur
Adviseer patiënten om eventuele fracturen, met name van de heup, pols of wervelkolom, aan hun zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cutane en systemische lupus erythematosus
Adviseer patiënten om onmiddellijk hun zorgverlener te bellen voor nieuwe of verergering van symptomen geassocieerd met cutane of systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cyanocobalamine (vitamine B-12)-tekort
Adviseer patiënten om klinische symptomen die verband kunnen houden met cyancobalaminedeficiëntie aan hun zorgverlener te melden als ze langer dan 3 jaar PROTONIX 40 mg krijgen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypomagnesiëmie
Adviseer patiënten om klinische symptomen die verband kunnen houden met hypomagnesiëmie aan hun zorgverlener te melden, als ze gedurende ten minste 3 maanden PROTONIX 40 mg hebben gekregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelinteracties
Instrueer patiënten om hun zorgverlener op de hoogte te stellen van andere medicijnen die ze momenteel gebruiken, inclusief producten die rilpivirine bevatten [zie CONTRA-INDICATIES ] digoxine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ] en hoge dosis methotrexaat [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zwangerschap
Adviseer een zwangere vrouw over het mogelijke risico voor een foetus. Adviseer vrouwen met reproductief potentieel om hun zorgverlener op de hoogte te stellen van een bekende of vermoede zwangerschap [zie: Gebruik bij specifieke populaties ].
Administratie
- PROTONIX voor orale suspensie met vertraagde afgifte en PROTONIX 20 mg tabletten met vertraagde afgifte niet splitsen, pletten of kauwen.
- Het PROTONIX-pakket voor orale suspensie is een vaste dosis en kan niet worden verdeeld om een kleinere dosis te maken.
- Slik PROTONIX 20 mg tabletten met vertraagde afgifte heel door, met of zonder voedsel in de maag.
- Gelijktijdige toediening van antacida heeft geen invloed op de absorptie van PROTONIX tabletten met vertraagde afgifte.
- Neem PROTONIX 20 mg voor orale suspensie met vertraagde afgifte ongeveer 30 minuten voor een maaltijd in.
- Dien PROTONIX voor orale suspensie met vertraagde afgifte toe in appelsap of appelmoes, zoals beschreven in de gebruiksaanwijzing. Niet toedienen in water, andere vloeistoffen of voedsel.
- Voor patiënten met een nasogastrische (NG) of gastrostomiesonde kan PROTONIX voor orale suspensie met vertraagde afgifte worden toegediend met appelsap, zoals beschreven in de gebruiksaanwijzing.
- Neem een vergeten dosis zo snel mogelijk in. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en neem de volgende dosis op het normale geplande tijdstip. Neem geen 2 doses tegelijk.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een carcinogeniteitsonderzoek van 24 maanden werden Sprague-Dawley-ratten oraal behandeld met pantoprazol-doses van 0,5 tot 200 mg/kg/dag, ongeveer 0,1 tot 40 keer de blootstelling op basis van het lichaamsoppervlak van een persoon van 50 kg die 40 mg kreeg toegediend. /dag. In de maagfundus veroorzaakte behandeling met 0,5 tot 200 mg/kg/dag enterochromaffine-achtige (ECL) celhyperplasie en goedaardige en kwaadaardige neuro-endocriene celtumoren op een dosisgerelateerde manier. In de voormaag veroorzaakte behandeling met 50 en 200 mg/kg/dag (ongeveer 10 en 40 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) goedaardige plaveiselcelpapillomen en kwaadaardige plaveiselcelcarcinomen. Zeldzame gastro-intestinale tumoren geassocieerd met behandeling met pantoprazol omvatten een adenocarcinoom van de twaalfvingerige darm met 50 mg/kg/dag en goedaardige poliepen en adenocarcinomen van de maagfundus met 200 mg/kg/dag. In de lever veroorzaakte behandeling met 0,5 tot 200 mg/kg/dag dosisgerelateerde verhogingen van de incidentie van hepatocellulaire adenomen en carcinomen. In de schildklier veroorzaakte behandeling met 200 mg/kg/dag een verhoogde incidentie van folliculaire celadenomen en carcinomen bij zowel mannelijke als vrouwelijke ratten.
In een carcinogeniteitsonderzoek van 24 maanden werden Fischer 344 ratten oraal behandeld met doses van 5 tot 50 mg/kg/dag pantoprazol, ongeveer 1 tot 10 keer de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak. In de maagfundus veroorzaakte behandeling met 5 tot 50 mg/kg/dag enterochromaffine-achtige (ECL) celhyperplasie en goedaardige en kwaadaardige neuro-endocriene celtumoren. De dosiskeuze voor dit onderzoek was mogelijk niet voldoende om het carcinogene potentieel van pantoprazol uitgebreid te evalueren.
In een carcinogeniteitsonderzoek van 24 maanden werden B6C3F1-muizen oraal behandeld met doses van 5 tot 150 mg/kg/dag pantoprazol, 0,5 tot 15 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak. In de lever veroorzaakte behandeling met 150 mg/kg/dag een verhoogde incidentie van hepatocellulaire adenomen en carcinomen bij vrouwelijke muizen. Behandeling met 5 tot 150 mg/kg/dag veroorzaakte ook maag-fundische ECL-celhyperplasie.
Een 26 weken durende p53 +/- transgene carcinogeniteitsstudie bij muizen was niet positief.
Pantoprazol was positief in de in vitro-tests op chromosomale aberratie van menselijke lymfocyten, in een van de twee micronucleustests bij muizen voor clastogene effecten, en in de in vitro Chinese hamster-ovariumcel/HGPRT-voorwaartse mutatietest voor mutagene effecten. Er werden twijfelachtige resultaten waargenomen in de in vivo covalente bindingsassay van DNA van rattenlever. Pantoprazol was negatief in de in vitro Ames-mutatietest, de in vitro ongeplande DNA-synthese (UDS)-test met rattenhepatocyten, de in vitro AS52/GPT zoogdiercel-voorwaartse genmutatietest, de in vitro thymidinekinase-mutatietest met muislymfoom L5178Y cellen, en de in vivo chromosomale aberratie-assay van rattenbeenmergcellen.
Er waren geen effecten op de vruchtbaarheid of het reproductievermogen wanneer pantoprazol werd gegeven in orale doses tot 500 mg/kg/dag bij mannelijke ratten (98 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) en 450 mg/kg/dag bij vrouwelijke ratten (88 keer de aanbevolen dosis voor mensen op basis van het lichaamsoppervlak).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beschikbare gegevens uit gepubliceerde observationele onderzoeken hebben geen verband aangetoond tussen ernstige misvormingen of andere nadelige zwangerschapsuitkomsten met pantoprazol.
In reproductiestudies bij dieren werden met pantoprazol geen aanwijzingen voor nadelige ontwikkelingsresultaten waargenomen. Er zijn reproductieonderzoeken uitgevoerd bij ratten bij orale doses tot 450 mg/kg/dag (ongeveer 88 maal de aanbevolen dosis voor de mens) en konijnen bij orale doses tot 40 mg/kg/dag (ongeveer 16 maal de aanbevolen dosis voor de mens) met toediening van pantoprazol tijdens de organogenese bij drachtige dieren en er zijn in dit onderzoek geen aanwijzingen gevonden voor schade aan de foetus als gevolg van pantoprazol (zie Gegevens ).
Een pre- en postnatale ontwikkelingstoxiciteitsstudie bij ratten met aanvullende eindpunten om het effect op de botontwikkeling te evalueren, werd uitgevoerd met pantoprazol-natrium. Orale doses pantoprazol van 5, 15 en 30 mg/kg/dag (ongeveer 1, 3 en 6 maal de dosis voor mensen van 40 mg/dag) werden toegediend aan drachtige vrouwtjes vanaf dag van de dracht (GD) 6 tot en met de dag van de lactatie (LDV). ) 21. Veranderingen in botmorfologie werden waargenomen bij pups die werden blootgesteld aan pantoprazol in utero en via melk tijdens de lactatieperiode en bij orale toediening van postnatale dag (PND) 4 tot PND 21 [zie Gebruik bij specifieke populaties ]. Er waren geen drugsgerelateerde bevindingen bij moederdieren. Adviseer zwangere vrouwen over het mogelijke risico op schade aan de foetus.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Gegevens
Menselijke gegevens
Beschikbare gegevens van gepubliceerde observationele onderzoeken konden geen verband aantonen tussen nadelige zwangerschapsgerelateerde uitkomsten en het gebruik van pantoprazol. Methodologische beperkingen van deze observationele onderzoeken kunnen geen enkel geneesmiddelgeassocieerd risico tijdens de zwangerschap definitief vaststellen of uitsluiten. In een prospectieve studie van het European Network of Teratology Information Services werden de resultaten van een groep van 53 zwangere vrouwen die mediane dagelijkse doses van 40 mg pantoprazol kregen toegediend, vergeleken met een controlegroep van 868 zwangere vrouwen die geen protonpompremmers (PPI's) gebruikten. . Er was geen verschil in het percentage ernstige misvormingen tussen vrouwen die werden blootgesteld aan PPI's en de controlegroep, wat overeenkomt met een relatief risico (RR) = 0,55, [95% betrouwbaarheidsinterval (BI) 0,08-3,95]. In een populatiegebaseerd retrospectief cohortonderzoek onder alle levendgeborenen in Denemarken van 1996 tot 2008 was er geen significante toename van ernstige geboorteafwijkingen tijdens de analyse van de blootstelling aan pantoprazol in het eerste trimester bij 549 levendgeborenen. Een meta-analyse die 1.530 zwangere vrouwen die in ten minste het eerste trimester waren blootgesteld aan PPI's vergeleek met 133.410 niet-blootgestelde zwangere vrouwen, toonde geen significante toename van het risico op aangeboren afwijkingen of spontane abortus met blootstelling aan PPI's (voor ernstige misvormingen OR=1,12 ([95% CI 0,86-1,45] en voor spontane abortussen OR=1,29 [95% CI 0,84-1,97]).
Dierlijke gegevens
Er zijn reproductieonderzoeken uitgevoerd bij ratten bij orale doses pantoprazol tot 450 mg/kg/dag (ongeveer 88 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) en bij konijnen bij orale doses tot 40 mg/kg/dag (ongeveer 16 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) bij toediening van pantoprazolnatrium tijdens de organogenese bij drachtige dieren. De onderzoeken hebben geen aanwijzingen opgeleverd voor verminderde vruchtbaarheid of schade aan de foetus als gevolg van pantoprazol.
Een pre- en postnatale ontwikkelingstoxiciteitsstudie bij ratten met aanvullende eindpunten om het effect op de botontwikkeling te evalueren, werd uitgevoerd met pantoprazol-natrium. Orale doses pantoprazol van 5, 15 en 30 mg/kg/dag (ongeveer 1, 3 en 6 maal de dosis voor mensen van 40 mg/dag op basis van het lichaamsoppervlak) werden toegediend aan zwangere vrouwen vanaf de dag van de dracht (GD) 6 tot en met lactatiedag (LD) 21. Op postnatale dag (PND 4) tot en met PND 21 kregen de pups orale doses toegediend van 5, 15 en 30 mg/kg/dag (ongeveer 1, 2,3 en 3,2 maal de blootstelling ( AUC) bij mensen in een dosis van 40 mg). Er waren geen drugsgerelateerde bevindingen bij moederdieren. Tijdens de toedieningsfase vóór het spenen (PND 4 tot 21) van de pups was er een verhoogde mortaliteit en/of sterfte en een verminderd lichaamsgewicht en lichaamsgewichtstoename bij 5 mg/kg/dag (ongeveer gelijke blootstellingen (AUC) bij mensen die de 40 mg dosis) en hogere doses. Op PND 21 werden verminderde gemiddelde femurlengte en -gewicht en veranderingen in femurbotmassa en geometrie waargenomen bij de nakomelingen bij 5 mg/kg/dag (ongeveer gelijke blootstellingen (AUC) bij mensen bij de dosis van 40 mg) en hogere doses. De bevindingen van het dijbeen omvatten een lagere totale oppervlakte, botmineraalgehalte en -dichtheid, periostale en endosteale omtrek en dwarsdoorsnede-traagheidsmoment. Er waren geen microscopische veranderingen in het distale dijbeen, proximale scheenbeen of kniegewrichten. Veranderingen in botparameters waren gedeeltelijk reversibel na een herstelperiode, waarbij de bevindingen over PND 70 beperkt waren tot lagere femurmetafyse corticale/subcorticale botmineraaldichtheid bij vrouwelijke pups bij 5 mg/kg/dag (ongeveer gelijke blootstellingen (AUC) bij mensen op de 40 mg dosis) en hogere doses.
Borstvoeding
Risico Samenvatting
Pantoprazol is aangetroffen in de moedermelk van een zogende moeder na een enkelvoudige orale dosis van 40 mg pantoprazol. Er waren geen effecten op de zuigeling die borstvoeding kreeg (zie: Gegevens ). Er zijn geen gegevens over de effecten van pantoprazol op de melkproductie.

De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten in overweging worden genomen, samen met de klinische behoefte van de moeder aan PROTONIX 40 mg en eventuele nadelige effecten op het kind dat borstvoeding krijgt van pantoprazol of van de onderliggende maternale aandoening.
Gegevens
De moedermelk van een 42-jarige vrouw die 10 maanden postpartum 40 mg oraal pantoprazol kreeg, werd gedurende 24 uur onderzocht om lage niveaus van pantoprazol in de moedermelk aan te tonen. Pantoprazol was slechts 2 en 4 uur na de dosis detecteerbaar in melk met melkspiegels van respectievelijk ongeveer 36 mcg/l en 24 mcg/l. Een melk-tot-plasmaverhouding van 0,022 werd 2 uur na toediening van het geneesmiddel waargenomen. Pantoprazol was 6, 8 en 24 uur na de dosis niet aantoonbaar (
Pediatrisch gebruik
De veiligheid en werkzaamheid van PROTONIX voor kortdurende behandeling (tot acht weken) van EE geassocieerd met GERD zijn vastgesteld bij pediatrische patiënten van 1 jaar tot en met 16 jaar. De werkzaamheid voor EE is niet aangetoond bij patiënten jonger dan 1 jaar. Bovendien is er voor patiënten jonger dan 5 jaar geen geschikte doseringssterkte in een voor de leeftijd geschikte formulering beschikbaar. Daarom is PROTONIX geïndiceerd voor de kortdurende behandeling van EE geassocieerd met GERD voor patiënten van 5 jaar en ouder. De veiligheid en werkzaamheid van PROTONIX voor andere pediatrische toepassingen dan EE zijn niet vastgesteld.
1 jaar tot 16 jaar oud
Het gebruik van PROTONIX bij pediatrische patiënten van 1 jaar tot 16 jaar voor kortdurende behandeling (tot acht weken) van EE geassocieerd met GERD wordt ondersteund door: a) extrapolatie van resultaten van adequate en goed gecontroleerde onderzoeken die de goedkeuring van PROTONIX voor de behandeling van EE geassocieerd met GERD bij volwassenen, en b) veiligheids-, effectiviteits- en farmacokinetische onderzoeken uitgevoerd bij pediatrische patiënten [zie Klinische studies , KLINISCHE FARMACOLOGIE ].
De veiligheid van PROTONIX 40 mg bij de behandeling van EE geassocieerd met GERD bij pediatrische patiënten van 1 tot 16 jaar werd geëvalueerd in drie multicenter, gerandomiseerde, dubbelblinde onderzoeken met parallelle behandeling, waarbij 249 pediatrische patiënten betrokken waren, waaronder 8 met EE (4 patiënten). leeftijden van 1 jaar tot 5 jaar en 4 patiënten van 5 jaar tot 11 jaar). De kinderen van 1 jaar tot 5 jaar met endoscopisch gediagnosticeerde EE (gedefinieerd als een endoscopische Hetzel-Dent-score ≥ 2) werden eenmaal daags gedurende 8 weken behandeld met een van de twee dosisniveaus PROTONIX (ongeveer 0,6 mg/kg of 1,2 mg/kg). ). Alle 4 van deze patiënten met EE waren genezen (Hetzel-Dent-score van 0 of 1) na 8 weken. Omdat EE ongewoon is bij pediatrische patiënten, werden voornamelijk pediatrische patiënten met endoscopisch bewezen of symptomatische GORZ ook in deze onderzoeken opgenomen. Patiënten werden gedurende 8 weken behandeld met een reeks doses PROTONIX 20 mg eenmaal daags. Voor veiligheidsbevindingen zie: ONGEWENSTE REACTIES Omdat deze pediatrische onderzoeken geen placebo, actieve comparator of bewijs van een dosisrespons hadden, waren de onderzoeken niet overtuigend met betrekking tot het klinische voordeel van PROTONIX 20 mg voor symptomatische GORZ bij de pediatrische populatie. De werkzaamheid van PROTONIX 40 mg voor de behandeling van symptomatische GERD bij pediatrische patiënten is niet vastgesteld.
Hoewel de gegevens uit de klinische onderzoeken het gebruik van PROTONIX ondersteunen voor de kortdurende behandeling van EE geassocieerd met GERD bij pediatrische patiënten van 1 jaar tot 5 jaar, is er geen commercieel verkrijgbare doseringsformulering die geschikt is voor patiënten jonger dan 5 jaar [zie DOSERING EN ADMINISTRATIE ].
In een farmacokinetische populatieanalyse hadden de klaringswaarden bij de kinderen van 1 tot 5 jaar oud met endoscopisch bewezen GERD een mediane waarde van 2,4 l/u. Na een equivalente dosis van 1,2 mg/kg (15 mg voor ≤12,5 kg en 20 mg voor >12,5 tot
Pasgeborenen tot minder dan een jaar oud
PROTONIX 20 mg bleek niet effectief te zijn in een multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde studie waarbij de behandeling werd stopgezet bij 129 pediatrische patiënten van 1 tot en met 11 maanden oud. Patiënten werden geïncludeerd als ze symptomatische GERD hadden op basis van de medische geschiedenis en gedurende twee weken niet hadden gereageerd op niet-farmacologische interventies voor GERD. De patiënten kregen gedurende vier weken dagelijks PROTONIX in een open-label fase, waarna de patiënten in gelijke verhoudingen werden gerandomiseerd om gedurende de daaropvolgende vier weken op dubbelblinde wijze een behandeling met PROTONIX 40 mg of placebo te krijgen. De werkzaamheid werd beoordeeld door de tijd te observeren vanaf randomisatie tot stopzetting van de studie als gevolg van verergering van de symptomen tijdens de vier weken durende stopzettingsfase van de behandeling. Er was geen statistisch significant verschil tussen PROTONIX 20 mg en placebo in de stopzettingssnelheid.
In dit onderzoek waren de bijwerkingen die vaker werden gemeld (verschil van ≥ 4%) bij de behandelde populatie in vergelijking met de placebopopulatie verhoogde CK, middenoorontsteking, rhinitis en laryngitis.
In een populatiefarmacokinetische analyse was de systemische blootstelling hoger bij patiënten jonger dan 1 jaar met GERD in vergelijking met volwassenen die een enkelvoudige dosis van 40 mg kregen (geometrisch gemiddelde AUC was 103% hoger bij te vroeg geboren baby's en pasgeborenen die een enkelvoudige dosis van 2,5 mg kregen). van PROTONIX, en 23% hoger bij zuigelingen van 1 tot en met 11 maanden oud die een enkele dosis van ongeveer 1,2 mg/kg krijgen). Bij deze patiënten nam de schijnbare klaring (CL/F) toe met de leeftijd (mediane klaring: 0,6 l/uur, bereik: 0,03 tot 3,2 l/uur).
Deze doses resulteerden in farmacodynamische effecten op de maag, maar niet op de pH van de slokdarm. Na eenmaal daagse dosering van 2,5 mg PROTONIX 20 mg bij premature zuigelingen en pasgeborenen, was er een stijging van de gemiddelde maag-pH (van 4,3 bij baseline tot 5,2 bij steady-state) en in het gemiddelde % tijd dat de maag-pH > 4 was ( van 60% bij baseline tot 80% bij steady-state). Na eenmaal daagse dosering van ongeveer 1,2 mg/kg PROTONIX 20 mg bij zuigelingen van 1 tot en met 11 maanden oud, was er een stijging van de gemiddelde maag-pH (van 3,1 bij baseline tot 4,2 bij steady-state) en in het gemiddelde % tijd dat maag-pH was > 4 (van 32% bij baseline tot 60% bij steady-state). Er werden echter geen significante veranderingen waargenomen in de gemiddelde intra-oesofageale pH of % tijd dat de slokdarm-pH
Omdat in de gerandomiseerde, placebogecontroleerde studie bij deze leeftijdsgroep niet is aangetoond dat PROTONIX 20 mg werkzaam is, is het gebruik van PROTONIX voor de behandeling van symptomatische GORZ bij zuigelingen jonger dan 1 jaar niet geïndiceerd.
Dierlijke toxiciteitsgegevens
In een pre- en postnataal ontwikkelingsonderzoek bij ratten kregen de jongen orale doses pantoprazol van 5, 15 en 30 mg/kg/dag toegediend (ongeveer 1, 2,3 en 3,2 maal de blootstelling (AUC) bij kinderen van 6 tot 11 jaar bij een dosis van 40 mg) op postnatale dag (PND 4) tot en met PND 21, naast lactatieblootstelling via melk. Op PND 21 werden verminderde gemiddelde femurlengte en -gewicht en veranderingen in femurbotmassa en -geometrie waargenomen bij de nakomelingen bij 5 mg/kg/dag (ongeveer gelijke blootstellingen (AUC) bij kinderen van 6 tot 11 jaar bij de dosis van 40 mg) en hogere doses. Veranderingen in botparameters waren gedeeltelijk omkeerbaar na een herstelperiode.
Bij neonatale/juveniele dieren (ratten en honden) waren de toxiciteiten vergelijkbaar met die waargenomen bij volwassen dieren, waaronder maagveranderingen, afname van de rode bloedcelmassa, toename van lipiden, enzyminductie en hepatocellulaire hypertrofie. Een verhoogde incidentie van eosinofiele hoofdcellen bij volwassen en neonatale/juveniele ratten, en atrofie van hoofdcellen bij volwassen ratten en bij neonatale/juveniele honden, werd waargenomen in het fundusslijmvlies van magen in onderzoeken met herhaalde doses. Volledig tot gedeeltelijk herstel van deze effecten werd waargenomen bij dieren van beide leeftijdsgroepen na een herstelperiode.
Geriatrisch gebruik
In kortdurende klinische onderzoeken in de VS waren de genezingspercentages van EE bij de 107 oudere patiënten (≥65 jaar oud) die werden behandeld met PROTONIX vergelijkbaar met die gevonden bij patiënten jonger dan 65 jaar. De incidentiepercentages van bijwerkingen en laboratoriumafwijkingen bij patiënten in de leeftijd 65 jaar en ouder waren vergelijkbaar met die van patiënten jonger dan 65 jaar.
OVERDOSERING
Ervaring bij patiënten die zeer hoge doses PROTONIX gebruiken (meer dan 240 mg) is beperkt. Spontane postmarketingmeldingen van overdosering vallen over het algemeen binnen het bekende veiligheidsprofiel van PROTONIX.
Pantoprazol wordt niet verwijderd door hemodialyse. In geval van overdosering dient de behandeling symptomatisch en ondersteunend te zijn.
Enkelvoudige orale doses pantoprazol van 709 mg/kg, 798 mg/kg en 887 mg/kg waren dodelijk voor respectievelijk muizen, ratten en honden. De symptomen van acute toxiciteit waren hypoactiviteit, ataxie, voorovergebogen zitten, gespreide ledematen, laterale positie, segregatie, afwezigheid van oorreflex en tremor.
Als er sprake is van overmatige blootstelling aan PROTONIX 20 mg, bel dan uw Antigifcentrum op 1-800-222-1222 voor actuele informatie over de behandeling van vergiftiging of overdosering.
CONTRA-INDICATIES
- PROTONIX is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor een van de bestanddelen van de formulering of voor een gesubstitueerd benzimidazol. Overgevoeligheidsreacties kunnen anafylaxie, anafylactische shock, angio-oedeem, bronchospasme, acute tubulo-interstitiële nefritis en urticaria omvatten (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
- Protonpompremmers (PPI's), waaronder PROTONIX, zijn gecontra-indiceerd bij patiënten die rilpivirine-bevattende producten krijgen [zie DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Pantoprazol is een PPI die de laatste stap in de maagzuurproductie onderdrukt door covalent te binden aan het (H+, K+)-ATPase-enzymsysteem op het secretoire oppervlak van de pariëtale maagcel. Dit effect leidt tot remming van zowel basale als gestimuleerde maagzuursecretie, ongeacht de stimulus. De binding aan de (H+, K+)-ATPase resulteert in een duur van het antisecretoire effect dat langer dan 24 uur aanhoudt voor alle geteste doses (20 mg tot 120 mg).
farmacodynamiek
PROTONIX 20 mg Voor orale suspensie met vertraagde afgifte is aangetoond dat 40 mg vergelijkbaar is met PROTONIX tabletten met vertraagde afgifte bij het onderdrukken van door pentagastrine gestimuleerde MAO bij patiënten (n = 49) met GERD en een voorgeschiedenis van EE. In deze farmacodynamische cross-overstudie in meerdere centra werd een orale dosis van 40 mg PROTONIX voor orale suspensie met vertraagde afgifte, toegediend in een theelepel appelmoes, vergeleken met een orale dosis van 40 mg PROTONIX tabletten met vertraagde afgifte na toediening van elke formulering eenmaal daags gedurende 7 dagen. dagen. Beide medicijnen werden dertig minuten voor het ontbijt toegediend. Pentagastrine-gestimuleerd (MAO) werd beoordeeld van uur 23 tot 24 uur bij steady state.
Antisecretoire activiteit
Onder maximale zuurstimulerende omstandigheden met pentagastrine treedt een dosisafhankelijke afname van de maagzuurproductie op na een enkele dosis oraal (20-80 mg) of een enkele dosis intraveneus (20-120 mg) pantoprazol bij gezonde proefpersonen. Pantoprazol dat eenmaal daags wordt gegeven, leidt tot een toenemende remming van de maagzuursecretie. Na de initiële orale dosis van 40 mg pantoprazol werd een gemiddelde remming van 51% bereikt na 2,5 uur. Bij eenmaal daagse dosering gedurende 7 dagen was de gemiddelde remming verhoogd tot 85%. Pantoprazol onderdrukte de zuursecretie met meer dan 95% bij de helft van de proefpersonen. De zuursecretie was binnen een week na de laatste dosis pantoprazol weer normaal; er was geen bewijs van rebound-hypersecretie.
In een reeks dosis-responsonderzoeken veroorzaakte pantoprazol, bij orale doses van 20 tot 120 mg, dosisgerelateerde verhogingen van de mediane basale maag-pH en in het percentage tijd dat de maag-pH >3 en >4 was. Behandeling met 40 mg pantoprazol veroorzaakte significant grotere stijgingen van de maag-pH dan de dosis van 20 mg. Doses hoger dan 40 mg (60, 80, 120 mg) resulteerden niet in verdere significante verhogingen van de mediane maag-pH. De effecten van pantoprazol op de mediane pH van één dubbelblind crossover-onderzoek worden weergegeven in tabel 5.
Serum Gastrine-effecten
Nuchtere serumgastrinespiegels werden beoordeeld in twee dubbelblinde onderzoeken naar de acute genezing van EE, waarbij 682 patiënten met gastro-oesofageale refluxziekte (GERD) 10, 20 of 40 mg PROTONIX 20 mg kregen gedurende maximaal 8 weken. Na 4 weken behandeling was er een stijging van de gemiddelde gastrinespiegels van 7%, 35% en 72% ten opzichte van de waarden voor de behandeling in respectievelijk de 10, 20 en 40 mg behandelingsgroepen. Een vergelijkbare stijging van de serumgastrinespiegels werd waargenomen bij het 8 weken durende bezoek met gemiddelde stijgingen van 3%, 26% en 84% voor de drie dosisgroepen met pantoprazol. De mediane serumgastrinespiegels bleven binnen de normale limieten tijdens onderhoudstherapie met PROTONIX-tabletten met vertraagde afgifte.
In internationale langetermijnstudies waarbij meer dan 800 patiënten betrokken waren, werd een 2- tot 3-voudige stijging van de nuchtere serumgastrinespiegel vóór de behandeling waargenomen in de eerste maanden van de behandeling met pantoprazol in doses van 40 mg per dag tijdens GERD-onderhoudsstudies en 40 mg mg of hoger per dag bij patiënten met refractaire GERD. Nuchtere serumgastrinespiegels bleven over het algemeen ongeveer 2 tot 3 keer de basislijn gedurende maximaal 4 jaar periodieke follow-up in klinische onderzoeken.
Na kortdurende behandeling met PROTONIX 20 mg worden verhoogde gastrinespiegels na ten minste 3 maanden weer normaal.
Enterochromaffine-achtige (ECL) celeffecten
Bij 39 patiënten die werden behandeld met oraal pantoprazol 40 mg tot 240 mg per dag (de meeste kregen 40 mg tot 80 mg) gedurende maximaal 5 jaar, was er een matige toename van de ECL-celdichtheid, beginnend na het eerste jaar van gebruik, die leek te plateau na 4 jaar.
In een niet-klinische studie bij Sprague-Dawley-ratten resulteerde levenslange blootstelling (24 maanden) aan pantoprazol in doses van 0,5 tot 200 mg/kg/dag in dosisgerelateerde verhogingen van maag-ECL-celproliferatie en maag-neuro-endocriene (NE)-celtumoren . Maag-NE-celtumoren bij ratten kunnen het gevolg zijn van chronische verhoging van de serumgastrineconcentraties. De hoge dichtheid van ECL-cellen in de maag van de rat maakt deze soort zeer vatbaar voor de proliferatieve effecten van verhoogde gastrineconcentraties geproduceerd door PPI's. Er werden echter geen verhogingen van serumgastrine waargenomen na toediening van pantoprazol in een dosis van 0,5 mg/kg/dag. In een afzonderlijke studie werd een maag-NE-celtumor zonder gelijktijdige ECL-celproliferatieve veranderingen waargenomen bij 1 vrouwelijke rat na 12 maanden dosering met pantoprazol van 5 mg/kg/dag en een herstel na 9 maanden zonder dosis [zie Niet-klinische toxicologie ].
Endocriene effecten
In een klinisch farmacologisch onderzoek had PROTONIX 40 mg eenmaal daags gedurende 2 weken geen effect op de spiegels van de volgende hormonen: cortisol, testosteron, trijoodthyronine (T3), thyroxine (T4), thyroïdstimulerend hormoon (TSH), thyronine- bindend eiwit, bijschildklierhormoon, insuline, glucagon, renine, aldosteron, follikelstimulerend hormoon, luteïniserend hormoon, prolactine en groeihormoon.
In een 1-jarige studie van GERD-patiënten die werden behandeld met PROTONIX 40 mg of 20 mg, waren er geen veranderingen ten opzichte van de uitgangswaarde in de totale niveaus van T3, T4 en TSH.
Farmacokinetiek
PROTONIX 40 mg tabletten met vertraagde afgifte worden bereid als maagsapresistente tabletten, zodat de absorptie van pantoprazol pas begint nadat de tablet de maag heeft verlaten. De piekserumconcentratie (Cmax) en het gebied onder de serumconcentratie-tijdcurve (AUC) nemen evenredig toe met orale en intraveneuze doses van 10 mg tot 80 mg. Pantoprazol accumuleert niet en de farmacokinetiek ervan blijft ongewijzigd bij meerdere dagelijkse doseringen. Na orale of intraveneuze toediening neemt de serumconcentratie van pantoprazol bi-exponentieel af, met een terminale eliminatiehalfwaardetijd van ongeveer één uur.
Bij snelle metaboliseerders met een normale leverfunctie die een orale dosis van de maagsapresistente tablet van 40 mg pantoprazol krijgen, is de piekconcentratie (Cmax) 2,5 g/ml; de tijd om de piekconcentratie (tmax) te bereiken is 2,5 uur en de gemiddelde totale oppervlakte onder de plasmaconcentratie versus tijdcurve (AUC) is 4,8 g-uur/ml (bereik 1,4 tot 13,3 g-uur/ml). Na intraveneuze toediening van pantoprazol aan snelle metaboliseerders is de totale klaring 7,6-14,0 l/u en het schijnbare distributievolume 11,0-23,6 l.
Een enkele orale dosis PROTONIX voor orale suspensie met vertraagde afgifte, 40 mg, bleek bio-equivalent te zijn bij toediening aan gezonde proefpersonen (N = 22) als korrels gestrooid over een theelepel appelmoes, als korrels gemengd met appelsap, of gemengd met appelsap gevolgd door toediening via een maagsonde. De farmacokinetische parameters van plasma uit een cross-overonderzoek bij gezonde proefpersonen zijn samengevat in tabel 6.
Absorptie
Na toediening van een enkelvoudige of meervoudige orale dosis van 40 mg PROTONIX 20 mg tabletten met vertraagde afgifte, werd de piekplasmaconcentratie van pantoprazol bereikt in ongeveer 2,5 uur en was de Cmax 2,5 g/ml. Pantoprazol ondergaat weinig first-pass metabolisme, wat resulteert in een absolute biologische beschikbaarheid van ongeveer 77%. De absorptie van pantoprazol wordt niet beïnvloed door gelijktijdige toediening van antacida.
Toediening van PROTONIX tabletten met vertraagde afgifte met voedsel kan de absorptie tot 2 uur of langer vertragen; de Cmax en de mate van absorptie van pantoprazol (AUC) veranderen echter niet. Daarom kunnen PROTONIX 40 mg tabletten met vertraagde afgifte worden ingenomen zonder rekening te houden met het tijdstip van maaltijden.
Toediening van pantoprazol granulaat, 40 mg, met een vetrijke maaltijd vertraagde de mediane tijd tot piekplasmaconcentratie met 2 uur. Bij een gelijktijdige vetrijke maaltijd daalden de Cmax en AUC van pantoprazol granulaat, 40 mg, gestrooid op appelmoes met respectievelijk 51% en 29%. Daarom moet PROTONIX 20 mg voor orale suspensie met vertraagde afgifte ongeveer 30 minuten voor een maaltijd worden ingenomen.
Verdeling
Het schijnbare distributievolume van pantoprazol is ongeveer 11 tot 23,6 l, voornamelijk verdeeld in extracellulaire vloeistof. De serumeiwitbinding van pantoprazol is ongeveer 98%, voornamelijk aan albumine.
Eliminatie
Metabolisme
Pantoprazol wordt uitgebreid gemetaboliseerd in de lever via het cytochroom P450 (CYP)-systeem. Het metabolisme van pantoprazol is onafhankelijk van de toedieningsweg (intraveneus of oraal). De belangrijkste metabole route is demethylering, door CYP2C19, met daaropvolgende sulfatering; andere metabole routes omvatten oxidatie door CYP3A4. Er is geen bewijs dat een van de pantoprazolmetabolieten significante farmacologische activiteit heeft.
uitscheiding
Na een enkelvoudige orale of intraveneuze dosis 14C-gelabeld pantoprazol aan gezonde proefpersonen met een normale metaboliseerder, werd ongeveer 71% van de dosis uitgescheiden in de urine en 18% uitgescheiden in de feces via excretie via de gal. Er was geen renale excretie van onveranderd pantoprazol.
Specifieke populaties
Geriatrische patiënten
Er werden slechts lichte tot matige verhogingen van de AUC (43%) en Cmax (26%) van pantoprazol gevonden bij oudere proefpersonen (64 tot 76 jaar) na herhaalde orale toediening, vergeleken met jongere proefpersonen [zie Gebruik bij specifieke populaties ].
Pediatrische patiënten
De farmacokinetiek van pantoprazol is onderzocht bij kinderen jonger dan 16 jaar in vier gerandomiseerde, open-label klinische onderzoeken bij pediatrische patiënten met vermoedelijke/bewezen GORZ. Een pediatrische granulaatformulering werd bestudeerd bij kinderen tot en met 5 jaar en PROTONIX 40 mg tabletten met vertraagde afgifte werden bestudeerd bij kinderen ouder dan 5 jaar.
In een farmacokinetische populatieanalyse nam de totale klaring op niet-lineaire wijze toe met toenemend lichaamsgewicht. Alleen bij kinderen jonger dan 3 jaar nam de totale klaring ook toe met toenemende leeftijd.
Pasgeborene tot en met 5 jaar
[zien Gebruik bij specifieke populaties ]
Kinderen en adolescenten van 6 tot en met 16 jaar
De farmacokinetiek van PROTONIX-tabletten met vertraagde afgifte werd geëvalueerd bij kinderen van 6 tot 16 jaar met een klinische diagnose van GERD. De PK-parameters na een enkelvoudige orale dosis van 20 mg of 40 mg PROTONIX 40 mg tabletten bij kinderen van 6 tot 16 jaar waren zeer variabel (%CV varieert van 40 tot 80%). De geometrische gemiddelde AUC geschat op basis van farmacokinetische populatieanalyse na een 40 mg PROTONIX 40 mg tablet bij pediatrische patiënten was respectievelijk ongeveer 39% en 10% hoger bij 6 tot 11 en 12 tot 16 jaar oude kinderen, vergeleken met die van volwassenen (Tabel 7) .
Mannelijke en vrouwelijke patiënten
Er is een bescheiden toename van de AUC en Cmax van pantoprazol bij vrouwen in vergelijking met mannen. De gewichtsgenormaliseerde klaringswaarden zijn echter vergelijkbaar bij vrouwen en mannen.
Bij pediatrische patiënten in de leeftijd van 1 tot en met 16 jaar waren er geen klinisch relevante effecten van geslacht op de klaring van pantoprazol, zoals blijkt uit farmacokinetische populatieanalyse.
Patiënten met nierinsufficiëntie
Bij patiënten met een ernstige nierfunctiestoornis waren de farmacokinetische parameters van pantoprazol vergelijkbaar met die van gezonde proefpersonen.
Patiënten met leverinsufficiëntie
Bij patiënten met een lichte tot ernstige leverfunctiestoornis (Child-Pugh A tot C cirrose) stegen de maximale pantoprazolconcentraties slechts licht (1,5-voudig) in vergelijking met gezonde proefpersonen. Hoewel de serumhalfwaardetijden stegen tot 7-9 uur en de AUC-waarden 5 tot 7 keer stegen bij patiënten met leverinsufficiëntie, waren deze stijgingen niet groter dan die waargenomen bij trage CYP2C19-metaboliseerders, waarvoor geen dosisaanpassing nodig is. Deze farmacokinetische veranderingen bij patiënten met leverinsufficiëntie resulteren in een minimale accumulatie van het geneesmiddel na eenmaaldaagse toediening van meervoudige doses. Doses hoger dan 40 mg/dag zijn niet onderzocht bij patiënten met leverinsufficiëntie.
Geneesmiddelinteractiestudies
Effect van andere geneesmiddelen op pantoprazol
Pantoprazol wordt voornamelijk gemetaboliseerd door CYP2C19 en in mindere mate door CYP's 3A4, 2D6 en 2C9. In in vivo geneesmiddelinteractiestudies met CYP2C19-substraten (diazepam [ook een CYP3A4-substraat] en fenytoïne [ook een CYP3A4-inductor] en clopidogrel), nifedipine, midazolam en claritromycine (CYP3A4-substraten), metoprolol (een CYPdiclofenac-substraat), , naproxen en piroxicam (CYP2C9-substraten) en theofylline (een CYP1A2-substraat) bij gezonde proefpersonen, was de farmacokinetiek van pantoprazol niet significant veranderd.
Effect van pantoprazol op andere geneesmiddelen
Clopidogrel
Clopidogrel wordt gedeeltelijk door CYP2C19 gemetaboliseerd tot zijn actieve metaboliet. In een cross-over klinisch onderzoek kregen 66 gezonde proefpersonen clopidogrel (300 mg oplaaddosis gevolgd door 75 mg per dag) alleen en pantoprazol (80 mg tegelijk met clopidogrel) toegediend gedurende 5 dagen. Op dag 5 was de gemiddelde AUC van de actieve metaboliet van clopidogrel met ongeveer 14% verminderd (geometrisch gemiddelde ratio was 86%, met een 90% BI van 79 tot 93%) wanneer pantoprazol gelijktijdig met clopidogrel werd toegediend in vergelijking met alleen clopidogrel. Farmacodynamische parameters werden ook gemeten en toonden aan dat de verandering in remming van de bloedplaatjesaggregatie (geïnduceerd door 5 μM ADP) gecorreleerd was met de verandering in de blootstelling aan de actieve metaboliet van clopidogrel. De klinische betekenis van deze bevinding is niet duidelijk.
Mycofenolaatmofetil (MMF)
Toediening van pantoprazol 40 mg tweemaal daags gedurende 4 dagen en een enkelvoudige dosis van 1000 mg MMF ongeveer één uur na de laatste dosis pantoprazol aan 12 gezonde proefpersonen in een cross-over onderzoek resulteerde in een verlaging van 57% van de Cmax en een verlaging van 27% in de AUC van MPA. Transplantatiepatiënten die ongeveer 2000 mg MMF per dag kregen (n=12) werden vergeleken met transplantatiepatiënten die ongeveer dezelfde dosis MMF en pantoprazol 40 mg per dag kregen (n=21). Er was een afname van 78% van de Cmax en een afname van 45% van de AUC van MPA bij patiënten die zowel pantoprazol als MMF kregen (zie DRUG-INTERACTIES ].
Andere medicijnen
In vivo-onderzoeken suggereren ook dat pantoprazol geen significante invloed heeft op de kinetiek van de volgende geneesmiddelen (cisapride, theofylline, diazepam [en zijn actieve metaboliet, desmethyldiazepam], fenytoïne, metoprolol, nifedipine, carbamazepine, midazolam, claritromycine, diclofenac, naprox, en orale anticonceptiva [levonorgestrel/ethinylestradiol]). In andere in-vivo-onderzoeken hadden digoxine, ethanol, glyburide, antipyrine, cafeïne, metronidazol en amoxicilline geen klinisch relevante interacties met pantoprazol.
Hoewel er in klinische onderzoeken geen significante geneesmiddelinteracties zijn waargenomen, is de mogelijkheid van significante geneesmiddelinteracties bij meer dan eenmaal daagse dosering met hoge doses pantoprazol niet onderzocht bij trage metaboliseerders of personen met een leverfunctiestoornis.
Antacida
Er was ook geen interactie met gelijktijdig toegediende antacida.
farmacogenomica
CYP2C19 vertoont een bekend genetisch polymorfisme vanwege de deficiëntie ervan in sommige subpopulaties (bijv. ongeveer 3% van de blanken en Afro-Amerikanen en 17% tot 23% van de Aziaten zijn slechte metaboliseerders). Hoewel deze subpopulaties van pantoprazol trage metaboliseerders een eliminatiehalfwaardetijd hebben van 3,5 tot 10 uur bij volwassenen, hebben ze nog steeds een minimale accumulatie (23% of minder) bij eenmaal daagse dosering. Voor volwassen patiënten die trage CYP2C19-metaboliseerders zijn, is geen dosisaanpassing nodig.
Net als bij volwassenen vertoonden pediatrische patiënten met het trage metaboliserende genotype CYP2C19 (CYP2C19 *2/*2) een meer dan 6-voudige toename van de AUC in vergelijking met pediatrische extensieve (CYP2C19 *1/*1) en intermediaire (CYP2C19 *1 /*x) metaboliseerders. Slechte metaboliseerders vertoonden een ongeveer 10 keer lagere schijnbare orale klaring in vergelijking met snelle metaboliseerders.
Voor bekende pediatrische trage metaboliseerders moet een dosisverlaging worden overwogen.
Klinische studies
PROTONIX 20 mg tabletten met vertraagde afgifte werden gebruikt in de volgende klinische onderzoeken.
Erosieve oesofagitis (EE) geassocieerd met gastro-oesofageale refluxziekte (GERD)
Volwassen patiënten
Een multicenter, dubbelblind, placebogecontroleerd onderzoek in de VS met PROTONIX 10 mg, 20 mg of 40 mg eenmaal daags werd uitgevoerd bij 603 patiënten met refluxsymptomen en endoscopisch gediagnosticeerde EE van graad 2 of hoger (Hetzel-Dent-schaal). In deze studie had ongeveer 25% van de geïncludeerde patiënten ernstige EE van graad 3 en 10% had graad 4. De percentages genezen patiënten (per protocol, n = 541) in deze studie worden weergegeven in Tabel 8.
In deze studie hadden alle PROTONIX-behandelingsgroepen significant hogere genezingspercentages dan de placebogroep. Dit gold ongeacht de H. pylori-status voor de 40 mg en 20 mg PROTONIX 40 mg behandelingsgroepen. De dosis van 40 mg PROTONIX 20 mg resulteerde in genezingssnelheden die significant hoger waren dan die gevonden met de dosis van 20 mg of 10 mg.
Een significant groter deel van de patiënten die PROTONIX 40 mg gebruikten, ervoer volledige verlichting van brandend maagzuur overdag en 's nachts en de afwezigheid van oprispingen, beginnend vanaf de eerste dag van de behandeling, vergeleken met placebo. Patiënten die PROTONIX gebruikten, consumeerden significant minder antacidumtabletten per dag dan degenen die placebo gebruikten.
PROTONIX 40 mg en 20 mg eenmaal daags werden ook vergeleken met nizatidine 150 mg tweemaal daags in een multicenter, dubbelblind onderzoek in de VS van 243 patiënten met refluxsymptomen en endoscopisch gediagnosticeerde EE van graad 2 of hoger. De percentages genezen patiënten (per protocol, n = 212) zijn weergegeven in Tabel 9.
Een eenmaal daagse behandeling met PROTONIX 40 mg of 20 mg resulteerde in significant betere genezingspercentages na zowel 4 als 8 weken vergeleken met tweemaal daagse behandeling met 150 mg nizatidine. Voor de 40 mg-behandelingsgroep werden significant hogere genezingspercentages bereikt in vergelijking met nizatidine, ongeacht de H. pylori-status.
Een significant groter deel van de patiënten in de PROTONIX-behandelingsgroepen ervoer volledige verlichting van brandend maagzuur en oprispingen tijdens de nacht, beginnend op de eerste dag en van brandend maagzuur overdag op de tweede dag, vergeleken met degenen die tweemaal daags 150 mg nizatidine gebruikten. Patiënten die PROTONIX gebruikten, consumeerden significant minder antacidumtabletten per dag dan degenen die nizatidine gebruikten.
Pediatrische patiënten in de leeftijd van 5 jaar tot 16 jaar
De werkzaamheid van PROTONIX bij de behandeling van EE geassocieerd met GERD bij pediatrische patiënten in de leeftijd van 5 jaar tot 16 jaar is geëxtrapoleerd van adequate en goed uitgevoerde onderzoeken bij volwassenen, aangezien de pathofysiologie hetzelfde wordt geacht. Vier pediatrische patiënten met endoscopisch gediagnosticeerde EE werden bestudeerd in multicenter, gerandomiseerde, dubbelblinde onderzoeken met parallelle behandeling. Kinderen met endoscopisch gediagnosticeerde EE (gedefinieerd als een endoscopische Hetzel-Dent-score ≥ 2) werden eenmaal daags gedurende 8 weken behandeld met een van de twee dosisniveaus PROTONIX (20 mg of 40 mg). Alle 4 patiënten met EE waren genezen (Hetzel-Dent-score van 0 of 1) na 8 weken.
Langdurige handhaving van genezing van erosieve oesofagitis
Twee onafhankelijke, multicenter, gerandomiseerde, dubbelblinde, vergelijkende gecontroleerde onderzoeken met een identiek ontwerp werden uitgevoerd bij volwassen GERD-patiënten met endoscopisch bevestigde genezen EE om de werkzaamheid van PROTONIX bij het behoud van genezing op lange termijn aan te tonen. In de twee Amerikaanse onderzoeken werden respectievelijk 386 en 404 patiënten opgenomen die ofwel 10 mg, 20 mg of 40 mg PROTONIX 40 mg tabletten met vertraagde afgifte eenmaal daags of 150 mg ranitidine tweemaal daags kregen. Zoals aangetoond in Tabel 10, waren PROTONIX 40 mg en 20 mg significant beter dan ranitidine op elk tijdstip met betrekking tot het behoud van genezing. Bovendien was PROTONIX 40 mg superieur aan alle andere onderzochte behandelingen.
PROTONIX 40 mg was superieur aan ranitidine bij het verminderen van het aantal episoden van brandend maagzuur overdag en 's nachts vanaf de eerste tot en met de twaalfde maand van de behandeling. PROTONIX 20 mg, eenmaal daags toegediend, was ook effectief in het verminderen van episoden van brandend maagzuur overdag en 's nachts in één onderzoek, zoals weergegeven in Tabel 11.
Pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom
In een multicenter, open-label onderzoek van 35 patiënten met pathologische hypersecretoire aandoeningen, zoals het Zollinger-Ellison-syndroom, met of zonder multipele endocriene neoplasie-type I, controleerde PROTONIX met succes de maagzuursecretie. Doses variërend van 80 mg per dag tot 240 mg per dag hielden de maagzuurproductie onder 10 mEq/u bij patiënten zonder eerdere zuurreducerende operatie en onder 5 mEq/h bij patiënten met eerdere zuurreducerende operatie.
Doses werden aanvankelijk getitreerd op basis van de individuele behoeften van de patiënt en bij sommige patiënten aangepast op basis van de klinische respons in de loop van de tijd [zie DOSERING EN ADMINISTRATIE ]. PROTONIX 40 mg werd bij deze doseringen gedurende langere perioden goed verdragen (bij sommige patiënten langer dan 2 jaar).
PATIËNT INFORMATIE
PROTONIX (pro-TAH-nix) (pantoprazol-natrium) tabletten met vertraagde afgifte en PROTONIX (pro-TAH-nix) (pantoprazol-natrium) voor orale suspensie met vertraagde afgifte
Wat is de belangrijkste informatie die ik over PROTONIX moet weten?
moet PROTONIX 20 mg precies innemen zoals voorgeschreven, in de laagst mogelijke dosis en voor de kortst mogelijke tijd.
PROTONIX kan helpen bij uw zuurgerelateerde symptomen, maar u kunt nog steeds ernstige maagproblemen hebben. Praat met uw arts.
PROTONIX kan ernstige bijwerkingen veroorzaken, waaronder:
- Een type nierprobleem (acute tubulo-interstitiële nefritis). Sommige mensen die geneesmiddelen met protonpompremmers (PPI), waaronder 40 mg PROTONIX, gebruiken, kunnen een nierprobleem ontwikkelen dat acute tubulo-interstitiële nefritis wordt genoemd en dat op elk moment tijdens de behandeling met PROTONIX kan optreden. Bel onmiddellijk uw arts als u minder plast of als u bloed in uw urine heeft.
- Diarree veroorzaakt door een infectie (Clostridium difficile) in uw darmen. Bel onmiddellijk uw arts als u waterige ontlasting of maagpijn heeft die niet weggaat. U kunt wel of geen koorts hebben.
- Botbreuken (heup, pols of wervelkolom). Botbreuken in de heup, pols of wervelkolom kunnen optreden bij mensen die meerdere dagelijkse doses PPI-geneesmiddelen gebruiken en gedurende een lange periode (een jaar of langer). Vertel het uw arts als u een botbreuk heeft, vooral in de heup, pols of wervelkolom.
- Bepaalde soorten lupus erythematosus. Lupus erythematosus is een auto-immuunziekte (de afweercellen van het lichaam vallen andere cellen of organen in het lichaam aan). Sommige mensen die PPI-geneesmiddelen gebruiken, waaronder PROTONIX 40 mg, kunnen bepaalde vormen van lupus erythematosus ontwikkelen of de lupus die ze al hebben verergeren. Bel onmiddellijk uw arts als u nieuwe of verergerende gewrichtspijn of uitslag op uw wangen of armen heeft die erger wordt in de zon.
Praat met uw arts over uw risico op deze ernstige bijwerkingen.
PROTONIX kan andere ernstige bijwerkingen hebben. Zien "Wat zijn de mogelijke bijwerkingen van PROTONIX?"
Wat is PROTONIX 20 mg?
Een receptgeneesmiddel dat een protonpompremmer (PPI) wordt genoemd en dat wordt gebruikt om de hoeveelheid zuur in uw maag te verminderen.
Bij volwassenen, PROTONIX wordt gebruikt voor:
- tot 8 weken voor de genezing en symptoomverlichting van zuurgerelateerde schade aan het slijmvlies van de slokdarm (erosieve oesofagitis of EE genoemd). Uw arts kan nog eens 8 weken PROTONIX 20 mg voorschrijven aan patiënten van wie de EE niet geneest.
- genezing van EE te behouden en de terugkeer van symptomen van brandend maagzuur veroorzaakt door GERD te helpen voorkomen. Het is niet bekend of PROTONIX 40 mg veilig en effectief is als het langer dan 12 maanden voor dit doel wordt gebruikt.
- de langdurige behandeling van aandoeningen waarbij uw maag te veel zuur aanmaakt. Dit omvat een zeldzame aandoening die het Zollinger-Ellison-syndroom wordt genoemd.
Bij kinderen van 5 jaar en ouder, PROTONIX wordt gebruikt voor:
- tot 8 weken voor de genezing en symptoomverlichting van EE. Het is niet bekend of PROTONIX 20 mg veilig is bij gebruik langer dan 8 weken bij kinderen.
PROTONIX 20 mg is niet bestemd voor gebruik bij kinderen jonger dan 5 jaar. Het is niet bekend of PROTONIX 40 mg veilig en effectief is bij kinderen voor een andere behandeling dan EE.
Gebruik PROTONIX 20 mg niet als u:
- allergisch zijn voor pantoprazol-natrium, voor enig ander PPI-geneesmiddel of voor één van de bestanddelen van PROTONIX. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten.
- het nemen van een geneesmiddel dat rilpivirine bevat (EDURANT, COMPLERA, ODEFSEY, JULUCA) dat wordt gebruikt voor de behandeling van hiv-1 (humaan immunodeficiëntievirus).
Vertel uw arts voordat u PROTONIX inneemt over al uw medische aandoeningen, ook als u:
- een laag magnesiumgehalte in uw bloed heeft.
- zwanger bent of van plan bent zwanger te worden. PROTONIX 40 mg kan uw ongeboren baby schaden. Vertel het uw arts als u zwanger wordt of denkt zwanger te zijn tijdens de behandeling met PROTONIX.
- borstvoeding geeft of van plan bent borstvoeding te geven. PROTONIX kan in uw moedermelk terechtkomen. Praat met uw arts over de beste manier om uw baby te voeden als u PROTONIX gebruikt.
Vertel uw arts over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Vertel het vooral aan uw arts als u methotrexaat (Otrexup, Rasuvo, Trexall, XATMEP), digoxine (LANOXIN) of een waterpil (diureticum).
Hoe moet ik PROTONIX 20 mg innemen?
- Neem PROTONIX 40 mg precies zoals voorgeschreven door uw arts.
PROTONIX tabletten met vertraagde afgifte (PROTONIX 20 mg tabletten):
-
- PROTONIX 40 mg tabletten niet splitsen, kauwen of fijnmaken.
- Slik PROTONIX 20 mg tabletten heel door, met of zonder voedsel.
- Vertel het uw arts als u uw tablet PROTONIX 20 mg niet kunt doorslikken.
- U mag maagzuurremmers gebruiken terwijl u PROTONIX 40 mg tabletten gebruikt.
PROTONIX 40 mg voor orale suspensie met vertraagde afgifte (PROTONIX voor orale suspensie):
-
- PROTONIX 20 mg voor orale suspensie niet splitsen, kauwen of fijnmaken.
- Neem PROTONIX 40 mg voor orale suspensie ongeveer 30 minuten voor een maaltijd in.
- PROTONIX voor orale suspensie mag alleen via de mond worden toegediend, gemengd in appelsap of appelmoes, of via een neussonde (NG) of gastrostomiesonde gemengd in appelsap. Meng PROTONIX voor orale suspensie niet in andere vloeistoffen dan appelsap of andere voedingsmiddelen dan appelmoes.
- Verdeel een pakket PROTONIX 20 mg voor orale suspensie niet om een kleinere dosis te maken.
- Zie de "Gebruiksaanwijzing" aan het einde van deze medicatiehandleiding voor instructies over het mengen en innemen van PROTONIX 40 mg voor orale suspensie via de mond in appelmoes of appelsap of hoe de suspensie te mengen en toe te dienen via een NG-buis of gastrostomiebuis gemengd in appelsap.
- Als u een dosis PROTONIX bent vergeten, neem deze dan zo snel mogelijk in. Als het bijna tijd is voor uw volgende dosis, neem dan de gemiste dosis niet in. Neem de volgende dosis op uw normale tijd. Neem geen 2 doses tegelijk.
- Als u te veel PROTONIX heeft ingenomen, bel dan onmiddellijk uw arts of uw antigifcentrum op 1-800-222-1222 of ga naar de dichtstbijzijnde eerste hulpafdeling.
Wat zijn de mogelijke bijwerkingen van PROTONIX 40 mg?
PROTONIX 20 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien “Wat is de belangrijkste informatie die ik over PROTONIX moet weten?”
- Lage vitamine B12-spiegels in uw lichaam kan optreden bij mensen die PROTONIX 40 mg gedurende lange tijd (meer dan 3 jaar) hebben gebruikt. Vertel het uw arts als u symptomen heeft van lage vitamine B12-spiegels, waaronder kortademigheid, duizeligheid, onregelmatige hartslag, spierzwakte, bleke huid, vermoeidheid, stemmingswisselingen en tintelingen of gevoelloosheid in de armen en benen.
- Laag magnesiumgehalte in uw lichaam kan optreden bij mensen die PROTONIX gedurende ten minste 3 maanden hebben gebruikt. Vertel het uw arts als u symptomen heeft van een laag magnesiumgehalte, waaronder toevallen, duizeligheid, onregelmatige hartslag, zenuwachtigheid, spierpijn of spierzwakte, en spasmen van handen, voeten of stem.
- Maaggroei (fundic gland poliepen). Mensen die gedurende lange tijd PPI-geneesmiddelen gebruiken, hebben een verhoogd risico op het ontwikkelen van een bepaald type maaggroei, de zogenaamde fundusklierpoliepen, vooral na het gebruik van PPI-geneesmiddelen gedurende meer dan 1 jaar.
De meest voorkomende bijwerkingen van PROTONIX 40 mg bij volwassenen zijn: hoofdpijn, diarree, misselijkheid, maag- (buik) pijn, braken, gas, duizeligheid en gewrichtspijn.
De meest voorkomende bijwerkingen van PROTONIX 40 mg bij kinderen zijn: infectie van de bovenste luchtwegen, hoofdpijn, koorts, diarree, braken, huiduitslag en buikpijn (buikpijn). Dit zijn niet alle mogelijke bijwerkingen van PROTONIX. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik PROTONIX 40 mg bewaren?
Bewaar PROTONIX 20 mg bij kamertemperatuur tussen 68 ° F tot 77 ° F (20 ° C tot 25 ° C).
Houd PROTONIX en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van PROTONIX.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik PROTONIX niet voor een aandoening waarvoor het niet is voorgeschreven. Geef PROTONIX 20 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw arts of apotheker om informatie vragen over PROTONIX 20 mg dat is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in PROTONIX?
Actief ingrediënt: pantoprazol-natriumsesquihydraat
Inactieve ingrediënten in PROTONIX tabletten met vertraagde afgifte: calciumstearaat, crospovidon, hypromellose, ijzeroxide, mannitol, methacrylzuurcopolymeer, polysorbaat 80, povidon, propyleenglycol, natriumcarbonaat, natriumlaurylsulfaat, titaniumdioxide en triethylcitraat.
Inactieve ingrediënten in PROTONIX 40 mg voor orale suspensie met vertraagde afgifte: crospovidon, hypromellose, methacrylzuurcopolymeer, microkristallijne cellulose, polysorbaat 80, povidon, natriumcarbonaat, natriumlaurylsulfaat, talk, titaniumdioxide, triethylcitraat en geel ijzeroxide.
Gebruiksaanwijzing
PROTONIX (pro-TAH-nix) (pantoprazol-natrium) voor orale suspensie met vertraagde afgifte
PROTONIX 40 mg voor vertraagde afgifte orale suspensie (PROTONIX 40 mg voor orale suspensie):
Belangrijke gegevens:
- PROTONIX voor orale suspensie niet splitsen, kauwen of fijnmaken.
- Neem PROTONIX voor orale suspensie ongeveer 30 minuten voor een maaltijd in.
- PROTONIX voor orale suspensie:
- zou moeten alleen worden ingenomen met appelmoes of appelsap.
- zou moeten niet worden gemengd in water of andere vloeistoffen of andere voedingsmiddelen.
- pakket mag niet worden verdeeld om een kleinere dosis te maken.
Inname van PROTONIX 20 mg voor orale suspensie met appelmoes:
Inname van PROTONIX 40 mg voor orale suspensie met appelsap:
PROTONIX 40 mg voor orale suspensie toedienen via een nasogastrische (NG) sonde of gastrostomiesonde:
- PROTONIX voor orale suspensie kan worden toegediend via een NG-sonde of gastrostomiesonde die: maat 16 Frans of groter. Geef PROTONIX 20 mg voor orale suspensie niet via een NG-sonde of gastrostomiesonde die kleiner is dan maat 16 French.
- Mengen PROTONIX 20 mg voor orale suspensie alleen in appelsap bij toediening via een NG-sonde of gastrostomiesonde.
Hoe moet ik PROTONIX 20 mg bewaren?
Bewaar PROTONIX 20 mg bij kamertemperatuur tussen 68 ° F tot 77 ° F (20 ° C tot 25 ° C).
Houd PROTONIX 40 mg en alle geneesmiddelen buiten het bereik van kinderen.
Deze medicatiehandleiding en gebruiksaanwijzing zijn goedgekeurd door de Amerikaanse Food and Drug Administration.
