Pepcid 20mg, 40mg Famotidine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Pepcid en hoe wordt het gebruikt?
Pepcid (famotidine) wordt gebruikt voor de behandeling van brandend maagzuur, GERD en het Zollinger-Ellison-syndroom. Het is vrij verkrijgbaar. Pepcid 20 mg is beschikbaar als generiek.
Wat zijn mogelijke bijwerkingen van het gebruik van Pepcid?
Bijwerkingen komen soms voor, maar kunnen zijn:
- vermoeidheid,
- braken,
- misselijkheid,
- buikpijn,
- anorexia,
- droge mond,
- uitslag, en
- spierkrampen
OMSCHRIJVING
Het actieve ingrediënt in PEPCID® (famotidine) is een histamine H2-receptorantagonist. Famotidine is N'(aminosulfonyl)-3-[[[2-[(diaminomethyleen)amino]-4-thiazolyl]methyl]thio]propanimidamide. De empirische formule van famotidine is C8H15N7O2S3 en het molecuulgewicht is 337.43. De structuurformule is:
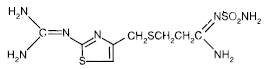
Famotidine is een witte tot lichtgele kristallijne verbinding die vrij oplosbaar is in ijsazijn, slecht oplosbaar in methanol, zeer slecht oplosbaar in water en praktisch onoplosbaar in ethanol.
Elke tablet voor orale toediening bevat 20 mg of 40 mg famotidine en de volgende inactieve ingrediënten: hydroxypropylcellulose, hypromellose, ijzeroxiden, magnesiumstearaat, microkristallijne cellulose, maïszetmeel, talk, titaniumdioxide en carnaubawas.
INDICATIES
PEPCID 40 mg is aangegeven in:
DOSERING EN ADMINISTRATIE
Duodenumulcus
Acute therapie: De aanbevolen orale dosering voor volwassenen voor actieve zweren aan de twaalfvingerige darm is 40 mg eenmaal daags voor het slapengaan. De meeste patiënten genezen binnen 4 weken; er is zelden reden om PEPCID langer dan 6 tot 8 weken in de volledige dosering te gebruiken. Een regime van 20 mg bid is ook effectief.
Onderhoudstherapie: De aanbevolen orale dosis voor volwassenen is 20 mg eenmaal daags voor het slapengaan.
Goedaardige maagzweer
Acute therapie: De aanbevolen orale dosering voor volwassenen voor actieve goedaardige maagzweren is 40 mg eenmaal daags voor het slapengaan.
Gastro-oesofageale refluxziekte (GERD)
De aanbevolen orale dosering voor de behandeling van volwassen patiënten met symptomen van GORZ is 20 mg tweemaal daags gedurende maximaal 6 weken. De aanbevolen orale dosering voor de behandeling van volwassen patiënten met oesofagitis inclusief erosies en ulceraties en bijbehorende symptomen als gevolg van GERD is 20 of 40 mg tweemaal daags gedurende maximaal 12 weken (zie KLINISCHE FARMACOLOGIE bij volwassenen , Klinische studies ).
Dosering voor pediatrische patiënten
Zien PREVENTIEVE MAATREGELEN , Pediatrische patiënten
De studies beschreven in VOORZORGSMAATREGELEN, pediatrische patiënten
Dosering voor pediatrische patiënten van 1-16 jaar oud
Zien PREVENTIEVE MAATREGELEN , Pediatrische patiënten van 1-16 jaar.
De onderzoeken beschreven in VOORZORGSMAATREGELEN, pediatrische patiënten van 1-16 jaar suggereren de volgende startdoses bij pediatrische patiënten van 1-16 jaar:
Maagzweer - 0,5 mg/kg/dag po voor het slapengaan of gedeeld bod tot 40 mg/dag.
Gastro-oesofageale refluxziekte met of zonder oesofagitis inclusief erosies en ulceraties - 1,0 mg/kg/dag po gedeeld bod tot 40 mg bid
Hoewel gepubliceerde, ongecontroleerde onderzoeken de werkzaamheid van famotidine bij de behandeling van gastro-oesofageale refluxziekte en maagzweren suggereren, zijn de gegevens bij pediatrische patiënten onvoldoende om het percentage respons met dosis en duur van de therapie vast te stellen. Daarom moeten de duur van de behandeling (aanvankelijk gebaseerd op de aanbevelingen voor de duur van volwassenen) en de dosis individueel worden bepaald op basis van de klinische respons en/of bepaling van de pH (maag of slokdarm) en endoscopie. In gepubliceerde ongecontroleerde klinische onderzoeken bij pediatrische patiënten van 1-16 jaar werden doses tot 1 mg/kg/dag gebruikt voor maagzweren en 2 mg/kg/dag voor GORZ met of zonder oesofagitis, inclusief erosies en ulceraties.
Pathologische hypersecretoire aandoeningen (bijv. Zollinger-Ellison-syndroom, meerdere endocriene adenomen)
De dosering van PEPCID bij patiënten met pathologische hypersecretoire aandoeningen varieert met de individuele patiënt. De aanbevolen orale startdosis voor volwassenen voor pathologische hypersecretoire aandoeningen is 20 mg elke 6 uur. Bij sommige patiënten kan een hogere startdosering nodig zijn. Doses moeten worden aangepast aan de individuele behoeften van de patiënt en moeten worden voortgezet zolang als klinisch geïndiceerd. Doses tot 160 mg om de 6 uur zijn toegediend aan sommige volwassen patiënten met ernstig Zollinger-Ellison-syndroom.
Gelijktijdig gebruik van antacida
Antacida kunnen indien nodig gelijktijdig worden gegeven.
Dosisaanpassing voor patiënten met matige of ernstige nierinsufficiëntie
Bij volwassen patiënten met matige (creatinineklaring
Op basis van de vergelijking van farmacokinetische parameters voor PEPCID bij volwassenen en pediatrische patiënten, moet een dosisaanpassing bij pediatrische patiënten met matige of ernstige nierinsufficiëntie worden overwogen.
HOE GELEVERD
PEPCID 40 mg tabletten 20 mg, zijn beige gekleurde, ronde, vierkante, filmomhulde tabletten met de code MSD aan de ene kant en glad aan de andere kant. Ze worden als volgt geleverd:
NDC 42998-639-09 gebruikseenheid flessen van 30 NDC 42998-639-98 gebruikseenheid flessen van 100.
PEPCID 40 mg tabletten, 40 mg, zijn geelbruine, ronde, vierkante, filmomhulde tabletten met de code MSD aan de ene kant en glad aan de andere kant. Ze worden als volgt geleverd:
NDC 42998-649-09 gebruikseenheid flessen van 30 NDC 42998-649-98 gebruikseenheid flessen van 100. Opslag
Bewaren bij gecontroleerde kamertemperatuur.
PEPCID® (famotidine) tabletten 20 mg en tabletten 40 mg worden vervaardigd voor: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, VS. Uitgegeven februari 2014.
BIJWERKINGEN
De hieronder vermelde bijwerkingen zijn gemeld tijdens nationale en internationale klinische onderzoeken bij ongeveer 2500 patiënten. In die gecontroleerde klinische onderzoeken waarin PEPCID 40 mg-tabletten werden vergeleken met placebo, was de incidentie van bijwerkingen in de groep die PEPCID-tabletten, 40 mg voor het slapengaan, ontving, vergelijkbaar met die in de placebogroep.
De volgende bijwerkingen zijn gemeld bij meer dan 1% van de patiënten die met PEPCID worden behandeld in gecontroleerde klinische onderzoeken en kunnen causaal verband houden met het geneesmiddel: hoofdpijn (4,7%), duizeligheid (1,3%), constipatie (1,2%) ) en diarree (1,7%).
De volgende andere bijwerkingen zijn niet vaak gemeld in klinische onderzoeken of sinds het geneesmiddel op de markt is gekomen. De relatie met therapie met PEPCID 20 mg was in veel gevallen onduidelijk. Binnen elke categorie zijn de bijwerkingen gerangschikt naar afnemende ernst:
Lichaam als geheel: koorts, asthenie, vermoeidheid
Cardiovasculair: aritmie, AV-blok, hartkloppingen. Verlengd QT-interval bij patiënten met een verminderde nierfunctie is zeer zelden gemeld.
Gastro-intestinaal: cholestatische geelzucht, hepatitis, leverenzymafwijkingen, braken, misselijkheid, buikpijn, anorexia, droge mond
Hematologische: zeldzame gevallen van agranulocytose, pancytopenie, leukopenie, trombocytopenie
Overgevoeligheid: anafylaxie, angio-oedeem, orbitaal of gezichtsoedeem, urticaria, huiduitslag, conjunctivale injectie
Musculoskeletaal: rabdomyolyse, musculoskeletale pijn inclusief spierkrampen, artralgie
Zenuwstelsel/psychiatrisch: grand mal aanval; psychische stoornissen, die reversibel waren in gevallen waarvoor follow-up werd verkregen, waaronder hallucinaties, verwardheid, agitatie, depressie, angst, verminderd libido; paresthesie; slapeloosheid; slaperigheid. Convulsies zijn zeer zelden gemeld bij patiënten met een verminderde nierfunctie.
Ademhaling: bronchospasme, interstitiële pneumonie
Huid: toxische epidermale necrolyse/Stevens-Johnson-syndroom (zeer zelden), alopecia, acne, pruritus, droge huid, blozen
Speciale zintuigen: tinnitus, smaakstoornis
Ander: zeldzame gevallen van impotentie en zeldzame gevallen van gynaecomastie zijn gemeld; in gecontroleerde klinische onderzoeken waren de incidenties echter niet groter dan die bij placebo.
De gemelde bijwerkingen voor PEPCID-tabletten kunnen ook optreden bij PEPCID 20 mg voor orale suspensie.
Pediatrische patiënten
In een klinische studie bij 35 pediatrische patiënten
DRUG-INTERACTIES
Er zijn geen geneesmiddelinteracties vastgesteld. Studies met famotidine bij de mens, in diermodellen en in vitro hebben geen significante interferentie aangetoond met de dispositie van verbindingen die worden gemetaboliseerd door de levermicrosomale enzymen, bijv. het cytochroom P450-systeem. Bij de mens geteste verbindingen omvatten warfarine, theofylline, fenytoïne, diazepam, aminopyrine en antipyrine. Indocyaninegroen als index voor extractie van hepatische geneesmiddelen is getest en er zijn geen significante effecten gevonden.
WAARSCHUWINGEN
Geen informatie verstrekt
PREVENTIEVE MAATREGELEN
Algemeen
Symptomatische respons op therapie met PEPCID sluit de aanwezigheid van maagmaligniteit niet uit.
Patiënten met matige of ernstige nierinsufficiëntie
Aangezien bijwerkingen op het centrale zenuwstelsel zijn gemeld bij patiënten met matige en ernstige nierinsufficiëntie, moeten mogelijk langere intervallen tussen doses of lagere doses worden gebruikt bij patiënten met een matige (creatinineklaring KLINISCHE FARMACOLOGIE bij volwassenen en DOSERING EN ADMINISTRATIE ). Verlengd QT-interval is zeer zelden gemeld bij patiënten met een verminderde nierfunctie bij wie de dosis/doseringsinterval van famotidine mogelijk niet goed is aangepast.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 106 weken durend onderzoek bij ratten en een 92 weken durend onderzoek bij muizen die orale doses tot 2000 mg/kg/dag kregen (ongeveer 2500 maal de aanbevolen dosis bij de mens voor actieve zweren in de twaalfvingerige darm), was er geen bewijs van carcinogeen potentieel voor PEPCID.
Famotidine was negatief in de microbiële mutageentest (Ames-test) met Salmonella typhimurium en Escherichia coli met of zonder activering van rattenleverenzymen bij concentraties tot 10.000 mcg/plaat. In in vivo studies bij muizen, met een micronucleustest en een chromosomale aberratietest, werd geen bewijs van een mutageen effect waargenomen.
In onderzoeken met ratten die orale doses tot 2000 mg/kg/dag of intraveneuze doses tot 200 mg/kg/dag kregen, werden de vruchtbaarheid en reproductieve prestaties niet beïnvloed.

Zwangerschap
Zwangerschap Categorie B
Er zijn reproductiestudies uitgevoerd bij ratten en konijnen bij orale doses tot respectievelijk 2000 en 500 mg/kg/dag, en bij beide soorten bij IV doses tot 200 mg/kg/dag, en er zijn geen significante aanwijzingen gevonden voor verminderde vruchtbaarheid of schade aan de foetus als gevolg van PEPCID. Hoewel er geen directe foetotoxische effecten zijn waargenomen, werden bij sommige konijnen sporadische abortussen waargenomen die alleen optraden bij moeders met een duidelijk verminderde voedselinname bij orale doses van 200 mg/kg/dag (250 maal de gebruikelijke dosis voor de mens) of hoger. Er zijn echter geen adequate of goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Moeders die borstvoeding geven
Studies uitgevoerd bij zogende ratten hebben aangetoond dat famotidine wordt uitgescheiden in de moedermelk. Voorbijgaande groeidepressie werd waargenomen bij jonge ratten die zogen van moeders die werden behandeld met maternotoxische doses van ten minste 600 maal de gebruikelijke dosis voor de mens. Famotidine is aantoonbaar in moedermelk. Vanwege het potentieel voor ernstige bijwerkingen van PEPCID bij zuigelingen die borstvoeding geven, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrische patiënten
Het gebruik van PEPCID 20 mg bij pediatrische patiënten
Twee farmacokinetische onderzoeken bij pediatrische patiënten 3 maanden tot 1 jaar vergelijkbaar is met die bij oudere pediatrische patiënten (1-15 jaar) en volwassenen . Daarentegen hadden pediatrische patiënten van 0-3 maanden famotidineklaringswaarden die 2 tot 4 keer lager waren dan die bij oudere pediatrische patiënten en volwassenen. Deze onderzoeken tonen ook aan dat de gemiddelde biologische beschikbaarheid bij pediatrische patiënten KLINISCHE FARMACOLOGIE bij pediatrische patiënten , Farmacokinetiek en farmacodynamiek .)
In een dubbelblinde, gerandomiseerde studie waarbij de behandeling werd stopgezet, werden 35 pediatrische patiënten ONGEWENSTE REACTIES , Pediatrische patiënten ).
Deze onderzoeken suggereren dat een startdosering van 0,5 mg/kg/dosis famotidine orale suspensie gunstig kan zijn voor de behandeling van GORZ gedurende maximaal 4 weken eenmaal daags bij patiënten
Pediatrische patiënten van 1-16 jaar oud
Het gebruik van PEPCID 40 mg bij pediatrische patiënten van 1-16 jaar wordt ondersteund door gegevens uit adequate en goed gecontroleerde onderzoeken naar PEPCID bij volwassenen en door de volgende onderzoeken bij pediatrische patiënten: In gepubliceerde onderzoeken bij kleine aantallen pediatrische patiënten 1-15 leeftijd, was de klaring van famotidine vergelijkbaar met die bij volwassenen. Bij pediatrische patiënten van 11-15 jaar werden orale doses van 0,5 mg/kg geassocieerd met een gemiddelde oppervlakte onder de curve (AUC) die vergelijkbaar was met die gezien bij volwassenen die oraal werden behandeld met 40 mg. Evenzo werden bij pediatrische patiënten van 1-15 jaar intraveneuze doses van 0,5 mg/kg geassocieerd met een gemiddelde AUC die vergelijkbaar was met die bij volwassenen die intraveneus werden behandeld met 40 mg. Beperkte gepubliceerde onderzoeken suggereren ook dat de relatie tussen serumconcentratie en zuursuppressie bij pediatrische patiënten van 1-15 jaar vergelijkbaar is met die bij volwassenen. Deze onderzoeken suggereren een startdosering voor pediatrische patiënten van 1-16 jaar als volgt:
Maagzweer - 0,5 mg/kg/dag po Voor het slapengaan of verdeeld bod Tot 40 mg/dag.
Gastro-oesofageale refluxziekte met of zonder oesofagitis inclusief erosies en ulceraties - 1,0 mg/kg/dag po gedeeld bod tot 40 mg bid
Hoewel gepubliceerde, ongecontroleerde onderzoeken de werkzaamheid van famotidine bij de behandeling van gastro-oesofageale refluxziekte en maagzweren suggereren, zijn de gegevens bij pediatrische patiënten onvoldoende om het percentage respons met dosis en duur van de therapie vast te stellen. Daarom moeten de duur van de behandeling (aanvankelijk gebaseerd op de aanbevelingen voor de duur van volwassenen) en de dosis individueel worden bepaald op basis van de klinische respons en/of bepaling van de pH (maag of slokdarm) en endoscopie. Gepubliceerde ongecontroleerde klinische onderzoeken bij pediatrische patiënten hebben doses tot 1 mg/kg/dag gebruikt voor maagzweren en 2 mg/kg/dag voor GERD met of zonder oesofagitis, inclusief erosies en ulceraties.
Geriatrisch gebruik
Van de 4.966 proefpersonen in klinische onderzoeken die met famotidine werden behandeld, waren 488 proefpersonen (9,8%) 65 jaar en ouder en 88 proefpersonen (1,7%) ouder dan 75 jaar. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen. Een grotere gevoeligheid van sommige ouderen kan echter niet worden uitgesloten.
Er is geen dosisaanpassing nodig op basis van leeftijd (zie: KLINISCHE FARMACOLOGIE bij volwassenen , Farmacokinetiek ). Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren. Dosisaanpassing in geval van matige of ernstige nierfunctiestoornis is noodzakelijk (zie: PREVENTIEVE MAATREGELEN , Patiënten met matige of ernstige nierinsufficiëntie en DOSERING EN ADMINISTRATIE , Dosisaanpassing voor patiënten met matige of ernstige nierinsufficiëntie ).
OVERDOSERING
De bijwerkingen in gevallen van overdosering zijn vergelijkbaar met de bijwerkingen die optreden bij normale klinische ervaring (zie: ONGEWENSTE REACTIES ). Orale doses tot 640 mg/dag zijn toegediend aan volwassen patiënten met pathologische hypersecretoire aandoeningen zonder ernstige bijwerkingen. In geval van overdosering dient de behandeling symptomatisch en ondersteunend te zijn. Niet-geabsorbeerd materiaal moet uit het maagdarmkanaal worden verwijderd, de patiënt moet worden gecontroleerd en ondersteunende therapie moet worden toegepast.
De orale LD50 van famotidine bij mannelijke en vrouwelijke ratten en muizen was hoger dan 3000 mg/kg en de minimale dodelijke acute orale dosis bij honden was hoger dan 2000 mg/kg. Famotidine veroorzaakte geen duidelijke effecten bij hoge orale doses bij muizen, ratten, katten en honden, maar veroorzaakte significante anorexia en groeidepressie bij konijnen, beginnend met oraal 200 mg/kg/dag. De intraveneuze LD50 van famotidine voor muizen en ratten varieerde van 254-563 mg/kg en de minimale dodelijke enkelvoudige IV-dosis bij honden was ongeveer 300 mg/kg. Tekenen van acute intoxicatie bij IV behandelde honden waren braken, rusteloosheid, bleekheid van de slijmvliezen of roodheid van mond en oren, hypotensie, tachycardie en collaps.
CONTRA-INDICATIES
Overgevoeligheid voor een van de bestanddelen van deze producten. Kruisgevoeligheid in deze klasse van verbindingen is waargenomen. Daarom dient PEPCID 40 mg niet te worden toegediend aan patiënten met een voorgeschiedenis van overgevoeligheid voor andere H2-receptorantagonisten.
KLINISCHE FARMACOLOGIE
Klinische farmacologie bij volwassenen
GI-effecten
PEPCID is een competitieve remmer van histamine H2-receptoren. De primaire klinisch belangrijke farmacologische activiteit van PEPCID 40 mg is remming van de maagsecretie. Zowel de zuurconcentratie als het volume van de maagsecretie worden onderdrukt door PEPCID, terwijl veranderingen in de pepsinesecretie evenredig zijn met de volume-output.
Bij normale vrijwilligers en hypersecretors remde PEPCID 20 mg de basale en nachtelijke maagsecretie, evenals de secretie gestimuleerd door voedsel en pentagastrine. Na orale toediening trad het antisecretoire effect binnen een uur in; het maximale effect was dosisafhankelijk en trad op binnen één tot drie uur. Duur van remming van secretie bij doses van 20 en 40 mg was 10 tot 12 uur.
Eenmalige orale doses van 20 en 40 mg remden de basale en nachtelijke zuursecretie bij alle proefpersonen; de gemiddelde nachtelijke maagzuursecretie werd geremd met respectievelijk 86% en 94% gedurende een periode van ten minste 10 uur. Dezelfde doses die 's ochtends werden gegeven, onderdrukten bij alle proefpersonen de door voedsel gestimuleerde zuursecretie. De gemiddelde onderdrukking was respectievelijk 76% en 84%, 3 tot 5 uur na toediening en respectievelijk 25% en 30%, 8 tot 10 uur na toediening. Bij sommige proefpersonen die de dosis van 20 mg kregen, was het antisecretoire effect echter binnen 6-8 uur verdwenen. Er was geen cumulatief effect bij herhaalde doses. De nachtelijke intragastrische pH werd verhoogd door avonddoses van 20 en 40 mg PEPCID tot gemiddelde waarden van respectievelijk 5,0 en 6,4. Wanneer PEPCID 40 mg na het ontbijt werd gegeven, werd de basale interdigestieve pH overdag op 3 en 8 uur na 20 of 40 mg PEPCID 40 mg verhoogd tot ongeveer 5.
PEPCID 40 mg had weinig of geen effect op nuchtere of postprandiale serumgastrinespiegels. De maaglediging en de exocriene pancreasfunctie werden niet beïnvloed door PEPCID.
Andere effecten
Systemische effecten van PEPCID op het CZS, cardiovasculaire, respiratoire of endocriene systemen werden niet opgemerkt in klinische farmacologische onderzoeken. Er werden ook geen anti-androgene effecten opgemerkt. (Zien ONGEWENSTE REACTIES .) Serumhormoonspiegels, waaronder prolactine, cortisol, thyroxine (T4) en testosteron, waren niet veranderd na behandeling met PEPCID.
Farmacokinetiek
PEPCID 20 mg wordt onvolledig geabsorbeerd. De biologische beschikbaarheid van orale doses is 40-45%. De biologische beschikbaarheid kan enigszins worden verhoogd door voedsel of enigszins worden verlaagd door antacida; deze effecten hebben echter geen klinische gevolgen. PEPCID ondergaat een minimaal first-pass-metabolisme. Na orale doses treden piekplasmaspiegels op in 1-3 uur. Plasmaspiegels na meerdere doses zijn vergelijkbaar met die na enkele doses. Vijftien tot 20% van PEPCID 20 mg in plasma is eiwitgebonden. PEPCID heeft een eliminatiehalfwaardetijd van 2,5-3,5 uur. PEPCID wordt geëlimineerd via de nieren (65-70%) en metabole (30-35%) routes. De renale klaring is 250-450 ml/min, wat wijst op enige tubulaire excretie. Vijfentwintig tot 30% van een orale dosis en 65-70% van een intraveneuze dosis worden als onveranderde verbinding in de urine teruggevonden. De enige metaboliet die bij de mens is geïdentificeerd, is het S-oxide.
Er is een nauw verband tussen de creatinineklaringswaarden en de eliminatiehalfwaardetijd van PEPCID. Bij patiënten met ernstige nierinsufficiëntie, dwz met een creatinineklaring van minder dan 10 ml/min, kan de eliminatiehalfwaardetijd van PEPCID meer dan 20 uur bedragen en kan aanpassing van de dosis of doseringsintervallen bij matige en ernstige nierinsufficiëntie noodzakelijk zijn (zie PREVENTIEVE MAATREGELEN , DOSERING EN ADMINISTRATIE ).
Bij oudere patiënten zijn er geen klinisch significante leeftijdsgerelateerde veranderingen in de farmacokinetiek van PEPCID. Bij oudere patiënten met een verminderde nierfunctie kan de klaring van het geneesmiddel echter verminderd zijn (zie: PREVENTIEVE MAATREGELEN , Geriatrisch gebruik ).
Klinische studies
Duodenumulcus
In een multicenter, dubbelblind onderzoek in de VS bij poliklinische patiënten met endoscopisch bevestigde ulcus duodeni, werd oraal toegediend PEPCID vergeleken met placebo. Zoals weergegeven in tabel 1, was 70% van de patiënten die werden behandeld met PEPCID 40 mg hs in week 4 genezen.
Patiënten die in week 4 nog niet waren genezen, werden in het onderzoek voortgezet. In week 8 was 83% van de met PEPCID behandelde patiënten genezen versus 45% van de met placebo behandelde patiënten. De incidentie van genezing van zweren met PEPCID was op elk tijdstip significant hoger dan met placebo op basis van het aandeel endoscopisch bevestigde genezen zweren.
In deze studie was de tijd tot verlichting van pijn overdag en 's nachts significant korter voor patiënten die PEPCID kregen dan voor patiënten die placebo kregen; patiënten die PEPCID kregen, namen ook minder antacidum in dan de patiënten die placebo kregen.
Langdurige onderhoudsbehandeling van duodenumzweren
PEPCID 40 mg, 20 mg pohs, werd vergeleken met placebo hs als onderhoudstherapie in twee dubbelblinde, multicentrische onderzoeken bij patiënten met endoscopisch bevestigde genezen zweren in de twaalfvingerige darm. In de Amerikaanse studie was de waargenomen incidentie van ulcera binnen 12 maanden bij patiënten die werden behandeld met placebo 2,4 keer groter dan bij de patiënten die met PEPCID werden behandeld. De 89 patiënten die met PEPCID werden behandeld, hadden een cumulatieve waargenomen incidentie van zweren van 23,4% vergeleken met een waargenomen incidentie van zweren van 56,6% bij de 89 patiënten die placebo kregen (p
Maagzweer
In zowel een Amerikaans als een internationaal multicenter, dubbelblind onderzoek bij patiënten met endoscopisch bevestigde actieve goedaardige maagzweren, oraal toegediend PEPCID 20 mg, 40 mg hs, werd vergeleken met placebo hs Antacida waren toegestaan tijdens de onderzoeken, maar de consumptie was niet significant verschillend tussen de PEPCID- en de placebogroep. Zoals weergegeven in Tabel 2, was de incidentie van genezing van zweren (uitvallers geteld als niet-genezen) met PEPCID 20 mg statistisch significant beter dan placebo in week 6 en 8 in de Amerikaanse studie, en in week 4, 6 en 8 in de internationale studie, gebaseerd op op het aantal genezen zweren, bevestigd door endoscopie.
De tijd tot volledige verlichting van pijn overdag en 's nachts was statistisch significant korter voor patiënten die 20 mg PEPCID kregen dan voor patiënten die placebo kregen; in geen van beide onderzoeken was er echter een statistisch significant verschil in het percentage patiënten bij wie de pijn aan het einde van het onderzoek (week 8) was verdwenen.
Gastro-oesofageale refluxziekte (GERD)
Oraal toegediend PEPCID werd vergeleken met placebo in een Amerikaans onderzoek waarin patiënten werden opgenomen met symptomen van GERD en zonder endoscopisch bewijs van erosie of ulceratie van de slokdarm. PEPCID 20 mg tweemaal daags was statistisch significant superieur aan 40 mg hs en placebo wat betreft het leveren van een succesvol symptomatisch resultaat, gedefinieerd als matige of uitstekende verbetering van symptomen (tabel 3).
Na twee weken behandeling werd symptomatisch succes waargenomen bij een groter percentage patiënten die PEPCID 20 mg tweemaal daags gebruikten in vergelijking met placebo (p ≤ 0,01).
Symptomatische verbetering en genezing van endoscopisch geverifieerde erosie en ulceratie werden bestudeerd in twee aanvullende onderzoeken. Genezing werd gedefinieerd als het volledig verdwijnen van alle erosies of ulceraties die zichtbaar zijn met endoscopie. De Amerikaanse studie waarin PEPCID 40 mg pobid werd vergeleken met placebo en PEPCID 20 mg pobid toonde een significant groter genezingspercentage voor PEPCID 40 mg bid in week 6 en 12 (tabel 4).
In vergelijking met placebo hadden patiënten die PEPCID kregen een snellere verlichting van brandend maagzuur overdag en 's nachts en een groter percentage van de patiënten ervoer volledige verlichting van brandend maagzuur 's nachts. Deze verschillen waren statistisch significant.
In de internationale studie, toen PEPCID 40 mg pobid werd vergeleken met ranitidine 150 mg pobid, werd een statistisch significant hoger percentage van genezing waargenomen met PEPCID 40 mg bid in week 12 (Tabel 5). Er was echter geen significant verschil tussen behandelingen in symptoomverlichting.
Pathologische hypersecretoire aandoeningen (bijv. Zollinger-Ellison-syndroom, meerdere endocriene adenomen)
In onderzoeken bij patiënten met pathologische hypersecretoire aandoeningen zoals het Zollinger-Ellison-syndroom met of zonder meerdere endocriene adenomen, remde PEPCID de maagzuursecretie significant en controleerde de bijbehorende symptomen. Oraal toegediende doses van 20 tot 160 mg elke 6 uur hielden de basale zuursecretie onder 10 mEq/uur; de aanvangsdoses werden getitreerd op basis van de individuele behoefte van de patiënt en bij sommige patiënten waren na verloop van tijd aanpassingen nodig. PEPCID 40 mg werd goed verdragen bij deze hoge doseringen gedurende langere perioden (langer dan 12 maanden) bij acht patiënten, en er werden geen gevallen gemeld van gynaecomastie, verhoogde prolactinespiegels of impotentie waarvan werd aangenomen dat ze het gevolg waren van het geneesmiddel.
Klinische farmacologie bij pediatrische patiënten
Farmacokinetiek
Tabel 6 geeft farmacokinetische gegevens weer van klinische onderzoeken en een gepubliceerd onderzoek bij pediatrische patiënten (
De plasmaklaring is verminderd en de eliminatiehalfwaardetijd is verlengd bij pediatrische patiënten van 0-3 maanden in vergelijking met oudere pediatrische patiënten. De farmacokinetische parameters voor pediatrische patiënten in de leeftijd > 3 maanden-15 jaar zijn vergelijkbaar met die voor volwassenen.
Onderzoeken naar biologische beschikbaarheid bij 8 pediatrische patiënten (11-15 jaar) lieten een gemiddelde orale biologische beschikbaarheid zien van 0,5 vergeleken met waarden voor volwassenen van 0,42 tot 0,49. Orale doses van 0,5 mg/kg bereikten AUC's van 645 ± 249 ng-uur/ml en 580 ± 60 ng-uur/ml bij pediatrische patiënten
farmacodynamiek
De farmacodynamiek van famotidine werd geëvalueerd bij 5 pediatrische patiënten van 2-13 jaar met behulp van het sigmoid Emax-model. Deze gegevens suggereren dat de relatie tussen de serumconcentratie van famotidine en maagzuursuppressie vergelijkbaar is met die waargenomen in één onderzoek bij volwassenen (Tabel 7).
Vijf gepubliceerde onderzoeken (Tabel 8) onderzochten het effect van famotidine op de pH van de maag en de duur van de zuursuppressie bij pediatrische patiënten. Hoewel elk onderzoek een ander ontwerp had, zijn de gegevens over zuuronderdrukking in de loop van de tijd als volgt samengevat:
De duur van het effect van famotidine IV 0,5 mg/kg op de maag-pH en zuursuppressie bleek in één onderzoek langer te zijn bij pediatrische patiënten
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de PREVENTIEVE MAATREGELEN sectie.
