Aciphex 10mg, 20mg Rabeprazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Aciphex 10 mg en hoe wordt het gebruikt?
Aciphex 10 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van gastro-oesofageale refluxziekte (GERD), Helicobacter Pylori en darmzweren. Aciphex 10 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Aciphex is een protonpompremmer.
Het is niet bekend of Aciphex 20 mg tablet met vertraagde afgifte veilig en effectief is bij kinderen jonger dan 12 jaar. Het is niet bekend of Aciphex 10 mg tablet met vertraagde afgifte (hagelslag) veilig en effectief is bij kinderen jonger dan 1 jaar.
Wat zijn de mogelijke bijwerkingen van Aciphex 10 mg?
Aciphex kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- bloederige diarree,
- plotselinge pijn of moeite met het bewegen van heup, pols of rug,
- toevallen (convulsies),
- minder plassen dan normaal,
- bloed in uw urine,
- zwelling,
- snelle gewichtstoename,
- gewrichtspijn,
- huiduitslag op uw wangen of armen verergerd door zonlicht,
- duizeligheid,
- snelle of onregelmatige hartslag,
- trillende of schokkende spierbewegingen (tremoren),
- zenuwachtig voelen,
- spierkrampen of spasmen in uw handen of voeten,
- hoesten,
- moeite met slikken of stikken,
- hoofdpijn,
- zwakheid,
- blauwe plekken,
- ongewone bloedingen (neusbloedingen, tandvlees),
- rode of roze urine,
- zware menstruatie,
- bloederige of teerachtige ontlasting,
- bloed ophoesten of braaksel dat op koffiedik lijkt,
- bloeding die moeilijk onder controle te houden is,
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Aciphex zijn:
- hoofdpijn,
- misselijkheid,
- braken,
- diarree,
- constipatie,
- buikpijn,
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Aciphex. Vraag uw arts of apotheker om meer informatie.
OMSCHRIJVING
Het werkzame bestanddeel van ACIPHEX 20 mg tabletten met vertraagde afgifte is rabeprazolnatrium, een protonpompremmer. Het is een gesubstitueerd benzimidazol dat chemisch bekend staat als 2-[[[4-(3methoxypropoxy)-3-methyl-2-pyridinyl]-methyl]sulfinyl]-1H-benzimidazool-natriumzout. Het heeft een empirische formule van C18H20N3NaO3S en een molecuulgewicht van 381,42. Rabeprazolnatrium is een witte tot licht geelachtig witte vaste stof. Het is zeer oplosbaar in water en methanol, goed oplosbaar in ethanol, chloroform en ethylacetaat en onoplosbaar in ether en n-hexaan. De stabiliteit van rabeprazol-natrium is een functie van de pH; het wordt snel afgebroken in zure media en is stabieler onder alkalische omstandigheden. Het structuurcijfer is:
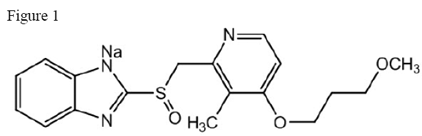
ACIPHEX is beschikbaar voor orale toediening als maagsapresistente tabletten met vertraagde afgifte die 20 mg rabeprazolnatrium bevatten.
Inactieve ingrediënten van de tablet van 20 mg zijn carnaubawas, crospovidon, gediacetyleerde monoglyceriden, ethylcellulose, hydroxypropylcellulose, hypromelloseftalaat, magnesiumstearaat, mannitol, propyleenglycol, natriumhydroxide, natriumstearylfumaraat, talk en titaniumdioxide. Geel ijzeroxide is de kleurstof voor de tabletcoating. IJzeroxide rood is het inktpigment.
INDICATIES
Genezing van erosieve of ulceratieve GERD bij volwassenen
ACIPHEX 20 mg tabletten met vertraagde afgifte zijn geïndiceerd voor kortdurende (4 tot 8 weken) behandeling voor de genezing en symptomatische verlichting van erosieve of ulceratieve gastro-oesofageale refluxziekte (GERD). Voor die patiënten die na 8 weken behandeling nog niet zijn genezen, kan een aanvullende 8-weekse kuur met ACIPHEX worden overwogen.
Onderhoud van genezing van erosieve of ulceratieve GERD bij volwassenen
ACIPHEX-tabletten met vertraagde afgifte zijn geïndiceerd voor het handhaven van de genezing en het verminderen van het terugvalpercentage van symptomen van brandend maagzuur bij patiënten met erosieve of ulceratieve gastro-oesofageale refluxziekte (GERD-onderhoud). Gecontroleerde studies duren niet langer dan 12 maanden.
Behandeling van symptomatische GERD bij volwassenen
ACIPHEX 20 mg tabletten met vertraagde afgifte zijn geïndiceerd voor de behandeling van brandend maagzuur overdag en 's nachts en andere symptomen die verband houden met GERD bij volwassenen gedurende maximaal 4 weken.
Genezing van duodenumzweren bij volwassenen
ACIPHEX 20 mg tabletten met vertraagde afgifte zijn geïndiceerd voor kortdurende (tot vier weken) behandeling voor de genezing en symptomatische verlichting van zweren in de twaalfvingerige darm. De meeste patiënten genezen binnen vier weken.
Helicobacter pylori-uitroeiing om het risico op herhaling van duodenumzweren bij volwassenen te verminderen
ACIPHEX 10 mg tabletten met vertraagde afgifte, in combinatie met amoxicilline en claritromycine als een regime van drie geneesmiddelen, zijn geïndiceerd voor de behandeling van patiënten met H. pylori-infectie en ulcus duodeni (actief of in de afgelopen 5 jaar) om H. pylori uit te roeien . Het is aangetoond dat de uitroeiing van H. pylori het risico op herhaling van een ulcus duodeni vermindert.
Bij patiënten bij wie de therapie faalt, moeten gevoeligheidstesten worden uitgevoerd. Als resistentie tegen claritromycine wordt aangetoond of gevoeligheidstests niet mogelijk zijn, moet een alternatieve antimicrobiële therapie worden ingesteld [zie KLINISCHE FARMACOLOGIE en de volledige voorschrijfinformatie voor claritromycine].
Behandeling van pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom bij volwassenen
ACIPHEX-tabletten met vertraagde afgifte zijn geïndiceerd voor de langdurige behandeling van pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom.
Behandeling van symptomatische GERD bij adolescente patiënten van 12 jaar en ouder
ACIPHEX 20 mg tabletten met vertraagde afgifte zijn geïndiceerd voor de behandeling van symptomatische GORZ bij adolescenten van 12 jaar en ouder gedurende maximaal 8 weken.
DOSERING EN ADMINISTRATIE
Tabel 1 toont de aanbevolen dosering van ACIPHEX tabletten met vertraagde afgifte bij volwassenen en adolescente patiënten van 12 jaar en ouder. Het gebruik van ACIPHEX-tabletten met vertraagde afgifte wordt niet aanbevolen voor gebruik bij pediatrische patiënten van 1 jaar tot jonger dan 12 jaar, omdat de laagst beschikbare tabletsterkte (20 mg) de aanbevolen dosis voor deze patiënten overschrijdt. Gebruik een andere formulering van rabeprazol voor pediatrische patiënten van 1 jaar tot jonger dan 12 jaar.
Beheer instructies
- Slik ACIPHEX 20 mg tabletten met vertraagde afgifte heel door. De tabletten niet kauwen, pletten of splitsen.
- Voor de behandeling van zweren in de twaalfvingerige darm, neem ACIPHEX tabletten met vertraagde afgifte na een maaltijd.
- Neem voor de uitroeiing van Helicobacter pylori ACIPHEX 20 mg tabletten met vertraagde afgifte in met voedsel.
- Voor alle andere indicaties kunnen ACIPHEX tabletten met vertraagde afgifte met of zonder voedsel worden ingenomen.
- Neem een vergeten dosis zo snel mogelijk in. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en ga terug naar het normale schema. Neem geen twee doses tegelijk.
HOE GELEVERD
Doseringsvormen en sterke punten
ACIPHEX 10 mg tabletten met vertraagde afgifte worden geleverd in één sterkte, 20 mg. De tabletten zijn ronde, lichtgele, maagsapresistente, biconvexe tabletten. "ACIPHEX 20" is in rood bedrukt aan één kant van de tablet.
Opslag en behandeling
ACIPHEX 20 mg wordt geleverd als lichtgele, maagsapresistente tabletten met vertraagde afgifte. De naam en sterkte, in mg, (ACIPHEX 20) is aan één zijde bedrukt.
Flessen van 30 ( NDC 69784-243-30)
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30°C (59-86°F) [zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen vocht.
Gedistribueerd door Eisai Inc., Woodcliff Lake, NJ 07677. Herzien: maart 2022
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Botbreuk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige cutane bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cutane en systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cyanocobalamine (vitamine B-12)-tekort [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypomagnesiëmie en mineraal metabolisme [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Fundische klierpoliepen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring in klinische studies
Omdat klinische onderzoeken onder verschillende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
volwassenen
De hieronder beschreven gegevens weerspiegelen de blootstelling aan ACIPHEX-tabletten met vertraagde afgifte bij 1064 volwassen patiënten die gedurende maximaal 8 weken werden blootgesteld. De onderzoeken waren voornamelijk placebo- en actief-gecontroleerde onderzoeken bij volwassen patiënten met erosieve of ulceratieve gastro-oesofageale refluxziekte (GERD), duodenumzweren en maagzweren. De populatie had een gemiddelde leeftijd van 53 jaar (spreiding 18-89 jaar) en had een verhouding van ongeveer 60% man: 40% vrouw. De raciale verdeling was 86% blank, 8% Afro-Amerikaans, 2% Aziatisch en 5% anders. De meeste patiënten kregen ofwel 10 mg, 20 mg of 40 mg ACIPHEX 20 mg tabletten met vertraagde afgifte per dag.
Een analyse van bijwerkingen die optraden bij ≥2% van de patiënten die werden behandeld met ACIPHEX 10 mg tabletten met vertraagde afgifte (n=1064) en met een grotere frequentie dan placebo (n=89) in gecontroleerde Noord-Amerikaanse en Europese acute behandelingsonderzoeken, bracht het volgende aan het licht: bijwerkingen: pijn (3% vs. 1%), faryngitis (3% vs. 2%), winderigheid (3% vs. 1%), infectie (2% vs. 1%) en constipatie (2% vs. 1%).
Drie langdurige onderhoudsonderzoeken bestonden uit in totaal 740 volwassen patiënten; ten minste 54% van de volwassen patiënten werd gedurende 6 maanden blootgesteld aan ACIPHEX 20 mg tabletten met vertraagde afgifte en ten minste 33% werd gedurende 12 maanden blootgesteld. Van de 740 volwassen patiënten kregen 247 (33%) en 241 (33%) patiënten respectievelijk 10 mg en 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte, terwijl 169 (23%) patiënten placebo kregen en 83 (11%) omeprazol.
Het veiligheidsprofiel van rabeprazol in de onderhoudsonderzoeken bij volwassenen kwam overeen met wat werd waargenomen in de acute onderzoeken.
Minder vaak voorkomende bijwerkingen die zijn gezien in gecontroleerde klinische onderzoeken (
Combinatiebehandeling met amoxicilline en claritromycine
In klinische onderzoeken met combinatietherapie met rabeprazol plus amoxicilline en claritromycine (RAC), werden geen bijwerkingen waargenomen die uniek zijn voor deze combinatie van geneesmiddelen. In de multicenterstudie in de VS waren de meest frequent gemelde geneesmiddelgerelateerde bijwerkingen bij patiënten die gedurende 7 of 10 dagen RAC-therapie kregen respectievelijk diarree (8% en 7%) en smaakverstoring (6% en 10%).
Er werden geen klinisch significante laboratoriumafwijkingen waargenomen die specifiek zijn voor de geneesmiddelcombinaties.
Voor meer informatie over bijwerkingen of laboratoriumveranderingen met amoxicilline of claritromycine, zie hun respectievelijke voorschrijfinformatie, rubriek Bijwerkingen.
Kindergeneeskunde
In een multicenter, open-label onderzoek bij adolescente patiënten van 12 tot 16 jaar met een klinische diagnose van symptomatische GERD of endoscopisch bewezen GERD, was het bijwerkingenprofiel vergelijkbaar met dat van volwassenen. De bijwerkingen die werden gemeld, ongeacht het verband met ACIPHEX 20 mg tabletten met vertraagde afgifte en die optraden bij ≥2% van de 111 patiënten, waren hoofdpijn (9,9%), diarree (4,5%), misselijkheid (4,5%), braken (3,6%) en buikpijn (3,6%). De gerelateerde gemelde bijwerkingen die optraden bij ≥2% van de patiënten waren hoofdpijn (5,4%) en misselijkheid (1,8%). Er zijn in dit onderzoek geen bijwerkingen gemeld die niet eerder bij volwassenen zijn waargenomen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van rabeprazol na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan geneesmiddelen:
Bloed- en lymfestelselaandoeningen: agranulocytose, hemolytische anemie, leukopenie, pancytopenie, trombocytopenie
Oor- en labyrintaandoeningen: hoogtevrees
Oogaandoeningen: wazig zien
Maagdarmstelselaandoeningen: fundische klierpoliepen
Algemene aandoeningen en toedieningsplaatsvoorwaarden: plotselinge dood
Lever- en galaandoeningen: geelzucht
Immuunsysteemaandoeningen: anafylaxie, angio-oedeem, systemische lupus erythematodes, Stevens-Johnson-syndroom, toxische epidermale necrolyse (soms fataal), DRESS, AGEP
Infecties en parasitaire aandoeningen: Clostridium difficile-geassocieerde diarree
onderzoeken: Verhogingen van de protrombinetijd/INR (bij patiënten die gelijktijdig met warfarine worden behandeld), TSH-verhogingen
Metabolisme en voedingsstoornissen: hyperammoniëmie, hypomagnesiëmie, hypocalciëmie, hypokaliëmie [Waarschuwingen en voorzorgsmaatregelen 5.8], hyponatriëmie
Aandoeningen van het bewegingsapparaat: botbreuk, rabdomyolyse
Zenuwstelselaandoeningen: coma
Psychische stoornissen: delirium, desoriëntatie
Nier- en urinewegaandoeningen: interstitiële nefritis
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: interstitiële pneumonie
Huid- en onderhuidaandoeningen: ernstige dermatologische reacties waaronder bulleuze en andere uitbarstingen van de huid, cutane lupus erythematosus, erythema multiforme
DRUG-INTERACTIES
Tabel 2 bevat geneesmiddelen met klinisch belangrijke geneesmiddelinteracties en interactie met diagnostiek bij gelijktijdige toediening met ACIPHEX 10 mg tabletten met vertraagde afgifte en instructies om deze te voorkomen of te behandelen.
Raadpleeg de etikettering van gelijktijdig gebruikte geneesmiddelen voor meer informatie over interacties met PPI's.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Aanwezigheid van maagmaligniteit
Bij volwassenen sluit de symptomatische respons op behandeling met ACIPHEX 10 mg de aanwezigheid van maagkanker niet uit. Overweeg aanvullende follow-up en diagnostische tests bij volwassen patiënten met een suboptimale respons of een vroege symptomatische terugval na voltooiing van de behandeling met een PPI.
Interactie met Warfarine
Steady-state-interacties van rabeprazol en warfarine zijn niet adequaat geëvalueerd bij patiënten. Er zijn meldingen geweest van verhoogde INR en protrombinetijd bij patiënten die gelijktijdig een protonpompremmer en warfarine kregen. Verhogingen van de INR en de protrombinetijd kunnen leiden tot abnormale bloedingen en zelfs de dood. Patiënten die gelijktijdig worden behandeld met ACIPHEX 10 mg tabletten met vertraagde afgifte en warfarine, moeten mogelijk worden gecontroleerd op verhogingen van de INR en protrombinetijd (zie DRUG-INTERACTIES ].
Acute tubulo-interstitiële nefritis
Acute tubulo-interstitiële nefritis (TIN) is waargenomen bij patiënten die PPI's gebruiken en kan op elk moment tijdens PPI-therapie optreden. Patiënten kunnen verschillende tekenen en symptomen vertonen, van symptomatische overgevoeligheidsreacties tot niet-specifieke symptomen van verminderde nierfunctie (bijv. malaise, misselijkheid, anorexia). In gerapporteerde casusreeksen werd bij sommige patiënten de diagnose gesteld op basis van biopsie en bij afwezigheid van extrarenale manifestaties (bijv. koorts, huiduitslag of artralgie).
Stop met ACIPHEX en evalueer patiënten met verdenking op acute TIN [zie CONTRA-INDICATIE ].
Clostridium Difficile-geassocieerde diarree
Gepubliceerde observationele studies suggereren dat PPI-therapie zoals ACIPHEX geassocieerd kan zijn met een verhoogd risico op Clostridium difficile-geassocieerde diarree, vooral bij gehospitaliseerde patiënten. Deze diagnose moet worden overwogen voor diarree die niet verbetert [zie ONGEWENSTE REACTIES ].
Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld.
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen. Voor meer specifieke informatie over antibacteriële middelen (claritromycine en amoxicilline) die zijn geïndiceerd voor gebruik in combinatie met ACIPHEX, raadpleegt u de rubrieken 'Waarschuwingen en voorzorgsmaatregelen' van de bijbehorende voorschrijfinformatie.
Bot fractuur
Verschillende gepubliceerde observationele studies bij volwassenen suggereren dat PPI-therapie geassocieerd kan zijn met een verhoogd risico op osteoporose-gerelateerde fracturen van de heup, pols of wervelkolom. Het risico op fracturen was verhoogd bij patiënten die een hoge dosis kregen, gedefinieerd als meerdere dagelijkse doses, en langdurige PPI-therapie (een jaar of langer). Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld. Patiënten met een risico op osteoporose-gerelateerde fracturen moeten worden behandeld volgens vastgestelde behandelrichtlijnen [zie: DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES ].
Ernstige cutane bijwerkingen
Ernstige cutane bijwerkingen, waaronder Stevens-Johnson-syndroom (SJS) en toxische epidermale necrolyse (TEN), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) en acute gegeneraliseerde exanthemateuze pustulose (AGEP) zijn gemeld in verband met het gebruik van PPI's [zien ONGEWENSTE REACTIES ]. Stop met ACIPHEX bij de eerste tekenen of symptomen van ernstige huidbijwerkingen of andere tekenen van overgevoeligheid en overweeg verdere evaluatie.
Cutane en systemische lupus erythematosus
Cutane lupus erythematodes (CLE) en systemische lupus erythematodes (SLE) zijn gemeld bij patiënten die PPI's gebruikten, waaronder rabeprazol. Deze voorvallen zijn opgetreden als zowel nieuw begin als een verergering van een bestaande auto-immuunziekte. De meeste PPI-geïnduceerde gevallen van lupus erythematosus waren CLE.
De meest voorkomende vorm van CLE die werd gemeld bij patiënten die met PPI's werden behandeld, was subacute CLE (SCLE) en trad op binnen weken tot jaren na continue medicamenteuze behandeling bij patiënten variërend van zuigelingen tot ouderen. Over het algemeen werden histologische bevindingen waargenomen zonder orgaanbetrokkenheid.
Systemische lupus erythematosus (SLE) wordt minder vaak gemeld dan CLE bij patiënten die PPI's krijgen. PPI-geassocieerde SLE is meestal milder dan niet-medicamenteuze SLE. Het begin van SLE trad meestal op binnen enkele dagen tot jaren na het starten van de behandeling, voornamelijk bij patiënten variërend van jongvolwassenen tot ouderen. De meerderheid van de patiënten vertoonde huiduitslag; er werden echter ook artralgie en cytopenie gemeld.
Vermijd toediening van PPI's langer dan medisch geïndiceerd. Als er tekenen of symptomen zijn die overeenkomen met CLE of SLE bij patiënten die ACIPHEX krijgen, stop dan met het medicijn en verwijs de patiënt naar de juiste specialist voor evaluatie. De meeste patiënten verbeteren na stopzetting van de PPI alleen in 4 tot 12 weken. Serologische testen (bijv. ANA) kunnen positief zijn en verhoogde serologische testresultaten kunnen langer duren om op te lossen dan klinische manifestaties.
Cyanocobalamine (vitamine B-12)-tekort
Dagelijkse behandeling met zuurremmende medicijnen gedurende een lange periode (bijv. langer dan 3 jaar) kan leiden tot malabsorptie van cyanocobalamine (vitamine B-12) veroorzaakt door hypo- of achloorhydrie. In de literatuur zijn zeldzame meldingen van cyanocobalaminedeficiëntie die optreden bij zuuronderdrukkende therapie gemeld. Deze diagnose moet worden overwogen als klinische symptomen worden waargenomen die overeenkomen met cyanocobalaminedeficiëntie bij patiënten die met ACIPHEX worden behandeld.
Hypomagnesiëmie en mineraal metabolisme
Hypomagnesiëmie, symptomatisch en asymptomatisch, is zelden gemeld bij patiënten die gedurende ten minste drie maanden met PPI's werden behandeld, in de meeste gevallen na een jaar therapie. Ernstige bijwerkingen zijn onder meer tetanie, aritmieën en toevallen. Hypomagnesiëmie kan leiden tot hypocalciëmie en/of hypokaliëmie en kan onderliggende hypocalciëmie verergeren bij risicopatiënten. Bij de meeste patiënten vereiste de behandeling van hypomagnesiëmie magnesiumvervanging en stopzetting van de PPI.
Voor patiënten die naar verwachting langdurig worden behandeld of die PPI's gebruiken met medicijnen zoals digoxine of geneesmiddelen die hypomagnesiëmie kunnen veroorzaken (bijv. Diuretica), kunnen beroepsbeoefenaren in de gezondheidszorg overwegen om de magnesiumspiegels te controleren voorafgaand aan de start van de PPI-behandeling en periodiek [zie ONGEWENSTE REACTIES ].
Overweeg om de magnesium- en calciumspiegels te controleren voordat met ACIPHEX wordt gestart en periodiek tijdens de behandeling bij patiënten met een reeds bestaand risico op hypocalciëmie (bijv. hypoparathyreoïdie). Eventueel aanvullen met magnesium en/of calcium. Als hypocalciëmie ongevoelig is voor behandeling, overweeg dan om de PPI te staken.
Interactie met methotrexaat
De literatuur suggereert dat gelijktijdig gebruik van PPI's met methotrexaat (voornamelijk in hoge doseringen; zie voorschrijfinformatie voor methotrexaat) de serumconcentraties van methotrexaat en/of zijn metaboliet kan verhogen en verlengen, wat mogelijk kan leiden tot toxiciteit van methotrexaat. Bij toediening van een hoge dosis methotrexaat kan bij sommige patiënten een tijdelijke stopzetting van de PPI worden overwogen [zie: DRUG-INTERACTIES ].
Fundische klierpoliepen
Het gebruik van PPI wordt in verband gebracht met een verhoogd risico op poliepen van de fundusklier dat toeneemt bij langdurig gebruik, vooral na een jaar. De meeste PPI-gebruikers die fundusklierpoliepen ontwikkelden, waren asymptomatisch en fundusklierpoliepen werden incidenteel vastgesteld op endoscopie. Gebruik de kortste duur van PPI-therapie die geschikt is voor de aandoening die wordt behandeld.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Acute tubulo-interstitiële nefritis
Adviseer de patiënt of zorgverlener om onmiddellijk de zorgverlener van de patiënt te bellen als ze tekenen en/of symptomen ervaren die verband houden met -acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Clostridium Difficile-geassocieerde diarree
Adviseer de patiënt of zorgverlener om onmiddellijk de zorgverlener van de patiënt te bellen als ze diarree krijgen die niet verbetert [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bot fractuur
Adviseer de patiënt of zorgverlener om eventuele fracturen, met name van de heup, pols of wervelkolom, aan de zorgverlener van de patiënt te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ernstige cutane bijwerkingen
Adviseer de patiënt of zorgverlener om te stoppen met ACIPHEX 20 mg en meld eventuele tekenen en symptomen van een ernstige huidbijwerking of ander teken van overgevoeligheid aan de zorgverlener [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cutane en systemische lupus erythematosus
Adviseer de patiënt of verzorger om onmiddellijk de zorgverlener van de patiënt te bellen voor nieuwe of verergering van symptomen geassocieerd met cutane of systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cyanocobalamine (vitamine B-12)-tekort
Adviseer de patiënt of zorgverlener om klinische symptomen die verband kunnen houden met cyanocobalaminedeficiëntie te melden aan de zorgverlener van de patiënt als deze langer dan 3 jaar ACIPHEX 20 mg krijgt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypomagnesiëmie en mineraal metabolisme
Adviseer de patiënt of verzorger om klinische symptomen te melden die geassocieerd kunnen zijn met hypomagnesiëmie, hypocalciëmie, hypokaliëmie en hyponatriëmie aan de zorgverlener van de patiënt, als deze ACIPHEX gedurende ten minste 3 maanden heeft gekregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelinteracties
Adviseer patiënten om hun zorgverlener te melden als ze rilpivirine-bevattende producten gebruiken [zie: CONTRA-INDICATIES ], warfarine, digoxine of hooggedoseerde methotrexaat [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Administratie
- Slik ACIPHEX 10 mg tabletten met vertraagde afgifte heel door. De tabletten niet kauwen, pletten of splitsen.
- Voor de behandeling van zweren in de twaalfvingerige darm, neem ACIPHEX tabletten met vertraagde afgifte na een maaltijd.
- Neem voor de uitroeiing van Helicobacter pylori ACIPHEX 20 mg tabletten met vertraagde afgifte in met voedsel.
- Voor alle andere indicaties kunnen ACIPHEX 10 mg tabletten met vertraagde afgifte met of zonder voedsel worden ingenomen.
- Neem een vergeten dosis zo snel mogelijk in. Als het bijna tijd is voor de volgende dosis, sla dan de gemiste dosis over en ga terug naar het normale schema. Neem geen twee doses tegelijk.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 88/104 weken durende carcinogeniteitsstudie bij CD-1-muizen veroorzaakte rabeprazol bij orale doses tot 100 mg/kg/dag geen verhoogd optreden van tumoren. De hoogste geteste dosis produceerde een systemische blootstelling aan rabeprazol (AUC) van 1,40 g•uur/ml, wat 1,6 keer de blootstelling bij de mens is (plasma AUC0-∞ = 0,88 g•uur/ml) bij de aanbevolen dosis voor GORZ (20 mg/ dag). In een carcinogeniteitsonderzoek van 28 weken bij p53+/-transgene muizen veroorzaakte rabeprazol in orale doses van 20, 60 en 200 mg/kg/dag geen toename van de incidentie van tumoren, maar veroorzaakte het bij alle doses maagslijmvlieshyperplasie. De systemische blootstelling aan rabeprazol bij 200 mg/kg/dag is ongeveer 17 tot 24 keer de menselijke blootstelling bij de aanbevolen dosis voor GERD. In een 104 weken durende carcinogeniteitsstudie bij Sprague-Dawley-ratten werden mannetjes behandeld met orale doses van 5, 15, 30 en 60 mg/kg/dag en vrouwtjes met 5, 15, 30, 60 en 120 mg/kg/dag . Rabeprazol veroorzaakte maag-enterochromaffine-achtige (ECL) celhyperplasie bij mannelijke en vrouwelijke ratten en ECL-celcarcinoïdtumoren bij vrouwelijke ratten bij alle doses, inclusief de laagste geteste dosis. De laagste dosis (5 mg/kg/dag) veroorzaakte een systemische blootstelling aan rabeprazol (AUC) van ongeveer 0,1 g•uur/ml, wat ongeveer 0,1 keer de menselijke blootstelling is bij de aanbevolen dosis voor GORZ. Bij mannelijke ratten werden geen behandelingsgerelateerde tumoren waargenomen bij doses tot 60 mg/kg/dag die een plasmablootstelling (AUC) van rabeprazol van ongeveer 0,2 g•uur/ml opleverden (0,2 maal de blootstelling bij de mens bij de aanbevolen dosis voor GORZ).
Rabeprazol was positief in de Ames-test, de Chinese hamsterovariumcel (CHO/HGPRT) voorwaartse genmutatietest en de muislymfoomcel (L5178Y/TK+/–) voorwaartse genmutatietest. De gedemethyleerde metaboliet was ook positief in de Ames-test. Rabeprazol was negatief in de in vitro Chinese hamster-longcelchromosoomafwijkingstest, de in vivo micronucleustest bij muizen en de in vivo en ex vivo rattenhepatocyten ongeplande DNA-synthese (UDS)-tests.
Rabeprazol bij intraveneuze doses tot 30 mg/kg/dag (plasma-AUC van 8,8 g•uur/ml, ongeveer 10 keer de menselijke blootstelling bij de aanbevolen dosis voor GORZ) bleek geen effect te hebben op de vruchtbaarheid en reproductieprestaties van mannelijke en vrouwelijke ratten.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Er zijn geen humane gegevens beschikbaar over het gebruik van ACIPHEX 10 mg bij zwangere vrouwen om het geneesmiddelgerelateerde risico te informeren. Het achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populaties is niet bekend. Het achtergrondrisico in de algemene bevolking van de VS op ernstige geboorteafwijkingen is echter 2 tot 4% en op een miskraam is 15 tot 20% van de klinisch erkende zwangerschappen. Er werden geen aanwijzingen voor nadelige ontwikkelingseffecten gezien in reproductiestudies bij dieren met rabeprazol toegediend tijdens de organogenese op 13 en 8 keer het humane gebied onder de plasmaconcentratie-tijdcurve (AUC) bij de aanbevolen dosis voor GERD, bij respectievelijk ratten en konijnen [zie Gegevens ].
Veranderingen in botmorfologie werden waargenomen bij nakomelingen van ratten die werden behandeld met orale doses van een andere PPI gedurende het grootste deel van de dracht en lactatie. Wanneer toediening aan de moeder werd beperkt tot alleen de dracht, waren er geen effecten op de botfysaire morfologie bij de nakomelingen op welke leeftijd dan ook [zie Gegevens ].
Gegevens
Dierlijke gegevens
Er zijn embryo-foetale ontwikkelingsstudies uitgevoerd bij ratten tijdens de organogenese met intraveneuze doses rabeprazol tot 50 mg/kg/dag (plasma-AUC van 11,8 g•uur/ml, ongeveer 13 maal de blootstelling bij de mens bij de aanbevolen orale dosis voor GORZ) en konijnen bij intraveneuze doses tot 30 mg/kg/dag (plasma-AUC van 7,3 g•uur/ml, ongeveer 8 keer de menselijke blootstelling bij de aanbevolen orale dosis voor GERD) en er zijn geen aanwijzingen gevonden voor schade aan de foetus als gevolg van rabeprazol.
Toediening van rabeprazol aan ratten in de late dracht en tijdens de lactatie met een orale dosis van 400 mg/kg/dag (ongeveer 195 maal de orale dosis voor mensen op basis van mg/m²) resulteerde in een afname van de toename van het lichaamsgewicht van de pups.
Een pre- en postnatale ontwikkelingstoxiciteitsstudie bij ratten met aanvullende eindpunten om botontwikkeling te evalueren, werd uitgevoerd met een andere PPI van ongeveer 3,4 tot 57 maal de orale dosis voor de mens op basis van lichaamsoppervlak. Verminderde femurlengte, breedte en dikte van corticaal bot, verminderde dikte van de tibiale groeischijf en minimale tot milde hypocellulariteit van het beenmerg werden waargenomen bij doses van deze PPI gelijk aan of groter dan 3,4 maal een orale dosis voor de mens op basis van het lichaamsoppervlak . Fyseale dysplasie in het dijbeen werd ook waargenomen bij nakomelingen na blootstelling in utero en lactatie aan de PPI bij doses gelijk aan of groter dan 33,6 maal een orale dosis voor de mens op basis van het lichaamsoppervlak. Effecten op het maternale bot werden waargenomen bij drachtige en zogende ratten in een pre- en postnatale toxiciteitsstudie wanneer de PPI werd toegediend in orale doses van 3,4 tot 57 maal de orale dosis voor de mens op basis van het lichaamsoppervlak. Wanneer ratten werden gedoseerd vanaf dag 7 van de zwangerschap tot het spenen op postnatale dag 21, werd een statistisch significante afname van het maternale femurgewicht van maximaal 14% (in vergelijking met placebobehandeling) waargenomen bij doses gelijk aan of groter dan 33,6 maal een orale dosis voor de mens op basis van lichaamsoppervlak.
Een vervolgonderzoek naar ontwikkelingstoxiciteit bij ratten met verdere tijdstippen om de botontwikkeling van de jongen te evalueren vanaf dag 2 postnataal tot volwassenheid werd uitgevoerd met een andere PPI bij orale doses van 280 mg/kg/dag (ongeveer 68 maal een orale dosis voor de mens op een lichaamsoppervlak) waarbij de toediening van het geneesmiddel plaatsvond vanaf dag 7 van de zwangerschap of dag 16 van de zwangerschap tot de bevalling. Wanneer toediening aan de moeder werd beperkt tot alleen de dracht, waren er geen effecten op de botfysaire morfologie bij de nakomelingen op welke leeftijd dan ook.
Borstvoeding
Risico Samenvatting
Er zijn geen lactatiestudies uitgevoerd om de aanwezigheid van rabeprazol in de moedermelk, de effecten van rabeprazol op de zuigeling die borstvoeding krijgt of de effecten van rabeprazol op de melkproductie te beoordelen. Rabeprazol is aanwezig in rattenmelk. De ontwikkeling en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan ACIPHEX en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van ACIPHEX of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van ACIPHEX 20 mg tabletten met vertraagde afgifte zijn vastgesteld bij pediatrische patiënten voor adolescente patiënten van 12 jaar en ouder voor de behandeling van symptomatische GORZ. Het gebruik van ACIPHEX 20 mg tabletten met vertraagde afgifte in deze leeftijdsgroep wordt ondersteund door adequate en goed gecontroleerde onderzoeken bij volwassenen en een multicenter, gerandomiseerd, open-label onderzoek met parallelle groepen bij 111 adolescente patiënten van 12 tot 16 jaar. Patiënten hadden een klinische diagnose van symptomatische GERD, of vermoede of endoscopisch bewezen GERD en werden gerandomiseerd naar 10 mg of 20 mg eenmaal daags gedurende maximaal 8 weken voor de evaluatie van veiligheid en werkzaamheid. Het bijwerkingenprofiel bij adolescente patiënten was vergelijkbaar met dat van volwassenen. De gerelateerde gemelde bijwerkingen die optraden bij ≥2% van de patiënten waren hoofdpijn (5%) en misselijkheid (2%). In deze onderzoeken zijn geen bijwerkingen gemeld die niet eerder bij volwassenen zijn waargenomen.
De veiligheid en werkzaamheid van ACIPHEX 10 mg tabletten met vertraagde afgifte zijn niet vastgesteld bij pediatrische patiënten voor:
- Genezing van erosieve of ulceratieve GERD
- Onderhoud van genezing van erosieve of ulceratieve GERD
- Behandeling van symptomatische GERD
- Genezing van duodenumzweren
- Uitroeiing van Helicobacter pylori om het risico op terugkeer van duodenumzweren te verminderen
- Behandeling van pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom
ACIPHEX tabletten met vertraagde afgifte van 20 mg worden niet aanbevolen voor gebruik bij pediatrische patiënten jonger dan 12 jaar omdat de tabletsterkte de aanbevolen dosis voor deze patiënten overschrijdt [zie DOSERING EN ADMINISTRATIE ]. Overweeg voor pediatrische patiënten van 1 jaar tot jonger dan 12 jaar een andere formulering van rabeprazol. De veiligheid en werkzaamheid van een andere doseringsvorm en doseringssterkte van rabeprazol is vastgesteld bij pediatrische patiënten van 1 tot 11 jaar voor de behandeling van GERD.
Juveniele diergegevens
Er werden studies uitgevoerd bij jonge en jongvolwassen ratten en honden. In juveniele dierstudies werd rabeprazol-natrium oraal toegediend aan ratten gedurende maximaal 5 weken en aan honden gedurende maximaal 13 weken, elk beginnend op dag 7 postpartum en gevolgd door een herstelperiode van 13 weken. Ratten kregen een dosering van 5, 25 of 150 mg/kg/dag en honden kregen een dosering van 3, 10 of 30 mg/kg/dag. De gegevens uit deze onderzoeken waren vergelijkbaar met die voor jongvolwassen dieren. Farmacologisch gemedieerde veranderingen, waaronder verhoogde serumgastrinespiegels en maagveranderingen, werden waargenomen bij alle dosisniveaus bij zowel ratten als honden. Deze waarnemingen waren omkeerbaar gedurende de herstelperiodes van 13 weken. Hoewel het lichaamsgewicht en/of de lengte van de kruin tijdens de dosering minimaal afnam, werden geen effecten op de ontwikkelingsparameters waargenomen bij jonge ratten of honden.
Wanneer juveniele dieren 28 dagen werden behandeld met een andere PPI in doses gelijk aan of hoger dan 34 maal de dagelijkse orale dosis voor de mens op basis van het lichaamsoppervlak, werd de algehele groei beïnvloed en aan de behandeling gerelateerde afname van het lichaamsgewicht (ongeveer 14%) en lichaamsgewichtstoename en afname van het dijbeengewicht en de dijbeenlengte werden waargenomen.
Geriatrisch gebruik
Van het totale aantal proefpersonen (n=2009) in klinische onderzoeken met ACIPHEX 20 mg tabletten met vertraagde afgifte was 19% 65 jaar en ouder, terwijl 4% 75 jaar en ouder was. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Leverfunctiestoornis
Toediening van ACIPHEX-tabletten met vertraagde afgifte aan patiënten met een lichte tot matige leverfunctiestoornis (respectievelijk Child-Pugh-klasse A en B) leidde tot verhoogde blootstelling en verminderde eliminatie (zie KLINISCHE FARMACOLOGIE ]. Bij patiënten met een lichte tot matige leverfunctiestoornis is geen dosisaanpassing nodig. Er is geen informatie over patiënten met een ernstige leverfunctiestoornis (Child-Pugh-klasse C). Vermijd het gebruik van ACIPHEX-tabletten met vertraagde afgifte bij patiënten met ernstige leverinsufficiëntie; als behandeling echter noodzakelijk is, moet u patiënten controleren op bijwerkingen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
OVERDOSERING
Er zijn zeven meldingen van accidentele overdosering met rabeprazol ontvangen. De maximaal gemelde overdosis was 80 mg. Er waren geen klinische tekenen of symptomen geassocieerd met een gemelde overdosis. Patiënten met het Zollinger-Ellison-syndroom zijn behandeld met maximaal 120 mg rabeprazol eenmaal daags. Er is geen specifiek antidotum voor rabeprazol bekend. Rabeprazol is sterk eiwitgebonden en is niet gemakkelijk dialyseerbaar.
In geval van overdosering dient de behandeling symptomatisch en ondersteunend te zijn.
Als er sprake is van overmatige blootstelling, bel dan uw Antigifcentrum op 1-800-222-1222 voor actuele informatie over het beheer van vergiftiging of overdosering.
CONTRA-INDICATIES
- ACIPHEX 10 mg is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor rabeprazol, gesubstitueerde benzimidazolen of voor enig bestanddeel van de formulering. Overgevoeligheidsreacties kunnen anafylaxie, anafylactische shock, angio-oedeem, bronchospasme, acute tubulo-interstitiële nefritis en urticaria omvatten (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
- PPI's, waaronder ACIPHEX, zijn gecontra-indiceerd met producten die rilpivirine bevatten [zie: DRUG-INTERACTIES ].
- Voor informatie over contra-indicaties van antibacteriële middelen (claritromycine en amoxicilline) die zijn geïndiceerd in combinatie met ACIPHEX 20 mg tabletten met vertraagde afgifte, raadpleegt u de rubriek Contra-indicaties van hun bijsluiters.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Rabeprazol behoort tot een klasse van antisecretoire verbindingen (gesubstitueerde benzimidazol-protonpompremmers) die geen anticholinerge of histamine H2-receptorantagonistische eigenschappen vertonen, maar de maagzuursecretie onderdrukken door de maag H+, K+ATPase op het secretoire oppervlak van de maag te remmen. pariëtale cel. Omdat dit enzym wordt beschouwd als de zure (proton)pomp in de pariëtale cel, is rabeprazol gekarakteriseerd als een protonpompremmer in de maag. Rabeprazol blokkeert de laatste stap van de maagzuursecretie.
In pariëtale maagcellen wordt rabeprazol geprotoneerd, accumuleert en wordt het omgezet in een actief sulfenamide. Bij in vitro onderzoek wordt rabeprazol chemisch geactiveerd bij pH 1,2 met een halfwaardetijd van 78 seconden. Het remt het zuurtransport in de maagblaasjes van varkens met een halfwaardetijd van 90 seconden.
farmacodynamiek
Antisecretoire activiteit
Het antisecretoire effect begint binnen één uur na orale toediening van 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte. Het mediane remmende effect van rabeprazol op 24-uurs maagzuur is 88% van het maximum na de eerste dosis. Een dosis van 20 mg ACIPHEX-tabletten met vertraagde afgifte remt de door basale en peptonmaaltijd gestimuleerde zuursecretie versus placebo met respectievelijk 86% en 95%, en verhoogt het percentage van een periode van 24 uur dat de maag-pH>3 van 10% naar 65% (zie onderstaande tabel). Deze relatief langdurige farmacodynamische werking vergeleken met de korte farmacokinetische halfwaardetijd (1 tot 2 uur) weerspiegelt de aanhoudende inactivatie van de H+, K+ATPase.
Vergeleken met placebo, verminderden 10 mg, 20 mg en 40 mg ACIPHEX tabletten met vertraagde afgifte, eenmaal daags toegediend gedurende 7 dagen, de intragastrische zuurgraad significant met alle doses voor elk van de vier maaltijdgerelateerde intervallen en de periode van 24 uur in het algemeen. In deze studie waren er geen statistisch significante verschillen tussen doses; er was echter een significante dosisgerelateerde afname van de zuurgraad in de maag. Het vermogen van rabeprazol om een dosisgerelateerde afname van de gemiddelde zuurgraad in de maag te veroorzaken, wordt hieronder geïllustreerd.

Na toediening van 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte eenmaal daags gedurende acht dagen, was het gemiddelde percentage van de tijd dat maag-pH hoger dan 3 of maag-pH hoger dan 4 na een enkele dosis (dag 1) en meervoudige doses (dag 8) significant groter dan placebo (zie onderstaande tabel). De afname van de maagzuurgraad en de toename van de pH van de maag die werden waargenomen met 20 mg ACIPHEX 10 mg tabletten met vertraagde afgifte, eenmaal daags toegediend gedurende acht dagen, werden vergeleken met dezelfde parameters voor placebo, zoals hieronder geïllustreerd:
Effecten op blootstelling aan slokdarmzuur
Bij patiënten met GORZ en matige tot ernstige blootstelling aan slokdarmzuur verminderde een dosis van 20 mg en 40 mg per dag ACIPHEX 20 mg tabletten met vertraagde afgifte de 24-uurs blootstelling aan slokdarmzuur. Na zeven dagen behandeling nam het tijdspercentage dat de slokdarm-pH minder dan 4 was, af van de basislijn van 24,7% voor 20 mg en 23,7% voor 40 mg tot respectievelijk 5,1% en 2,0%. Normalisatie van 24-uurs intra-oesofageale zuurblootstelling was gecorreleerd aan maag-pH hoger dan 4 gedurende ten minste 35% van de periode van 24 uur; dit niveau werd bereikt bij 90% van de proefpersonen die ACIPHEX 20 mg kregen en bij 100% van de proefpersonen die ACIPHEX 40 mg kregen. Met ACIPHEX 20 mg en 40 mg per dag werden significante effecten op de maag- en slokdarm-pH opgemerkt na één dag behandeling en meer uitgesproken na zeven dagen behandeling.
Effecten op serumgastrine
De mediane nuchtere gastrinespiegel nam dosisafhankelijk toe bij patiënten die eenmaal daags werden behandeld met ACIPHEX 10 mg tabletten met vertraagde afgifte gedurende maximaal acht weken voor ulceratieve of erosieve oesofagitis en bij patiënten die gedurende maximaal 52 weken werden behandeld om herhaling van de ziekte te voorkomen. De mediaanwaarden van de groep bleven binnen het normale bereik.
Bij een groep proefpersonen die gedurende 4 weken werden behandeld met 20 mg ACIPHEX-tabletten met vertraagde afgifte, werd een verdubbeling van de gemiddelde serumgastrineconcentraties waargenomen. Ongeveer 35% van deze behandelde proefpersonen ontwikkelde serumgastrineconcentraties boven de bovengrens van normaal.
Effecten op enterochromaffine-achtige (ECL) cellen
Verhoogd serumgastrine als gevolg van antisecretoire middelen stimuleert de proliferatie van maag-ECL-cellen, wat na verloop van tijd kan leiden tot ECL-celhyperplasie bij ratten en muizen en maagcarcinoïden bij ratten, vooral bij vrouwtjes [zie Niet-klinische toxicologie ].
Bij meer dan 400 patiënten die werden behandeld met ACIPHEX tabletten met vertraagde afgifte (10 of 20 mg) eenmaal daags gedurende maximaal een jaar, nam de incidentie van ECL-celhyperplasie toe met de tijd en de dosis, wat consistent is met de farmacologische werking van de protonpompremmer. Geen enkele patiënt ontwikkelde de adenomatoïde, dysplastische of neoplastische veranderingen van ECL-cellen in het maagslijmvlies. Geen enkele patiënt ontwikkelde de carcinoïde tumoren die bij ratten werden waargenomen.
Endocriene effecten
Studies bij mensen gedurende maximaal een jaar hebben geen klinisch significante effecten op het endocriene systeem aangetoond. Bij gezonde mannelijke proefpersonen die gedurende 13 dagen werden behandeld met ACIPHEX-tabletten met vertraagde afgifte, werden geen klinisch relevante veranderingen gedetecteerd in de volgende onderzochte endocriene parameters: 17 β-estradiol, thyroïdstimulerend hormoon, tri-joodthyronine, thyroxine, thyroxine-bindend eiwit, parathyroïde hormoon, insuline, glucagon, renine, aldosteron, follikelstimulerend hormoon, luteotroof hormoon, prolactine, somatotroop hormoon, dehydroepiandrosteron, cortisolbindend globuline en urinair 6β-hydroxycortisol, serumtestosteron en circadiaans cortisolprofiel.
Andere effecten
Bij mensen die gedurende maximaal één jaar werden behandeld met ACIPHEX 10 mg tabletten met vertraagde afgifte, zijn geen systemische effecten waargenomen op het centrale zenuwstelsel, lymfoïde, hematopoëtische, nier-, lever-, cardiovasculaire of ademhalingsstelsel. Er zijn geen gegevens beschikbaar over langdurige behandeling met ACIPHEX 10 mg tabletten met vertraagde afgifte en effecten op de ogen.
Farmacokinetiek
Na orale toediening van 20 mg ACIPHEX 10 mg tabletten met vertraagde afgifte, treden piekplasmaconcentraties (Cmax) van rabeprazol op over een bereik van 2 tot 5 uur (Tmax). De Cmax en AUC van rabeprazol zijn lineair over een oraal doseringsbereik van 10 mg tot 40 mg. Er is geen merkbare accumulatie wanneer doses van 10 mg tot 40 mg elke 24 uur worden toegediend; de farmacokinetiek van rabeprazol wordt niet veranderd door meervoudige dosering.
Absorptie
De absolute biologische beschikbaarheid voor een orale tablet van 20 mg rabeprazol (vergeleken met intraveneuze toediening) is ongeveer 52%. Wanneer ACIPHEX 10 mg tabletten met vertraagde afgifte worden toegediend met een vetrijke maaltijd, is de Tmax variabel; waarbij gelijktijdige voedselinname de absorptie tot 4 uur of langer kan vertragen. De Cmax en de mate van absorptie van rabeprazol (AUC) zijn echter niet significant veranderd. Zo kunnen ACIPHEX-tabletten met vertraagde afgifte worden ingenomen zonder rekening te houden met het tijdstip van maaltijden.
Verdeling
Rabeprazol is voor 96,3% gebonden aan humane plasma-eiwitten.
Eliminatie
Metabolisme
Rabeprazol wordt uitgebreid gemetaboliseerd. Een aanzienlijk deel van rabeprazol wordt gemetaboliseerd via systemische niet-enzymatische reductie tot een thioetherverbinding. Rabeprazol wordt ook gemetaboliseerd tot sulfon- en desmethylverbindingen via cytochroom P450 in de lever. De thioether en sulfon zijn de primaire metabolieten die in humaan plasma worden gemeten. Deze metabolieten bleken geen significante antisecretoire activiteit te hebben. In vitro-onderzoeken hebben aangetoond dat rabeprazol in de lever voornamelijk wordt gemetaboliseerd door cytochroom P450 3A (CYP3A) tot een sulfonmetaboliet en cytochroom P450 2C19 (CYP2C19) tot desmethylrabeprazol. CYP2C19 vertoont een bekend genetisch polymorfisme vanwege de deficiëntie ervan in sommige subpopulaties (bijv. 3 tot 5% van de blanken en 17 tot 20% van de Aziaten). Het metabolisme van rabeprazol is traag in deze subpopulaties, daarom worden ze slechte metaboliseerders van het geneesmiddel genoemd.
uitscheiding
Na een enkelvoudige orale dosis van 20 mg 14C-gelabeld rabeprazol werd ongeveer 90% van het geneesmiddel uitgescheiden in de urine, voornamelijk als thioethercarbonzuur; zijn glucuronide en mercaptuurzuurmetabolieten. De rest van de dosis werd teruggevonden in de feces. De totale terugwinning van radioactiviteit was 99,8%. Er werd geen onveranderd rabeprazol teruggevonden in de urine of feces.
Specifieke populaties
Geriatrische patiënten
Bij 20 gezonde oudere proefpersonen die gedurende zeven dagen eenmaal daags 20 mg ACIPHEX-tabletten met vertraagde afgifte kregen, verdubbelden de AUC-waarden ongeveer en nam de Cmax met 60% toe in vergelijking met de waarden in een parallelle jongere controlegroep. Er waren geen aanwijzingen voor accumulatie van het geneesmiddel na eenmaaldaagse toediening [zie: Gebruik in specifieke populatie ].
Pediatrische patiënten
De farmacokinetiek van rabeprazol is onderzocht bij 12 adolescente patiënten met GERD van 12 tot 16 jaar in een multicenter onderzoek. Patiënten kregen eenmaal daags 20 mg ACIPHEX tabletten met vertraagde afgifte gedurende vijf of zeven dagen. Een toename van ongeveer 40% in de blootstelling aan rabeprazol werd waargenomen na 5 tot 7 dagen dosering vergeleken met de blootstelling na 1 dag dosering. De farmacokinetische parameters bij adolescente patiënten met GERD van 12 tot 16 jaar lagen binnen het bereik dat werd waargenomen bij gezonde volwassen proefpersonen.
Mannelijke en vrouwelijke patiënten en raciale of etnische groepen
In analyses gecorrigeerd voor lichaamsmassa en lengte vertoonde de farmacokinetiek van rabeprazol geen klinisch significante verschillen tussen mannelijke en vrouwelijke proefpersonen. In onderzoeken waarin verschillende formuleringen van rabeprazol werden gebruikt, waren de AUC0-∞-waarden voor gezonde Japanse mannen ongeveer 50 tot 60% hoger dan de waarden afgeleid van gepoolde gegevens van gezonde mannen in de Verenigde Staten.
Patiënten met nierinsufficiëntie
Bij 10 patiënten met stabiele nierziekte in het eindstadium die onderhoudshemodialyse nodig hadden (creatinineklaring ≤ 5 ml/min/1,73 m²), werden geen klinisch significante verschillen waargenomen in de farmacokinetiek van rabeprazol na een enkelvoudige dosis van 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte in vergelijking met 10 gezonde proefpersonen.
Patiënten met leverinsufficiëntie
In een studie met een enkelvoudige dosis van 10 patiënten met een lichte tot matige leverfunctiestoornis (respectievelijk Child-Pugh-klasse A en B) die een enkelvoudige dosis van 20 mg ACIPHEX 10 mg tabletten met vertraagde afgifte kregen toegediend, was de AUC0-24 ongeveer verdubbeld, de eliminatie de halfwaardetijd was 2 tot 3 keer hoger en de totale lichaamsklaring was verminderd tot minder dan de helft in vergelijking met waarden bij gezonde mannen.
In een onderzoek met meerdere doses bij 12 patiënten met een lichte tot matige leverfunctiestoornis die gedurende acht dagen eenmaal daags 20 mg ACIPHEX 10 mg tabletten met vertraagde afgifte kregen toegediend, stegen de AUC0-∞- en Cmax-waarden met ongeveer 20% vergeleken met waarden bij gezonde leeftijd- en geslachtsafhankelijke onderwerpen. Deze stijgingen waren niet statistisch significant.
Er is geen informatie over de dispositie van rabeprazol bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh-klasse C) (zie Gebruik bij specifieke populaties ].
Geneesmiddelinteractiestudies
Gecombineerde toediening met antimicrobiële middelen
Zestien gezonde proefpersonen gegenotypeerd als snelle metaboliseerders met betrekking tot CYP2C19 kregen 20 mg ACIPHEX tabletten met vertraagde afgifte, 1000 mg amoxicilline, 500 mg claritromycine, of alle drie de geneesmiddelen in een viervoudig cross-overonderzoek. Elk van de vier regimes werd gedurende 6 dagen tweemaal daags toegediend. De AUC en Cmax voor claritromycine en amoxicilline waren niet verschillend na gecombineerde toediening in vergelijking met waarden na enkelvoudige toediening. De AUC en Cmax van rabeprazol namen echter toe met respectievelijk 11% en 34% na gecombineerde toediening. De AUC en Cmax voor 14-hydroxyclaritromycine (actieve metaboliet van claritromycine) namen ook toe met respectievelijk 42% en 46%. Deze verhoogde blootstelling aan rabeprazol en 14-hydroxyclaritromycine zal naar verwachting geen veiligheidsrisico's opleveren.
Effecten van andere geneesmiddelen op rabeprazol
Antacida
Gelijktijdige toediening van ACIPHEX 20 mg tabletten met vertraagde afgifte en antacida veroorzaakte geen klinisch relevante veranderingen in de plasmaconcentraties van rabeprazol.
Effecten van rabeprazol op andere geneesmiddelen
Studies bij gezonde proefpersonen hebben aangetoond dat rabeprazol geen klinisch significante interacties heeft met andere geneesmiddelen die worden gemetaboliseerd door het CYP450-systeem, zoals theofylline (CYP1A2) toegediend als enkelvoudige orale doses, diazepam (CYP2C9 en CYP3A4) als enkelvoudige intraveneuze dosis, en fenytoïne ( CYP2C9 en CYP2C19) gegeven als een enkele intraveneuze dosis (met aanvullende orale dosering). Steady-state-interacties van rabeprazol en andere geneesmiddelen die door dit enzymsysteem worden gemetaboliseerd, zijn niet onderzocht bij patiënten.
Clopidogrel
Clopidogrel wordt gedeeltelijk door CYP2C19 gemetaboliseerd tot zijn actieve metaboliet. Er werd een onderzoek uitgevoerd onder gezonde proefpersonen, waaronder CYP2C19 extensieve en intermediaire metaboliseerders die gedurende 7 dagen eenmaal daags 75 mg clopidogrel gelijktijdig met placebo of met 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte (n=36) kregen. De gemiddelde AUC van de actieve metaboliet van clopidogrel was met ongeveer 12% verminderd (gemiddelde AUC-ratio was 88%, met een 90% BI van 81,7 tot 95,5%) wanneer ACIPHEX tabletten met vertraagde afgifte gelijktijdig werden toegediend in vergelijking met toediening van clopidogrel met placebo (zie DRUG-INTERACTIES ].
Digoxine
Bij gezonde volwassen proefpersonen (n=16) resulteerde gelijktijdige toediening van 20 mg rabeprazolnatriumtabletten met vertraagde afgifte en 2,5 mg eenmaal daagse doses digoxine bij steady state in een toename van ongeveer 29% en 19% van de gemiddelde Cmax en AUC(0- 24) van digoxine [zie DRUG-INTERACTIES ].
Ketoconazol
Bij gezonde volwassen proefpersonen (n=19) resulteerde gelijktijdige toediening van 20 mg rabeprazolnatriumtabletten met vertraagde afgifte in steady state met een enkelvoudige orale dosis van 400 mg ketoconazol in een verlaging van ongeveer 31% van zowel de Cmax als de AUC(0- inf) van ketoconazol [zie DRUG-INTERACTIES ].
Cyclosporine
In-vitro-incubaties met menselijke levermicrosomen gaven aan dat rabeprazol het cyclosporinemetabolisme remde met een IC50 van 62 micromolair, een concentratie die meer dan 50 keer hoger is dan de Cmax bij gezonde vrijwilligers na 14 dagen dosering met 20 mg ACIPHEX 10 mg tabletten met vertraagde afgifte. Deze mate van remming is vergelijkbaar met die van omeprazol bij equivalente concentraties.
Microbiologie
De volgende in-vitrogegevens zijn beschikbaar, maar de klinische betekenis is niet bekend.
Van rabeprazolnatrium, amoxicilline en claritromycine als een regime van drie geneesmiddelen is aangetoond dat het actief is tegen de meeste stammen van Helicobacter pylori in vitro en bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK , Klinische studies ].
Helicobacter pylori
De gevoeligheidstesten van H. pylori-isolaten werden uitgevoerd voor amoxicilline en claritromycine met behulp van agarverdunningsmethodologie1 en minimale remmende concentraties (MIC's) werden bepaald.
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontrolemicro-organismen om de technische aspecten van de laboratoriumprocedures te controleren.
Incidentie van antibioticaresistente organismen onder klinische isolaten
Voorbehandelingsweerstand:
Het resistentiepercentage voor claritromycine vóór de behandeling (MIC ≥1 mcg/ml) tegen H. pylori was 9% (51/560) bij baseline in alle behandelingsgroepen samen. Meer dan 99% (558/560) van de patiënten had H. pylori-isolaten die bij baseline als gevoelig werden beschouwd (MIC ≤ 0,25 mcg/ml) voor amoxicilline. Twee patiënten hadden baseline H. pylori-isolaten met een amoxicilline-MIC van 0,5 mcg/ml.
Voor informatie over gevoeligheidstests over Helicobacter pylori, zie de sectie Microbiologie in de voorschrijfinformatie voor claritromycine en amoxicilline.
Patiënten met aanhoudende H. pylori-infectie na behandeling met rabeprazol, amoxicilline en claritromycine zullen waarschijnlijk klinische isolaten hebben die resistent zijn tegen claritromycine. Daarom moeten waar mogelijk gevoeligheidstesten voor claritromycine worden uitgevoerd. Als resistentie tegen claritromycine wordt aangetoond of als gevoeligheidstests niet mogelijk zijn, moet een alternatieve antimicrobiële therapie worden ingesteld.
Resultaten van amoxicillinegevoeligheidstests en klinische/bacteriologische resultaten
In het multicenteronderzoek in de VS had meer dan 99% (558/560) van de patiënten H. pylori-isolaten die bij baseline als gevoelig werden beschouwd (MIC ≤ 0,25 mcg/ml) voor amoxicilline. De andere 2 patiënten hadden baseline H. pylori isolaten met een amoxicilline MIC van 0,5 mcg/ml, en beide isolaten waren claritromycine-resistent bij baseline; in één geval werd de H. pylori uitgeroeid. In de 7- en 10-daagse behandelingsgroepen werden respectievelijk 75% (107/145) en 79% (112/142) van de patiënten die voor de behandeling voor amoxicilline gevoelige MIC's hadden (≤0,25 mcg/ml) uitgeroeid van H. pylori . Geen van de patiënten ontwikkelde tijdens de behandeling amoxicilline-resistente H. pylori.
farmacogenomica
In een klinische studie ter evaluatie van ACIPHEX-tabletten met vertraagde afgifte bij volwassen Japanse patiënten, gecategoriseerd op CYP2C19-genotype (n=6 per genotypecategorie), was de maagzuursuppressie hoger bij trage metaboliseerders dan bij snelle metaboliseerders. Dit kan te wijten zijn aan hogere plasmaspiegels van rabeprazol bij trage metaboliseerders. De klinische relevantie hiervan is niet bekend. Of interacties van rabeprazolnatrium met andere geneesmiddelen die door CYP2C19 worden gemetaboliseerd, zouden verschillen tussen snelle metaboliseerders en trage metaboliseerders, is niet onderzocht.
Klinische studies
Genezing van erosieve of ulceratieve GERD bij volwassenen
In een multicenter, gerandomiseerd, dubbelblind, placebogecontroleerd onderzoek in de VS werden 103 patiënten gedurende maximaal acht weken behandeld met eenmaal daags placebo, 10 mg, 20 mg of 40 mg ACIPHEX tabletten met vertraagde afgifte. Voor deze en alle onderzoeken naar genezing van GERD kwamen alleen patiënten met GERD-symptomen en ten minste graad 2 oesofagitis (gemodificeerde Hetzel-Dent-beoordelingsschaal) in aanmerking voor deelname. Endoscopische genezing werd gedefinieerd als graad 0 of 1. Elke dosis rabeprazol was significant beter dan placebo wat betreft endoscopische genezing na vier en acht weken behandeling. Het percentage patiënten dat endoscopische genezing vertoonde was als volgt:
Bovendien was er een statistisch significant verschil in het voordeel van de doses ACIPHEX 10 mg, 20 mg en 40 mg vergeleken met placebo in week 4 en 8 met betrekking tot het volledig verdwijnen van de frequentie van GORZ maagzuur (p≤0,026). Alle ACIPHEX-groepen rapporteerden significant hogere percentages van volledige verdwijning van de ernst van brandend maagzuur overdag in vergelijking met placebo in week 4 en 8 (p≤0,036). De gemiddelde verlagingen van de dagelijkse dosis antacidum ten opzichte van de uitgangswaarde waren statistisch significant voor alle ACIPHEX-groepen in vergelijking met placebo in zowel week 4 als week 8 (p≤0,007).
In een Noord-Amerikaanse multicenter, gerandomiseerde, dubbelblinde, actief-gecontroleerde studie van 336 patiënten, was het percentage patiënten genezen bij endoscopie na vier en acht weken behandeling statistisch superieur bij de patiënten die werden behandeld met ACIPHEX tabletten met vertraagde afgifte vergeleken met ranitidine :
Een dosis van 20 mg eenmaal daags ACIPHEX tabletten met vertraagde afgifte was significant effectiever dan ranitidine 150 mg viermaal daags bij het percentage patiënten met volledige genezing van brandend maagzuur in week 4 en 8 (p
De aanbevolen dosering van ACIPHEX 10 mg tabletten met vertraagde afgifte is 20 mg eenmaal daags gedurende 4 tot 8 weken.
Langdurig onderhoud van genezing van erosieve of ulceratieve GERD bij volwassenen
Het behoud van genezing op lange termijn bij patiënten met erosieve of ulceratieve GORZ die eerder waren genezen met maag-secretoire therapie, werd beoordeeld in twee Amerikaanse, multicenter, gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken met een identieke opzet van 52 weken. In de twee onderzoeken werden respectievelijk 209 en 285 patiënten gerandomiseerd om ofwel 10 mg ofwel 20 mg ACIPHEX tabletten met vertraagde afgifte eenmaal daags of placebo te krijgen. Zoals aangetoond in Tabellen 10 en 11 hieronder, waren patiënten die werden behandeld met ACIPHEX-tabletten met vertraagde afgifte significant beter dan placebo in beide onderzoeken met betrekking tot het behoud van de genezing van GORZ en het percentage patiënten dat na 52 weken vrij bleef van symptomen van brandend maagzuur. De aanbevolen dosering van ACIPHEX 20 mg tabletten met vertraagde afgifte is eenmaal daags 20 mg.
Behandeling van symptomatische GERD bij volwassenen
Twee Amerikaanse, multicenter, dubbelblinde, placebogecontroleerde onderzoeken werden uitgevoerd bij 316 volwassen patiënten met brandend maagzuur overdag en 's nachts. Patiënten rapporteerden 5 of meer perioden van matig tot zeer ernstig brandend maagzuur tijdens de placebobehandelingsfase in de week voorafgaand aan randomisatie. De patiënten werden bevestigd door endoscopie om geen oesofageale erosies te hebben.
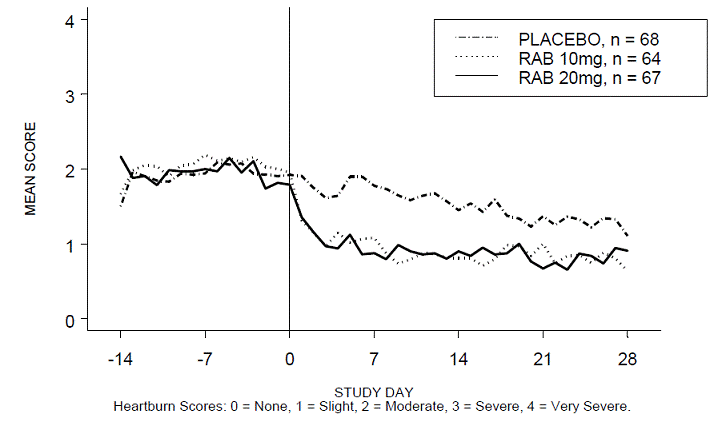
Het percentage maagzuurvrije perioden overdag en/of 's nachts was groter met 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte in vergelijking met placebo gedurende de 4 weken durende studie in onderzoek RABUSA-2 (47% vs. 23%) en onderzoek RAB-USA- 3 (52% versus 28%). De gemiddelde dalingen ten opzichte van de uitgangswaarde van de gemiddelde scores voor brandend maagzuur overdag en 's nachts waren significant groter voor ACIPHEX 20 mg in vergelijking met placebo in week 4. Grafische displays die de dagelijkse gemiddelde scores voor overdag en 's nachts weergeven, zijn weergegeven in de figuren 2 tot en met 5.
Figuur 2: Gemiddelde maagzuurscores overdag RAB-USA-2
Figuur 3: Gemiddelde nachtelijke maagzuurscores RAB-USA-2
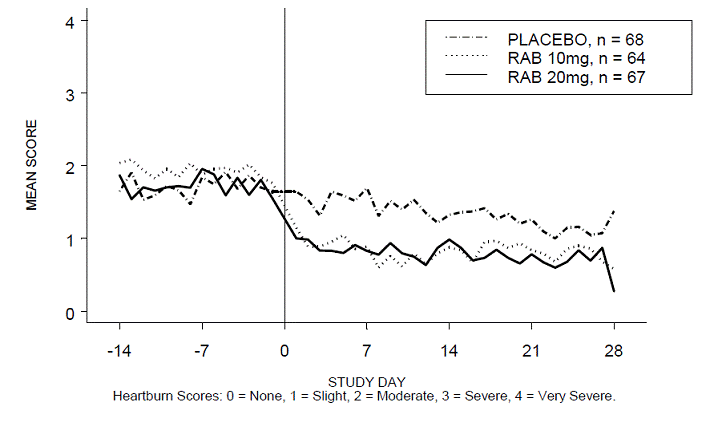
Afbeelding 4: Gemiddelde scores voor brandend maagzuur overdag RAB-USA-3 Afbeelding 3: Gemiddelde scores voor brandend maagzuur overdag RAB - VS –3
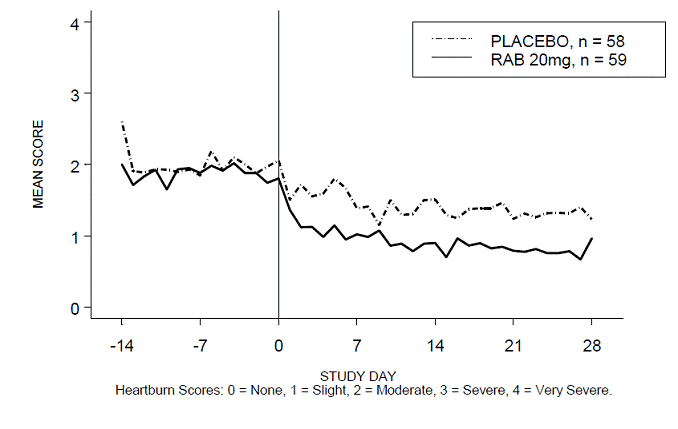
Figuur 5: Gemiddelde nachtelijke maagzuurscores RAB-USA-3
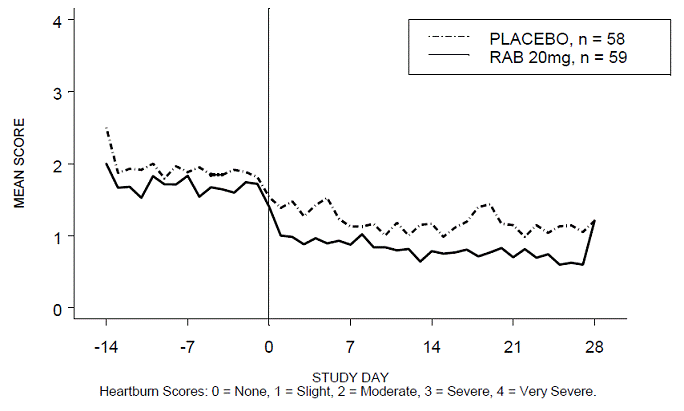
Bovendien toonde de gecombineerde analyse van deze twee onderzoeken aan dat 20 mg ACIPHEX 10 mg tabletten met vertraagde afgifte significante andere GORZ-gerelateerde symptomen (regurgitatie, oprispingen en vroege verzadiging) in week 4 significant verbeterden in vergelijking met placebo (alle p-waarden
Een dosis van 20 mg ACIPHEX 20 mg tabletten met vertraagde afgifte verminderde ook significant de dagelijkse consumptie van antacidum in vergelijking met placebo gedurende 4 weken (p
De aanbevolen dosering van ACIPHEX tabletten met vertraagde afgifte is 20 mg eenmaal daags gedurende 4 weken.
Genezing van duodenumzweren bij volwassenen
In een gerandomiseerde, dubbelblinde, multicentrische studie in de VS waarin de werkzaamheid van 20 mg en 40 mg ACIPHEX 10 mg tabletten met vertraagde afgifte eenmaal daags versus placebo werd beoordeeld voor de genezing van endoscopisch gedefinieerde zweren in de twaalfvingerige darm, werden 100 patiënten gedurende maximaal vier weken behandeld. ACIPHEX was significant superieur aan placebo bij het produceren van genezing van zweren in de twaalfvingerige darm. De percentages patiënten met endoscopische genezing worden hieronder weergegeven:
In week 2 en 4 rapporteerden significant meer patiënten in de ACIPHEX 20- en 40 mg-groepen volledige verdwijning van de frequentie van ulcuspijn (p≤0,018), de ernst van de pijn overdag (p≤0,023) en de ernst van de nachtelijke pijn (p≤0,035) vergeleken met placebo-patiënten. De enige uitzondering was de 40 mg-groep versus placebo in week 2 voor de frequentie van pijn aan de twaalfvingerige darm (p=0,094). Aan het einde van de eerste week van het onderzoek werden in beide ACIPHEX-groepen significante verschillen waargenomen in het verdwijnen van pijn overdag en 's nachts in vergelijking met placebo. In beide ACIPHEX-groepen werden in week 2 en 4 ook significante verlagingen van het dagelijks gebruik van antacidum waargenomen (p
Een internationale, gerandomiseerde, dubbelblinde, actief-gecontroleerde studie werd uitgevoerd bij 205 patiënten, waarbij 20 mg ACIPHEX tabletten met vertraagde afgifte eenmaal daags werden vergeleken met 20 mg omeprazol eenmaal daags. De studie was opgezet om ten minste 80% power te leveren om een verschil van ten minste 10% tussen ACIPHEX 10 mg en omeprazol uit te sluiten, uitgaande van een genezingsrespons van vier weken van 93% voor beide groepen. Bij patiënten met endoscopisch gedefinieerde zweren in de twaalfvingerige darm die tot vier weken werden behandeld, was ACIPHEX vergelijkbaar met omeprazol wat betreft de genezing van zweren in de twaalfvingerige darm. De percentages patiënten met endoscopische genezing na twee en vier weken worden hieronder weergegeven:
ACIPHEX 20 mg en omeprazol waren vergelijkbaar wat betreft het volledig verdwijnen van de symptomen.
De aanbevolen dosering van ACIPHEX 20 mg tabletten met vertraagde afgifte is 20 mg eenmaal daags gedurende 4 weken.
Uitroeiing van Helicobacter pylori bij patiënten met maagzweerziekte of symptomatische niet-ulcusziekte bij volwassenen
Het Amerikaanse multicenteronderzoek was een dubbelblinde vergelijking in parallelle groepen van ACIPHEX-tabletten met vertraagde afgifte, amoxicilline en claritromycine gedurende 3, 7 of 10 dagen versus omeprazol, amoxicilline en claritromycine gedurende 10 dagen. De therapie bestond uit rabeprazol 20 mg tweemaal daags, amoxicilline 1000 mg tweemaal daags en claritromycine 500 mg tweemaal daags (RAC) of omeprazol 20 mg tweemaal daags, amoxicilline 1000 mg tweemaal daags en claritromycine 500 mg tweemaal daags (OAC). Patiënten met een H. pylori-infectie werden gestratificeerd in een verhouding van 1:1 voor degenen met een maagzweer (actief of een voorgeschiedenis van een maagzweer in de afgelopen vijf jaar) [PUD] en degenen die symptomatisch waren maar zonder een maagzweer [NPUD], zoals bepaald door endoscopie van het bovenste deel van het maagdarmkanaal. De totale uitroeiingspercentages van H. pylori, gedefinieerd als negatief 13C-UBT voor H. pylori ≥6 weken vanaf het einde van de behandeling, worden weergegeven in de volgende tabel. De uitroeiingspercentages in de 7-daagse en 10-daagse RAC-regimes bleken vergelijkbaar te zijn met de 10-daagse OAC-regime met ofwel de Intent-to-Treat (ITT) of Per-Protocol (PP) populaties. De eradicatiepercentages in het RAC-regime van 3 dagen waren lager dan bij de andere regimes.
De aanbevolen dosering van ACIPHEX 20 mg tabletten met vertraagde afgifte is tweemaal daags 20 mg met amoxicilline en claritromycine gedurende 7 dagen.
Pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom bij volwassenen
Twaalf patiënten met idiopathische hypersecretie van de maag of het Zollinger-Ellison-syndroom zijn met succes behandeld met ACIPHEX 10 mg tabletten met vertraagde afgifte in doses van 20 tot 120 mg gedurende maximaal 12 maanden. ACIPHEX 10 mg veroorzaakte een bevredigende remming van de maagzuursecretie bij alle patiënten en volledige verdwijning van tekenen en symptomen van zuur-peptische ziekte, indien aanwezig. ACIPHEX 20 mg voorkwam ook herhaling van maaghypersecretie en manifestaties van zuur-peptische ziekte bij alle patiënten. De hoge doses ACIPHEX die werden gebruikt om dit kleine cohort patiënten met maaghypersecretie te behandelen, werden goed verdragen.
De aanbevolen startdosering van ACIPHEX tabletten met vertraagde afgifte is 60 mg eenmaal daags.
REFERENTIES
1. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard: tiende editie. CLSI-document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, VS 2015.
PATIËNT INFORMATIE
ACIPHEX® (a-se-feks) (rabeprazolnatrium) tabletten met vertraagde afgifte
Wat is de belangrijkste informatie die ik moet weten over ACIPHEX 10 mg?
U dient ACIPHEX 20 mg precies zoals voorgeschreven in te nemen, in de laagst mogelijke dosis en voor de kortst mogelijke tijd.
ACIPHEX 20 mg kan helpen bij uw zuurgerelateerde symptomen, maar u kunt nog steeds ernstige maagproblemen hebben. Praat met uw arts.
ACIPHEX 20 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Een type nierprobleem (acute tubulo-interstitiële nefritis). Sommige mensen die geneesmiddelen met protonpompremmers (PPI), waaronder ACIPHEX, gebruiken, kunnen een nierprobleem ontwikkelen dat acute tubulo-interstitiële nefritis wordt genoemd en dat op elk moment tijdens de behandeling met ACIPHEX kan optreden. Bel onmiddellijk uw arts als u minder plast of als u bloed in uw urine heeft.
- Diarree veroorzaakt door een infectie (Clostridium difficile) in uw darmen. Bel onmiddellijk uw arts als u waterige ontlasting of maagpijn heeft die niet weggaat. U kunt wel of geen koorts hebben.
- Botbreuken (heup, pols of wervelkolom). Botbreuken in de heup, pols of wervelkolom kunnen optreden bij mensen die meerdere dagelijkse doses PPI-geneesmiddelen gebruiken en gedurende een lange periode (een jaar of langer). Vertel het uw arts als u een botbreuk heeft, vooral in de heup, pols of wervelkolom.
- Bepaalde soorten lupus erythematosus. Lupus erythematosus is een auto-immuunziekte (de afweercellen van het lichaam vallen andere cellen of organen in het lichaam aan). Sommige mensen die PPI-geneesmiddelen gebruiken, waaronder ACIPHEX, kunnen bepaalde vormen van lupus erythematosus ontwikkelen of de lupus die ze al hebben verergeren. Bel onmiddellijk uw arts als u nieuwe of verergerende gewrichtspijn of uitslag op uw wangen of armen heeft die erger wordt in de zon.
Praat met uw arts over uw risico op deze ernstige bijwerkingen.
ACIPHEX 10 mg kan andere ernstige bijwerkingen hebben. Zie "Wat zijn de mogelijke bijwerkingen van ACIPHEX 10 mg?"
Wat is ACIPHEX 20 mg?
ACIPHEX 10 mg is een receptgeneesmiddel dat een protonpompremmer (PPI) wordt genoemd.
ACIPHEX 20 mg vermindert de hoeveelheid zuur in uw maag.
Bij volwassenen, ACIPHEX wordt gebruikt voor:
- 8 weken tot 16 weken om zuurgerelateerde schade aan het slijmvlies van de slokdarm (erosieve oesofagitis of EE genoemd) te genezen en om symptomen, zoals brandend maagzuur, te verlichten.
- behoud van genezing van de slokdarm en verlichting van symptomen die verband houden met EE. Het is niet bekend of ACIPHEX 20 mg veilig en effectief is bij gebruik langer dan 12 maanden (1 jaar).
- tot 4 weken voor de behandeling van brandend maagzuur overdag en 's nachts en andere symptomen die optreden bij gastro-oesofageale refluxziekte (GERD).
- tot 4 weken voor de genezing en verlichting van symptomen van zweren in de twaalfvingerige darm.
- 7 dagen met bepaalde antibiotische geneesmiddelen voor de behandeling van een infectie en maagzweren (twaalfvingerige darm) veroorzaakt door de bacterie H. pylori.
- de langdurige behandeling van aandoeningen waarbij uw maag te veel zuur aanmaakt. Dit omvat een zeldzame aandoening die het Zollinger-Ellison-syndroom wordt genoemd.
Bij adolescenten van 12 jaar en ouder, ACIPHEX 10 mg wordt tot 8 weken gebruikt om de symptomen van GERD te behandelen.
Het is niet bekend of ACIPHEX veilig en effectief is bij kinderen jonger dan 12 jaar voor ander gebruik.
ACIPHEX-tabletten met vertraagde afgifte mogen niet worden gebruikt bij kinderen jonger dan 12 jaar.
Gebruik ACIPHEX 10 mg niet als u:
- allergisch zijn voor rabeprazol, voor enig ander PPI-geneesmiddel of voor één van de bestanddelen van ACIPHEX. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten.
- het nemen van een geneesmiddel dat rilpivirine bevat (EDURANT, COMPLERA, ODEFSEY) dat wordt gebruikt voor de behandeling van hiv-1 (humaan immunodeficiëntievirus).
Vertel uw arts voordat u ACIPHEX gebruikt over al uw medische aandoeningen, ook als u:
- een laag magnesiumgehalte, laag calciumgehalte en laag kaliumgehalte in uw bloed heeft.
- leverproblemen hebben.
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of ACIPHEX 20 mg schadelijk kan zijn voor uw ongeboren baby.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of ACIPHEX 10 mg in uw moedermelk terechtkomt. Praat met uw arts over de beste manier om uw baby te voeden als u ACIPHEX gebruikt.
Vertel uw arts over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Vertel het vooral aan uw arts als u een antibioticum gebruikt dat claritromycine of amoxicilline bevat of als u warfarine (COUMADIN, JANTOVEN), methotrexaat (OTREXUP, RASUVO, TREXALL, XATMEP), digoxine (LANOXIN) of een waterpil (diureticum) gebruikt.
Hoe moet ik ACIPHEX gebruiken?
- Neem ACIPHEX precies zoals voorgeschreven.
- ACIPHEX wordt gewoonlijk 1 keer per dag ingenomen. Uw arts zal u op basis van uw medische toestand vertellen hoe laat u ACIPHEX moet innemen.
- ACIPHEX 10 mg kan met of zonder voedsel worden ingenomen. Uw arts zal u vertellen of u dit geneesmiddel met of zonder voedsel moet innemen op basis van uw medische toestand.
- Slik elke ACIPHEX 20 mg tablet heel door. ACIPHEX 10 mg tabletten niet kauwen, pletten of splitsen. Vertel het uw arts als u de tabletten niet heel kunt doorslikken.
- Als u een dosis ACIPHEX 10 mg bent vergeten, neem deze dan zo snel mogelijk in. Als het bijna tijd is voor uw volgende dosis, mag u de gemiste dosis niet innemen. U dient uw volgende dosis op uw normale tijdstip in te nemen. Neem geen 2 doses tegelijk.
- Als u te veel ACIPHEX 20 mg heeft ingenomen, bel dan onmiddellijk uw arts of uw antigifcentrum op 1-800-222-1222 of ga naar de dichtstbijzijnde eerste hulpafdeling.
- Als uw arts samen met ACIPHEX antibiotische geneesmiddelen voorschrijft, lees dan de patiënteninformatie die bij de antibiotische geneesmiddelen wordt geleverd voordat u ze inneemt.
Wat zijn de mogelijke bijwerkingen van ACIPHEX 20 mg?
ACIPHEX 10 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Zie "Wat is de belangrijkste informatie die ik moet weten over ACIPHEX 20 mg?"
- Interactie met warfarine. Het gebruik van warfarine met een PPI-medicijn kan leiden tot een verhoogd risico op bloedingen en overlijden. Als u warfarine gebruikt, kan uw arts uw bloed controleren om te zien of u een verhoogd risico op bloedingen heeft. Als u warfarine gebruikt tijdens de behandeling met ACIPHEX 20 mg, vertel het dan onmiddellijk aan uw arts als u tekenen of symptomen van bloeding heeft, waaronder:
- pijn, zwelling of ongemak
- hoofdpijn, duizeligheid of zwakte
- ongewone blauwe plekken (blauwe plekken die ontstaan zonder bekende oorzaak of die groter worden)
- neusbloedingen
- bloedend tandvlees
- bloeden door snijwonden duurt lang om te stoppen
- menstruatiebloeding die zwaarder is dan normaal
- roze of bruine urine
- rode of zwarte ontlasting
- bloed ophoesten
- bloed overgeven of braaksel dat op koffiedik lijkt
- Lage vitamine B12-spiegels in het lichaam kan optreden bij mensen die ACIPHEX 10 mg gedurende een lange tijd (meer dan 3 jaar) hebben gebruikt. Vertel het uw arts als u symptomen heeft van lage vitamine B12-spiegels, waaronder kortademigheid, duizeligheid, onregelmatige hartslag, spierzwakte, bleke huid, vermoeidheid, stemmingswisselingen en tintelingen of gevoelloosheid in de armen en benen.
- Laag magnesiumgehalte in het lichaam kan optreden bij mensen die ACIPHEX 20 mg gedurende ten minste 3 maanden hebben ingenomen. Vertel het uw arts als u symptomen heeft van een laag magnesiumgehalte, waaronder toevallen, duizeligheid, onregelmatige hartslag, zenuwachtigheid, spierpijn of spierzwakte, en spasmen van handen, voeten of stem.
- Maaggroei (fundic gland poliepen). Mensen die gedurende lange tijd PPI-geneesmiddelen gebruiken, hebben een verhoogd risico op het ontwikkelen van een bepaald type maaggroei, de zogenaamde fundusklierpoliepen, vooral na het gebruik van PPI-geneesmiddelen gedurende meer dan 1 jaar.
- Ernstige huidreacties. ACIPHEX kan zeldzame maar ernstige huidreacties veroorzaken die elk deel van uw lichaam kunnen aantasten. Deze ernstige huidreacties moeten mogelijk in een ziekenhuis worden behandeld en kunnen levensbedreigend zijn:
- Huiduitslag met blaarvorming, vervelling of bloeding op elk deel van uw huid (inclusief uw lippen, ogen, mond, neus, geslachtsdelen, handen of voeten).
- U kunt ook koorts, koude rillingen, pijn in het lichaam, kortademigheid of vergrote lymfeklieren hebben.
Stop met het innemen van ACIPHEX 20 mg en bel onmiddellijk uw arts. Deze symptomen kunnen het eerste teken zijn van een ernstige huidreactie.
De meest voorkomende bijwerkingen van ACIPHEX 20 mg bij volwassenen zijn: pijn, keelpijn, gas, infectie en constipatie.
De meest voorkomende bijwerkingen van ACIPHEX bij adolescenten van 12 jaar en ouder zijn: hoofdpijn, diarree, misselijkheid, braken en pijn in de maagstreek (buik).
Dit zijn niet alle mogelijke bijwerkingen van ACIPHEX. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik ACIPHEX bewaren?
Bewaar ACIPHEX-tabletten op een droge plaats bij kamertemperatuur tussen 20 ° C en 25 ° C (68 ° F tot 77 ° F).
Houd ACIPHEX 20 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van ACIPHEX.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik ACIPHEX niet voor een aandoening waarvoor het niet is voorgeschreven. Geef ACIPHEX niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
U kunt uw arts of apotheker om informatie vragen over ACIPHEX die is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in ACIPHEX 10 mg?
Actief ingrediënt: rabeprazol-natrium
Inactieve ingredienten: carnaubawas, crospovidon, gediacetyleerde monoglyceriden, ethylcellulose, hydroxypropylcellulose, hypromelloseftalaat, magnesiumstearaat, mannitol, natriumhydroxide, natriumstearylfumaraat, talk en titaniumdioxide. Geel ijzeroxide is de kleurstof voor de tabletcoating. IJzeroxide rood is het inktpigment.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration. Herzien: 03/2022
