Prevacid 15mg, 30mg Lansoprazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Prevacid en hoe wordt het gebruikt?
Prevacid 15 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van maag- en darmzweren te behandelen en om de hoeveelheid zuur die in de maag wordt geproduceerd te verminderen. Prevacid 15 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Prevacid 15 mg is een protonpompremmer.
Wat zijn de mogelijke bijwerkingen van Prevacid 30 mg?
Prevacid 30 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree met bloed,
- toevallen (convulsies,
- moeite met plassen,
- bloed in uw urine,
- zwelling,
- snelle gewichtstoename,
- duizeligheid,
- snelle of onregelmatige hartslag,
- schudden,
- schokkerige spierbewegingen,
- zenuwachtig voelen,
- spierkrampen of spasmen in uw handen of voeten,
- hoesten,
- het gevoel alsof je stikt,
- gewrichtspijn, en
- huiduitslag op uw wangen of armen die verergert in zonlicht
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Prevacid 15 mg zijn:
- misselijkheid,
- buikpijn,
- diarree,
- constipatie, en
- hoofdpijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Prevacid. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
PREVACID (lansoprazol) oraal uiteenvallende tabletten met vertraagde afgifte
OMSCHRIJVING
Het werkzame bestanddeel in PREVACID 30 mg capsules met vertraagde afgifte en PREVACID 15 mg SoluTab oraal uiteenvallende tabletten met vertraagde afgifte is lansoprazol, een gesubstitueerd benzimidazool, 2-[[[3-methyl-4-(2,2,2trifluorethoxy)-2-pyridyl] methyl]sulfinyl]benzimidazool, een verbinding die de maagzuursecretie remt. De empirische formule is C16H14F3N3O2S met een molecuulgewicht van 369,37. Lansoprazol heeft de volgende structuur:
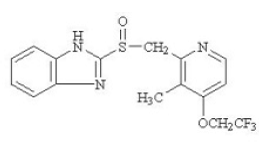
Lansoprazol is een wit tot bruinachtig wit geurloos kristallijn poeder dat bij ongeveer 166°C smelt bij ontleding. Lansoprazol is vrij oplosbaar in dimethylformamide; oplosbaar in methanol; slecht oplosbaar in ethanol; enigszins oplosbaar in ethylacetaat, dichloormethaan en acetonitril; zeer slecht oplosbaar in ether en praktisch onoplosbaar in hexaan en water.
Lansoprazol is stabiel bij blootstelling aan licht gedurende maximaal twee maanden. De afbraaksnelheid van de verbinding in een waterige oplossing neemt toe met afnemende pH. De afbraakhalfwaardetijd van de geneesmiddelsubstantie in een waterige oplossing bij 25°C is ongeveer 0,5 uur bij pH 5,0 en ongeveer 18 uur bij pH 7,0.
PREVACID wordt geleverd in capsules met vertraagde afgifte en PREVACID 15 mg SoluTab wordt geleverd in oraal desintegrerende tabletten met vertraagde afgifte (SoluTab) voor orale toediening.
PREVACID is verkrijgbaar in twee doseringssterktes: 15 en 30 mg lansoprazol per capsule. Elke capsule met vertraagde afgifte bevat maagsapresistente korrels bestaande uit 15 of 30 mg lansoprazol (actief bestanddeel) en de volgende inactieve ingrediënten: suikerbolletjes, sucrose, methacrylzuurcopolymeer, laag gesubstitueerde hydroxypropylcellulose, zetmeel, magnesiumcarbonaat, talk, polyethyleen glycol, titaniumdioxide, polysorbaat 80, hydroxypropylcellulose, colloïdaal siliciumdioxide, D&C Red No. 28, FD&C Blue No. 1, FD&C Green No. 31 en FD&C Red No. 40.
PREVACID 30 mg SoluTab is verkrijgbaar in twee doseringssterkten: 15 en 30 mg lansoprazol per tablet. Elke oraal desintegrerende tablet met vertraagde afgifte bevat microgranulaat met een maagsapresistente coating, bestaande uit 15 of 30 mg lansoprazol (actief bestanddeel) en de volgende inactieve ingrediënten: mannitol, methacrylzuur, hydroxypropylcellulose, lactosemonohydraat-microkristallijne cellulosebolletjes, triethylcitraat, crospovidon, polyacrylaat, magnesiumcarbonaat, aspartaam2, glycerylmonostearaat, hypromellose, magnesiumstearaat, citroenzuur, titaniumdioxide, talk, kunstmatige aardbeiensmaak, polyethyleenglycol, polysorbaat 80 en ijzeroxide.
Alleen PREVACID 15 mg capsules. 2Fenylketonurie: PREVACID SoluTab bevat fenylalanine 2,5 mg per tablet van 15 mg en 5,1 mg per tablet van 30 mg.
INDICATIES
Behandeling van actieve duodenumulcus
PREVACID en PREVACID SoluTab zijn geïndiceerd bij volwassenen voor kortdurende behandeling (gedurende vier weken) voor genezing en symptoomverlichting van actieve darmzweren (zie Klinische studies ].
Uitroeiing van H. pylori om het risico op herhaling van duodenumzweren te verminderen
Drievoudige therapie: PREVACID of PREVACID SoluTab/amoxicilline/claritromycine
PREVACID of PREVACID 30 mg SoluTab in combinatie met amoxicilline plus claritromycine als drievoudige therapie is geïndiceerd bij volwassenen voor de behandeling van patiënten met H. pylori-infectie en zweren van de twaalfvingerige darm (actieve of éénjarige geschiedenis van een zweer in de twaalfvingerige darm) om H. pylori uit te roeien. Het is aangetoond dat de uitroeiing van H. pylori het risico op herhaling van zweren in de twaalfvingerige darm vermindert [zie: Klinische studies ].
Raadpleeg de volledige voorschrijfinformatie voor amoxicilline en claritromycine.
Duale therapie: PREVACID of PREVACID SoluTab/amoxicilline
PREVACID of PREVACID 15 mg SoluTab in combinatie met amoxicilline als tweevoudige therapie is geïndiceerd bij volwassenen voor de behandeling van patiënten met H. pylori-infectie en ulcus duodeni (een actieve of éénjarige zweer van de twaalfvingerige darm) die allergisch of intolerant zijn voor claritromycine of bij wie resistentie tegen claritromycine bekend is of vermoed wordt (zie de voorschrijfinformatie voor claritromycine, rubriek Microbiologie). Het is aangetoond dat de uitroeiing van H. pylori het risico op herhaling van zweren in de twaalfvingerige darm vermindert [zie: Klinische studies ].
Raadpleeg de volledige voorschrijfinformatie voor amoxicilline.
Onderhoud van genezen duodenumzweren
PREVACID en PREVACID SoluTab zijn geïndiceerd bij volwassenen om de genezing van zweren in de twaalfvingerige darm te behouden. Gecontroleerde onderzoeken duren niet langer dan 12 maanden [zie Klinische studies ].
Behandeling van actieve goedaardige maagzweer
PREVACID en PREVACID 30 mg SoluTab zijn geïndiceerd bij volwassenen voor kortdurende behandeling (tot acht weken) voor genezing en symptoomverlichting van actieve goedaardige maagzweren [zie Klinische studies ].
Genezing van NSAID-geassocieerde maagzweer
PREVACID 30 mg en PREVACID SoluTab zijn geïndiceerd bij volwassenen voor de behandeling van NSAID-geassocieerde maagzweren bij patiënten die doorgaan met het gebruik van NSAID's. Gecontroleerde studies duurden niet langer dan acht weken [zie Klinische studies ].
Risicovermindering van NSAID-geassocieerde maagzweren
PREVACID 15 mg en PREVACID SoluTab zijn geïndiceerd bij volwassenen voor het verminderen van het risico op NSAID-geassocieerde maagzweren bij patiënten met een voorgeschiedenis van een gedocumenteerd maagzweer die het gebruik van een NSAID nodig hebben. Gecontroleerde onderzoeken duurden niet langer dan 12 weken [zie Klinische studies ].
Behandeling van symptomatische gastro-oesofageale refluxziekte (GERD)
PREVACID 15 mg en PREVACID 30 mg SoluTab zijn geïndiceerd voor kortdurende behandeling bij volwassenen en pediatrische patiënten van 12 tot 17 jaar (tot acht weken) en pediatrische patiënten van één tot 11 jaar (tot 12 weken) voor de behandeling van brandend maagzuur en andere symptomen geassocieerd met GERD [zie Klinische studies ].
Behandeling van erosieve oesofagitis (EE)
PREVACID 15 mg en PREVACID 30 mg SoluTab zijn geïndiceerd voor kortdurende behandeling bij volwassenen en pediatrische patiënten van 12 tot 17 jaar (tot acht weken) en pediatrische patiënten van één tot 11 jaar (tot 12 weken) voor genezing en symptoomverlichting van alle graden van EE.
Voor volwassenen die gedurende acht weken (5 tot 10%) niet genezen met PREVACID 30 mg of PREVACID 15 mg SoluTab, kan het nuttig zijn om nog eens acht weken behandeling te geven. Als erosieve oesofagitis opnieuw optreedt, kan een aanvullende kuur van acht weken met PREVACID 30 mg of PREVACID SoluTab worden overwogen [zie Klinische studies ].
Onderhoud van genezing van EE
PREVACID en PREVACID SoluTab zijn geïndiceerd bij volwassenen om de genezing van EE te behouden. Gecontroleerde studies duurden niet langer dan 12 maanden [zie Klinische studies ].
Pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom (ZES)
PREVACID 15 mg en PREVACID SoluTab zijn geïndiceerd bij volwassenen voor de langdurige behandeling van pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom [zie Klinische studies ].
DOSERING EN ADMINISTRATIE
Aanbevolen dosering voor volwassenen op indicatie
Aanbevolen pediatrische dosering op indicatie
Pediatrische patiënten van 1 tot 11 jaar oud
In klinische onderzoeken werd PREVACID niet langer dan 12 weken toegediend aan kinderen van 1 tot 11 jaar. Het is niet bekend of PREVACID veilig en effectief is bij langer gebruik dan de aanbevolen duur. De aanbevolen dosis en gebruiksduur bij pediatrische patiënten niet overschrijden, zoals hieronder beschreven [zie: Gebruik bij specifieke populaties ].
Leverfunctiestoornis
De aanbevolen dosering is 15 mg oraal per dag bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh C) [zie: Gebruik bij specifieke populaties ].
Belangrijke administratieve informatie
- Neem PREVACID of PREVACID 30 mg SoluTab in voor de maaltijd.
- Prevacid 15 mg capsule of PREVACID 30 mg SoluTab niet pletten of erop kauwen.
- Neem PREVACID of PREVACID 30 mg SoluTab ten minste 30 minuten vóór sucralfaat [zie DRUG-INTERACTIES ].
- Antacida kunnen gelijktijdig met PREVACID of PREVACID SoluTab worden gebruikt.
- Gemiste doses: Als een dosis wordt gemist, zo snel mogelijk toedienen. Als de volgende geplande dosis echter moet worden ingenomen, neem dan de gemiste dosis niet in en neem de volgende dosis op tijd in. Neem geen twee doses tegelijk om een vergeten dosis in te halen.
PREVACID-capsules
- Geheel doorslikken; niet kauwen.
- Voor patiënten die moeite hebben met het doorslikken van capsules, kunnen PREVACID-capsules worden geopend en oraal of via een maagsonde worden toegediend in de hieronder gespecificeerde zachte voedingsmiddelen of vloeistoffen.
- Toediening van PREVACID in andere voedingsmiddelen of vloeistoffen dan hieronder besproken is niet klinisch onderzocht en wordt daarom niet aanbevolen.
Toediening in Soft Foods (appelmoes, ENSURE pudding, kwark, yoghurt of gezeefde peren):
Toediening in vloeistoffen (appelsap, sinaasappelsap of tomatensap):
Toediening met appelsap via een neussonde (≥16 Frans)
PREVACID 15 mg SoluTab
- Niet breken of snijden.
- Plaats de tablet op de tong, laat deze met of zonder water desintegreren totdat de microkorrels kunnen worden ingeslikt. Kauw niet op de microkorrels.
- De tablet valt meestal in minder dan een minuut uiteen.
- Als alternatief kan PREVACID SoluTab, voor kinderen of andere patiënten die moeite hebben met het doorslikken van tabletten, als volgt met water worden toegediend via een orale spuit of NG-buis:
Toediening met water in een orale spuit
Toediening met water via een NG-buis (≥8 Frans)
HOE GELEVERD
Doseringsvormen en sterke punten
PREVACID 15 mg capsules met vertraagde afgifte
- De sterkte van 15 mg is een ondoorzichtige, roze en groene capsule bedrukt met “TAP” en “PREVACID 15”.
- De sterkte van 30 mg is een ondoorzichtige, roze en zwarte capsule bedrukt met “TAP” en “PREVACID 30”.
PREVACID 30 mg SoluTab oraal desintegrerende tabletten met vertraagde afgifte
- De sterkte van 15 mg is een witte tot geelachtig witte, niet-omhulde ronde tablet met oranje tot donkerbruine spikkels met aan één kant de inscriptie “15”.
- De sterkte van 30 mg is een witte tot geelachtig witte, niet-omhulde ronde tablet met oranje tot donkerbruine spikkels met aan één kant “30”.
Opslag en behandeling
PREVACID capsules met vertraagde afgifte , 15 mg, zijn ondoorzichtig, roze en groen met de opdruk "TAP" en "PREVACID 15" op de capsules. De capsules met vertraagde afgifte van 30 mg zijn ondoorzichtig, roze en zwart met de opdruk “TAP” en “PREVACID 30” op de capsules. Ze zijn als volgt verkrijgbaar:
PREVACID 30 mg SoluTab oraal uiteenvallende tabletten met vertraagde afgifte , 15 mg, zijn witte tot geelachtig witte, ronde, niet-omhulde tabletten met oranje tot donkerbruine spikkels, met de inscriptie “15” aan één kant van de tablet. De 30 mg zijn witte tot geelachtig witte, ronde, niet-omhulde tabletten met oranje tot donkerbruine spikkels, met “30” ingeslagen aan één kant van de tablet. De tabletten zijn als volgt verkrijgbaar:
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP-gecontroleerde kamertemperatuur ].
Gedistribueerd door: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Herzien: juni 2018
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Botbreuk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige cutane bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cutane en systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cyanocobalamine (vitamine B12)-tekort [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypomagnesiëmie en mineraal metabolisme [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Fundische klierpoliepen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Wereldwijd zijn meer dan 10.000 patiënten behandeld met PREVACID 30 mg in klinische fase 2- of fase 3-onderzoeken met verschillende doseringen en behandelingsduur. Over het algemeen werd de behandeling met PREVACID 30 mg goed verdragen in zowel korte- als langetermijnonderzoeken.
De volgende bijwerkingen werden door de behandelend arts gemeld met een mogelijke of waarschijnlijke relatie met het geneesmiddel bij 1% of meer van de met PREVACID behandelde patiënten en kwamen vaker voor bij met PREVACID behandelde patiënten dan met placebo behandelde patiënten in Tabel 1.
Hoofdpijn werd ook gezien met een incidentie van meer dan 1%, maar kwam vaker voor bij placebo. De incidentie van diarree was vergelijkbaar tussen patiënten die placebo kregen en patiënten die 15 en 30 mg PREVACID kregen, maar hoger bij de patiënten die 60 mg PREVACID kregen (respectievelijk 2,9, 1,4, 4,2 en 7,4%).
De meest gemelde mogelijk of waarschijnlijk aan de behandeling gerelateerde bijwerking tijdens onderhoudstherapie was diarree.
In de risicoverminderingsstudie van PREVACID voor NSAID-geassocieerde maagzweren was de incidentie van diarree bij patiënten die werden behandeld met PREVACID 30 mg, misoprostol en placebo respectievelijk 5, 22 en 3%.
Een ander onderzoek voor dezelfde indicatie, waarbij patiënten ofwel een COX-2-remmer ofwel lansoprazol en naproxen gebruikten, toonde aan dat het veiligheidsprofiel vergelijkbaar was met dat van het eerdere onderzoek. Bijkomende reacties van dit onderzoek die niet eerder zijn waargenomen in andere klinische onderzoeken met PREVACID 30 mg waren onder meer kneuzing, duodenitis, epigastrisch ongemak, oesofageale aandoening, vermoeidheid, honger, hiatale hernia, heesheid, verstoorde maaglediging, metaplasie en nierfunctiestoornis.
Aanvullende bijwerkingen die optreden bij minder dan 1% van de patiënten of proefpersonen die PREVACID 15 mg kregen in binnenlandse onderzoeken, worden hieronder weergegeven:
Lichaam als geheel - opgezette buik, allergische reactie, asthenie, rugpijn, candidiasis, carcinoom, pijn op de borst (niet anders gespecificeerd), koude rillingen, oedeem, koorts, griepsyndroom, halitose, infectie (niet anders gespecificeerd), malaise, nekpijn, nekstijfheid, pijn , bekkenpijn
Cardiovasculair systeem - angina, aritmie, bradycardie, cerebrovasculair accident/cerebraal infarct, hypertensie/hypotensie, migraine, myocardinfarct, palpitaties, shock (falen van de bloedsomloop), syncope, tachycardie, vasodilatatie
Spijsverteringsstelsel - abnormale ontlasting, anorexia, bezoar, cardiospasme, cholelithiasis, colitis, droge mond, dyspepsie, dysfagie, enteritis, oprisping, oesofageale stenose, slokdarmzweer, oesofagitis, fecale verkleuring, winderigheid, maagknobbeltjes/fundusklierpoliepen, gastritis, gastro-intestinale klierpoliepen, gastritis, , gastro-intestinale stoornis, gastro-intestinale bloeding, glossitis, tandvleesbloeding, hematemesis, verhoogde eetlust, verhoogde speekselvloed, melena, mondzweren, misselijkheid en braken, misselijkheid en braken en diarree, gastro-intestinale moniliasis, rectale aandoening, rectale bloeding, stomatitis, tenesmus, dorst, tongaandoening, colitis ulcerosa, ulceratieve stomatitis
Endocrien systeem - diabetes mellitus, struma, hypothyreoïdie Hemisch en lymfestelsel - bloedarmoede, hemolyse, lymfadenopathie
Metabolisme en voedingsstoornissen - avitaminose, jicht, uitdroging, hyperglykemie/hypoglykemie, perifeer oedeem, gewichtstoename/-verlies
Musculoskeletaal systeem - artralgie, artritis, botaandoening, gewrichtsaandoening, krampen in de benen, musculoskeletale pijn, myalgie, myasthenie, ptosis, synovitis
Zenuwstelsel - abnormale dromen, agitatie, geheugenverlies, angst, apathie, verwardheid, convulsie, dementie, depersonalisatie, depressie, diplopie, duizeligheid, emotionele labiliteit, hallucinaties, hemiplegie, verergerde vijandigheid, hyperkinesie, hypertonie, hypesthesie, slapeloosheid, verminderd/verhoogd libido, nervositeit, neurose, paresthesie, slaapstoornis, slaperigheid, denkafwijking, tremor, vertigo
Ademhalingssysteem - astma, bronchitis, verhoogde hoest, dyspnoe, bloedneus, bloedspuwing, hik, laryngeale neoplasie, longfibrose, faryngitis, pleurale aandoening, pneumonie, ademhalingsstoornis, bovenste luchtwegontsteking/-infectie, rhinitis, sinusitis, stridor
Huid en aanhangsels - acne, alopecia, contactdermatitis, droge huid, vaste eruptie, haaraandoening, maculopapulaire uitslag, nagelaandoening, pruritus, uitslag, huidcarcinoom, huidaandoening, zweten, urticaria
Speciale zintuigen - abnormaal zicht, amblyopie, blefaritis, wazig zien, cataract, conjunctivitis, doofheid, droge ogen, oor-/oogaandoening, oogpijn, glaucoom, middenoorontsteking, parosmie, fotofobie, retinale degeneratie/-aandoening, smaakverlies, smaakvervorming, tinnitus, visueel velddefect
Urogenitaal systeem - abnormale menstruatie, borstvergroting, borstpijn, gevoelige borsten, dysmenorroe, dysurie, gynaecomastie, impotentie, nierstenen, nierpijn, leukorroe, menorragie, menstruatiestoornis, penisstoornis, polyurie, testisstoornis, urethrale pijn, urinaire frequentie, urineretentie, urineweginfectie, urinaire urgentie, verstoord urineren, vaginitis
Postmarketingervaring
Er zijn aanvullende bijwerkingen gemeld sinds PREVACID en PREVACID 30 mg SoluTab op de markt zijn gebracht. De meeste van deze gevallen zijn van buitenlandse oorsprong en er is geen relatie met PREVACID 15 mg of PREVACID SoluTab vastgesteld. Omdat deze reacties vrijwillig werden gemeld door een populatie van onbekende grootte, kunnen schattingen van de frequentie niet worden gemaakt. Deze gebeurtenissen worden hieronder vermeld per COSTART-lichaamssysteem.
Lichaam als geheel - anafylactische/anafylactoïde reacties, systemische lupus erythematodes;
Spijsverteringsstelsel - hepatotoxiciteit, pancreatitis, braken;
Hemic en lymfatisch systeem - agranulocytose, aplastische anemie, hemolytische anemie, leukopenie, neutropenie, pancytopenie, trombocytopenie en trombotische trombocytopenische purpura;
Infecties en parasitaire aandoeningen - Clostridium difficile-geassocieerde diarree;
Metabolisme en voedingsstoornissen - hypomagnesiëmie, hypocalciëmie, hypokaliëmie, hyponatriëmie;
Musculoskeletaal systeem - botbreuk, myositis;
Huid en aanhangsels - ernstige dermatologische reacties waaronder erythema multiforme, SJS/TEN (sommige fataal), DRESS, AGEP, cutane lupus erythematosus;
Speciale zintuigen - spraakstoornis;
Urogenitaal systeem - interstitiële nefritis, urineretentie.
Combinatietherapie met amoxicilline en claritromycine
In klinische onderzoeken met combinatietherapie met PREVACID plus amoxicilline en claritromycine en PREVACID 30 mg plus amoxicilline werden geen bijwerkingen waargenomen die eigen zijn aan deze geneesmiddelcombinaties. Bijwerkingen die zijn opgetreden, zijn beperkt gebleven tot de bijwerkingen die eerder zijn gemeld met PREVACID 15 mg, amoxicilline of claritromycine.
Drievoudige therapie: PREVACID/amoxicilline/claritromycine
De meest gemelde bijwerkingen bij patiënten die gedurende 14 dagen drievoudige therapie kregen, waren diarree (7%), hoofdpijn (6%) en smaakperversie (5%). Er waren geen statistisch significante verschillen in de frequentie van gemelde bijwerkingen tussen de 10- en 14-daagse drievoudige therapieregimes. Er werden geen tijdens de behandeling optredende bijwerkingen waargenomen met significant hogere percentages bij triple therapie dan bij een dual therapie regime.
Duale therapie: PREVACID/amoxicilline
De meest gemelde bijwerkingen bij patiënten die driemaal daags 30 mg PREVACID plus driemaal daags amoxicilline kregen, waren diarree (8%) en hoofdpijn (7%). Er werden geen tijdens de behandeling optredende bijwerkingen waargenomen met significant hogere percentages met PREVACID 30 mg driemaal daags plus amoxicilline driemaal daags tweevoudige therapie dan met PREVACID 15 mg alleen.
Voor informatie over bijwerkingen met antibacteriële middelen (amoxicilline en claritromycine) die zijn geïndiceerd in combinatie met PREVACID of PREVACID SoluTab, raadpleegt u de rubriek Bijwerkingen van hun voorschrijfinformatie.
Laboratoriumwaarden
De volgende veranderingen in laboratoriumparameters bij patiënten die PREVACID 30 mg kregen, werden gemeld als bijwerkingen:
Abnormale leverfunctietesten, verhoogde SGOT (AST), verhoogde SGPT (ALT), verhoogde creatinine, verhoogde alkalische fosfatase, verhoogde globulinen, verhoogde GGTP, verhoogde/verlaagde/abnormale WBC, abnormale AG-ratio, abnormale RBC, bilirubinemie, verhoogd kalium in het bloed, bloedureum verhoogd, kristalurine aanwezig, eosinofilie, hemoglobine verlaagd, hyperlipemie, verhoogde/verlaagde elektrolyten, verhoogde/verlaagde cholesterol, verhoogde glucocorticoïden, verhoogde LDH, verhoogde/verlaagde/abnormale bloedplaatjes, verhoogde gastrinespiegels en positief fecaal occult bloed. Urine-afwijkingen zoals albuminurie, glycosurie en hematurie werden ook gemeld. Aanvullende geïsoleerde laboratoriumafwijkingen werden gemeld.
In de placebogecontroleerde onderzoeken, toen SGOT (AST) en SGPT (ALT) werden geëvalueerd, hadden de patiënten die respectievelijk placebo en PREVACID kregen van 0,4% (4/978) en 0,4% (11/2677) enzymverhogingen van meer dan driemaal de bovengrens van het normale bereik bij het laatste behandelbezoek. Geen van deze patiënten die PREVACID 30 mg kregen, meldde op enig moment tijdens het onderzoek geelzucht.
In klinische onderzoeken met combinatietherapie met PREVACID 15 mg plus amoxicilline en claritromycine en PREVACID plus amoxicilline werden geen verhoogde laboratoriumafwijkingen waargenomen die specifiek zijn voor deze geneesmiddelcombinaties.
Voor informatie over veranderingen in laboratoriumwaarden met antibacteriële middelen (amoxicilline en claritromycine) die zijn geïndiceerd in combinatie met PREVACID of PREVACID 30 mg SoluTab, raadpleegt u de rubriek Bijwerkingen van hun voorschrijfinformatie.
DRUG-INTERACTIES
Tabellen 2 en 3 bevatten geneesmiddelen met klinisch belangrijke geneesmiddelinteracties en interactie met diagnostiek bij gelijktijdige toediening met PREVACID 15 mg of PREVACID SoluTab en instructies om deze te voorkomen of te behandelen.
Raadpleeg de etikettering van gelijktijdig gebruikte geneesmiddelen voor meer informatie over interacties met PPI's.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Aanwezigheid van maagmaligniteit
Bij volwassenen sluit de symptomatische respons op behandeling met PREVACID 15 mg of PREVACID SoluTab de aanwezigheid van maagkanker niet uit. Overweeg aanvullende follow-up en diagnostische tests bij volwassen patiënten met een suboptimale respons of een vroege symptomatische terugval na voltooiing van de behandeling met een PPI. Overweeg bij oudere patiënten ook een endoscopie.
Acute tubulo-interstitiële nefritis
Acute tubulo-interstitiële nefritis (TIN) is waargenomen bij patiënten die PPI's gebruiken en kan op elk moment tijdens PPI-therapie optreden. Patiënten kunnen verschillende tekenen en symptomen vertonen, van symptomatische overgevoeligheidsreacties tot niet-specifieke symptomen van verminderde nierfunctie (bijv. malaise, misselijkheid, anorexia). In gerapporteerde casusreeksen werd bij sommige patiënten de diagnose gesteld op basis van biopsie en bij afwezigheid van extrarenale manifestaties (bijv. koorts, huiduitslag of artralgie). Stop met PREVACID of PREVACID 15 mg SoluTab en evalueer patiënten met verdenking op acute TIN [zie CONTRA-INDICATIES ].
Clostridium Difficile-geassocieerde diarree
Gepubliceerde observationele studies suggereren dat PPI-therapie zoals PREVACID 30 mg en PREVACID 30 mg SoluTab in verband kunnen worden gebracht met een verhoogd risico op Clostridium difficile-geassocieerde diarree (CDAD), vooral bij gehospitaliseerde patiënten. Deze diagnose moet worden overwogen voor diarree die niet verbetert [zie ONGEWENSTE REACTIES ].
Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld.
CDAD is gemeld bij gebruik van bijna alle antibacteriële middelen. Voor meer specifieke informatie over antibacteriële middelen (claritromycine en amoxicilline) die zijn geïndiceerd voor gebruik in combinatie met PREVACID 15 mg of PREVACID 15 mg SoluTab, raadpleegt u de rubriek Waarschuwingen en voorzorgsmaatregelen van hun voorschrijfinformatie.
Bot fractuur
Verschillende gepubliceerde observationele studies suggereren dat PPI-therapie geassocieerd kan zijn met een verhoogd risico op osteoporose-gerelateerde fracturen van de heup, pols of wervelkolom. Het risico op fracturen was verhoogd bij patiënten die een hoge dosis kregen, gedefinieerd als meerdere dagelijkse doses, en langdurige PPI-therapie (een jaar of langer). Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld. Patiënten met een risico op osteoporose-gerelateerde fracturen moeten worden behandeld volgens vastgestelde behandelrichtlijnen [zie: DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES ].
Ernstige cutane bijwerkingen
Ernstige cutane bijwerkingen, waaronder Stevens-Johnson-syndroom (SJS) en toxische epidermale necrolyse (TEN), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) en acute gegeneraliseerde exanthemateuze pustulose (AGEP) zijn gemeld in verband met het gebruik van PPI's [zien ONGEWENSTE REACTIES ]. Stop met PREVACID 30 mg of PREVACID SoluTab bij de eerste tekenen of symptomen van ernstige huidbijwerkingen of andere tekenen van overgevoeligheid en overweeg verdere evaluatie.
Cutane en systemische lupus erythematosus
Cutane lupus erythematodes (CLE) en systemische lupus erythematodes (SLE) zijn gemeld bij patiënten die PPI's gebruikten, waaronder lansoprazol. Deze voorvallen zijn opgetreden als zowel nieuw begin als een verergering van een bestaande auto-immuunziekte. De meeste PPI-geïnduceerde gevallen van lupus erythematosus waren CLE.
De meest voorkomende vorm van CLE die werd gemeld bij patiënten die met PPI's werden behandeld, was subacute CLE (SCLE) en trad op binnen weken tot jaren na continue medicamenteuze behandeling bij patiënten variërend van zuigelingen tot ouderen. Over het algemeen werden histologische bevindingen waargenomen zonder orgaanbetrokkenheid.
Systemische lupus erythematosus (SLE) wordt minder vaak gemeld dan CLE bij patiënten die PPI's krijgen. PPI-geassocieerde SLE is meestal milder dan niet-medicamenteuze SLE. Het begin van SLE trad meestal op binnen enkele dagen tot jaren na het starten van de behandeling, voornamelijk bij patiënten variërend van jongvolwassenen tot ouderen. De meerderheid van de patiënten vertoonde huiduitslag; er werden echter ook artralgie en cytopenie gemeld.
Vermijd toediening van PPI's langer dan medisch geïndiceerd. Als er tekenen of symptomen zijn die overeenkomen met CLE of SLE bij patiënten die PREVACID 15 mg of PREVACID SoluTab krijgen, stop dan met het geneesmiddel en verwijs de patiënt naar de juiste specialist voor evaluatie. De meeste patiënten verbeteren na stopzetting van de PPI alleen in vier tot twaalf weken. Serologische testen (bijv. ANA) kunnen positief zijn en verhoogde serologische testresultaten kunnen langer duren om op te lossen dan klinische manifestaties.
Cyanocobalamine (vitamine B12)-tekort
Dagelijkse behandeling met zuurremmende medicijnen gedurende een lange periode (bijv. langer dan drie jaar) kan leiden tot malabsorptie van cyanocobalamine (vitamine B12) veroorzaakt door hypo- of achloorhydrie. In de literatuur zijn zeldzame meldingen van cyanocobalaminedeficiëntie die optreden bij zuuronderdrukkende therapie gemeld. Deze diagnose moet worden overwogen als klinische symptomen worden waargenomen die overeenkomen met cyanocobalaminedeficiëntie bij patiënten die worden behandeld met PREVACID of PREVACID SoluTab.
Hypomagnesiëmie en mineraal metabolisme
Hypomagnesiëmie, symptomatisch en asymptomatisch, is zelden gemeld bij patiënten die gedurende ten minste drie maanden met PPI's werden behandeld, in de meeste gevallen na een jaar therapie. Ernstige bijwerkingen zijn onder meer tetanie, aritmieën en toevallen. Hypomagnesiëmie kan leiden tot hypocalciëmie en/of hypokaliëmie en kan onderliggende hypocalciëmie verergeren bij risicopatiënten. Bij de meeste patiënten vereiste de behandeling van hypomagnesiëmie magnesiumvervanging en stopzetting van de PPI.
Voor patiënten die naar verwachting langdurig worden behandeld of die PPI's gebruiken met medicijnen zoals digoxine of geneesmiddelen die hypomagnesiëmie kunnen veroorzaken (bijv. Diuretica), kunnen beroepsbeoefenaren in de gezondheidszorg overwegen om de magnesiumspiegels te controleren voorafgaand aan de start van de PPI-behandeling en periodiek [zie ONGEWENSTE REACTIES ].
Overweeg om de magnesium- en calciumspiegels te controleren voordat wordt gestart met PREVACID 30 mg of PREVACID SoluTab en periodiek tijdens de behandeling bij patiënten met een reeds bestaand risico op hypocalciëmie (bijv. hypoparathyreoïdie). Eventueel aanvullen met magnesium en/of calcium. Als hypocalciëmie ongevoelig is voor behandeling, overweeg dan om de PPI te staken.
Interacties met onderzoeken naar neuro-endocriene tumoren
Serum chromogranine A (CgA) niveaus stijgen secundair aan geneesmiddel-geïnduceerde dalingen in maagzuur. Het verhoogde CgA-niveau kan vals-positieve resultaten veroorzaken bij diagnostisch onderzoek naar neuro-endocriene tumoren. Zorgverleners moeten de behandeling met lansoprazol ten minste 14 dagen voor de beoordeling van de CgA-spiegels tijdelijk stopzetten en overwegen de test te herhalen als de initiële CgA-spiegels hoog zijn. Als seriële tests worden uitgevoerd (bijv. voor monitoring), moet hetzelfde commerciële laboratorium worden gebruikt voor het testen, aangezien de referentiebereiken tussen tests kunnen variëren [zie DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
Interactie met methotrexaat
Literatuur suggereert dat gelijktijdig gebruik van PPI's met methotrexaat (voornamelijk in hoge doses) de serumspiegels van methotrexaat en/of zijn metaboliet kan verhogen en verlengen, wat mogelijk kan leiden tot methotrexaattoxiciteit. Bij toediening van een hoge dosis methotrexaat kan bij sommige patiënten een tijdelijke stopzetting van de PPI worden overwogen [zie: DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
Patiënten met fenylketonurie
Fenylalanine kan schadelijk zijn voor patiënten met fenylketonurie (PKU). PREVACID 30 mg SoluTab bevat fenylalanine, een bestanddeel van aspartaam. Elke tablet van 15 mg bevat 2,5 mg en elke tablet van 30 mg bevat 5,1 mg fenylalanine. Voordat u PREVACID SoluTab aan een patiënt met PKU voorschrijft, moet u rekening houden met de gecombineerde dagelijkse hoeveelheid fenylalanine uit alle bronnen, inclusief PREVACID 30 mg SoluTab.
Fundische klierpoliepen
Het gebruik van PPI wordt in verband gebracht met een verhoogd risico op poliepen van de fundusklier dat toeneemt bij langdurig gebruik, vooral na een jaar. De meeste PPI-gebruikers die fundusklierpoliepen ontwikkelden, waren asymptomatisch en fundusklierpoliepen werden incidenteel vastgesteld op endoscopie. Gebruik de kortste duur van PPI-therapie die geschikt is voor de aandoening die wordt behandeld.
Risico op verdikking van de hartklep bij pediatrische patiënten jonger dan één jaar
PREVACID 30 mg en PREVACID SoluTab zijn niet goedgekeurd bij pediatrische patiënten jonger dan één jaar. Niet-klinische onderzoeken bij jonge ratten met lansoprazol hebben een nadelig effect van hartklepverdikking aangetoond. Het risico op hartklepbeschadiging lijkt niet relevant voor patiënten van één jaar en ouder [zie Gebruik bij specifieke populaties ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids en Gebruiksaanwijzing ).
Adviseer patiënten om:
Acute tubulo-interstitiële nefritis
Om hun zorgverlener te bellen als ze tekenen en/of symptomen ervaren die verband houden met acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Clostridium Difficile-geassocieerde diarree
Om onmiddellijk hun zorgverlener te bellen als ze diarree krijgen die niet verbetert [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bot fractuur
Om eventuele breuken, met name van de heup, pols of wervelkolom, aan hun zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ernstige cutane bijwerkingen
Om te stoppen met PREVACID of PREVACID 30 mg SoluTab en onmiddellijk hun zorgverlener te bellen voor verdere evaluatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cutane en systemische lupus erythematosus
Om onmiddellijk hun zorgverlener te bellen voor nieuwe of verergering van symptomen geassocieerd met cutane of systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cyanocobalamine (vitamine B12)-tekort
 Om klinische symptomen die verband kunnen houden met cyanocobalaminedeficiëntie aan hun zorgverlener te melden, als ze PREVACID of PREVACID SoluTab langer dan drie jaar krijgen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypomagnesiëmie en mineraal
Metabolisme Om klinische symptomen die geassocieerd kunnen zijn met hypomagnesiëmie, hypocalciëmie en/of hypokaliëmie aan hun zorgverlener te melden, als ze PREVACID of PREVACID 15 mg SoluTab gedurende ten minste drie maanden hebben gekregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelinteracties
Adviseer patiënten om hun zorgverlener te melden als ze rilpivirine-bevattende producten gebruiken [zie: CONTRA-INDICATIES ] of een hoge dosis methotrexaat [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zwangerschap
Adviseer een zwangere vrouw over het mogelijke risico voor een foetus. Adviseer vrouwen met reproductief potentieel om hun zorgverlener op de hoogte te stellen van een bekende of vermoede zwangerschap [zie: Gebruik bij specifieke populaties ].
Administratie
- Gemiste doses: Als een dosis wordt gemist, zo snel mogelijk toedienen. Als de volgende geplande dosis echter moet worden ingenomen, neem dan de gemiste dosis niet in en neem de volgende dosis op tijd in. Neem geen twee doses tegelijk om een vergeten dosis in te halen.
- PREVACID of PREVACID 30 mg SoluTab moet voor het eten worden ingenomen.
- Prevacid 15 mg capsule of PREVACID SoluTab niet pletten of erop kauwen.
- Neem PREVACID of PREVACID 30 mg SoluTab ten minste 30 minuten vóór sucralfaat in.
- Fenylketonurie: bevat fenylalanine 2,5 mg per 15 mg PREVACID 30 mg SoluTab-tablet en 5,1 mg per 30 mg PREVACID SoluTab-tablet.
PREVACID-capsules
- Geheel doorslikken; niet kauwen.
- Voor patiënten die moeite hebben met het doorslikken van capsules:
- PREVACID 15 mg capsules kunnen worden geopend en over appelmoes, ENSURE pudding, kwark, yoghurt of gezeefde peren worden gestrooid
- PREVACID 15 mg capsules kunnen ook worden geleegd in een kleine hoeveelheid appelsap, sinaasappelsap of tomatensap
- Als alternatief kunnen PREVACID-capsules worden toegediend met appelsap via een maagsonde
- Zie de gebruiksaanwijzing voor een beschrijving van alle bereidings- en toedieningsinstructies
PREVACID SoluTab
- Niet breken of snijden.
- Plaats de tablet op de tong; laat het desintegreren, met of zonder water, totdat de deeltjes kunnen worden ingeslikt. Kauw niet op de deeltjes.
- De tablet valt meestal in minder dan een minuut uiteen.
- Als alternatief kan PREVACID 30 mg SoluTab, voor kinderen of andere patiënten die moeite hebben met het doorslikken van tabletten, worden toegediend met water via een orale spuit of NG-slang, zoals beschreven in de gebruiksaanwijzing.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In twee carcinogeniteitsstudies van 24 maanden werden Sprague-Dawley-ratten behandeld met orale doses lansoprazol van 5 tot 150 mg/kg/dag, ongeveer één tot 40 keer de blootstelling op het lichaamsoppervlak (mg/m²) van een persoon van 50 kg. van gemiddelde lengte [1,46 m² lichaamsoppervlak (BSA)] gegeven de aanbevolen dosis voor de mens van 30 mg/dag. Lansoprazol veroorzaakte dosisgerelateerde maag-enterochromaffine-achtige (ECL) celhyperplasie en ECL-celcarcinoïden bij zowel mannelijke als vrouwelijke ratten. Het verhoogde ook de incidentie van intestinale metaplasie van het maagepitheel bij beide geslachten. Bij mannelijke ratten veroorzaakte lansoprazol een dosisgerelateerde toename van adenomen van de testiculaire interstitiële cellen. De incidentie van deze adenomen bij ratten die doses kregen van 15 tot 150 mg/kg/dag (vier tot 40 keer de aanbevolen dosis voor de mens op basis van BSA) overschreed de lage achtergrondincidentie (bereik = 1,4 tot 10%) voor deze rattenstam.
In een carcinogeniteitsonderzoek van 24 maanden werden CD-1-muizen behandeld met orale doses lansoprazol van 15 tot 600 mg/kg/dag, twee tot 80 keer de aanbevolen dosis voor mensen op basis van lichaamsoppervlak. Lansoprazol veroorzaakte een dosisgerelateerde verhoogde incidentie van maag-ECL-celhyperplasie. Het veroorzaakte ook een verhoogde incidentie van levertumoren (hepatocellulair adenoom plus carcinoom). De tumorincidentie bij mannelijke muizen die werden behandeld met 300 en 600 mg/kg/dag (40 tot 80 keer de aanbevolen dosis voor mensen op basis van lichaamsoppervlakte) en vrouwelijke muizen die werden behandeld met 150 tot 600 mg/kg/dag (20 tot 80 keer de aanbevolen dosis voor mensen dosis gebaseerd op BSA) overschreed de reeksen van achtergrondincidenties in historische controles voor deze muizenstam. Behandeling met lansoprazol veroorzaakte adenoom van rete testis bij mannelijke muizen die 75 tot 600 mg/kg/dag kregen (10 tot 80 keer de aanbevolen dosis voor mensen op basis van lichaamsoppervlak).
Een 26 weken durende p53 (+/-) transgene carcinogeniteitsstudie bij muizen was niet positief.
Lansoprazol was positief in de Ames-test en de in vitro-test op chromosoomafwijkingen van menselijke lymfocyten. Lansoprazol was niet genotoxisch in de ex vivo rat hepatocyte ongeplande DNA-synthese (UDS) test, de in vivo muis micronucleus test, of de rat beenmergcel chromosomale aberratietest.
Lansoprazol bij orale doses tot 150 mg/kg/dag (40 maal de aanbevolen dosis voor mensen op basis van lichaamsoppervlak) bleek geen effect te hebben op de vruchtbaarheid en reproductieprestaties van mannelijke en vrouwelijke ratten.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beschikbare gegevens van gepubliceerde observationele onderzoeken wijzen in het algemeen niet op een verband tussen nadelige zwangerschapsuitkomsten en behandeling met lansoprazol (zie: Gegevens ).
In reproductiestudies bij dieren veroorzaakte orale toediening van lansoprazol aan ratten tijdens organogenese tot en met lactatie met 6,4 maal de maximaal aanbevolen dosis voor de mens een vermindering van het dijbeengewicht, de lengte van het dijbeen, de lengte van de kruin en de dikte van de groeischijf (alleen mannen) op de postnatale dag. 21 (zie Gegevens ). Deze effecten waren geassocieerd met een vermindering van de toename van het lichaamsgewicht. Adviseer zwangere vrouwen over het mogelijke risico voor de foetus.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2 tot 4% en 15 tot 20%.
Als PREVACID 15 mg of PREVACID 15 mg SoluTab wordt toegediend met claritromycine, is de zwangerschapsinformatie voor claritromycine ook van toepassing op het combinatieschema. Raadpleeg de voorschrijfinformatie voor claritromycine voor meer informatie over gebruik tijdens de zwangerschap.
Gegevens
Menselijke gegevens
Beschikbare gegevens van gepubliceerde observationele onderzoeken konden geen verband aantonen tussen nadelige zwangerschapsgerelateerde uitkomsten en het gebruik van lansoprazol. Methodologische beperkingen van deze observationele onderzoeken kunnen geen enkel geneesmiddelgeassocieerd risico tijdens de zwangerschap definitief vaststellen of uitsluiten. In een prospectieve studie door het European Network of Teratology Information Services werden de resultaten van een groep van 62 zwangere vrouwen die mediane dagelijkse doses van 30 mg lansoprazol kregen, vergeleken met een controlegroep van 868 zwangere vrouwen die geen PPI's gebruikten. Er was geen verschil in het percentage ernstige misvormingen tussen vrouwen die werden blootgesteld aan PPI's en de controlegroep, wat overeenkomt met een relatief risico (RR) = 1,04, [95% betrouwbaarheidsinterval (BI) 0,25-4,21]. In een populatiegebaseerd retrospectief cohortonderzoek dat alle levendgeborenen in Denemarken van 1996 tot 2008 omvatte, was er geen significante toename van ernstige geboorteafwijkingen tijdens de analyse van de blootstelling in het eerste trimester aan lansoprazol bij 794 levendgeborenen. Een meta-analyse die 1.530 zwangere vrouwen die in ten minste het eerste trimester aan PPI's waren blootgesteld, vergeleek met 133.410 niet-blootgestelde zwangere vrouwen, toonde geen significante toename van het risico op aangeboren misvormingen of spontane abortus bij blootstelling aan PPI's (voor ernstige misvormingen Odds Ratio (OR) = 1,12 , [95% BI 0,86-1,45] en voor spontane abortussen OR=1,29, [95% BI 0,841,97]).
Dierlijke gegevens
Er traden geen nadelige effecten op de embryo-foetale ontwikkeling op in onderzoeken uitgevoerd bij zwangere ratten bij orale doses lansoprazol tot 150 mg/kg/dag (40 maal de aanbevolen dosis voor de mens [30 mg/dag] op basis van lichaamsoppervlak) toegediend tijdens organogenese en zwangere konijnen bij orale doses lansoprazol tot 30 mg/kg/dag (16 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) toegediend tijdens de organogenese.
Een pre- en postnatale ontwikkelingstoxiciteitsstudie bij ratten met aanvullende eindpunten om de botontwikkeling te evalueren, werd uitgevoerd met lansoprazol in orale doses van 10 tot 100 mg/kg/dag (0,7 tot 6,4 maal de maximaal aanbevolen humane lansoprazoldosis van 30 mg op basis van AUC [gebied onder de plasmaconcentratie-tijdcurve]) toegediend tijdens organogenese tot en met borstvoeding. De maternale effecten die werden waargenomen bij 100 mg/kg/dag (6,4 maal de maximaal aanbevolen dosis lansoprazol voor mensen van 30 mg op basis van de AUC) omvatten een langere draagtijd, verminderde lichaamsgewichtstoename tijdens de zwangerschap en verminderde voedselconsumptie. Het aantal doodgeborenen was bij deze dosis verhoogd, wat mogelijk secundair was aan maternale toxiciteit. Het lichaamsgewicht van de pups was verminderd met 100 mg/kg/dag vanaf postnatale dag 11. Het dijbeengewicht, de dijbeenlengte en de lengte van de kruin waren verminderd met 100 mg/kg/dag op postnatale dag 21. Het dijbeengewicht was nog steeds verlaagd in de 100 mg/kg/dag-groep op de leeftijd van 17 tot 18 weken. De dikte van de groeischijf was afgenomen bij de mannen van 100 mg/kg/dag op postnatale dag 21 en was toegenomen bij de mannen van 30 en 100 mg/kg/dag op de leeftijd van 17 tot 18 weken. De effecten op botparameters waren geassocieerd met een afname van de toename van het lichaamsgewicht.
Borstvoeding
Risico Samenvatting
Er is geen informatie over de aanwezigheid van lansoprazol in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Lansoprazol en zijn metabolieten zijn echter aanwezig in rattenmelk. Er moet rekening worden gehouden met de ontwikkelings- en gezondheidsvoordelen van borstvoeding, samen met de klinische behoefte van de moeder aan PREVACID 30 mg of PREVACID 30 mg SoluTab en eventuele nadelige effecten op het kind dat borstvoeding krijgt van PREVACID 30 mg of PREVACID SoluTab of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van PREVACID 15 mg en PREVACID 30 mg SoluTab zijn vastgesteld bij pediatrische patiënten van één jaar tot 17 jaar voor kortdurende behandeling van symptomatische GORZ en erosieve oesofagitis.
In klinische onderzoeken naar symptomatische GORZ en erosieve oesofagitis werd PREVACID 30 mg niet langer dan 12 weken toegediend aan patiënten van één jaar tot 11 jaar oud. Het is niet bekend of PREVACID 30 mg en PREVACID SoluTab veilig en effectief zijn bij langer gebruik dan de aanbevolen duur. De aanbevolen dosis en gebruiksduur bij pediatrische patiënten niet overschrijden (zie: Gegevens over toxiciteit bij jonge dieren ).
PREVACID was niet effectief bij pediatrische patiënten met symptomatische GERD van één maand tot minder dan één jaar oud in een multicenter, dubbelblind, placebogecontroleerd onderzoek. Daarom zijn de veiligheid en werkzaamheid niet vastgesteld bij patiënten jonger dan één jaar. Niet-klinische onderzoeken bij jonge ratten hebben een nadelig effect aangetoond van hartklepverdikking en botveranderingen bij doses lansoprazol die hoger zijn dan de maximaal aanbevolen equivalente dosis voor de mens.
Pasgeboren tot minder dan een jaar oud
De farmacokinetiek van lansoprazol is onderzocht bij pediatrische patiënten met GORZ in de leeftijd van minder dan 28 dagen en één tot 11 maanden. Vergeleken met gezonde volwassenen die 30 mg kregen, hadden pasgeborenen een hogere blootstelling (gemiddelde op gewicht gebaseerde genormaliseerde AUC-waarden 2,04 en 1,88 maal hoger bij doses van respectievelijk 0,5 en 1 mg/kg/dag). Zuigelingen van ≤ 10 weken hadden klarings- en blootstellingswaarden die vergelijkbaar waren met die van pasgeborenen. Zuigelingen ouder dan 10 weken die 1 mg/kg/dag kregen, hadden gemiddelde AUC-waarden die vergelijkbaar waren met die van volwassenen die een dosis van 30 mg kregen.
Lansoprazol bleek niet effectief te zijn in een vier weken durende, multicenter, dubbelblinde, placebogecontroleerde studie met parallelle groepen van 162 patiënten met symptomatische GORZ met symptomatische GORZ, gebaseerd op een medische voorgeschiedenis. van huilen/ophef/prikkelbaarheid geassocieerd met voedingen die zeven tot veertien dagen niet hadden gereageerd op conservatieve GERD-behandeling (dwz niet-farmacologische interventie). Patiënten ontvangen
lansoprazol als suspensie dagelijks (0,2 tot 0,3 mg/kg/dag bij zuigelingen ≤ 10 weken oud of 1,0 tot 1,5 mg/kg/dag bij zuigelingen ouder dan 10 weken of placebo) gedurende maximaal vier weken dubbelblinde behandeling.
Het primaire werkzaamheidseindpunt werd beoordeeld door een reductie van meer dan 50% ten opzichte van de uitgangswaarde in ofwel het percentage voedingen met een episode van huilen/ophef/prikkelbaarheid of de duur (minuten) van een episode van huilen/ophef/prikkelbaarheid binnen één uur na het voeden.
Er was geen verschil in het percentage responders tussen de lansoprazol pediatrische suspensiegroep en de placebogroep (54% in beide groepen).
Er zijn geen bijwerkingen gemeld in pediatrische klinische onderzoeken (van een maand tot minder dan 12 maanden oud) die niet eerder werden waargenomen bij volwassenen.
Op basis van de resultaten van het fase 3-werkzaamheidsonderzoek bleek lansoprazol niet werkzaam te zijn. Daarom ondersteunen deze resultaten het gebruik van lansoprazol bij de behandeling van symptomatische GORZ bij zuigelingen niet.
Een jaar tot 11 jaar oud
In een ongecontroleerd, open-label, multicenter onderzoek in de VS kregen 66 pediatrische patiënten (van 1 jaar tot 11 jaar) met GERD, op basis van lichaamsgewicht, een aanvangsdosis van ofwel PREVACID 15 mg per dag als ≤30 kg of PREVACID 30 mg per dag indien meer dan 30 kg toegediend gedurende acht tot twaalf weken. De dosis PREVACID werd verhoogd (tot 30 mg tweemaal daags) bij 24 van de 66 pediatrische patiënten na twee of meer weken behandeling als ze symptomatisch bleven. Bij aanvang had 85% van de patiënten milde tot matige algemene GERD-symptomen (beoordeeld door een interview met de onderzoeker), 58% had niet-erosieve GORZ en 42% had erosieve oesofagitis (beoordeeld door endoscopie).
Na acht tot twaalf weken behandeling met PREVACID 15 mg, toonde de intent-to-treat-analyse een afname van ongeveer 50% in frequentie en ernst van GERD-symptomen.
Eenentwintig van de 27 patiënten met erosieve oesofagitis werden genezen na acht weken en 100% van de patiënten werden genezen na 12 weken door middel van endoscopie (Tabel 4).
In een onderzoek onder 66 pediatrische patiënten in de leeftijdsgroep van één jaar tot 11 jaar oud na behandeling met PREVACID 15 mg oraal toegediend in doses van 15 mg per dag tot 30 mg tweemaal per dag, waren de stijgingen van de serumgastrinespiegels vergelijkbaar met die waargenomen in onderzoeken bij volwassenen. De mediane nuchtere serumgastrinespiegels stegen met 89% van 51 pg/ml bij baseline tot 97 pg/ml [interkwartielbereik (25e tot 75e percentiel) van 71 tot 130 pg/ml] bij het laatste bezoek.
De pediatrische veiligheid van PREVACID 30 mg capsules is beoordeeld bij 66 pediatrische patiënten in de leeftijd van 1 tot 11 jaar. Van de 66 patiënten met GERD nam 85% (56/66) PREVACID 30 mg gedurende acht weken en 15% (10/66) nam het gedurende 12 weken.
De meest frequent gemelde (twee of meer patiënten) behandelingsgerelateerde bijwerkingen bij patiënten van één tot 11 jaar (N=66) waren constipatie (5%) en hoofdpijn (3%).
Twaalf jaar tot 17 jaar oud
In een ongecontroleerd, open-label, multicenter onderzoek in de VS werden 87 adolescente patiënten (12 jaar tot 17 jaar) met symptomatische GORZ gedurende acht tot twaalf weken behandeld met PREVACID. Bij baseline bovenste endoscopieën werden deze patiënten in twee groepen ingedeeld: 64 (74%) niet-erosieve GERD en 23 (26%) erosieve oesofagitis (EE). De niet-erosieve GERD-patiënten kregen PREVACID 15 mg per dag gedurende acht weken en de EE-patiënten kregen PREVACID 30 mg per dag gedurende acht tot twaalf weken. Bij aanvang had 89% van deze patiënten milde tot matige algemene GERD-symptomen (beoordeeld door interviews met de onderzoeker). Tijdens acht weken behandeling met PREVACID 15 mg ondervonden adolescente patiënten een vermindering van 63% in frequentie en een vermindering van 69% in ernst van GORZ-symptomen op basis van dagboekresultaten.
Eenentwintig van de 22 (95,5%) adolescente patiënten met erosieve oesofagitis waren genezen na acht weken behandeling met PREVACID 15 mg. Eén patiënt bleef ongenezen na 12 weken behandeling (Tabel 5).
Bij deze 87 adolescente patiënten waren de stijgingen van de serumgastrinespiegels vergelijkbaar met die waargenomen in onderzoeken bij volwassenen, de mediane nuchtere serumgastrinespiegels stegen met 42% van 45 pg/ml bij baseline tot 64 pg/ml [interkwartielbereik (25e tot 75e percentiel) van 44 tot 88 pg/ml] bij het laatste bezoek. (Normale serumgastrinespiegels zijn 25 tot 111 pg/ml.)
De veiligheid van PREVACID-capsules is onderzocht bij deze 87 adolescente patiënten. Van de 87 adolescente patiënten met GERD nam 6% (5/87) PREVACID 15 mg gedurende minder dan zes weken, 93% (81/87) gedurende zes tot 10 weken en 1% (1/87) gedurende meer dan 10 weken .
De meest frequent gemelde (ten minste 3%) behandelingsgerelateerde bijwerkingen bij deze patiënten waren hoofdpijn (7%), buikpijn (5%), misselijkheid (3%) en duizeligheid (3%). Aan de behandeling gerelateerde duizeligheid, in deze voorschrijfinformatie gerapporteerd als optredend bij minder dan 1% van de volwassen patiënten, werd in dit onderzoek gemeld door drie adolescente patiënten met niet-erosieve GORZ, die gelijktijdig met andere reacties (zoals migraine, dyspneu, en braken).
Gegevens over toxiciteit bij jonge dieren
Hartklepverdikking
In twee orale toxiciteitsstudies trad verdikking van de mitralisklep op bij juveniele ratten die werden behandeld met lansoprazol. Hartklepverdikking werd voornamelijk waargenomen bij orale toediening gestart op dag 7 postnataal (leeftijd gelijk aan neonatale mens) en postnataal dag 14 (menselijke leeftijd equivalent van ongeveer een jaar) bij doses van 250 mg/kg/dag en hoger (op dag 7 postnataal). en postnatale dag 14, respectievelijk 6,2 maal en 4,2 maal de dagelijkse pediatrische dosis van 15 mg bij pediatrische patiënten van 1 tot 11 jaar die 30 kg of minder wegen, op basis van de AUC). De duur van de behandeling in verband met verdikking van de hartklep varieerde van 5 dagen tot 8 weken. De bevindingen keerden om of neigden naar omkeerbaarheid na een herstelperiode van 4 weken zonder medicijnen. De incidentie van hartklepverdikking na aanvang van de dosering op postnatale dag 21 (menselijke leeftijdsequivalent van ongeveer twee jaar) was beperkt tot een enkele rat (1/24) in groepen die 500 mg/kg/dag kregen gedurende 4 of 8 weken (ongeveer 5,2 maal de dagelijkse pediatrische dosis van 15 mg bij pediatrische patiënten van 1 tot 11 jaar die 30 kg of minder wegen, op basis van de AUC). Op basis van blootstellingsmarges lijkt het risico op hartklepbeschadiging niet relevant voor patiënten van één jaar en ouder.
Botveranderingen
In een oraal toxiciteitsonderzoek van acht weken bij juveniele ratten waarbij de dosering werd gestart op postnatale dag 7, werden doses gelijk aan of groter dan 100 mg/kg/dag (2,5 maal de dagelijkse pediatrische dosis van 15 mg bij kinderen van 1 tot 11 jaar met een gewicht van 30). kg of minder, gebaseerd op de AUC) veroorzaakte een vertraagde groei, waarbij de gewichtstoename al op dag 10 postnataal werd waargenomen (leeftijd gelijk aan neonatale mensen). Aan het einde van de behandeling waren de tekenen van verminderde groei bij 100 mg/kg/dag en hoger: afname van lichaamsgewicht (14 tot 44% vergeleken met controles), absoluut gewicht van meerdere organen, femurgewicht, femurlengte en kroon- romp lengte. De dikte van de femurgroeischijf was alleen verminderd bij mannen en alleen bij de dosis van 500 mg/kg/dag. De effecten van vertraagde groei hielden aan tot het einde van de herstelperiode van vier weken. Gegevens op langere termijn werden niet verzameld.
Geriatrisch gebruik
Van het totale aantal patiënten (n=21.486) in klinische onderzoeken met PREVACID was 16% van de patiënten 65 jaar en ouder, terwijl 4% 75 jaar en ouder was. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere patiënten en andere gerapporteerde klinische ervaringen hebben geen significante verschillen in respons tussen geriatrische en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten [zie KLINISCHE FARMACOLOGIE ].

Leverfunctiestoornis
Bij patiënten met verschillende gradaties van chronische leverfunctiestoornis was de blootstelling aan lansoprazol verhoogd in vergelijking met gezonde proefpersonen met een normale leverfunctie [zie KLINISCHE FARMACOLOGIE ]. Er is geen dosisaanpassing voor PREVACID of PREVACID SoluTab nodig voor patiënten met een lichte (Child-Pugh-klasse A) of matige (Child-Pugh-klasse B) leverfunctiestoornis. De aanbevolen dosering is dagelijks 15 mg oraal bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh-klasse C) [zie DOSERING EN ADMINISTRATIE ].
OVERDOSERING
Lansoprazol wordt niet door hemodialyse uit de bloedsomloop verwijderd. Bij één gemelde overdosis gebruikte een patiënt 600 mg PREVACID 15 mg zonder bijwerking. Orale doses lansoprazol tot 5000 mg/kg bij ratten [ongeveer 1300 maal de dosis voor de mens van 30 mg op basis van lichaamsoppervlak (BSA)] en bij muizen (ongeveer 675,7 maal de dosis voor de mens van 30 mg op basis van het lichaamsoppervlak) veroorzaakten geen sterfgevallen of eventuele klinische symptomen.
In geval van overmatige blootstelling dient de behandeling symptomatisch en ondersteunend te zijn.
Als er sprake is van overmatige blootstelling, bel dan uw antigifcentrum op 1-800-222-1222 voor actuele informatie over het beheer van vergiftiging of overmatige blootstelling.
CONTRA-INDICATIES
- PREVACID 15 mg en PREVACID 15 mg SoluTab zijn gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor een van de bestanddelen van de formulering. Overgevoeligheidsreacties kunnen anafylaxie, anafylactische shock, angio-oedeem, bronchospasme, acute tubulo-interstitiële nefritis en urticaria omvatten (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
- Protonpompremmers (PPI's), waaronder PREVACID en PREVACID SoluTab, zijn gecontra-indiceerd met producten die rilpivirine bevatten [zie DRUG-INTERACTIES ].
- Voor informatie over contra-indicaties van antibacteriële middelen (claritromycine en amoxicilline) die zijn geïndiceerd in combinatie met PREVACID of PREVACID 30 mg SoluTab, raadpleegt u de rubriek Contra-indicaties van hun voorschrijfinformatie.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Lansoprazol behoort tot een klasse van antisecretoire verbindingen, de gesubstitueerde benzimidazolen, die de maagzuursecretie onderdrukken door specifieke remming van het (H+, K+)-ATPase-enzymsysteem op het secretoire oppervlak van de pariëtale maagcel. Omdat dit enzymsysteem wordt beschouwd als de zure (proton)pomp in de pariëtale cel, is lansoprazol gekarakteriseerd als een maagzuurpompremmer, omdat het de laatste stap van de zuurproductie blokkeert. Dit effect is dosisafhankelijk en leidt tot remming van zowel basale als gestimuleerde maagzuursecretie, ongeacht de stimulus. Lansoprazol vertoont geen anticholinerge of histamine type-2 antagonist activiteit.
farmacodynamiek
Antisecretoire activiteit
Na orale toediening bleek lansoprazol de basale zuurproductie significant te verlagen en de gemiddelde maag-pH aanzienlijk te verhogen en het percentage van de tijd dat de maag-pH hoger was dan drie en hoger dan vier. Lansoprazol verminderde ook significant de door de maaltijd gestimuleerde maagzuurproductie en het secretievolume, evenals de door pentagastrine gestimuleerde zuurproductie. Bij patiënten met hypersecretie van zuur verminderde lansoprazol de basale en pentagastrine-gestimuleerde maagzuursecretie significant. Lansoprazol remde de normale toename van het secretievolume, de zuurgraad en de zuurproductie veroorzaakt door insuline.
De intragastrische pH-resultaten van een vijfdaags, farmacodynamisch, cross-over onderzoek van 15 en 30 mg eenmaal daags lansoprazol worden weergegeven in Tabel 6:
Na de aanvangsdosis in dit onderzoek werd binnen één tot twee uur een verhoogde maag-pH waargenomen met 30 mg lansoprazol en twee tot drie uur met 15 mg lansoprazol. Na meervoudige dagelijkse doseringen werd binnen het eerste uur na toediening van 30 mg lansoprazol een verhoogde maag-pH waargenomen en binnen één tot twee uur na toediening van 15 mg lansoprazol.
Zuuronderdrukking kan het effect van antimicrobiële middelen bij het uitroeien van Helicobacter pylori (H. pylori) versterken. Het percentage tijd dat de maag-pH was verhoogd tot boven vijf en zes werd geëvalueerd in een cross-overonderzoek van PREVACID dat dagelijks, tweemaal daags en driemaal daags werd gegeven (Tabel 7).
De remming van de maagzuursecretie, zoals gemeten door de intragastrische pH, keerde geleidelijk terug naar normaal gedurende twee tot vier dagen na meerdere doses. Er was geen indicatie van rebound maagzuur.
Enterochromaffine-achtige (ECL) celeffecten
Tijdens levenslange blootstelling van ratten met tot 150 mg/kg/dag lansoprazol toegediend zeven dagen per week, werd duidelijke hypergastrinemie waargenomen, gevolgd door ECL-celproliferatie en vorming van carcinoïde tumoren, vooral bij vrouwelijke ratten. Maagbiopsiemonsters uit het maaglichaam van ongeveer 150 patiënten die gedurende ten minste één jaar ononderbroken met lansoprazol werden behandeld, vertoonden geen bewijs van ECL-celeffecten die vergelijkbaar waren met die in onderzoeken bij ratten. Er zijn gegevens op langere termijn nodig om de mogelijkheid van een verhoogd risico op de ontwikkeling van maagtumoren uit te sluiten bij patiënten die langdurig met lansoprazol worden behandeld [zie Niet-klinische toxicologie ].
Andere maageffecten bij mensen
Lansoprazol had geen significante invloed op de mucosale bloedstroom in de fundus van de maag. Als gevolg van het normale fysiologische effect dat wordt veroorzaakt door de remming van de maagzuursecretie, werd een afname van ongeveer 17% van de bloedstroom in het antrum, de pylorus en de twaalfvingerige darm waargenomen. Lansoprazol vertraagde de maaglediging van verteerbare vaste stoffen aanzienlijk. Lansoprazol verhoogde de pepsinogeenspiegels in serum en verminderde de pepsine-activiteit onder basale omstandigheden en als reactie op maaltijdstimulatie of insuline-injectie. Net als bij andere middelen die de pH in de maag verhogen, werden verhogingen van de pH in de maag geassocieerd met verhogingen van nitraatreducerende bacteriën en verhoging van de nitrietconcentratie in maagsap bij patiënten met maagzweren. Er werd geen significante verhoging van de nitrosamineconcentraties waargenomen.
Serum Gastrine-effecten
Bij meer dan 2100 patiënten stegen de mediane nuchtere serumgastrinespiegels met 50 tot 100% ten opzichte van de uitgangswaarde, maar bleven binnen het normale bereik na behandeling met 15 tot 60 mg oraal lansoprazol. Deze verhogingen bereikten een plateau binnen twee maanden na de behandeling en keerden binnen vier weken na stopzetting van de therapie terug naar het niveau van voor de behandeling.
Verhoogde gastrine veroorzaakt enterochromaffine-achtige celhyperplasie en verhoogde serum-CgA-spiegels. De verhoogde CgA-spiegels kunnen vals-positieve resultaten veroorzaken bij diagnostisch onderzoek naar neuro-endocriene tumoren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Endocriene effecten
Studies bij mensen gedurende maximaal een jaar hebben geen klinisch significante effecten op het endocriene systeem aangetoond. De onderzochte hormonen omvatten testosteron, luteïniserend hormoon (LH), follikelstimulerend hormoon (FSH), geslachtshormoonbindend globuline (SHBG), dehydroepiandrosteronsulfaat (DHEA-S), prolactine, cortisol, estradiol, insuline, aldosteron, parathormoon, glucagon, schildklierstimulerende hormoon (TSH), trijoodthyronine (T3), thyroxine (T4) en somatotroop hormoon (STH). Lansoprazol in orale doses van 15 tot 60 mg gedurende maximaal één jaar had geen klinisch significant effect op de seksuele functie. Bovendien had lansoprazol in orale doses van 15 tot 60 mg gedurende twee tot acht weken geen klinisch significant effect op de schildklierfunctie. In carcinogeniteitsstudies van 24 maanden bij Sprague-Dawley-ratten met dagelijkse doseringen van lansoprazol tot 150 mg/kg, waren proliferatieve veranderingen in de Leydig-cellen van de testikels, waaronder goedaardig neoplasma, toegenomen in vergelijking met controleratten.
Andere effecten
Er zijn bij mensen geen systemische effecten van lansoprazol op het centrale zenuwstelsel, lymfoïde, hematopoëtische, nier-, lever-, cardiovasculaire of ademhalingssystemen gevonden. Bij 56 patiënten die bij aanvang uitgebreide oogonderzoeken hadden ondergaan, werd geen visuele toxiciteit waargenomen na behandeling met lansoprazol (tot 180 mg/dag) gedurende maximaal 58 maanden. Na levenslange blootstelling aan lansoprazol bij ratten werden focale pancreas-atrofie, diffuse lymfoïde hyperplasie in de thymus en spontane retinale atrofie waargenomen.
Farmacokinetiek
Absorptie
PREVACID 15 mg en PREVACID SoluTab bevatten een maagsapresistente granulaatformulering van lansoprazol (omdat lansoprazol zuurlabiel is), zodat de absorptie van lansoprazol pas begint nadat de korrels de maag hebben verlaten. De gemiddelde piekplasmaspiegels van lansoprazol treden op na ongeveer 1,7 uur. Na toediening van een enkelvoudige dosis van 15 tot 60 mg oraal lansoprazol waren de piekplasmaconcentraties (Cmax) van lansoprazol en de oppervlakte onder de plasmaconcentratiecurven (AUC's) van lansoprazol ongeveer evenredig met de toegediende dosis. Lansoprazol accumuleert niet en de farmacokinetiek ervan wordt niet gewijzigd door meervoudige dosering. De absolute biologische beschikbaarheid is meer dan 80%. Bij gezonde proefpersonen was de gemiddelde (±SD) plasmahalfwaardetijd 1,5 (±1,0) uur. Zowel de Cmax als de AUC nemen af met ongeveer 50 tot 70% als lansoprazol 30 minuten na voedsel wordt gegeven, vergeleken met nuchtere toestand. Er is geen significant voedseleffect als lansoprazol vóór de maaltijd wordt gegeven.
Verdeling
Lansoprazol is voor 97% gebonden aan plasma-eiwitten. De plasma-eiwitbinding is constant over het concentratiebereik van 0,05 tot 5 mcg/ml.
Eliminatie
Metabolisme
Lansoprazol wordt uitgebreid gemetaboliseerd in de lever. Er zijn twee metabolieten geïdentificeerd in meetbare hoeveelheden in plasma (de gehydroxyleerde sulfinyl- en sulfonderivaten van lansoprazol). Deze metabolieten hebben zeer weinig of geen antisecretoire activiteit. Men denkt dat lansoprazol wordt getransformeerd in twee actieve soorten die de zuursecretie remmen door de protonpomp [(H+, K+)-ATPase-enzymsysteem] op het secretoire oppervlak van de pariëtale maagcel te blokkeren. De twee actieve soorten zijn niet aanwezig in de systemische circulatie. De plasma-eliminatiehalfwaardetijd van lansoprazol is minder dan twee uur, terwijl het zuurremmende effect meer dan 24 uur aanhoudt. Daarom weerspiegelt de plasma-eliminatiehalfwaardetijd van lansoprazol niet de duur van de onderdrukking van de maagzuursecretie.
uitscheiding
Na orale toediening van een enkelvoudige dosis PREVACID werd vrijwel geen onveranderd lansoprazol uitgescheiden in de urine. In één onderzoek werd na een enkelvoudige orale dosis 14Clansoprazol ongeveer een derde van de toegediende straling uitgescheiden in de urine en tweederde werd teruggevonden in de feces. Dit impliceert een significante uitscheiding via de gal van de metabolieten van lansoprazol.
Specifieke populaties
Pediatrische patiënten
Eén tot 17 jaar oud
De farmacokinetiek van lansoprazol is onderzocht bij pediatrische patiënten met GORZ in de leeftijd van één tot 11 jaar en van 12 tot 17 jaar in twee afzonderlijke klinische onderzoeken. Bij kinderen van 1 tot 11 jaar werd lansoprazol dagelijks 15 mg gedoseerd voor proefpersonen die 30 kg wogen en 30 mg per dag voor proefpersonen die meer dan 30 kg wogen. De gemiddelde Cmax- en AUC-waarden die werden waargenomen op dag 5 van de dosering waren vergelijkbaar tussen de twee dosisgroepen en werden niet beïnvloed door gewicht of leeftijd binnen elke voor het gewicht aangepaste dosisgroep die in het onderzoek werd gebruikt. Bij adolescente proefpersonen van 12 tot 17 jaar werden proefpersonen gerandomiseerd om 15 of 30 mg lansoprazol per dag te krijgen. De gemiddelde Cmax- en AUC-waarden van lansoprazol werden niet beïnvloed door lichaamsgewicht of leeftijd; en bijna dosisproportionele verhogingen van de gemiddelde Cmax- en AUC-waarden werden waargenomen tussen de twee dosisgroepen in het onderzoek. Over het algemeen was de farmacokinetiek van lansoprazol bij pediatrische patiënten in de leeftijd van 1 tot 17 jaar vergelijkbaar met die waargenomen bij gezonde volwassen proefpersonen.
Geriatrische patiënten
De klaring van lansoprazol is verminderd bij ouderen, waarbij de eliminatiehalfwaardetijd met ongeveer 50 tot 100% is toegenomen. Omdat de gemiddelde halfwaardetijd bij ouderen tussen 1,9 en 2,9 uur blijft, leidt herhaalde eenmaaldaagse dosering niet tot accumulatie van lansoprazol. Piekplasmaspiegels waren niet verhoogd bij ouderen [zie: Gebruik bij specifieke populaties ].
Mannelijke en vrouwelijke patiënten
In een onderzoek waarin 12 mannelijke en zes vrouwelijke proefpersonen werden vergeleken die lansoprazol kregen, werden geen seksegerelateerde verschillen gevonden in farmacokinetiek en intragastrische pH-resultaten.
Raciale of etnische groepen
De gepoolde gemiddelde farmacokinetische parameters van PREVACID uit twaalf Amerikaanse onderzoeken (N=513) werden vergeleken met de gemiddelde farmacokinetische parameters uit twee Aziatische onderzoeken (N=20). De gemiddelde AUC's van PREVACID 30 mg bij Aziatische proefpersonen waren ongeveer tweemaal zo hoog als die in gepoolde Amerikaanse gegevens; de interindividuele variabiliteit was echter hoog. De Cmax-waarden waren vergelijkbaar.
Patiënten met nierinsufficiëntie
Bij patiënten met een ernstige nierfunctiestoornis nam de plasma-eiwitbinding af met 1 tot 1,5% na toediening van 60 mg lansoprazol. Patiënten met nierinsufficiëntie hadden een kortere eliminatiehalfwaardetijd en een verlaagde totale AUC (vrij en gebonden). De AUC van vrij lansoprazol in plasma was echter niet gerelateerd aan de mate van nierfunctiestoornis; en de Cmax en Tmax (tijd om de maximale concentratie te bereiken) waren niet anders dan de Cmax en Tmax van proefpersonen met een normale nierfunctie. Daarom was de farmacokinetiek van lansoprazol niet klinisch verschillend bij patiënten met een lichte, matige of ernstige nierfunctiestoornis in vergelijking met gezonde proefpersonen met een normale nierfunctie.
Patiënten met leverinsufficiëntie
Bij patiënten met een lichte (Child-Pugh-klasse A) of matige (Child-Pugh-klasse B) leverfunctiestoornis was er een ongeveer 3-voudige toename van de gemiddelde AUC vergeleken met gezonde proefpersonen met een normale leverfunctie na meervoudige orale doses van 30 mg PREVACID 30 mg voor zeven dagen. De overeenkomstige gemiddelde plasmahalfwaardetijd van lansoprazol was verlengd van 1,5 tot vier uur (Child-Pugh A) of vijf uur (Child-Pugh B).
Bij patiënten met gecompenseerde en gedecompenseerde cirrose was er een ongeveer 6- en 5-voudige toename van respectievelijk de AUC in vergelijking met gezonde proefpersonen met een normale leverfunctie na een enkelvoudige orale dosis van 30 mg PREVACID (zie DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ].
Geneesmiddelinteractiestudies
Effect van lansoprazol op andere geneesmiddelen
Cytochroom P450-interacties
Lansoprazol wordt gemetaboliseerd door het cytochroom P450-systeem, met name door de isozymen CYP3A en CYP2C19. Studies hebben aangetoond dat PREVACID 15 mg geen klinisch significante interacties heeft met andere geneesmiddelen die worden gemetaboliseerd door het cytochroom P450-systeem, zoals warfarine, antipyrine, indomethacine, ibuprofen, fenytoïne, propranolol, prednison, diazepam of claritromycine bij gezonde proefpersonen. Deze verbindingen worden gemetaboliseerd door verschillende cytochroom P450-isozymen, waaronder CYP1A2, CYP2C9, CYP2C19, CYP2D6 en CYP3A.
theofylline
Wanneer PREVACID 30 mg gelijktijdig met theofylline (CYP1A2, CYP3A) werd toegediend, werd een kleine toename (10%) in de klaring van theofylline waargenomen. Vanwege de kleine omvang en de richting van het effect op de theofyllineklaring is het onwaarschijnlijk dat deze interactie klinisch zorgwekkend is [zie DRUG-INTERACTIES ].
Methotrexaat en 7-hydroxymethotrexaat
In een open-label, eenarmig, achtdaags, farmacokinetisch onderzoek bij 28 volwassen patiënten met reumatoïde artritis (die chronisch 7,5 tot 15 mg methotrexaat per week nodig hadden), toediening van zeven dagen naproxen 500 mg tweemaal daags en PREVACID 30 mg per dag had geen effect op de farmacokinetiek van methotrexaat en 7-hydroxymethotrexaat. Hoewel deze studie niet was opgezet om de veiligheid van deze combinatie van geneesmiddelen te beoordelen, werden er geen belangrijke bijwerkingen opgemerkt. Dit onderzoek is echter uitgevoerd met lage doses methotrexaat. Er is geen geneesmiddelinteractieonderzoek uitgevoerd met hoge doses methotrexaat [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Amoxicilline
Er is ook aangetoond dat PREVACID 30 mg geen klinisch significante interactie heeft met amoxicilline.
Sucralfaat
In een cross-overstudie met een enkelvoudige dosis waarbij PREVACID 30 mg werd onderzocht, alleen toegediend en gelijktijdig met sucralfaat 1 gram, werd de absorptie van lansoprazol vertraagd en de biologische beschikbaarheid verminderd met 17% bij gelijktijdige toediening met sucralfaat [zie DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES ].
Antacida
In klinische onderzoeken werden antacida gelijktijdig toegediend met PREVACID 15 mg en er waren geen aanwijzingen voor een verandering in de werkzaamheid van PREVACID.
Clopidogrel
Clopidogrel wordt gedeeltelijk door CYP2C19 gemetaboliseerd tot zijn actieve metaboliet. Er werd een onderzoek uitgevoerd bij gezonde proefpersonen die snelle CYP2C19-metaboliseerders waren en die gedurende negen dagen eenmaal daags 75 mg clopidogrel alleen of gelijktijdig met PREVACID 30 mg (n=40) kregen toegediend. De gemiddelde AUC van de actieve metaboliet van clopidogrel was met ongeveer 14% verminderd (gemiddelde AUC-ratio was 86%, met een 90% BI van 80 tot 92%) wanneer PREVACID gelijktijdig werd toegediend in vergelijking met toediening van alleen clopidogrel.
Farmacodynamische parameters werden ook gemeten en toonden aan dat de verandering in remming van de bloedplaatjesaggregatie (geïnduceerd door 5 mcM ADP) verband hield met de verandering in de blootstelling aan de actieve metaboliet van clopidogrel. Het effect op de blootstelling aan de actieve metaboliet van clopidogrel en op de door clopidogrel geïnduceerde bloedplaatjesremming wordt niet als klinisch belangrijk beschouwd.
Effect van andere geneesmiddelen op lansoprazol
Omdat lansoprazol wordt gemetaboliseerd door CYP2C19 en CYP3A4, kunnen inductoren en remmers van deze enzymen mogelijk de blootstelling aan lansoprazol veranderen.
Microbiologie
Microbiologie
Van lansoprazol, claritromycine en/of amoxicilline is aangetoond dat ze actief zijn tegen de meeste stammen van Helicobacter pylori in vitro en bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK ].
Helicobacter Pylori Voorbehandelingsresistentie
De resistentie tegen claritromycine vóór de behandeling (≥2,0 mcg/ml) was 9,5% (91/960) volgens E-test en 11,3% (12/106) volgens agarverdunning in de klinische onderzoeken met dubbele en drievoudige therapie (M93-125, M93-130, M93131, M95-392 en M95-399).
Voor amoxicilline gevoelige isolaten (≤0,25 mcg/ml) kwamen voor bij respectievelijk 97,8% (936/957) en 98,0% (98/100) van de patiënten in de klinische onderzoeken met dubbele en drievoudige therapie door middel van E-test en agarverdunning. Eenentwintig van de 957 patiënten (2,2%) volgens de E-test en twee van de 100 patiënten (2,0%) volgens agarverdunning, hadden MIC's voor de voorbehandeling van amoxicilline van meer dan 0,25 mcg/ml. Eén patiënt op het 14-daagse drievoudige therapieregime had een onbevestigde amoxicilline-minimale remmende concentratie (MIC) van meer dan 256 mcg/ml volgens de E-test en de patiënt was uitgeroeid van H. pylori (tabel 8).
Patiënten die niet zijn uitgeroeid van H. pylori na drievoudige therapie met lansoprazol/amoxicilline/claritromycine, zullen waarschijnlijk claritromycineresistente H. pylori hebben. Daarom moeten bij patiënten bij wie de therapie faalt, indien mogelijk claritromycinegevoeligheidstests worden uitgevoerd. Patiënten met claritromycine-resistente H. pylori mogen niet worden behandeld met een drievoudige therapie met lansoprazol/amoxicilline/claritromycine of met regimes die claritromycine als het enige antimicrobiële middel bevatten.
Resultaten van amoxicillinegevoeligheidstests en klinische/bacteriologische resultaten
In de klinische onderzoeken met dubbele en drievoudige therapie werd H. pylori bij 82,6% (195/236) van de patiënten met voor de behandeling voor amoxicilline gevoelige MIC's (≤0,25 mcg/ml) uitgeroeid. Van degenen met amoxicilline-MIC's voor de behandeling van meer dan 0,25 mcg/ml, was bij drie van de zes de H. pylori uitgeroeid. Een totaal van 30% (21/70) van de patiënten faalde lansoprazol 30 mg driemaal daags/amoxicilline 1 g driemaal daags tweevoudige therapie en in totaal 12,8% (22/172) van de patiënten faalde in de 10- en 14-daagse triple therapie regimes. De gevoeligheidsresultaten na de behandeling werden niet verkregen bij 11 van de patiënten bij wie de therapie faalde. Negen van de 11 patiënten met amoxicilline-MIC's na behandeling die het drievoudige therapieregime niet hadden doorstaan, hadden ook claritromycine-resistente H. pylori-isolaten.
Gevoeligheidstest voor Helicobacter pylori
Voor informatie over gevoeligheidstests over Helicobacter pylori, zie: Microbiologiesectie in voorschrijfinformatie voor claritromycine en amoxicilline .
Klinische studies
Duodenumulcus
In een multicenter, dubbelblind, placebogecontroleerd, dosis-responsonderzoek (15, 30 en 60 mg PREVACID eenmaal daags) onder 284 patiënten met endoscopisch gedocumenteerd ulcus duodeni, was het percentage patiënten dat na twee en vier weken was genezen significant hoger bij alle doses PREVACID dan bij placebo. Er was geen bewijs van een grotere of eerdere respons met de twee hogere doses in vergelijking met PREVACID 15 mg. Op basis van dit onderzoek en het tweede onderzoek dat hieronder wordt beschreven, is de aanbevolen dosis PREVACID 15 mg bij zweren van de twaalfvingerige darm 15 mg per dag (tabel 9).
PREVACID 15 mg was significant effectiever dan placebo bij het verlichten van buikpijn overdag en 's nachts en bij het verminderen van de hoeveelheid antacidum die per dag werd ingenomen.
In een tweede multicenter onderzoek in de VS, ook dubbelblind, placebogecontroleerd, dosisvergelijking (15 en 30 mg PREVACID 15 mg eenmaal daags), en inclusief een vergelijking met ranitidine, bij 280 patiënten met endoscopisch gedocumenteerde ulcus duodeni, het percentage van patiënten die na vier weken waren genezen, was significant hoger met beide doses PREVACID 15 mg dan met placebo. Er was geen bewijs van een grotere of eerdere respons met de hogere dosis PREVACID. Hoewel de dosis PREVACID van 15 mg superieur was aan ranitidine na vier weken, laat het ontbreken van een significant verschil na twee weken en de afwezigheid van een verschil tussen 30 mg PREVACID en ranitidine de relatieve effectiviteit van de twee middelen onbepaald (Tabel 10) [ zien AANWIJZINGEN EN GEBRUIK ].
Uitroeiing van H. pylori om het risico op herhaling van duodenumzweren te verminderen
Gerandomiseerde, dubbelblinde klinische onderzoeken uitgevoerd in de VS bij patiënten met H. pylori en ulcus duodeni (gedefinieerd als een actieve zweer of een voorgeschiedenis van een zweer binnen één jaar) evalueerden de werkzaamheid van PREVACID in combinatie met amoxicilline en claritromycine als triple 14 dagtherapie of in combinatie met amoxicilline als duale 14-daagse therapie voor de uitroeiing van H. pylori. Op basis van de resultaten van deze onderzoeken werden de veiligheid en werkzaamheid van twee verschillende uitroeiingsregimes vastgesteld:
Drievoudige therapie : PREVACID 30 mg tweemaal daags/amoxicilline 1 g tweemaal daags/claritromycine 500 mg tweemaal daags
Dubbele therapie : PREVACID 30 mg driemaal daags/amoxicilline 1 g driemaal daags
Alle behandelingen waren voor 14 dagen. Uitroeiing van H. pylori werd gedefinieerd als twee negatieve tests (kweek en histologie) vier tot zes weken na het einde van de behandeling.
Triple therapie bleek effectiever dan alle mogelijke dual-therapie combinaties. Duale therapie bleek effectiever dan beide monotherapieën. Het is aangetoond dat de uitroeiing van H. pylori het risico op herhaling van een ulcus duodeni vermindert.
Een gerandomiseerde, dubbelblinde klinische studie, uitgevoerd in de VS bij patiënten met H. pylori en ulcus duodeni (gedefinieerd als een actieve zweer of een voorgeschiedenis van een zweer binnen één jaar) vergeleek de werkzaamheid van de PREVACID drievoudige therapie gedurende 10 en 14 dagen. Deze studie stelde vast dat de 10-daagse drievoudige therapie equivalent was aan de 14-daagse drievoudige therapie bij het uitroeien van H. pylori (tabellen 11 en 12) [zie AANWIJZINGEN EN GEBRUIK ].
Onderhoud van genezen duodenumzweren
Van PREVACID is aangetoond dat het herhaling van zweren in de twaalfvingerige darm voorkomt. Twee onafhankelijke, dubbelblinde, multicenter, gecontroleerde onderzoeken werden uitgevoerd bij patiënten met endoscopisch bevestigde genezen ulcus duodeni. Patiënten bleven significant langer genezen en het aantal recidieven van zweren in de twaalfvingerige darm was significant lager bij patiënten die werden behandeld met PREVACID 15 mg dan bij patiënten die werden behandeld met placebo gedurende een periode van 12 maanden (tabel 13) [zie AANWIJZINGEN EN GEBRUIK ].
In proef #2 werd geen significant verschil opgemerkt tussen PREVACID 15 en 30 mg bij het handhaven van remissie.
Maagzweer
In een multicenter, dubbelblind, placebogecontroleerd onderzoek in de VS onder 253 patiënten met endoscopisch gedocumenteerd maagulcus, was het percentage patiënten dat na vier en acht weken genezen was significant hoger met PREVACID 15 en 30 mg eenmaal daags dan met placebo (tabel 14 ) [zien AANWIJZINGEN EN GEBRUIK ].
Patiënten die met een PREVACID-dosis werden behandeld, rapporteerden significant minder buikpijn overdag en 's nachts, samen met minder dagen antacidumgebruik en minder antacidumtabletten per dag dan de placebogroep.
Onafhankelijke onderbouwing van de werkzaamheid van PREVACID 30 mg werd geleverd door een meta-analyse van gepubliceerde en niet-gepubliceerde gegevens.
Genezing van NSAID-geassocieerde maagzweer
In twee Amerikaanse en Canadese multicenter, dubbelblinde, actief-gecontroleerde onderzoeken bij patiënten met endoscopisch bevestigde NSAID-geassocieerde maagzweren die hun NSAID-gebruik voortzetten, was het percentage patiënten dat na acht weken genezen was statistisch significant hoger met 30 mg PREVACID dan met de actieve controle. In totaal namen 711 patiënten deel aan het onderzoek en werden 701 patiënten behandeld. De leeftijd van de patiënten varieerde van 18 tot 88 jaar (mediane leeftijd 59 jaar), met 67% vrouwelijke patiënten en 33% mannelijke patiënten. Ras was als volgt verdeeld: 87% blank, 8% zwart, 5% overig. Er was geen statistisch significant verschil tussen PREVACID 30 mg per dag en de actieve controle op symptoomverlichting (dwz buikpijn) (Tabel 15) [zie AANWIJZINGEN EN GEBRUIK ].
Risicovermindering van NSAID-geassocieerde maagzweren
In een grote Amerikaanse, multicenter, dubbelblinde, placebo- en misoprostol-gecontroleerde (misoprostol alleen geblindeerd voor de endoscopist) studie bij patiënten die chronisch gebruik van een NSAID nodig hadden en die een voorgeschiedenis hadden van een endoscopisch gedocumenteerde maagzweer, was het aandeel van patiënten die na vier, acht en twaalf weken geen maagzweer hadden, was significant hoger met 15 of 30 mg PREVACID 15 mg dan met placebo. In totaal namen 537 patiënten deel aan het onderzoek en werden 535 patiënten behandeld. De leeftijd van de patiënten varieerde van 23 tot 89 jaar (mediane leeftijd 60 jaar), met 65% vrouwelijke patiënten en 35% mannelijke patiënten. Ras was als volgt verdeeld: 90% blank, 6% zwart, 4% overig. De dosis PREVACID van 30 mg vertoonde geen bijkomend voordeel in risicovermindering van het NSAID-geassocieerde maagulcus dan de dosis van 15 mg (Tabel 16) [zie AANWIJZINGEN EN GEBRUIK ].
Symptomatische gastro-oesofageale refluxziekte (GERD)
Symptomatische GERD
In een multicenter, dubbelblind, placebogecontroleerd onderzoek in de VS bij 214 patiënten met frequente GERD-symptomen, maar geen oesofageale erosies door endoscopie, werd een significant grotere verlichting van brandend maagzuur geassocieerd met GERD waargenomen bij toediening van lansoprazol 15 mg eenmaal daags tot maximaal acht weken dan bij placebo. Er werd geen significant bijkomend voordeel van lansoprazol 30 mg eenmaal daags waargenomen.
De intent-to-treat-analyses toonden een significante afname in frequentie en ernst van brandend maagzuur overdag en 's nachts. Gegevens voor frequentie en ernst voor de behandelingsperiode van acht weken worden weergegeven in Tabel 17 en in Figuren 1 en 2:
Figuur 1: Gemiddelde ernst van de dag Maagzuur per studiedag voor evalueerbare patiënten (3=ernstig, 2=matig, 1=mild, 0=geen)
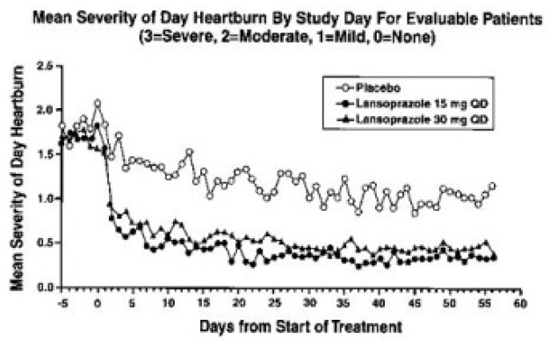
Figuur 2: Gemiddelde ernst van nachtelijk brandend maagzuur per studiedag voor evalueerbare patiënten (3 = Ernstig, 2 = Matig, 1 = Mild, 0 = Geen)
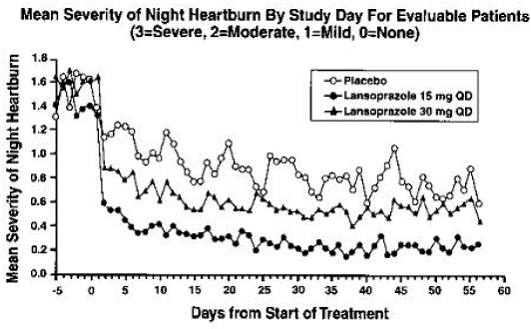
In twee Amerikaanse, multicenter dubbelblinde, ranitidine-gecontroleerde onderzoeken van in totaal 925 patiënten met frequente GERD-symptomen, maar geen oesofageale erosies door endoscopie, was lansoprazol 15 mg superieur aan ranitidine 150 mg (tweemaal daags) bij het verminderen van de frequentie en ernst van de dag en nachtelijk brandend maagzuur geassocieerd met GERD gedurende de behandelingsperiode van acht weken. Er werd geen significant bijkomend voordeel van lansoprazol 30 mg eenmaal daags waargenomen [zie: AANWIJZINGEN EN GEBRUIK ].
Erosieve oesofagitis
In een Amerikaanse, multicenter, dubbelblinde, placebo-gecontroleerde studie van 269 patiënten die binnenkwamen met een endoscopische diagnose van oesofagitis met mucosale gradatie van twee of meer en graad drie en vier die erosieve ziekte aanduiden, worden de percentages patiënten met genezing weergegeven in tabel 18:
In deze studie rapporteerden alle PREVACID-groepen een significant grotere verlichting van brandend maagzuur en minder buikpijn overdag en 's nachts, samen met minder dagen van antacidumgebruik en minder antacidumtabletten per dag dan de placebogroep. Hoewel alle doses effectief waren, suggereert de eerdere genezing bij de hogere twee doses 30 mg per dag als de aanbevolen dosis.
PREVACID werd ook vergeleken in een Amerikaans, multicenter, dubbelblind onderzoek met een lage dosis ranitidine bij 242 patiënten met erosieve refluxoesofagitis. PREVACID in een dosis van 30 mg was significant effectiever dan ranitidine 150 mg tweemaal daags, zoals hieronder weergegeven (Tabel 19).
Bovendien rapporteerden patiënten die werden behandeld met PREVACID 30 mg minder brandend maagzuur overdag en 's nachts en namen ze minder antacidumtabletten gedurende minder dagen dan patiënten die tweemaal daags 150 mg ranitidine gebruikten.
Hoewel dit onderzoek de effectiviteit van PREVACID 15 mg bij het genezen van erosieve oesofagitis aantoont, vormt het geen adequate vergelijking met ranitidine omdat de aanbevolen dosis ranitidine voor oesofagitis viermaal daags 150 mg is, tweemaal de dosis die in dit onderzoek werd gebruikt.
In de twee beschreven onderzoeken en in verschillende kleinere onderzoeken met patiënten met matige tot ernstige erosieve oesofagitis, produceerde PREVACID genezingspercentages die vergelijkbaar waren met die hierboven weergegeven.
In een multicenter, dubbelblind, actief-gecontroleerd onderzoek in de VS werd 30 mg PREVACID 30 mg vergeleken met ranitidine 150 mg tweemaal daags bij 151 patiënten met erosieve refluxoesofagitis die slecht reageerde op een behandeling van minimaal 12 weken met ten minste één H2-receptorantagonist gegeven in de dosis die is aangegeven voor symptoomverlichting of hoger, namelijk cimetidine 800 mg/dag, ranitidine 300 mg/dag, famotidine 40 mg/dag of nizatidine 300 mg/dag. PREVACID 30 mg was effectiever dan ranitidine 150 mg tweemaal daags bij het genezen van reflux-oesofagitis, en het percentage patiënten met genezing was als volgt. Dit onderzoek vormt geen vergelijking van de werkzaamheid van histamine-H2-receptorantagonisten met PREVACID 30 mg, aangezien alle patiënten niet reageerden op de histamine-H2-receptorantagonist-behandelingswijze. Het geeft echter wel aan dat PREVACID 30 mg nuttig kan zijn bij patiënten die falen op een histamine H2-receptorantagonist (Tabel 20) [zie AANWIJZINGEN EN GEBRUIK ].
Onderhoud van genezing van erosieve oesofagitis
Er werden twee onafhankelijke, dubbelblinde, multicenter, gecontroleerde onderzoeken uitgevoerd bij patiënten met endoscopisch bevestigde genezen oesofagitis. Patiënten bleven significant langer in remissie en het aantal recidieven van erosieve oesofagitis was significant minder bij patiënten behandeld met PREVACID 30 mg dan bij patiënten behandeld met placebo gedurende een periode van 12 maanden (Tabel 21).
Ongeacht de initiële graad van erosieve oesofagitis, waren PREVACID 15 en 30 mg vergelijkbaar in het handhaven van remissie.
In een Amerikaans, gerandomiseerd, dubbelblind onderzoek werd PREVACID 15 mg per dag (n=100) vergeleken met ranitidine 150 mg tweemaal per dag (n=106), in de aanbevolen dosering, bij patiënten met endoscopisch bewezen genezen erosieve oesofagitis gedurende een periode van 12 maanden. Behandeling met PREVACID 15 mg resulteerde in patiënten die gedurende significant langere tijd genezen bleven (graad 0 laesies) van erosieve oesofagitis dan die behandeld met ranitidine (p AANWIJZINGEN EN GEBRUIK ].
Pathologische hypersecretoire aandoeningen, waaronder het Zollinger-Ellison-syndroom
In open onderzoeken bij 57 patiënten met pathologische hypersecretoire aandoeningen, zoals het Zollinger-Ellison-syndroom (ZES) met of zonder meerdere endocriene adenomen, remde PREVACID 15 mg de maagzuursecretie significant en controleerde de bijbehorende symptomen van diarree, anorexia en pijn. Doses variërend van 15 mg om de dag tot 180 mg per dag hielden de basale zuursecretie onder de 10 mEq/uur bij patiënten zonder eerdere maagoperatie en onder 5 mEq/uur bij patiënten met eerdere maagoperaties.
De aanvangsdoses werden getitreerd naar de individuele behoefte van de patiënt, en bij sommige patiënten waren na verloop van tijd aanpassingen nodig [zie: DOSERING EN ADMINISTRATIE ]. PREVACID werd bij deze hoge doseringen gedurende langere perioden goed verdragen (bij sommige patiënten langer dan vier jaar). Bij de meeste ZES-patiënten werden de serumgastrinespiegels niet gewijzigd door PREVACID. Bij sommige patiënten steeg het serumgastrine echter tot spiegels die hoger waren dan de waarden die aanwezig waren vóór de start van de behandeling met lansoprazol (zie AANWIJZINGEN EN GEBRUIK ].
PATIËNT INFORMATIE
PREVACID (prev-a-sid) (lansoprazol) capsules met vertraagde afgifte, voor oraal gebruik en
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) oraal desintegrerende tabletten met vertraagde afgifte
Wat is de belangrijkste informatie die ik moet weten over PREVACID en PREVACID 15 mg SoluTab?
U dient PREVACID en PREVACID 15 mg SoluTab precies zoals voorgeschreven in te nemen, in de laagst mogelijke dosis en voor de kortst mogelijke tijd.
PREVACID en PREVACID SoluTab kunnen helpen bij uw zuurgerelateerde symptomen, maar u kunt nog steeds ernstige maagproblemen hebben.
Praat met uw arts. PREVACID 30 mg en PREVACID 30 mg SoluTab kunnen ernstige bijwerkingen veroorzaken, waaronder:
- Een type nierprobleem (acute tubulo-interstitiële nefritis). Sommige mensen die geneesmiddelen met protonpompremmers (PPI), waaronder PREVACID 30 mg en PREVACID 15 mg SoluTab, gebruiken, kunnen een nierprobleem ontwikkelen dat acute tubulo-interstitiële nefritis wordt genoemd en dat op elk moment tijdens de behandeling met PPI-geneesmiddelen, waaronder PREVACID en PREVACID SoluTab, kan optreden. Bel onmiddellijk uw arts als u minder plast of als u bloed in uw urine heeft.
- Diarree veroorzaakt door een infectie (Clostridium difficile) in uw darmen. Bel onmiddellijk uw arts als u waterige ontlasting of maagpijn heeft die niet weggaat. U kunt wel of geen koorts hebben.
- Botbreuken (heup, pols of wervelkolom). Botbreuken in de heup, pols of wervelkolom kunnen optreden bij mensen die meerdere dagelijkse doses PPI-geneesmiddelen gebruiken en gedurende een lange periode (een jaar of langer). Vertel het uw arts als u een botbreuk heeft, vooral in de heup, pols of wervelkolom.
- Bepaalde soorten lupus erythematosus. Lupus erythematosus is een auto-immuunziekte (de afweercellen van het lichaam vallen andere cellen of organen in het lichaam aan). Sommige mensen die PPI-geneesmiddelen gebruiken, waaronder PREVACID 15 mg en PREVACID 30 mg SoluTab, kunnen bepaalde vormen van lupus erythematosus ontwikkelen of de lupus die ze al hebben verergeren. Bel onmiddellijk uw arts als u nieuwe of verergerende gewrichtspijn of uitslag op uw wangen of armen heeft die erger wordt in de zon.
Praat met uw arts over uw risico op deze ernstige bijwerkingen.
PREVACID 15 mg en PREVACID SoluTab kunnen andere ernstige bijwerkingen hebben. Zien "Wat zijn de mogelijke bijwerkingen van PREVACID en PREVACID SoluTab?".
Wat zijn PREVACID en PREVACID 30 mg SoluTab?
Een receptgeneesmiddel dat een protonpompremmer (PPI) wordt genoemd en dat wordt gebruikt om de hoeveelheid zuur in uw maag te verminderen.
Bij volwassenen, PREVACID 15 mg en PREVACID SoluTab worden gebruikt voor:
- 4 weken voor de genezing en symptoomverlichting van zweren in de twaalfvingerige darm.
- 10 tot 14 dagen met bepaalde antibiotica om een infectie te behandelen die wordt veroorzaakt door de bacterie H. pylori.
- behoud van genezing van zweren in de twaalfvingerige darm. PREVACID 30 mg is voor dit doel niet langer dan 12 maanden onderzocht.
- tot 8 weken voor de genezing en symptoomverlichting van maagzweren.
- tot 8 weken voor de genezing van maagzweren bij mensen die pijnstillers gebruiken die niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) worden genoemd. PREVACID 30 mg is voor dit doel niet langer dan 8 weken onderzocht.
- het verminderen van het risico op maagzweren bij mensen die risico lopen op het ontwikkelen van maagzweren met NSAID's. PREVACID is voor dit doel niet langer dan 12 weken onderzocht.
- tot 8 weken voor de behandeling van brandend maagzuur en andere symptomen die optreden bij gastro-oesofageale refluxziekte (GERD). GERD treedt op wanneer zuur in uw maag een back-up maakt in de buis (slokdarm) die uw mond met uw maag verbindt. Dit kan een branderig gevoel in uw borst of keel, een zure smaak of boeren veroorzaken.
- tot 8 weken voor de genezing en symptoomverlichting van zuurgerelateerde schade aan het slijmvlies van de slokdarm (erosieve oesofagitis of EE genoemd). Uw arts kan nog eens 8 tot 16 weken PREVACID of PREVACID 15 mg SoluTab voorschrijven aan patiënten bij wie de EE niet verbetert of bij wie de symptomen terugkeren.
- genezing van EE behouden. PREVACID is voor dit doel niet langer dan 12 maanden onderzocht.
- de langdurige behandeling van aandoeningen waarbij uw maag te veel zuur aanmaakt. Dit omvat een zeldzame aandoening die het Zollinger-Ellison-syndroom wordt genoemd.
Kinderen: Geef PREVACID 30 mg en PREVACID 30 mg SoluTab precies zoals voorgeschreven door de arts van uw kind. Verhoog de dosis PREVACID en PREVACID SoluTab niet en geef uw kind PREVACID 15 mg en PREVACID 15 mg SoluTab niet langer dan de tijd die uw arts u heeft voorgeschreven.
Bij kinderen van 1 tot 11 jaar oud PREVACID 15 mg en PREVACID 15 mg SoluTab worden gebruikt voor:
- tot 12 weken voor de behandeling van brandend maagzuur en andere symptomen die kunnen optreden bij GERD.
- tot 12 weken voor de genezing en symptoomverlichting van EE.
Bij kinderen van 12 tot 17 jaar PREVACID en PREVACID SoluTab worden gebruikt voor:
- tot 8 weken voor de behandeling van brandend maagzuur en andere symptomen die kunnen optreden bij GERD.
- tot 8 weken voor de genezing en symptoomverlichting van EE.
PREVACID 30 mg en PREVACID SoluTab worden niet aanbevolen voor de behandeling van de symptomen van GORZ bij kinderen jonger dan 1 jaar en kunnen hen schaden.
Gebruik PREVACID of PREVACID 15 mg SoluTab niet als u:
- allergisch zijn voor lansoprazol, voor enig ander PPI-geneesmiddel of voor één van de bestanddelen van PREVACID 15 mg of PREVACID 30 mg SoluTab. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in PREVACID en PREVACID 30 mg SoluTab.
- het nemen van een geneesmiddel dat rilpivirine bevat (EDURANT, COMPLERA, ODEFSEY, JULUCA) dat wordt gebruikt voor de behandeling van hiv-1 (humaan immunodeficiëntievirus).
Vertel uw arts over al uw medische aandoeningen voordat u PREVACID 15 mg of PREVACID SoluTab gebruikt, ook als u:
- een laag magnesium-, calcium-, kalium- of natriumgehalte in uw bloed heeft of als u een diureticum gebruikt.
- leverproblemen hebben.
- fenylketonurie hebben. PREVACID SoluTab bevat aspartaam.
- zwanger bent, denkt zwanger te zijn of van plan bent zwanger te worden. PREVACID of PREVACID SoluTab kan uw ongeboren baby schaden. Praat met uw arts over de mogelijke risico's voor een ongeboren baby als PREVACID 30 mg of PREVACID 15 mg SoluTab tijdens de zwangerschap wordt ingenomen.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of PREVACID of PREVACID 30 mg SoluTab in uw moedermelk terechtkomt. Praat met uw arts over de beste manier om uw baby te voeden als u PREVACID of PREVACID SoluTab gebruikt.
Vertel uw arts over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Vertel het uw arts vooral als u methotrexaat (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP) gebruikt.
Hoe moet ik PREVACID 15 mg en PREVACID 30 mg SoluTab gebruiken?
- Gebruik PREVACID 30 mg of PREVACID SoluTab precies zoals uw arts heeft voorgeschreven.
- Verander uw dosis niet en stop niet met het gebruik van PREVACID 30 mg of PREVACID SoluTab zonder met uw arts te overleggen.
- Neem PREVACID 30 mg of PREVACID 15 mg SoluTab voor de maaltijd in.
PREVACID 15 mg-capsules:
-
- Slik PREVACID 30 mg capsules heel door.
- PREVACID-capsules niet pletten of erop kauwen.
- Als u problemen heeft met het doorslikken van een hele capsule, kunt u de capsule openen en de inhoud met bepaald voedsel of sappen innemen. Zie de “Gebruiksaanwijzing” aan het einde van deze medicatiehandleiding voor instructies over hoe u PREVACID 30 mg capsules moet innemen met bepaalde voedingsmiddelen of sappen.
- Zie de “Gebruiksaanwijzing” aan het einde van deze medicatiehandleiding voor instructies over het mengen en toedienen van PREVACID 30 mg capsules via een neus-maagsonde (NG-sonde).
PREVACID SoluTab:
-
- PREVACID 30 mg SoluTab is een tablet die met of zonder water in uw mond smelt.
- De tabletten niet breken, snijden, pletten of erop kauwen.
- Zie de "Instructies voor gebruik" aan het einde van deze medicatiehandleiding voor instructies over het mengen en toedienen van PREVACID SoluTab via een spuit en NG-buis.
- Als u een dosis PREVACID of PREVACID 30 mg SoluTab bent vergeten, neem deze dan in zodra u eraan denkt. Als het bijna tijd is voor uw volgende dosis, neem dan de gemiste dosis niet in. Neem uw volgende dosis op uw normale tijdstip. Neem geen 2 doses tegelijk.
- Als u te veel PREVACID of PREVACID 30 mg SoluTab heeft ingenomen, neem dan onmiddellijk contact op met uw arts of uw antigifcentrum op 1-800-222-1222 of ga naar de dichtstbijzijnde eerstehulpafdeling van het ziekenhuis.
Wat zijn de mogelijke bijwerkingen van PREVACID en PREVACID SoluTab?
PREVACID en PREVACID SoluTab kunnen ernstige bijwerkingen veroorzaken, waaronder:
- Zien "Wat is de belangrijkste informatie die ik moet weten over PREVACID 30 mg en PREVACID SoluTab?".
- Lage vitamine B12-spiegels in het lichaam kan optreden bij mensen die PREVACID 30 mg of PREVACID SoluTab gedurende lange tijd (meer dan 3 jaar) hebben gebruikt. Vertel het uw arts als u symptomen heeft van lage vitamine B12-spiegels, waaronder kortademigheid, duizeligheid, onregelmatige hartslag, spierzwakte, bleke huid, vermoeidheid, stemmingswisselingen en tintelingen of gevoelloosheid in de armen en benen.
- Maaggroei (fundic gland poliepen). Mensen die gedurende lange tijd PPI-geneesmiddelen gebruiken, hebben een verhoogd risico op het ontwikkelen van een bepaald type maaggroei, de zogenaamde fundusklierpoliepen, vooral na het gebruik van PPI-geneesmiddelen gedurende meer dan 1 jaar.
- Laag magnesiumgehalte in het lichaam kan optreden bij mensen die PREVACID gedurende ten minste 3 maanden hebben gebruikt. Vertel het uw arts meteen als u symptomen heeft van een laag magnesiumgehalte, waaronder toevallen, duizeligheid, onregelmatige hartslag, zenuwachtigheid, spierpijn of spierzwakte, en spasmen van handen, voeten of stem.
- Ernstige huidreacties. PREVACID 15 mg kan zeldzame maar ernstige huidreacties veroorzaken die elk deel van uw lichaam kunnen aantasten. Deze ernstige huidreacties moeten mogelijk in een ziekenhuis worden behandeld en kunnen levensbedreigend zijn:
- Huiduitslag met blaarvorming, vervelling of bloeding op elk deel van uw huid (inclusief uw lippen, ogen, mond, neus, geslachtsdelen, handen of voeten).
- U kunt ook koorts, koude rillingen, pijn in het lichaam, kortademigheid of vergrote lymfeklieren hebben.
Stop met het innemen van PREVACID en bel onmiddellijk uw arts. Deze symptomen kunnen het eerste teken zijn van een ernstige huidreactie.
De meest voorkomende bijwerkingen van PREVACID en PREVACID SoluTab zijn: diarree, pijn in de maagstreek (buik), misselijkheid en constipatie.
Dit zijn niet alle mogelijke bijwerkingen van PREVACID 30 mg en PREVACID 30 mg SoluTab.
Bel uw arts voor medisch advies over bijwerkingen.
U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik PREVACID en PREVACID 30 mg SoluTab bewaren?
Bewaar PREVACID bij kamertemperatuur tussen 20 ° C en 25 ° C (68 ° F tot 77 ° F).
Houd PREVACID 15 mg en PREVACID SoluTab en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van PREVACID 15 mg en PREVACID SoluTab.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik PREVACID of PREVACID 30 mg SoluTab niet voor aandoeningen waarvoor het niet is voorgeschreven. Geef PREVACID 30 mg of PREVACID SoluTab niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw arts of apotheker om informatie vragen over PREVACID 30 mg en PREVACID 15 mg SoluTab die zijn bedoeld voor gezondheidswerkers.
Wat zijn de ingrediënten in PREVACID en PREVACID SoluTab?
Actief ingrediënt: lansoprazol.
Inactieve ingrediënten in PREVACID 30 mg capsules: suikerbol, sucrose, methacrylzuurcopolymeer, laag gesubstitueerde hydroxypropylcellulose, zetmeel, magnesiumcarbonaat, talk, polyethyleenglycol, titaniumdioxide, polysorbaat 80, hydroxypropylcellulose, colloïdaal siliciumdioxide, D&C Red No. 28, FD&C Blue No. 1 en FD&C Rood nr. 40.
Alleen PREVACID 15 mg capsule: FD&C Groen nr. 3.
Inactieve ingrediënten in PREVACID 15 mg SoluTab: mannitol, methacrylzuur, hydroxypropylcellulose, lactosemonohydraat-microkristallijne cellulosebol, triethylcitraat, crospovidon, polyacrylaat, magnesiumcarbonaat, aspartaam, glycerylmonostearaat, hypromellose, magnesiumstearaat, citroenzuur, titaniumdioxide, talk, kunstmatige aardbeiensmaak, polyethyleenglycol, polysorbaat 80 en ijzeroxide.
PREVACID SoluTab bevat 2,5 mg fenylalanine in elke tablet van 15 mg en 5,1 mg fenylalanine in elke tablet van 30 mg.
GEBRUIKSAANWIJZING
PREVACID (prev-a-sid) (lansoprazol) capsules met vertraagde afgifte, voor oraal gebruik en
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) oraal desintegrerende tabletten met vertraagde afgifte
Belangrijk:
- Neem PREVACID 15 mg of PREVACID 15 mg SoluTab voor de maaltijd in.
- Prevacid 15 mg capsules of PREVACID 30 mg SoluTab niet pletten of erop kauwen.
- PREVACID of PREVACID 15 mg SoluTab mag alleen worden gebruikt met de onderstaande voedingsmiddelen en sappen.
PREVACID capsules met vertraagde afgifte (PREVACID 30 mg capsules)
Inname van PREVACID 15 mg capsules met bepaalde voedingsmiddelen:
Je kunt alleen appelmoes, ENSURE pudding, kwark, yoghurt of gezeefde peren gebruiken.
Inname van PREVACID-capsules met bepaalde sappen:
Je kunt alleen appelsap, sinaasappelsap of tomatensap gebruiken.
Het geven van PREVACID-capsules via een neus-maagsonde (NG-sonde) maat 16 French of groter:
Je kunt alleen appelsap gebruiken.
PREVACID 15 mg SoluTab vertraagde afgifte oraal desintegrerende tabletten (PREVACID SoluTab)
Voor patiënten die moeite hebben met het doorslikken van tabletten, kan PREVACID SoluTab als volgt worden gegeven:
PREVACID SoluTab met water geven met een orale spuit:
PREVACID 15 mg SoluTab met water toedienen via een neus-maagsonde (NG-sonde) maat 8 French of groter:
Hoe moet ik PREVACID en PREVACID 30 mg SoluTab bewaren?
- Bewaar PREVACID-capsules en PREVACID 15 mg SoluTab bij kamertemperatuur tussen 20 ° C en 25 ° C (68 ° F tot 77 ° F).
Houd PREVACID en PREVACID 30 mg SoluTab en alle geneesmiddelen buiten het bereik van kinderen.
Deze gebruiksaanwijzing is goedgekeurd door de Amerikaanse Food and Drug Administration.
