Pentasa 400mg Mesalamine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Pentasa en hoe wordt het gebruikt?
Pentasa is een receptgeneesmiddel dat wordt gebruikt om de symptomen van colitis ulcerosa te behandelen. Pentasa 400 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Pentasa behoort tot een klasse geneesmiddelen die 5-aminosalicylzuurderivaten worden genoemd.
Het is niet bekend of Pentasa veilig en effectief is bij kinderen ouder dan 5 jaar.
Wat zijn de mogelijke bijwerkingen van Pentasa?
Pentasa kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- maagkrampen,
- bloederige diarree,
- koorts,
- hoofdpijn,
- huiduitslag,
- bloederige of teerachtige ontlasting,
- bloed ophoesten,
- braaksel dat op koffiedik lijkt,
- weinig of geen plassen,
- pijnlijk of moeilijk plassen,
- zwelling in uw voeten of enkels,
- moe of kortademig voelen,
- verlies van eetlust,
- pijn in de bovenbuik,
- vermoeidheid,
- gemakkelijk blauwe plekken of bloedingen,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Pentasa 400 mg zijn:
- misselijkheid,
- braken,
- buikpijn,
- diarree,
- indigestie,
- gas,
- hoofdpijn,
- uitslag, en
- abnormale leverfunctietesten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Pentasa. Vraag uw arts of apotheker om meer informatie.
OMSCHRIJVING
PENTASA (mesalamine) voor orale toediening is een formulering met gereguleerde afgifte van mesalamine, een aminosalicylaat-ontstekingsremmend middel voor gastro-intestinaal gebruik.
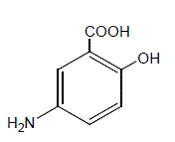
Chemisch gezien is mesalamine 5-amino-2-hydroxybenzoëzuur. Het heeft een molecuulgewicht van 153,14.
De structuurformule is:
Elke capsule van 250 mg bevat 250 mg mesalamine. Het bevat ook de volgende inactieve ingrediënten: geacetyleerde monoglyceride, ricinusolie, colloïdaal siliciumdioxide, ethylcellulose, hydroxypropylmethylcellulose, zetmeel, stearinezuur, suiker, talk en witte was. Het omhulsel van de capsule bevat D&C Yellow #10, FD&C Blue #1, FD&C Green #3, gelatine, titaniumdioxide en andere ingrediënten.
Elke capsule van 500 mg bevat 500 mg mesalamine. Het bevat ook de volgende inactieve ingrediënten: geacetyleerde monoglyceride, ricinusolie, colloïdaal siliciumdioxide, ethylcellulose, hydroxypropylmethylcellulose, zetmeel, stearinezuur, suiker, talk en witte was. Het omhulsel van de capsule bevat FD&C Blue #1, gelatine, titaniumdioxide en andere ingrediënten.
INDICATIES
PENTASA 400 mg is geïndiceerd voor de inductie van remissie en voor de behandeling van volwassen patiënten met licht tot matig actieve colitis ulcerosa.
DOSERING EN ADMINISTRATIE
De aanbevolen dosering voor de inductie van remissie en de symptomatische behandeling van licht tot matig actieve colitis ulcerosa bij volwassenen is 1 g (4 capsules PENTASA 250 mg of 2 capsules PENTASA 500 mg) 4 keer per dag voor een totale dagelijkse dosering van 4 g. De behandelingsduur in gecontroleerde onderzoeken was maximaal 8 weken.
PENTASA-capsules kunnen heel worden doorgeslikt, of de capsule kan worden geopend en de volledige inhoud op appelmoes of yoghurt worden gestrooid. De volledige inhoud moet onmiddellijk worden geconsumeerd. De capsules en de inhoud van de capsule mogen niet worden fijngemaakt of gekauwd.
Drink voldoende vloeistof.
De veiligheid en werkzaamheid van PENTASA 400 mg bij pediatrische patiënten zijn niet vastgesteld.
HOE GELEVERD
PENTASA verlengde afgifte 250 mg capsules worden geleverd in flessen van 240 capsules ( NDC 54092-189-81). Elke groene en blauwe capsule bevat 250 mg mesalamine in korrels met verlengde afgifte. PENTASA-capsules met verlengde afgifte zijn te herkennen aan een vijfhoekig starburst-logo en het nummer 2010 op het groene gedeelte en S429 250 mg op het blauwe gedeelte van de capsules.
PENTASA verlengde afgifte 500 mg capsules worden geleverd in flessen van 120 capsules ( NDC 54092-191-12). Elke blauwe capsule bevat 500 mg mesalamine in korrels met verlengde afgifte. PENTASA 400 mg capsules met verlengde afgifte zijn te herkennen aan een vijfhoekig starburst-logo en S429 500 mg op de capsules.
Bewaren bij 25°C (77°F); excursies toegestaan tot 15 ° C tot 30 ° C (59 ° F tot 86 ° F) [zie USP-gecontroleerde kamertemperatuur].
Om VERMOEDELIJKE ONGEWENSTE REACTIES te melden, neemt u contact op met Takeda Pharmaceuticals op 1800-828-2088 of FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.
Gedistribueerd door: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, VS. Herzien: november 2021
BIJWERKINGEN
In gecombineerde klinische onderzoeken in binnen- en buitenland kregen meer dan 2100 patiënten met colitis ulcerosa of de ziekte van Crohn een behandeling met PENTASA. Over het algemeen werd de behandeling met PENTASA goed verdragen. De meest voorkomende bijwerkingen (dwz groter dan of gelijk aan 1%) waren diarree (3,4%), hoofdpijn (2,0%), misselijkheid (1,8%), buikpijn (1,7%), dyspepsie (1,6%), braken (1,5 %), en uitslag (1,0%).
In twee binnenlandse placebogecontroleerde onderzoeken waarbij meer dan 600 patiënten met colitis ulcerosa betrokken waren, waren de bijwerkingen minder bij met PENTASA (mesalamine) behandelde patiënten dan in de placebogroep (PENTASA 14% versus placebo 18%) en waren ze niet dosisgerelateerd. Gebeurtenissen die bij meer dan 1% voorkomen, worden weergegeven in de onderstaande tabel. Hiervan kwamen alleen misselijkheid en braken vaker voor in de PENTASA-groep. Stopzetting van de behandeling vanwege bijwerkingen kwam vaker voor bij placebo dan bij PENTASA (7% versus 4%).
Klinische laboratoriummetingen toonden voor geen enkele test significante abnormale trends, inclusief meting van hematologische, lever- en nierfunctie.
De volgende bijwerkingen, gepresenteerd door het lichaamssysteem, werden niet vaak gemeld (dwz minder dan 1%) tijdens onderzoeken naar binnenlandse colitis ulcerosa en de ziekte van Crohn. In veel gevallen is de relatie met PENTASA niet vastgesteld.
Gastro-intestinaal: opgezette buik, anorexia, constipatie, zweer in de twaalfvingerige darm, dysfagie, oprisping, slokdarmzweer, fecale incontinentie, GGTP-verhoging, GI-bloeding, verhoogde alkalische fosfatase, LDH-verhoging, mondzweer, orale moniliasis, pancreatitis, rectale bloeding, SGOT-verhoging, SGPT-verhoging, abnormale ontlasting (verandering van kleur of textuur), dorst
Dermatologisch: acne, alopecia, droge huid, eczeem, erythema nodosum, nagelaandoening, lichtgevoeligheid, pruritus, zweten, urticaria
Zenuwstelsel: depressie, duizeligheid, slapeloosheid, slaperigheid, paresthesie
Cardiovasculair: hartkloppingen, pericarditis, vasodilatatie
Ander: albuminurie, amenorroe, toename amylase, artralgie, asthenie, pijn in de borst, conjunctivitis, ecchymose, oedeem, koorts, hematurie, hypomenorroe, Kawasaki-achtig syndroom, krampen in de benen, lichen planus, lipaseverhoging, malaise, menorragie, metrorragie, spierpijn, long , trombocytemie, trombocytopenie, urinaire frequentie
Een week na voltooiing van een 8 weken durend onderzoek naar colitis ulcerosa ontwikkelde een 72-jarige man, zonder voorgeschiedenis van longproblemen, dyspneu. De patiënt werd vervolgens gediagnosticeerd met interstitiële longfibrose zonder eosinofilie door een arts en bronchiolitis obliterans met organiserende pneumonitis door een tweede arts. Een causaal verband tussen deze gebeurtenis en de behandeling met mesalamine is niet vastgesteld.
In gepubliceerde casusrapporten en/of spontane postmarketingsurveillance zijn zeldzame gevallen beschreven van pericarditis, fatale myocarditis, pijn op de borst en T-golfafwijkingen, overgevoeligheidspneumonitis, pancreatitis, nefrotisch syndroom, interstitiële nefritis, hepatitis, aplastische anemie, pancytopenie, leukopenie, agranulocytose of bloedarmoede tijdens het ontvangen van mesalamine-therapie. Bloedarmoede kan een onderdeel zijn van de klinische presentatie van inflammatoire darmaandoeningen. Allergische reacties, die eosinofilie kunnen inhouden, kunnen worden waargenomen in verband met de behandeling met PENTASA 400 mg.
Postmarketingrapporten
De volgende gebeurtenissen zijn vastgesteld tijdens het gebruik van het PENTASA-merk mesalamine na goedkeuring in de klinische praktijk. Omdat ze vrijwillig worden gerapporteerd vanuit een populatie van onbekende omvang, kunnen schattingen van de frequentie niet worden gemaakt. Deze voorvallen zijn gekozen voor opname vanwege een combinatie van ernst, frequentie van rapportage of mogelijk causaal verband met mesalamine:
Gastro-intestinaal: Meldingen van hepatotoxiciteit, waaronder verhoogde leverenzymen (SGOT/AST, SGPT/ALT, GGT, LDH, alkalische fosfatase, bilirubine), hepatitis, geelzucht, cholestatische geelzucht, cirrose en mogelijke hepatocellulaire schade waaronder levernecrose en leverfalen. Sommige van deze gevallen waren fataal. Eén geval van Kawasaki-achtig syndroom met veranderingen in de leverfunctie werd ook gemeld.
Ander: anafylactische reactie, SJS/TEN, DRESS, AGEP, pleuritis/pleuritis, pneumonitis, granulocytopenie, systemische lupus erythematodes, lupusachtig syndroom, acuut nierfalen, interstitiële longziekte, overgevoeligheidspneumonitis (inclusief interstitiële pneumonitis, allergische alveolitis, pneuemonosinofiele), chronisch nierfalen, nefrogene diabetes insipidus, nefrolithiasis, intracraniële hypertensie, angio-oedeem en oligospermie (reversibel).
DRUG-INTERACTIES
Er is geen onderzoek gedaan naar interacties tussen PENTASA 400 mg en andere geneesmiddelen; de volgende geneesmiddelinteracties zijn echter gemeld voor producten die mesalamine bevatten:
Nefrotoxische middelen, waaronder niet-steroïde anti-inflammatoire geneesmiddelen
Gelijktijdig gebruik van mesalamine met bekende nefrotoxische middelen, waaronder niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), kan het risico op nefrotoxiciteit verhogen. Monitor patiënten die nefrotoxische geneesmiddelen gebruiken op veranderingen in de nierfunctie en mesalamine-gerelateerde bijwerkingen.

Azathioprine of 6-mercaptopurine
Gelijktijdig gebruik van mesalamine met azathioprine of 6-mercaptopurine en/of andere geneesmiddelen waarvan bekend is dat ze myelotoxiciteit veroorzaken, kan het risico op bloedaandoeningen, beenmergfalen en bijbehorende complicaties verhogen. Als gelijktijdig gebruik van PENTASA en azathioprine of 6-mercaptopurine niet kan worden vermeden, controleer dan de bloedtesten, inclusief het volledige aantal bloedcellen en het aantal bloedplaatjes.
WAARSCHUWINGEN
Geen informatie verstrekt
PREVENTIEVE MAATREGELEN
Nierfunctiestoornis
Nierinsufficiëntie, waaronder minimale verandering van de ziekte, acute en chronische interstitiële nefritis en nierfalen zijn gemeld bij patiënten die PENTASA of andere producten kregen die mesalamine bevatten of worden omgezet in mesalamine.
Van mesalamine is bekend dat het grotendeels door de nieren wordt uitgescheiden, en het risico op bijwerkingen kan groter zijn bij patiënten met een verminderde nierfunctie. Evalueer de nierfunctie bij alle patiënten voorafgaand aan de start en periodiek tijdens de behandeling met PENTASA. Evalueer de risico's en voordelen van het gebruik van PENTASA bij patiënten met een bekende nierfunctiestoornis of een voorgeschiedenis van nierziekte of bij gelijktijdig gebruik van nefrotoxische geneesmiddelen.
Door mesalamine geïnduceerd acuut intolerantiesyndroom
Mesalamine is in verband gebracht met een acuut intolerantiesyndroom dat moeilijk te onderscheiden is van een opflakkering van inflammatoire darmaandoeningen. Symptomen zijn onder meer krampen, acute buikpijn, bloederige diarree en soms koorts, hoofdpijn en huiduitslag. Controleer patiënten op verergering van deze symptomen tijdens de behandeling. Als een acuut intolerantiesyndroom wordt vermoed, stop dan onmiddellijk met de behandeling met PENTASA.
Overgevoeligheidsreacties
Overgevoeligheidsreacties zijn gemeld bij patiënten die sulfasalazine gebruikten. Sommige patiënten kunnen een soortgelijke reactie hebben op PENTASA of op andere verbindingen die mesalamine bevatten of worden omgezet in mesalamine.
Net als bij sulfasalazine kunnen door mesalamine geïnduceerde overgevoeligheidsreacties optreden als interne organen, waaronder myocarditis, pericarditis, nefritis, hepatitis, pneumonitis en hematologische afwijkingen. Evalueer patiënten onmiddellijk als er tekenen of symptomen van een overgevoeligheidsreactie aanwezig zijn. Stop met PENTASA als er geen alternatieve etiologie voor de tekenen en symptomen kan worden vastgesteld.
Leverfalen
Er zijn meldingen geweest van leverfalen bij patiënten met een reeds bestaande leverziekte die andere producten kregen toegediend die mesalamine bevatten. Evalueer de risico's en voordelen van het gebruik van PENTASA 400 mg bij patiënten met een bekende leverfunctiestoornis.
Ernstige cutane bijwerkingen
Ernstige cutane bijwerkingen, zoals Stevens-Johnson-syndroom (SJS) en toxische epidermale necrolyse (TEN), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) en acute gegeneraliseerde exanthemateuze pustulose (AGEP) zijn gemeld bij het gebruik van mesalamine (zien ONGEWENSTE REACTIES ). Stop met PENTASA bij de eerste tekenen of symptomen van ernstige huidbijwerkingen of andere tekenen van overgevoeligheid en overweeg verdere evaluatie.
lichtgevoeligheid
Patiënten met reeds bestaande huidaandoeningen zoals atopische dermatitis en atopisch eczeem hebben ernstigere fotosensibiliteitsreacties gemeld. Adviseer patiënten om blootstelling aan de zon te vermijden, beschermende kleding te dragen en buitenshuis een breedspectrumzonnescherm te gebruiken.
Nefrolithiase
Er zijn gevallen van nefrolithiase gemeld bij het gebruik van mesalamine, waaronder stenen met een mesalaminegehalte van 100%. Mesalamine-bevattende stenen zijn radiotransparant en niet detecteerbaar door standaard radiografie of computertomografie (CT). Zorg voor voldoende hydratatie tijdens de behandeling.
Interferentie met laboratoriumtests
Het gebruik van mesalamine kan leiden tot oneigenlijk verhoogde testresultaten bij het meten van urine-normetanefrine door vloeistofchromatografie met elektrochemische detectie vanwege de overeenkomst in de chromatogrammen van normetanefrine en de belangrijkste metaboliet van mesalamine, N-acetyl-5-aminosalicylzuur (N-Ac-5-ASA ). Overweeg een alternatieve, selectieve test voor normetanefrine.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 104 weken durende carcinogeniteitsstudie met mesalamine via de voeding werden CD-1-muizen behandeld met doses tot 2500 mg/kg/dag en het was niet tumorverwekkend. Voor een persoon van 50 kg met een gemiddelde lengte (1,46 m2 lichaamsoppervlak) vertegenwoordigt dit 2,5 keer de aanbevolen dosis voor de mens op basis van lichaamsoppervlakte (2960 mg/m2/dag). In een 104 weken durende carcinogeniteitsstudie via de voeding bij Wistar-ratten was mesalamine tot een dosis van 800 mg/kg/dag niet tumorverwekkend. Deze dosis vertegenwoordigt 1,5 keer de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak.
Er werd geen bewijs van mutageniteit waargenomen in een in vitro Ames-test en in een in vivo micronucleustest bij muizen.
Er werden geen effecten op de vruchtbaarheid of het reproductievermogen waargenomen bij mannelijke of vrouwelijke ratten bij orale doses mesalamine tot 400 mg/kg/dag (0,8 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak).
Spermaafwijkingen en onvruchtbaarheid bij mannen, die zijn gemeld in verband met sulfasalazine, zijn niet waargenomen met PENTASA 400 mg capsules tijdens gecontroleerde klinische onderzoeken.
Zwangerschap
Teratogene effecten
Gepubliceerde gegevens van meta-analyses, cohortstudies en casusreeksen over het gebruik van mesalamine tijdens de zwangerschap hebben geen betrouwbaar verband aangetoond met mesalamine en ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten. Er is geen duidelijk bewijs dat blootstelling aan mesalamine tijdens de vroege zwangerschap geassocieerd is met een verhoogd risico op ernstige aangeboren afwijkingen, waaronder hartafwijkingen. Gepubliceerde epidemiologische onderzoeken hebben belangrijke methodologische beperkingen die de interpretatie van de gegevens belemmeren, waaronder het onvermogen om confounders te controleren, zoals onderliggende maternale ziekte, maternale gebruik van gelijktijdige medicatie en ontbrekende informatie over de dosis en duur van het gebruik van mesalamineproducten. PENTASA mag alleen tijdens de zwangerschap worden gebruikt als de voordelen opwegen tegen de risico's.
In reproductiestudies bij dieren bracht orale toediening van mesalamine tijdens de organogenese aan drachtige ratten in doses tot 1000 mg/kg/dag (5900 mg/m²) en konijnen in doses van 800 mg/kg/dag (6856 mg/m²) geen bewijs aan het licht. van teratogene effecten of schade aan de foetus als gevolg van mesalamine.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populaties is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Nietteratogene effecten
Gepubliceerde gegevens suggereren dat verhoogde ziekteactiviteit geassocieerd is met het risico op het ontwikkelen van nadelige zwangerschapsuitkomsten bij vrouwen met colitis ulcerosa. Ongunstige zwangerschapsuitkomsten zijn onder meer vroeggeboorte (vóór 37 weken zwangerschap), baby's met een laag geboortegewicht (minder dan 2500 g) en klein voor de zwangerschapsduur bij de geboorte.
Moeders die borstvoeding geven
Gegevens uit gepubliceerde literatuur melden de aanwezigheid van mesalamine en zijn metaboliet, N-acetyl-5-aminosalicylzuur in moedermelk in kleine hoeveelheden met relatieve zuigelingendoses (RID) van 0,1% of minder voor mesalamine. De klinische betekenis hiervan is niet vastgesteld en er is beperkte ervaring met vrouwen die borstvoeding geven en mesalamine gebruiken.
Er zijn meldingen van diarree waargenomen bij zuigelingen die borstvoeding krijgen en die zijn blootgesteld aan mesalamine. Het effect van PENTASA 400 mg op de melkproductie is niet bekend. Wees voorzichtig als PENTASA 400 mg wordt toegediend aan een vrouw die borstvoeding geeft en controleer zuigelingen die borstvoeding krijgen op diarree.
In gepubliceerde lactatiestudies varieerden de doses mesalamine van de moeder van verschillende orale en rectale formuleringen en producten van 500 mg tot 4,8 g per dag. De gemiddelde concentratie mesalamine in melk varieerde van niet-detecteerbaar tot 0,5 mg/L. De gemiddelde concentratie N-acetyl-5-aminosalicylzuur in melk varieerde van 0,2 tot 9,3 mg/L. Op basis van deze concentraties zijn de geschatte dagelijkse zuigelingendoseringen voor een zuigeling die uitsluitend borstvoeding krijgt 0 tot 0,075 mg/kg/dag mesalamine (RID 0% tot 0,1%) en 0,03 tot 1,4 mg/kg/dag N-acetyl-5-aminosalicylzuur zuur.
Pediatrisch gebruik
De veiligheid en werkzaamheid van PENTASA bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met PENTASA 400 mg omvatten niet voldoende aantallen patiënten van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere patiënten. Rapporten uit ongecontroleerde klinische onderzoeken en postmarketingrapportagesystemen suggereerden een hogere incidentie van bloeddyscrasieën (dwz agranulocytose, neutropenie en pancytopenie) bij patiënten die mesalaminebevattende producten zoals PENTASA 400 mg kregen en die 65 jaar of ouder waren in vergelijking met jongere patiënten. Controleer het volledige aantal bloedcellen en het aantal bloedplaatjes bij oudere patiënten tijdens de behandeling met PENTASA.
Houd bij het voorschrijven van PENTASA in het algemeen rekening met de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling bij oudere patiënten.
OVERDOSERING
PENTASA 400 mg is een aminosalicylaat en symptomen van salicylaattoxiciteit kunnen mogelijk zijn, zoals: misselijkheid, braken, buikpijn, tachypneu, hyperpneu, tinnitus en neurologische symptomen (hoofdpijn, duizeligheid, verwardheid, toevallen). Ernstige intoxicatie met salicylaten kan leiden tot verstoring van de elektrolyten- en bloed-pH en mogelijk tot schade aan andere organen (bijv. nier- en lever).
Behandeling van overdosering
Er is geen specifiek antidotum voor een overdosis mesalamine; conventionele therapie voor salicylaattoxiciteit kan echter gunstig zijn in het geval van acute overdosering en kan ontsmetting van het maagdarmkanaal omvatten om verdere absorptie te voorkomen. Corrigeer de verstoring van de vocht- en elektrolytenbalans door de toediening van geschikte intraveneuze therapie en behoud een adequate nierfunctie.
CONTRA-INDICATIES
PENTASA is gecontra-indiceerd bij patiënten met bekende of vermoede overgevoeligheid voor salicylaten, aminosalicylaten of enig bestanddeel van dit medicijn.
KLINISCHE FARMACOLOGIE
Sulfasalazine wordt door bacteriële werking in de dikke darm gesplitst in sulfapyridine (SP) en mesalamine (5-ASA). De gebruikelijke orale dosis sulfasalazine voor actieve colitis ulcerosa bij volwassenen is 2 tot 4 g per dag in verdeelde doses. Vier gram sulfasalazine levert 1,6 g vrij mesalamine aan de dikke darm.
Het werkingsmechanisme van mesalamine (en sulfasalazine) is niet volledig begrepen, maar het lijkt een actueel ontstekingsremmend effect op colonepitheelcellen te zijn. De mucosale productie van metabolieten van arachidonzuur (AA), zowel via de cyclo-oxygenaseroutes (dwz prostanoïden) als via de lipoxygenaseroutes (dwz leukotriënen (LT's) en hydroxyeicosatetraeenzuren (HETE's), is verhoogd bij patiënten met colitis ulcerosa, en het is mogelijk dat mesalamine de ontsteking vermindert door cyclo-oxygenase te blokkeren en de productie van prostaglandine (PG) in de dikke darm te remmen.
Menselijke farmacokinetiek en metabolisme
Absorptie
PENTASA is een met ethylcellulose gecoate formulering van mesalamine met verlengde afgifte, ontworpen om therapeutische hoeveelheden mesalamine door het maagdarmkanaal af te geven. Op basis van gegevens over uitscheiding via de urine wordt 20% tot 30% van het mesalamine in PENTASA geabsorbeerd. Wanneer mesalamine daarentegen oraal wordt toegediend als een niet-geformuleerde waterige suspensie van 1 g, wordt mesalamine voor ongeveer 80% geabsorbeerd.
De plasmaconcentratie van mesalamine bereikte een piek van ongeveer 1 mcg/ml 3 uur na een dosis van 1 g PENTASA en nam bifasisch af. De literatuur beschrijft een gemiddelde terminale halfwaardetijd van 42 minuten voor mesalamine na intraveneuze toediening. Vanwege de continue afgifte en absorptie van mesalamine uit PENTASA door het gehele maagdarmkanaal kan de werkelijke eliminatiehalfwaardetijd niet worden bepaald na orale toediening. N-acetyl-5-aminosalicylzuur, de belangrijkste metaboliet van mesalamine (5-aminosalicylzuur), bereikte een piek van ongeveer 3 uur bij 1,8 mcg/ml, en de concentratie ervan volgde een bifasische afname. De farmacologische werking van N-acetyl-5-aminosalicylzuur is niet bekend en er zijn geen andere metabolieten geïdentificeerd.
De farmacokinetiek van oraal mesalamine was niet-lineair wanneer PENTASA-capsules werden gedoseerd van 250 mg tot 1 g viermaal daags, waarbij de steady-state plasmaconcentraties van mesalamine ongeveer negenmaal stegen, van 0,14 mcg/ml tot 1,21 mcg/ml, wat wijst op een verzadigbaar first-pass metabolisme. De farmacokinetiek van N-acetyl-5-aminosalicylzuur was lineair.
Eliminatie
Ongeveer 130 mg vrij mesalamine werd teruggevonden in de feces na een enkele dosis van 1 g PENTASA 400 mg, wat vergelijkbaar was met de 140 mg mesalamine die werd teruggevonden uit de molaire equivalente sulfasalazinetabletdosis van 2,5 g. De eliminatie van vrij mesalamine en salicylaten in de feces nam evenredig toe met de dosis PENTASA. N-acetyl-5-aminosalicylzuur was de primaire verbinding die in de urine werd uitgescheiden (19% tot 30%) na een dosering van PENTASA 400 mg.
Klinische proeven
In twee gerandomiseerde, dubbelblinde, placebogecontroleerde dosis-responsonderzoeken (UC-1 en UC-2) bij 625 patiënten met actieve milde tot matige colitis ulcerosa, PENTASA 400 mg, in een orale dosis van 4 g/dag gegeven 1 g viermaal daags, produceerde een consistente verbetering in prospectief geïdentificeerde primaire werkzaamheidsparameters, PGA, Tx F en SI, zoals weergegeven in de onderstaande tabel.
De dosis van 4 g PENTASA gaf ook een consistente verbetering van de secundaire werkzaamheidsparameters, namelijk de frequentie van toiletbezoeken, de consistentie van de ontlasting, rectale bloeding, abdominale/rectale pijn en urgentie. De dosis van 4 g PENTASA induceerde remissie zoals beoordeeld aan de hand van endoscopische en symptomatische eindpunten.
Bij sommige patiënten werd waargenomen dat de dosis van 2 g PENTASA 400 mg de gemeten werkzaamheidsparameters verbeterde. De dosis van 2 g gaf echter inconsistente resultaten in primaire werkzaamheidsparameters in de twee adequate en goed gecontroleerde onderzoeken.
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de PREVENTIEVE MAATREGELEN sectie.
