Prilosec 40mg, 10mg, 20mg Omeprazole Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Prilosec 40 mg en hoe wordt het gebruikt?
Prilosec 40 mg is een receptplichtig en vrij verkrijgbaar geneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van gastro-oesofageale refluxziekte (GERD), maagzweren en andere aandoeningen veroorzaakt door overmatig maagzuur. Prilosec 10 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Prilosec behoort tot een klasse geneesmiddelen die protonpompremmers worden genoemd.
Het is niet bekend of Prilosec 40 mg veilig en effectief is bij kinderen jonger dan 1 maand.
Wat zijn de mogelijke bijwerkingen van Prilosec 10 mg?
Prilosec kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree die waterig of bloederig is,
- nieuwe of ongebruikelijke pijn in pols, dij, heup of rug,
- toevallen (convulsies),
- weinig of geen plassen,
- bloed in uw urine,
- zwelling,
- snelle gewichtstoename,
- duizeligheid,
- onregelmatige hartslagen,
- zenuwachtig voelen,
- spierkrampen,
- spiertrekkingen,
- hoesten,
- verstikkend gevoel,
- gewrichtspijn, en
- huiduitslag op uw wangen of armen die verergert door zonlicht
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Prilosec zijn:
- buikpijn,
- gas,
- misselijkheid,
- braken,
- diarree, en
- hoofdpijn
OMSCHRIJVING
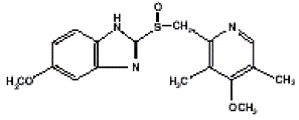
Het werkzame bestanddeel in PRILOSEC (omeprazol) Capsules met vertraagde afgifte is een gesubstitueerd benzimidazool, 5-methoxy-2-[[(4-methoxy-3, 5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazool, een verbinding die de maagzuursecretie remt. De empirische formule is C17H19N3O3S, met een molecuulgewicht van 345,42. De structuurformule is:
Omeprazol is een wit tot gebroken wit kristallijn poeder dat smelt bij ontleding bij ongeveer 155°C. Het is een zwakke base, goed oplosbaar in ethanol en methanol, en slecht oplosbaar in aceton en isopropanol en zeer slecht oplosbaar in water. De stabiliteit van omeprazol is een functie van de pH; het wordt snel afgebroken in zure media, maar heeft een acceptabele stabiliteit onder alkalische omstandigheden.
Het actieve ingrediënt in PRILOSEC (omeprazol magnesium) voor orale suspensie met vertraagde afgifte is 5-Methoxy-2-[[(4-methoxy-3,5-dimethyl-2-pyridinyl)methyl]sulfinyl]-1H-benzimidazool, magnesium zout (2:1)
Omeprazol magnesium is een wit tot gebroken wit poeder met een smeltpunt met afbraak bij 200°C. Het zout is enigszins oplosbaar (0,25 mg/ml) in water bij 25°C en het is oplosbaar in methanol. De halfwaardetijd is sterk pH-afhankelijk.
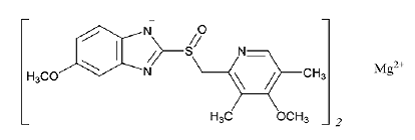
De empirische formule voor magnesium omeprazol is (C17H18N3O3S)2 Mg, het molecuulgewicht is 713,12 en de structuurformule is:
PRILOSEC wordt geleverd als capsules met vertraagde afgifte voor orale toediening. Elke capsule met vertraagde afgifte bevat 10 mg, 20 mg of 40 mg omeprazol in de vorm van maagsapresistente korrels met de volgende inactieve ingrediënten: cellulose, dinatriumwaterstoffosfaat, hydroxypropylcellulose, hypromellose, lactose, mannitol, natriumlaurylsulfaat en andere ingrediënten. De capsulehulzen bevatten de volgende inactieve ingrediënten: gelatine-NF, FD&C Blue #1, FD&C Red #40, D&C Red #28, titaniumdioxide, synthetisch zwart ijzeroxide, isopropanol, butylalcohol, FD&C Blue #2, D&C Red #7 Calcium Lake en bovendien bevatten de capsulehulzen van 10 mg en 40 mg ook D&C Yellow #10.
Elk pakket PRILOSEC voor orale suspensie met vertraagde afgifte bevat 2,8 mg of 11,2 mg omeprazol magnesium (overeenkomend met 2,5 mg of 10 mg omeprazol), in de vorm van maagsapresistente korrels met de volgende inactieve ingrediënten: glycerylmonostearaat, hydroxypropyl cellulose, hypromellose, magnesiumstearaat, methacrylzuurcopolymeer C, polysorbaat, suikerbolletjes, talk en triethylcitraat, en ook inactieve korrels. De inactieve korrels zijn samengesteld uit de volgende ingrediënten: citroenzuur, crospovidon, dextrose, hydroxypropylcellulose, ijzeroxide en xanthaangom. De omeprazol-korrels en inactieve korrels worden gevormd met water om een suspensie te vormen en worden toegediend via orale, nasogastrische of directe maagtoediening.
INDICATIES
Behandeling van actieve duodenumulcus
PRILOSEC 20 mg is geïndiceerd voor de kortdurende behandeling van actieve zweren aan de twaalfvingerige darm bij volwassenen. De meeste patiënten genezen binnen vier weken. Sommige patiënten hebben mogelijk nog eens vier weken therapie nodig.
Uitroeiing van Helicobacter pylori om het risico op terugkeer van duodenumzweren te verminderen
Het is aangetoond dat de uitroeiing van H. pylori het risico op herhaling van een ulcus duodeni vermindert.
Drievoudige therapie
PRILOSEC 40 mg in combinatie met claritromycine en amoxicilline is geïndiceerd voor de behandeling van patiënten met H. pylori-infectie en ulcus duodeni (actief of tot 1 jaar voorgeschiedenis) om H. pylori bij volwassenen uit te roeien.
Dubbele therapie
PRILOSEC in combinatie met claritromycine is geïndiceerd voor de behandeling van patiënten met H. pylori-infectie en ulcus duodeni om H. pylori bij volwassenen uit te roeien.
Bij patiënten bij wie de therapie faalt, is de kans groter dat PRILOSEC met claritromycine wordt geassocieerd met de ontwikkeling van claritromycine-resistentie in vergelijking met drievoudige therapie. Bij patiënten bij wie de therapie faalt, moeten gevoeligheidstesten worden uitgevoerd. Als resistentie tegen claritromycine wordt aangetoond of gevoeligheidstests niet mogelijk zijn, moet een alternatieve antimicrobiële therapie worden ingesteld [zie KLINISCHE FARMACOLOGIE en de claritromycine-voorschrijfinformatie, sectie Microbiologie].
Behandeling van actieve goedaardige maagzweer
PRILOSEC is geïndiceerd voor kortdurende behandeling (4 tot 8 weken) van actieve goedaardige maagzweren bij volwassenen.
Behandeling van symptomatische gastro-oesofageale refluxziekte (GERD)
PRILOSEC is geïndiceerd voor de behandeling van brandend maagzuur en andere symptomen geassocieerd met GERD gedurende maximaal 4 weken bij patiënten van 1 jaar en ouder.
Behandeling van erosieve oesofagitis (EE) als gevolg van door zuur gemedieerde GERD
Pediatrische patiënten van 1 jaar tot volwassenen
PRILOSEC 20 mg is geïndiceerd voor de kortdurende behandeling (4 tot 8 weken) van EE als gevolg van door zuur gemedieerde GERD die is gediagnosticeerd door endoscopie bij patiënten van 1 jaar en ouder.
De werkzaamheid van PRILOSEC 10 mg bij gebruik langer dan 8 weken bij patiënten met EE is niet vastgesteld. Als een patiënt niet reageert op een behandeling van 8 weken, kan een extra behandeling van 4 weken worden gegeven. Als EE- of GERD-symptomen terugkeren (bijv. brandend maagzuur), kunnen aanvullende kuren van 4 tot 8 weken met PRILOSEC worden overwogen.
Pediatrische patiënten van 1 maand tot minder dan 1 jaar oud
PRILOSEC is geïndiceerd voor de kortdurende behandeling (tot 6 weken) van EE als gevolg van zuurgemedieerde GORZ bij pediatrische patiënten van 1 maand tot jonger dan 1 jaar.
Onderhoud van genezing van EE door zuur-gemedieerde GERD
PRILOSEC 40 mg is geïndiceerd voor de instandhouding van de genezing van EE als gevolg van door zuur gemedieerde GERD bij patiënten van 1 jaar en ouder.
Gecontroleerde studies duren niet langer dan 12 maanden.
Pathologische hypersecretoire aandoeningen
PRILOSEC 40 mg is geïndiceerd voor de langdurige behandeling van pathologische hypersecretoire aandoeningen (bijv. Zollinger-Ellison-syndroom, meerdere endocriene adenomen en systemische mastocytose) bij volwassenen.
DOSERING EN ADMINISTRATIE
Aanbevolen doseringsschema voor volwassenen op indicatie
Tabel 1 toont de aanbevolen dosering van PRILOSEC 40 mg bij volwassen patiënten per indicatie.
Aanbevolen pediatrisch doseringsschema op indicatie
Tabel 2 toont de aanbevolen dosering van PRILOSEC bij pediatrische patiënten per indicatie.
Beheer instructies
- PRILOSEC 40 mg is bedoeld om te worden bereid in water en oraal of via een nasogastrische (NG) of maagsonde te worden toegediend.
- Neem PRILOSEC 40 mg voor de maaltijd.
- Antacida kunnen gelijktijdig met PRILOSEC worden gebruikt.
- Gemiste doses: Als een dosis wordt gemist, zo snel mogelijk toedienen. Als de volgende geplande dosis echter moet worden ingenomen, neem dan de gemiste dosis niet in en neem de volgende dosis op tijd in. Neem geen twee doses tegelijk om een vergeten dosis in te halen.
Orale toediening in water
Toediening met water via een NG of maagsonde (maat 6 of groter)
HOE GELEVERD
Doseringsvormen en sterke punten
PRILOSEC Voor orale suspensie met vertraagde afgifte: 2,5 mg en 10 mg omeprazol in eenheidsdosisverpakkingen die een fijn geel poeder bevatten, bestaande uit witte tot bruinachtige magnesiumkorrels van omeprazol en lichtgele inactieve korrels.
Opslag en behandeling
PRILOSEC (omeprazolmagnesium) voor orale suspensie met vertraagde afgifte, 2,5 mg of 10 mg omeprazol, wordt geleverd als een eenheidsdosispakket met een fijn geel poeder, bestaande uit witte tot bruinachtige magnesiumkorrels van omeprazol en lichtgele inactieve korrels. PRILOSEC-eenheidsdosispakketten worden als volgt geleverd:
NDC 70515-625-01 eenheidsdosisverpakkingen van 30: 2,5 mg pakketten NDC 70515-610 - 01 eenheidsdosisverpakkingen van 30: pakketten van 10 mg
Opslag
Bewaar PRILOSEC voor orale suspensie met vertraagde afgifte bij 25 ° C (77 ° F); excursies toegestaan tot 15 – 30°C (59 – 86°F). [Zien USP-gecontroleerde kamertemperatuur .]
Gefabriceerd voor: Covis Pharma, Zug, 6300 Zwitserland. Herzien: maart 2022
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering beschreven:
- Acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridium difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Botbreuk [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige cutane bijwerkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cutane en systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cyanocobalamine (vitamine B-12)-tekort [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hypomagnesiëmie en mineraal metabolisme [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Fundische klierpoliepen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven met PRILOSEC
Monotherapie
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De hieronder beschreven veiligheidsgegevens weerspiegelen de blootstelling aan omeprazol-magnesiumcapsules met vertraagde afgifte bij 3096 patiënten uit wereldwijde klinische onderzoeken (465 patiënten uit Amerikaanse onderzoeken en 2631 patiënten uit internationale onderzoeken). Indicaties die klinisch zijn onderzocht in Amerikaanse onderzoeken omvatten ulcus duodeni, resistente ulcera en het Zollinger-Ellison-syndroom. De internationale klinische onderzoeken waren dubbelblind en open-label van opzet. De meest voorkomende bijwerkingen die werden gemeld (dwz met een incidentie van ≥2%) van met PRILOSEC behandelde patiënten die deelnamen aan deze onderzoeken waren hoofdpijn (7%), buikpijn (5%), misselijkheid (4%), diarree (4% ), braken (3%) en winderigheid (3%).
Bijkomende bijwerkingen die werden gemeld met een incidentie ≥1% waren onder meer zure oprispingen (2%), infectie van de bovenste luchtwegen (2%), constipatie (2%), duizeligheid (2%), huiduitslag (2%), asthenie (1% ), rugpijn (1%) en hoesten (1%).
Het veiligheidsprofiel van klinische onderzoeken bij patiënten ouder dan 65 jaar was vergelijkbaar met dat bij patiënten van 65 jaar of jonger.
Het veiligheidsprofiel van klinisch onderzoek bij pediatrische patiënten die omeprazol-magnesiumcapsules met vertraagde afgifte kregen, was vergelijkbaar met dat bij volwassen patiënten. Uniek voor de pediatrische populatie werden echter vaak bijwerkingen van het ademhalingssysteem gemeld in de leeftijdsgroep van 1 maand tot Gebruik bij specifieke populaties ].
Klinische onderzoeken Ervaring met PRILOSEC 20 mg in combinatietherapie voor uitroeiing van H. pylori
In klinische onderzoeken met ofwel een dubbele therapie met omeprazol-magnesiumcapsules met vertraagde afgifte en claritromycine, of drievoudige therapie met omeprazol-magnesiumcapsules met vertraagde afgifte, claritromycine en amoxicilline, werden geen bijwerkingen waargenomen die uniek zijn voor deze geneesmiddelcombinaties. De waargenomen bijwerkingen waren beperkt tot de bijwerkingen die eerder werden gemeld met alleen omeprazol, claritromycine of amoxicilline.
Dual Therapy (omeprazol magnesium capsules met vertraagde afgifte/claritromycine)
Bijwerkingen die zijn waargenomen in gecontroleerde klinische onderzoeken met combinatietherapie met omeprazol-magnesiumcapsules met vertraagde afgifte en claritromycine (n = 346) die verschilden van de eerder beschreven voor alleen omeprazolmagnesiumcapsules met vertraagde afgifte, waren smaakverstoring (15%), tongverkleuring (2 %), rhinitis (2%), faryngitis (1%) en griepsyndroom (1%). (Raadpleeg voor meer informatie over claritromycine de voorschrijfinformatie voor claritromycine, rubriek Bijwerkingen.)
Triple Therapy (omeprazol magnesium capsules met vertraagde afgifte/claritromycine/amoxicilline)
De meest voorkomende bijwerkingen die werden waargenomen in klinische onderzoeken met combinatietherapie met omeprazol-magnesiumcapsules met vertraagde afgifte, claritromycine en amoxicilline (n = 274) waren diarree (14%), smaakverstoring (10%) en hoofdpijn (7%). Geen van deze trad op met een hogere frequentie dan die gemeld door patiënten die alleen antimicrobiële middelen gebruikten. (Voor meer informatie over claritromycine of amoxicilline, zie de respectievelijke voorschrijfinformatie, rubrieken over bijwerkingen.)
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van omeprazol na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting van hun werkelijke frequentie of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam als geheel: Overgevoeligheidsreacties waaronder anafylaxie, anafylactische shock, angio-oedeem, bronchospasme, interstitiële nefritis, urticaria (zie ook Huid hieronder); koorts; pijn; vermoeidheid; malaise; systemische lupus erythematosus
Cardiovasculair: Pijn op de borst of angina, tachycardie, bradycardie, hartkloppingen, verhoogde bloeddruk, perifeer oedeem
Endocrien: gynaecomastie
Gastro-intestinaal: Pancreatitis (sommige fataal), anorexia, prikkelbare dikke darm, fecale verkleuring, oesofageale candidiasis, mucosale atrofie van de tong, stomatitis, abdominale zwelling, droge mond, microscopische colitis, fundic gland poliepen.
Gastroduodenale carcinoïden zijn gemeld bij patiënten met het ZE-syndroom die langdurig met omeprazol werden behandeld. Aangenomen wordt dat deze bevinding een manifestatie is van de onderliggende aandoening, waarvan bekend is dat deze geassocieerd is met dergelijke tumoren.
lever: Leverziekte waaronder leverfalen (sommige fataal), levernecrose (sommige fataal), hepatische encefalopathie hepatocellulaire ziekte, cholestatische ziekte, gemengde hepatitis, geelzucht en verhogingen van leverfunctietesten [ALT, AST, GGT, alkalische fosfatase en bilirubine]
Infecties en parasitaire aandoeningen: Clostridium difficile-geassocieerde diarree
Metabolisme en voedingsstoornissen: Hypomagnesiëmie, hypocalciëmie, hypokaliëmie [Waarschuwingen en voorzorgsmaatregelen 5.9], hyponatriëmie, hypoglykemie, gewichtstoename
Musculoskeletaal: Spierzwakte, myalgie, spierkrampen, gewrichtspijn, pijn in de benen, botbreuk
Zenuwstelsel/psychiatrisch: Psychische en slaapstoornissen waaronder depressie, opwinding, agressie, hallucinaties, verwardheid, slapeloosheid, nervositeit, apathie, slaperigheid, angst en droomafwijkingen; tremoren, paresthesie; hoogtevrees
Ademhaling: Epistaxis, faryngeale pijn
Huid: Ernstige gegeneraliseerde huidreacties waaronder toxische SJS/TEN (sommige fataal), DRESS, AGEP, cutane lupus erythematosus en erythema multiforme; lichtgevoeligheid; netelroos; uitslag; huidontsteking; jeuk; petechiën; purpura; alopecia; droge huid; hyperhidrose
Speciale zintuigen: Tinnitus, smaakperversie
Oculair: Optische atrofie, anterieure ischemische optische neuropathie, optische neuritis, droge-ogen-syndroom, oculaire irritatie, wazig zien, dubbel zien
Urogenitaal: Interstitiële nefritis, hematurie, proteïnurie, verhoogd serumcreatinine, microscopische pyurie, urineweginfectie, glycosurie, urinaire frequentie, testiculaire pijn
Hematologische: Agranulocytose (sommige fataal), hemolytische anemie, pancytopenie, neutropenie, anemie, trombocytopenie, leukopenie, leukocytose
DRUG-INTERACTIES
Tabellen 3 en 4 bevatten geneesmiddelen met klinisch belangrijke geneesmiddelinteracties en interactie met diagnostiek bij gelijktijdige toediening met omeprazol en instructies om deze te voorkomen of te behandelen.
Raadpleeg de etikettering van gelijktijdig gebruikte geneesmiddelen voor meer informatie over interacties met PPI's.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Aanwezigheid van maagmaligniteit
Bij volwassenen sluit de symptomatische respons op behandeling met PRILOSEC de aanwezigheid van maagmaligniteiten niet uit. Overweeg aanvullende follow-up en diagnostische tests bij volwassen patiënten met een suboptimale respons of een vroege symptomatische terugval na voltooiing van de behandeling met een PPI. Overweeg bij oudere patiënten ook een endoscopie.
Acute tubulo-interstitiële nefritis
Acute tubulo-interstitiële nefritis (TIN) is waargenomen bij patiënten die PPI's gebruiken en kan op elk moment tijdens PPI-therapie optreden. Patiënten kunnen verschillende tekenen en symptomen vertonen, van symptomatische overgevoeligheidsreacties tot niet-specifieke symptomen van verminderde nierfunctie (bijv. malaise, misselijkheid, anorexia). In gerapporteerde casusreeksen werd bij sommige patiënten de diagnose gesteld op basis van biopsie en bij afwezigheid van extrarenale manifestaties (bijv. koorts, huiduitslag of artralgie). Stop PRILOSEC 40 mg en evalueer patiënten met verdenking op acute TIN [zie CONTRA-INDICATIES ].
Clostridium Difficile-geassocieerde diarree
Gepubliceerde observationele studies suggereren dat PPI-therapie zoals PRILOSEC in verband kan worden gebracht met een verhoogd risico op Clostridium difficile-geassocieerde diarree, vooral bij gehospitaliseerde patiënten. Deze diagnose moet worden overwogen voor diarree die niet verbetert [zie ONGEWENSTE REACTIES ].
Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld.
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen. Voor meer specifieke informatie over antibacteriële middelen (claritromycine en amoxicilline) die zijn geïndiceerd voor gebruik in combinatie met PRILOSEC, raadpleegt u de rubrieken 'Waarschuwingen en voorzorgsmaatregelen' van de bijbehorende voorschrijfinformatie.
Bot fractuur
Verschillende gepubliceerde observationele studies suggereren dat behandeling met protonpompremmers (PPI) geassocieerd kan zijn met een verhoogd risico op osteoporose-gerelateerde fracturen van de heup, pols of wervelkolom. Het risico op fracturen was verhoogd bij patiënten die een hoge dosis kregen, gedefinieerd als meerdere dagelijkse doses, en langdurige PPI-therapie (een jaar of langer). Patiënten dienen de laagste dosis en kortste duur van PPI-therapie te gebruiken die geschikt is voor de aandoening die wordt behandeld. Patiënten met een risico op osteoporose-gerelateerde fracturen moeten worden behandeld volgens vastgestelde behandelrichtlijnen [zie: DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES ].
Ernstige cutane bijwerkingen
Ernstige cutane bijwerkingen, waaronder Stevens-Johnson-syndroom (SJS) en toxische epidermale necrolyse (TEN), geneesmiddelreactie met eosinofilie en systemische symptomen (DRESS) en acute gegeneraliseerde exanthemateuze pustulose (AGEP) zijn gemeld in verband met het gebruik van PPI's [zien ONGEWENSTE REACTIES ]. Stop PRILOSEC bij de eerste tekenen of symptomen van ernstige huidbijwerkingen of andere tekenen van overgevoeligheid en overweeg verdere evaluatie.
Cutane en systemische lupus erythematosus
Cutane lupus erythematodes (CLE) en systemische lupus erythematodes (SLE) zijn gemeld bij patiënten die PPI's gebruikten, waaronder omeprazol. Deze voorvallen zijn opgetreden als zowel nieuw begin als een verergering van een bestaande auto-immuunziekte. De meeste PPI-geïnduceerde gevallen van lupus erythematosus waren CLE.
De meest voorkomende vorm van CLE die werd gemeld bij patiënten die met PPI's werden behandeld, was subacute CLE (SCLE) en trad op binnen weken tot jaren na continue medicamenteuze behandeling bij patiënten variërend van zuigelingen tot ouderen. Over het algemeen werden histologische bevindingen waargenomen zonder orgaanbetrokkenheid.
Systemische lupus erythematosus (SLE) wordt minder vaak gemeld dan CLE bij patiënten die PPI's krijgen. PPI-geassocieerde SLE is meestal milder dan niet-medicamenteuze SLE. Het begin van SLE trad meestal op binnen enkele dagen tot jaren na het starten van de behandeling, voornamelijk bij patiënten variërend van jongvolwassenen tot ouderen. De meerderheid van de patiënten vertoonde huiduitslag; er werden echter ook artralgie en cytopenie gemeld.
Vermijd toediening van PPI's langer dan medisch geïndiceerd. Als er tekenen of symptomen zijn die overeenkomen met CLE of SLE bij patiënten die PRILOSEC 10 mg krijgen, stop dan met het medicijn en verwijs de patiënt naar de juiste specialist voor evaluatie. De meeste patiënten verbeteren na stopzetting van de PPI alleen in 4 tot 12 weken. Serologische testen (bijv. ANA) kunnen positief zijn en verhoogde serologische testresultaten kunnen langer duren om op te lossen dan klinische manifestaties.
Interactie met Clopidogrel
Vermijd gelijktijdig gebruik van PRILOSEC 10 mg met clopidogrel. Clopidogrel is een prodrug. Remming van de bloedplaatjesaggregatie door clopidogrel is volledig te wijten aan een actieve metaboliet. Het metabolisme van clopidogrel tot zijn actieve metaboliet kan worden verstoord door gelijktijdig gebruik van geneesmiddelen, zoals omeprazol, die de CYP2C19-activiteit remmen. Gelijktijdig gebruik van clopidogrel met 80 mg omeprazol vermindert de farmacologische activiteit van clopidogrel, zelfs bij toediening met een tussenpoos van 12 uur.
Overweeg bij gebruik van PRILOSEC een alternatieve anti-bloedplaatjestherapie [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Cyanocobalamine (vitamine B-12)-tekort
Dagelijkse behandeling met zuurremmende medicijnen gedurende een lange periode (bijv. langer dan 3 jaar) kan leiden tot malabsorptie van cyanocobalamine (vitamine B-12) veroorzaakt door hypo- of achloorhydrie. In de literatuur zijn zeldzame meldingen van cyanocobalaminedeficiëntie die optreden bij zuuronderdrukkende therapie gemeld. Deze diagnose moet worden overwogen als klinische symptomen worden waargenomen die overeenkomen met cyanocobalaminedeficiëntie bij patiënten die met PRILOSEC worden behandeld.
Hypomagnesiëmie en mineraal metabolisme
Hypomagnesiëmie, symptomatisch en asymptomatisch, is zelden gemeld bij patiënten die gedurende ten minste drie maanden met PPI's werden behandeld, in de meeste gevallen na een jaar therapie. Ernstige bijwerkingen zijn onder meer tetanie, aritmieën en toevallen. Hypomagnesiëmie kan leiden tot hypocalciëmie en/of hypokaliëmie en kan onderliggende hypocalciëmie verergeren bij risicopatiënten. Bij de meeste patiënten vereiste de behandeling van hypomagnesiëmie magnesiumvervanging en stopzetting van de PPI.
Voor patiënten die naar verwachting langdurig worden behandeld of die PPI's gebruiken met medicijnen zoals digoxine of geneesmiddelen die hypomagnesiëmie kunnen veroorzaken (bijv. Diuretica), kunnen beroepsbeoefenaren in de gezondheidszorg overwegen om de magnesiumspiegels te controleren voorafgaand aan de start van de PPI-behandeling en periodiek [zie ONGEWENSTE REACTIES ].
Overweeg om de magnesium- en calciumspiegels te controleren voordat met PRILOSEC wordt gestart en periodiek tijdens de behandeling bij patiënten met een reeds bestaand risico op hypocalciëmie (bijv. hypoparathyreoïdie). Eventueel aanvullen met magnesium en/of calcium. Als hypocalciëmie ongevoelig is voor behandeling, overweeg dan om de PPI te staken.
Interactie met sint-janskruid of rifampicine
Geneesmiddelen die CYP2C19 of CYP3A4 induceren (zoals sint-janskruid of rifampicine) kunnen de omeprazolconcentraties aanzienlijk verlagen [zie DRUG-INTERACTIES ]. Vermijd gelijktijdig gebruik van PRILOSEC met sint-janskruid of rifampicine.
Interacties met diagnostisch onderzoek naar neuro-endocriene tumoren
Serum chromogranine A (CgA) niveaus stijgen secundair aan geneesmiddel-geïnduceerde dalingen in maagzuur. Het verhoogde CgA-niveau kan vals-positieve resultaten veroorzaken bij diagnostisch onderzoek naar neuro-endocriene tumoren. Zorgverleners moeten de behandeling met PRILOSEC 20 mg tijdelijk stopzetten ten minste 14 dagen voordat de CgA-spiegels worden beoordeeld en overwegen de test te herhalen als de initiële CgA-spiegels hoog zijn. Als seriële tests worden uitgevoerd (bijv. voor monitoring), moet hetzelfde commerciële laboratorium worden gebruikt voor het testen, aangezien de referentiebereiken tussen tests kunnen variëren [zie DRUG-INTERACTIES ].
Interactie met methotrexaat
Literatuur suggereert dat gelijktijdig gebruik van PPI's met methotrexaat (voornamelijk in hoge doses) de serumspiegels van methotrexaat en/of zijn metaboliet kan verhogen en verlengen, wat mogelijk kan leiden tot methotrexaattoxiciteit. Bij toediening van een hoge dosis methotrexaat kan bij sommige patiënten een tijdelijke stopzetting van de PPI worden overwogen [zie: DRUG-INTERACTIES ].
Fundische klierpoliepen
Het gebruik van PPI wordt in verband gebracht met een verhoogd risico op poliepen van de fundusklier dat toeneemt bij langdurig gebruik, vooral na een jaar. De meeste PPI-gebruikers die fundusklierpoliepen ontwikkelden, waren asymptomatisch en fundusklierpoliepen werden incidenteel vastgesteld op endoscopie. Gebruik de kortste duur van PPI-therapie die geschikt is voor de aandoening die wordt behandeld.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids en gebruiksaanwijzing ).
Acute tubulo-interstitiële nefritis
Adviseer de patiënt of zorgverlener om onmiddellijk de zorgverlener van de patiënt te bellen als ze tekenen en/of symptomen ervaren die verband houden met acute tubulo-interstitiële nefritis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Clostridium Difficile-geassocieerde diarree
Adviseer de patiënt of zorgverlener om onmiddellijk de zorgverlener van de patiënt te bellen als ze diarree krijgen die niet verbetert [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Bot fractuur
Adviseer de patiënt of zorgverlener om eventuele fracturen, met name van de heup, pols of wervelkolom, aan de zorgverlener van de patiënt te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ernstige cutane bijwerkingen
Adviseer de patiënt of zorgverlener om te stoppen met PRILOSEC 40 mg en meld dit aan hun zorgverlener bij het eerste optreden van een ernstige huidbijwerking of ander teken van overgevoeligheid [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Cutane en systemische lupus erythematosus
Adviseer de patiënt of verzorger om onmiddellijk de zorgverlener van de patiënt te bellen voor nieuwe of verergering van symptomen geassocieerd met cutane of systemische lupus erythematosus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Cyanocobalamine (vitamine B-12)-tekort
Adviseer de patiënt of zorgverlener om klinische symptomen die verband kunnen houden met cyanocobalaminedeficiëntie te melden aan de zorgverlener van de patiënt als deze langer dan 3 jaar PRILOSEC krijgt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypomagnesiëmie en mineraal metabolisme
Adviseer de patiënt of verzorger om klinische symptomen te melden die kunnen worden geassocieerd met hypomagnesiëmie, hypocalciëmie en/of hypokaliëmie, aan de zorgverlener van de patiënt, als deze gedurende ten minste 3 maanden PRILOSEC heeft gekregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelinteracties
Adviseer patiënten om hun zorgverlener te melden als ze beginnen met de behandeling met rilpivirine-bevattende producten, clopidogrel, sint-janskruid of rifampicine; of, als ze een hoge dosis methotrexaat gebruiken [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Administratie
- PRILOSEC is bedoeld om te worden bereid in water en oraal of via een nasogastrische (NG) of maagsonde te worden toegediend, zoals beschreven in de medicatiehandleiding.
- Neem PRILOSEC voor de maaltijd in.
- Antacida kunnen gelijktijdig met PRILOSEC worden gebruikt.
- Gemiste doses: Als een dosis wordt gemist, zo snel mogelijk toedienen. Als de volgende geplande dosis echter moet worden ingenomen, neem dan de gemiste dosis niet in en neem de volgende dosis op tijd in. Neem geen twee doses tegelijk om een vergeten dosis in te halen.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In twee carcinogeniteitsstudies van 24 maanden bij ratten, werd omeprazol in dagelijkse doses van 1,7, 3,4, 13,8, 44,0 en 140,8 mg/kg/dag (ongeveer 0,4 tot 34 maal een humane dosis van 40 mg/dag, uitgedrukt op een lichaamsoppervlak) oppervlaktebasis) produceerden maag-ECL-celcarcinoïden op een dosisgerelateerde manier bij zowel mannelijke als vrouwelijke ratten; de incidentie van dit effect was aanzienlijk hoger bij vrouwelijke ratten, die hogere bloedspiegels van omeprazol hadden. Maagcarcinoïden komen zelden voor bij onbehandelde ratten. Bovendien was ECL-celhyperplasie aanwezig in alle behandelde groepen van beide geslachten. In een van deze onderzoeken werden vrouwelijke ratten gedurende één jaar behandeld met 13,8 mg omeprazol/kg/dag (ongeveer 3,4 maal een dosis voor mensen van 40 mg/dag, gebaseerd op het lichaamsoppervlak) en daarna nog een jaar gevolgd zonder de medicijn. Bij deze ratten werden geen carcinoïden gezien. Een verhoogde incidentie van behandelingsgerelateerde ECL-celhyperplasie werd waargenomen aan het einde van één jaar (94% behandeld versus 10% controles). Tegen het tweede jaar was het verschil tussen behandelde en controleratten veel kleiner (46% vs. 26%), maar vertoonde nog steeds meer hyperplasie in de behandelde groep. Adenocarcinoom van de maag werd gezien bij één rat (2%). Er werd geen vergelijkbare tumor gezien bij mannelijke of vrouwelijke ratten die gedurende twee jaar werden behandeld. Voor deze rattenstam is historisch geen vergelijkbare tumor gevonden, maar een bevinding waarbij slechts één tumor betrokken is, is moeilijk te interpreteren. In een 52 weken durende toxiciteitsstudie bij Sprague-Dawley-ratten werden hersenastrocytomen gevonden bij een klein aantal mannetjes die omeprazol kregen in doseringen van 0,4, 2 en 16 mg/kg/dag (ongeveer 0,1 tot 3,9 maal de dosis voor mensen). van 40 mg/dag, op basis van lichaamsoppervlak). In deze studie werden geen astrocytomen waargenomen bij vrouwelijke ratten. In een 2 jaar durende carcinogeniteitsstudie bij Sprague-Dawley-ratten werden geen astrocytomen gevonden bij mannetjes of vrouwtjes bij de hoge dosis van 140,8 mg/kg/dag (ongeveer 34 maal de dosis voor de mens van 40 mg/dag op basis van het lichaamsoppervlak). . Een 78 weken durende carcinogeniteitsstudie bij muizen met omeprazol toonde geen verhoogd optreden van tumoren aan, maar de studie was niet overtuigend. Een 26 weken durende p53 (+/-) transgene carcinogeniteitsstudie bij muizen was niet positief.
Omeprazol was positief voor clastogene effecten in een in vitro chromosomale aberratietest bij menselijke lymfocyten, in een van de twee in vivo micronucleustests bij muizen en in een in vivo beenmergcelchromosomale aberratietest. Omeprazol was negatief in de in vitro Ames-test, een in vitro muis-lymfoomcel-voorwaartse mutatie-assay en een in vivo rattenlever-DNA-schadeassay.
Omeprazol in orale doses tot 138 mg/kg/dag bij ratten (ongeveer 34 maal een orale dosis voor de mens van 40 mg op basis van het lichaamsoppervlak) bleek geen effect te hebben op de vruchtbaarheid en reproductieve prestaties.
In carcinogeniteitsstudies van 24 maanden bij ratten werd een dosisgerelateerde significante toename van maagcarcinoïdtumoren en ECL-celhyperplasie waargenomen bij zowel mannelijke als vrouwelijke dieren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Carcinoïde tumoren zijn ook waargenomen bij ratten die een fundectomie of langdurige behandeling met andere protonpompremmers of hoge doses H2-receptorantagonisten hebben ondergaan.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Er zijn geen adequate en goed gecontroleerde onderzoeken met omeprazol bij zwangere vrouwen. Beschikbare epidemiologische gegevens tonen geen verhoogd risico op ernstige aangeboren afwijkingen of andere nadelige zwangerschapsuitkomsten aan bij gebruik van omeprazol in het eerste trimester. Voortplantingsstudies bij ratten en konijnen resulteerden in dosisafhankelijke embryo-letaliteit bij omeprazol-doses die ongeveer 3,4 tot 34 maal de orale humane dosis van 40 mg waren (op basis van een lichaamsoppervlak voor een persoon van 60 kg).
Teratogeniteit werd niet waargenomen in reproductiestudies bij dieren met toediening van oraal esomeprazol (een enantiomeer van omeprazol) magnesium bij ratten en konijnen tijdens de organogenese met doses van respectievelijk ongeveer 68 keer en 42 keer een orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol ( op basis van lichaamsoppervlak voor een persoon van 60 kg).
Veranderingen in botmorfologie werden waargenomen bij nakomelingen van ratten die gedurende het grootste deel van de dracht en lactatie werden toegediend in doses gelijk aan of groter dan ongeveer 34 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol. Wanneer toediening aan de moeder werd beperkt tot alleen de dracht, waren er geen effecten op de botfysaire morfologie bij de nakomelingen op welke leeftijd dan ook [zie Gegevens ].
De geschatte achtergrondrisico's van ernstige geboorteafwijkingen en miskramen voor de aangegeven populatie zijn niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Gegevens
Menselijke gegevens
Vier gepubliceerde epidemiologische onderzoeken vergeleken de frequentie van aangeboren afwijkingen bij zuigelingen van vrouwen die omeprazol tijdens de zwangerschap gebruikten met de frequentie van afwijkingen bij zuigelingen van vrouwen die waren blootgesteld aan H2-receptorantagonisten of andere controles.
Een populatiegebaseerd retrospectief cohort epidemiologisch onderzoek van de Swedish Medical Birth Registry, dat ongeveer 99% van de zwangerschappen van 1995 tot 99 omvatte, rapporteerde 955 zuigelingen (824 blootgesteld tijdens het eerste trimester, waarvan 39 na het eerste trimester en 131 blootgesteld na het eerste trimester) van wie de moeder omeprazol heeft gebruikt tijdens de zwangerschap. Het aantal zuigelingen dat in utero werd blootgesteld aan omeprazol en een misvorming, een laag geboortegewicht, een lage Apgar-score of ziekenhuisopname had, was vergelijkbaar met het aantal waargenomen in deze populatie. Het aantal zuigelingen dat werd geboren met ventrikelseptumdefecten en het aantal doodgeboren zuigelingen was iets hoger bij de aan omeprazol blootgestelde zuigelingen dan het verwachte aantal in deze populatie.
Een populatiegebaseerde retrospectieve cohortstudie die alle levendgeborenen in Denemarken van 1996 tot 2009 omvatte, rapporteerde over 1.800 levendgeborenen van wie de moeders omeprazol gebruikten tijdens het eerste trimester van de zwangerschap en 837.317 levendgeborenen van wie de moeders geen protonpompremmer gebruikten. Het totale aantal geboorteafwijkingen bij baby's van moeders die in het eerste trimester werden blootgesteld aan omeprazol was 2,9% en 2,6% bij baby's van moeders die tijdens het eerste trimester niet waren blootgesteld aan een protonpompremmer.
In een retrospectief cohortonderzoek werden 689 zwangere vrouwen gerapporteerd die in het eerste trimester aan ofwel H2-blokkers ofwel omeprazol werden blootgesteld (134 aan omeprazol) en 1.572 zwangere vrouwen die tijdens het eerste trimester niet werden blootgesteld aan een van beide. Het totale percentage misvormingen bij nakomelingen van moeders die in het eerste trimester waren blootgesteld aan omeprazol, een H2-blokker, of die niet waren blootgesteld, was respectievelijk 3,6%, 5,5% en 4,1%.
Een kleine prospectieve observationele cohortstudie volgde 113 vrouwen die tijdens de zwangerschap aan omeprazol werden blootgesteld (89% bij blootstelling in het eerste trimester). Het gerapporteerde percentage ernstige aangeboren afwijkingen was 4% in de omeprazol-groep, 2% bij controles die waren blootgesteld aan niet-teratogenen en 2,8% bij controles die gepaard gingen met ziekte. De percentages van spontane en electieve abortussen, vroeggeboorte, zwangerschapsduur bij bevalling en gemiddeld geboortegewicht waren vergelijkbaar tussen de groepen.
Verschillende onderzoeken hebben geen duidelijke nadelige effecten op korte termijn op de zuigeling gemeld wanneer een enkelvoudige dosis orale of intraveneuze omeprazol werd toegediend aan meer dan 200 zwangere vrouwen als premedicatie voor een keizersnede onder algehele anesthesie.
Dierlijke gegevens
Omeprazol
Voortplantingsonderzoeken uitgevoerd met omeprazol bij ratten bij orale doses tot 138 mg/kg/dag (ongeveer 34 maal een orale dosis voor de mens van 40 mg op basis van lichaamsoppervlak) en bij konijnen bij doses tot 69,1 mg/kg/dag ( ongeveer 34 maal een orale dosis voor de mens van 40 mg op basis van lichaamsoppervlak) tijdens de organogenese leverde geen bewijs voor een teratogeen potentieel van omeprazol. Bij konijnen veroorzaakte omeprazol in een dosisbereik van 6,9 tot 69,1 mg/kg/dag (ongeveer 3,4 tot 34 maal een orale dosis voor de mens van 40 mg op basis van het lichaamsoppervlak), toegediend tijdens de organogenese, dosisgerelateerde verhogingen van de embryoletaliteit, foetale resorpties en zwangerschapsverstoringen. Bij ratten werden dosisgerelateerde embryo-/foetale toxiciteit en postnatale ontwikkelingstoxiciteit waargenomen bij nakomelingen die het gevolg waren van ouders die werden behandeld met omeprazol met 13,8 tot 138,0 mg/kg/dag (ongeveer 3,4 tot 34 maal een orale dosis voor mensen van 40 mg op een lichaamsoppervlak). gebiedsbasis), toegediend voorafgaand aan het paren tijdens de lactatieperiode.
Esomeprazol
De hieronder beschreven gegevens zijn gegenereerd uit onderzoeken met esomeprazol, een enantiomeer van omeprazol. De dosisveelvouden van dier op mens zijn gebaseerd op de aanname van gelijke systemische blootstelling aan esomeprazol bij mensen na orale toediening van ofwel 40 mg esomeprazol ofwel 40 mg omeprazol.
Er werden geen effecten op de embryo-foetale ontwikkeling waargenomen in reproductiestudies met esomeprazolmagnesium bij ratten bij orale doses tot 280 mg/kg/dag (ongeveer 68 maal een orale dosis voor de mens van 40 mg op basis van lichaamsoppervlak) of bij konijnen bij orale doses tot 86 mg/kg/dag (ongeveer 42 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol op basis van het lichaamsoppervlak) toegediend tijdens de organogenese.
Een pre- en postnatale ontwikkelingstoxiciteitsstudie bij ratten met aanvullende eindpunten om de botontwikkeling te evalueren, werd uitgevoerd met esomeprazolmagnesium in orale doses van 14 tot 280 mg/kg/dag (ongeveer 3,4 tot 68 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg esomeprazol). mg omeprazol op basis van lichaamsoppervlak). Neonatale/vroege postnatale overleving (van geboorte tot spenen) was verminderd bij doses gelijk aan of hoger dan 138 mg/kg/dag (ongeveer 34 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol op basis van lichaamsoppervlak). Het lichaamsgewicht en de toename van het lichaamsgewicht waren verminderd en neurologische gedrags- of algemene ontwikkelingsachterstanden in de onmiddellijke periode na het spenen waren duidelijk bij doses gelijk aan of hoger dan 69 mg/kg/dag (ongeveer 17 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg esomeprazol). mg omeprazol op basis van lichaamsoppervlak). Bovendien werden verminderde femurlengte, -breedte en -dikte van corticaal bot, verminderde dikte van de tibiale groeischijf en minimale tot milde beenmerghypocellulariteit waargenomen bij doses gelijk aan of hoger dan 14 mg/kg/dag (ongeveer 3,4 maal een orale humane dosis van 40 mg esomeprazol of 40 mg omeprazol op basis van lichaamsoppervlak). Fyseale dysplasie in het dijbeen werd waargenomen bij nakomelingen van ratten die werden behandeld met orale doses esomeprazolmagnesium in doses gelijk aan of hoger dan 138 mg/kg/dag (ongeveer 34 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol op een oppervlakte basis).
Effecten op het maternale bot werden waargenomen bij drachtige en zogende ratten in het pre- en postnatale toxiciteitsonderzoek wanneer esomeprazolmagnesium werd toegediend in orale doses van 14 tot 280 mg/kg/dag (ongeveer 3,4 tot 68 maal een orale dosis voor de mens van 40 mg esomeprazol). of 40 mg omeprazol op basis van lichaamsoppervlak). Wanneer ratten werden gedoseerd vanaf dag 7 van de zwangerschap tot het spenen op postnatale dag 21, werd een statistisch significante afname van het maternale femurgewicht van maximaal 14% (in vergelijking met placebobehandeling) waargenomen bij doses gelijk aan of hoger dan 138 mg/kg/dag (ongeveer 34 maal een orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol op basis van lichaamsoppervlak).
Een pre- en postnataal ontwikkelingsonderzoek bij ratten met esomeprazol strontium (met equimolaire doses in vergelijking met esomeprazolmagnesiumonderzoek) leverde vergelijkbare resultaten op bij moederdieren en jongen als hierboven beschreven.
Een vervolgonderzoek naar ontwikkelingstoxiciteit bij ratten met verdere tijdstippen om de botontwikkeling van de jongen te evalueren vanaf dag 2 na de geboorte tot volwassenheid werd uitgevoerd met esomeprazolmagnesium in orale doses van 280 mg/kg/dag (ongeveer 68 maal een orale dosis voor de mens van 40 mg op lichaamsoppervlak) waarbij de toediening van esomeprazol plaatsvond vanaf dag 7 van de zwangerschap of dag 16 van de zwangerschap tot de bevalling. Wanneer toediening aan de moeder werd beperkt tot alleen de dracht, waren er geen effecten op de botfysaire morfologie bij de nakomelingen op welke leeftijd dan ook.
Borstvoeding
Risico Samenvatting
Beperkte gegevens suggereren dat omeprazol aanwezig kan zijn in de moedermelk. Er zijn geen klinische gegevens over de effecten van omeprazol op de zuigeling die borstvoeding krijgt of op de melkproductie. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan PRILOSEC 40 mg en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van PRILOSEC 20 mg of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van PRILOSEC 40 mg zijn vastgesteld bij pediatrische patiënten van 1 tot 16 jaar voor de behandeling van symptomatische GERD, de behandeling van EE als gevolg van zuurgemedieerde GERD en het behoud van genezing van EE als gevolg van zuurgemedieerde GERD. Het gebruik van PRILOSEC 10 mg in deze leeftijdsgroep wordt ondersteund door adequate en goed gecontroleerde onderzoeken bij volwassenen en ongecontroleerde veiligheids-, werkzaamheids- en farmacokinetische onderzoeken die zijn uitgevoerd bij pediatrische en adolescente patiënten [zie KLINISCHE FARMACOLOGIE , Klinische studies ].
De veiligheid en werkzaamheid van PRILOSEC 10 mg zijn vastgesteld bij pediatrische patiënten van 1 maand tot jonger dan 1 jaar voor de behandeling van EE als gevolg van zuurgemedieerde GORZ en wordt ondersteund door adequate en goed gecontroleerde onderzoeken bij volwassenen en veiligheids-, farmacokinetische, en farmacodynamische onderzoeken uitgevoerd bij pediatrische patiënten [zie KLINISCHE FARMACOLOGIE ].
Bij de pediatrische populatie werden vaak bijwerkingen van het ademhalingssysteem gemeld in de gehele leeftijdsgroep (1 maand tot 16 jaar). Otitis media werd vaak gemeld in de leeftijdsgroep van 1 maand tot ONGEWENSTE REACTIES ].
De veiligheid en effectiviteit van PRILOSEC zijn niet vastgesteld in:
- patiënten jonger dan 1 jaar voor:
- Behandeling van symptomatische GERD
- Handhaving van genezing van EE als gevolg van door zuur gemedieerde GERD
- pediatrische patiënten voor:
- Behandeling van actieve ulcus duodeni
- Uitroeiing van H. pylori om het risico op herhaling van zweren in de twaalfvingerige darm te verminderen
- Behandeling van actieve goedaardige maagzweren
- Pathologische hypersecretoire aandoeningen
- patiënten jonger dan 1 maand voor welke indicatie dan ook.
Juveniele diergegevens
Van esomeprazol, een enantiomeer van omeprazol, is aangetoond dat het het lichaamsgewicht, de lichaamsgewichtstoename, het dijbeengewicht, de dijbeenlengte en de totale groei verlaagt bij orale doses van ongeveer 34 tot 68 maal een dagelijkse dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol op basis van oppervlakte in een toxiciteitsonderzoek bij jonge ratten. De dosisveelvouden van dier op mens zijn gebaseerd op de aanname van gelijke systemische blootstelling aan esomeprazol bij mensen na orale toediening van ofwel 40 mg esomeprazol ofwel 40 mg omeprazol.
Een 28-daagse toxiciteitsstudie met een 14-daagse herstelfase werd uitgevoerd bij juveniele ratten met esomeprazolmagnesium in doses van 70 tot 280 mg/kg/dag (ongeveer 17 tot 68 maal een dagelijkse orale humane dosis van 40 mg esomeprazol of 40 mg omeprazol op basis van lichaamsoppervlak). Een toename van het aantal sterfgevallen bij de hoge dosis van 280 mg/kg/dag werd waargenomen wanneer juveniele ratten esomeprazolmagnesium kregen toegediend van postnatale dag 7 tot postnatale dag 35. Bovendien werden doses gelijk aan of hoger dan 140 mg/kg/ dag (ongeveer 34 maal een dagelijkse orale dosis voor de mens van 40 mg esomeprazol of 40 mg omeprazol op basis van het lichaamsoppervlak), veroorzaakte behandelingsgerelateerde afnamen in lichaamsgewicht (ongeveer 14%) en lichaamsgewichtstoename, afname van femurgewicht en femur lengte en beïnvloedde de algehele groei. Vergelijkbare bevindingen die hierboven zijn beschreven, zijn ook waargenomen in dit onderzoek met een ander esomeprazolzout, esomeprazol strontium, in equimolaire doses esomeprazol.
Geriatrisch gebruik
Omeprazol werd toegediend aan meer dan 2000 oudere personen (≥ 65 jaar) in klinische onderzoeken in de VS en Europa. Er waren geen verschillen in veiligheid en effectiviteit tussen ouderen en jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen ouderen en jongere proefpersonen aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Farmacokinetische onderzoeken hebben aangetoond dat de eliminatiesnelheid bij ouderen enigszins was afgenomen en dat de biologische beschikbaarheid was verhoogd. De plasmaklaring van omeprazol was 250 ml/min (ongeveer de helft van die van jonge vrijwilligers) en de plasmahalfwaardetijd was gemiddeld één uur, ongeveer tweemaal die van jonge gezonde vrijwilligers. Bij ouderen is echter geen dosisaanpassing nodig [zie: KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Bij patiënten met een leverfunctiestoornis (Child-Pugh-klasse A, B of C) nam de blootstelling aan omeprazol aanzienlijk toe in vergelijking met gezonde proefpersonen. Een verlaging van de dosering van PRILOSEC 10 mg tot 10 mg eenmaal daags wordt aanbevolen voor patiënten met leverinsufficiëntie voor het behoud van de genezing van EE [zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
Aziatische bevolking
In onderzoeken met gezonde proefpersonen hadden Aziaten een ongeveer vier keer hogere blootstelling dan blanken. Doseringsverlaging van PRILOSEC 20 mg tot 10 mg eenmaal daags wordt aanbevolen voor Aziatische patiënten voor het behoud van genezing van EE [zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Er zijn meldingen ontvangen van overdosering met omeprazol bij mensen. Doses varieerden tot 2400 mg (120 maal de gebruikelijke aanbevolen klinische dosis). Manifestaties waren variabel, maar omvatten verwarring, slaperigheid, wazig zien, tachycardie, misselijkheid, braken, diaforese, blozen, hoofdpijn, droge mond en andere bijwerkingen vergelijkbaar met die waargenomen bij normale klinische ervaring [zie ONGEWENSTE REACTIES ]. Symptomen waren van voorbijgaande aard en er is geen ernstige klinische uitkomst gemeld wanneer PRILOSEC 20 mg alleen werd ingenomen. Er is geen specifiek antidotum voor overdosering met omeprazol bekend.
Omeprazol is sterk eiwitgebonden en is daarom niet gemakkelijk dialyseerbaar. In geval van overdosering dient de behandeling symptomatisch en ondersteunend te zijn.
Als er sprake is van overmatige blootstelling, bel dan uw Antigifcentrum op 1-800-222-1222 voor actuele informatie over het beheer van vergiftiging of overdosering.
CONTRA-INDICATIES
- PRILOSEC is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor gesubstitueerde benzimidazolen of voor enig bestanddeel van de formulering. Overgevoeligheidsreacties kunnen anafylaxie, anafylactische shock, angio-oedeem, bronchospasme, acute tubulo-interstitiële nefritis en urticaria omvatten (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ].
- Protonpompremmers (PPI's), waaronder PRILOSEC 10 mg, zijn gecontra-indiceerd bij patiënten die rilpivirine-bevattende producten krijgen [zie DRUG-INTERACTIES ].
- Voor informatie over contra-indicaties van antibacteriële middelen (claritromycine en amoxicilline) die zijn geïndiceerd in combinatie met PRILOSEC 40 mg, raadpleegt u de rubriek CONTRA-INDICATIES van hun bijsluiters.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Omeprazol behoort tot een klasse van antisecretoire verbindingen, de gesubstitueerde benzimidazolen, die de maagzuursecretie onderdrukken door specifieke remming van het H+/K+ ATPase-enzymsysteem op het secretoire oppervlak van de pariëtale maagcel. Omdat dit enzymsysteem wordt beschouwd als de zure (protonen) pomp in het maagslijmvlies, is omeprazol gekarakteriseerd als een maagzuurpompremmer, in die zin dat het de laatste stap van de zuurproductie blokkeert. Dit effect is dosisafhankelijk en leidt tot remming van zowel basale als gestimuleerde zuursecretie, ongeacht de stimulus.
farmacodynamiek
Antisecretoire activiteit
Na orale toediening treedt het antisecretoire effect van omeprazol binnen één uur op, met het maximale effect binnen twee uur. Remming van secretie is ongeveer 50% van het maximum na 24 uur en de duur van remming duurt tot 72 uur. Het antisecretoire effect houdt dus veel langer aan dan zou worden verwacht op basis van de zeer korte (minder dan een uur) plasmahalfwaardetijd, blijkbaar als gevolg van langdurige binding aan het pariëtale H+/K+ ATPase-enzym. Wanneer het medicijn wordt stopgezet, keert de secretoire activiteit geleidelijk terug, gedurende 3 tot 5 dagen. Het remmende effect van omeprazol-onzuursecretie neemt toe bij herhaalde eenmaaldaagse dosering en bereikt na vier dagen een plateau.
De resultaten van talrijke onderzoeken naar het antisecretoire effect van meervoudige doses van 20 mg en 40 mg omeprazol bij gezonde proefpersonen en patiënten worden hieronder weergegeven. De “max”-waarde vertegenwoordigt de bepalingen op een moment van maximaal effect (2 tot 6 uur na dosering), terwijl de “min”-waarden die zijn 24 uur na de laatste dosis omeprazol.
Eenmalige dagelijkse orale doses omeprazol, variërend van een dosis van 10 mg tot 40 mg, hebben bij sommige patiënten tot 100% remming van de 24-uurs intragastrische zuurgraad geleid.
Serum Gastrine-effecten
In onderzoeken waarbij meer dan 200 patiënten betrokken waren, stegen de serumgastrinespiegels tijdens de eerste 1 tot 2 weken van eenmaal daagse toediening van therapeutische doses omeprazol, parallel aan de remming van de zuursecretie. Er trad geen verdere verhoging van serumgastrine op bij voortzetting van de behandeling. In vergelijking met histamine-H2-receptorantagonisten waren de mediane verhogingen geproduceerd door doses van 20 mg omeprazol hoger (1,3- tot 3,6-voudige versus 1,1- tot 1,8-voudige verhoging). De gastrinewaarden keerden terug naar het niveau van voor de behandeling, gewoonlijk binnen 1 tot 2 weken na stopzetting van de behandeling.
Verhoogde gastrine veroorzaakt enterochromaffine-achtige celhyperplasie en verhoogde chromogranine A (CgA)-spiegels in het serum. De verhoogde CgA-spiegels kunnen vals-positieve resultaten veroorzaken bij diagnostisch onderzoek naar neuro-endocriene tumoren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Enterochromaffine-achtige (ECL) celeffecten
Bij meer dan 3000 patiënten (zowel kinderen als volwassenen) die in langdurige klinische onderzoeken met omeprazol werden behandeld, zijn menselijke maagbiopten verkregen. De incidentie van ECL-celhyperplasie in deze onderzoeken nam met de tijd toe; bij deze patiënten is echter geen geval van ECL-celcarcinoïden, dysplasie of neoplasie gevonden. Deze onderzoeken zijn echter van onvoldoende duur en omvang om de mogelijke invloed van langdurige toediening van omeprazol op de ontwikkeling van premaligne of maligne aandoeningen uit te sluiten.
Andere effecten
Systemische effecten van omeprazol op het CZS, het cardiovasculaire systeem en de luchtwegen zijn tot op heden niet gevonden. Omeprazol, toegediend in orale doses van 30 of 40 mg gedurende 2 tot 4 weken, had geen effect op de schildklierfunctie, het koolhydraatmetabolisme of de circulerende spiegels van parathyroïdhormoon, cortisol, estradiol, testosteron, prolactine, cholecystokinine of secretine.
Er werd geen effect op de maaglediging van de vaste en vloeibare componenten van een testmaaltijd aangetoond na een enkele dosis omeprazol 90 mg. Bij gezonde proefpersonen had een enkelvoudige intraveneuze dosis omeprazol (0,35 mg/kg) geen effect op de secretie van intrinsieke factoren. Er is geen systematisch dosisafhankelijk effect waargenomen op de basale of gestimuleerde pepsine-output bij mensen.
Wanneer de intragastrische pH echter op 4,0 of hoger wordt gehouden, is de basale pepsine-output laag en neemt de pepsine-activiteit af.
Net als andere middelen die de pH in de maag verhogen, veroorzaakte omeprazol, toegediend gedurende 14 dagen bij gezonde proefpersonen, een significante toename van de intragastrische concentraties van levensvatbare bacteriën. Het patroon van de bacteriesoorten was onveranderd ten opzichte van het patroon dat gewoonlijk in speeksel wordt aangetroffen. Alle veranderingen verdwenen binnen drie dagen na het stoppen van de behandeling.
Het verloop van de Barrett-slokdarm bij 106 patiënten werd geëvalueerd in een dubbelblind, gecontroleerd onderzoek in de VS met PRILOSEC 40 mg tweemaal daags gedurende 12 maanden gevolgd door 20 mg tweemaal daags gedurende 12 maanden of ranitidine 300 mg tweemaal daags gedurende 24 maanden. Er werd geen klinisch significant effect op het slijmvlies van Barrett waargenomen door antisecretoire therapie. Hoewel neosquameus epitheel zich ontwikkelde tijdens antisecretoire therapie, werd volledige eliminatie van Barrett's mucosa niet bereikt. Er werd geen significant verschil waargenomen tussen de behandelingsgroepen in de ontwikkeling van dysplasie in het slijmvlies van Barrett en geen enkele patiënt ontwikkelde slokdarmcarcinoom tijdens de behandeling. Er werden geen significante verschillen tussen behandelingsgroepen waargenomen bij de ontwikkeling van ECL-celhyperplasie, corpus atrofische gastritis, corpus intestinale metaplasie of colonpoliepen met een diameter van meer dan 3 mm.
Farmacokinetiek
Absorptie
PRILOSEC 20 mg voor orale suspensie met vertraagde afgifte bevat magnesiumgranulaat omeprazol en inactief granulaat voor toediening in water. De absorptie van omeprazol begint pas nadat de maagsapresistente korrels de maag hebben verlaten. De farmacokinetiek van omeprazol is tijdsafhankelijk, met hogere plasmaconcentraties bij steady-state in vergelijking met na een enkele dosis. De systemische blootstelling (AUC en Cmax) aan omeprazol na eenmaal daagse dosering van 20 mg orale suspensie met vertraagde afgifte gedurende 5 dagen is respectievelijk 51% en 58% hoger dan na de eerste dosis. Piekplasmaconcentraties van omeprazol na herhaalde doses orale suspensie met vertraagde afgifte treden binnen 1,5 tot 2 uur op. Bij gezonde proefpersonen is de plasmahalfwaardetijd 0,5 tot 1 uur.
Verdeling
Eiwitbinding is ongeveer 95%.
Eliminatie
Metabolisme
Omeprazol wordt uitgebreid gemetaboliseerd door het cytochroom P450 (CYP)-enzymsysteem. Het grootste deel van het metabolisme is afhankelijk van het polymorf tot expressie gebrachte CYP2C19, dat verantwoordelijk is voor de vorming van hydroxyomeprazol, de belangrijkste metaboliet in plasma. Het resterende deel is afhankelijk van een andere specifieke isovorm, CYP3A4, die verantwoordelijk is voor de vorming van omeprazolsulfon.
uitscheiding
Na orale toediening van een enkele dosis van een gebufferde oplossing van omeprazol werd weinig of geen onveranderd geneesmiddel uitgescheiden in de urine. Het grootste deel van de dosis (ongeveer 77%) werd in de urine uitgescheiden als ten minste zes metabolieten. Twee werden geïdentificeerd als hydroxyomeprazol en het overeenkomstige carbonzuur. De rest van de dosis kon worden teruggevonden in de feces. Dit impliceert een significante uitscheiding via de gal van de metabolieten van omeprazol. In plasma zijn drie metabolieten geïdentificeerd, de sulfide- en sulfonderivaten van omeprazol en hydroxyomeprazol. Deze metabolieten hebben zeer weinig of geen antisecretoire activiteit.
Combinatietherapie met antimicrobiële middelen
Omeprazol 40 mg per dag werd om de 8 uur in combinatie met claritromycine 500 mg gegeven aan gezonde volwassen mannelijke proefpersonen. De steady-state plasmaconcentraties van omeprazol waren verhoogd (Cmax, AUC0-24 en T½-stijgingen van respectievelijk 30%, 89% en 34%) door gelijktijdige toediening van claritromycine. De waargenomen verhogingen van de plasmaconcentratie van omeprazol gingen gepaard met de volgende farmacologische effecten. De gemiddelde pH-waarde van de maag gedurende 24 uur was wanneer omeprazol alleen werd toegediend en 5,7 bij gelijktijdige toediening met claritromycine.
De plasmaconcentraties van claritromycine en 14-hydroxy-claritromycine werden verhoogd door gelijktijdige toediening van omeprazol. Voor claritromycine was de gemiddelde Cmax 10% hoger, de gemiddelde Cmin 27% hoger en de gemiddelde AUC0-8 15% hoger wanneer claritromycine werd toegediend met omeprazol dan wanneer claritromycine alleen werd toegediend. Vergelijkbare resultaten werden gezien voor 14-hydroxy-claritromycine, de gemiddelde Cmax was 45% hoger, de gemiddelde Cmin was 57% hoger en de gemiddelde AUC0-8 was 45% hoger. De claritromycineconcentraties in het maagweefsel en het slijmvlies waren ook verhoogd bij gelijktijdige toediening van omeprazol.
Specifieke populaties
Geriatrische patiënten
De eliminatiesnelheid van omeprazol was enigszins verlaagd bij ouderen en de biologische beschikbaarheid was verhoogd. Omeprazol was voor 76% biologisch beschikbaar wanneer een enkele orale dosis omeprazol (gebufferde oplossing) van 40 mg werd toegediend aan gezonde oudere vrijwilligers, tegenover 58% bij jonge vrijwilligers die dezelfde dosis kregen. Bijna 70% van de dosis werd in de urine teruggevonden als metabolieten van omeprazol en er werd geen onveranderd geneesmiddel gedetecteerd. De plasmaklaring van omeprazol was 250 ml/min (ongeveer de helft van die van jonge vrijwilligers) en de plasmahalfwaardetijd was gemiddeld één uur, ongeveer tweemaal die van jonge gezonde vrijwilligers.
Pediatrische patiënten
2 tot 16 jaar oud
De farmacokinetiek van omeprazol is onderzocht bij pediatrische patiënten van 2 tot 16 jaar:
Na vergelijkbare mg/kg-doses omeprazol hebben jongere kinderen (2 tot 5 jaar) een lagere AUC dan kinderen van 6 tot 16 jaar of volwassenen; AUC's van de laatste twee groepen verschilden niet [zie: DOSERING EN ADMINISTRATIE ].
1 tot 11 maanden oud
Er werd een populatiefarmacokinetisch model gebruikt om geschikte doses PRILOSEC 40 mg te bepalen bij pediatrische patiënten
1 maand tot minder dan 1 jaar oud voor behandeling (tot 6 weken) van erosieve oesofagitis als gevolg van zuur-gemedieerde GERD. Het model was gebaseerd op gegevens van 64 kinderen van 0,5 maand tot 16 jaar oud. Er waren slechts beperkte gegevens beschikbaar bij kinderen jonger dan 1 jaar. Omeprazol werd in deze onderzoeken aan pediatrische patiënten toegediend als een orale suspensie, bereid uit de capsules met vertraagde afgifte. Pediatrische doses werden gesimuleerd in de leeftijdsgroep van 1 tot 11 maanden, om vergelijkbare blootstellingen aan omeprazol te bereiken met volwassenen na behandeling met 20 mg eenmaal daags [zie DOSERING EN ADMINISTRATIE ].
Raciale of etnische groepen
[Zien KLINISCHE FARMACOLOGIE ].
Patiënten met nierinsufficiëntie
Bij patiënten met chronische nierinsufficiëntie (creatinineklaring tussen 10 en 62 ml/min/1,73 m²) was de dispositie van omeprazol sterk vergelijkbaar met die bij gezonde proefpersonen, hoewel er een lichte toename van de biologische beschikbaarheid was. Omdat excretie via de urine een primaire excretieroute van omeprazolmetabolieten is, vertraagde hun eliminatie in verhouding tot de verminderde creatinineklaring. Deze toename van de biologische beschikbaarheid wordt niet als klinisch zinvol beschouwd.
Patiënten met leverinsufficiëntie
Bij patiënten met chronische leverziekte geclassificeerd als Child-Pugh klasse A (n=3), B (n=4) en C (n=1), nam de biologische beschikbaarheid toe tot ongeveer 100% in vergelijking met gezonde proefpersonen, als gevolg van verminderde first-pass effect, en de plasmahalfwaardetijd van het geneesmiddel nam toe tot bijna 3 uur vergeleken met de halfwaardetijd bij gezonde proefpersonen van 0,5 tot 1 uur. De plasmaklaring was gemiddeld 70 ml/min, vergeleken met een waarde van 500 tot 600 ml/min bij gezonde proefpersonen [zie: DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ].
Geneesmiddelinteractiestudies
Effect van omeprazol op andere geneesmiddelen
Omeprazol is een tijdsafhankelijke remmer van CYP2C19 en kan de systemische blootstelling verhogen van gelijktijdig toegediende geneesmiddelen die CYP2C19-substraten zijn. Bovendien verhoogt de toediening van omeprazol de intragastrische pH en kan de systemische blootstelling van bepaalde geneesmiddelen die pH-afhankelijke oplosbaarheid vertonen, veranderen.
antiretrovirale middelen
Voor sommige antiretrovirale geneesmiddelen, zoals rilpivirine, atazanavir en nelfinavir, zijn verlaagde serumconcentraties gemeld bij gelijktijdige toediening met omeprazol (zie DRUG-INTERACTIES ].
Rilpivirine: Na meerdere doses rilpivirine (150 mg, dagelijks) en omeprazol (20 mg, dagelijks), was de AUC verlaagd met 40%, de Cmax met 40% en de Cmin met 33% voor rilpivirine.
Nelfinavir: Na meerdere doses nelfinavir (1250 mg, tweemaal daags) en omeprazol (40 mg per dag) was de AUC verlaagd met 36% en 92%, Cmax met 37% en 89% en Cmin met respectievelijk 39% en 75% voor nelfinavir en M8 .
Atazanavir: Na meerdere doses atazanavir (400 mg, dagelijks) en omeprazol (40 mg, dagelijks, 2 uur voor atazanavir), was de AUC verlaagd met 94%, de Cmax met 96% en de Cmin met 95%.
Saquinavir: Na meervoudige dosering van saquinavir/ritonavir (1000/100 mg) tweemaal daags gedurende 15 dagen met omeprazol 40 mg per dag gelijktijdig toegediend op dag 11 tot 15.
De AUC was verhoogd met 82%, de Cmax met 75% en de Cmin met 106%. Het mechanisme achter deze interactie is niet volledig opgehelderd.
Clopidogrel
In een cross-over klinisch onderzoek kregen 72 gezonde proefpersonen clopidogrel (300 mg oplaaddosis gevolgd door 75 mg per dag) alleen en omeprazol (80 mg tegelijk met clopidogrel) gedurende 5 dagen toegediend. De blootstelling aan de actieve metaboliet van clopidogrel nam af met 46% (dag 1) en 42% (dag 5) wanneer clopidogrel en omeprazol samen werden toegediend.
Resultaten van een ander cross-overonderzoek bij gezonde proefpersonen lieten een vergelijkbare farmacokinetische interactie zien tussen clopidogrel (300 mg oplaaddosis/75 mg dagelijkse onderhoudsdosis) en omeprazol 80 mg per dag bij gelijktijdige toediening gedurende 30 dagen. Blootstelling aan de actieve metaboliet van clopidogrel werd in deze periode met 41% tot 46% verminderd.
In een ander onderzoek kregen 72 gezonde proefpersonen dezelfde doses clopidogrel en 80 mg omeprazol, maar de geneesmiddelen werden met een tussenpoos van 12 uur toegediend; de resultaten waren vergelijkbaar, wat aangeeft dat toediening van clopidogrel en omeprazol op verschillende tijdstippen hun interactie niet verhindert [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
Mycofenolaatmofetil
Toediening van omeprazol 20 mg tweemaal daags gedurende 4 dagen en een enkelvoudige dosis van 1000 mg MMF ongeveer één uur na de laatste dosis omeprazol aan 12 gezonde proefpersonen in een cross-over onderzoek resulteerde in een verlaging van 52% van de Cmax en 23% verlaging in de AUC van MPA [zie DRUG-INTERACTIES ].
Cilostazol
Omeprazol werkt als een remmer van CYP2C19. Omeprazol, gegeven in doses van 40 mg per dag gedurende één week aan 20 gezonde proefpersonen in een cross-over onderzoek, verhoogde de Cmax en AUC van cilostazol met respectievelijk 18% en 26%. De Cmax en AUC van een van de actieve metabolieten, 3,4-dihydro-cilostazol, dat 4-7 keer de activiteit van cilostazol heeft, waren met respectievelijk 29% en 69% verhoogd. Gelijktijdige toediening van cilostazol met omeprazol zal naar verwachting de concentraties van cilostazol en de bovengenoemde actieve metaboliet verhogen (zie DRUG-INTERACTIES ].
diazepam
Gelijktijdige toediening van eenmaal daags 20 mg omeprazol en intraveneus toegediend diazepam 0,1 mg/kg resulteerde in een afname van 27% van de klaring en een toename van 36% van de halfwaardetijd van diazepam [zie DRUG-INTERACTIES ].
Digoxine
Gelijktijdige toediening van eenmaal daags 20 mg omeprazol en digoxine bij gezonde proefpersonen verhoogde de biologische beschikbaarheid van digoxine met 10% (30% bij twee proefpersonen) [zie DRUG-INTERACTIES ].
Effect van andere geneesmiddelen op omeprazol
Voriconazol
Gelijktijdige toediening van omeprazol en voriconazol (een gecombineerde remmer van CYP2C19 en CYP3A4) resulteerde in een meer dan verdubbeling van de blootstelling aan omeprazol. Wanneer voriconazol (400 mg elke 12 uur gedurende één dag, gevolgd door 200 mg eenmaal daags gedurende 6 dagen) werd gegeven met omeprazol (40 mg eenmaal daags gedurende 7 dagen) aan gezonde proefpersonen, werden de steady-state Cmax en AUC0-24 van omeprazol significant verhoogd: gemiddeld 2 keer (90% BI: 1,8, 2,6) en 4 keer (90% BI: 3,3, 4,4), in vergelijking met wanneer omeprazol werd gegeven zonder voriconazol [zie DRUG-INTERACTIES ].
Microbiologie
Omeprazol en claritromycine duale therapie en omeprazol, claritromycine en amoxicilline drievoudige therapie zijn werkzaam gebleken tegen de meeste stammen van Helicobacter pylori in vitro en bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK , Klinische studies ].
Helicobacter pylori
De gevoeligheidstesten van H. pylori-isolaten werden uitgevoerd voor amoxicilline en claritromycine met behulp van agarverdunningsmethodologie1 en minimale remmende concentraties (MIC's) werden bepaald.
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontrolemicro-organismen om de technische aspecten van de laboratoriumprocedures te controleren.
Voorbehandelingsweerstand:
De resistentiepercentages voor claritromycine vóór de behandeling waren 3,5% (4/113) in de onderzoeken met dubbele therapie omeprazol/claritromycine (4 en 5) en 9,3% (41/439) in de onderzoeken met drievoudige therapie omeprazol/claritromycine/amoxicilline (1, 2 en 3).
Voor de behandeling van amoxicilline gevoelige isolaten (≤ 0,25 g/ml) werden gevonden bij 99,3% (436/439) van de patiënten in de drievoudige therapie-onderzoeken omeprazol/claritromycine/amoxicilline (1, 2 en 3). Minimale remmende concentraties (MIC's) voor de behandeling van amoxicilline > 0,25 g/ml kwamen voor bij 0,7% (3/439) van de patiënten, die allemaal in de claritromycine- en amoxicilline-onderzoeksarm zaten. Eén patiënt had een onbevestigde amoxicilline minimale remmende concentratie (MIC) vóór de behandeling van > 256 g/ml volgens Etest®.
Patiënten die niet zijn uitgeroeid van H. pylori na drievoudige therapie met omeprazol/claritromycine/amoxicilline of tweevoudige therapie omeprazol/claritromycine, zullen waarschijnlijk claritromycine-resistente H. pylori-isolaten hebben. Daarom moeten, indien mogelijk, gevoeligheidstesten voor claritromycine worden uitgevoerd. Patiënten met claritromycine-resistente H. pylori mogen niet worden behandeld met een van de volgende behandelingen: tweevoudige therapie omeprazol/claritromycine, drievoudige therapie omeprazol/claritromycine/amoxicilline of andere regimes die claritromycine als het enige antimicrobiële middel bevatten.
Resultaten van amoxicillinegevoeligheidstests en klinische/bacteriologische resultaten
In de klinische onderzoeken met drievoudige therapie werd H. pylori uitgeroeid bij 84,9% (157/185) van de patiënten in de omeprazol/claritromycine/amoxicilline-behandelingsgroep die voor de behandeling voor amoxicilline gevoelige MIC's hadden (≤ 0,25 g/ml) en bij 15,1% (28). /185) mislukte therapie. Van de 28 patiënten bij wie drievoudige therapie faalde, hadden er 11 geen gevoeligheidstestresultaten na de behandeling en 17 hadden H. pylori-isolaten na de behandeling met voor amoxicilline gevoelige MIC's. Elf van de patiënten bij wie drievoudige therapie faalde, hadden na de behandeling ook H. pylori-isolaten met claritromycine-resistente MIC's.
Gevoeligheidstest voor Helicobacter pylori
Voor informatie over gevoeligheidstests over Helicobacter pylori, zie de sectie Microbiologie in de voorschrijfinformatie voor claritromycine en amoxicilline.
Effecten op gastro-intestinale microbiële ecologie
Verminderde maagzuurgraad als gevolg van welke middelen dan ook, waaronder protonpompremmers, verhoogt het aantal bacteriën in de maag dat normaal in het maagdarmkanaal aanwezig is. Behandeling met protonpompremmers kan leiden tot een licht verhoogd risico op gastro-intestinale infecties zoals Salmonella en Campylobacter en, bij gehospitaliseerde patiënten, mogelijk ook Clostridium difficile.
farmacogenomica
CYP2C19, een polymorf enzym, is betrokken bij het metabolisme van omeprazol. Het CYP2C19*1-allel is volledig functioneel, terwijl de CYP2C19*2- en *3-allelen niet-functioneel zijn. Er zijn andere allelen geassocieerd met geen of verminderde enzymatische functie. Patiënten met twee volledig functionele allelen zijn uitgebreide metaboliseerders en patiënten met twee functieverliesallelen zijn slechte metaboliseerders. Bij snelle metaboliseerders wordt omeprazol voornamelijk gemetaboliseerd door CYP2C19.
De systemische blootstelling aan omeprazol varieert met de stofwisselingsstatus van een patiënt: trage metaboliseerders > intermediaire metaboliseerders > uitgebreide metaboliseerders. Ongeveer 3% van de blanken en 15 tot 20% van de Aziaten zijn slechte CYP2C19-metaboliseerders.
In een farmacokinetisch onderzoek met een enkelvoudige dosis van 20 mg omeprazol was de AUC van omeprazol bij Aziatische proefpersonen ongeveer het viervoudige van die bij blanken [zie DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ].
Klinische studies
Actieve ulcus duodeni
In een multicenter, dubbelblinde, placebo-gecontroleerde studie van 147 patiënten met endoscopisch gedocumenteerd ulcus duodeni, was het percentage patiënten dat (volgens protocol) na 2 en 4 weken genezen significant hoger met omeprazol magnesium capsules met vertraagde afgifte 20 mg eenmaal daags dan met placebo (p 0,01).
Behandeling van actieve duodenumulcus % genezen patiënten
Volledige pijnverlichting overdag en 's nachts trad significant sneller op (p 0,01) bij patiënten die werden behandeld met 20 mg omeprazol magnesium capsules met vertraagde afgifte dan bij patiënten die werden behandeld met placebo. Aan het einde van de studie hadden significant meer patiënten die omeprazolmagnesium capsules met vertraagde afgifte hadden gekregen volledige verlichting van pijn overdag (p 0,05) en pijn 's nachts (p 0,01).
In een multicenter, dubbelblind onderzoek onder 293 patiënten met endoscopisch gedocumenteerde ulcus duodeni, was het percentage patiënten dat (volgens protocol) na 4 weken genezen was significant hoger met omeprazol magnesium capsules met vertraagde afgifte 20 mg eenmaal daags dan met ranitidine 150 mg tweemaal daags ( p
Behandeling van actieve duodenumulcus % genezen patiënten
Genezing trad significant sneller op bij patiënten die werden behandeld met omeprazol magnesium capsules met vertraagde afgifte dan bij patiënten die werden behandeld met ranitidine 150 mg tweemaal daags (p
In een buitenlandse multinationale gerandomiseerde, dubbelblinde studie van 105 patiënten met endoscopisch gedocumenteerde ulcus duodeni, werden 20 mg en 40 mg omeprazol magnesium capsules met vertraagde afgifte vergeleken met 150 mg ranitidine tweemaal daags na 2, 4 en 8 weken. Na 2 en 4 weken waren beide doses PRILOSEC 10 mg statistisch superieur (per protocol) aan ranitidine, maar 40 mg was niet superieur aan 20 mg omeprazol magnesium capsules met vertraagde afgifte, en na 8 weken was er geen significant verschil tussen een van de actieve medicijnen.
Behandeling van actieve duodenumulcus % genezen patiënten
Uitroeiing van H. pylori bij patiënten met zweren aan de twaalfvingerige darm
Triple Therapy (omeprazol magnesium capsules met vertraagde afgifte/claritromycine/amoxicilline)
Drie Amerikaanse, gerandomiseerde, dubbelblinde klinische onderzoeken bij patiënten met H. pylori-infectie en ulcus duodeni (n = 558) vergeleken omeprazol-magnesiumcapsules met vertraagde afgifte plus claritromycine plus amoxicilline met claritromycine plus amoxicilline. Twee onderzoeken (1 en 2) werden uitgevoerd bij patiënten met een actieve zweer in de twaalfvingerige darm, en de andere studie (3) werd uitgevoerd bij patiënten met een voorgeschiedenis van een zweer in de twaalfvingerige darm in de afgelopen 5 jaar, maar zonder dat er een ulcus aanwezig was op het moment van inschrijving . Het doseringsschema in de onderzoeken was omeprazol magnesium capsules met vertraagde afgifte 20 mg tweemaal daags plus claritromycine 500 mg tweemaal daags plus amoxicilline 1 g tweemaal daags gedurende 10 dagen; of claritromycine 500 mg tweemaal daags plus amoxicilline 1 g tweemaal daags gedurende 10 dagen. In onderzoeken 1 en 2 kregen patiënten die de omeprazol-kuur gebruikten ook nog eens 18 dagen omeprazol magnesium capsules met vertraagde afgifte 20 mg eenmaal daags. De onderzochte eindpunten waren uitroeiing van H. pylori en genezing van zweren in de twaalfvingerige darm (alleen onderzoeken 1 en 2). De status van H. pylori werd in alle drie de onderzoeken bepaald door CLOtest®, histologie en kweek. Voor een bepaalde patiënt werd H. pylori als uitgeroeid beschouwd als ten minste twee van deze tests negatief waren en geen enkele positief.
De combinatie van omeprazol plus claritromycine plus amoxicilline was effectief bij het uitroeien van H. pylori.
Dual Therapy (omeprazol magnesium capsules met vertraagde afgifte/claritromycine)
Vier gerandomiseerde, dubbelblinde, multicenter studies (4, 5, 6 en 7) evalueerden omeprazol magnesium capsules met vertraagde afgifte 40 mg eenmaal daags plus claritromycine 500 mg driemaal daags gedurende 14 dagen, gevolgd door omeprazol magnesium met vertraagde afgifte capsules 20 mg eenmaal daags (onderzoeken 4, 5 en 7) of door omeprazol magnesium capsules met vertraagde afgifte 40 mg eenmaal daags (onderzoek 6) gedurende nog eens 14 dagen bij patiënten met een actief ulcus duodeni geassocieerd met H. pylori. Studies 4 en 5 werden uitgevoerd in de VS en Canada en namen respectievelijk 242 en 256 patiënten op. H. pylori-infectie en ulcus duodeni werden bevestigd bij 219 patiënten in onderzoek 4 en 228 patiënten in onderzoek 5. In deze onderzoeken werd het combinatieschema vergeleken met omeprazol-magnesiumcapsules met vertraagde afgifte en claritromycine monotherapieën. Studies 6 en 7 werden uitgevoerd in Europa en namen respectievelijk 154 en 215 patiënten op. H. pylori-infectie en ulcus duodeni werden bevestigd bij 148 patiënten in onderzoek 6 en bij 208 patiënten in onderzoek 7. In deze onderzoeken werd het combinatieschema vergeleken met omeprazol als monotherapie. De resultaten voor de werkzaamheidsanalyses voor deze onderzoeken worden hieronder beschreven. Uitroeiing van H. pylori werd gedefinieerd als geen positieve test (kweek of histologie) 4 weken na het einde van de behandeling, en er waren twee negatieve tests nodig om te worden beschouwd als uitgeroeid van H. pylori. In de analyse per protocol werden de volgende patiënten uitgesloten: drop-outs, patiënten met ontbrekende H. pylori-tests na de behandeling en patiënten bij wie de uitroeiing van H. pylori niet werd beoordeeld omdat ze aan het einde van de behandeling een ulcus hadden gevonden .
De combinatie van omeprazol en claritromycine was effectief bij het uitroeien van H. pylori.
De genezing van de zweer was niet significant verschillend wanneer claritromycine werd toegevoegd aan omeprazol-therapie in vergelijking met alleen omeprazol-therapie.
De combinatie van omeprazol en claritromycine was effectief bij het uitroeien van H. pylori en verminderde het terugkeren van zweren in de twaalfvingerige darm.
Actieve goedaardige maagzweer
In een multicenter, dubbelblind onderzoek in de VS met omeprazol 40 mg eenmaal daags, 20 mg eenmaal daags en placebo bij 520 patiënten met endoscopisch gediagnosticeerde maagzweer, werden de volgende resultaten verkregen.
Behandeling van maagzweren % genezen patiënten (alle behandelde patiënten)
Voor de gestratificeerde groepen patiënten met een ulcusgrootte kleiner dan of gelijk aan 1 cm, werd geen verschil in genezingspercentages tussen 40 mg en 20 mg waargenomen na 4 of 8 weken. Voor patiënten met een ulcus groter dan 1 cm was 40 mg significant effectiever dan 20 mg na 8 weken.
In een buitenlandse, multinationale, dubbelblinde studie van 602 patiënten met endoscopisch gediagnosticeerde maagzweren, werden omeprazol 40 mg eenmaal daags, 20 mg eenmaal daags en ranitidine 150 mg tweemaal daags geëvalueerd.
Behandeling van maagzweren % genezen patiënten (alle behandelde patiënten)
Symptomatische GERD
Er is een placebogecontroleerd onderzoek uitgevoerd in Scandinavië om de werkzaamheid van omeprazol 20 mg of 10 mg eenmaal daags gedurende maximaal 4 weken te vergelijken bij de behandeling van brandend maagzuur en andere symptomen bij GORZ-patiënten zonder EE. Resultaten worden hieronder weergegeven.
% succesvolle symptomatische uitkomst1
EE vanwege zuur-gemedieerde GERD
In een multicenter dubbelblind placebogecontroleerd onderzoek in de VS van 20 mg of 40 mg omeprazol magnesium capsules met vertraagde afgifte bij patiënten met symptomen van GORZ en endoscopisch gediagnosticeerde EE van graad 2 of hoger, waren de percentages genezingspercentages (per protocol) als volgt :
In deze studie was de dosis van 40 mg niet superieur aan de dosis van 20 mg omeprazol magnesium capsules met vertraagde afgifte wat betreft genezingspercentage. Andere gecontroleerde klinische onderzoeken hebben ook aangetoond dat omeprazol-magnesiumcapsules met vertraagde afgifte effectief zijn bij ernstige GORZ. In vergelijking met histamine-H2-receptorantagonisten bij patiënten met EE, graad 2 of hoger, waren omeprazol-magnesiumcapsules met vertraagde afgifte in een dosis van 20 mg significant effectiever dan de actieve controles. Volledige verlichting van brandend maagzuur overdag en 's nachts trad significant sneller op (p
In deze en vijf andere gecontroleerde GERD-onderzoeken rapporteerden significant meer patiënten die 20 mg omeprazol gebruikten (84%) volledige verlichting van GERD-symptomen dan patiënten die placebo kregen (12%).
Onderhoud van genezing van EE door zuur-gemedieerde GERD
In een dubbelblind, gerandomiseerd, multicenter, placebogecontroleerd onderzoek in de VS werden twee doseringsschema's van omeprazol-magnesiumcapsules met vertraagde afgifte onderzocht bij patiënten met endoscopisch bevestigde genezen oesofagitis. Resultaten om het behoud van genezing van EE te bepalen, worden hieronder weergegeven.
Levenstafelanalyse
In een internationaal multicenter dubbelblind onderzoek werden omeprazol magnesium capsules met vertraagde afgifte 20 mg per dag en 10 mg per dag vergeleken met ranitidine 150 mg tweemaal per dag bij patiënten met endoscopisch bevestigde genezen oesofagitis. De onderstaande tabel geeft de resultaten van deze studie voor het behoud van genezing van EE.
Levenstafelanalyse
Bij patiënten die aanvankelijk graad 3 of 4 erosieve oesofagitis hadden, was voor onderhoud na genezing 20 mg omeprazol magnesium capsules met vertraagde afgifte per dag effectief, terwijl 10 mg geen effectiviteit aantoonde.
Pathologische hypersecretoire aandoeningen
In open onderzoeken bij 136 patiënten met pathologische hypersecretoire aandoeningen, zoals het Zollinger-Ellison (ZE)-syndroom met of zonder meerdere endocriene adenomen, remden omeprazol-magnesiumcapsules met vertraagde afgifte de maagzuursecretie en beheersten de bijbehorende symptomen van diarree, anorexia en pijn. Doses variërend van 20 mg om de dag tot 360 mg per dag hielden de basale zuursecretie lager dan 10 mEq/uur bij patiënten zonder eerdere maagchirurgie, en lager dan 5 mEq/uur bij patiënten met eerdere maagchirurgie.
De aanvangsdoses werden getitreerd naar de individuele behoefte van de patiënt, en bij sommige patiënten waren na verloop van tijd aanpassingen nodig [zie: DOSERING EN ADMINISTRATIE ]. Omeprazol magnesium capsules met vertraagde afgifte werden bij deze hoge doseringen gedurende langere perioden goed verdragen (> 5 jaar bij sommige patiënten). Bij de meeste ZE-patiënten werden de serumgastrinespiegels niet gewijzigd door capsules met vertraagde afgifte van magnesium omeprazol. Bij sommige patiënten steeg het serumgastrine echter tot spiegels die hoger waren dan die welke aanwezig waren vóór de start van de behandeling met omeprazol. Ten minste 11 patiënten met ZE-syndroom die langdurig werden behandeld met omeprazol-magnesiumcapsules met vertraagde afgifte, ontwikkelden maagcarcinoïden. Aangenomen wordt dat deze bevindingen een manifestatie zijn van de onderliggende aandoening, waarvan bekend is dat deze geassocieerd is met dergelijke tumoren, en niet het resultaat van de toediening van omeprazol-magnesiumcapsules met vertraagde afgifte [zie ONGEWENSTE REACTIES ].
Pediatrische studies voor de behandeling van symptomatische GERD, behandeling van EE als gevolg van zuur-gemedieerde GERD en onderhoud van genezing van EE als gevolg van zuur-gemedieerde GERD
Behandeling van symptomatische GERD
De werkzaamheid van omeprazol-magnesiumcapsules met vertraagde afgifte voor de behandeling van symptomatische GORZ bij pediatrische patiënten van 1 tot 16 jaar is gedeeltelijk gebaseerd op gegevens die zijn verkregen van 125 pediatrische patiënten in twee ongecontroleerde klinische onderzoeken.
Aan de eerste studie namen 12 pediatrische patiënten van 1 tot 2 jaar deel met een voorgeschiedenis van klinisch gediagnosticeerde GERD. Patiënten kregen gedurende 8 weken een enkele dosis omeprazol (0,5 mg/kg, 1 mg/kg of 1,5 mg/kg) toegediend als een open capsule in 8,4% natriumbicarbonaatoplossing. Vijfenzeventig procent (9/12) van de patiënten had episodes van braken/regurgitatie die met ten minste 50% afnamen ten opzichte van de uitgangswaarde.
Aan de tweede studie namen 113 pediatrische patiënten van 2 tot 16 jaar deel met een voorgeschiedenis van symptomen die wijzen op symptomatische GORZ. De patiënten kregen gedurende 4 weken een enkele dosis omeprazol (10 mg of 20 mg, gebaseerd op het lichaamsgewicht) toegediend als intacte capsule of als open capsule in appelmoes. Succesvolle respons werd gedefinieerd als geen matige of ernstige episodes van pijngerelateerde symptomen of braken/regurgitatie gedurende de laatste 4 dagen van de behandeling. De resultaten toonden succespercentages van respectievelijk 60% (9/15; 10 mg omeprazol) en 59% (58/98; 20 mg omeprazol).
Behandeling van EE als gevolg van door zuur gemedieerde GERD
In een ongecontroleerd, open-label dosistitratieonderzoek, voor de behandeling van EE bij pediatrische patiënten van 1 tot 16 jaar, waren doses nodig die varieerden van 0,7 tot 3,5 mg/kg/dag (80 mg/dag). Doses werden gestart met 0,7 mg/kg/dag. Doses werden verhoogd in stappen van 0,7 mg/kg/dag (als de intra-oesofageale pH een pH van
Onderhoud van genezing van EE door zuur-gemedieerde GERD
In een ongecontroleerd, open-label onderzoek naar het behoud van genezing van EE bij 46 pediatrische patiënten van 1 tot 16 jaar, had 54% van de patiënten de helft van de genezingsdosis nodig. De overige patiënten verhoogden de genezingsdosis (0,7 tot maximaal 2,8 mg/kg/dag) ofwel gedurende de gehele onderhoudsperiode, of keerden terug naar de helft van de dosis voordat deze was voltooid. Van de 46 patiënten die in de onderhoudsfase kwamen, hadden 19 (41%) geen terugval tijdens de follow-up (spreiding 4 tot 25 maanden). Bovendien leidde onderhoudstherapie bij EE-patiënten ertoe dat 63% van de patiënten geen algemene symptomen had.
REFERENTIES
1. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard: tiende editie. CLSI-document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, VS 2015.
PATIËNT INFORMATIE
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) voor orale suspensie met vertraagde afgifte
Wat is de belangrijkste informatie die ik over PRILOSEC moet weten?
PRILOSEC 10 mg kan helpen bij uw zuurgerelateerde symptomen, maar u kunt nog steeds ernstige maagproblemen hebben. Praat met uw arts.
PRILOSEC kan ernstige bijwerkingen veroorzaken, waaronder:
- Een type nierprobleem (acute tubulo-interstitiële nefritis). Sommige mensen die geneesmiddelen met protonpompremmers (PPI), waaronder PRILOSEC, gebruiken, kunnen een nierprobleem ontwikkelen dat acute tubulo-interstitiële nefritis wordt genoemd en dat op elk moment tijdens de behandeling met PRILOSEC kan optreden. Bel onmiddellijk uw arts als u minder plast of als u bloed in uw urine heeft.
- Diarree veroorzaakt door een infectie (Clostridium difficile) in uw darmen. Bel onmiddellijk uw arts als u waterige ontlasting of maagpijn heeft die niet weggaat. U kunt wel of geen koorts hebben.
- Botbreuken (heup, pols of wervelkolom). Botbreuken in de heup, pols of wervelkolom kunnen optreden bij mensen die meerdere dagelijkse doses PPI-geneesmiddelen gebruiken en gedurende een lange periode (een jaar of langer). Vertel het uw arts als u een botbreuk heeft, vooral in de heup, pols of wervelkolom.
- Bepaalde soorten lupus erythematosus. Lupus erythematosus is een auto-immuunziekte (de afweercellen van het lichaam vallen andere cellen of organen in het lichaam aan). Sommige mensen die PPI-geneesmiddelen gebruiken, waaronder PRILOSEC 10 mg, kunnen bepaalde vormen van lupus erythematosus ontwikkelen of de lupus die ze al hebben verergeren. Bel onmiddellijk uw arts als u nieuwe of verergerende gewrichtspijn of uitslag op uw wangen of armen heeft die erger wordt in de zon.
Praat met uw arts over uw risico op deze ernstige bijwerkingen. PRILOSEC 10 mg kan andere ernstige bijwerkingen hebben. Zie “Wat zijn de mogelijke bijwerkingen van PRILOSEC 20 mg?”
Wat is PRILOSEC 20 mg?
Een receptgeneesmiddel dat een protonpompremmer (PPI) wordt genoemd en dat wordt gebruikt om de hoeveelheid zuur in uw maag te verminderen.
Bij volwassenen, PRILOSEC 20 mg wordt gebruikt voor:
- tot 8 weken voor de genezing van zweren in de twaalfvingerige darm.
- 10 tot 14 dagen met bepaalde antibiotica om een infectie te behandelen die wordt veroorzaakt door de bacterie H. pylori. Indien nodig kan uw arts u na behandeling met de antibiotica nog eens 14 tot 18 dagen PRILOSEC voorschrijven.
- tot 8 weken voor genezing van maagzweren.
- tot 4 weken voor de behandeling van brandend maagzuur en andere symptomen die optreden bij gastro-oesofageale refluxziekte (GERD).
- tot 8 weken voor de genezing en symptoomverlichting van zuurgerelateerde schade aan het slijmvlies van de slokdarm (erosieve oesofagitis of EE genoemd). Uw arts kan nog eens 4 weken PRILOSEC 20 mg voorschrijven aan patiënten van wie de EE niet geneest.
- genezing van EE te behouden en de terugkeer van symptomen van brandend maagzuur veroorzaakt door GERD te helpen voorkomen. Het is niet bekend of PRILOSEC veilig en effectief is als het langer dan 12 maanden voor dit doel wordt gebruikt.
- de langdurige behandeling van aandoeningen waarbij uw maag te veel zuur aanmaakt. Dit omvat een zeldzame aandoening die het Zollinger-Ellison-syndroom wordt genoemd.
Bij kinderen van 1 tot 16 jaar PRILOSEC 20 mg wordt gebruikt voor:
- tot 4 weken voor de behandeling van brandend maagzuur en andere symptomen die optreden bij GERD.
- tot 8 weken om GERD met EE te behandelen.
- genezing van EE te behouden en de terugkeer van symptomen van brandend maagzuur veroorzaakt door GERD te helpen voorkomen. Het is niet bekend of PRILOSEC veilig en effectief is bij gebruik langer dan 12 maanden voor dit doel.
Bij kinderen van 1 maand tot jonger dan 12 maanden, PRILOSEC 10 mg wordt gebruikt voor:
- tot 6 weken om GERD met EE te behandelen. Het is niet bekend of PRILOSEC veilig en effectief is voor ander gebruik bij kinderen van 1 maand tot jonger dan 12 maanden, of bij kinderen jonger dan 1 maand.
Gebruik PRILOSEC niet als u:
- allergisch zijn voor omeprazol, voor enig ander PPI-geneesmiddel of voor één van de bestanddelen van PRILOSEC. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten.
- het nemen van een geneesmiddel dat rilpivirine bevat (EDURANT, COMPLERA, ODEFSEY) dat wordt gebruikt voor de behandeling van hiv-1 (humaan immunodeficiëntievirus).
Vertel uw arts over al uw medische aandoeningen voordat u PRILOSEC 20 mg inneemt, ook als u:
- een laag magnesiumgehalte, laag calciumgehalte en laag kaliumgehalte in uw bloed heeft.
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of PRILOSEC 10 mg schadelijk is voor uw ongeboren baby.
- borstvoeding geeft of van plan bent borstvoeding te geven. PRILOSEC 40 mg kan in uw moedermelk terechtkomen. Praat met uw arts over de beste manier om uw baby te voeden als u PRILOSEC gebruikt.
- Vertel uw arts over alle geneesmiddelen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. Vertel het vooral aan uw arts als u een geneesmiddel dat claritromycine of amoxicilline, clopidogrel (Plavix), methotrexaat (Otrxup, Rasuvo, Trexall, XATMEP), digoxine (LANOXIN), een waterpil (diureticum), sint-janskruid (Hypericum perforatum) of rifampicine bevat (Rimactaan, Rifater, Rifamaat).
Hoe moet ik PRILOSEC 20 mg innemen?
- Neem PRILOSEC 20 mg precies in zoals voorgeschreven door uw arts.
- Verander uw dosis niet en stop niet met PRILOSEC 40 mg zonder met uw arts te overleggen.
- PRILOSEC wordt gewoonlijk 1 keer per dag ingenomen.
- Neem PRILOSEC 20 mg voor een maaltijd.
- Antacida kunnen samen met PRILOSEC worden ingenomen.
- PRILOSEC wordt gemengd met water en kan via de mond worden ingenomen of via een nasogastrische (NG) sonde of maagsonde worden toegediend.
- Zie de "Gebruiksaanwijzing" aan het einde van deze medicatiehandleiding voor instructies over het mengen en innemen van PRILOSEC 10 mg via de mond in water of hoe PRILOSEC te mengen en toe te dienen via een NG-slang of maagsonde gemengd in water.
- Als u een dosis PRILOSEC bent vergeten, neem deze dan in zodra u eraan denkt. Als het bijna tijd is voor uw volgende dosis, neem dan de gemiste dosis niet in. Neem de volgende dosis op uw normale tijd. Neem geen 2 doses tegelijk.
- Als u te veel PRILOSEC heeft ingenomen, bel dan onmiddellijk uw arts of uw antigifcentrum op 1-800-222-1222 of ga naar de dichtstbijzijnde eerste hulpafdeling.
Wat zijn de mogelijke bijwerkingen van PRILOSEC 40 mg?
PRILOSEC kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien “Wat is de belangrijkste informatie die ik moet weten over PRILOSEC 40 mg?”
- Lage vitamine B12-spiegels in uw lichaam kan optreden bij mensen die PRILOSEC 40 mg gedurende lange tijd (meer dan 3 jaar) hebben gebruikt. Vertel het uw arts als u symptomen heeft van lage vitamine B12-spiegels, waaronder kortademigheid, duizeligheid, onregelmatige hartslag, spierzwakte, bleke huid, vermoeidheid, stemmingswisselingen en tintelingen of gevoelloosheid in de armen en benen.
- Laag magnesiumgehalte en mineraalmetabolisme in uw lichaam kan optreden bij mensen die PRILOSEC gedurende ten minste 3 maanden hebben gebruikt. Vertel het uw arts als u symptomen heeft van een laag magnesiumgehalte, waaronder toevallen, duizeligheid, onregelmatige hartslag, zenuwachtigheid, spierpijn of spierzwakte, en spasmen van handen, voeten of stem.
- Maaggroei (fundic gland poliepen). Mensen die gedurende lange tijd PPI-geneesmiddelen gebruiken, hebben een verhoogd risico op het ontwikkelen van een bepaald type maaggroei, de zogenaamde fundusklierpoliepen, vooral na het gebruik van PPI-geneesmiddelen gedurende meer dan 1 jaar.
- Ernstige huidreacties. PRILOSEC kan zeldzame maar ernstige huidreacties veroorzaken die elk deel van uw lichaam kunnen aantasten. Deze ernstige huidreacties moeten mogelijk in een ziekenhuis worden behandeld en kunnen levensbedreigend zijn:
- Huiduitslag met blaarvorming, vervelling of bloeding op elk deel van uw huid (inclusief uw lippen, ogen, mond, neus, geslachtsdelen, handen of voeten).
- U kunt ook koorts, koude rillingen, pijn in het lichaam, kortademigheid of vergrote lymfeklieren hebben.
Stop met het innemen van PRILOSEC 20 mg en bel onmiddellijk uw arts. Deze symptomen kunnen het eerste teken zijn van een ernstige huidreactie.
De meest voorkomende bijwerkingen van PRILOSEC 40 mg bij volwassenen zijn: hoofdpijn, maag (buik) pijn, misselijkheid, diarree, braken en gas.
De meest voorkomende bijwerkingen van PRILOSEC bij kinderen van 1 tot 16 jaar zijn: infectie van de bovenste luchtwegen, koorts, hoofdpijn, pijn in de maagstreek (buik), misselijkheid, diarree, braken en gas. Dit zijn niet alle mogelijke bijwerkingen van PRILOSEC. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik PRILOSEC 40 mg bewaren?
Bewaar PRILOSEC bij kamertemperatuur tussen 68 ° F en 77 ° F (20 ° C tot 25 ° C).
Houd PRILOSEC 20 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van PRILOSEC.
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik PRILOSEC niet voor een aandoening waarvoor het niet is voorgeschreven. Geef PRILOSEC 40 mg niet aan andere mensen, ook niet als ze dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw arts of apotheker om informatie vragen over PRILOSEC 20 mg die is geschreven voor beroepsbeoefenaren in de gezondheidszorg.
Wat zijn de ingrediënten in PRILOSEC?
Actief ingrediënt: omeprazol magnesium
Inactieve ingredienten: glycerylmonostearaat, hydroxypropylcellulose, hypromellose, magnesiumstearaat, methacrylzuurcopolymeer C, polysorbaat, suikerbolletjes, talk en triethylcitraat, en ook inactieve korrels. De inactieve korrels zijn samengesteld uit citroenzuur, crospovidon, dextrose, hydroxypropylcellulose, ijzeroxide en xanthaangom.
GEBRUIKSAANWIJZING
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) voor orale suspensie met vertraagde afgifte
Inname van PRILOSEC 40 mg in water:
PRILOSEC met water toedienen via een nasogastrische (NG) sonde of maagsonde:
Voor mensen met een NG-slang of maagsonde van maat 6 of groter, kan PRILOSEC als volgt worden toegediend:
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration
