Imodium 2mg Loperamide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Imodium 2 mg en hoe wordt het gebruikt?
Imodium 2 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van acute diarree, chronische diarree en reizigersdiarree te behandelen. Imodium kan alleen of met andere medicijnen worden gebruikt.
Imodium behoort tot een klasse geneesmiddelen die antidiarree wordt genoemd.
Wat zijn de mogelijke bijwerkingen van Imodium?
Imodium kan ernstige bijwerkingen veroorzaken, waaronder:
- diarree die waterig of bloederig is,
- maagpijn of een opgeblazen gevoel,
- aanhoudende of verergerende diarree,
- snelle of bonzende hartslagen,
- fladderend in je borst,
- kortademigheid, en
- duizeligheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Imodium zijn:
- constipatie,
- duizeligheid,
- slaperigheid,
- misselijkheid, en
- buikkrampen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Imodium. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
IMODIUM® (loperamidehydrochloride), 4- (p-chloorfenyl)-4-hydroxy-N, N-dimethyl-a, a-difenyl-1-piperidinebutyramide-monohydrochloride, is een synthetisch middel tegen diarree voor oraal gebruik.
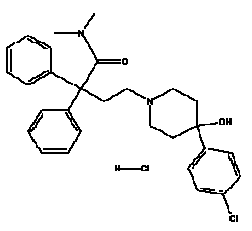
IMODIUM® (loperamide hcl) is verkrijgbaar in capsules van 2 mg.
De inactieve ingrediënten zijn: Lactose, maïszetmeel, talk en magnesiumstearaat. IMODIUM® (loperamide hcl) capsules bevatten FD & C Yellow No. 6.
INDICATIES
IMODIUM® (loperamidehydrochloride) is geïndiceerd voor de controle en symptomatische verlichting van acute niet-specifieke diarree en van chronische diarree geassocieerd met inflammatoire darmaandoeningen. IMODIUM® (loperamide hcl) is ook geïndiceerd voor het verminderen van het volume van afscheiding uit ileostomieën.
DOSERING EN ADMINISTRATIE
(1 capsule = 2mg)
Patiënten moeten indien nodig de juiste vloeistof- en elektrolytenvervanging krijgen.
Acute diarree
Volwassenen: De aanbevolen aanvangsdosis is 4 mg (twee capsules) gevolgd door 2 mg (één capsule) na elke ongevormde ontlasting. De dagelijkse dosis mag niet hoger zijn dan 16 mg (acht capsules). Klinische verbetering wordt meestal binnen 48 uur waargenomen.
Kinderen: Bij kinderen van 2 tot 5 jaar (20 kg of minder) moet de niet-voorgeschreven vloeibare formulering (IMODIUM® (loperamide hcl) AD 1 mg/5 ml) worden gebruikt; voor kinderen van 6 tot 12 jaar kunnen IMODIUM® (loperamide hcl) capsules of IMODIUM® (loperamide hcl) AD Liquid worden gebruikt. Voor kinderen van 2 tot 12 jaar voldoet het volgende schema voor capsules of vloeistof meestal aan de initiële doseringsvereisten:
Aanbevolen doseringsschema voor de eerste dag
Twee tot vijf jaar: 1 mg driemaal daags (3 mg dagelijkse dosis) (13 tot 20 kg) Zes tot acht jaar: 2 mg tweemaal daags (4 mg dagelijkse dosis) (20 tot 30 kg) Acht tot twaalf jaar: 2 mg driemaal daags (6 mg dagelijkse dosis) (groter dan 30 kg )
Aanbevolen vervolgdosering
Na de eerste behandelingsdag wordt aanbevolen om volgende doses IMODIUM® (loperamide hcl) (1 mg/10 kg lichaamsgewicht) alleen na een dunne ontlasting toe te dienen. De totale dagelijkse dosering mag de aanbevolen doseringen voor de eerste dag niet overschrijden.
Chronische diarree
Kinderen: Hoewel IMODIUM® (loperamide hcl) is onderzocht bij een beperkt aantal kinderen met chronische diarree; de therapeutische dosis voor de behandeling van chronische diarree bij pediatrische patiënten is niet vastgesteld.
Volwassenen: De aanbevolen aanvangsdosis is 4 mg (twee capsules) gevolgd door 2 mg (één capsule) na elke ongevormde ontlasting totdat de diarree onder controle is, waarna de dosering van IMODIUM® (loperamide hcl) moet worden verlaagd om aan de individuele behoeften te voldoen. Wanneer de optimale dagelijkse dosering is vastgesteld, kan deze hoeveelheid vervolgens als een enkele dosis of in verdeelde doses worden toegediend.
De gemiddelde dagelijkse onderhoudsdosering in klinische onderzoeken was 4 tot 8 mg (twee tot vier capsules). Een dosering van 16 mg (acht capsules) werd zelden overschreden. Als er geen klinische verbetering wordt waargenomen na behandeling met 16 mg per dag gedurende ten minste 10 dagen, is het onwaarschijnlijk dat de symptomen onder controle worden gebracht door verdere toediening. De toediening van IMODIUM® (loperamide hcl) kan worden voortgezet als diarree niet voldoende onder controle kan worden gebracht met een dieet of een specifieke behandeling.
Kinderen jonger dan 2 jaar
Het gebruik van IMODIUM (loperamide hcl) bij kinderen jonger dan 2 jaar wordt niet aanbevolen. Er zijn zeldzame meldingen geweest van paralytische ileus geassocieerd met opgezette buik. De meeste van deze meldingen deden zich voor bij acute dysenterie, overdosering en bij zeer jonge kinderen jonger dan twee jaar.
Ouderen
Er zijn geen formele farmacokinetische onderzoeken uitgevoerd bij oudere proefpersonen. Er werden echter geen grote verschillen gerapporteerd in de dispositie van het geneesmiddel bij oudere patiënten met diarree in vergelijking met jonge patiënten. Voor ouderen is geen dosisaanpassing nodig.
Nierfunctiestoornis
Er zijn geen farmacokinetische gegevens beschikbaar bij patiënten met een nierfunctiestoornis. Aangezien de metabolieten en het onveranderde geneesmiddel voornamelijk in de feces worden uitgescheiden, is er geen dosisaanpassing nodig voor patiënten met nierinsufficiëntie (zie VOORZORGSMAATREGELEN sectie ).
Leverfunctiestoornis
Hoewel er geen farmacokinetische gegevens beschikbaar zijn bij patiënten met leverinsufficiëntie, moet IMODIUM (loperamide hcl) bij dergelijke patiënten met voorzichtigheid worden gebruikt vanwege het verminderde first-pass-metabolisme. (zien PREVENTIEVE MAATREGELEN ).
HOE GELEVERD
Capsules - elke capsule bevat 2 mg loperamidehydrochloride. De capsules hebben een lichtgroene romp en een donkergroene dop met de opdruk "JANSSEN" op het ene segment en "IMODIUM" op het andere segment. IMODIUM® (loperamide hcl) capsules worden geleverd in flessen van 100.
NDC 50458-400-10 ......... (100 CAPSULES)
Bewaren bij 15°-25°C (59°-77°F).
Janssen Pharmaceutica Inc. Herzien september 1996, juli 1998. FDA Rev-datum: 21-10-2005
BIJWERKINGEN
Klinische onderzoeksgegevens
De bijwerkingen die zijn gemeld tijdens klinisch onderzoek van IMODIUM® (loperamidehydrochloride) zijn moeilijk te onderscheiden van symptomen die gepaard gaan met het diarreesyndroom. Bijwerkingen die werden geregistreerd tijdens klinische onderzoeken met IMODIUM® (loperamide hcl) waren over het algemeen van ondergeschikte en zelfbeperkende aard. Ze werden vaker waargenomen tijdens de behandeling van chronische diarree.
De gemelde bijwerkingen zijn samengevat, ongeacht de causaliteitsbeoordeling door de onderzoekers.
1) Bijwerkingen uit 4 placebogecontroleerde onderzoeken bij patiënten met acute diarree De bijwerkingen met een incidentie van 1,0% of meer, die minstens zo vaak werden gemeld bij patiënten die loperamidehydrochloride kregen als die bij placebo, worden weergegeven in de onderstaande tabel.
De bijwerkingen met een incidentie van 1,0% of meer, die vaker werden gemeld bij patiënten op placebo dan op loperamidehydrochloride, waren: droge mond, winderigheid, buikkramp en koliek.
2) Bijwerkingen uit 20 placebogecontroleerde onderzoeken bij patiënten met chronische diarree
De bijwerkingen met een incidentie van 1,0% of meer, die minstens zo vaak werden gemeld bij patiënten die loperamidehydrochloride kregen als bij placebo, worden hieronder in de onderstaande tabel weergegeven.
De bijwerkingen met een incidentie van 1,0% of meer, die vaker werden gemeld bij patiënten op placebo dan op loperamidehydrochloride waren: misselijkheid, braken, hoofdpijn, meteorisme, buikpijn, buikkramp en koliek.
3) Bijwerkingen uit zesenzeventig gecontroleerde en ongecontroleerde onderzoeken bij patiënten met acute of chronische diarree
De bijwerkingen met een incidentie van 1,0% of meer bij patiënten uit alle onderzoeken staan in de onderstaande tabel.
Postmarketingervaring
De volgende bijwerkingen zijn gemeld:
Huid- en onderhuidaandoeningen
Huiduitslag, pruritus, urticaria, angio-oedeem en uiterst zeldzame gevallen van bulleuze eruptie, waaronder erythema multiforme, Stevens-Johnson-syndroom en toxische epidermale necrolyse, zijn gemeld bij gebruik van IMODIUM (loperamide hcl).
Immuunsysteemaandoeningen
Geïsoleerde gevallen van allergische reacties en in sommige gevallen ernstige overgevoeligheidsreacties waaronder anafylactische shock en anafylactoïde reacties zijn gemeld bij het gebruik van IMODIUM (loperamide hcl).

Maagdarmstelselaandoeningen
Droge mond, buikpijn, uitzetting of ongemak, misselijkheid, braken, flatulentie, dyspepsie, constipatie, paralytische ileus, megacolon, inclusief toxisch megacolon (zie CONTRA-INDICATIES en WAARSCHUWINGEN ).
Nier- en urinewegaandoeningen
Urineretentie
Zenuwstelselaandoeningen
Slaperigheid, duizeligheid
Algemene aandoeningen en toedieningsplaatsstoornissen
Vermoeidheid
Een aantal van de bijwerkingen die tijdens klinische onderzoeken en postmarketingervaring met loperamide zijn gemeld, zijn frequente symptomen van het onderliggende diarreesyndroom (buikpijn/ongemak, misselijkheid, braken, droge mond, vermoeidheid, slaperigheid, duizeligheid, constipatie en winderigheid) . Deze symptomen zijn vaak moeilijk te onderscheiden van bijwerkingen van geneesmiddelen.
Drugsmisbruik en afhankelijkheid
Misbruik
Een specifiek klinisch onderzoek dat was opgezet om het misbruikpotentieel van loperamide bij hoge doses te beoordelen, resulteerde in een bevinding van een extreem laag misbruikpotentieel.
Afhankelijkheid
Studies bij van morfine afhankelijke apen hebben aangetoond dat loperamidehydrochloride in doses die hoger zijn dan aanbevolen voor mensen, tekenen van morfineontwenning voorkwam. Bij mensen was de naloxon-uitdagingspupiltest, die, wanneer positief, wijst op opiaatachtige effecten, uitgevoerd na een enkele hoge dosis of na meer dan twee jaar therapeutisch gebruik van IMODIUM® (loperamidehydrochloride), echter negatief. Oraal toegediend IMODIUM® (loperamide hcl) (loperamide geformuleerd met magnesiumstearaat) is zowel zeer onoplosbaar als dringt slecht door in het CZS.
DRUG-INTERACTIES
Niet-klinische gegevens hebben aangetoond dat loperamide een P-glycoproteïnesubstraat is. Gelijktijdige toediening van loperamide (16 mg enkelvoudige dosis) met een enkelvoudige dosis van 600 mg van ofwel kinidine, ofwel ritonavir, die beide P-glycoproteïneremmers zijn, resulteerde in een 2- tot 3-voudige verhoging van de loperamideplasmaspiegels. Vanwege het potentieel voor versterkte centrale effecten wanneer loperamide gelijktijdig wordt toegediend met kinidine en met ritonavir, is voorzichtigheid geboden wanneer loperamide wordt toegediend in de aanbevolen doseringen (2 mg, tot 16 mg maximale dagelijkse dosis) met P-glycoproteïneremmers.
Wanneer een enkelvoudige dosis loperamide van 16 mg gelijktijdig wordt toegediend met een enkelvoudige dosis saquinavir van 600 mg, verminderde loperamide de blootstelling aan saquinavir met 54%, wat klinisch relevant kan zijn vanwege de vermindering van de therapeutische werkzaamheid van saquinavir. Het effect van saquinavir op loperamide is van minder klinische betekenis. Daarom moet, wanneer loperamide samen met saquinavir wordt gegeven, de therapeutische werkzaamheid van saquinavir nauwlettend worden gecontroleerd.
WAARSCHUWINGEN
Vocht- en elektrolytdepletie komt vaak voor bij patiënten met diarree. In dergelijke gevallen is het toedienen van de juiste vloeistof en elektrolyten erg belangrijk. Het gebruik van IMODIUM® (loperamide hcl) sluit de noodzaak van geschikte vloeistof- en elektrolytentherapie niet uit.
Over het algemeen mag IMODIUM (loperamide hcl) niet worden gebruikt wanneer remming van de peristaltiek moet worden vermeden vanwege het mogelijke risico op significante gevolgen, waaronder ileus, megacolon en toxisch megacolon. IMODIUM (loperamide hcl) moet onmiddellijk worden stopgezet wanneer constipatie, opgezette buik of ileus zich ontwikkelt.
Behandeling van diarree met IMODIUM (loperamide hcl) is alleen symptomatisch. Telkens wanneer een onderliggende etiologie kan worden vastgesteld, moet een specifieke behandeling worden gegeven indien van toepassing (of indien geïndiceerd).
Bij patiënten met AIDS die worden behandeld met IMODIUM (loperamide hcl) voor diarree, moet de therapie worden stopgezet bij de eerste tekenen van opgezette buik. Er zijn geïsoleerde meldingen geweest van toxisch megacolon bij AIDS-patiënten met infectieuze colitis van zowel virale als bacteriële pathogenen die werden behandeld met loperamidehydrochloride. {ref EDMS-PSDB-2564186, blz. 12}
IMODIUM® (loperamide hcl) moet met bijzondere voorzichtigheid worden gebruikt bij jonge kinderen vanwege de grotere variabiliteit van de respons in deze leeftijdsgroep. Uitdroging, vooral bij jongere kinderen, kan de variabiliteit van de respons op IMODIUM® (loperamide hcl) verder beïnvloeden.
PREVENTIEVE MAATREGELEN
Algemeen
Uiterst zeldzame allergische reacties, waaronder anafylaxie en anafylactische shock, zijn gemeld. Bij acute diarree, als klinische verbetering niet binnen 48 uur wordt waargenomen, moet de toediening van IMODIUM® (loperamidehydrochloride) worden stopgezet en moeten patiënten worden geadviseerd hun arts te raadplegen. Hoewel er geen farmacokinetische gegevens beschikbaar zijn bij patiënten met leverinsufficiëntie, moet IMODIUM (loperamide hcl) bij dergelijke patiënten met voorzichtigheid worden gebruikt vanwege het verminderde first-pass-metabolisme. Patiënten met een leverfunctiestoornis moeten nauwlettend worden gecontroleerd op tekenen van CZS-toxiciteit. Er zijn geen farmacokinetische gegevens beschikbaar bij patiënten met een nierfunctiestoornis. Aangezien is gemeld dat het grootste deel van het geneesmiddel wordt gemetaboliseerd en de metabolieten of het onveranderde geneesmiddel voornamelijk in de feces worden uitgescheiden, zijn dosisaanpassingen bij patiënten met nierinsufficiëntie niet vereist. Er zijn geen formele onderzoeken uitgevoerd om de farmacokinetiek van loperamide bij oudere proefpersonen te evalueren. In twee onderzoeken waarbij oudere patiënten werden opgenomen, waren er echter geen grote verschillen in de dispositie van het geneesmiddel bij oudere patiënten met diarree in vergelijking met jonge patiënten.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 18 maanden durend onderzoek bij ratten met orale doses tot 40 mg/kg/dag (21 maal de maximale humane dosis van 16 mg/dag, gebaseerd op een vergelijking van het lichaamsoppervlak), was er geen bewijs van carcinogenese.
Loperamide was niet genotoxisch in de Ames-test, de SOS-chromotest in E. coli, de dominante letale test bij vrouwelijke muizen of de bepaling van de transformatie van muizenembryocellen.
Vruchtbaarheid en reproductieprestaties werden geëvalueerd bij ratten met orale doses van 2,5, 10 en 40 mg/kg/dag in één onderzoek, en 1, 5, 10, 20 en 40 mg/kg/dag (alleen vrouwtjes) in een tweede onderzoek. studie. Orale toediening van 20 mg/kg/dag (ongeveer 11 maal de dosis voor de mens op basis van een vergelijking van het lichaamsoppervlak) en hoger veroorzaakte een sterke aantasting van de vrouwelijke vruchtbaarheid. Behandeling van vrouwelijke ratten met maximaal 10 mg/kg/dag po (ongeveer 5 keer de dosis voor mensen op basis van een vergelijking van het lichaamsoppervlak) had geen effect op de vruchtbaarheid. Behandeling van mannelijke ratten met 40 mg/kg/dag po (ongeveer 21 keer de dosis voor mensen op basis van een vergelijking van het lichaamsoppervlak) veroorzaakte een verslechtering van de mannelijke vruchtbaarheid, terwijl toediening van maximaal 10 mg/kg/dag (ongeveer 5 keer de menselijke dosis gebaseerd op een vergelijking van het lichaamsoppervlak) had geen effect.
Zwangerschap
Teratogene effecten Zwangerschap Categorie C
Er zijn teratologische onderzoeken uitgevoerd bij ratten met orale doses van 2,5, 10 en 40 mg/kg/dag, en bij konijnen met orale doses van 5, 20 en 40 mg/kg/dag. Deze onderzoeken hebben geen aanwijzingen opgeleverd voor verminderde vruchtbaarheid of schade aan de foetus bij doses tot 10 mg/kg/dag bij ratten (5 maal de dosis voor mensen op basis van vergelijking van het lichaamsoppervlak) en 40 mg/kg/dag bij konijnen (43 maal de dosis voor de mens op basis van vergelijking van het lichaamsoppervlak). Behandeling van ratten met 40 mg/kg/dag po (21 maal de dosis voor de mens op basis van een vergelijking van het lichaamsoppervlak) veroorzaakte een duidelijke vermindering van de vruchtbaarheid. De onderzoeken leverden geen bewijs van teratogene activiteit op. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Loperamide mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Niet-teratogene effecten
In een peri- en postnatale reproductiestudie bij ratten veroorzaakte orale toediening van 40 mg/kg/dag een verslechtering van de groei en overleving van de nakomelingen.
Moeders die borstvoeding geven
In de moedermelk kunnen kleine hoeveelheden loperamide voorkomen. Daarom wordt IMODIUM (loperamide hcl) niet aanbevolen tijdens het geven van borstvoeding.
Pediatrisch gebruik
Zie de " WAARSCHUWINGEN " Sectie voor informatie over de grotere variabiliteit van de respons in deze leeftijdsgroep.
In geval van accidentele overdosering van IMODIUM® door kinderen, zie " OVERDOSERING " Sectie voor voorgestelde behandeling.
OVERDOSERING
In gevallen van overdosering (inclusief relatieve overdosering als gevolg van leverdisfunctie), kunnen urineretentie, paralytische ileus en depressie van het CZS optreden. Kinderen kunnen gevoeliger zijn voor CZS-effecten dan volwassenen. Klinische onderzoeken hebben aangetoond dat een suspensie van geactiveerde kool die onmiddellijk na inname van loperamidehydrochloride wordt toegediend, de hoeveelheid geneesmiddel die in de systemische circulatie wordt geabsorbeerd, met een factor negen kan verminderen. Als braken spontaan optreedt na inname, moet een suspensie van 100 g actieve kool oraal worden toegediend zodra vocht kan worden vastgehouden.
Als er geen braken heeft plaatsgevonden, moet een maagspoeling worden uitgevoerd, gevolgd door toediening van 100 g actieve koolsuspensie via de maagsonde. In geval van overdosering moeten patiënten gedurende ten minste 24 uur worden gecontroleerd op tekenen van CZS-depressie.
Als symptomen van overdosering optreden, kan naloxon als tegengif worden gegeven. Als de patiënt reageert op naloxon, moeten de vitale functies gedurende ten minste 24 uur na de laatste dosis naloxon zorgvuldig worden gecontroleerd op terugkeer van symptomen van een overdosis.
Gezien de langdurige werking van loperamide en de korte duur (één tot drie uur) van naloxon, moet de patiënt nauwlettend worden gecontroleerd en herhaaldelijk worden behandeld met naloxon zoals aangegeven. Aangezien relatief weinig geneesmiddel in de urine wordt uitgescheiden, wordt niet verwacht dat geforceerde diurese effectief is bij overdosering met IMODIUM® (loperamidehydrochloride).
In klinische onderzoeken werd een volwassene die binnen een periode van 24 uur drie doses van 20 mg innam, misselijk na de tweede dosis en braakte na de derde dosis. In onderzoeken die waren opgezet om de kans op bijwerkingen te onderzoeken, resulteerde de opzettelijke inname van maximaal 60 mg loperamidehydrochloride in een enkele dosis bij gezonde proefpersonen niet in significante bijwerkingen.
CONTRA-INDICATIES
IMODIUM (loperamide hcl) is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor loperamidehydrochloride of voor een van de hulpstoffen.
IMODIUM (loperamide hcl) is gecontra-indiceerd bij patiënten met buikpijn in afwezigheid van diarree.
IMODIUM (loperamide hcl) wordt niet aanbevolen bij zuigelingen jonger dan 24 maanden.
IMODIUM (loperamide hcl) mag niet als primaire therapie worden gebruikt:
- bij patiënten met acute dysenterie, die wordt gekenmerkt door bloed in de ontlasting en hoge koorts,
- bij patiënten met acute colitis ulcerosa,
bij patiënten met bacteriële enterocolitis veroorzaakt door invasieve organismen, waaronder Salmonella, Shigella en Campylobacter,
- bij patiënten met pseudomembraneuze colitis geassocieerd met het gebruik van breedspectrumantibiotica.
KLINISCHE FARMACOLOGIE
In vitro en dierstudies tonen aan dat IMODIUM® (loperamidehydrochloride) werkt door de darmmotiliteit te vertragen en door de beweging van water en elektrolyten door de darm te beïnvloeden. Loperamide bindt aan de opiaatreceptor in de darmwand. Bijgevolg remt het de afgifte van acetylcholine en prostaglandinen, waardoor de peristaltiek wordt verminderd en de darmtransittijd wordt verlengd. Loperamide verhoogt de tonus van de anale sluitspier, waardoor incontinentie en urgentie worden verminderd.
Bij de mens verlengt IMODIUM® (loperamide hcl) de transittijd van de darminhoud. Het vermindert het dagelijkse fecale volume, verhoogt de viscositeit en bulkdichtheid en vermindert het verlies van vocht en elektrolyten. Er is geen tolerantie voor het antidiarree-effect waargenomen. Klinische studies hebben aangetoond dat de schijnbare eliminatiehalfwaardetijd van loperamide bij de mens 10,8 uur is met een spreiding van 9,1-14,4 uur. Plasmaspiegels van onveranderd geneesmiddel blijven onder 2 nanogram per ml na inname van een capsule van 2 mg IMODIUM® (loperamide hcl). De plasmaspiegels zijn het hoogst ongeveer vijf uur na toediening van de capsule en 2,5 uur na de vloeistof. De piekplasmaspiegels van loperamide waren vergelijkbaar voor beide formuleringen. Eliminatie van loperamide vindt voornamelijk plaats door oxidatieve N-demethylering. Van cytochroom P450 (CYP450)-isozymen, CYP2C8 en CYP3A4, wordt gedacht dat ze een belangrijke rol spelen in het N-demethyleringsproces van loperamide, aangezien quercetine (CYP2C8-remmer) en ketoconazol (CYP3A4-remmer) het N-demethyleringsproces in vitro significant remden met 40% en 90 %, respectievelijk. Bovendien lijken CYP2B6 en CYP2D6 een ondergeschikte rol te spelen bij de N-demethylering van loperamide. Uitscheiding van het onveranderde loperamide en zijn metabolieten vindt voornamelijk plaats via de feces. Bij die patiënten bij wie biochemische en hematologische parameters werden gecontroleerd tijdens klinische onderzoeken, werden geen trends in de richting van afwijkingen tijdens IMODIUM® (loperamide hcl) -therapie opgemerkt. Evenzo lieten urineanalyses, ECG's en klinische oftalmologische onderzoeken geen trends in de richting van afwijkingen zien.
PATIËNT INFORMATIE
Patiënten moeten het advies krijgen hun arts te raadplegen als hun diarree niet binnen 48 uur verbetert of als ze bloed in hun ontlasting opmerken, koorts krijgen of een opgezette buik krijgen.
Vermoeidheid, duizeligheid of slaperigheid kunnen optreden bij diarreesyndromen die worden behandeld met IMODIUM (loperamide hcl). Daarom is het raadzaam om voorzichtig te zijn bij het besturen van een auto of het bedienen van machines. (zien ONGEWENSTE REACTIES ).
