Nimotop 30mg Nimodipine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Nimotop 30 mg en hoe wordt het gebruikt?
Nimotop is een receptgeneesmiddel dat wordt gebruikt om de symptomen van aneurysma (subarachnoïdale bloeding) te behandelen. Nimotop kan alleen of in combinatie met andere medicijnen worden gebruikt.
Nimotop behoort tot een klasse geneesmiddelen die calciumkanaalblokkers worden genoemd; Neurologica, andere; Calciumkanaalblokkers, dihydrophyridine.
Het is niet bekend of Nimotop 30 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Nimotop?
Nimotop kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- duizeligheid,
- snelle of langzame hartslag, en
- zwelling of uw enkels of voeten
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Nimotop zijn:
- lage bloeddruk (licht gevoel in het hoofd),
- misselijkheid,
- maagklachten,
- trage hartslagen, en
- spierpijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Nimotop. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
DOE NIMOTOP (nimodipine) NIET INTRAVENEUS OF VIA ANDERE OUDERLIJKE ROUTES. OVERLIJDEN EN ERNSTIGE, LEVENSBEDREIGENDE ONGEWENSTE GEBEURTENISSEN ZIJN VOORGEKOMEN WANNEER DE INHOUD VAN NIMOTOP (nimodipine) CAPSULES PARENTERAAL WERD GENJECTEERD (zie WAARSCHUWINGEN en DOSERING EN TOEDIENING).
OMSCHRIJVING
Nimotop® (nimodipine) behoort tot de klasse van farmacologische middelen die bekend staat als calciumkanaalblokkers. Nimodipine is isopropyl-2-methoxyethyl-1,4-dihydro-2,6-dimethyl-4-(m-nitrofenyl)-3,5-pyridinedicarboxylaat. Het heeft een molecuulgewicht van 418,5 en een molecuulformule van C21H26N2O7. De structuurformule is:
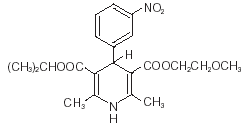
Nimodipine is een gele kristallijne stof, praktisch onoplosbaar in water.
NIMOTOP® (nimodipine) capsules zijn geformuleerd als zachte gelatinecapsules voor orale toediening. Elke met vloeistof gevulde capsule bevat 30 mg nimodipine in een drager van glycerine, pepermuntolie, gezuiverd water en polyethyleenglycol 400. Het omhulsel van de zachte gelatinecapsule bevat gelatine, glycerine, gezuiverd water en titaniumdioxide.
INDICATIES
Nimotop® (nimodipine) is geïndiceerd voor de verbetering van de neurologische uitkomst door het verminderen van de incidentie en ernst van ischemische afwijkingen bij patiënten met subarachnoïdale bloeding door gescheurde intracraniële bessenaneurysma's, ongeacht hun neurologische toestand na ictus (dwz Hunt en Hess graad IV).
DOSERING EN ADMINISTRATIE
TOEDIEN NIMOTOP (nimodipine) CAPSULES NIET INTRAVENEUS OF VOLGENS ANDERE PARENTERALE ROUTES (zie WAARSCHUWINGEN). Als Nimotop (nimodipine) per ongeluk intraveneus wordt toegediend, kan klinisch significante hypotensie cardiovasculaire ondersteuning met pressormiddelen vereisen. Specifieke behandelingen voor overdosering van calciumantagonisten moeten ook onmiddellijk worden gegeven.
Nimotop (nimodipine) wordt oraal toegediend in de vorm van ivoorkleurige, zachte gelatinecapsules van 30 mg voor subarachnoïdale bloeding.
De orale dosis is 60 mg (twee capsules van 30 mg) elke 4 uur gedurende 21 opeenvolgende dagen, bij voorkeur niet minder dan één uur vóór of twee uur na de maaltijd. Orale Nimotop® (nimodipine) -therapie moet binnen 96 uur na de subarachnoïdale bloeding beginnen.
Als de capsule niet kan worden ingeslikt, bijv. tijdens een operatie, of als de patiënt bewusteloos is, moet een gaatje in beide uiteinden van de capsule worden gemaakt met een 18 gauge naald en moet de inhoud van de capsule in een spuit worden geëxtraheerd. Een parenterale spuit kan worden gebruikt om de vloeistof in de capsule te extraheren, maar de vloeistof moet altijd worden overgebracht naar een spuit die geen naald kan opnemen en die is ontworpen voor orale toediening of via een neus-maagsonde of PEG. Om toedieningsfouten tot een minimum te beperken, wordt aanbevolen om op de injectiespuit die voor toediening wordt gebruikt, het etiket "Niet voor IV-gebruik" te vermelden. De inhoud moet dan in de situnaso-maagsonde van de patiënt worden geleegd en door de sonde worden weggespoeld met 30 ml normale zoutoplossing (0,9%). De werkzaamheid en veiligheid van deze wijze van toediening is niet aangetoond in klinische onderzoeken.
Patiënten met levercirrose hebben een aanzienlijk verminderde klaring en een ongeveer verdubbelde Cmax. De dosering moet worden verlaagd tot 30 mg om de 4 uur, met nauwlettende controle van de bloeddruk en de hartslag.
HOE GELEVERD
Elke ivoorkleurige, zachte gelatine NIMOTOP® (nimodipine) capsule is bedrukt met het woord Nimotop 30 mg en bevat 30 mg nimodipine. De capsules van 30 mg zijn verpakt in foliezakjes voor eenheidsdoses en worden geleverd in dozen met 100 capsules. Het product is ook verkrijgbaar in kindveilige veiligheidsverpakkingen voor eenheidsdoses met 30 capsules per doos. De capsules moeten worden bewaard in de originele folieverpakking van de fabrikant bij 25 ° C (77 ° F), excursies toegestaan tot 15-30 ° C (59-86 ° F) [Zie USP-gecontroleerde kamertemperatuur.]
Capsules moeten worden beschermd tegen licht en bevriezing.
Gedistribueerd door: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Gefabriceerd door: Catalent Pharma Solutions St. Petersburg, FL 33716. FDA-revisiedatum: 20-1-2006
BIJWERKINGEN
Bijwerkingen werden gemeld door 92 van de 823 patiënten met subarachnoïdale bloeding (11,2%) die nimodipine kregen. De meest gemelde bijwerking was een verlaagde bloeddruk bij 4,4% van deze patiënten. Negenentwintig van de 479 (6,1%) met placebo behandelde patiënten rapporteerden ook bijwerkingen. De gemelde voorvallen met een frequentie van meer dan 1% worden hieronder weergegeven per dosis.
DOSIS elke 4 uur Aantal patiënten (%) Nimodipine
Er werden geen andere bijwerkingen gemeld door de patiënten die 0,35 mg/kg om de 4 uur, 30 mg om de 4 uur of 120 mg om de 4 uur kregen. Bijwerkingen met een incidentie van minder dan 1% in de 60 mg q4h-dosisgroep waren: hepatitis; jeuk; gastro-intestinale bloeding; trombocytopenie; Bloedarmoede; hartkloppingen; braken; blozen; diaforese; piepende ademhaling fenytoïne-toxiciteit; duizeligheid; duizeligheid; rebound vasospasme; geelzucht; hypertensie; hematoom.
Bijwerkingen met een incidentie van minder dan 1% in de 90 mg om de 4 uur dosisgroep waren: jeuk, gastro-intestinale bloeding; trombocytopenie; neurologische achteruitgang; braken; diaforese; congestief hartfalen; hyponatriëmie; afnemend aantal bloedplaatjes; diffuse intravasale stolling; diepe veneuze trombose.
Zoals uit de tabel blijkt, omvatten bijwerkingen die verband lijken te houden met het gebruik van nimodipine op basis van een verhoogde incidentie bij een hogere dosis of een hoger percentage in vergelijking met placebocontrole, waaronder verlaagde bloeddruk, oedeem en hoofdpijn, bekende farmacologische werkingen van calciumkanaalblokkers. Er moet echter worden opgemerkt dat SAB vaak gepaard gaat met veranderingen in het bewustzijn die leiden tot een onderrapportage van bijwerkingen. Patiënten die nimodipine kregen in klinische onderzoeken voor andere indicaties, meldden flushing (2,1%), hoofdpijn (4,1%) en vochtretentie (0,3%), typische reacties op calciumkanaalblokkers. Als calciumantagonist kan nimodipine het potentieel hebben om hartfalen te verergeren bij gevoelige patiënten of om de AV-geleiding te verstoren, maar deze voorvallen werden niet waargenomen.
Er zijn geen klinisch significante effecten op hematologische factoren, nier- of leverfunctie of koolhydraatmetabolisme in verband gebracht met oraal nimodipine. Geïsoleerde gevallen van niet-nuchtere verhoogde serumglucosespiegels (0,8%), verhoogde LDH-spiegels (0,4%), verlaagd aantal bloedplaatjes (0,3%), verhoogde alkalische fosfatasespiegels (0,2%) en verhoogde SGPT-spiegels (0,2%) zijn gemeld zelden.

Drugsmisbruik en afhankelijkheid
Er zijn geen gevallen gemeld van drugsmisbruik of afhankelijkheid van Nimotop® (nimodipine).
DRUG-INTERACTIES
Het is mogelijk dat de cardiovasculaire werking van andere calciumkanaalblokkers kan worden versterkt door toevoeging van Nimotop® (nimodipine).
In Europa werd waargenomen dat Nimotop® (nimodipine) af en toe het effect versterkt van antihypertensiva die gelijktijdig worden ingenomen door patiënten die lijden aan hypertensie; dit fenomeen werd niet waargenomen in Noord-Amerikaanse klinische onderzoeken.
Een onderzoek bij acht gezonde vrijwilligers heeft een stijging van 50% aangetoond in de gemiddelde piekplasmaconcentraties van nimodipine en een stijging van 90% in de gemiddelde oppervlakte onder de curve, na een kuur van een week met cimetidine van 1000 mg/dag en nimodipine van 90 mg/dag . Dit effect kan worden gemedieerd door de bekende remming van hepatisch cytochroom P-450 door cimetidine, wat het first-pass-metabolisme van nimodipine zou kunnen verminderen.
WAARSCHUWINGEN
OVERLIJDEN DOOR ONGEWENSTE INTRAVENEUZE TOEDIENING: DOE NIMOTOP (nimodipine) NIET INTRAVENEUS OF VIA ANDERE OUDERLIJKE ROUTES. OVERLIJDEN EN ERNSTIGE, LEVENSBEDREIGENDE ONGEWENSTE GEBEURTENISSEN, WAARONDER HARTSLUITING, CARDIOVASCULAIRE INVAL, HYPOTENSIE EN BRADYCARDIA, ZIJN VOORGEKOMEN WANNEER DE INHOUD VAN NIMOTOP-CAPSULES (nimodipine) CAPSULES HEBBEN GENJECTEERD EN DOOR PAROS GENJECTEERDE DAGEN.
PREVENTIEVE MAATREGELEN
Algemeen: Bloeddruk: Nimodipine heeft de hemodynamische effecten die verwacht worden van een calciumantagonist, hoewel deze over het algemeen niet uitgesproken zijn. Intraveneuze toediening van de inhoud van Nimotop (nimodipine) capsules heeft echter geleid tot ernstige bijwerkingen, waaronder overlijden, hartstilstand, cardiovasculaire collaps, hypotensie en bradycardie. Bij patiënten met subarachnoïdale bloeding die Nimotop® (nimodipine) kregen in klinische onderzoeken, werd gemeld dat ongeveer 5% de bloeddruk had verlaagd en ongeveer 1% verliet het onderzoek hierdoor (niet alle konden worden toegeschreven aan nimodipine). Niettemin moet de bloeddruk tijdens de behandeling met Nimotop® (nimodipine) zorgvuldig worden gecontroleerd op basis van de bekende farmacologie en de bekende effecten van calciumkanaalblokkers. (zien WAARSCHUWINGEN en DOSERING EN ADMINISTRATIE )
Leverziekte: Het metabolisme van Nimotop® (nimodipine) is verminderd bij patiënten met een verminderde leverfunctie. Bij dergelijke patiënten moet hun bloeddruk en hartslag nauwlettend worden gecontroleerd en moeten ze een lagere dosis krijgen (zie: DOSERING EN ADMINISTRATIE ).
Intestinale pseudo-obstructie en ileus zijn zelden gemeld bij patiënten die met nimodipine werden behandeld. Een causaal verband is niet vastgesteld. De aandoening heeft gereageerd op conservatief management.
Laboratoriumtestinteracties: Geen bekend.
Carcinogenese, mutagenese, verminderde vruchtbaarheid: In een twee jaar durend onderzoek werden hogere incidenties van adenocarcinoom van de baarmoeder en Leydig-celadenoom van de testikels waargenomen bij ratten die een dieet kregen dat 1800 ppm nimodipine bevatte (overeenkomend met 91 tot 121 mg/kg/dag nimodipine) dan bij placebo-controles . De verschillen waren echter niet statistisch significant en de hogere percentages lagen ruim binnen het historische controlebereik voor deze tumoren in de Wistar-stam.
Nimodipine bleek niet kankerverwekkend te zijn in een 91 weken durende muisstudie, maar de hoge dosis van 1800 ppm nimodipine in het voer (546 tot 774 mg/kg/dag) verkortte de levensverwachting van de dieren. Mutageniteitsonderzoeken, waaronder de Ames-, micronucleus- en dominant letale tests waren negatief. Nimodipine had geen nadelige invloed op de vruchtbaarheid en algemene reproductieprestaties van mannelijke en vrouwelijke Wistar-ratten na orale doses tot 30 mg/kg/dag bij dagelijkse toediening gedurende meer dan 10 weken bij de mannetjes en 3 weken bij de vrouwtjes voorafgaand aan de paring en voortgezet tot dag 7 van de zwangerschap. Deze dosis bij een rat is ongeveer 4 keer de equivalente klinische dosis van 60 mg om de 4 uur bij een patiënt van 50 kg.
Zwangerschap: Zwangerschap Categorie C. Van nimodipine is aangetoond dat het een teratogeen effect heeft bij Himalaya-konijnen. De incidentie van misvormingen en onvolgroeide foetussen was verhoogd bij orale doses van 1 en 10 mg/kg/dag toegediend (via sondevoeding) van dag 6 tot dag 18 van de zwangerschap, maar niet bij 3,0 mg/kg/dag in een van de twee identieke onderzoeken met konijnen. In de tweede studie werd een verhoogde incidentie van onvolgroeide foetussen gezien bij 1,0 mg/kg/dag, maar niet bij hogere doses. Nimodipine was embryotoxisch en veroorzaakte resorptie en groeiachterstand van foetussen bij Long Evans-ratten bij 100 mg/kg/dag toegediend via een sonde van dag 6 tot dag 15 van de zwangerschap. In twee andere onderzoeken bij ratten werden doses van 30 mg/kg/dag nimodipine, toegediend via sondevoeding vanaf dag 16 van de dracht en voortgezet tot opoffering (dag 20 van de zwangerschap of dag 21 postpartum) geassocieerd met hogere incidenties van skeletvariatie, onvolgroeide foetussen en doodgeboorten maar geen misvormingen. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen om het effect op menselijke foetussen direct te beoordelen. Nimodipine mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Moeders die borstvoeding geven: Het is aangetoond dat nimodipine en/of zijn metabolieten in rattenmelk voorkomen in concentraties die veel hoger zijn dan in maternaal plasma. Het is niet bekend of het geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel medicijnen worden uitgescheiden in de moedermelk, wordt moeders die borstvoeding geven geadviseerd hun baby's geen borstvoeding te geven als ze het medicijn gebruiken.
Pediatrisch gebruik: De veiligheid en werkzaamheid bij kinderen zijn niet vastgesteld.
Geriatrisch gebruik: Klinische onderzoeken met nimodipine omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet dosering bij oudere patiënten voorzichtig zijn, gezien de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
OVERDOSERING
Er zijn geen meldingen geweest van overdosering door orale toediening van Nimotop® (nimodipine). Symptomen van overdosering zijn naar verwachting gerelateerd aan cardiovasculaire effecten zoals overmatige perifere vasodilatatie met duidelijke systemische hypotensie. Klinisch significante hypotensie als gevolg van overdosering met Nimotop® (nimodipine) kan actieve cardiovasculaire ondersteuning met pressormiddelen vereisen. Specifieke behandelingen voor overdosering van calciumantagonisten moeten ook onmiddellijk worden gegeven. Aangezien Nimotop® (nimodipine) sterk eiwitgebonden is, zal dialyse waarschijnlijk niet van nut zijn.
CONTRA-INDICATIES
Geen bekend.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme: Nimodipine is een calciumkanaalblokker. De contractiele processen van gladde spiercellen zijn afhankelijk van calciumionen, die deze cellen binnenkomen tijdens depolarisatie als langzame ionische transmembraanstromen. Nimodipine remt de overdracht van calciumionen naar deze cellen en remt zo de contracties van vasculaire gladde spieren. In dierproeven had nimodipine een groter effect op de hersenslagaders dan op de slagaders elders in het lichaam, misschien omdat het zeer lipofiel is, waardoor het de bloed-hersenbarrière kan passeren; concentraties van nimodipine tot wel 12,5 ng/ml zijn gedetecteerd in de cerebrospinale vloeistof van met nimodipine behandelde subarachnoïdale bloeding (SAH)-patiënten. Het precieze werkingsmechanisme van nimodipine bij de mens is niet bekend. Hoewel de hieronder beschreven klinische onderzoeken een gunstig effect aantonen van nimodipine op de ernst van neurologische afwijkingen veroorzaakt door cerebrale vasospasme na SAH, is er geen arteriografisch bewijs dat het geneesmiddel de spasmen van deze slagaders voorkomt of verlicht. Het is echter niet bekend of de gebruikte arteriografische methodologie voldoende was om een eventueel klinisch relevant effect op vasospasme te detecteren.
Farmacokinetiek en metabolisme: Bij de mens wordt nimodipine snel geabsorbeerd na orale toediening en piekconcentraties worden over het algemeen binnen een uur bereikt. De terminale eliminatiehalfwaardetijd is ongeveer 8 tot 9 uur, maar eerdere eliminatiesnelheden zijn veel sneller, wat overeenkomt met een halfwaardetijd van 1-2 uur; een gevolg is de noodzaak van frequente (elke 4 uur) dosering. Er waren geen tekenen van accumulatie wanneer nimodipine gedurende zeven dagen driemaal daags werd gegeven. Nimodipine is voor meer dan 95% gebonden aan plasma-eiwitten. De binding was onafhankelijk van de concentratie over het bereik van 10 ng/ml tot 10 µg/ml. Nimodipine wordt bijna uitsluitend uitgescheiden in de vorm van metabolieten en minder dan 1% wordt als onveranderd geneesmiddel in de urine teruggevonden. Er zijn talrijke metabolieten geïdentificeerd, die allemaal inactief of aanzienlijk minder actief zijn dan de moederverbinding. Vanwege een hoog first-pass metabolisme is de biologische beschikbaarheid van nimodipine gemiddeld 13% na orale toediening. De biologische beschikbaarheid is significant verhoogd bij patiënten met levercirrose, met een Cmax die ongeveer het dubbele is van die bij normale patiënten, wat een verlaging van de dosis bij deze groep patiënten noodzakelijk maakt (zie DOSERING EN ADMINISTRATIE ). In een onderzoek onder 24 gezonde mannelijke vrijwilligers resulteerde toediening van nimodipinecapsules na een standaardontbijt in een 68% lagere piekplasmaconcentratie en 38% lagere biologische beschikbaarheid in vergelijking met dosering in nuchtere toestand.
In een onderzoek met een enkele parallelle groep met 24 oudere proefpersonen (59-79 jaar) en 24 jongere proefpersonen (22-40 jaar) was de waargenomen AUC en Cmax van nimodipine ongeveer 2 maal hoger bij de oudere populatie in vergelijking met de jongere studie proefpersonen na orale toediening (gegeven als een enkele dosis van 30 mg en gedoseerd tot steady-state met 30 mg driemaal daags gedurende 6 dagen). De klinische respons op deze leeftijdsgebonden farmacokinetische verschillen werd echter niet als significant beschouwd. (Zien PREVENTIEVE MAATREGELEN : Geriatrisch gebruik.)
Klinische proeven: In 4 gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken is aangetoond dat nimodipine de ernst van neurologische afwijkingen als gevolg van vasospasme vermindert bij patiënten die recent een subarachnoïdale bloeding (SAH) hebben gehad. De onderzoeken gebruikten doses variërend van 20-30 mg tot 90 mg om de 4 uur, waarbij het geneesmiddel gedurende 21 dagen werd gegeven in 3 onderzoeken en gedurende ten minste 18 dagen in de andere. Drie van de vier onderzoeken volgden patiënten gedurende 3-6 maanden. Drie van de onderzoeken bestudeerden relatief goed patiënten, met alle of de meeste patiënten in Hunt en Hess graad I - III (in wezen vrij van focale tekorten na de eerste bloeding), de vierde bestudeerde veel ziekere patiënten, Hunt en Hess graad III - V. Twee onderzoeken , een Amerikaanse, een Franse, waren vergelijkbaar in opzet, met relatief onaangetast SAH-patiënten gerandomiseerd naar nimodipine of placebo. In elk werd beoordeeld of een zich laat ontwikkelend tekort te wijten was aan spasmen of andere oorzaken, en de tekorten werden beoordeeld. Beide onderzoeken toonden significant minder ernstige tekorten als gevolg van spasmen in de nimodipine-groep; de tweede (Franse) studie toonde minder spasmen-gerelateerde tekorten van alle ernst. Er werd geen effect gezien op tekorten die niet gerelateerd waren aan spasmen.
Een derde, grote studie werd uitgevoerd in het Verenigd Koninkrijk bij SAH-patiënten met alle gradaties van ernst (maar 89% was in graad I-III). Nimodipine werd elke 4 uur gedoseerd 60 mg. Uitkomsten werden niet gedefinieerd als gerelateerd aan spasmen of niet, maar er was een significante afname van het totale aantal infarcten en ernstig invaliderende neurologische uitkomst na 3 maanden:
Een Canadese studie nam deel aan veel ziekere patiënten (Hunt en Hess graad III-V), die een hoog sterftecijfer en invaliditeit hadden, en die een dosis van 90 mg om de 4 uur gebruikten, maar verder vergelijkbaar was met de eerste twee onderzoeken. Analyse van vertraagde ischemische tekorten, waarvan vele het gevolg zijn van spasmen, toonde een significante vermindering van spasmengerelateerde tekorten. Onder geanalyseerde patiënten (72 nimodipine, 82 placebo) waren er de volgende uitkomsten.
Wanneer de gegevens voor de Canadese en de Britse studies werden gecombineerd, was het behandelingsverschil op succespercentage (dwz goed herstel) op de Glasgow Outcome Scale 25,3% (nimodipine) versus 10,9% (placebo) voor Hunt en Hess Grades IV of V. De onderstaande tabel laat zien dat nimodipine de neiging heeft om het goede herstel van SAH-patiënten met een slechte neurologische status na ictus te verbeteren, terwijl het aantal met ernstige invaliditeit en vegetatieve overleving afneemt.
Een dosisbereikonderzoek waarin doses van 30, 60 en 90 mg werden vergeleken, vond een over het algemeen laag aantal spasmen-gerelateerde neurologische gebreken, maar geen dosis-responsrelatie.
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN secties.
