Cordarone 100mg, 50mg Amiodarone Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Cordarone 100 mg en hoe wordt het gebruikt?
Cordarone 100 mg IV is een receptgeneesmiddel dat wordt gebruikt om de symptomen van een onregelmatig hartritme (ventriculaire aritmieën) te behandelen.
- Cordarone IV kan alleen of met andere medicijnen worden gebruikt.
- Cordarone 50 mg IV behoort tot een klasse geneesmiddelen die Antidysrhythmisc, III wordt genoemd.
Wat zijn de mogelijke bijwerkingen van Cordarone 100 mg?
Cordarone 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- kortademigheid,
- flauwvallen,
- snelle of onregelmatige hartslagen,
- pijn op de borst,
- piepende ademhaling, en
- moeite met ademhalen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Cordarone 100 mg IV zijn:
- lage bloeddruk (hypotensie),
- trage hartslag,
- hartstilstand,
- misselijkheid,
- koorts,
- congestief hartfalen,
- abnormaal hartritme,
- cardiogene shock, en
- afwijkingen in leverfunctietesten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Cordarone. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
PULMONALE, HEPATISCHE EN CARDIAC TOXICITEIT
CORDARONE 100 mg is alleen bedoeld voor gebruik bij patiënten met de aangegeven levensbedreigende aritmieën, omdat het gebruik gepaard gaat met aanzienlijke toxiciteit (zie INDICATIES EN GEBRUIK ).
CORDARONE kan pulmonale toxiciteit veroorzaken (overgevoeligheidspneumonitis of interstitiële/alveolaire pneumonitis) die heeft geleid tot klinisch manifeste ziekte met percentages van wel 17% bij sommige reeksen patiënten. Pulmonale toxiciteit is ongeveer 10% van de tijd fataal geweest. Verkrijg een baseline thoraxfoto en longfunctietests, inclusief diffusiecapaciteit, wanneer de behandeling met CORDARONE 100 mg wordt gestart. Herhaal de geschiedenis, lichamelijk onderzoek en thoraxfoto om de 3 tot 6 maanden (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
CORDARONE kan hepatoxiciteit veroorzaken, wat fataal kan zijn. Verkrijg baseline en periodieke levertransaminasen en stop of verlaag de dosis als de verhoging driemaal de normale waarde overschrijdt, of verdubbelt bij een patiënt met een verhoogde baseline. Stop met CORDARONE als de patiënt tekenen of symptomen van klinische leverbeschadiging ervaart (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
CORDARONE kan aritmieën verergeren. Start CORDARONE 50 mg in een klinische omgeving waar continue elektrocardiogrammen en hartreanimatie beschikbaar zijn (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
CORDARONE (amiodaron HCl) is een anti-aritmicum, beschikbaar voor orale toediening als roze tabletten met breukgleuf die 200 mg amiodaronhydrochloride bevatten. De aanwezige inactieve ingrediënten zijn colloïdaal siliciumdioxide, lactose, magnesiumstearaat, povidon, zetmeel en FD&C Red 40. CORDARONE is een benzofuraanderivaat: 2-butyl-3-benzofuranyl 4-[2-(diethylamino)-ethoxy]-3, 5-dijoodfenylketonhydrochloride.
De structuurformule is als volgt:
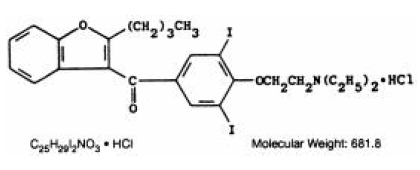
Amiodaron HCl is een wit tot crèmekleurig kristallijn poeder. Het is slecht oplosbaar in water, oplosbaar in alcohol en vrij oplosbaar in chloroform. Het bevat 37,3% jodium op gewichtsbasis.
INDICATIES
CORDARONE is geïndiceerd voor de behandeling van gedocumenteerde, levensbedreigende recidiverende ventriculaire fibrillatie en levensbedreigende recidiverende hemodynamisch instabiele tachycardie bij volwassenen die niet hebben gereageerd op adequate doses van andere beschikbare anti-aritmica of wanneer alternatieve middelen niet verdragen kunnen worden.
DOSERING EN ADMINISTRATIE
De dosering moet individueel worden bepaald op basis van de ernst van de aritmie en de respons. Gebruik de laagste effectieve dosis. Verkrijg baseline thoraxfoto's, longfunctietests, schildklierfunctietests en leveraminotransferasen. Corrigeer hypokaliëmie, hypomagnesiëmie en hypocalciëmie voordat de behandeling wordt gestart
Aanbevolen dosering
Start de behandeling met oplaaddoses van 800 tot 1600 mg/dag totdat de eerste therapeutische respons optreedt (meestal 1 tot 3 weken). Zodra adequate controle van de aritmie is bereikt, of als bijwerkingen prominent worden, verlaag dan de CORDARONE 50 mg-dosis tot 600 tot 800 mg/dag gedurende één maand en vervolgens tot de onderhoudsdosis, gewoonlijk 400 mg/dag.
Administratie
Dien CORDARONE consequent toe met betrekking tot maaltijden [zie: KLINISCHE FARMACOLOGIE ]. Toediening van CORDARONE in verdeelde doses bij de maaltijd wordt aanbevolen voor totale dagelijkse doses van 1000 mg of hoger, of wanneer gastro-intestinale intolerantie optreedt.
HOE GELEVERD
Doseringsvormen en sterke punten
200 mg tabletten: ronde, bolle, roze tabletten met een verhoogde “C” en gemarkeerd met “200” aan één kant, met een breukgleuf aan de andere kant en gemarkeerd met “WYETH” en “4188”.
Opslag en behandeling
CORDARONE® (amiodaron HCl) tabletten zijn als volgt verkrijgbaar in flacons van 60 tabletten:
200 mg , NDC 0008-4188-04, ronde, bolle, roze tabletten met een verhoogde "C" en gemarkeerd met "200" aan één kant, met een breukstreep aan de andere kant en gemarkeerd met "WYETH" en "4188".
Goed gesloten bewaren.
Bewaren bij gecontroleerde kamertemperatuur, 20° tot 25°C (68° tot 77°F).
Bescherm tegen licht.
Doseer in een lichtbestendige, strakke container.
Vervaardigd door Sanofi Winthrop Industrie, 1, rue de la Vierge, 33440 Ambares, Frankrijk. Gedistribueerd door: Wyeth Pharmaceuticals Inc., een dochteronderneming van Pfizer Inc., Philadelphia, PA 19101. Herzien: okt 2018
BIJWERKINGEN
De volgende ernstige bijwerkingen worden in meer detail beschreven in andere rubrieken van de voorschrijfinformatie:
- Longtoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leverletsel [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verergerde aritmie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Visuele stoornis en verlies van gezichtsvermogen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Schildklierafwijkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Bradycardie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Perifere neuropathie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Lichtgevoeligheid en huidverkleuring [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Bij de gebruikelijke onderhoudsdosering (400 mg/dag) en hoger, veroorzaakt CORDARONE 100 mg bijwerkingen bij ongeveer driekwart van alle patiënten, resulterend in stopzetting bij 7 tot 18%.
In onderzoeken onder bijna 5.000 patiënten die werden behandeld in open Amerikaanse onderzoeken en in gepubliceerde rapporten van behandeling met CORDARONE, waren de bijwerkingen die het vaakst het staken van CORDARONE vereisten pulmonale infiltraten of fibrose, paroxysmale ventriculaire tachycardie, congestief hartfalen en verhoging van leverenzymen. Andere symptomen die minder vaak het staken van de behandeling veroorzaakten, waren gezichtsstoornissen, lichtgevoeligheid, blauwe verkleuring van de huid, hyperthyreoïdie en hypothyreoïdie.
De volgende bijwerkingenpercentages zijn gebaseerd op een retrospectieve studie van 241 patiënten die werden behandeld gedurende 2 tot 1.515 dagen (gemiddeld 441,3 dagen):
Schildklier
Vaak: Hypothyreoïdie, hyperthyreoïdie.
Cardiovasculair
Vaak: Congestief hartfalen, hartritmestoornissen, SA-knoopdisfunctie.
gastro-intestinaal
Zeer vaak: Misselijkheid, braken.
Vaak: Constipatie, anorexia, buikpijn.
dermatologisch
Vaak: Zonnedermatitis/lichtgevoeligheid.
neurologisch
Vaak: Malaise en vermoeidheid, tremor/abnormale onwillekeurige bewegingen, gebrek aan coördinatie, abnormale gang/ataxie, duizeligheid, paresthesieën, verminderd libido, slapeloosheid, hoofdpijn, slaapstoornissen.
oogheelkunde
Vaak: Visuele stoornissen.
lever
Vaak: Abnormale leverfunctietesten, niet-specifieke leveraandoeningen.
Ademhaling
Vaak: Longontsteking of fibrose.
Ander
Vaak: blozen, abnormale smaak en geur, oedeem, abnormale speekselvloed, stollingsafwijkingen.
Soms: Blauwe verkleuring van de huid, huiduitslag, spontane ecchymose, alopecia, hypotensie en hartgeleidingsstoornissen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van CORDARONE na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
hematologisch hemolytische anemie, aplastische anemie, pancytopenie, neutropenie, trombocytopenie, agranulocytose, granuloom.
Immuun : anafylactische/anafylactoïde reactie (inclusief shock), angio-oedeem.
neurologisch : pseudotumor cerebri, parkinsonsymptomen zoals akinesie en bradykinesie (soms reversibel bij stopzetting van de therapie), demyeliniserende polyneuropathie.
Psychiatrisch : hallucinatie, verwardheid, desoriëntatie, delirium.
Cardiale : hypotensie (soms fataal), sinusarrest.
Ademhaling : eosinofiele pneumonie, acuut respiratoir distress syndroom in de postoperatieve setting, bronchospasme, bronchiolitis obliterans organiserende pneumonie, pulmonale alveolaire bloeding, pleurale effusie, pleuritis.
gastro-intestinaal : pancreatitis, acute pancreatitis.
lever : hepatitis, cholestatische hepatitis, cirrose.
Huid- en onderhuidaandoeningen urticaria, toxische epidermale necrolyse (soms fataal), erythema multiforme, Stevens-Johnson-syndroom, exfoliatieve dermatitis, bulleuze dermatitis, medicijnuitslag met eosinofilie en systemische symptomen (DRESS), eczeem, pruritus, huidkanker, lupusachtig syndroom.
Musculoskeletaal : myopathie, spierzwakte, rabdomyolyse.
nier : nierfunctiestoornis, nierinsufficiëntie, acuut nierfalen.
reproductief : epididymitis, impotentie.
Lichaam als geheel : koorts, droge mond.
Endocrien en metabool : schildklierknobbeltjes/schildklierkanker, syndroom van onvoldoende secretie van antidiuretisch hormoon (SIADH).
Vasculair : vasculitis.
DRUG-INTERACTIES
Vanwege de lange halfwaardetijd van amiodaron, kunt u verwachten dat geneesmiddelinteracties weken tot maanden aanhouden na stopzetting van amiodaron.
Geneesmiddelinteracties met amiodaron worden beschreven in tabel 1 hieronder.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Persistentie van bijwerkingen
Vanwege de lange halfwaardetijd van amiodaron (15 tot 142 dagen) en zijn actieve metaboliet desethylamiodaron (14 tot 75 dagen), kunnen bijwerkingen en geneesmiddelinteracties enkele weken aanhouden na stopzetting van amiodaron (zie KLINISCHE FARMACOLOGIE ].
Longtoxiciteit
CORDARONE kan een klinisch syndroom van hoesten en progressieve dyspneu veroorzaken, vergezeld van functionele, radiografische, galliumscan- en pathologische gegevens die consistent zijn met pulmonale toxiciteit. Pulmonale toxiciteit secundair aan CORDARONE kan het gevolg zijn van indirecte of directe toxiciteit, zoals weergegeven door respectievelijk overgevoeligheidspneumonitis (inclusief eosinofiele pneumonie) of interstitiële/alveolaire pneumonitis. Er is gemeld dat de pulmonale toxiciteit zo hoog is als 17% en in ongeveer 10% van de gevallen fataal is. Verkrijg een baseline thoraxfoto en longfunctietests, inclusief diffusiecapaciteit, wanneer de behandeling met CORDARONE 50 mg wordt gestart. Herhaal de geschiedenis, lichamelijk onderzoek en thoraxfoto om de 3 tot 6 maanden of als er symptomen optreden. Overweeg alternatieve anti-aritmische therapie als de patiënt tekenen of symptomen van pulmonale toxiciteit ervaart. Prednison 40 tot 60 mg/dag afbouwen over meerdere weken kan nuttig zijn bij de behandeling van longtoxiciteit.
Ademhalingsnoodsyndroom bij volwassenen (ARDS)
Postoperatief zijn gevallen van ARDS gemeld bij patiënten die CORDARONE-therapie kregen en die ofwel een hartoperatie ofwel een niet-cardiale operatie hebben ondergaan. Hoewel patiënten gewoonlijk goed reageren op krachtige ademhalingstherapie, was de afloop in zeldzame gevallen fataal.
Leverletsel
Asymptomatische verhogingen van leverenzymspiegels worden vaak gezien, maar CORDARONE 100 mg kan levensbedreigend leverletsel veroorzaken. Histologie lijkt op die van alcoholische hepatitis of cirrose. Verkrijg baseline en periodieke levertransaminasen. Als transaminasen meer dan driemaal normaal zijn, of verdubbelen bij een patiënt met een verhoogde basislijn, stop dan met of verlaag de dosis CORDARONE 100 mg, verkrijg vervolgonderzoeken en behandel dienovereenkomstig.
Verergerde aritmie
CORDARONE 100 mg kan de aanwezige aritmie bij ongeveer 2 tot 5% van de patiënten verergeren of nieuwe ventriculaire fibrillatie, onophoudelijke ventriculaire tachycardie, verhoogde weerstand tegen cardioversie en polymorfe ventriculaire tachycardie geassocieerd met QTc-verlenging (Torsade de Pointes [TdP]) veroorzaken.
Corrigeer hypokaliëmie, hypomagnesiëmie en hypocalciëmie voordat de behandeling met CORDARONE wordt gestart, aangezien deze aandoeningen de mate van QTc-verlenging kunnen vergroten en de kans op TdP kunnen vergroten. Besteed speciale aandacht aan het elektrolyten- en zuur-base-evenwicht bij patiënten die ernstige of langdurige diarree hebben of die geneesmiddelen krijgen die de elektrolytenspiegels beïnvloeden, zoals diuretica, laxeermiddelen, systemische corticosteroïden of amfotericine B.
Visuele stoornis en verlies van gezichtsvermogen
Optische neuropathie en optische neuritis
Gevallen van optische neuropathie en optische neuritis, gewoonlijk resulterend in een visuele beperking en soms permanente blindheid, zijn gemeld bij patiënten die werden behandeld met amiodaron en kunnen op elk moment tijdens de behandeling optreden. Als zich symptomen van een visuele beperking voordoen, zoals veranderingen in gezichtsscherpte en afname van het perifere zicht, overweeg dan te stoppen met CORDARONE 100 mg en onmiddellijk door te verwijzen voor oogheelkundig onderzoek. Regelmatig oogheelkundig onderzoek, inclusief fundoscopie en spleetlamponderzoek, wordt aanbevolen tijdens de toediening van CORDARONE (zie ONGEWENSTE REACTIES ].
Microafzettingen op het hoornvlies
Microafzettingen op het hoornvlies komen voor bij de meeste volwassenen die met CORDARONE worden behandeld. Ze zijn meestal alleen waarneembaar door spleetlamponderzoek, maar veroorzaken bij maar liefst 10% van de patiënten symptomen zoals visuele halo's of wazig zien. Microafzettingen op het hoornvlies zijn reversibel na verlaging van de dosis of beëindiging van de behandeling. Asymptomatische microafzettingen alleen zijn geen reden om de dosis te verlagen of de behandeling te staken [zie: ONGEWENSTE REACTIES ].
Schildklierafwijkingen
CORDARONE 50 mg remt de perifere omzetting van thyroxine (T4) naar trijoodthyronine (T3) en kan verhoogde thyroxinespiegels, verlaagde T3-spiegels en verhoogde spiegels van inactief omgekeerd T3 (rT3) veroorzaken bij klinisch euthyroïde patiënten. CORDARONE 50 mg kan hypothyreoïdie veroorzaken (gemeld bij maximaal 10% van de patiënten) of hyperthyreoïdie (komt voor bij ongeveer 2% van de patiënten). Controleer de schildklierfunctie voorafgaand aan de behandeling en periodiek daarna, vooral bij oudere patiënten en bij elke patiënt met een voorgeschiedenis van schildklierknobbeltjes, struma of andere schildklierdisfunctie.
Hyperthyreoïdie kan een doorbraak van aritmie veroorzaken. Als er nieuwe tekenen van aritmie optreden, moet rekening worden gehouden met de mogelijkheid van hyperthyreoïdie. Antithyroid-geneesmiddelen, β-adrenerge blokkers, tijdelijke therapie met corticosteroïden kunnen nodig zijn om de symptomen van hyperthyreoïdie te behandelen. De werking van thyreostatica kan vertraagd zijn bij door amiodaron geïnduceerde thyreotoxicose vanwege aanzienlijke hoeveelheden voorgevormde schildklierhormonen die in de klier zijn opgeslagen. Behandeling met radioactief jodium is gecontra-indiceerd vanwege de lage opname van radioactief jodium die gepaard gaat met door amiodaron geïnduceerde hyperthyreoïdie. Door CORDARONE geïnduceerde hyperthyreoïdie kan worden gevolgd door een voorbijgaande periode van hypothyreoïdie.
Hypothyreoïdie kan primair zijn of volgend op het verdwijnen van eerdere door amiodaron geïnduceerde hyperthyreoïdie. Ernstige hypothyreoïdie en myxoedeem-coma, soms fataal, zijn gemeld in verband met behandeling met amiodaron. Bij sommige klinisch met hypothyroïde amiodaron behandelde patiënten kunnen de vrije thyroxine-indexwaarden normaal zijn. Beheer hypothyreoïdie door de dosis van CORDARONE en suppletie met schildklierhormoon te verlagen of stop te zetten.
Bradycardie
CORDARONE veroorzaakt symptomatische bradycardie of sinusarrest met onderdrukking van ontsnappingshaarden bij 2 tot 4% van de patiënten. Het risico wordt verhoogd door elektrolytische stoornissen of gelijktijdig gebruik van anti-aritmica of negatieve chronotropen [zie DRUG-INTERACTIES ]. Bij bradycardie kan een pacemaker nodig zijn voor frequentiecontrole.
Postmarketinggevallen van symptomatische bradycardie, waarvan sommige het inbrengen van een pacemaker vereisen en ten minste één fataal, zijn gemeld toen ledipasvir/sofosbuvir of sofosbuvir met simeprevir werd gestart bij patiënten die amiodaron kregen. Bradycardie trad in het algemeen binnen enkele uren tot dagen op, maar trad in sommige gevallen op tot 2 weken na het starten van de antivirale behandeling. Bradycardie verdween over het algemeen na stopzetting van de antivirale behandeling. Het mechanisme voor dit effect is niet bekend. Controleer de hartslag bij patiënten die amiodaron gebruiken of recentelijk zijn gestopt bij het starten van een antivirale behandeling [zie: DRUG-INTERACTIES ].
Implanteerbare hartapparaten
Bij patiënten met geïmplanteerde defibrillators of pacemakers kan chronische toediening van anti-aritmica de stimulatie- of defibrillatiedrempels beïnvloeden. Daarom moeten bij het begin van en tijdens de behandeling met amiodaron de stimulatie- en defibrillatiedrempels worden bepaald.
Foetale toxiciteit
CORDARONE kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Foetale blootstelling kan de kans op hart-, schildklier-, neurologische ontwikkelings-, neurologische en groei-effecten bij pasgeborenen vergroten [zie: Gebruik bij specifieke populaties ].
Perifere neuropathie
Chronische toediening van CORDARONE kan leiden tot perifere neuropathie, die mogelijk niet verdwijnt wanneer CORDARONE wordt stopgezet.
Lichtgevoeligheid en huidverkleuring
CORDARONE induceert fotosensibilisatie bij ongeveer 10% van de patiënten; enige bescherming kan worden geboden door zonnebrandcrèmes of beschermende kleding. Bij langdurige behandeling kan een blauwgrijze verkleuring van de blootgestelde huid optreden. Het risico kan verhoogd zijn bij patiënten met een lichte huidskleur of bij patiënten met overmatige blootstelling aan de zon. Enige omkering van de verkleuring kan optreden bij stopzetting van het geneesmiddel.
Chirurgie
Vluchtige anesthetica
Patiënten die met CORDARONE 100 mg worden behandeld, kunnen gevoeliger zijn voor de myocardonderdrukkende en geleidingseffecten van gehalogeneerde inhalatie-anesthetica.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( Medicatiegids ).
Adviseer zwangere vrouwen over het mogelijke risico voor een foetus. Adviseer vrouwen met reproductief vermogen om hun voorschrijver te informeren over een bekende of vermoede zwangerschap [zie: Gebruik bij specifieke populaties ].
Adviseer vrouwen dat borstvoeding niet wordt aanbevolen tijdens de behandeling met CORDARONE [zie: Gebruik bij specifieke populaties ].
Adviseer patiënten om grapefruitsap en sint-janskruid te vermijden.
Adviseer patiënten om medische hulp in te roepen als ze de tekenen en symptomen van pulmonale toxiciteit, verergering van aritmie, bradycardie, visusstoornis of hypo- en hyperthyreoïdie ervaren.
Het label van dit product is mogelijk bijgewerkt. Ga voor volledige informatie over het voorschrijven naar www.pfizer.com.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Amiodaron HCl werd in verband gebracht met een statistisch significante, dosisgerelateerde toename van de incidentie van schildkliertumoren (folliculair adenoom en/of carcinoom) bij ratten. De incidentie van schildkliertumoren was groter dan bij de controle bij het laagste geteste dosisniveau, namelijk 5 mg/kg/dag (ongeveer 0,08 maal de maximaal aanbevolen onderhoudsdosis voor de mens*).
Mutageniteitsonderzoeken (Ames-, micronucleus- en lysogene tests) met CORDARONE waren negatief.
In een onderzoek waarin amiodaron HCl werd toegediend aan mannelijke en vrouwelijke ratten, beginnend 9 weken voor de paring, werd verminderde vruchtbaarheid waargenomen bij een dosisniveau van 90 mg/kg/dag (ongeveer 1,4 maal de maximaal aanbevolen humane onderhoudsdosis*).
*600 mg bij een patiënt van 60 kg (dosis vergeleken op basis van lichaamsoppervlak)
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beschikbare gegevens uit postmarketingrapporten en gepubliceerde casusreeksen geven aan dat het gebruik van amiodaron bij zwangere vrouwen het risico op foetale bijwerkingen kan verhogen, waaronder neonatale hypo- en hyperthyreoïdie, neonatale bradycardie, neurologische ontwikkelingsstoornissen, vroeggeboorte en foetale groeibeperking. Amiodaron en zijn metaboliet, desethylamiodaron (DEA), passeren de placenta. Onbehandelde onderliggende aritmieën, waaronder ventriculaire aritmieën, tijdens de zwangerschap vormen een risico voor de moeder en de foetus (zie Klinische overwegingen ). In dierstudies resulteerde toediening van amiodaron aan konijnen, ratten en muizen tijdens de organogenese in embryofoetale toxiciteit bij doses die lager waren dan de maximaal aanbevolen onderhoudsdosis voor de mens (zie Gegevens ). Adviseer zwangere vrouwen over het mogelijke risico voor een foetus.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2%-4% en 15%-20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en of embryo-/foetale risico
De incidentie van ventriculaire tachycardie is verhoogd en kan meer symptomatisch zijn tijdens de zwangerschap. Ventriculaire aritmieën komen het vaakst voor bij zwangere vrouwen met onderliggende cardiomyopathie, aangeboren hartziekte, hartklepaandoening of mitralisklepprolaps. De meeste tachycardie-episodes worden geïnitieerd door ectopische slagen en het optreden van aritmie-episodes kan daarom toenemen tijdens de zwangerschap vanwege de verhoogde neiging tot ectopische activiteit. Doorbraakaritmieën kunnen ook optreden tijdens de zwangerschap, aangezien de therapeutische behandelingsniveaus moeilijk te handhaven kunnen zijn vanwege het verhoogde distributievolume en het verhoogde geneesmiddelmetabolisme dat inherent is aan de zwangere toestand.
Foetale/neonatale bijwerkingen
Van amiodaron en zijn metaboliet is aangetoond dat ze de placenta passeren. Bijwerkingen van de foetus die in verband worden gebracht met het gebruik van amiodaron door de moeder tijdens de zwangerschap kunnen zijn: neonatale bradycardie, QT-verlenging en periodieke ventriculaire extrasystolen, neonatale hypothyreoïdie (met of zonder struma), prenataal of bij de pasgeborene gedetecteerd en zelfs na een paar dagen blootstelling gemeld, neonatale hyperthyroxinemie, neurologische afwijkingen onafhankelijk van de schildklierfunctie, waaronder spraakvertraging en problemen met geschreven taal en rekenen, vertraagde motorische ontwikkeling en ataxie, schokkerige nystagmus met synchrone hoofdtitubatie, foetale groeibeperking en vroeggeboorte. Controleer de pasgeborene op tekenen en symptomen van een schildklieraandoening en hartritmestoornissen.
Bevalling
Het risico op aritmieën kan toenemen tijdens de bevalling en de bevalling. Patiënten die met CORDARONE worden behandeld, moeten tijdens de bevalling en de bevalling continu worden gecontroleerd [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gegevens
Dierlijke gegevens
Bij drachtige ratten en konijnen tijdens de periode van organogenese had amiodaron HCl in doses van 25 mg/kg/dag (respectievelijk ongeveer 0,4 en 0,9 maal de maximaal aanbevolen humane onderhoudsdosis*) geen nadelige effecten op de foetus. Bij konijnen veroorzaakte 75 mg/kg/dag (ongeveer 2,7 maal de maximaal aanbevolen onderhoudsdosis voor de mens*) abortus bij meer dan 90% van de dieren. Bij ratten werden doses van 50 mg/kg/dag of meer in verband gebracht met een lichte verplaatsing van de testikels en een verhoogde incidentie van onvolledige ossificatie van sommige schedel- en digitale botten; bij 100 mg/kg/dag of meer was het foetale lichaamsgewicht verminderd; bij 200 mg/kg/dag was er een verhoogde incidentie van foetale resorptie. (Deze doses bij ratten zijn ongeveer 0,8, 1,6 en 3,2 maal de maximaal aanbevolen onderhoudsdosis voor de mens*) Bij een dosis van 5 mg/kg/dag werden ook nadelige effecten op de groei en overleving van de foetus waargenomen bij een van de twee muizenstammen ( ongeveer 0,04 keer de maximaal aanbevolen onderhoudsdosis voor mensen*).
*600 mg bij een patiënt van 60 kg (doses vergeleken op basis van lichaamsoppervlak)
Borstvoeding
Risico Samenvatting
Amiodaron en een van zijn belangrijkste metabolieten, DEA, zijn aanwezig in moedermelk tussen 3,5% en 45% van de voor het moedergewicht aangepaste dosering van amiodaron. Er zijn gevallen van hypothyreoïdie en bradycardie bij zuigelingen die borstvoeding krijgen, hoewel het onduidelijk is of deze effecten te wijten zijn aan blootstelling aan amiodaron in moedermelk. Borstvoeding wordt niet aanbevolen tijdens de behandeling met CORDARONE (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
Op basis van vruchtbaarheidsonderzoeken bij dieren kan CORDARONE de vrouwelijke en mannelijke vruchtbaarheid verminderen. Het is niet bekend of dit effect omkeerbaar is. [zien Niet-klinische toxicologie ].
Pediatrisch gebruik
De veiligheid en werkzaamheid van CORDARONE bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Normale proefpersonen ouder dan 65 jaar vertonen een lagere klaring en een langere halfwaardetijd van het geneesmiddel dan jongere proefpersonen [zie: KLINISCHE FARMACOLOGIE ]. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
OVERDOSERING
Er zijn gevallen geweest, sommige fataal, van een overdosis CORDARONE 50 mg.
Controleer het hartritme en de bloeddruk van de patiënt en, als bradycardie optreedt, kan een β-adrenerge agonist of een pacemaker worden gebruikt. Behandel hypotensie met onvoldoende weefselperfusie met positieve inotrope en vasopressormiddelen. Noch CORDARONE 50 mg, noch zijn metaboliet is dialyseerbaar.
CONTRA-INDICATIES
- Cardiogene schok.
- Sick sinus-syndroom, tweede- of derdegraads atrioventriculair blok, bradycardie leidend tot syncope zonder werkende pacemaker.
- Bekende overgevoeligheid voor het geneesmiddel of voor een van de componenten ervan, inclusief jodium.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Amiodaron wordt beschouwd als een klasse III antiaritmicum, maar het bezit elektrofysiologische kenmerken van alle vier de Vaughan Williams-klassen. Net als klasse I-geneesmiddelen blokkeert amiodaron de natriumkanalen bij snelle stimulatiefrequenties, en net als klasse II-geneesmiddelen oefent amiodaron een niet-competitieve antisympathische werking uit. Een van de belangrijkste effecten, bij langdurige toediening, is het verlengen van de cardiale actiepotentiaal, een klasse III-effect. Het negatieve chronotrope effect van amiodaron in knoopweefsel is vergelijkbaar met het effect van klasse IV-geneesmiddelen. Naast het blokkeren van natriumkanalen, blokkeert amiodaron de myocardiale kaliumkanalen, wat bijdraagt aan het vertragen van de geleiding en verlenging van de ongevoeligheid. De antisympathische werking en de blokkering van calcium- en kaliumkanalen zijn verantwoordelijk voor de negatieve dromotrope effecten op de sinusknoop en voor de vertraging van geleiding en verlenging van de ongevoeligheid in de atrioventriculaire (AV) knoop. De vaatverwijdende werking kan de belasting van het hart en bijgevolg het zuurstofverbruik van het myocard verminderen.
CORDARONE verlengt de duur van de actiepotentiaal van alle hartvezels en veroorzaakt een minimale vermindering van dV/dt (maximale opwaartse snelheid van de actiepotentiaal). De refractaire periode is verlengd in alle hartweefsels. CORDARONE verlengt de cardiale refractaire periode zonder de rustmembraanpotentiaal te beïnvloeden, behalve in automatische cellen waar de helling van de prepotentiaal wordt verminderd, waardoor in het algemeen de automatisering wordt verminderd. Deze elektrofysiologische effecten worden weerspiegeld in een verminderde sinusfrequentie van 15 tot 20%, verhoogde PR- en QT-intervallen van ongeveer 10%, de ontwikkeling van U-golven en veranderingen in de T-golfcontour. Voor deze veranderingen hoeft de behandeling met CORDARONE 50 mg niet te worden gestaakt, aangezien ze een aanwijzing zijn voor de farmacologische werking, hoewel CORDARONE duidelijke sinusbradycardie of sinusarrest en hartblok kan veroorzaken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hemodynamiek
In dierstudies en na intraveneuze toediening bij de mens ontspant CORDARONE 100 mg de vasculaire gladde spieren, vermindert de perifere vasculaire weerstand (afterload) en verhoogt het de hartindex enigszins. Na orale toediening geeft CORDARONE 100 mg echter geen significante verandering in de linkerventrikelejectiefractie (LVEF), zelfs niet bij patiënten met een depressieve LVEF. Na acute intraveneuze toediening bij de mens kan CORDARONE 100 mg een licht negatief inotroop effect hebben.
farmacodynamiek
Er is geen duidelijk vastgesteld verband tussen plasmaconcentratie en effectiviteit, maar het lijkt erop dat concentraties die veel lager zijn dan 1 mg/L vaak niet effectief zijn en dat niveaus boven 2,5 mg/L over het algemeen niet nodig zijn. Plasmaconcentratiemetingen kunnen worden gebruikt om patiënten te identificeren van wie de spiegels ongewoon laag zijn, die baat zouden kunnen hebben bij een verhoging van de dosis, of die abnormaal hoog zouden kunnen zijn, en bij wie de dosis zou kunnen worden verlaagd in de hoop de bijwerkingen te minimaliseren.
Effecten op abnormale ritmes worden niet eerder gezien dan 2 tot 3 dagen en duren meestal 1 tot 3 weken, zelfs wanneer een oplaaddosis wordt gebruikt. Er kan een aanhoudende toename van het effect zijn voor nog langere perioden. Er zijn aanwijzingen dat de tijd tot effect korter is wanneer een oplaaddosisregime wordt gebruikt.
In overeenstemming met de langzame eliminatiesnelheid, blijven de anti-aritmische effecten weken of maanden aanhouden nadat CORDARONE 50 mg is stopgezet, maar de tijd van recidief is variabel en onvoorspelbaar. In het algemeen wordt, wanneer het geneesmiddel wordt hervat na herhaling van de aritmie, de controle relatief snel tot stand gebracht in vergelijking met de aanvankelijke respons, vermoedelijk omdat de weefselvoorraden niet volledig waren uitgeput.
Farmacokinetiek
Absorptie
Na orale toediening bij mensen wordt CORDARONE langzaam en variabel geabsorbeerd. De biologische beschikbaarheid van CORDARONE is ongeveer 50%. Maximale plasmaconcentraties worden 3 tot 7 uur na een enkele dosis bereikt. Plasmaconcentraties bij chronische dosering van 100 tot 600 mg/dag zijn ongeveer dosisproportioneel, met een gemiddelde stijging van 0,5 mg/L voor elke 100 mg/dag. Deze middelen omvatten echter een aanzienlijke individuele variabiliteit.
Voedsel verhoogt de snelheid en mate van absorptie van CORDARONE. De effecten van voedsel op de biologische beschikbaarheid van CORDARONE zijn onderzocht bij 30 gezonde proefpersonen die een enkele dosis van 600 mg kregen onmiddellijk na het nuttigen van een vetrijke maaltijd en na een nacht vasten. De oppervlakte onder de plasmaconcentratie-tijdcurve (AUC) en de piekplasmaconcentratie (Cmax) van amiodaron namen in aanwezigheid van voedsel respectievelijk 2,3 (bereik 1,7 tot 3,6) en 3,8 (bereik 2,7 tot 4,4) toe. Voedsel verhoogde ook de absorptiesnelheid van amiodaron, waardoor de tijd tot piekplasmaconcentratie (Tmax) met 37% werd verkort. De gemiddelde AUC en gemiddelde Cmax van de belangrijkste metaboliet van amiodaron, DEA, stegen met respectievelijk 55% (bereik 58 tot 101%) en 32% (bereik 4 tot 84%), maar er was geen verandering in de Tmax in aanwezigheid van voedsel.
Verdeling
CORDARONE is sterk eiwitgebonden (ongeveer 96%). CORDARONE heeft een zeer groot maar variabel distributievolume, gemiddeld ongeveer 60 l/kg, vanwege uitgebreide accumulatie op verschillende plaatsen, met name vetweefsel en sterk doorbloede organen, zoals de lever, long en milt.
Eén belangrijke metaboliet van CORDARONE 50 mg, DEA, is bij de mens geïdentificeerd; het accumuleert in nog grotere mate in bijna alle weefsels. Er zijn geen gegevens beschikbaar over de activiteit van DEA bij mensen, maar bij dieren heeft het significante elektrofysiologische en antiaritmische effecten die over het algemeen vergelijkbaar zijn met die van amiodaron zelf. De precieze rol en bijdrage van DEA aan de antiaritmische activiteit van oraal amiodaron is niet zeker. De ontwikkeling van maximale ventriculaire klasse III-effecten na orale toediening van 100 mg CORDARONE bij de mens hangt nauwer samen met de accumulatie van DEA in de loop van de tijd dan met de accumulatie van amiodaron.
Eliminatie
Na toediening van een enkelvoudige dosis aan 12 gezonde proefpersonen vertoonde CORDARONE farmacokinetiek in meerdere compartimenten met een gemiddelde schijnbare terminale plasma-eliminatiehalfwaardetijd van 58 dagen (bereik 15 tot 142 dagen) voor amiodaron en 36 dagen (bereik 14 tot 75 dagen) voor de actieve metaboliet (DEA). Bij patiënten na stopzetting van chronische orale therapie is aangetoond dat CORDARONE 100 mg een bifasische eliminatie heeft met een initiële 50% verlaging van de plasmaspiegels na 2,5 tot 10 dagen. Een veel langzamere terminale plasma-eliminatiefase vertoont een halfwaardetijd van de moederverbinding variërend van 26 tot 107 dagen, met een gemiddelde van ongeveer 53 dagen en de meeste patiënten in het bereik van 40 tot 55 dagen. Bij afwezigheid van een oplaaddosisperiode zouden de steady-state plasmaconcentraties bij constante orale dosering daarom worden bereikt tussen 130 en 535 dagen, met een gemiddelde van 265 dagen. Voor de metaboliet was de gemiddelde plasma-eliminatiehalfwaardetijd ongeveer 61 dagen. Deze gegevens weerspiegelen waarschijnlijk een initiële eliminatie van het geneesmiddel uit goed doorbloed weefsel (de halfwaardetijd van 2,5 tot 10 dagen), gevolgd door een terminale fase die een extreem langzame eliminatie vertegenwoordigt uit slecht doorbloede weefselcompartimenten zoals vet.
De aanzienlijke interindividuele variatie in beide fasen van eliminatie, evenals onzekerheid over welk compartiment cruciaal is voor het effect van het geneesmiddel, vereist aandacht voor individuele reacties zodra aritmiecontrole is bereikt met oplaaddoses, omdat de juiste onderhoudsdosis gedeeltelijk is bepaald, door de eliminatietarieven. Individualiseer de onderhoudsdoses van CORDARONE [zie DOSERING EN ADMINISTRATIE ].
Metabolisme
Amiodaron wordt gemetaboliseerd tot DEA door de cytochroom P450 (CYP)-enzymgroep, met name CYP3A en CYP2C8. Het CYP3A iso-enzym is aanwezig in zowel de lever als de darmen. In vitro vertonen amiodaron en DEA het vermogen om CYP2C9, CYP2C19, CYP2D6, CYP3A, CYP2A6, CYP2B6 en CYP2C8 te remmen. Amiodaron en DEA kunnen ook sommige transporters remmen, zoals P-glycoproteïne en organische kationtransporters (OCT2).
uitscheiding
Amiodaron wordt voornamelijk geëlimineerd door levermetabolisme en uitscheiding via de gal, en de uitscheiding van amiodaron of DEA in de urine is verwaarloosbaar. Noch amiodaron noch DEA is dialyseerbaar.
Specifieke populaties
Effect van leeftijd
Normale proefpersonen ouder dan 65 jaar vertonen een lagere klaring (ongeveer 100 ml/uur/kg) dan jongere proefpersonen (ongeveer 150 ml/uur/kg) en een toename van de t½ van ongeveer 20 tot 47 dagen.
Nierfunctiestoornis
Nierfunctiestoornis heeft geen invloed op de farmacokinetiek van amiodaron of DEA.
Leverfunctiestoornis
Na een enkele dosis intraveneuze amiodaron aan cirrotische patiënten worden significant lagere Cmax- en gemiddelde concentratiewaarden gezien voor DEA, maar de gemiddelde amiodaronspiegels zijn onveranderd.
Hartziekte
Bij patiënten met ernstige linkerventrikeldisfunctie is de farmacokinetiek van amiodaron niet significant veranderd, maar de terminale eliminatie-t van DEA is verlengd.
Hoewel er geen dosisaanpassing is vastgesteld voor patiënten met nier-, lever- of hartafwijkingen tijdens chronische behandeling met oraal amiodaron, is nauwlettende klinische controle verstandig voor oudere patiënten en patiënten met ernstige linkerventrikeldisfunctie.
Geneesmiddelinteracties
Effecten van andere middelen op amiodaron
Grapefruitsap: Grapefruitsap toegediend aan gezonde vrijwilligers verhoogde de AUC van amiodaron met 50% en de Cmax met 84%, en verlaagde DEA tot niet-kwantificeerbare concentraties.
Cimetidine remt CYP3A en kan de serumamiodaronspiegels verhogen.
Cholestyramine vermindert de enterohepatische circulatie van amiodaron, waardoor de eliminatie ervan toeneemt. Dit resulteert in verlaagde serumconcentraties en halfwaardetijd van amiodaron.
Effecten van amiodaron op middelen
CYP3A-substraten
Gelijktijdig ingenomen amiodaron met kinidine verhoogt de serumconcentratie van kinidine na twee dagen met 33%. Amiodaron, gelijktijdig ingenomen met procaïnamide gedurende minder dan zeven dagen, verhoogt de plasmaconcentraties van procaïnamide en n-acetylprocaïnamide met respectievelijk 55% en 33%.
Loratadine, een niet-sederend antihistaminicum, wordt voornamelijk gemetaboliseerd door CYP3A en het metabolisme ervan kan worden geremd door amiodaron.
Metabolisme van lidocaïne kan worden geremd door amiodaron.
Cyclofosfamide is een prodrug, gemetaboliseerd door CYP450 inclusief CYP3A tot een actieve metaboliet. Het metabolisme van cyclofosfamide kan worden geremd door amiodaron.
Clopidogrel, een inactieve thienopyridine-prodrug, wordt in de lever door CYP3A gemetaboliseerd tot een actieve metaboliet. Er is melding gemaakt van een mogelijke interactie tussen clopidogrel en amiodaron, resulterend in een ineffectieve remming van de bloedplaatjesaggregatie.
Macrolide/Ketolide Antibiotica
Amiodaron kan het metabolisme van macrolide/ketolide-antibiotica (behalve azitromycine) en systemische azol-antischimmelmiddelen remmen.
P-glycoproteïne-substraten
Gelijktijdig ingenomen amiodaron met digoxine verhoogt de serumconcentratie van digoxine na één dag met 70%.
Wanneer dabigatran etexilaat gelijktijdig met oraal amiodaron wordt ingenomen, kan dit leiden tot verhoogde serumconcentraties van dabigatran.
Dextromethorfan is een substraat voor zowel CYP2D6 als CYP3A. Amiodaron remt CYP2D6. Chronische (> 2 weken) orale toediening van amiodaron verslechtert het metabolisme van dextromethorfan en kan leiden tot verhoogde serumconcentraties.
PATIËNT INFORMATIE
CORDARONE® (KOR-DU-RON) (amiodaron) tabletten
Wat is de belangrijkste informatie die ik moet weten over CORDARONE 50 mg?
CORDARONE kan ernstige bijwerkingen veroorzaken die tot de dood kunnen leiden, waaronder:
- longproblemen
- leverproblemen
- verergering van hartslagproblemen
Bel uw zorgverlener of zoek onmiddellijk medische hulp als u een van de volgende symptomen heeft tijdens de behandeling met CORDARONE:
- moeite met ademhalen, piepende ademhaling, kortademigheid, hoesten pijn op de borst, bloed opspugen of koorts
- misselijkheid of braken, bruine of donkergekleurde urine, zich vermoeider voelen dan normaal, gele verkleuring van uw huid of het wit van uw ogen (geelzucht), of pijn in de rechterbovenbuik
- hartkloppingen, een slag overslaan, snel of langzaam kloppen, een licht gevoel in het hoofd voelen of flauwvallen
- problemen met het gezichtsvermogen, waaronder wazig zien, halo's zien, of uw ogen worden gevoelig voor licht. U moet regelmatig oogonderzoeken ondergaan voor en tijdens de behandeling met CORDARONE.
Met CORDARONE moet worden gestart in een ziekenhuis, zodat uw medische toestand zorgvuldig kan worden gecontroleerd.
CORDARONE mag alleen worden gebruikt voor de behandeling van mensen bij wie levensbedreigende hartslagproblemen, ventriculaire aritmieën genaamd, zijn vastgesteld, wanneer andere behandelingen niet hebben gewerkt of u deze niet kunt verdragen.
CORDARONE 50 mg kan andere ernstige bijwerkingen veroorzaken. Zie "Wat zijn de mogelijke bijwerkingen van CORDARONE 100 mg?" Als u tijdens de behandeling ernstige bijwerkingen krijgt, moet u mogelijk stoppen met CORDARONE, uw dosis laten veranderen of medische behandeling krijgen. Praat met uw zorgverlener voordat u stopt met het gebruik van CORDARONE.
kunt nog steeds bijwerkingen krijgen nadat u met CORDARONE bent gestopt, omdat het geneesmiddel nog maanden in uw lichaam blijft nadat de behandeling is gestopt.
U dient voor en tijdens de behandeling met CORDARONE 100 mg regelmatig gecontroleerd te worden, bloedonderzoek en röntgenfoto's van de borstkas te ondergaan om te controleren op ernstige bijwerkingen. U moet ook longfunctietesten ondergaan voordat u met de behandeling met CORDARONE begint.
Wat is CORDARONE?
CORDARONE is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van mensen bij wie levensbedreigende hartslagproblemen, ventriculaire aritmieën genaamd, zijn vastgesteld, wanneer andere behandelingen niet hebben gewerkt of u deze niet kunt verdragen. Het is niet bekend of CORDARONE veilig en effectief is bij kinderen.
Wie mag CORDARONE 100 mg niet gebruiken?
Gebruik CORDARONE 100 mg niet als u:
- een ernstig hartprobleem heeft dat cardiogene shock wordt genoemd
- een bepaalde hartaandoening heeft die hartblok wordt genoemd, met of zonder een trage hartslag
- een trage hartslag heeft met duizeligheid of een licht gevoel in het hoofd, en u heeft geen geïmplanteerde pacemaker
- zijn allergisch voor amiodaron, jodium of voor één van de andere bestanddelen van CORDARONE. Zie het einde van deze medicatiehandleiding voor een volledige lijst van ingrediënten in CORDARONE.
Voordat u CORDARONE 100 mg inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- long- of ademhalingsproblemen heeft
- leverproblemen hebben
- schildklierproblemen heeft of heeft gehad
- een trage hartslag of bloeddrukproblemen heeft
- diarree heeft of gedurende een lange tijd diarree heeft gehad
- is verteld dat u een laag kalium-, magnesium- of calciumgehalte in uw bloed heeft
- een geïmplanteerde pacemaker of defribrillator hebben;
- als u van plan bent een operatie onder algehele anesthesie te ondergaan
- zwanger bent of van plan bent zwanger te worden. CORDARONE kan uw ongeboren baby schaden. Vertel het uw zorgverlener meteen als u zwanger wordt tijdens de behandeling met CORDARONE. CORDARONE 100 mg kan nog maanden in uw lichaam blijven nadat de behandeling is gestopt.
- borstvoeding geeft of van plan bent borstvoeding te geven. CORDARONE 100 mg kan in de moedermelk terechtkomen en kan schadelijk zijn voor uw baby. U mag geen borstvoeding geven tijdens het gebruik van CORDARONE. CORDARONE kan nog maanden in uw lichaam blijven nadat de behandeling is gestopt. Praat met uw zorgverlener over de beste manier om uw baby gedurende deze tijd te voeden.
Vertel uw zorgverlener over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. CORDARONE 50 mg en bepaalde andere geneesmiddelen kunnen elkaar beïnvloeden en ernstige bijwerkingen veroorzaken. U kunt uw apotheker om een lijst vragen van geneesmiddelen die een wisselwerking hebben met CORDARONE.
Hoe moet ik CORDARONE innemen?
- Wanneer u uit het ziekenhuis wordt ontslagen, neem CORDARONE dan precies in zoals uw arts u zegt.
- Uw zorgverlener zal u vertellen hoeveel CORDARONE u moet innemen en wanneer u het moet innemen.
- Uw zorgverlener kan uw dosis CORDARONE 50 mg naar behoefte aanpassen als uw hartritme onder controle is of als u bepaalde bijwerkingen heeft. Uw zorgverlener dient u zorgvuldig te controleren wanneer uw dosis CORDARONE 50 mg wordt gewijzigd.
- Neem uw dosis CORDARONE elke keer op dezelfde manier in, met of zonder voedsel.
- Als u te veel CORDARONE 100 mg heeft ingenomen, neem dan onmiddellijk contact op met uw zorgverlener of ga naar de eerste hulpafdeling van het dichtstbijzijnde ziekenhuis. Als u een dosis bent vergeten, wacht dan en neem uw volgende dosis op het normale tijdstip. Neem geen twee doses tegelijk. Ga door met uw volgende regelmatig geplande dosis.
Wat moet ik vermijden tijdens het gebruik van CORDARONE?
- Vermijd het drinken van grapefruitsap tijdens de behandeling met CORDARONE. Het drinken van grapefruitsap met CORDARONE 50 mg kan de hoeveelheid CORDARONE in uw bloed verhogen en dit kan leiden tot bijwerkingen.
- CORDARONE 100 mg kan uw huid gevoelig maken voor zonlicht. U kunt ernstige zonnebrand krijgen. Gebruik zonnebrandcrème en draag een hoed en kleding die uw huid bedekken om u te helpen beschermen als u in de zon moet zijn. Neem contact op met uw arts als u zonnebrand krijgt. Zie "Huidproblemen" in het gedeelte Medicatiegids "Wat zijn de mogelijke bijwerkingen van CORDARONE?" onderstaand.
Wat zijn de mogelijke bijwerkingen van CORDARONE?
CORADARONE kan ernstige bijwerkingen veroorzaken, waaronder:
- Zien “Wat is de belangrijkste informatie die ik over CORDARONE moet weten?”
- Zenuwproblemen. CORDARONE 100 mg kan zenuwproblemen veroorzaken. Bel uw zorgverlener als u symptomen van zenuwproblemen krijgt, waaronder: een gevoel van "pinnen en naalden" of gevoelloosheid in uw handen, benen of voeten, spierzwakte, ongecontroleerde bewegingen, slechte coördinatie of moeite met lopen.
- Huid problemen. CORDARONE kan ervoor zorgen dat uw huid gevoeliger wordt voor de zon of een blauwgrijze kleur krijgt. Mensen met een lichte huid of mensen die veel aan de zon zijn blootgesteld, lopen mogelijk meer risico op deze huidproblemen. Een deel van de blauwgrijze huidskleur kan weer normaal worden na het stoppen met CORDARONE.
- Schildklier problemen. CORDARONE kan ervoor zorgen dat u ofwel een verminderde schildklierfunctie heeft (hypothyreoïdie), die soms ernstig kan zijn, of een overactieve schildklier (hyperthyreoïdie), die ernstig kan zijn.
- Als u een verminderde schildklierfunctie krijgt tijdens de behandeling met CORDARONE, kan het zijn dat uw zorgverlener uw dosis moet verlagen of uw behandeling met CORDARONE moet stoppen, en mogelijk medicijnen moet voorschrijven om uw schildklierhormoon te vervangen.
- Een overactieve schildklier kan ervoor zorgen dat u te veel schildklierhormoon aanmaakt. U kunt een abnormale hartslag hebben, zelfs als u CORDARONE krijgt. Uw zorgverlener kan bepaalde geneesmiddelen voorschrijven om uw overactieve schildklier te behandelen. Bel uw zorgverlener als u een abnormale hartslag krijgt tijdens de behandeling met CORDARONE. Dit kan betekenen dat u een overactieve schildklier heeft.
- Uw zorgverlener moet tests doen om uw schildklierfunctie te controleren voordat u begint en tijdens de behandeling met CORDARONE.
- Bel uw zorgverlener als u een van de volgende symptomen van een schildklierprobleem krijgt tijdens de behandeling met CORDARONE:
- zwakheid
- gewichtsverlies of gewichtstoename
- warmte- of koude-intolerantie
- dunner wordend haar
- zweten
- veranderingen in uw menstruatie
- zwelling van uw nek (struma)
- nervositeit
- prikkelbaarheid
- rusteloosheid
- verminderde concentratie
- zich depressief voelen (bij ouderen)
- tremor
De meest voorkomende bijwerkingen van CORDARONE zijn:
- longproblemen
- hartslag problemen
- hart problemen
- leverproblemen
CORDARONE 50 mg kan de vruchtbaarheid bij mannen en vrouwen beïnvloeden. Het is niet bekend of de effecten omkeerbaar zijn. Praat met uw zorgverlener als u zich zorgen maakt over de vruchtbaarheid.
Dit zijn niet alle mogelijke bijwerkingen van CORDARONE. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik CORDARONE bewaren?
- Bewaar CORDARONE 100 mg bij kamertemperatuur tussen 20° en 25°C (68° tot 77°F).
- Bewaar CORDARONE in een goed gesloten verpakking en bewaar CORDARONE 50 mg uit het licht.
Houd CORDARONE 50 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van CORDARONE
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik CORDARONE niet voor een aandoening waarvoor het niet is voorgeschreven. Geef CORDARONE niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden. U kunt uw apotheker of zorgverlener om informatie vragen over CORDARONE die is geschreven voor gezondheidswerkers.
Wat zijn de ingrediënten in CORDARONE 100 mg?
Actief ingrediënt: amiodaron HCl
Inactieve ingredienten: colloïdaal siliciumdioxide, lactose, magnesiumstearaat, povidon, zetmeel en FD&C Red 40.
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
