Micardis 20mg, 40mg, 80mg Telmisartan Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Micardis 40 mg en hoe wordt het gebruikt?
Micardis is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hoge bloeddruk (hypertensie) te behandelen en om het risico op hart- en vaatziekten zoals beroerte en hartaanval te verminderen. Micardis 20 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Micardis 80 mg behoort tot een klasse geneesmiddelen die ARB's worden genoemd.
Het is niet bekend of Micardis veilig en effectief is bij kinderen jonger dan 18 jaar.
Wat zijn de mogelijke bijwerkingen van Micardis?
Micardis 80 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- zwelling,
- snelle gewichtstoename,
- misselijkheid,
- zwakheid,
- tintelend gevoel,
- pijn op de borst,
- onregelmatige hartslag, en
- verlies van beweging
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Micardis zijn:
- verstopte neus,
- sinuspijn,
- rugpijn, en
- diarree
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Micardis. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
FOETALE TOXICITEIT
- Wanneer zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met MICARDIS 40 mg [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
- Geneesmiddelen die direct op het renine-angiotensinesysteem inwerken, kunnen letsel en de dood van de zich ontwikkelende foetus veroorzaken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
OMSCHRIJVING
MICARDIS 40 mg is een anon-peptide angiotensine II-receptor (type AT1)-antagonist.
Telmisartan wordt chemisch beschreven als 4'-[(1,4'-dimethyl-2'-propyl [2,6'-bi-1H-benzimidazol]-1'-yl)methyl ]-[1,1'-bifenyl]-2-carbonzuur. De empirische formule is C33H30N4O2, het molecuulgewicht is 514,63 en de structuurformule is:
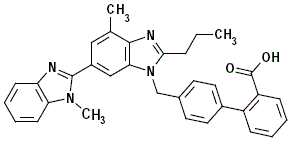
Telmisartan is een witte tot licht geelachtige vaste stof. Het is praktisch onoplosbaar in water en in het pH-bereik van 3 tot 9, matig oplosbaar in sterk zuur (behalve onoplosbaar in zoutzuur) en oplosbaar in sterke base.
MICARDIS 20 mg is verkrijgbaar als tabletten voor orale toediening, die 20 mg, 40 mg of 80 mg telmisartan bevatten. De tabletten bevatten de volgende inactieve ingrediënten: natriumhydroxide, meglumine, povidon, sorbitol en magnesiumstearaat. MICARDIS-tabletten zijn hygroscopisch en vereisen bescherming tegen vocht.
INDICATIES
MICARDIS HCT (telmisartan en hydrochloorthiazide) is geïndiceerd voor de behandeling van hypertensie, om de bloeddruk te verlagen. Het verlagen van de bloeddruk vermindert het risico op fatale en niet-fatale cardiovasculaire voorvallen, voornamelijk beroertes en myocardinfarcten. Deze voordelen zijn waargenomen in gecontroleerde onderzoeken met antihypertensiva uit een grote verscheidenheid aan farmacologische klassen, waaronder de klassen waartoe dit medicijn voornamelijk behoort. Er zijn geen gecontroleerde onderzoeken die risicovermindering met MICARDIS HCT aantonen.
Beheersing van hoge bloeddruk moet deel uitmaken van een uitgebreid cardiovasculair risicobeheer, inclusief, indien van toepassing, lipidencontrole, diabetesbeheer, antitrombotische therapie, stoppen met roken, lichaamsbeweging en beperkte natriuminname. Veel patiënten hebben meer dan één medicijn nodig om bloeddrukdoelen te bereiken. Voor specifiek advies over doelen en beheer, zie gepubliceerde richtlijnen, zoals die van het Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC) van het National High Blood Pressure Education Program.
Talrijke antihypertensiva, uit verschillende farmacologische klassen en met verschillende werkingsmechanismen, zijn aangetoond in gerandomiseerde gecontroleerde onderzoeken om cardiovasculaire morbiditeit en mortaliteit te verminderen, en er kan worden geconcludeerd dat het een bloeddrukverlaging is en niet een andere farmacologische eigenschap van de medicijnen, die grotendeels verantwoordelijk zijn voor die voordelen. Het grootste en meest consistente cardiovasculaire uitkomstvoordeel was een verlaging van het risico op een beroerte, maar verlagingen van het myocardinfarct en cardiovasculaire mortaliteit zijn ook regelmatig waargenomen.
Verhoogde systolische of diastolische druk veroorzaakt een verhoogd cardiovasculair risico, en de absolute risicotoename per mmHg is groter bij hogere bloeddruk, zodat zelfs een bescheiden verlaging van ernstige hypertensie een aanzienlijk voordeel kan opleveren. Relatieve risicoreductie door bloeddrukverlaging is vergelijkbaar in populaties met variërend absoluut risico, dus het absolute voordeel is groter bij patiënten met een hoger risico, onafhankelijk van hun hypertensie (bijvoorbeeld patiënten met diabetes of hyperlipidemie), en dergelijke patiënten zouden worden verwacht om te profiteren van een agressievere behandeling om een lagere bloeddruk te bereiken.
Sommige antihypertensiva hebben kleinere bloeddrukeffecten (als monotherapie) bij negroïde patiënten, en veel antihypertensiva hebben aanvullende goedgekeurde indicaties en effecten (bijv. op angina, hartfalen of diabetische nierziekte). Deze overwegingen kunnen leidend zijn bij de selectie van therapie [zie Klinische studies ].
MICARDIS 40 mg HCT is niet geïndiceerd voor initiële therapie voor de behandeling van hypertensie [zie: DOSERING EN ADMINISTRATIE ].
MICARDIS HCT kan alleen of in combinatie met andere antihypertensiva worden gebruikt.
DOSERING EN ADMINISTRATIE
Doseringsinformatie
Start een patiënt bij wie de bloeddruk niet voldoende onder controle is met telmisartan monotherapie 80 mg op MICARDIS 40 mg HCT, 80 mg/12,5 mg eenmaal daags. Indien nodig kan de dosis worden getitreerd tot 160 mg/25 mg na 2 tot 4 weken.
Start een patiënt bij wie de bloeddruk niet voldoende onder controle wordt gebracht met eenmaal daags 25 mg hydrochloorthiazide, of die wel onder controle is, maar die hypokaliëmie ervaart met dit regime op MICARDIS HCT 80 mg/12,5 mg eenmaal daags. Indien nodig kan de dosis worden getitreerd tot 160 mg/25 mg na 2 tot 4 weken.
Patiënten die getitreerd zijn naar de afzonderlijke componenten (telmisartan en hydrochloorthiazide) kunnen in plaats daarvan de overeenkomstige dosis MICARDIS 20 mg HCT krijgen.
MICARDIS 20 mg HCT kan samen met andere antihypertensiva worden toegediend.
Dosisaanpassing voor leverinsufficiëntie
Start patiënten met galwegobstructie of leverinsufficiëntie onder strikt medisch toezicht met de combinatie van 40 mg/12,5 mg. MICARDIS 40 mg HCT-tabletten worden niet aanbevolen voor patiënten met een ernstige leverfunctiestoornis [zie: Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ].
Belangrijke administratie-instructies
MICARDIS HCT-tabletten mogen pas vlak voor toediening uit de blisterverpakking worden verwijderd.
HOE GELEVERD
Doseringsvormen en sterke punten
- 40 mg/12,5 mg, rode en witte tabletten met het Boehringer Ingelheim-logo en H4
- 80 mg/12,5 mg, rode en witte tabletten met het Boehringer Ingelheim-logo en H8
- 80 mg/25 mg, gele en witte tabletten met het Boehringer Ingelheim-logo en H9
Opslag en behandeling
MICARDIS 20 mg HCT is verkrijgbaar in drie sterktes als biconvexe tweelaagse, langwerpige, niet-omhulde tabletten die telmisartan en hydrochloorthiazide bevatten:
- 40 mg/12,5 mg-tablet: rood en wit (kan rode stippen bevatten) gemarkeerd met het Boehringer Ingelheim bedrijfssymbool en H4; individuele blisterverpakking in dozen van 30 tabletten als 3 x 10 kaarten ( NDC 0597-0043-37)
- 80 mg/12,5 mg-tablet: rood en wit (kan rode stippen bevatten) gemarkeerd met het Boehringer Ingelheim bedrijfssymbool en H8; individuele blisterverpakking in dozen van 30 tabletten als 3 x 10 kaarten ( NDC 0597-0044-37)
- 80 mg/25 mg-tablet: geel en wit (kan gele spikkels bevatten) gemarkeerd met het Boehringer Ingelheim bedrijfssymbool en H9; individuele blisterverpakking in dozen van 30 tabletten als 3 x 10 kaarten ( NDC 0597-0042-37)
Opslag
Bewaren bij 25°C (77°F); excursies toegestaan tot 15°C-30°C (59°F-86°F) [zie USP-gecontroleerde kamertemperatuur]. Tabletten mogen pas vlak voor toediening uit de blisterverpakking worden verwijderd.
Gedistribueerd door: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 VS. Herzien: oktober 2018
BIJWERKINGEN
De volgende bijwerkingen worden elders in de etikettering besproken:
- hypotensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Nierfunctiestoornis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Elektrolyten en stofwisselingsstoornissen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de in de praktijk waargenomen percentages.
MICARDIS HCT is beoordeeld op veiligheid bij meer dan 1700 patiënten, van wie 716 die langer dan 6 maanden voor hypertensie werden behandeld en 420 langer dan 1 jaar. Bijwerkingen zijn beperkt tot de bijwerkingen die eerder zijn gemeld met telmisartan en/of hydrochloorthiazide.
Bijwerkingen die optreden met een incidentie van ≥ 2% bij patiënten behandeld met telmisartan/hydrochloorthiazide en met een grotere frequentie dan bij patiënten behandeld met placebo, worden weergegeven in tabel 1 [zie Klinische studies ].
Andere bijwerkingen die werden waargenomen voor telmisartan/hydrochloorthiazide waren: pijn (inclusief rug en buik), dyspepsie, erytheem, braken, bronchitis en faryngitis.
Bijwerkingen traden in ongeveer dezelfde mate op bij mannen en vrouwen, oudere en jongere patiënten, en zwarte en niet-zwarte patiënten.
Telmisartan
Andere bijwerkingen die met telmisartan zijn gemeld, worden hieronder vermeld:
Autonoom zenuwstelsel: impotentie, meer zweten, opvliegers
Lichaam als geheel: allergie, koorts, pijn in de benen, pijn op de borst
Cardiovasculair: hartkloppingen, angina pectoris, abnormaal ECG, hypertensie, perifeer oedeem
Centraal zenuwstelsel: slapeloosheid, slaperigheid, migraine, paresthesie, onwillekeurige spiersamentrekkingen, hypesthesie
Gastro-intestinaal: flatulentie, constipatie, gastritis, droge mond, aambeien, gastro-oesofageale reflux, kiespijn
Lever-gal: verhogingen van leverenzymen of serumbilirubine
Metabolisch: jicht, hypercholesterolemie, diabetes mellitus
Musculoskeletaal: artritis, artralgie, krampen in de benen, myalgie
Psychiatrisch: angst, depressie, nervositeit
Weerstandsmechanisme: infectie, abces, middenoorontsteking
Ademhaling: astma, rhinitis, dyspnoe, epistaxis
Huid: dermatitis, eczeem, pruritus
Urine: mictiefrequentie, cystitis
Vasculair: cerebrovasculaire aandoening
Speciale zintuigen: abnormaal zicht, conjunctivitis, tinnitus, oorpijn
Hydrochloorthiazide
Andere bijwerkingen die zijn gemeld met hydrochloorthiazide staan hieronder vermeld:
Lichaam als geheel: zwakheid
spijsvertering: pancreatitis, geelzucht (intrahepatische cholestatische geelzucht), sialadenitis, krampen, maagirritatie
Hematologische: aplastische anemie, agranulocytose, leukopenie, hemolytische anemie, trombocytopenie
Overgevoeligheid: purpura, lichtgevoeligheid, urticaria, necrotiserende angiitis (vasculitis en cutane vasculitis), koorts, ademnood inclusief pneumonitis en longoedeem, anafylactische reacties
Metabolisch: hyperglykemie, glycosurie
Musculoskeletaal: spierspasmen
Zenuwstelsel/psychiatrisch: rusteloosheid
nier: interstitiële nefritis
Huid: erythema multiforme inclusief Stevens-Johnson syndroom, exfoliatieve dermatitis inclusief toxische epidermale necrolyse
Speciale zintuigen: voorbijgaand wazig zien, xanthopsie
Klinische laboratoriumbevindingen
Creatinine, Bloedureumstikstof (BUN)
Verhogingen van BUN (≥11,2 mg/dL) en serumcreatinine (≥0,5 mg/dL) werden waargenomen bij respectievelijk 2,8% en 1,4% van de patiënten met essentiële hypertensie die werden behandeld met MICARDIS 80 mg HCT-tabletten in gecontroleerde onderzoeken. Geen enkele patiënt stopte met de behandeling met MICARDIS 80 mg HCT-tabletten vanwege een toename van BUN of creatinine (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van MICARDIS HCT na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan geneesmiddelen.
Bloed- en lymfestelselaandoeningen: eosinofilie
Hartaandoeningen: atriale fibrillatie, congestief hartfalen, myocardinfarct, tachycardie, bradycardie
Oor- en labyrintaandoeningen: hoogtevrees
Algemene aandoeningen en toedieningsplaatsvoorwaarden: asthenie, oedeem
Lever-gal: Abnormale leverfunctie/leveraandoening
Immuunsysteemaandoeningen: anafylactische reactie
Infecties en parasitaire aandoeningen: urineweginfectie
onderzoeken: verhoogde CPK
Metabolisme en voedingsstoornissen: hypoglykemie (bij diabetespatiënten)
Musculoskeletale en bindweefselaandoeningen: peespijn (inclusief tendinitis, tenosynovitis), rabdomyolyse
Zenuwstelselaandoeningen: syncope, hoofdpijn
Nier- en urinewegaandoeningen: nierfalen, nierfunctiestoornis inclusief acuut nierfalen
Voortplantingsstelsel en borstaandoeningen: erectiestoornis
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: hoesten
Huid- en onderhuidaandoeningen: uitbarsting van geneesmiddelen (toxische huiduitslag, meestal gemeld als toxicoderma, huiduitslag en urticaria), angio-oedeem (met fatale afloop)
Vasculaire aandoening: orthostatische hypotensie
DRUG-INTERACTIES
Middelen die serumkalium verhogen
Gelijktijdige toediening van telmisartan met andere geneesmiddelen die de serumkaliumspiegels verhogen, kan leiden tot hyperkaliëmie. Controleer het serumkalium bij dergelijke patiënten.
Lithium
Verhogingen van serumlithiumconcentraties en lithiumtoxiciteit zijn gemeld bij gelijktijdig gebruik van thiazidediuretica of angiotensine II-receptorantagonisten, waaronder telmisartan. Controleer de lithiumspiegels bij patiënten die MICARDIS 80 mg HCT en lithium krijgen.
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve Cyclooxygenas E-2-remmers
Telmisartan
Niet-steroïde anti-inflammatoire middelen, waaronder selectieve cyclo-oxygenase-2-remmers (COX-2-remmers): bij oudere patiënten, patiënten met volumedepletie (inclusief patiënten die diuretica krijgen) of met een verminderde nierfunctie, gelijktijdige toediening van NSAID's, waaronder selectieve COX-2-remmers, met ARB's, waaronder telmisartan, kunnen leiden tot verslechtering van de nierfunctie, inclusief mogelijk acuut nierfalen. Deze effecten zijn meestal omkeerbaar. Het antihypertensieve effect van ARB's kan worden afgezwakt door NSAID's. Controleer daarom de nierfunctie en bloeddruk regelmatig bij patiënten die MICARDIS 40 mg HCT en NSAID's krijgen.
Hydrochloorthiazide
Toediening van een niet-steroïde anti-inflammatoir middel, waaronder een selectieve COX2-remmer, kan de diuretische, natriuretische en antihypertensieve effecten van diuretica verminderen. Wanneer MICARDIS HCT en niet-steroïde anti-inflammatoire middelen, waaronder selectieve COX2-remmers, gelijktijdig worden gebruikt, moet u daarom nauwkeurig observeren om te bepalen of het gewenste effect van het diureticum wordt bereikt.
Dubbele blokkade van het renine-angiotens-in-aldosteronsysteem en veranderingen in de nierfunctie
Dubbele blokkade van het renine-angiotensine-aldosteronsysteem (RAS) met angiotensineblokkers, ACE-remmers of aliskiren gaat gepaard met een verhoogd risico op hypotensie, hyperkaliëmie en nierfunctiestoornis. Aan de ONTARGET-studie namen 25.620 patiënten ≥55 jaar oud met atherosclerotische ziekte of diabetes met beschadiging van de eindorganen deel, randomiseerden ze naar alleen telmisartan (ARB), alleen ramipril (ACE-remmer) of de combinatie, en volgden ze gedurende een mediane periode van 56 maanden. . Patiënten die de combinatie van ARB en ACE-remmer kregen, kregen geen extra voordeel (geen extra vermindering van het risico op cardiovasculair overlijden, myocardinfarct, beroerte of ziekenhuisopname door hartfalen) vergeleken met ARB monotherapie of ACE-remmer monotherapie, maar ervoeren een verhoogde incidentie van nierdisfunctie (bijv. acuut nierfalen) vergeleken met groepen met monotherapie.
Vermijd in het algemeen gecombineerd gebruik van RAS-remmers. Houd de bloeddruk, nierfunctie en elektrolyten nauwlettend in de gaten bij patiënten die MICARDIS 40 mg HCT gebruiken en andere middelen die de RAS beïnvloeden.
Dien aliskiren niet gelijktijdig toe met MICARDIS HCT bij patiënten met diabetes. Vermijd gelijktijdig gebruik van aliskiren met MICARDIS HCT bij patiënten met een nierfunctiestoornis (GFR
Digoxine
Wanneer telmisartan gelijktijdig met digoxine werd toegediend, werden mediane verhogingen van de digoxinepiekplasmaconcentratie (49%) en van de dalconcentratie (20%) waargenomen. Controleer de digoxinespiegels bij patiënten die gelijktijdig MICARDIS 40 mg HCT en digoxine gebruiken.
Antidiabetica (orale middelen en insuline)
Aanpassing van de dosering van antidiabetica kan nodig zijn bij gelijktijdige toediening met hydrochloorthiazide.
Cholestyramine en Colestipol-harsen
De absorptie van hydrochloorthiazide is verminderd in aanwezigheid van anionenuitwisselingsharsen. Spreid de dosering van hydrochloorthiazide en de hars zodanig dat hydrochloorthiazide ten minste 4 uur vóór of 4 tot 6 uur na de toediening van de hars wordt toegediend.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Foetale toxiciteit
Telmisartan
Het gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap, vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte. Resulterende oligohydramnionen kunnen in verband worden gebracht met foetale longhypoplasie en skeletdeformaties. Mogelijke neonatale bijwerkingen zijn onder meer schedelhypoplasie, anurie, hypotensie, nierfalen en overlijden. Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met MICARDIS HCT.
Hydrochloorthiazide
Thiaziden passeren de placentabarrière en komen voor in navelstrengbloed. Bijwerkingen zijn foetale of neonatale geelzucht en trombocytopenie [zie: Gebruik bij specifieke populaties ].
Hypotensie bij patiënten met volume- of zoutdepletie
Bij patiënten met een geactiveerd renine-angiotensinesysteem, zoals patiënten met volume- of zoutdepletie (bijv. patiënten die worden behandeld met hoge doses diuretica), kan symptomatische hypotensie optreden na het starten van de behandeling met MICARDIS HCT. Corrigeer volume- of zoutdepletie vóór toediening van MICARDIS 80 mg HCT.
Verminderde nierfunctie
Veranderingen in de nierfunctie, waaronder acuut nierfalen, kunnen worden veroorzaakt door geneesmiddelen die het renine-angiotensinesysteem remmen en door diuretica. Patiënten bij wie de nierfunctie gedeeltelijk kan afhangen van de activiteit van het renine-angiotensinesysteem (bijv. patiënten met nierarteriestenose, chronische nierziekte, ernstig congestief hartfalen of volumedepletie) kunnen een bijzonder risico lopen op het ontwikkelen van oligurie, progressieve azotemie of acuut nierfalen op MICARDIS HCT. Controleer de nierfunctie periodiek bij deze patiënten. Overweeg om de behandeling te staken of stop te zetten bij patiënten die een klinisch significante afname van de nierfunctie ontwikkelen op MICARDIS HCT.
Elektrolyten en stofwisselingsstoornissen
Geneesmiddelen, waaronder telmisartan, die het renine-angiotensinesysteem remmen, kunnen hyperkaliëmie veroorzaken, vooral bij patiënten met nierinsufficiëntie, diabetes of combinatiegebruik met andere angiotensinereceptorblokkers of ACE-remmers en het gelijktijdig gebruik van andere geneesmiddelen die de serumkaliumspiegels verhogen (zie DRUG-INTERACTIES ].
Hydrochloorthiazide kan hypokaliëmie en hyponatriëmie veroorzaken. Van thiaziden is aangetoond dat ze de urinaire excretie van magnesium verhogen; dit kan leiden tot hypomagnesiëmie. Hypomagnesiëmie kan leiden tot hypokaliëmie die ondanks kaliumrepletie moeilijk te behandelen kan zijn. Controleer de serumelektrolyten periodiek.
In gecontroleerde onderzoeken waarbij de combinatiebehandeling telmisartan/hydrochloorthiazide werd gebruikt, ervoer geen enkele patiënt die 40 mg/12,5 mg, 80 mg/12,5 mg of 80 mg/25 mg werd toegediend een verlaging van het kaliumgehalte van ≥ 1,4 mEq/l en ervoer geen enkele patiënt hyperkaliëmie.
Hydrochloorthiazide vermindert de uitscheiding van calcium via de urine en kan verhogingen van het serumcalcium veroorzaken.
Hydrochloorthiazide kan de glucosetolerantie veranderen en de serumspiegels van cholesterol en triglyceriden verhogen.
Bij bepaalde patiënten die met thiazide worden behandeld, kan hyperurikemie optreden of kan uitgesproken jicht optreden. Omdat telmisartan urinezuur verlaagt, vermindert telmisartan in combinatie met hydrochloorthiazide de door diuretica geïnduceerde hyperurikemie.
Overgevoeligheidsreactie
Hydrochloorthiazide
Overgevoeligheidsreacties op hydrochloorthiazide kunnen optreden bij patiënten met of zonder een voorgeschiedenis van allergie of bronchiaal astma, maar komen vaker voor bij patiënten met een dergelijke voorgeschiedenis [zie CONTRA-INDICATIES ].
Acute bijziendheid en secundair geslotenhoekglaucoom
Hydrochloorthiazide, een sulfonamide, kan een idiosyncratische reactie veroorzaken, resulterend in acute voorbijgaande bijziendheid en acuut geslotenhoekglaucoom. Symptomen zijn onder meer een acuut begin van verminderde gezichtsscherpte of oculaire pijn en treden meestal op binnen enkele uren tot weken na aanvang van het geneesmiddel. Onbehandeld acuut geslotenhoekglaucoom kan leiden tot permanent verlies van het gezichtsvermogen. De primaire behandeling is om zo snel mogelijk te stoppen met hydrochloorthiazide. Als de intraoculaire druk ongecontroleerd blijft, moeten mogelijk onmiddellijke medische of chirurgische behandelingen worden overwogen. Risicofactoren voor het ontwikkelen van acuut geslotenhoekglaucoom kunnen een voorgeschiedenis van sulfonamide- of penicilline-allergie zijn.
Systemische lupus erythematodes
Van thiazidediuretica is gemeld dat ze een exacerbatie of activering van systemische lupus erythematosus veroorzaken.
Postsympathectomiepatiënten
De antihypertensieve effecten van hydrochloorthiazide kunnen worden versterkt bij patiënten die postsympathectomie hebben ondergaan.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Zwangerschap
Adviseer vrouwelijke patiënten in de vruchtbare leeftijd over de gevolgen van blootstelling aan MICARDIS 40 mg HCT tijdens de zwangerschap. Bespreek behandelingsopties met vrouwen die zwanger willen worden. Vertel patiënten om zwangerschappen zo snel mogelijk aan hun arts te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven geen borstvoeding te geven tijdens de behandeling met MICARDIS HCT (zie: Gebruik bij specifieke populaties ].
Symptomatische hypotensie en syncope
Adviseer patiënten dat duizeligheid kan optreden, vooral tijdens de eerste dagen van de therapie, en meld dit aan hun zorgverlener. Informeer patiënten dat onvoldoende vochtinname, overmatige transpiratie, diarree of braken kan leiden tot een overmatige bloeddrukdaling, met dezelfde gevolgen van duizeligheid en mogelijke syncope. Adviseer patiënten om contact op te nemen met hun zorgverlener als syncope optreedt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Kaliumsupplementen
Adviseer patiënten geen kaliumsupplementen of zoutvervangers te gebruiken die kalium bevatten zonder de voorschrijvende zorgverlener te raadplegen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Acute bijziendheid en secundair geslotenhoekglaucoom
Adviseer patiënten om te stoppen met MICARDIS 80 mg HCT en onmiddellijk medische hulp in te roepen als ze symptomen van acute bijziendheid of secundair geslotenhoekglaucoom ervaren (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Telmisartan en hydrochloorthiazide
Er zijn geen carcinogeniteits-, mutageniteits- of vruchtbaarheidsonderzoeken uitgevoerd met de combinatie van telmisartan en hydrochloorthiazide.
Telmisartan
Er waren geen aanwijzingen voor carcinogeniteit wanneer telmisartan gedurende maximaal 2 jaar via de voeding aan muizen en ratten werd toegediend. De hoogste doses die aan muizen (1000 mg/kg/dag) en ratten (100 mg/kg/dag) worden toegediend, zijn, op basis van mg/m2 respectievelijk ongeveer 59 en 13 maal de maximaal aanbevolen dosis voor de mens (MRHD) van telmisartan. Van dezelfde doses is aangetoond dat ze een gemiddelde systemische blootstelling aan telmisartan geven van respectievelijk >100 keer en >25 keer de systemische blootstelling bij mensen die de MRHD van telmisartan (80 mg/dag) krijgen.
Genotoxiciteitstesten lieten geen aan telmisartan gerelateerde effecten op gen- of chromosoomniveau zien. Deze tests omvatten bacteriële mutageniteitstesten met Salmonella en E. coli (Ames), een genmutatietest met V79-cellen van de Chinese hamster, een cytogenetische test met menselijke lymfocyten en een micronucleustest bij muizen.
Er werden geen geneesmiddelgerelateerde effecten op de reproductieprestaties van mannelijke en vrouwelijke ratten waargenomen bij 100 mg/kg/dag (de hoogste toegediende dosis), ongeveer 13 keer, op basis van mg/m2, de MRHD van telmisartan. Deze dosis bij de rat resulteerde in een gemiddelde systemische blootstelling (telmisartan AUC zoals bepaald op dag 6 van de zwangerschap) van ten minste 50 maal de gemiddelde systemische blootstelling bij mensen bij de MRHD (80 mg/dag).
Hydrochloorthiazide
Twee jaar durende voedingsstudies bij muizen en ratten, uitgevoerd onder auspiciën van het National Toxicology Program (NTP), brachten geen bewijs aan het licht van een carcinogeen potentieel van hydrochloorthiazide bij vrouwelijke muizen (in doses tot ongeveer 600 mg/kg/dag) of bij mannelijke muizen. en vrouwelijke ratten (in doses tot ongeveer 100 mg/kg/dag). Het NTP vond echter dubbelzinnig bewijs voor hepatocarcinogeniteit bij mannelijke muizen.
Hydrochloorthiazide was in vitro niet genotoxisch in de Ames-mutageniteitstest van Salmonella typhimurium-stammen TA 98, TA 100, TA 1535, TA 1537 en TA 1538 en in de Chinese Hamster Ovary (CHO)-test voor chromosomale afwijkingen, of in vivo in testen met muis kiemcelchromosomen, Chinese hamsterbeenmergchromosomen en het geslachtsgebonden recessieve letale eigenschapsgen van Drosophila. Positieve testresultaten werden verkregen in de in vitro CHO Sister Chromatid Exchange (clastogeniciteit)-assay, in de Mouse Lymphoma Cell (mutageniteit)-assay en in de Aspergillus nidulans non-disjunction-assay.
Hydrochloorthiazide had geen nadelige effecten op de vruchtbaarheid van muizen en ratten van beide geslachten in onderzoeken waarin deze soorten via hun dieet werden blootgesteld aan doses tot respectievelijk 100 en 4 mg/kg, voorafgaand aan de paring en tijdens de dracht.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
MICARDIS HCT kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Gebruik van geneesmiddelen die inwerken op het renine-angiotensinesysteem tijdens het tweede en derde trimester van de zwangerschap vermindert de foetale nierfunctie en verhoogt de foetale en neonatale morbiditeit en sterfte (zie Klinische overwegingen ). De meeste epidemiologische onderzoeken naar foetale afwijkingen na blootstelling aan antihypertensiva in het eerste trimester hebben geen onderscheid gemaakt tussen geneesmiddelen die het renine-angiotensinesysteem beïnvloeden en andere antihypertensiva. Studies bij ratten en konijnen met telmisartan lieten alleen foetotoxiciteit zien bij maternale toxische doses (zie Gegevens ). Als zwangerschap wordt vastgesteld, stop dan zo snel mogelijk met MICARDIS HCT.
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijking, verlies of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo/foetale risico
Hypertensie tijdens de zwangerschap verhoogt het maternale risico op pre-eclampsie, zwangerschapsdiabetes, vroeggeboorte en complicaties bij de bevalling (bijvoorbeeld een keizersnede en postpartumbloeding). Hypertensie verhoogt het foetale risico op intra-uteriene groeibeperking en intra-uteriene sterfte. Zwangere vrouwen met hypertensie moeten zorgvuldig worden gecontroleerd en dienovereenkomstig worden behandeld.
Foetale/neonatale bijwerkingen
Telmisartan
Gebruik van geneesmiddelen die inwerken op het RAS in het tweede en derde trimester van de zwangerschap kan leiden tot het volgende: oligohydramnion, verminderde foetale nierfunctie leidend tot anurie en nierfalen, foetale longhypoplasie, skeletdeformaties, waaronder schedelhypoplasie, hypotensie en overlijden . In het ongebruikelijke geval dat er voor een bepaalde patiënt geen geschikt alternatief is voor therapie met geneesmiddelen die het renine-angiotensinesysteem beïnvloeden, dient u de moeder op de hoogte te stellen van het mogelijke risico voor de foetus.
Voer bij patiënten die MICARDIS HCT gebruiken tijdens de zwangerschap seriële echografie-onderzoeken uit om de intra-amnionische omgeving te beoordelen. Foetale testen kunnen geschikt zijn, op basis van de week van de zwangerschap. Als oligohydramnion wordt waargenomen, stop dan met MICARDIS HCT, tenzij dit als levensreddend voor de moeder wordt beschouwd. Patiënten en artsen moeten zich er echter van bewust zijn dat oligohydramnionen pas kunnen verschijnen nadat de foetus onomkeerbaar letsel heeft opgelopen.
Observeer nauwkeurig zuigelingen met een geschiedenis van in utero blootstelling aan MICARDIS 20 mg HCT voor hypotensie, oligurie en hyperkaliëmie. Als oligurie of hypotensie optreedt, ondersteun dan de bloeddruk en de nierperfusie. Wisseltransfusies of dialyse kunnen nodig zijn als middel om hypotensie om te keren en de nierfunctie te vervangen [zie Gebruik bij specifieke populaties ].
Hydrochloorthiazide
Thiaziden passeren de placenta en het gebruik van thiaziden tijdens de zwangerschap gaat gepaard met een risico op foetale of neonatale geelzucht, trombocytopenie en mogelijke andere bijwerkingen die bij volwassenen zijn opgetreden.
Gegevens
Dierlijke gegevens
MICARDIS 40 mg HCT
Er is een ontwikkelingstoxiciteitsonderzoek uitgevoerd bij ratten met doses telmisartan/hydrochloorthiazide van 3,2/1,0, 15/4,7, 50/15,6 en 0/15,6 mg/kg/dag. Hoewel de twee combinaties met een hogere dosis giftiger leken te zijn (aanzienlijke afname van de toename van het lichaamsgewicht) voor de moederdieren dan elk van de geneesmiddelen alleen, leek er geen toename van de toxiciteit voor de zich ontwikkelende embryo's te zijn.
Telmisartan
Er werden geen teratogene effecten waargenomen wanneer telmisartan werd toegediend aan drachtige ratten in orale doses tot 50 mg/kg/dag en aan drachtige konijnen bij orale doses tot 45 mg/kg/dag. Bij konijnen werd embryoletaliteit geassocieerd met maternale toxiciteit (verminderde lichaamsgewichtstoename en voedselconsumptie) waargenomen bij 45 mg/kg/dag (ongeveer 12 keer de maximaal aanbevolen dosis voor de mens [MRHD] van 80 mg op basis van mg/m²). Bij ratten werden voor de moeder toxische (verminderde lichaamsgewichtstoename en voedselconsumptie) telmisartan-doses van 15 mg/kg/dag (ongeveer 1,9 maal de MRHD op basis van mg/m2), toegediend tijdens late dracht en lactatie, nadelige effecten waargenomen. bij pasgeborenen, waaronder verminderde levensvatbaarheid, laag geboortegewicht, vertraagde rijping en verminderde gewichtstoename. De doses zonder waargenomen effect voor ontwikkelingstoxiciteit bij ratten en konijnen, respectievelijk 5 en 15 mg/kg/dag, zijn respectievelijk ongeveer 0,64 en 3,7 maal de MRHD van telmisartan (80 mg/dag) op basis van mg/m2. ).
Hydrochloorthiazide
Studies waarin hydrochloorthiazide werd toegediend aan zwangere muizen en ratten tijdens hun respectieve perioden van belangrijke organogenese in doses tot respectievelijk 3000 en 1000 mg/kg/dag (ongeveer 600 en 400 keer de MRHD), leverden geen bewijs op van schade aan de foetus .
Thiaziden kunnen de placenta passeren en de concentraties die in de navelstrengader worden bereikt, benaderen die in het maternale plasma. Hydrochloorthiazide kan, net als andere diuretica, placentaire hypoperfusie veroorzaken. Het hoopt zich op in het vruchtwater, met gerapporteerde concentraties tot 19 keer hoger dan in het plasma van de navelstrengader. Het gebruik van thiaziden tijdens de zwangerschap gaat gepaard met een risico op foetale of neonatale geelzucht of trombocytopenie. Aangezien ze het verloop van EPH (oedeem, proteïnurie, hypertensie) gestosis (pre-eclampsie) niet voorkomen of veranderen, mogen deze geneesmiddelen niet worden gebruikt voor de behandeling van hypertensie bij zwangere vrouwen. Het gebruik van hydrochloorthiazide voor andere indicaties (bijv. hartziekte) tijdens de zwangerschap moet worden vermeden.
Borstvoeding
Risico Samenvatting
Er is geen informatie over de aanwezigheid van MICARDIS 20 mg HCT of telmisartan in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Beperkte gepubliceerde onderzoeken melden dat hydrochloorthiazide aanwezig is in moedermelk. Er is echter onvoldoende informatie om de effecten van hydrochloorthiazide op de zuigeling die borstvoeding krijgt of de effecten van hydrochloorthiazide op de melkproductie te bepalen. Telmisartan is aanwezig in de melk van zogende ratten. (zien Gegevens ). Vanwege het potentieel voor ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen, waaronder hypotensie, hyperkaliëmie en nierinsufficiëntie, adviseren vrouwen die borstvoeding geven geen borstvoeding te geven tijdens de behandeling met MICARDIS HCT.
Gegevens
Telmisartan was aanwezig in de melk van zogende ratten in concentraties die 1,5 tot 2 keer hoger waren dan die in plasma 4 tot 8 uur na toediening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van MICARDIS HCT bij pediatrische patiënten zijn niet vastgesteld.
Pasgeborenen met een voorgeschiedenis van blootstelling aan MICARDIS HCT in de baarmoeder
Als oligurie of hypotensie optreedt, ondersteun dan de bloeddruk en de nierperfusie. Wisseltransfusies of dialyse kunnen nodig zijn als middel om hypotensie om te keren en/of om een gestoorde nierfunctie te vervangen.
Geriatrisch gebruik
In de gecontroleerde klinische onderzoeken (n=1017) was ongeveer 20% van de met telmisartan/hydrochloorthiazide behandelde patiënten 65 jaar of ouder en 5% 75 jaar of ouder. Er werden geen algemene verschillen in effectiviteit en veiligheid van telmisartan/hydrochloorthiazide waargenomen bij deze patiënten in vergelijking met jongere patiënten. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekten of andere medicamenteuze behandeling.
Gebruik bij patiënten met leverinsufficiëntie
Patiënten met galwegobstructie of leverinsufficiëntie dienen de behandeling onder strikt medisch toezicht te starten met de combinatie van 40 mg/12,5 mg.
Telmisartan
Aangezien het grootste deel van telmisartan wordt geëlimineerd door excretie via de gal, kan worden verwacht dat patiënten met galwegobstructie of leverinsufficiëntie een verminderde klaring en hogere bloedspiegels hebben.
Hydrochloorthiazide
Kleine veranderingen in de vocht- en elektrolytenbalans kunnen levercoma veroorzaken bij patiënten met een verminderde leverfunctie of progressieve leverziekte.
Gebruik bij patiënten met nierinsufficiëntie
De veiligheid en werkzaamheid van MICARDIS 40 mg HCT bij patiënten met een ernstige nierfunctiestoornis (CrCl ≤30 ml/min) zijn niet vastgesteld. Bij patiënten met een ernstige nierfunctiestoornis worden MICARDIS 80 mg HCT-tabletten niet aanbevolen. Er is geen dosisaanpassing nodig bij patiënten met een lichte (CrCl 60 tot 90 ml/min) of matige (CrCl 30 tot 60 ml/min) nierfunctiestoornis.
OVERDOSERING
Telmisartan
Er zijn beperkte gegevens beschikbaar met betrekking tot overdosering van telmisartan bij mensen. De meest waarschijnlijke verschijnselen van overdosering met telmisartan zijn hypotensie, duizeligheid en tachycardie; bradycardie kan optreden door parasympathische (vagale) stimulatie. Als symptomatische hypotensie optreedt, moet een ondersteunende behandeling worden ingesteld. Telmisartan wordt niet verwijderd door hemodialyse.
Hydrochloorthiazide
De meest voorkomende tekenen en symptomen die worden waargenomen bij patiënten met een overdosis hydrochloorthiazide zijn die veroorzaakt door elektrolytdepletie (hypokaliëmie, hypochloremie, hyponatriëmie) en uitdroging als gevolg van overmatige diurese. Als ook digitalis is toegediend, kan hypokaliëmie hartritmestoornissen verergeren. De mate waarin hydrochloorthiazide wordt verwijderd door hemodialyse is niet vastgesteld. De orale LD van hydrochloorthiazide is hoger dan 10 g/kg bij zowel muizen als ratten.
CONTRA-INDICATIES
MICARDIS HCT is gecontra-indiceerd:
- Bij patiënten die overgevoelig zijn voor een van de bestanddelen van dit product [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Bij patiënten met anurie.
- Voor gelijktijdige toediening met aliskiren bij patiënten met diabetes [zie: DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
MICARDIS 40 mg HCT
MICARDIS 20 mg HCT is een combinatie van twee geneesmiddelen met antihypertensieve eigenschappen: een thiazidediureticum, hydrochloorthiazide en een angiotensine II-receptorblokker (ARB), telmisartan.
Telmisartan
Angiotensine II wordt gevormd uit angiotensine I in een reactie die wordt gekatalyseerd door angiotensine-converterend enzym (ACE, kininase II). Angiotensine II is het belangrijkste pressormiddel van het renine-angiotensinesysteem, met effecten zoals vasoconstrictie, stimulatie van de synthese en afgifte van aldosteron, hartstimulatie en renale reabsorptie van natrium. Telmisartan blokkeert de vaatvernauwende en aldosteronafscheidende effecten van angiotensine II door selectief de binding van angiotensine II aan de AT1-receptor in veel weefsels, zoals vasculaire gladde spieren en de bijnier, te blokkeren. De werking ervan is daarom onafhankelijk van de routes voor de synthese van angiotensine II.
Er is ook een AT2-receptor die in veel weefsels wordt gevonden, maar het is niet bekend dat AT2 geassocieerd is met cardiovasculaire homeostase. Telmisartan heeft een veel grotere affiniteit (>3000-voudig) voor de AT1-receptor dan voor de AT2-receptor.
Telmisartan remt ACE (kininase II) niet, noch bindt het aan of blokkeert het andere hormoonreceptoren of ionkanalen waarvan bekend is dat ze belangrijk zijn bij de cardiovasculaire regulatie.
Blokkade van de angiotensine II-receptor remt de negatieve regelgevende feedback van angiotensine II op de reninesecretie, maar de resulterende verhoogde plasmarenineactiviteit en de circulerende angiotensine II-spiegels doen het effect van telmisartan op de bloeddruk niet teniet.
Hydrochloorthiazide
Hydrochloorthiazide is een thiazidediureticum. Thiaziden beïnvloeden de renale tubulaire mechanismen van de reabsorptie van elektrolyten, waardoor de uitscheiding van natriumzout en chloride in ongeveer gelijke hoeveelheden direct wordt verhoogd. Indirect vermindert de diuretische werking van hydrochloorthiazide het plasmavolume, met als gevolg een toename van de plasmarenine-activiteit, een toename van de aldosteronsecretie, een toename van het kaliumverlies in de urine en een afname van het serumkalium. De renine-aldosteronlink wordt gemedieerd door angiotensine II, dus gelijktijdige toediening van een ARB heeft de neiging om het kaliumverlies dat met deze diuretica gepaard gaat, om te keren. Het mechanisme van het antihypertensieve effect van thiaziden is niet volledig begrepen.
farmacodynamiek
Telmisartan
Bij normale vrijwilligers remde een dosis telmisartan 80 mg de pressorrespons op een intraveneuze infusie van angiotensine II met ongeveer 90% bij piekplasmaconcentraties, waarbij ongeveer 40% remming aanhield gedurende 24 uur.
De plasmaconcentratie van angiotensine II en de plasmarenine-activiteit namen op dosisafhankelijke wijze toe na eenmalige toediening van telmisartan aan gezonde proefpersonen en herhaalde toediening aan hypertensieve patiënten. De eenmaal daagse toediening van maximaal 80 mg telmisartan aan gezonde proefpersonen had geen invloed op de plasma-aldosteronconcentraties. In onderzoeken met meerdere doses bij hypertensieve patiënten waren er geen klinisch significante veranderingen in elektrolyten (serumkalium of natrium) of in metabole functie (inclusief serumspiegels van cholesterol, triglyceriden, HDL, LDL, glucose of urinezuur).
De antihypertensieve effecten van telmisartan zijn onderzocht in zes placebogecontroleerde klinische onderzoeken met in totaal 1773 patiënten met lichte tot matige hypertensie (diastolische bloeddruk van 95 tot 114 mmHg), van wie 1031 werden behandeld met telmisartan. Na eenmaaldaagse toediening van telmisartan was de omvang van de bloeddrukdaling vanaf baseline na aftrekken van placebo ongeveer (SBP/DBP) 6-8/6 mmHg voor 20 mg, 9-13/6-8 mmHg voor 40 mg en 12 -13/7-8 mmHg voor 80 mg. Grotere doses (tot 160 mg) leken geen verdere verlaging van de bloeddruk te veroorzaken.
De antihypertensieve activiteit begint binnen 3 uur, met een maximale afname van ongeveer 4 weken. Bij doses van 20, 40 en 80 mg bleef het antihypertensieve effect van eenmaal daagse toediening van telmisartan gedurende het volledige dosisinterval van 24 uur behouden.
Bij 30 hypertensieve patiënten met een normale nierfunctie die gedurende 8 weken werden behandeld met telmisartan 80 mg of telmisartan 80 mg in combinatie met hydrochloorthiazide 12,5 mg, waren er geen klinisch significante veranderingen ten opzichte van baseline in de renale bloedstroom, glomerulaire filtratiesnelheid, filtratiefractie, renovasculaire weerstand, of creatinineklaring.
Hydrochloorthiazide
Na orale toediening van hydrochloorthiazide begint de diurese binnen 2 uur, piekt na ongeveer 4 uur en duurt ongeveer 6 tot 12 uur.
Geneesmiddelinteracties
Hydrochloorthiazide
Alcohol, barbituraten of verdovende middelen
Versterking van orthostatische hypotensie kan optreden.
Skeletspierverslappers
Mogelijk verhoogde respons op spierverslappers zoals curare-derivaten.
Corticosteroïden, ACTH
Intensieve uitputting van elektrolyten, met name hypokaliëmie.
Pressoramines (bijv. noradrenaline)
Mogelijk verminderde respons op pressoramines, maar niet voldoende om het gebruik ervan uit te sluiten.
Farmacokinetiek
Telmisartan
Absorptie:
Na orale toediening worden de piekconcentraties (Cmax) van telmisartan 0,5 tot 1 uur na toediening bereikt. Voedsel vermindert de biologische beschikbaarheid van telmisartan enigszins, met een afname van het gebied onder de plasmaconcentratie-tijdcurve (AUC) van ongeveer 6% bij 40 mg en ongeveer 20% na een dosis van 160 mg. MICARDIS 20 mg HCT kan met of zonder voedsel worden toegediend. De absolute biologische beschikbaarheid van telmisartan is dosisafhankelijk. Bij 40 en 160 mg was de biologische beschikbaarheid respectievelijk 42% en 58%. De farmacokinetiek van telmisartan met oraal toegediende MICARDIS 20 mg is niet-lineair over het dosisbereik van 20 tot 160 mg, met meer dan proportionele stijgingen van de plasmaconcentraties (Cmax en AUC) met toenemende doses. Telmisartan vertoont bi-exponentiële vervalkinetiek met een terminale eliminatiehalfwaardetijd van ongeveer 24 uur. Dalplasmaconcentraties van telmisartan bij eenmaal daagse dosering zijn ongeveer 10% tot 25% van de piekplasmaconcentraties. Telmisartan heeft een accumulatie-index in plasma van 1,5 tot 2,0 bij herhaalde eenmaaldaagse dosering.
Verdeling:
Telmisartan is sterk gebonden aan plasma-eiwitten (>99,5%), voornamelijk albumine en α1-zuurglycoproteïne. De plasma-eiwitbinding is constant over het concentratiebereik dat wordt bereikt met de aanbevolen doses. Het distributievolume van telmisartan is ongeveer 500 liter, wat wijst op extra weefselbinding.
Metabolisme:
Telmisartan wordt gemetaboliseerd door conjugatie om een farmacologisch inactief acylglucuronide te vormen; de glucuronide van de moederverbinding is de enige metaboliet die is geïdentificeerd in humaan plasma en urine. Na een enkele dosis vertegenwoordigt de glucuronide ongeveer 11% van de gemeten radioactiviteit in plasma. De cytochroom P450 iso-enzymen zijn niet betrokken bij het metabolisme van telmisartan.
Eliminatie:
Na intraveneuze of orale toediening van 14C-gelabeld telmisartan werd het grootste deel van de toegediende dosis (>97%) onveranderd via de gal uitgescheiden in de feces; in de urine werden slechts minieme hoeveelheden gevonden (respectievelijk 0,91% en 0,49% van de totale radioactiviteit).
De totale plasmaklaring van telmisartan is >800 ml/min. De terminale halfwaardetijd en totale klaring lijken onafhankelijk te zijn van de dosis.
Hydrochloorthiazide
Hydrochloorthiazide wordt niet gemetaboliseerd maar wordt snel door de nieren uitgescheiden. Wanneer plasmaspiegels gedurende ten minste 24 uur zijn gevolgd, is waargenomen dat de plasmahalfwaardetijd varieert tussen 5,6 en 14,8 uur. Ten minste 61% van de orale dosis wordt binnen 24 uur onveranderd uitgescheiden.
Hydrochloorthiazide passeert de placenta, maar niet de bloed-hersenbarrière en wordt uitgescheiden in de moedermelk.
Specifieke populaties
Telmisartan
Nierinsufficiëntie
Telmisartan wordt niet door hemofiltratie uit het bloed verwijderd [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en Gebruik bij specifieke populaties ].
Leverinsufficiëntie
Bij patiënten met leverinsufficiëntie zijn de plasmaconcentraties van telmisartan verhoogd en de absolute biologische beschikbaarheid benadert 100% [zie Gebruik bij specifieke populaties ].
Geslacht
De plasmaconcentraties van telmisartan zijn over het algemeen 2 tot 3 keer hoger bij vrouwen dan bij mannen. In klinische onderzoeken werden bij vrouwen echter geen significante verhogingen van de bloeddrukrespons of de incidentie van orthostatische hypotensie gevonden. Er is geen dosisaanpassing nodig.
Geriatrische patiënten
De farmacokinetiek van telmisartan verschilt niet tussen ouderen en personen jonger dan 65 jaar.
Geneesmiddelinteractiestudies
Telmisartan
Ramipril
Gelijktijdige toediening van telmisartan 80 mg eenmaal daags en ramipril 10 mg eenmaal daags aan gezonde proefpersonen verhoogt de steady-state Cmax en AUC van ramipril respectievelijk 2,3- en 2,1-voudig, en Cmax en AUC van ramiprilaat respectievelijk 2,4- en 1,5-voudig . Daarentegen nemen de Cmax en AUC van telmisartan af met respectievelijk 31% en 16%. Bij gelijktijdige toediening van telmisartan en ramipril kan de respons groter zijn vanwege de mogelijk additieve farmacodynamische effecten van de gecombineerde geneesmiddelen, en ook vanwege de verhoogde blootstelling aan ramipril en ramiprilaat in aanwezigheid van telmisartan.
Andere medicijnen
Gelijktijdige toediening van telmisartan resulteerde niet in een klinisch significante interactie met paracetamol, amlodipine, glyburide, simvastatine, hydrochloorthiazide, warfarine of ibuprofen. Telmisartan wordt niet gemetaboliseerd door het cytochroom P450-systeem en had in vitro geen effecten op cytochroom P450-enzymen, behalve enige remming van CYP2C19. Er wordt niet verwacht dat telmisartan een interactie aangaat met geneesmiddelen die cytochroom P450-enzymen remmen; er wordt ook geen interactie verwacht met geneesmiddelen die worden gemetaboliseerd door cytochroom P450-enzymen, behalve voor mogelijke remming van het metabolisme van geneesmiddelen die worden gemetaboliseerd door CYP2C19.
Klinische studies
Telmisartan en hydrochloorthiazide
In gecontroleerde klinische onderzoeken met meer dan 2500 hypertensieve patiënten werden 1017 patiënten blootgesteld aan telmisartan (20 mg tot 160 mg) en gelijktijdig hydrochloorthiazide (6,25 mg tot 25 mg). Deze onderzoeken omvatten één factorieel onderzoek (onderzoek 1) met combinaties van telmisartan (20 mg, 40 mg, 80 mg, 160 mg of placebo) en hydrochloorthiazide (6,25 mg, 12,5 mg, 25 mg en placebo). In de factoriële studie werden 818 patiënten gerandomiseerd, waaronder 493 (60%) mannen; 596 (73%) niet-zwart en 222 (27%) zwarten; en 143 (18%) ≥65 jaar (mediane leeftijd was 53 jaar). De gemiddelde liggende bloeddruk bij baseline voor de totale populatie was 154/101 mmHg.
De combinatie van telmisartan en hydrochloorthiazide resulteerde in additieve, placebo-gecorrigeerde verlagingen van de systolische en diastolische bloeddruk bij dalwaarden van 16-21/9-11 mmHg voor doses tussen 40 mg/12,5 mg en 80 mg/25 mg, vergeleken met 9-13 /7-8 mmHg voor telmisartan 40 mg tot 80 mg monotherapie en 4/4 mmHg voor hydrochloorthiazide 12,5 mg monotherapie. Het antihypertensieve effect was onafhankelijk van leeftijd of geslacht. Er was in wezen geen verandering in de hartslag bij patiënten die werden behandeld met de combinatie van telmisartan en hydrochloorthiazide in de placebogecontroleerde studie.
Vier andere onderzoeken bij hypertensieve patiënten met een duur van ten minste zes maanden maakten de toevoeging van hydrochloorthiazide mogelijk voor patiënten die ofwel niet voldoende onder controle waren met de gerandomiseerde dosis telmisartan als monotherapie of die geen adequate bloeddrukrespons hadden bereikt na voltooiing van de optitratie van telmisartan. In actief gecontroleerde onderzoeken zorgde de toevoeging van 12,5 mg hydrochloorthiazide aan getitreerde doses telmisartan bij patiënten die geen adequate respons bereikten of behouden met telmisartan als monotherapie, voor een verdere verlaging van de systolische en diastolische bloeddruk.
PATIËNT INFORMATIE
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan en hydrochloorthiazide) Tabletten
Lees deze patiënteninformatie voordat u begint met het innemen van MICARDIS HCT-tabletten en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of uw behandeling.
Wat is de belangrijkste informatie die ik moet weten over MICARDIS 20 mg HCT-tabletten?
MICARDIS HCT kan een ongeboren baby schaden of overlijden. Praat met uw arts over andere manieren om uw bloeddruk te verlagen als u van plan bent zwanger te worden. Als u zwanger wordt terwijl u MICARDIS 20 mg HCT gebruikt, vertel dit dan onmiddellijk aan uw arts.
Wat is MICARDIS HCT?
MICARDIS 40 mg HCT is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van hoge bloeddruk (hypertensie).
MICARDIS 40 mg HCT bevat:
- telmisartan, een angiotensinereceptorblokker (ARB)
- hydrochloorthiazide, een waterpil of diureticum
Uw arts kan u andere geneesmiddelen voorschrijven die u samen met MICARDIS 80 mg HCT kunt gebruiken om uw hoge bloeddruk te behandelen.
Het is niet bekend of MICARDIS 40 mg HCT veilig en effectief is bij kinderen.
Gebruik MICARDIS 20 mg HCT-tabletten niet als u:
- lage of geen urineproductie hebben
- allergisch (overgevoelig) bent voor de werkzame bestanddelen (telmisartan of hydrochloorthiazide) of voor één van de andere bestanddelen die aan het einde van deze bijsluiter worden vermeld
Wat moet ik mijn arts vertellen voordat ik MICARDIS 40 mg HCT-tabletten gebruik?
Vertel uw arts voordat u MICARDIS 20 mg HCT-tabletten inneemt als u:
- zwanger bent of van plan bent zwanger te worden. Zien "Wat is de belangrijkste informatie die ik moet weten over MICARDIS 20 mg HCT-tabletten?"
- borstvoeding geeft of van plan bent borstvoeding te geven. MICARDIS 80 mg HCT kan in de moedermelk terechtkomen en kan schadelijk zijn voor uw baby. U moet samen met uw arts beslissen of u MICARDIS HCT gaat gebruiken of borstvoeding geeft. Je moet niet allebei doen. Praat met uw arts over de beste manier om uw baby te voeden als u MICARDIS HCT-tabletten gebruikt.
- is verteld dat u abnormale hoeveelheden lichaamszout (elektrolyten) in uw bloed heeft
- leverproblemen hebben
- astma of een voorgeschiedenis van astma heeft
- lupus hebben
- diabetes hebben
- nierproblemen hebben
- andere medische aandoeningen heeft
Vertel uw arts over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Vertel het uw arts ook als u alcohol drinkt.
MICARDIS 20 mg HCT kan de manier waarop andere geneesmiddelen werken beïnvloeden, en andere geneesmiddelen kunnen de werking van MICARDIS 20 mg HCT beïnvloeden. Vertel het uw arts vooral als u:
- aliskiren
- digoxine (Lanoxin®)
- lithium (Lithobid®, lithiumcarbonaat, lithiumcitraat)
- andere geneesmiddelen die worden gebruikt om uw hoge bloeddruk of een hartprobleem te behandelen
- plaspillen (diureticum)
- aspirine of andere niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)
- kaliumsupplementen of een zoutvervanger die kalium bevat
- geneesmiddel voor de behandeling van diabetes, waaronder insuline
- verdovende pijnstillers
- slaappillen
- steroïde medicijnen of adrenocorticotroop hormoon (ACTH)
- barbituraten
- bepaalde cholesterolverlagende geneesmiddelen (harsen die worden gebruikt voor cholesterolverlaging, bijv. colestyramine en colestipolharsen)
Vraag uw arts als u niet zeker weet of u een van de hierboven genoemde geneesmiddelen gebruikt.
Weet welke medicijnen u gebruikt. Houd er een lijst van bij en laat deze aan uw arts of apotheker zien als u een nieuw geneesmiddel krijgt.
Hoe moet ik MICARDIS HCT-tabletten innemen?
- Neem MICARDIS 40 mg HCT-tabletten precies in zoals uw arts u heeft verteld.
- Uw arts zal u vertellen hoeveel MICARDIS HCT u moet innemen en wanneer u het moet innemen.
- Verander uw dosis niet tenzij uw arts u dat zegt.
- Neem MICARDIS HCT eenmaal per dag in.
- Neem MICARDIS 20 mg HCT-tabletten met of zonder voedsel.
- Als u te veel MICARDIS HCT heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ga naar de dichtstbijzijnde eerstehulpafdeling van het ziekenhuis.
- Lees de “Hoe de blister te openen” aan het einde van deze bijsluiter voordat u MICARDIS 20 mg HCT gebruikt. Praat met uw arts als u de instructies niet begrijpt.
Wat zijn de mogelijke bijwerkingen van MICARDIS 80 mg HCT-tabletten?
MICARDIS 20 mg HCT-tabletten kunnen ernstige bijwerkingen veroorzaken, waaronder:
- Letsel of overlijden van uw ongeboren baby. Zien "Wat is de belangrijkste informatie die ik moet weten over MICARDIS HCT-tabletten?"
- Lage bloeddruk (hypotens-ion) is het meest waarschijnlijk als u ook:
- plaspillen nemen (diuretica)
- zijn op een zoutarm dieet
- dialysebehandelingen krijgen
- hartproblemen hebben
- ziek worden met braken of diarree
- drink niet genoeg vloeistoffen
- veel zweten
- Nierproblemen , die erger kan worden als u al een nierziekte heeft. Mogelijk heeft u veranderingen in de resultaten van uw niertest en heeft u mogelijk een lagere dosis MICARDIS 40 mg HCT-tabletten nodig. Bel uw arts als u:
- zwelling in uw voeten, enkels of handen
- onverklaarbare gewichtstoename
- Lever problemen, die erger kan worden bij mensen die al leverproblemen hebben en MICARDIS 40 mg HCT gebruiken.
- Oog problemen. Een van de geneesmiddelen in MICARDIS HCT kan oogproblemen veroorzaken die kunnen leiden tot verlies van het gezichtsvermogen. Symptomen van oogproblemen kunnen optreden binnen enkele uren tot weken na het starten van MICARDIS
HCT. Vertel het uw arts meteen als u:
- vermindering van het gezichtsvermogen
- oogpijn
- Allergische reacties . Vertel het uw arts meteen als u een van deze symptomen krijgt:
- zwelling van het gezicht, de tong, de keel
- moeite met ademhalen
- Verergering van lupus. Vertel het uw arts als uw lupus erger wordt of actief wordt terwijl u MICARDIS 20 mg HCT gebruikt.
- Verandering in het gehalte aan lichaamszouten (elektrolyten) in uw bloed en vochtproblemen. Uw arts kan testen doen om uw bloed te controleren. Bel onmiddellijk uw arts als u:
- droge mond
- dorst
- vermoeidheid
- slaperigheid
- rusteloosheid
- verwardheid
- toevallen
- snelle hartslagen
- zwakheid
- spierpijn of krampen
- zeer lage urineproductie
- misselijkheid of braken
Als u zich zwak of duizelig voelt, ga dan liggen en bel onmiddellijk uw arts.
Bel onmiddellijk uw arts als u een van de hierboven genoemde symptomen krijgt.
De meest voorkomende bijwerkingen van MICARDIS 80 mg HCT-tabletten zijn:
- infecties van de bovenste luchtwegen, waaronder sinuspijn/congestie en keelpijn
- duizeligheid
- zich moe voelen
- griepachtige symptomen
- rugpijn
- diarree
- misselijkheid
Dit zijn niet alle mogelijke bijwerkingen van MICARDIS 20 mg HCT-tabletten. Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik MICARDIS 80 mg HCT-tabletten bewaren?
- Bewaar MICARDIS HCT-tabletten bij kamertemperatuur 20 ° C tot 25 ° C (68 ° F tot 77 ° F).
- Haal MICARDIS 40 mg HCT-tabletten niet uit de blisterverpakking tot vlak voordat u ze inneemt.
Bewaar MICARDIS 80 mg HCT-tabletten en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over MICARDIS 40 mg HCT-tabletten:
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een patiëntenbijsluiter. Gebruik MICARDIS HCT-tabletten niet voor een aandoening waarvoor het niet is voorgeschreven. Geef MICARDIS 20 mg HCT-tabletten niet aan andere mensen, ook niet als ze dezelfde aandoening hebben als u. Het kan hen schaden.
Deze bijsluiter met patiënteninformatie vat de belangrijkste informatie over MICARDIS HCT-tabletten samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw apotheker of arts om informatie vragen over MICARDIS 20 mg HCT-tabletten die zijn geschreven voor gezondheidswerkers.
Scan voor actuele voorschrijfinformatie de onderstaande code of bel Boehringer Ingelheim Pharmaceuticals, Inc. op 1-800-542-6257 of (TTY) 1-800-459-9906.
Wat zijn de ingrediënten in MICARDIS 20 mg HCT-tabletten?
Actieve ingrediënten: telmisartan en hydrochloorthiazide
Inactieve ingrediënten: natriumhydroxide, meglumine, povidon, sorbitol, magnesiumstearaat, lactosemonohydraat, microkristallijne cellulose, maïszetmeel en natriumzetmeelglycolaat
De tabletten van 40 mg/12,5 mg en 80 mg/12,5 mg bevatten ook: rood ijzeroxide.
De 80 mg/25 mg tabletten bevatten ook: geel ijzeroxide.
Wat is hoge bloeddruk (hypertensie)?
Bloeddruk is de kracht in uw bloedvaten wanneer uw hart klopt en wanneer uw hart rust. Je hebt een hoge bloeddruk als de kracht te veel is. Geneesmiddelen die uw bloeddruk verlagen, verlagen uw kans op een beroerte of een hartaanval.
Hoge bloeddruk zorgt ervoor dat het hart harder moet werken om bloed door het lichaam te pompen en veroorzaakt schade aan de bloedvaten. MICARDIS 80 mg HCT-tabletten kunnen uw bloedvaten helpen ontspannen, zodat uw bloeddruk lager wordt.
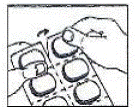
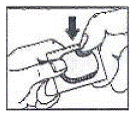
Hoe de blister te openen:
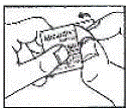
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
