Cardizem 30mg, 60mg, 90mg, 120mg, 180mg Diltiazem Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Cardizem 120 mg en hoe wordt het gebruikt?
Cardizem is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van pijn op de borst (angina pectoris), hoge bloeddruk (hypertensie), evenals bepaalde hartritmestoornissen zoals gevaarlijk snelle hartslagen (paroxysmale supraventriculaire tachycardie) en atriale fibrillatie/flutter. Cardizem kan alleen of in combinatie met andere medicijnen worden gebruikt.
Cardizem behoort tot een klasse geneesmiddelen genaamd Antidysrhythmics, IV; Calciumkanaalblokkers; Calciumkanaalblokkers, niet-dihydropyridine.
Wat zijn de mogelijke bijwerkingen van Cardizem 120 mg?
Cardizem kan ernstige bijwerkingen veroorzaken, waaronder:
- pijn op de borst,
- trage hartslagen,
- bonzende hartslagen of fladderen in uw borst,
- duizeligheid,
- zwelling,
- snelle gewichtstoename, en
- kortademig voelen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Cardizem zijn:
- zwelling,
- duizeligheid,
- zwakheid,
- hoofdpijn,
- misselijkheid, en
- uitslag
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Cardizem. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
CARDIZEM® (diltiazemhydrochloride) is een cellulaire influxremmer van calciumionen (slow channel blocker of calciumantagonist). Chemisch gezien is diltiazemhydrochloride 1,5-Benzothiazepin-4(5H)-on, 3-(acetyloxy)-5-[2-(dimethylamino)ethyl]-2,3-dihydro-2-(4-methoxyfenyl)-, monohydrochloride,(+)-cis-. De chemische structuur is:
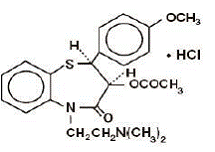
Diltiazemhydrochloride is een wit tot gebroken wit kristallijn poeder met een bittere smaak. Het is oplosbaar in water, methanol en chloroform. Het heeft een molecuulgewicht van 450,98. Elke tablet CARDIZEM 60 mg bevat 30 mg, 60 mg, 90 mg of 120 mg diltiazemhydrochloride.
Bevat ook: colloïdaal siliciumdioxide, D&C Yellow #10 Aluminium Lake, FD&C Blue #1 Aluminium Lake (30 mg en 90 mg), FD&C Yellow #6 Aluminium Lake (60 mg en 120 mg), hydroxypropylcellulose, hypromellose, lactose, magnesium stearaat, methylparaben, microkristallijne cellulose en polyethyleenglycol.
Voor orale toediening.
INDICATIES
CARDIZEM 120 mg is geïndiceerd voor de behandeling van chronische stabiele angina en angina als gevolg van coronaire arteriële spasmen.
DOSERING EN ADMINISTRATIE
Inspanningsangina pectoris als gevolg van atherosclerotische coronaire hartziekte of angina pectoris in rust als gevolg van coronaire hartspasmen
De dosering moet worden aangepast aan de behoeften van elke patiënt. Beginnend met viermaal daags 30 mg, vóór de maaltijd en voor het slapengaan, moet de dosering geleidelijk worden verhoogd (in verdeelde doses drie- of viermaal daags) met tussenpozen van 1 tot 2 dagen totdat een optimale respons is verkregen. Hoewel individuele patiënten op elk doseringsniveau kunnen reageren, lijkt het gemiddelde optimale doseringsbereik 180 tot 360 mg/dag te zijn. Er zijn geen gegevens beschikbaar over de doseringsvereisten bij patiënten met een verminderde nier- of leverfunctie. Als het geneesmiddel bij dergelijke patiënten moet worden gebruikt, moet de titratie met bijzondere voorzichtigheid worden uitgevoerd.
Gelijktijdig gebruik met andere cardiovasculaire middelen
Slik Cardizem-tabletten heel door; de tabletten niet splitsen, pletten of kauwen.
HOE GELEVERD
CARDIZEM 30 mg tabletten worden geleverd in flessen van 100 ( NDC 0187-0771-47) en 500 ( NDC 0187-0771-55). Elke lichtgroene, ronde tablet is aan de ene kant gegraveerd met MARION en aan de andere kant 1771.
CARDIZEM 60 mg tabletten met breukgleuf worden geleverd in flessen van 100 ( NDC 0187-0772-47). Elke lichtgele, ronde tablet is aan de ene kant gegraveerd met MARION en aan de andere kant 1772.
CARDIZEM 90 mg tabletten met breukgleuf worden geleverd in flessen van 100 ( NDC 0187-0791-47). Elke groene, langwerpige tablet is aan de ene kant gegraveerd met CARDIZEM en aan de andere kant met 90 mg.
CARDIZEM 120 mg tabletten met breukgleuf worden geleverd in flessen van 100 ( NDC 0187-0792-47). Elke lichtgele, capsulevormige tablet is aan de ene kant gegraveerd met CARDIZEM en aan de andere kant met 120 mg.
Bewaren bij 25°C (77°); excursies toegestaan tot 15-30°C (59-86°) [zie USP-gecontroleerde kamertemperatuur ].
Vermijd overmatige vochtigheid.
Gedistribueerd door: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 VS. Gemaakt in Canada. Beoordeeld. 11/14
BIJWERKINGEN
Ernstige bijwerkingen zijn zeldzaam in onderzoeken die tot nu toe zijn uitgevoerd, maar het moet worden erkend dat patiënten met een gestoorde ventriculaire functie en hartgeleidingsstoornissen gewoonlijk zijn uitgesloten.
In binnenlandse placebogecontroleerde angina-onderzoeken was de incidentie van bijwerkingen gemeld tijdens CARDIZEM-therapie niet groter dan die gemeld tijdens placebotherapie.
Het volgende geeft de voorvallen weer die zijn waargenomen in klinische onderzoeken bij anginapatiënten. In veel gevallen is de relatie met CARDIZEM niet vastgesteld. De meest voorkomende voorvallen van deze onderzoeken, evenals de frequentie van presentatie, zijn oedeem (2,4%), hoofdpijn (2,1%), misselijkheid (1,9%), duizeligheid (1,5%), huiduitslag (1,3%) en asthenie (1,2 %). Bovendien werden de volgende voorvallen niet vaak gemeld (minder dan 1 %):
Cardiovasculair
Angina, aritmie, AV-blok (eerste graad), AV-blok (tweede of derde graad – zie .) WAARSCHUWINGEN , Hartgeleiding ), bradycardie, bundeltakblok, congestief hartfalen, ECG-afwijking, blozen, hypotensie, hartkloppingen, syncope, tachycardie, ventriculaire extrasystolen.
Zenuwstelsel
Abnormale dromen, geheugenverlies, depressie, abnormale gang, hallucinaties, slapeloosheid, nervositeit, paresthesie, persoonlijkheidsverandering, slaperigheid, tremor.
gastro-intestinaal
Anorexia, constipatie, diarree, dysgeusie, dyspepsie, lichte verhogingen van alkalische fosfatase, SGOT, SGPT en LDH (zie WAARSCHUWINGEN , Acuut leverletsel ), dorst, braken, gewichtstoename.
Dermatologisch
Petechiën, lichtgevoeligheid, pruritus, urticaria.
Ander
Amblyopie, CPK-verhoging, droge mond, dyspneu, epistaxis, oogirritatie, hyperglykemie, hyperurikemie, impotentie, spierkrampen, verstopte neus, nocturie, osteoarticulaire pijn, polyurie, seksuele problemen, tinnitus.
De volgende postmarketinggebeurtenissen zijn niet vaak gemeld bij patiënten die CARDIZEM kregen: acute gegeneraliseerde exanthemateuze pustulose, allergische reacties, alopecia, angio-oedeem (inclusief gezichts- of periorbitaal oedeem), asystolie, erythema multiforme (inclusief Stevens-Johnson-syndroom, toxische epidermale necrolyse), extrapiramidale symptomen , gingivale hyperplasie, hemolytische anemie, verhoogde bloedingstijd, leukopenie, fotosensitiviteit (inclusief lichenoïde keratose en hyperpigmentatie op aan de zon blootgestelde huidgebieden), purpura, retinopathie, myopathie en trombocytopenie. Er zijn gevallen waargenomen van gegeneraliseerde huiduitslag, sommige gekarakteriseerd als leukocytoclastische vasculitis. Bovendien zijn voorvallen zoals een myocardinfarct waargenomen, die bij deze patiënten niet gemakkelijk te onderscheiden zijn van het natuurlijke beloop van de ziekte. Een definitieve oorzaak en gevolg relatie tussen deze gebeurtenissen en CARDIZEM therapie kan nog niet worden vastgesteld. Exfoliatieve dermatitis (bewezen door hernieuwde behandeling) is ook gemeld.
DRUG-INTERACTIES
Vanwege de mogelijkheid van additieve effecten is voorzichtigheid en zorgvuldige titratie geboden bij patiënten die CARDIZEM 180 mg gelijktijdig krijgen met middelen waarvan bekend is dat ze de cardiale contractiliteit en/of geleiding beïnvloeden (zie WAARSCHUWINGEN ).
Farmacologische onderzoeken geven aan dat er additieve effecten kunnen zijn bij het verlengen van de AV-geleiding bij gelijktijdig gebruik van bètablokkers of digitalis met CARDIZEM (zie WAARSCHUWINGEN ).
Zoals bij alle geneesmiddelen, moet voorzichtigheid worden betracht bij de behandeling van patiënten met meerdere medicijnen. Diltiazem is zowel een substraat als een remmer van het cytochroom P-450 3A4-enzymsysteem. Andere geneesmiddelen die specifieke substraten, remmers of inductoren van dit enzymsysteem zijn, kunnen een significante invloed hebben op de werkzaamheid en het bijwerkingenprofiel van diltiazem. Patiënten die andere geneesmiddelen gebruiken die substraten zijn van CYP450 3A4, vooral patiënten met nier- en/of leverinsufficiëntie, kunnen dosisaanpassing nodig hebben bij het starten of stoppen met gelijktijdige toediening van diltiazem om optimale therapeutische bloedspiegels te behouden.
verdoving
De verlaging van de contractiliteit, geleidbaarheid en automatisme van het hart, evenals de vasculaire dilatatie die gepaard gaat met anesthetica, kan worden versterkt door calciumkanaalblokkers. Bij gelijktijdig gebruik moeten anesthetica en calciumblokkers zorgvuldig worden getitreerd.
Benzodiazepinen
Studies toonden aan dat diltiazem de AUC van midazolam en triazolam met een factor 3 tot 4 verhoogde en de Cmax met een factor 2, vergeleken met placebo. De eliminatiehalfwaardetijd van midazolam en triazolam nam ook toe (1,5 tot 2,5 keer) bij gelijktijdige toediening met diltiazem. Deze farmacokinetische effecten die worden waargenomen bij gelijktijdige toediening van diltiazem kunnen leiden tot verhoogde klinische effecten (bijv. langdurige sedatie) van zowel midazolam als triazolam.
Bètablokkers
Gecontroleerde en ongecontroleerde onderzoeken in huis suggereren dat gelijktijdig gebruik van CARDIZEM 180 mg en bètablokkers gewoonlijk goed wordt verdragen. De beschikbare gegevens zijn echter niet voldoende om de effecten van gelijktijdige behandeling te voorspellen, met name bij patiënten met linkerventrikeldisfunctie of hartgeleidingsstoornissen.
Toediening van CARDIZEM (diltiazemhydrochloride) gelijktijdig met propranolol bij vijf normale vrijwilligers resulteerde in verhoogde propranololspiegels bij alle proefpersonen en de biologische beschikbaarheid van propranolol nam met ongeveer 50% toe. In vitro lijkt propranolol door diltiazem van zijn bindingsplaatsen te worden verdrongen. Als combinatietherapie wordt gestart of stopgezet in combinatie met propranolol, kan een aanpassing van de propranololdosis gerechtvaardigd zijn (zie WAARSCHUWINGEN ).
buspiron
Bij negen gezonde proefpersonen verhoogde diltiazem significant de gemiddelde buspiron AUC 5,5-voudig en Cmax 4,1-voudig in vergelijking met placebo. De T½ en Tmax van buspiron werden niet significant beïnvloed door diltiazem. Verhoogde effecten en verhoogde toxiciteit van buspiron kunnen mogelijk zijn bij gelijktijdige toediening met diltiazem. Daaropvolgende dosisaanpassingen kunnen nodig zijn tijdens gelijktijdige toediening en moeten gebaseerd zijn op klinische beoordeling.

Carbamazepine
Er is gemeld dat gelijktijdige toediening van diltiazem met carbamazepine leidt tot verhoogde serumspiegels van carbamazepine (toename van 40% tot 72%), wat in sommige gevallen tot toxiciteit leidt. Patiënten die deze geneesmiddelen gelijktijdig krijgen, moeten worden gecontroleerd op een mogelijke geneesmiddelinteractie.
cimetidine
Een onderzoek bij zes gezonde vrijwilligers heeft een significante toename aangetoond van de piekplasmaspiegels van diltiazem (58%) en de oppervlakte onder de curve (53%) na een kuur van 1 week met cimetidine van 1200 mg per dag en een enkele dosis van diltiazem 60 mg. Ranitidine veroorzaakte kleinere, niet-significante stijgingen. Het effect kan worden gemedieerd door de bekende remming door cimetidine van hepatisch cytochroom P-450, het enzymsysteem dat verantwoordelijk is voor het first-pass-metabolisme van diltiazem. Patiënten die momenteel met diltiazem worden behandeld, moeten zorgvuldig worden gecontroleerd op een verandering in het farmacologische effect bij het starten en stoppen van de behandeling met cimetidine. Een aanpassing van de dosis diltiazem kan gerechtvaardigd zijn.
Clonidine
Sinusbradycardie resulterend in ziekenhuisopname en het inbrengen van een pacemaker is gemeld in verband met het gelijktijdig gebruik van clonidine met diltiazem. Controleer de hartslag bij patiënten die gelijktijdig diltiazem en clonidine krijgen.
Cyclosporine
Een farmacokinetische interactie tussen diltiazem en ciclosporine is waargenomen tijdens onderzoeken met nier- en harttransplantatiepatiënten. Bij nier- en harttransplantatiepatiënten was een verlaging van de daldosis van ciclosporine van 15% tot 48% nodig om de concentraties vergelijkbaar te houden met die voorafgaand aan de toevoeging van diltiazem. Als deze middelen gelijktijdig moeten worden toegediend, moeten de ciclosporineconcentraties worden gecontroleerd, vooral wanneer de behandeling met diltiazem wordt gestart, aangepast of stopgezet. Het effect van ciclosporine op de plasmaconcentraties van diltiazem is niet onderzocht.
Digitalis
Toediening van CARDIZEM 180 mg met digoxine bij 24 gezonde mannelijke proefpersonen verhoogde de plasmaconcentraties van digoxine met ongeveer 20%. Een andere onderzoeker vond geen verhoging van de digoxinespiegels bij 12 patiënten met coronaire hartziekte. Aangezien er tegenstrijdige resultaten zijn met betrekking tot het effect van digoxinespiegels, wordt aanbevolen de digoxinespiegels te controleren bij het starten, aanpassen en beëindigen van de behandeling met CARDIZEM 60 mg om mogelijke over- of onderdigitalisering te voorkomen (zie WAARSCHUWINGEN ).
kinidine
Diltiazem verhoogt de AUC (0→infin;) van kinidine significant met 51%, T½ met 36% en verlaagt de CLoraal met 33%. Controle op bijwerkingen van kinidine kan nodig zijn en de dosis moet dienovereenkomstig worden aangepast.
rifampicijn
Gelijktijdige toediening van rifampicine met diltiazem verlaagde de plasmaconcentraties van diltiazem tot ondetecteerbare niveaus. Gelijktijdige toediening van diltiazem met rifampicine of een bekende CYP3A4-inductor moet indien mogelijk worden vermeden en een alternatieve therapie moet worden overwogen.
statines
Diltiazem is een remmer van CYP3A4 en er is aangetoond dat het de AUC van sommige statines significant verhoogt. Het risico op myopathie en rabdomyolyse met statines die door CYP3A4 worden gemetaboliseerd, kan toenemen bij gelijktijdig gebruik van diltiazem. Gebruik indien mogelijk een niet-CYP3A4-gemetaboliseerde statine samen met diltiazem; anders moeten dosisaanpassingen voor zowel diltiazem als de statine worden overwogen, samen met nauwlettende controle op tekenen en symptomen van statinegerelateerde bijwerkingen.
In een cross-over onderzoek met gezonde vrijwilligers (N=10) resulteerde gelijktijdige toediening van een enkelvoudige dosis van 20 mg simvastatine aan het einde van een 14-daags regime met 120 mg tweemaal daags diltiazem SR in een 5-voudige verhoging van de gemiddelde AUC van simvastatine. versus simvastatine alleen. Proefpersonen met een verhoogde gemiddelde steady-state blootstelling aan diltiazem vertoonden een meervoudige toename van de blootstelling aan simvastatine. Computergebaseerde simulaties toonden aan dat bij een dagelijkse dosis van 480 mg diltiazem een 8- tot 9-voudige toename van de AUC van simvastatine kan worden verwacht. Als gelijktijdige toediening van simvastatine met diltiazem nodig is, beperk dan de dagelijkse doses simvastatine tot 10 mg en diltiazem tot 240 mg.
In een gerandomiseerde, open-label, 4-weg cross-over studie met tien proefpersonen resulteerde gelijktijdige toediening van diltiazem (120 mg BID diltiazem SR gedurende 2 weken) met een enkelvoudige dosis van 20 mg lovastatine in een 3- tot 4-voudige verhoging in gemiddelde lovastatine AUC en Cmax versus lovastatine alleen. In hetzelfde onderzoek was er geen significante verandering in de AUC en Cmax van een enkelvoudige dosis van 20 mg pravastatine tijdens gelijktijdige toediening van diltiazem. De plasmaspiegels van diltiazem werden niet significant beïnvloed door lovastatine of pravastatine.
WAARSCHUWINGEN
PREVENTIEVE MAATREGELEN
Algemeen
CARDIZEM (diltiazemhydrochloride) wordt uitgebreid gemetaboliseerd door de lever en uitgescheiden door de nieren en in de gal. Zoals bij elk geneesmiddel dat gedurende langere perioden wordt toegediend, moeten de laboratoriumparameters van de nier- en leverfunctie met regelmatige tussenpozen worden gecontroleerd. Het geneesmiddel moet met voorzichtigheid worden gebruikt bij patiënten met een verminderde nier- of leverfunctie. In subacute en chronische onderzoeken bij honden en ratten die waren opgezet om toxiciteit te veroorzaken, werden hoge doses diltiazem in verband gebracht met leverbeschadiging. In speciale subacute leverstudies werden orale doses van 125 mg/kg en hoger bij ratten geassocieerd met histologische veranderingen in de lever, die reversibel waren toen het geneesmiddel werd stopgezet. Bij honden werden doses van 20 mg/kg ook in verband gebracht met leververanderingen; deze veranderingen waren echter omkeerbaar bij voortgezette dosering. Dermatologische gebeurtenissen (zie ONGEWENSTE REACTIES kan van voorbijgaande aard zijn en kan verdwijnen ondanks voortgezet gebruik van CARDIZEM. Er zijn echter ook zelden huiderupties gemeld die zich ontwikkelen tot erythema multiforme en/of exfoliatieve dermatitis. Als een dermatologische reactie aanhoudt, moet het medicijn worden stopgezet.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Een studie van 24 maanden bij ratten en een studie van 21 maanden bij muizen toonden geen bewijs van carcinogeniteit. Er was ook geen mutagene respons in in vitro bacteriële tests. Er werd geen intrinsiek effect op de vruchtbaarheid waargenomen bij ratten.
Zwangerschap
Categorie C
Er zijn reproductieonderzoeken uitgevoerd bij muizen, ratten en konijnen. Toediening van doses variërend van vijf tot tien keer hoger (op basis van mg/kg) dan de dagelijks aanbevolen therapeutische dosis heeft geleid tot embryonale en foetale letaliteit. Van deze doses is in sommige onderzoeken gemeld dat ze skeletafwijkingen veroorzaken. In de perinatale/postnatale onderzoeken was er enige afname in het vroege gewicht van de individuele pups en de overlevingspercentages. Er was een verhoogde incidentie van doodgeboorten bij doses van 20 maal de dosis voor de mens of hoger.
Er zijn geen goed gecontroleerde onderzoeken bij zwangere vrouwen; gebruik daarom CARDIZEM bij zwangere vrouwen alleen als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Moeders die borstvoeding geven
Diltiazem wordt uitgescheiden in de moedermelk. Eén rapport suggereert dat concentraties in moedermelk de serumspiegels kunnen benaderen. Als het gebruik van CARDIZEM essentieel wordt geacht, moet een alternatieve methode voor zuigelingenvoeding worden ingesteld.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met diltiazem omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
OVERDOSERING
De orale LD50's bij muizen en ratten variëren van respectievelijk 415 tot 740 mg/kg en van 560 tot 810 mg/kg. De intraveneuze LD50's bij deze soorten waren respectievelijk 60 en 38 mg/kg. De orale LD50 bij honden wordt geacht hoger te zijn dan 50 mg/kg, terwijl letaliteit bij apen werd waargenomen bij 360 mg/kg.
De toxische dosis bij de mens is niet bekend. Als gevolg van een uitgebreid metabolisme kunnen bloedspiegels na een standaarddosis diltiazem meer dan tien keer variëren, waardoor de bruikbaarheid van bloedspiegels in gevallen van overdosering wordt beperkt.
Er zijn meldingen geweest van overdosering met diltiazem in hoeveelheden variërend van
Gebeurtenissen die werden waargenomen na een overdosis diltiazem waren bradycardie, hypotensie, hartblokkade en hartfalen. In de meeste meldingen van overdosering werd een ondersteunende medische maatregel en/of medicamenteuze behandeling beschreven. Bradycardie reageerde vaak gunstig op atropine, net als hartblok, hoewel cardiale stimulatie ook vaak werd gebruikt om hartblok te behandelen. Vloeistoffen en vasopressoren werden gebruikt om de bloeddruk te handhaven en in geval van hartfalen werden inotrope middelen toegediend. Bovendien kregen sommige patiënten een behandeling met beademingsondersteuning, maagspoeling, actieve kool en/of intraveneus calcium.
De effectiviteit van intraveneuze calciumtoediening om de farmacologische effecten van een overdosis diltiazem ongedaan te maken, is inconsistent. In enkele gemelde gevallen werd een overdosis met calciumkanaalblokkers geassocieerd met hypotensie en bradycardie die aanvankelijk ongevoelig was voor atropine, gevoeliger voor atropine nadat de patiënten intraveneus calcium hadden gekregen. In sommige gevallen is intraveneus calcium toegediend (1 g calciumchloride of 3 g calciumgluconaat) gedurende 5 minuten en indien nodig elke 10 tot 20 minuten herhaald. Calciumgluconaat is ook toegediend als een continu infuus met een snelheid van 2 g per uur gedurende 10 uur. Infusies van calcium gedurende 24 uur of langer kunnen nodig zijn. Patiënten moeten worden gecontroleerd op tekenen van hypercalciëmie.
In het geval van een overdosis of een overdreven respons, moeten naast de ontsmetting van het maagdarmkanaal ook passende ondersteunende maatregelen worden genomen. Diltiazem lijkt niet te worden verwijderd door peritoneale of hemodialyse. Beperkte gegevens suggereren dat plasmaferese of houtskoolhemoperfusie de eliminatie van diltiazem na overdosering kan versnellen. Op basis van de bekende farmacologische effecten van diltiazem en/of gerapporteerde klinische ervaringen, kunnen de volgende maatregelen worden overwogen:
Bradycardie: Dien atropine toe (0,60 tot 1,0 mg). Als er geen reactie is op vagale blokkade, dien dan isoproterenol voorzichtig toe.
Hoogwaardig AV-blok: Behandel zoals voor bradycardie hierboven. Een vast hooggradig AV-blok moet worden behandeld met cardiale pacing.
Hartfalen: Dien inotrope middelen (isoproterenol, dopamine of dobutamine) en diuretica toe.
Hypotensie: Vasopressoren (bijv. Dopamine of noradrenaline).
De werkelijke behandeling en dosering moeten afhangen van de ernst van de klinische situatie en het oordeel en de ervaring van de behandelend arts.
CONTRA-INDICATIES
CARDIZEM is gecontra-indiceerd bij (1) patiënten met sick sinus-syndroom behalve in aanwezigheid van een functionerende ventriculaire pacemaker, (2) patiënten met tweede- of derdegraads AV-blok behalve in aanwezigheid van een functionerende ventriculaire pacemaker, (3) patiënten met hypotensie (minder dan 90 mm Hg systolisch), (4) patiënten die overgevoeligheid voor het geneesmiddel hebben aangetoond, en (5) patiënten met een acuut myocardinfarct en pulmonale congestie gedocumenteerd door röntgenfoto's bij opname.
KLINISCHE FARMACOLOGIE
Aangenomen wordt dat de therapeutische voordelen die met CARDIZEM 180 mg worden bereikt, verband houden met het vermogen om de instroom van calciumionen tijdens membraandepolarisatie van hart- en vasculaire gladde spieren te remmen.
Werkingsmechanismen
Hoewel de precieze mechanismen van zijn anti-angineuze werking nog steeds worden afgebakend, wordt aangenomen dat CARDIZEM 120 mg op de volgende manieren werkt:
In diermodellen verstoort diltiazem de langzame binnenwaartse (depolariserende) stroom in prikkelbaar weefsel. Het veroorzaakt een ontkoppeling van excitatie-contractie in verschillende myocardiale weefsels zonder veranderingen in de configuratie van de actiepotentiaal. Diltiazem veroorzaakt ontspanning van de gladde spieren van de kransslagaders en verwijding van zowel de grote als de kleine kransslagaders op geneesmiddelniveaus die weinig of geen negatief inotroop effect veroorzaken. De resulterende verhogingen van de coronaire bloedstroom (epicardiaal en subendocardiaal) treden op in ischemische en niet-ischemische modellen en gaan gepaard met dosisafhankelijke verlagingen van de systemische bloeddruk en verlagingen van de perifere weerstand.
Hemodynamische en elektrofysiologische effecten
Net als andere calciumantagonisten vermindert diltiazem de sinoatriale en atrioventriculaire geleiding in geïsoleerde weefsels en heeft het een negatief inotroop effect in geïsoleerde preparaten. Bij het intacte dier kan bij hogere doses een verlenging van het AH-interval worden waargenomen.
Bij de mens voorkomt diltiazem spontane en door ergonovine veroorzaakte coronaire arteriële spasmen. Het veroorzaakt een afname van de perifere vasculaire weerstand en een bescheiden daling van de bloeddruk, en in inspanningstolerantieonderzoeken bij patiënten met ischemische hartziekte, verlaagt het de hartslag-bloeddrukproduct voor een bepaalde werkbelasting. Studies tot nu toe, voornamelijk bij patiënten met een goede ventriculaire functie, hebben geen bewijs van een negatief inotroop effect opgeleverd; hartminuutvolume, ejectiefractie en linkerventrikel eind-diastolische druk zijn niet beïnvloed. Er zijn nog weinig gegevens over de interactie van diltiazem en bètablokkers. De hartslag in rust is gewoonlijk onveranderd of licht verlaagd door diltiazem.
Intraveneus diltiazem in doses van 20 mg verlengt de AH-geleidingstijd en de functionele en effectieve refractaire perioden van de AV-knoop met ongeveer 20%. In een onderzoek met enkelvoudige orale doses van 300 mg CARDIZEM 60 mg bij zes normale vrijwilligers, was de gemiddelde maximale PR-verlenging 14% zonder gevallen van meer dan eerstegraads AV-blok. Diltiazem-geassocieerde verlenging van het AH-interval is niet meer uitgesproken bij patiënten met een eerstegraads hartblok. Bij patiënten met sick sinus-syndroom verlengt diltiazem de sinuscyclus aanzienlijk (tot 50% in sommige gevallen).
Chronische orale toediening van CARDIZEM in doses tot 240 mg/dag heeft geleid tot een kleine toename van het PR-interval, maar heeft gewoonlijk geen abnormale verlenging veroorzaakt.
Farmacokinetiek en metabolisme
Diltiazem wordt goed geabsorbeerd uit het maagdarmkanaal en is onderhevig aan een uitgebreid first-pass-effect, wat resulteert in een absolute biologische beschikbaarheid (vergeleken met intraveneuze dosering) van ongeveer 40%. CARDIZEM ondergaat een uitgebreid metabolisme waarbij 2% tot 4% van het onveranderde geneesmiddel in de urine verschijnt. In vitro bindingsstudies tonen aan dat CARDIZEM 90 mg voor 70% tot 80% gebonden is aan plasma-eiwitten. Competitieve in vitro ligandbindingsstudies hebben ook aangetoond dat de binding van CARDIZEM 120 mg niet verandert door therapeutische concentraties van digoxine, hydrochloorthiazide, fenylbutazon, propranolol, salicylzuur of warfarine. De plasma-eliminatiehalfwaardetijd na toediening van één of meerdere geneesmiddelen is ongeveer 3,0 tot 4,5 uur. Desacetyldiltiazem is ook aanwezig in het plasma in niveaus van 10% tot 20% van het oorspronkelijke geneesmiddel en is 25% tot 50% zo krachtig als een coronaire vasodilatator als diltiazem. De minimale therapeutische plasmaspiegels van CARDIZEM 120 mg lijken in het bereik van 50 tot 200 ng/ml te liggen. Er is een afwijking van lineariteit wanneer de dosissterkten worden verhoogd. Een studie waarin patiënten met een normale leverfunctie werden vergeleken met patiënten met cirrose, vond een toename van de halfwaardetijd en een toename van 69% van de AUC (oppervlakte-onder-de-plasmaconcentratie versus tijdcurve) bij de patiënten met leverinsufficiëntie. Een enkele studie bij negen patiënten met een ernstige nierfunctiestoornis liet geen verschil zien in het farmacokinetische profiel van diltiazem in vergelijking met patiënten met een normale nierfunctie.
CARDIZEM 120 mg tabletten . Diltiazem wordt geabsorbeerd uit de tabletformulering tot ongeveer 98% van een referentieoplossing. Enkelvoudige orale doses van 30 tot 120 mg CARDIZEM 30 mg tabletten resulteren in detecteerbare plasmaspiegels binnen 30 tot 60 minuten en piekplasmaspiegels 2 tot 4 uur na toediening van het geneesmiddel. Aangezien de dosis CARDIZEM 120 mg tabletten wordt verhoogd van een dagelijkse dosis van 120 mg (30 mg eenmaal daags) naar 240 mg (60 mg eenmaal daags), is er een toename van de oppervlakte onder de curve van 2,3 maal. Wanneer de dosis wordt verhoogd van 240 mg tot 360 mg per dag, is er een toename van de oppervlakte onder de curve van 1,8 maal.
PATIËNT INFORMATIE
Slik Cardizem-tabletten heel door; niet splitsen, pletten of kauwen. Het medicijn in Cardizem 180 mg is zo samengesteld dat het langzaam vrijkomt.
