Rhinocort 100mcg Budesonide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Rhinocort Aqua en hoe wordt het gebruikt?
Rhinocort Aqua (budesonide) neusspray is een steroïde die wordt gebruikt voor de behandeling van neussymptomen zoals congestie, niezen en loopneus veroorzaakt door seizoensgebonden of het hele jaar door allergieën. Rhinocort Aqua neusspray wordt ook gebruikt om te voorkomen dat neuspoliepen terugkeren na chirurgische verwijdering.
Wat zijn bijwerkingen van Rhinocort 100mcg Aqua?
Vaak voorkomende bijwerkingen van Rhinocort Aqua-neusspray zijn:
- droge neus/keel of irritatie,
- keelpijn,
- hoesten,
- niezen,
- neusbloedingen,
- onaangename smaak/geur,
- zweren of witte vlekken in of rond uw neus, of
- pijn, zwelling, branderig gevoel, jeuk of irritatie rond uw neus.
Vertel het uw arts als u zeldzame maar ernstige bijwerkingen heeft van Rhinocort Aqua neusspray, waaronder:
- verlies van smaak of geur, of
- pijn of zweren in uw neus.
OMSCHRIJVING
Budesonide, het werkzame bestanddeel van RHINOCORT AQUA (budesonide) neusspray, is een ontstekingsremmende synthetische corticosteroïde.
Het wordt chemisch aangeduid als (RS)-11-beta, 16-alpha, 17, 21-tetrahydroxypregna-l,4-dieen-3,20-dion cyclisch 16, 17-acetaal met butyraldehyde.
Budesonide wordt geleverd als het mengsel van twee epimeren (22R en 22S).
De empirische formule van budesonide is C25H34O6 en het molecuulgewicht is 430,5.
De structuurformule is:
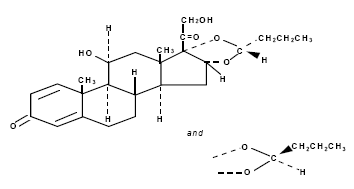
Budesonide is een wit tot gebroken wit, geurloos poeder dat praktisch onoplosbaar is in water en heptaan, matig oplosbaar in ethanol en vrij oplosbaar in chloroform.
De verdelingscoëfficiënt tussen octanol en water bij pH 5 is 1,6 x 103.
RHINOCORT AQUA (budesonide) neusspray is een ongeparfumeerde, gedoseerde, handmatige pompsprayformulering die een gemicroniseerde suspensie van budesonide in een waterig medium bevat. Dit medium bevat microkristallijne cellulose en carboxymethylcellulose-natrium, watervrij dextrose, polysorbaat 80, dinatriumedetaat, kaliumsorbaat en gezuiverd water; zoutzuur wordt toegevoegd om de pH in te stellen op een streefwaarde van 4,5.
RHINOCORT 100mcg AQUA Neusspray levert 32 mcg budesonide per verstuiving.
Elke fles RHINOCORT 100 mcg AQUA (budesonide) neusspray 32 mcg bevat 120 afgemeten sprays na de eerste priming.
Voor het eerste gebruik moet de container voorzichtig worden geschud en moet de pomp worden gevuld door acht keer te bedienen. Bij dagelijks gebruik hoeft de pomp niet opnieuw te worden geprimed. Indien niet gebruikt gedurende twee opeenvolgende dagen, opnieuw vullen met één verstuiving of totdat een fijne verstuiving verschijnt. Indien niet gebruikt voor meer dan 14 dagen, spoel de applicator en vul opnieuw met twee verstuivingen of totdat een fijne verstuiving verschijnt.
INDICATIES
Behandeling van seizoensgebonden of niet-seizoensgebonden allergische rhinitis
RHINOCORT AQUA (budesonide) neusspray is geïndiceerd voor de behandeling van nasale symptomen van seizoensgebonden of niet-seizoensgebonden allergische rhinitis bij volwassenen en kinderen van zes jaar en ouder.
DOSERING EN ADMINISTRATIE
De aanbevolen startdosering voor volwassenen en kinderen van 6 jaar en ouder is 64 mcg per dag, toegediend als één verstuiving per neusgat van RHINOCORT AQUA (budesonide) Neusspray 32 mcg eenmaal daags. Sommige patiënten die de symptomen niet onder controle krijgen bij de aanbevolen startdosering, kunnen baat hebben bij een hogere dosering. De maximale aanbevolen dosering voor volwassenen (12 jaar en ouder) is 256 mcg per dag, toegediend als vier verstuivingen per neusgat eenmaal daags van RHINOCORT AQUA (budesonide) neusspray 32 mcg en de maximale aanbevolen dosis voor pediatrische patiënten (6 tot
Het is altijd wenselijk om een individuele patiënt te titreren tot de minimale effectieve dosering om de kans op bijwerkingen te verminderen. Een verbetering van de neussymptomen kan worden opgemerkt bij patiënten binnen 10 uur na het eerste gebruik van RHINOCORT 100mcg AQUA (budesonide) neusspray, maar klinische verbetering duurt gewoonlijk 1-2 dagen met een maximaal voordeel in ongeveer 2 weken. Wanneer het maximale voordeel is bereikt en de symptomen onder controle zijn, kan het verlagen van de dosering effectief zijn om de symptomen van allergische rhinitis onder controle te houden bij patiënten die aanvankelijk onder controle waren met hogere doseringen.
Voor het eerste gebruik moet de container voorzichtig worden geschud en moet de pomp worden gevuld door acht keer te bedienen. Bij dagelijks gebruik hoeft de pomp niet opnieuw te worden geprimed. Indien niet gebruikt gedurende twee opeenvolgende dagen, opnieuw vullen met één verstuiving of totdat een fijne verstuiving verschijnt. Indien niet gebruikt voor meer dan 14 dagen, spoel de applicator en vul opnieuw met twee verstuivingen of totdat een fijne verstuiving verschijnt. Schud de container voorzichtig voor elk gebruik.
Geïllustreerd Instructies voor gebruik van de patiënt vergezel elke verpakking van RHINOCORT AQUA (budesonide) neusspray 32 mcg.
HOE GELEVERD
Doseringsvormen en sterke punten
RHINOCORT AQUA (budesonide) Neusspray is een suspensie voor neusspray. Elke spray levert 32 mcg budesonide. Elke fles RHINOCORT 100 mcg AQUA (budesonide) neusspray 32 mcg bevat 120 afgemeten sprays na de eerste priming.
RHINOCORT 100mcg AQUA (budesonide) Neusspray 32 mcg is verkrijgbaar in een amberkleurige glazen fles met een doseerpompspray en een groene beschermkap. RHINOCORT 100mcg AQUA (budesonide) Neusspray 32 mcg ( NDC 0186-1070-08) levert 120 afgemeten sprays na de eerste priming; netto vulgewicht 8,6 g. De RHINOCORT 100 mcg AQUA (budesonide) Neusspray 32 mcg fles is gevuld met een overmaat om de priming-activiteit op te vangen. De fles moet worden weggegooid na 120 verstuivingen na de eerste priming, aangezien de hoeveelheid budesonide die daarna per verstuiving wordt toegediend aanzienlijk minder kan zijn dan de op het etiket vermelde dosis. Elke spray levert 32 mcg budesonide aan de patiënt.
RHINOCORT 100mcg AQUA (budesonide) Neusspray moet worden bewaard bij een gecontroleerde kamertemperatuur, 20 tot 25 ° C (68 tot 77 ° F) met het ventiel omhoog. Niet bevriezen. Bescherm tegen licht. Schud voorzichtig voor gebruik. Niet in de ogen sprayen.
Gedistribueerd door: AstraZeneca LP, Wilmington, DE 19850. Herzien: 12/2010
BIJWERKINGEN
Systemisch en intranasaal gebruik van corticosteroïden kan het volgende tot gevolg hebben:
- Epistaxis, Candida albicans-infectie, perforatie van het neustussenschot en verminderde wondgenezing [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Overgevoeligheid inclusief anafylaxie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Immunosuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Hypercorticisme en bijniersuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Groei-effect [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik in specifieke populaties ].
- Glaucoom en staar [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De incidentie van vaak voorkomende bijwerkingen in tabel 1 is gebaseerd op twee Amerikaanse en vijf niet-Amerikaanse gecontroleerde klinische onderzoeken bij 1.526 patiënten met seizoensgebonden of niet-seizoensgebonden rhinitis bij volwassenen en kinderen ≥ 6 jaar die werden behandeld met RHINOCORT AQUA (budesonide) neusspray in doses tot maximaal 400 mcg eenmaal daags gedurende 3-6 weken. Deze populatie omvatte 745 vrouwen en 781 mannen met een gemiddelde leeftijd van 31 jaar (spreiding van 6-85 jaar, 349 waren 6
Een vergelijkbaar bijwerkingenprofiel werd waargenomen in de subgroep van pediatrische patiënten van 6 tot 12 jaar. Deze patiënten zijn opgenomen in tabel 1.
Twee tot drie procent (2-3%) van de patiënten in klinische onderzoeken stopte vanwege bijwerkingen. Systemische bijwerkingen van corticosteroïden werden niet gemeld tijdens gecontroleerde klinische onderzoeken met RHINOCORT AQUA (budesonide) neusspray.
Als de aanbevolen doses worden overschreden of als personen bijzonder gevoelig zijn, kunnen symptomen van hypercorticisme, dwz het syndroom van Gushing, en bijniersuppressie optreden.
Postmarketingervaring
De volgende bijwerkingen zijn gemeld tijdens het gebruik van RHINOCORT AQUA (budesonide) neusspray na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Immuunsysteemaandoeningen: onmiddellijke en vertraagde overgevoeligheidsreacties (inclusief anafylactische reactie, urticaria, huiduitslag, dermatitis, angio-oedeem en pruritus), [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en CONTRA-INDICATIES ]
Oogaandoeningen: glaucoom, verhoogde oogdruk, cataract [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: neustussenschotperforatie, anosmie, keelholteaandoeningen (keelirritatie, keelpijn, gezwollen keel, brandende keel en jeukende keel) en piepende ademhaling
Hartaandoeningen: hartkloppingen
Skeletspierstelsel- en bindweefselaandoeningen: groeionderdrukking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ]
DRUG-INTERACTIES
Remmers van cytochroom P450 3A4
De belangrijkste metabolische route van corticosteroïden, waaronder budesonide, is via cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4). Na orale toediening van ketoconazol, een sterke remmer van CYP3A4, nam de gemiddelde plasmaconcentratie van oraal toegediend budesonide toe. Gelijktijdige toediening van CYP3A4 kan het metabolisme van budesonide remmen en de systemische blootstelling verhogen. Voorzichtigheid is geboden wanneer gelijktijdige toediening van RHINOCORT AQUA (budesonide) neusspray met langdurig ketoconazol en andere bekende sterke CYP3A4-remmers (bijv. ritonavir, atazanavir claritromycine, indinavir itraconazol, nefazodon nelfinavir-saquinavir), WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Lokale nasale effecten
Epistaxis
In klinische onderzoeken met een duur van 3 tot 52 weken werd epistaxis vaker waargenomen bij patiënten die werden behandeld met RHINOCORT 100 mcg AQUA (budesonide) neusspray dan bij degenen die placebo kregen [zie ONGEWENSTE REACTIES ].
Candida-infectie
In klinische onderzoeken met intranasale toediening van budesonide is de ontwikkeling van gelokaliseerde infecties van neus en keelholte met Candida albicans opgetreden. Wanneer zich een dergelijke infectie ontwikkelt, kan behandeling met geschikte lokale of systemische therapie en stopzetting van de behandeling met RHINOCORT AQUA (budesonide) neusspray nodig zijn. Patiënten die RHINOCORT AQUA (budesonide) neusspray gedurende meerdere maanden of langer gebruiken, moeten periodiek worden onderzocht op tekenen van Candida-infectie of andere tekenen van nadelige effecten op het neusslijmvlies.
Neusseptumperforatie
Gevallen van perforatie van het neustussenschot zijn gemeld na intranasale toediening van corticosteroïden, waaronder budesonide [zie ONGEWENSTE REACTIES ].
Verminderde wondgenezing
Vanwege het remmende effect van corticosteroïden op de wondgenezing, mogen patiënten die recent neusseptumzweren, neusoperaties of neustrauma hebben gehad, geen nasale corticosteroïden gebruiken totdat genezing is opgetreden.
Overgevoeligheidsreacties waaronder anafylaxie
Overgevoeligheidsreacties waaronder anafylactische reactie, urticaria, huiduitslag, dermatitis, angio-oedeem en pruritus kunnen optreden [zie CONTRA-INDICATIES en ONGEWENSTE REACTIES, postmarketingervaring ].
Immunosuppressie
Patiënten die medicijnen gebruiken die het immuunsysteem onderdrukken, zijn vatbaarder voor infecties dan gezonde personen. Waterpokken en mazelen kunnen bijvoorbeeld een ernstiger of zelfs fataal verloop hebben bij gevoelige kinderen of volwassenen die corticosteroïden gebruiken. Bij dergelijke kinderen of volwassenen die deze ziekten niet hebben gehad of niet goed zijn geïmmuniseerd, moet bijzondere aandacht worden besteed aan het vermijden van blootstelling. Hoe de dosis, de route en de duur van de toediening van corticosteroïden het risico op het ontwikkelen van een gedissemineerde infectie beïnvloeden, is niet bekend. De bijdrage van de onderliggende ziekte en/of eerdere behandeling met corticosteroïden aan het risico is ook niet bekend. Bij blootstelling aan waterpokken kan therapie met varicella zoster-immunoglobuline (VZIG) of gepoold intraveneus immunoglobuline (WIG), naargelang het geval, geïndiceerd zijn. Bij blootstelling aan mazelen kan profylaxe met gepoolde intramusculaire immunoglobuline (IG) geïndiceerd zijn. (Zien de respectievelijke bijsluiters voor volledige VZIG- en IG-voorschrijfinformatie ). Als zich waterpokken ontwikkelen, kan behandeling met antivirale middelen worden overwogen.
Het klinische verloop van waterpokken- of mazeleninfectie bij patiënten die intranasale of inhalatiecorticosteroïden gebruiken, is niet onderzocht. Hoewel er geen gegevens zijn over intranasale corticosteroïden, is in een klinische studie de immuunrespons op het varicellavaccin onderzocht bij astmapatiënten van 12 maanden tot 8 jaar oud die werden behandeld met budesonide-inhalatiesuspensie.
Een open-label, niet-gerandomiseerde klinische studie onderzocht de immuunrespons op het varicellavaccin bij 243 astmapatiënten van 12 maanden tot 8 jaar oud die werden behandeld met budesonide-inhalatiesuspensie 0,25 mg tot 1 mg per dag (n=151) of niet-corticosteroïd astmatherapie (n=92) (dwz bèta-agonisten, leukotrieenreceptorantagonisten of cromonen). Het percentage patiënten dat een seroprotectieve antilichaamtiter ≥ 5,0 (gpELISA-waarde) ontwikkelde als reactie op de vaccinatie was vergelijkbaar bij patiënten die werden behandeld met budesonide-inhalatiesuspensie (85%) in vergelijking met patiënten die werden behandeld met astma zonder corticosteroïden (90%). Geen enkele patiënt die werd behandeld met budesonide-inhalatiesuspensie ontwikkelde waterpokken als gevolg van vaccinatie.
Corticosteroïden moeten met voorzichtigheid of helemaal niet worden gebruikt bij patiënten met actieve of latente tuberculose-infectie, onbehandelde schimmel-, bacteriële, systemische virale of parasitaire infecties; of oculaire herpes simplex.
Hypothalamus-hypofyse-bijnieras effecten
Hypercorticisme en bijniersuppressie: Wanneer intranasale steroïden worden gebruikt in hogere dan de aanbevolen doseringen of bij gevoelige personen in de aanbevolen doseringen, kunnen systemische corticosteroïd-effecten zoals hypercorticisme en bijniersuppressie optreden. Als dergelijke veranderingen optreden, moet de dosering van RHINOCORT 100mcg AQUA (budesonide) neusspray langzaam worden stopgezet, in overeenstemming met de geaccepteerde procedures voor het stopzetten van de behandeling met orale corticosteroïden.
De vervanging van een systemische corticosteroïde door een topische corticosteroïde kan gepaard gaan met tekenen van bijnierinsufficiëntie, en daarnaast kunnen sommige patiënten symptomen van ontwenning van de corticosteroïden ervaren, bijv. gewrichts- en/of spierpijn, vermoeidheid, zwakte, misselijkheid, braken, hypotensie, vermoeidheid en depressie. Patiënten die eerder gedurende langere perioden met systemische corticosteroïden zijn behandeld, moeten langzaam worden afgebouwd wanneer ze worden overgezet op lokale corticosteroïden en moeten zorgvuldig worden gecontroleerd op acute bijnierinsufficiëntie als reactie op stress. Bij patiënten met astma of andere klinische aandoeningen die een langdurige behandeling met systemische corticosteroïden vereisen, kan een te snelle afname van systemische corticosteroïden een ernstige verergering van hun symptomen veroorzaken.
Interacties met sterke cytochroom P450 3A4-remmers
Voorzichtigheid is geboden wanneer gelijktijdige toediening van RHINOCORT AQUA Neusspray met ketoconazol en andere bekende sterke CYP3A4-remmers (bijv. ritonavir, atazanavir, claritromycine, indinavir, itraconazol, nefazodon, nelfinavir, saquinavir, telithromycine) systemische blootstelling aan budesonide kan optreden [zie: DRUG-INTERACTIES, KLINISCHE FARMACOLOGIE ].
Effect op groei
Intranasale corticosteroïden, waaronder budesonide, kunnen een vermindering van de groeisnelheid veroorzaken bij toediening aan pediatrische patiënten. Controleer routinematig de groei van pediatrische patiënten die langdurig worden behandeld met RHINOCORT 100mcg AQUA (budesonide) neusspray. Om de systemische effecten van intranasale corticosteroïden, waaronder RHINOCORT AQUA (budesonide) neusspray, te minimaliseren, moet de dosering van elke patiënt worden getitreerd tot de laagste dosis die zijn / haar symptomen effectief onder controle houdt (zie Gebruik bij specifieke populaties, pediatrisch gebruik ].
Glaucoom en staar
Glaucoom, verhoogde intraoculaire druk en cataract zijn gemeld na intranasale toediening van corticosteroïden, waaronder budesonide. Daarom is nauwlettende controle geboden bij patiënten met een veranderd gezichtsvermogen of met een voorgeschiedenis van verhoogde intraoculaire druk, glaucoom en/of cataracten [zie ONGEWENSTE REACTIES ].
Informatie over patiëntbegeleiding
[Zien Door de FDA goedgekeurde etikettering van patiënten ]
Patiënten die worden behandeld met RHINOCORT 100mcg AQUA (budesonide) neusspray dienen de volgende informatie en instructies te ontvangen. Deze informatie is bedoeld om de patiënt te helpen bij een veilig en effectief gebruik van de medicatie. Het is geen onthulling van alle mogelijke nadelige of beoogde effecten. Voor een juist gebruik van RHINOCORT 100mcg AQUA (budesonide) neusspray en om maximale verbetering te bereiken, dient de patiënt de bijbehorende FDA-goedgekeurde patiëntetikettering te lezen en te volgen.
Lokale nasale effecten
Patiënten moeten erop worden gewezen dat bij sommige patiënten epistaxis en plaatselijke infecties met Candida albicans in de neus en farynx zijn opgetreden. Als zich candidiasis ontwikkelt, moet deze worden behandeld met geschikte lokale of systemische therapie en moet de behandeling met RHINOCORT 100mcg AQUA (budesonide) Neusspray worden gestaakt. Bovendien worden nasale corticosteroïden geassocieerd met nasale septumperforatie en verminderde wondgenezing. Patiënten die recent neuszweren, neusoperaties of neustrauma hebben gehad, mogen RHINOCORT AQUA (budesonide) neusspray niet gebruiken totdat genezing is opgetreden (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Overgevoeligheid inclusief anafylaxie
Patiënten moeten erop worden gewezen dat overgevoeligheidsreacties, waaronder anafylactische reactie, urticaria, huiduitslag, dermatitis, angio-oedeem en pruritus, zijn gemeld bij gebruik van RHINOCORT AQUA (budesonide) neusspray. Stoppen
RHINOCORT AQUA (budesonide) Neusspray als dergelijke reacties optreden [zie: CONTRA-INDICATIES, WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
Immunosuppressie
Patiënten die immunosuppressieve doses corticosteroïden gebruiken, moeten worden gewaarschuwd om blootstelling aan waterpokken of mazelen te vermijden en, indien blootgesteld, onmiddellijk hun arts te raadplegen. Patiënten moeten worden geïnformeerd over mogelijke verergering van bestaande tuberculose, schimmel-, bacteriële, virale of parasitaire infectie of oculaire herpes simplex [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Verminderde groeisnelheid
Patiënten moeten erop worden gewezen dat intranasale corticosteroïden, waaronder budesonide, een vermindering van de groeisnelheid kunnen veroorzaken bij toediening aan pediatrische patiënten. Artsen moeten de groei nauwlettend volgen van kinderen en adolescenten die corticosteroïden gebruiken via welke route dan ook [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Glaucoom en staar
Patiënten moeten erop worden gewezen dat langdurig gebruik van intranasale corticosteroïden, waaronder budesonide, het risico op bepaalde oogproblemen (cataract en glaucoom) kan verhogen. Patiënten moeten hun zorgverlener op de hoogte stellen als een verandering in het gezichtsvermogen wordt opgemerkt tijdens het gebruik van RHINOCORT AQUA (budesonide) neusspray (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Dagelijks gebruiken
Patiënten dienen RHINOCORT 100mcg AQUA (budesonide) neusspray met regelmatige tussenpozen te gebruiken, aangezien de effectiviteit ervan afhangt van regelmatig gebruik. Patiënten kunnen een verbetering van de neussymptomen waarnemen binnen 10 uur na het eerste gebruik van RHINOCORT AQUA (budesonide) neusspray. Het maximale voordeel wordt mogelijk pas ongeveer 2 weken na het begin van de behandeling bereikt [zie DOSERING EN ADMINISTRATIE ].
Patiënten moeten de medicatie nemen zoals voorgeschreven en mogen de voorgeschreven dosering niet overschrijden. De patiënt moet contact opnemen met de arts als de symptomen na twee weken niet verbeteren of als de toestand verergert. Patiënten die terugkerende epistaxis (neusbloedingen) of ongemak in het neustussenschot ervaren tijdens het gebruik van dit medicijn, dienen contact op te nemen met hun arts. Voor een juist gebruik van RHINOCORT AQUA (budesonide) neusspray en om maximale verbetering te bereiken, moet de patiënt de begeleidende patiënteninformatie zorgvuldig lezen en opvolgen. Gebruik RHINOCORT 100mcg AQUA (budesonide) Neusspray niet nadat het op het etiket vermelde aantal verstuivingen is gebruikt (exclusief priming) of na de vervaldatum die staat vermeld op het etiket van de doos of het flesje.
Hoe gebruikt u RHINOCORT 100mcg AQUA (budesonide) neusspray?
Patiënten moeten zorgvuldig worden geïnstrueerd over het gebruik van dit geneesmiddel om een optimale dosisafgifte te verzekeren [zie: PATIËNT INFORMATIE ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een oraal onderzoek van 104 weken bij Sprague-Dawley-ratten werd een statistisch significante toename van de incidentie van gliomen waargenomen bij mannelijke ratten die een orale dosis budesonide kregen van 50 mcg/kg/dag (ongeveer tweemaal de maximaal aanbevolen dagelijkse intranasale dosis in volwassenen en kinderen op mcg/m2 basis). Er werd geen tumorigeniciteit waargenomen bij mannelijke ratten bij orale doses tot 25 mcg/kg (ongeveer gelijk aan de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen en kinderen op basis van mcg/m2, en bij vrouwelijke ratten bij orale doses tot 50 mcg/kg ongeveer twee keer de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen en kinderen op basis van mcg/m2. In twee aanvullende onderzoeken van twee jaar bij mannelijke Fischer- en Sprague-Dawley-ratten veroorzaakte budesonide geen gliomen bij een orale dosis van 50 mcg/kg (ongeveer tweemaal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen en kinderen op basis van mcg/m2). Bij mannelijke Sprague-Dawley-ratten veroorzaakte budesonide echter een statistisch significante toename van de incidentie van hepatocellulaire tumoren bij een orale dosis van 50 mcg/kg (ongeveer tweemaal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen en kinderen op basis van mcg/m2 ). De gelijktijdige referentie-corticosteroïden (prednisolon en triamcinolonacetonide) in deze twee onderzoeken lieten vergelijkbare bevindingen zien.
Er waren geen aanwijzingen voor een carcinogeen effect wanneer budesonide gedurende 91 weken oraal werd toegediend aan muizen in doses tot 200 mcg/kg/dag (ongeveer 3 maal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen en kinderen op basis van mcg/m2) .
Budesonide was niet mutageen of clastogeen in zes verschillende testsystemen: Ames Salmonella/microsoomplaattest, muismicronucleustest, muislymfoomtest, chromosoomafwijkingstest in menselijke lymfocyten, geslachtsgebonden recessieve letale test in Drosophila melanogaster en DNA-reparatieanalyse bij ratten hepatocyten cultuur.
Bij ratten had budesonide geen effect op de vruchtbaarheid bij subcutane doses tot 80 mcg/kg (ongeveer 3 maal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2).
Bij een subcutane dosis van 20 mcg/kg/dag (minder dan de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2), afname van maternale lichaamsgewichtstoename, prenatale levensvatbaarheid en levensvatbaarheid van de jongen bij de geboorte en tijdens borstvoeding waren geobserveerd. Dergelijke effecten werden niet waargenomen bij 5 mcg/kg (minder dan de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2).
Gebruik bij specifieke populaties
Zwangerschap
Teratogene effecten: Zwangerschap Categorie B. De impact van budesonide op de zwangerschapsuitkomsten bij de mens is geëvalueerd door middel van beoordelingen van geboorteregisters die verband houden met het gebruik door de moeder van budesonide voor inhalatie (dwz PULMICORT TURBUHALER) en intranasaal toegediende budesonide (dwz RHINOCORT 100 mcg AQUA (budesonide) neusspray). De resultaten van prospectieve cohort-epidemiologische onderzoeken op populatiebasis, waarbij gegevens werden beoordeeld uit drie Zweedse registers die ongeveer 99% van de zwangerschappen van 1995-2001 bestrijken (dwz het Zweedse medische geboorteregister; het register van aangeboren misvormingen; het kindercardiologieregister) duiden niet op een verhoogd risico op algehele aangeboren afwijkingen door het gebruik van inhalatie- of intranasale budesonide tijdens de vroege zwangerschap.
Congenitale misvormingen werden onderzocht bij 2.014 baby's van moeders die melding maakten van het gebruik van inhalatiebudesonide voor astma tijdens de vroege zwangerschap (meestal 10-12 weken na de laatste menstruatie), de periode waarin de meeste ernstige orgaanmisvormingen optreden.1 Het aantal algemene aangeboren misvormingen was vergelijkbaar met het percentage in de algemene bevolking (respectievelijk 3,8% vs. 3,5%). Het aantal zuigelingen geboren met orofaciale spleten en hartafwijkingen was vergelijkbaar met het verwachte aantal in de algemene populatie (respectievelijk 4 kinderen versus 3,3 en 18 kinderen versus 17-18). In een vervolgonderzoek waarmee het totale aantal zuigelingen op 2.534 kwam, was het percentage aangeboren afwijkingen bij zuigelingen van wie de moeder tijdens de vroege zwangerschap werd blootgesteld aan inhalatie van budesonide niet verschillend van het percentage voor alle pasgeboren baby's in dezelfde periode (3,6% ).2 Een derde studie van de Swedish Medical Birth Registry van 2.968 zwangerschappen die waren blootgesteld aan geïnhaleerd budesonide, waarvan de meeste blootstellingen in het eerste trimester waren, rapporteerde zwangerschapsduur, geboortegewicht, geboortelengte, doodgeboorten en meerlinggeboorten die vergelijkbaar waren voor blootgestelde zuigelingen in vergelijking met niet-blootgestelde baby's
Congenitale misvormingen werden onderzocht bij 2.113 baby's van moeders die het gebruik van intranasaal budesonide vroeg in de zwangerschap meldden. Het percentage aangeboren afwijkingen was vergelijkbaar met het percentage in de algemene bevolking (respectievelijk 4,5% vs. 3,5%). De aangepaste odds ratio (OR) was 1,06 (95% BI 0,86-1,31). Het aantal zuigelingen geboren met orofaciale spleten was vergelijkbaar met het verwachte aantal in de algemene populatie (respectievelijk 3 kinderen versus 3). Het aantal baby's geboren met hartafwijkingen was groter dan verwacht in de algemene bevolking (respectievelijk 28 kinderen versus 17,8). De systemische blootstelling van intranasaal budesonide is 6 keer minder dan van geïnhaleerd budesonide en er werd geen associatie van hartafwijkingen gezien met hogere blootstellingen aan budesonide.
Ondanks de bevindingen bij dieren, lijkt het erop dat de mogelijkheid van schade aan de foetus klein is als het medicijn tijdens de zwangerschap wordt gebruikt. Desalniettemin, omdat de onderzoeken bij mensen de mogelijkheid van schade niet kunnen uitsluiten, mag RHINOCORT AQUA (budesonide) neusspray alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Budesonide veroorzaakte foetaal verlies, verminderd gewicht van de jongen en skeletafwijkingen bij een subcutane dosis bij konijnen die ongeveer 2 keer de maximaal aanbevolen dagelijkse intranasale dosis was bij volwassenen op basis van mcg/m2 en bij een subcutane dosis bij ratten die ongeveer 16 keer de maximale aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2. Er werden geen teratogene of embryocidale effecten waargenomen bij ratten wanneer budesonide werd toegediend via inhalatie in doses tot ongeveer 8 maal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2.
Ervaring met orale corticosteroïden sinds hun introductie in farmacologische, in tegenstelling tot fysiologische doses, suggereert dat knaagdieren vatbaarder zijn voor teratogene effecten van corticosteroïden dan mensen.
Niet-teratogene effecten: Hypoadrenalisme kan optreden bij baby's die zijn geboren uit moeders die tijdens de zwangerschap corticosteroïden krijgen. Dergelijke baby's moeten zorgvuldig worden geobserveerd.
Moeders die borstvoeding geven
Budesonide wordt uitgescheiden in de moedermelk. Gegevens over budesonide afgegeven via een inhalator voor droog poeder geven aan dat de totale dagelijkse orale dosis budesonide die beschikbaar is in de moedermelk voor de zuigeling ongeveer 0,3% tot 1% is van de dosis die door de moeder wordt geïnhaleerd [zie KLINISCHE FARMACOLOGIE, farmacokinetiek, speciale populaties, verpleging ]. Er zijn geen studies uitgevoerd bij vrouwen die borstvoeding geven specifiek met RHINOCORT 100mcg AQUA Neusspray; het is echter te verwachten dat de dosis budesonide die beschikbaar is voor de zuigeling in de moedermelk, als percentage van de maternale dosis, vergelijkbaar is. RHINOCORT AQUA (budesonide) Neusspray mag alleen worden gebruikt bij vrouwen die borstvoeding geven als dit klinisch aangewezen is. Voorschrijvers dienen de bekende voordelen van borstvoeding voor moeder en kind af te wegen tegen de mogelijke risico's van minimale blootstelling aan budesonide bij het kind. Doseringsoverwegingen omvatten het voorschrijven of titratie tot de laagste klinisch effectieve dosis en het gebruik van RHINOCORT 100mcg AQUA (budesonide) Neusspray onmiddellijk na de borstvoeding om het tijdsinterval tussen de dosering en de borstvoeding te maximaliseren om de blootstelling van de baby tot een minimum te beperken.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 6 jaar zijn niet vastgesteld.
Gecontroleerde klinische onderzoeken hebben aangetoond dat intranasale corticosteroïden een vermindering van de groeisnelheid bij pediatrische patiënten kunnen veroorzaken. Dit effect is waargenomen bij afwezigheid van laboratoriumgegevens van onderdrukking van de hypothalamus-hypofyse-bijnier (HPA)-as, wat suggereert dat groeisnelheid een gevoeligere indicator is van systemische blootstelling aan corticosteroïden bij pediatrische patiënten dan sommige veelgebruikte tests van de werking van de HPA-as . De langetermijneffecten van deze verlaging van de groeisnelheid geassocieerd met intranasale corticosteroïden, inclusief de impact op de uiteindelijke volwassen lengte, zijn onbekend. Het potentieel voor "inhaalgroei" na stopzetting van de behandeling met intranasale corticosteroïden is niet voldoende onderzocht.
De groei van pediatrische patiënten die intranasale corticosteroïden krijgen, waaronder RHINOCORT 100mcg AQUA (budesonide) neusspray, moet routinematig worden gecontroleerd (bijv. via stadiometrie). De mogelijke groei-effecten van langdurige behandeling moeten worden afgewogen tegen de verkregen klinische voordelen en de risico's en voordelen die verband houden met alternatieve therapieën. Om de systemische effecten van intranasale corticosteroïden, waaronder RHINOCORT AQUA (budesonide) neusspray, te minimaliseren, moet elke patiënt worden getitreerd naar de laagste dosis die zijn/haar symptomen effectief onder controle houdt.
Er werd een eenjarig placebogecontroleerd klinisch groeionderzoek uitgevoerd bij 229 pediatrische patiënten (in de leeftijd van 4 tot en met 8 jaar) om het effect van RHINOCORT AQUA (budesonide) neusspray (eenmalige dagelijkse dosis van 64 mcg, de aanbevolen startdosis) te beoordelen. voor kinderen van 6 jaar en ouder) op groeisnelheid. Van een populatie van 141 patiënten die RHINOCORT 100mcg AQUA (budesonide) neusspray kregen en 67 die placebo kregen, was de puntschatting voor de groeisnelheid met RHINOCORT AQUA (budesonide) neusspray 0,25 cm/jaar lager dan die waargenomen met placebo (95% betrouwbaarheidsinterval variërend van 0,59 cm/jaar lager dan placebo tot 0,08 cm/jaar hoger dan placebo).
In een onderzoek onder astmatische kinderen van 5-12 jaar hadden degenen die werden behandeld met budesonide toegediend via een inhalator voor droog poeder 200 mcg tweemaal daags (n=311) een groeivermindering van 1,1 centimeter (0,433 inch) vergeleken met degenen die placebo kregen ( n=418) aan het einde van een jaar; het verschil tussen deze twee behandelingsgroepen nam niet verder toe gedurende drie jaar aanvullende behandeling. Tegen het einde van vier jaar hadden kinderen die werden behandeld met een droge poederinhalator van budesonide en kinderen die werden behandeld met placebo vergelijkbare groeisnelheden. De conclusies die uit deze studie worden getrokken, kunnen worden vertroebeld door het ongelijke gebruik van corticosteroïden in de behandelingsgroepen en de opname van gegevens van patiënten die in de loop van de studie de puberteit bereikten.
De systemische effecten van inhalatiecorticosteroïden houden verband met de systemische blootstelling aan dergelijke geneesmiddelen. Farmacokinetische onderzoeken hebben aangetoond dat bij zowel volwassenen als kinderen de systemische blootstelling aan budesonide bij de hoogste aanbevolen doses RHINOCORT AQUA (budesonide) neusspray naar verwachting niet groter zal zijn dan de blootstelling bij de laagste aanbevolen doses via een droogpoederinhalator. Daarom wordt verwacht dat de systemische effecten (HPA-as en groei) van budesonide afgegeven door RHINOCORT AQUA (budesonide) neusspray niet groter zijn dan wat is gemeld voor geïnhaleerd budesonide bij toediening via de droogpoederinhalator.
Het kan niet worden uitgesloten dat RHINOCORT 100 mcg AQUA (budesonide) neusspray groeisuppressie veroorzaakt bij daarvoor gevoelige patiënten of wanneer het wordt gegeven in doses van meer dan 64 mcg per dag. Het aanbevolen doseringsbereik bij patiënten van 6 tot 11 jaar is 64 tot 128 mcg per dag [zie: DOSERING EN ADMINISTRATIE ].
Geriatrisch gebruik
Van de 2.461 patiënten in klinische onderzoeken met RHINOCORT 100 mcg AQUA (budesonide) neusspray was 5% 60 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, behalve een bijwerking die de frequentie van epistaxis meldde die toenam met de leeftijd. Verder hebben andere gerapporteerde klinische ervaringen geen andere verschillen in respons tussen oudere en jongere patiënten geïdentificeerd, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Leverfunctiestoornis
Er zijn geen formele farmacokinetische onderzoeken uitgevoerd met RHINOCORT 100mcg AQUA (budesonide) neusspray bij patiënten met leverinsufficiëntie. Aangezien budesonide echter voornamelijk wordt geklaard door levermetabolisme, kan een leverfunctiestoornis leiden tot accumulatie van budesonide in plasma. Daarom moeten patiënten met een leveraandoening nauwlettend worden gecontroleerd.
OVERDOSERING
Acute overdosering met deze doseringsvorm is onwaarschijnlijk aangezien een 120-spuitfles RHINOCORT 100mcg AQUA (budesonide) Neusspray 32 mcg slechts ongeveer 5,4 mg budesonide bevat. Chronische overdosering kan leiden tot tekenen/symptomen van hypercorticisme [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CONTRA-INDICATIES
RHINOCORT AQUA (budesonide) Neusspray is gecontra-indiceerd bij patiënten met overgevoeligheid voor een van de bestanddelen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Budesonide is een ontstekingsremmend corticosteroïd dat een krachtige glucocorticoïde activiteit en een zwakke mineralocorticoïde activiteit vertoont. In standaard in vitro- en diermodellen heeft budesonide een ongeveer 200 keer hogere affiniteit voor de glucocorticoïde receptor en een 1000 keer hogere lokale ontstekingsremmende potentie dan cortisol (test crotonolie-ooroedeem bij ratten). Als maat voor de systemische activiteit is budesonide 40 keer krachtiger dan cortisol bij subcutane toediening en 25 keer krachtiger bij orale toediening in de thymus-involutietest bij ratten. De klinische betekenis hiervan is niet bekend.
De activiteit van RHINOCORT 100mcg AQUA Neusspray is te danken aan het oorspronkelijke geneesmiddel, budesonide. In onderzoeken naar de affiniteit van de glucocorticoïdereceptor was de 22R-vorm twee keer zo actief als het 22S-epimeer. In vitro-onderzoeken wezen uit dat de twee vormen van budesonide niet in elkaar overgaan.
Het precieze mechanisme van de werking van corticosteroïden op ontstekingen bij seizoensgebonden en niet-seizoensgebonden allergische rhinitis is niet goed bekend. Ontsteking is een belangrijke component in de pathogenese van seizoensgebonden en niet-seizoensgebonden allergische rhinitis. Corticosteroïden hebben een breed scala aan remmende activiteiten tegen meerdere celtypen (bijv. mestcellen, eosinofielen, neutrofielen, macrofagen en lymfocyten) en mediatoren (bijv. histamine, eicosanoïden, leukotriënen en cytokinen) die betrokken zijn bij allergische en niet-allergische gemedieerde ontsteking. Deze ontstekingsremmende werking van corticosteroïden kan bijdragen aan hun werkzaamheid bij seizoensgebonden en niet-seizoensgebonden allergische rhinitis.
farmacodynamiek
Een klinische studie van 3 weken bij seizoensgebonden rhinitis, waarbij RHINOCORT 100 mcg neusinhalator, oraal ingenomen budesonide en placebo werden vergeleken bij 98 patiënten met allergische rhinitis als gevolg van berkenpollen, toonde aan dat het therapeutische effect van RHINOCORT neusinhalator kan worden toegeschreven aan de plaatselijke effecten van budesonide.

HPA-as effecten
De effecten van RHINOCORT 100mcg AQUA (budesonide) neusspray op de bijnierfunctie zijn geëvalueerd in verschillende klinische onderzoeken. In een vier weken durende klinische studie vertoonden 61 volwassen patiënten die dagelijks 256 mcg RHINOCORT AQUA (budesonide) neusspray kregen, geen significante verschillen met patiënten die placebo kregen in plasmacortisolspiegels gemeten vóór en 60 minuten na 0,25 mg intramusculair cosyntropine. Er waren geen consistente verschillen in 24-uurs urinecortisolmetingen bij patiënten die dagelijks tot 400 mcg kregen. Vergelijkbare resultaten werden gezien in een onderzoek bij 150 kinderen en adolescenten van 6 tot 17 jaar met niet-seizoensgebonden rhinitis die gedurende maximaal 12 maanden werden behandeld met 256 mcg per dag.
Na behandeling met de aanbevolen maximale dagelijkse dosis RHINOCORT AQUA (budesonide) neusspray (256 mcg) gedurende zeven dagen, was er een kleine, maar statistisch significante afname in het gebied onder de plasmacortisol-tijdcurve gedurende 24 uur (AUC0-24 uur). ) bij gezonde volwassen vrijwilligers.
Een dosisgerelateerde onderdrukking van de 24-uurs urinaire cortisoluitscheiding werd waargenomen na toediening van RHINOCORT AQUA (budesonide) neusspray doses variërend van 100-800 mcg per dag gedurende maximaal vier dagen bij 78 gezonde volwassen vrijwilligers. De klinische relevantie van deze resultaten is niet bekend.
Farmacokinetiek
Absorptie
Na intranasale toediening van een enkele dosis RHINOCORT AQUA (budesonide) neusspray (128 mcg) treedt de gemiddelde piekplasmaconcentratie van ongeveer 0,3 nmol/L ongeveer 0,5 uur na de dosis op. In vergelijking met een intraveneuze dosis bereikt ongeveer 34% van de toegediende intranasale dosis de systemische circulatie, waarvan het grootste deel wordt geabsorbeerd via het neusslijmvlies. Hoewel budesonide goed wordt geabsorbeerd uit het maagdarmkanaal, is de orale biologische beschikbaarheid van budesonide laag (~ 10%), voornamelijk als gevolg van een uitgebreid first-pass-metabolisme in de lever.
Verdeling
Het distributievolume van budesonide was ongeveer 2-3 l/kg. Het was voor 85-90% gebonden aan plasma-eiwitten. Het distributievolume voor het 22R-epimeer is bijna tweemaal dat van het 22S-epimeer. De eiwitbinding was constant over een concentratiebereik (1-100 nmol/L) dat werd bereikt met, en overschreed, de aanbevolen doses RHINOCORT 100mcg AQUA Neusspray. Budesonide vertoonde weinig of geen binding aan corticosteroïdbindend globuline. Budesonide kwam snel in evenwicht met rode bloedcellen op een concentratieonafhankelijke manier met een bloed/plasmaverhouding van ongeveer 0,8.
Metabolisme
In vitro-onderzoeken met humane leverhomogenaten hebben aangetoond dat budesonide snel en uitgebreid wordt gemetaboliseerd. Twee belangrijke metabolieten gevormd via door cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4) gekatalyseerde biotransformatie zijn geïsoleerd en geïdentificeerd als 16α-hydroxyprednisolon en 6p-hydroxybudesonide. De corticosteroïdactiviteit van elk van deze twee metabolieten is minder dan 1% van die van de moederverbinding. Er is geen kwalitatief verschil gevonden tussen de in vitro en in vivo metabole patronen. Verwaarloosbare metabole inactivatie werd waargenomen in humane long- en serumpreparaten.
Uitscheiding/eliminatie
De 22R-vorm van budesonide werd bij voorkeur geklaard door de lever met een systemische klaring van 1,4 l/min versus 1,0 l/min voor de 22S-vorm. De terminale halfwaardetijd, 2 tot 3 uur, was hetzelfde voor beide epimeren en was onafhankelijk van de dosis. Budesonide werd uitgescheiden in de urine en feces in de vorm van metabolieten. Ongeveer 2/3 van een intranasale radioactief gelabelde dosis werd teruggevonden in de urine en de rest in de feces. Er werd geen onveranderd budesonide in de urine aangetroffen.
Specifieke populaties
geriatrische
De farmacokinetiek van RHINOCORT 100mcg AQUA (budesonide) neusspray bij geriatrische patiënten is niet specifiek onderzocht.
pediatrisch
Na toediening van RHINOCORT 100mcg AQUA (budesonide) neusspray waren de tijd om de maximale geneesmiddelconcentraties te bereiken en de plasmahalfwaardetijd vergelijkbaar bij kinderen en bij volwassenen. Kinderen hadden plasmaconcentraties die ongeveer tweemaal zo hoog waren als die bij volwassenen, voornamelijk als gevolg van verschillen in gewicht tussen kinderen en volwassenen.
Geslacht
Er is geen specifiek farmacokinetisch onderzoek uitgevoerd om het effect van geslacht op de farmacokinetiek van budesonide te evalueren. Na toediening van 400 mcg RHINOCORT 100 mcg AQUA (budesonide) neusspray aan 7 mannelijke en 8 vrouwelijke vrijwilligers in een farmacokinetisch onderzoek, werden echter geen grote geslachtsverschillen in de farmacokinetische parameters gevonden.
Ras
Er is geen specifiek onderzoek uitgevoerd om het effect van ras op de farmacokinetiek van budesonide te evalueren.
Moeders die borstvoeding geven
De dispositie van budesonide bij toediening via orale inhalatie uit een droge poederinhalator in doses van 200 of 400 mcg tweemaal daags gedurende ten minste 3 maanden werd bestudeerd bij acht zogende vrouwen met astma van 1 tot 6 maanden postpartum. De systemische blootstelling aan budesonide bij deze vrouwen lijkt vergelijkbaar te zijn met die bij niet-lacterende vrouwen met astma uit andere onderzoeken. Moedermelk die meer dan acht uur na de dosis werd verkregen, toonde aan dat de maximale concentratie van budesonide voor de doses van 400 en 800 mcg respectievelijk 0,39 en 0,78 nmol/L was en binnen 45 minuten na toediening optrad. De geschatte orale dagelijkse dosis budesonide uit de moedermelk voor de zuigeling was ongeveer 0,007 en 0,014 mcg/kg/dag voor de twee doseringsschema's die in dit onderzoek werden gebruikt, wat overeenkomt met ongeveer 0,3% tot 1% van de dosis die door de moeder wordt geïnhaleerd. Budesonidespiegels in plasmamonsters verkregen van vijf zuigelingen ongeveer 90 minuten na borstvoeding (en ongeveer 140 minuten na toediening van het geneesmiddel aan de moeder) waren lager dan kwantificeerbare niveaus ( Gebruik bij specifieke populaties, moeders die borstvoeding geven ].
Nier- of leverfunctiestoornis
De farmacokinetiek van budesonide is niet onderzocht bij patiënten met een nierfunctiestoornis. Een verminderde leverfunctie kan de eliminatie van corticosteroïden beïnvloeden. De farmacokinetiek van budesonide werd beïnvloed door een verminderde leverfunctie, zoals blijkt uit een verdubbelde systemische beschikbaarheid na orale inname. De relevantie van deze bevinding voor intranasaal toegediende budesonide is niet vastgesteld.
Geneesmiddel-geneesmiddelinteracties
Remmers van cytochroom P450-enzymen
Ketoconazol: Ketoconazol, een sterke remmer van cytochroom P450 (CYP) iso-enzym 3A4 (CYP3A4), het belangrijkste metabole enzym voor corticosteroïden, verhoogde plasmaspiegels van oraal ingenomen budesonide (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Cimetidine: Bij de aanbevolen doseringen had cimetidine, een niet-specifieke remmer van CYP-enzymen, een licht maar klinisch onbeduidend effect op de farmacokinetiek van oraal budesonide.
Diertoxicologie en/of farmacologie
Budesonide was teratogeen en embryocide bij konijnen en ratten. Budesonide veroorzaakte foetaal verlies, verminderd gewicht van de jongen en skeletafwijkingen bij een subcutane dosis van 25 mcg/kg bij konijnen (ongeveer 2 maal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2) en bij een subcutane dosis van 500 mcg /kg bij ratten (ongeveer 16 maal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2). Er werden geen teratogene of embryocidale effecten waargenomen bij ratten wanneer budesonide werd toegediend via inhalatiedoses tot 250 mcg/kg (ongeveer 8 maal de maximaal aanbevolen dagelijkse intranasale dosis bij volwassenen op basis van mcg/m2).
Klinische studies
De therapeutische werkzaamheid van RHINOCORT AQUA (budesonide) neusspray is geëvalueerd in placebogecontroleerde klinische onderzoeken naar seizoensgebonden en niet-seizoensgebonden allergische rhinitis met een duur van 3-6 weken.
Het aantal patiënten dat in deze onderzoeken met budesonide werd behandeld, was 90 mannen en 51 vrouwen van 6-12 jaar en 691 mannen en 694 vrouwen van 12 jaar en ouder. De patiënten waren overwegend blank.
Over het algemeen toonden de resultaten van deze klinische onderzoeken aan dat eenmaal daags toegediende RHINOCORT AQUA (budesonide) neusspray een statistisch significante vermindering van de ernst van de neussymptomen van seizoensgebonden en niet-seizoensgebonden allergische rhinitis, waaronder loopneus, niezen en verstopte neus, geeft.
Bij patiënten kan binnen 10 uur na het eerste gebruik van RHINOCORT 100mcg AQUA (budesonide) neusspray een verbetering van de neussymptomen worden opgemerkt. Deze tijd tot aanvang wordt ondersteund door een milieublootstellingsstudie bij patiënten met seizoensgebonden allergische rhinitis die aantoonde dat RHINOCORT 100 mcg AQUA (budesonide) neusspray leidde tot een statistisch significante verbetering van de neussymptomen in vergelijking met placebo na 10 uur. Verdere ondersteuning is afkomstig van een klinische studie bij patiënten met niet-seizoensgebonden allergische rhinitis die een statistisch significante verbetering van de neussymptomen aantoonde voor zowel RHINOCORT AQUA (budesonide) neusspray als voor de actieve comparator (mometasonfuroaat) in vergelijking met placebo na 8 uur. Het begin werd in dit onderzoek ook beoordeeld met een piek inademingssnelheid van de neus en dit eindpunt toonde geen werkzaamheid aan voor beide actieve behandelingen. Hoewel in deze onderzoeken binnen 8-10 uur statistisch significante verbeteringen in neussymptomen werden waargenomen in vergelijking met placebo, treedt ongeveer de helft tot tweederde van de uiteindelijke klinische verbetering met RHINOCORT 100mcg AQUA (budesonide) neusspray op gedurende de eerste 1-2 dagen, en het maximale voordeel wordt mogelijk pas ongeveer 2 weken na het begin van de behandeling bereikt.
REFERENTIES
Kallen B, Rydhstroem H, Aberg A. Congenitale misvormingen na het gebruik van geïnhaleerd budesonide in de vroege zwangerschap. Obstet Gynacol 1999; 93:392-395.
2 Ericson A, Kallen B. Drugsgebruik tijdens de zwangerschap: unieke Zweedse registratiemethode die voor verbetering vatbaar is. Zweeds Agentschap voor Medische Producten 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Normale zwangerschapsuitkomsten in een populatiegebaseerd onderzoek met 2968 zwangere vrouwen die werden blootgesteld aan budesonide. J Allergie Clin Immunol 2003;! 11:736-742.
PATIËNT INFORMATIE
RHINOCORT 100mcg AQUA (budesonide) ® (RINE-o-cort AH-kwa) (budesonide) Neusspray
Alleen voor gebruik in uw neus
Lees de patiënteninformatie die bij RHINOCORT 100mcg AQUA (budesonide) neusspray wordt geleverd voordat u het gaat gebruiken en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling. Als u vragen heeft over RHINOCORT AQUA (budesonide) Neusspray, neem dan contact op met uw zorgverlener of apotheker.
Wat is RHINOCORT 100mcg AQUA (budesonide) neusspray?
RHINOCORT AQUA (budesonide) neusspray is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van seizoensgebonden en het hele jaar door allergiesymptomen bij volwassenen en kinderen van 6 jaar en ouder.
RHINOCORT AQUA Neusspray bevat budesonide, een door de mens gemaakt (synthetisch) corticosteroïd. Intranasale corticosteroïden zijn natuurlijke hormonen die in het lichaam worden aangetroffen en die de zwelling van het slijmvlies van uw neus verminderen. Wanneer u RHINOCORT 100mcg AQUA (budesonide) Neusspray in uw neus spuit, helpt het de neussymptomen van allergische rinitis (ontsteking van het neusslijmvlies), zoals verstopte neus, loopneus, jeuk en niezen te verminderen.
De veiligheid en werkzaamheid van RHINOCORT 100mcg AQUA (budesonide) neusspray is niet aangetoond bij kinderen jonger dan 6 jaar.
Wie mag RHINOCORT AQUA (budesonide) neusspray niet gebruiken?
Gebruik RHINOCORT 100mcg AQUA (budesonide) Neusspray niet:
- als u allergisch bent voor budesonide of voor één van de bestanddelen van RHINOCORT AQUA neusspray. Zie het einde van deze bijsluiter voor een volledige lijst van de ingrediënten in RHINOCORT AQUA (budesonide) Neusspray.
Wat moet ik mijn zorgverlener vertellen voordat ik RHINOCORT 100mcg AQUA (budesonide) neusspray gebruik?
Vertel uw zorgverlener of apotheker voordat u RHINOCORT AQUA (budesonide) neusspray gebruikt als u:
- onlangs in de buurt bent geweest van iemand met waterpokken of mazelen
- leverproblemen hebben
- onbehandelde infecties hebben
- ooit een infectie heeft gehad die tuberculose wordt genoemd
- een ooginfectie hebben
- onlangs een operatie of een verwonding aan uw neus heeft gehad
- andere medische aandoeningen heeft
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of RHINOCORT 100mcg AQUA (budesonide) neusspray schadelijk is voor uw ongeboren baby. Neem contact op met uw arts als u zwanger bent of van plan bent zwanger te worden.
- borstvoeding geeft of van plan bent borstvoeding te geven. RHINOCORT 100mcg AQUA (budesonide) Neusspray kan in de moedermelk terechtkomen. Praat met uw arts over de beste manier om uw baby te voeden als u RHINOCORT AQUA (budesonide) neusspray gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen.
RHINOCORT AQUA (budesonide) neusspray kan de werking van andere geneesmiddelen beïnvloeden, en andere geneesmiddelen kunnen de werking van RHINOCORT 100mcg AQUA (budesonide) neusspray beïnvloeden.
Weet welke medicijnen u gebruikt. Houd een lijst van uw medicijnen bij u om uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik RHINOCORT 100mcg AQUA (budesonide) neusspray gebruiken?
- RHINOCORT 100mcg AQUA (budesonide) Neusspray is alleen voor gebruik in uw neus. Spuit het niet in uw ogen of mond.
- Gebruik RHINOCORT AQUA (budesonide) Neusspray precies zoals uw zorgverlener u vertelt om het te gebruiken.
- Het is erg belangrijk dat u RHINOCORT AQUA (budesonide) neusspray regelmatig gebruikt. Stop niet met het gebruik van RHINOCORT AQUA (budesonide) Neusspray of verander uw dosis niet zonder met uw zorgverlener te overleggen, ook niet als u zich beter voelt.
- Neem contact op met uw zorgverlener als uw symptomen niet verbeteren na het innemen van RHINOCORT AQUA (budesonide) neusspray gedurende 2 weken of als uw symptomen verergeren.
- Een volwassene moet een jong kind helpen dit geneesmiddel te gebruiken.
- Zie de gebruiksaanwijzing voor de patiënt aan het einde van deze bijsluiter voor volledige informatie over het gebruik van RHINOCORT AQUA (budesonide) neusspray.
Wat zijn de mogelijke bijwerkingen van RHINOCORT AQUA (budesonide) neusspray?
RHINOCORT 100mcg AQUA (budesonide) neusspray kan ernstige bijwerkingen veroorzaken, waaronder:
- gat in het kraakbeen in de neus (neusseptumperforatie). Vertel het uw zorgverlener als u een fluitend geluid uit uw neus krijgt wanneer u ademt.
- langzame wondgenezing. U mag RHINOCORT 100mcg AQUA (budesonide) Neusspray pas gebruiken als uw neus is genezen als u een zweertje in uw neus heeft, als u een operatie aan uw neus heeft ondergaan of als uw neus gewond is geraakt.
- schimmelinfectie in uw neus.
- allergische reacties. Vertel het uw zorgverlener of zoek onmiddellijk medische hulp als u:
- huiduitslag, roodheid of zwelling
- ernstige jeuk
- zwelling van het gezicht, de mond en de tong
- problemen met het immuunsysteem die uw risico op infecties kunnen verhogen. U heeft meer kans op infecties als u geneesmiddelen gebruikt die het vermogen van uw lichaam om infecties te bestrijden, verzwakken. Vermijd contact met mensen die besmettelijke ziekten hebben zoals waterpokken of mazelen tijdens het gebruik van RHINOCORT AQUA (budesonide) Neusspray. Symptomen van infectie kunnen koorts, pijn, pijn, koude rillingen, vermoeidheid, misselijkheid en braken zijn.
- bijnierinsufficiëntie, Bijnierinsufficiëntie is een aandoening waarbij de bijnieren niet genoeg steroïde hormonen aanmaken. Symptomen van bijnierinsufficiëntie kunnen zijn: vermoeidheid, zwakte, misselijkheid, braken en lage bloeddruk.
- vertraagde of vertraagde groei bij kinderen. De groei van een kind moet regelmatig worden gecontroleerd tijdens het gebruik van RHINOCORT 100mcg AQUA (budesonide) neusspray.
- oogproblemen, zoals glaucoom en staar. Vertel het uw zorgverlener als u een verandering in het gezichtsvermogen heeft of een voorgeschiedenis heeft van verhoogde intraoculaire druk, glaucoom en/of cataracten.
Bel uw zorgverlener of zoek onmiddellijk medische hulp als u symptomen heeft van een van de hierboven genoemde ernstige bijwerkingen.
De meest voorkomende bijwerkingen van RHINOCORT 100mcg AQUA (budesonide) neusspray zijn:
- neusbloedingen
- keelpijn
- ademhalingsmoeilijkheden zoals piepende ademhaling of beklemming op de borst
- hoesten
- irritatie van je neus
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van RHINOCORT 100mcg AQUA (budesonide) neusspray. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw zorgverlener voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.
U kunt bijwerkingen melden aan AstraZeneca op 1-800-236-9933.
Wat moet ik weten over allergische rhinitis?
"Rhinitis" betekent ontsteking van het slijmvlies van de neus. Het wordt soms "hooikoorts" genoemd. Allergische rhinitis kan worden veroorzaakt door allergieën voor pollen, huidschilfers van dieren, huisstofmijt en schimmelsporen. Als u allergische rhinitis heeft, wordt uw neus benauwd, loopneus en jeukt. Je kunt ook veel niezen. U kunt rode, jeukende, tranende ogen hebben; jeukende keel; of verstopte, jeukende oren.
RHINOCORT AQUA (budesonide) Neusspray helpt uw neusklachten te verlichten.
Als u ook jeukende, tranende ogen heeft, moet u dit aan uw zorgverlener vertellen. Hij of zij kan aanvullende medicatie voorschrijven om deze symptomen te behandelen.
Hoe moet ik RHINOCORT AQUA (budesonide) neusspray bewaren?
- Bewaar RHINOCORT AQUA (budesonide) neusspray bij 20 ° C tot 25 ° C (68 ° F tot 77 ° F).
- RHINOCORT AQUA (budesonide) neusspray niet invriezen.
- Bescherm RHINOCORT 100mcg AQUA (budesonide) Neusspray tegen licht.
- Gebruik RHINOCORT 100mcg AQUA (budesonide) Neusspray niet nadat het op het etiket vermelde aantal verstuivingen is gebruikt (exclusief priming) of na de vervaldatum die staat vermeld op het etiket van de doos of het flesje.
- Bewaar de groene beschermkap op RHINOCORT AQUA (budesonide) neusspray wanneer deze niet in gebruik is. (Alsjeblieft zie Voor gebruik op de achterkant: ).
- Houd RHINOCORT 100mcg AQUA (budesonide) neusspray en alle medicijnen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van RHINOCORT AQUA (budesonide) neusspray:
Gebruik RHINOCORT 100mcg AQUA (budesonide) neusspray niet voor een aandoening waarvoor het niet is voorgeschreven. Geef RHINOCORT AQUA (budesonide) Neusspray niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze bijsluiter voor patiënten vat de belangrijkste informatie samen over RHINOCORT 100mcg AQUA (budesonide) neusspray. Als u meer informatie wilt, neem dan contact op met uw zorgverlener. U kunt uw apotheker of zorgverlener om informatie vragen over RHINOCORT 100mcg AQUA (budesonide) neusspray die is geschreven voor gezondheidswerkers.
Ga voor meer informatie naar www.astrazeneca-us.com of bel AstraZeneca op 1-800-236-9933.
Wat zijn de ingrediënten van RHINOCORT AQUA (budesonide) neusspray?
Actief ingrediënt: budesonide
Inactieve ingredienten: Microkristallijne cellulose en carboxymethylcellulose-natrium, watervrij dextrose, polysorbaat 80, dinatriumedetaat, kaliumsorbaat en gezuiverd water en zoutzuur.
Instructies voor gebruik van de patiënt
Alleen voor gebruik in uw neus. Niet in uw ogen of mond sprayen.
Lees de gebruiksaanwijzing voor de patiënt zorgvuldig door voordat u RHINOCORT 100mcg AQUA (budesonide) neusspray gaat gebruiken. Als u vragen heeft, stel deze dan aan uw zorgverlener
Afbeelding A 
Hoe u uw RHINOCORT AQUA (budesonide) neusspray moet primen?
Voordat u RHINOCORT AQUA (budesonide) neusspray gebruikt, moet de fles worden geprimed. Om RHINOCORT 100mcg AQUA (budesonide) neusspray te primen:
1. Trek om de groene beschermkap van de neussprayeenheid te verwijderen.
2. Schud de fles voor elk gebruik enkele seconden zachtjes.
3. Houd de fles stevig vast, zoals weergegeven in afbeelding B, met uw wijs- en middelvinger aan weerszijden van de spuittip en uw duim onder de fles.
Figuur B 
4. Activeer de pomp door snel en stevig op de witte kraag te drukken terwijl u de bodem van de fles met uw duim vasthoudt.
5. Schud de fles voorzichtig voordat u RHINOCORT AQUA (budesonide) neusspray voor het eerst gebruikt. De pomp moet worden gevuld door 8 keer op de witte kraag te drukken. De pomp is nu klaar voor gebruik. Bij dagelijks gebruik hoeft de pomp niet opnieuw te worden geprimed. Indien 2 dagen achtereen niet gebruikt, opnieuw vullen met 1 verstuiving of totdat een fijne verstuiving verschijnt. Indien niet gebruikt voor meer dan 14 dagen, spoel de spuittip van de pomp met behulp van de reinigingsstappen vermeld aan het einde van deze bijsluiter. Na het reinigen opnieuw vullen met 2 verstuivingen of tot een fijne verstuiving verschijnt.
Elke fles RHINOCORT AQUA (budesonide) neusspray bevat voldoende geneesmiddel om het geneesmiddel 120 keer uit de fles te spuiten nadat de fles is gevuld.
U mag de fles RHINOCORT 100mcg AQUA (budesonide) neusspray niet gebruiken na 120 verstuivingen. Extra verstuivingen na 120 bevatten mogelijk niet de juiste hoeveelheid geneesmiddel. U dient het aantal verstuivingen bij te houden dat u van elke fles RHINOCORT 100mcg AQUA Neusspray gebruikt en het resterende geneesmiddel dat in de fles achterblijft weg te gooien. Vul uw recept maandelijks bij.
Hoe gebruikt u uw RHINOCORT 100mcg AQUA (budesonide) neusspray?
Volg deze instructies voor het dagelijks gebruik van RHINOCORT AQUA (budesonide) Neusspray:
Figuur C 
4. Breng de spraytip in uw neusgat (de tip mag niet ver in uw neus reiken). Sluit het andere neusgat met een vinger en leun uw hoofd iets naar voren zodat de spray naar de achterkant van uw neus gaat (zie Figuur D ).
Figuur D 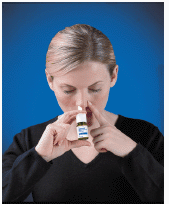
5. Activeer voor elke verstuiving het pompje door snel en stevig op de witte kraag te drukken terwijl u de onderkant van de fles met uw duim vasthoudt. Adem zachtjes naar binnen door het neusgat.
6. Na het sprayen in je neusgat, leun je je hoofd een paar seconden achterover (Zie Figuur E ).
Figuur E 
7. Als een tweede verstuiving in hetzelfde neusgat nodig is, herhaal dan stap 3 tot en met 6.
8. Herhaal stap 3 tot en met 7 voor uw andere neusgat.
9. Vermijd het snuiten van uw neus gedurende 15 minuten nadat u RHINOCORT 100mcg AQUA (budesonide) Neusspray heeft gebruikt.
10. Veeg de spuittip af met een schone tissue (zie Figuur F ), en plaats de groene beschermkap terug. Bewaar de fles rechtop.
Figuur F 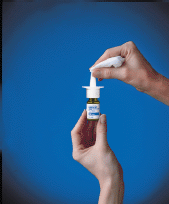
Hoe uw RHINOCORT 100mcg AQUA (budesonide) neusspray schoon te maken?
Figuur G 
Spoel de groene beschermkap en de spuittip regelmatig af. Om dit te doen:
Voor meer informatie over RHINOCORT 100mcg AQUA (budesonide) ® Neusspray kunt u bellen met het AstraZeneca Informatiecentrum, van maandag tot en met vrijdag, 08.00 - 18.00 uur ET, behalve op feestdagen op 1-800-236-9933.
