Prandin 0.5mg, 1mg, 2mg Repaglinide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Prandin 2 mg en hoe wordt het gebruikt?
Prandin 1 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van diabetes mellitus type 2 te behandelen. Prandin kan alleen of in combinatie met andere medicijnen worden gebruikt.
Prandin behoort tot een klasse geneesmiddelen die antidiabetica wordt genoemd, maglitinidederivaten.
Het is niet bekend of Prandin 1 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Prandin?
Prandin kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- hevige pijn in uw bovenbuik die zich uitbreidt naar uw rug,
- misselijkheid,
- braken,
- snelle hartslag,
- bleke of vergeelde huid,
- donker gekleurde urine,
- koorts,
- verwardheid,
- zwakheid,
- keelpijn,
- brandend in je ogen,
- huidpijn, en
- gevolgd door een rode of paarse huiduitslag die zich uitbreidt (vooral in het gezicht of bovenlichaam) en blaarvorming en vervelling veroorzaakt
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Prandin zijn:
- lage bloedsuikerspiegel,
- misselijkheid,
- diarree,
- hoofdpijn,
- rugpijn,
- gewrichtspijn, en
- verkoudheidsverschijnselen (verstopte neus, niezen, keelpijn)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Prandin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
PRANDIN (repaglinide) is een oraal bloedglucoseverlagend medicijn van de glinideklasse. Repaglinide, S(+)2-ethoxy-4(2((3-methyl-1-(2-(1piperidinyl)fenyl)-butyl)amino)-2-oxoethyl)benzoëzuur, is chemisch niet verwant aan de orale sulfonylureuminsuline secretagogen.
Structuurformule van Repaglinide
Repaglinide is een wit tot gebroken wit poeder met molecuulformule C27H36N2O4 en een molecuulgewicht van 452,6. PRANDIN-tabletten bevatten 0,5 mg, 1 mg of 2 mg repaglinide. Bovendien bevat elke tablet de volgende inactieve ingrediënten: calciumwaterstoffosfaat (watervrij), microkristallijne cellulose, maïszetmeel, polacrilinekalium, povidon, glycerol (85%), magnesiumstearaat, meglumine en poloxameer. De tabletten van 1 mg en 2 mg bevatten ijzeroxiden (respectievelijk geel en rood) als kleurstof.
INDICATIES
PRANDIN is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle te verbeteren bij volwassenen met type 2-diabetes mellitus.
Beperking van gebruik
PRANDIN mag niet worden gebruikt bij patiënten met type 1 diabetes mellitus of voor de behandeling van diabetische ketoacidose.
DOSERING EN ADMINISTRATIE
Aanbevolen dosering en toediening
De aanbevolen startdosering voor patiënten met een HbA1c van minder dan 8% is 0,5 mg oraal voor elke maaltijd. Voor patiënten bij wie het HbA1c 8% of hoger is, is de startdosering 1 of 2 mg oraal voor elke maaltijd.
Het aanbevolen doseringsbereik is 0,5 mg tot 4 mg vóór de maaltijd, met een maximale dagelijkse dosis van 16 mg. De dosis van de patiënt moet bij elke maaltijd worden verdubbeld tot maximaal 4 mg totdat een bevredigende glykemische controle is bereikt. Na elke dosisaanpassing moet er ten minste één week verstrijken om de respons te beoordelen.
Instrueer patiënten om PRANDIN binnen 30 minuten voor de maaltijd in te nemen. PRANDIN 2 mg kan 2, 3 of 4 keer per dag worden gedoseerd als reactie op veranderingen in het maaltijdpatroon van de patiënt.
Instrueer patiënten bij patiënten die maaltijden overslaan de geplande dosis PRANDIN 1 mg over te slaan om het risico op hypoglykemie te verminderen. Bij patiënten die hypoglykemie ervaren, moet de dosis PRANDIN 1 mg worden verlaagd [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Patiënten met ernstige nierinsufficiëntie
Bij patiënten met ernstige nierinsufficiëntie (CrCl = 20 tot 40 ml/min) start u met PRANDIN 0,5 mg oraal vóór elke maaltijd. Titreer de dosis geleidelijk, indien nodig, om glykemische controle te bereiken.
Dosisaanpassingen voor geneesmiddelinteracties
Dosisaanpassingen worden aanbevolen bij patiënten die gelijktijdig sterke CYP3A4- of CYP2C8-remmers of sterke CYP3A4- of CYP2C8-inductoren gebruiken (zie DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
Gelijktijdig gebruik met gemfibrozil is gecontra-indiceerd [zie CONTRA-INDICATIES ].
Vermijd gelijktijdig gebruik van PRANDIN 2 mg met clopidogrel. Als gelijktijdig gebruik niet kan worden vermeden, start dan PRANDIN met 0,5 mg vóór elke maaltijd en overschrijd een totale dagelijkse dosis van 4 mg niet (zie DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
Overschrijd een totale dagelijkse dosis van 6 mg PRANDIN 2 mg niet bij patiënten die ciclosporine krijgen [zie: DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
- mg tabletten (gele, ronde, biconvexe tabletten, met de inscriptie "745" aan de ene kant en 'C' aan de andere kant)
- 2 mg tabletten (roze, ronde, biconvexe tabletten, met de inscriptie "747" aan de ene kant en 'C' aan de andere kant)
PRANDIN (repaglinide) tabletten, 1 mg , worden geleverd als gele, ronde, biconvexe tabletten, met de inscriptie "745" aan de ene kant en 'C' aan de andere kant. Ze zijn als volgt verkrijgbaar:
Flessen van 100 NDC 60846-882-01
PRANDIN (repaglinide) tabletten, 2 mg , worden geleverd als roze, ronde, biconvexe tabletten, met de inscriptie "747" aan de ene kant en 'C' aan de andere kant. Ze zijn als volgt verkrijgbaar:
Flessen van 100 NDC 60846-884-01
Bewaren bij 20 ° tot 25 ° C (68 ° tot 77 ° F) (zie USP-gecontroleerde kamertemperatuur). Beschermen tegen vocht. Houd flessen goed gesloten.
Doseer in strakke containers met veiligheidssluitingen.
Gedistribueerd door: Amneal Specialty, een divisie van Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Herzien: maart 2019
BIJWERKINGEN
De volgende ernstige bijwerking wordt ook elders in de etikettering beschreven:
hypoglykemie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende opzet worden uitgevoerd, is het mogelijk dat de percentages van bijwerkingen die in een klinische studie zijn gemeld, niet gemakkelijk kunnen worden vergeleken met de percentages die in een andere klinische studie zijn gemeld, en mogelijk niet overeenkomen met de percentages die daadwerkelijk in de klinische praktijk zijn waargenomen.
PRANDIN 1 mg is tijdens klinische onderzoeken aan 2931 personen toegediend. Ongeveer 1500 van deze personen met diabetes type 2 zijn gedurende ten minste 3 maanden behandeld, 1000 gedurende ten minste 6 maanden en 800 gedurende ten minste 1 jaar. De meerderheid van deze personen (1228) ontving PRANDIN in een van de vijf 1-jarige, actief-gecontroleerde onderzoeken. Gedurende een jaar werd 13% van de PRANDIN 1 mg-patiënten stopgezet vanwege bijwerkingen. De meest voorkomende bijwerkingen die tot ontwenning leidden waren hyperglykemie, hypoglykemie en gerelateerde symptomen.
Tabel 1 geeft een overzicht van de vaak voorkomende bijwerkingen voor PRANDIN-patiënten in vergelijking met placebo in onderzoeken met een duur van 12 tot 24 weken.
Hypoglykemie
In klinische onderzoeken met PRANDIN 1 mg is hypoglykemie de meest waargenomen bijwerking. Milde of matige hypoglykemie trad op bij 31% van de met PRANDIN 1 mg behandelde patiënten en bij 7% van de met placebo behandelde patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypoglykemie werd gemeld bij 16% van de 1228 PRANDIN-patiënten, 20% van de 417 glyburide-patiënten en 19% van de 81 glipizide-patiënten in gecontroleerde onderzoeken van 1 jaar. Van de met PRANDIN behandelde patiënten met symptomatische hypoglykemie ontwikkelde geen enkele coma of vereiste ziekenhuisopname.
In een 24 weken durende placebogecontroleerde studie hadden patiënten die nog niet eerder oraal behandeld waren met hypoglykemische middelen en patiënten met een HbA1c lager dan 8% bij aanvang, een hogere frequentie van hypoglykemie.
Gewichtstoename
Er was geen gemiddelde toename in lichaamsgewicht wanneer patiënten die eerder waren behandeld met orale bloedglucoseverlagende middelen werden overgezet op PRANDIN. De gemiddelde gewichtstoename bij patiënten behandeld met PRANDIN 0, 5 mg en niet eerder behandeld met sulfonylureumderivaten was 3, 3%.
Cardiovasculaire gebeurtenissen
De incidentie van totale ernstige cardiovasculaire bijwerkingen, waaronder ischemie, was hoger voor PRANDIN (51/1228 of 4%) dan voor sulfonylureumderivaten (13/498 of 3%) in gecontroleerde klinische vergelijkende onderzoeken.
Zeven gecontroleerde klinische onderzoeken omvatten PRANDIN-combinatietherapie met NPH-insuline (n=431), insulineformuleringen alleen (n=388) of andere combinaties (sulfonylureumderivaat plus NPH-insuline of PRANDIN 1 mg plus metformine) (n=120). Er waren zes ernstige bijwerkingen van myocardischemie bij patiënten die werden behandeld met PRANDIN 0,5 mg plus NPH-insuline uit twee onderzoeken, en één voorval bij patiënten die alleen insulineformuleringen gebruikten uit een ander onderzoek [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Combinatietherapie met thiazolidinedionen
Hypoglykemie
Tijdens klinische onderzoeken van 24 weken durende behandeling met PRANDIN-rosiglitazon of PRANDIN-pioglitazon combinatietherapie (in totaal 250 patiënten in combinatietherapie), trad hypoglykemie (bloedglucose
Perifeer oedeem en hartfalen
Perifeer oedeem werd gemeld bij 12 van de 250 (4,8%) patiënten met combinatietherapie met PRANDIN-thiazolidinedion en bij 3 van de 124 (2,4%) patiënten met thiazolidinedion als monotherapie, in deze onderzoeken werden geen gevallen gemeld voor PRANDIN-monotherapie. Er waren meldingen bij 2 van de 250 patiënten (0,8%) die werden behandeld met PRANDIN-thiazolidinedion-therapie van episodes van oedeem met congestief hartfalen. Beide patiënten hadden een voorgeschiedenis van coronaire hartziekte en herstelden na behandeling met diuretica. Er werden geen vergelijkbare gevallen gerapporteerd in de monotherapiebehandelingsgroepen.
Gewichtstoename
De gemiddelde gewichtstoename geassocieerd met combinatie-, PRANDIN- en pioglitazontherapie was respectievelijk 5,5 kg, 0,3 kg en 2,0 kg. De gemiddelde gewichtstoename geassocieerd met combinatie-, PRANDIN- en rosiglitazontherapie was respectievelijk 4,5 kg, 1,3 kg en 3,3 kg.
Onregelmatige bijwerkingen (
Minder vaak voorkomende klinische of laboratoriumgebeurtenissen die in klinische onderzoeken werden waargenomen, waren verhoogde leverenzymen, trombocytopenie, leukopenie en anafylactoïde reacties.
Postmarketingervaring
De volgende aanvullende bijwerkingen zijn vastgesteld tijdens het gebruik van PRANDIN na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het over het algemeen niet mogelijk om een betrouwbare schatting te maken van hun frequentie of een causaal verband met blootstelling aan geneesmiddelen.
- alopecia
- Hemolytische anemie
- Pancreatitis
- Stevens-Johnson-syndroom
- Ernstige leverfunctiestoornis waaronder geelzucht en hepatitis
DRUG-INTERACTIES
Klinisch belangrijke geneesmiddelinteracties met PRANDIN
Tabel 3 bevat een lijst van geneesmiddelen met klinisch belangrijke geneesmiddelinteracties bij gelijktijdige toediening met PRANDIN 1 mg en instructies om deze te voorkomen of te behandelen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Hypoglykemie
Alle gliniden, inclusief PRANDIN 0,5 mg, kunnen hypoglykemie veroorzaken [zie ONGEWENSTE REACTIES ]. Ernstige hypoglykemie kan epileptische aanvallen veroorzaken, kan levensbedreigend zijn of de dood veroorzaken. Hypoglykemie kan het concentratievermogen en de reactietijd verminderen; dit kan een persoon en anderen in gevaar brengen in situaties waarin deze vaardigheden belangrijk zijn (bijv. autorijden of andere machines bedienen).
Hypoglykemie kan plotseling optreden en de symptomen kunnen bij elk individu verschillen en in de loop van de tijd bij hetzelfde individu veranderen. Symptomatisch bewustzijn van hypoglykemie kan minder uitgesproken zijn bij patiënten met langdurige diabetes, bij patiënten met diabetische zenuwziekte, bij patiënten die medicijnen gebruiken die het sympathische zenuwstelsel blokkeren (bijv. bètablokkers) [zie DRUG-INTERACTIES ], of bij patiënten die terugkerende hypoglykemie ervaren.
Factoren die het risico op hypoglykemie kunnen verhogen, zijn onder meer veranderingen in het maaltijdpatroon (bijv. het gehalte aan macronutriënten), veranderingen in het niveau van fysieke activiteit, veranderingen in gelijktijdig toegediende medicatie [zie DRUG-INTERACTIES ] en gelijktijdig gebruik met andere antidiabetica. Patiënten met nier- of leverinsufficiëntie lopen mogelijk een hoger risico op hypoglykemie [zie: Gebruik bij specifieke populaties ].
Patiënten moeten PRANDIN 0,5 mg vóór de maaltijd toedienen en de instructie krijgen om de dosis PRANDIN over te slaan als een maaltijd wordt overgeslagen. Bij patiënten die hypoglykemie ervaren, moet de dosis PRANDIN worden verlaagd [zie: DOSERING EN ADMINISTRATIE ]. Patiënten en zorgverleners moeten worden opgeleid om hypoglykemie te herkennen en te behandelen. Zelfcontrole van de bloedglucose speelt een essentiële rol bij de preventie en behandeling van hypoglykemie. Bij patiënten met een hoger risico op hypoglykemie en patiënten met een verminderd symptomatisch bewustzijn van hypoglykemie, wordt een verhoogde frequentie van bloedglucosecontrole aanbevolen.
Ernstige cardiovasculaire bijwerkingen bij gelijktijdig gebruik met NPH-insuline
In zeven gecontroleerde onderzoeken waren er zes ernstige bijwerkingen van myocardischemie bij patiënten die werden behandeld met PRANDIN 0,5 mg plus NPH-insuline uit twee onderzoeken, en één voorval bij patiënten die alleen insulineformuleringen gebruikten uit een ander onderzoek [zie ONGEWENSTE REACTIES ]. PRANDIN is niet geïndiceerd voor gebruik in combinatie met NPH-insuline.
Macrovasculaire resultaten
Er zijn geen klinische onderzoeken geweest die overtuigend bewijs van macrovasculaire risicovermindering met PRANDIN hebben aangetoond.

Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 104 weken durende carcinogeniteitsstudie bij ratten met doses tot 120 mg/kg/dag, wat ongeveer 60 maal de klinische blootstelling is op basis van mg/m2, was de incidentie van goedaardige adenomen van de schildklier en de lever verhoogd bij mannelijke ratten. Er werd geen bewijs van carcinogeniteit gevonden bij vrouwelijke ratten. De hogere incidenties van schildklier- en levertumoren bij mannelijke ratten werden niet gezien bij een lagere dosis van respectievelijk 30 mg/kg/dag en 60 mg/kg/dag (die respectievelijk meer dan 15 en 30 keer de klinische blootstelling zijn op een mg/m2 basis). In een 104 weken durende carcinogeniteitsstudie bij muizen met doses tot 500 mg/kg/dag werd geen bewijs van carcinogeniteit gevonden bij muizen (wat ongeveer 125 keer de klinische blootstelling is op basis van mg/m2).
Repaglinide was niet-genotoxisch in een reeks in-vivo- en in-vitro-onderzoeken: bacteriële mutagenese (Ames-test), in vitro voorwaartse celmutatietest in V79-cellen (HGPRT), in vitro chromosomale aberratietest in menselijke lymfocyten, ongeplande en replicerende DNA-synthese in rattenlever en in vivo micronucleustests bij muizen en ratten.
In een vruchtbaarheidsonderzoek bij ratten werd repaglinide toegediend aan mannelijke en vrouwelijke ratten in doses tot respectievelijk 300 en 80 mg/kg/dag. Er werden geen nadelige effecten op de vruchtbaarheid waargenomen (die meer dan 40 keer de klinische blootstelling zijn op basis van mg/m2).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beperkte gegevens over het gebruik van PRANDIN en repaglinide bij zwangere vrouwen zijn onvoldoende om een geneesmiddelgerelateerd risico op ernstige geboorteafwijkingen of miskraam te melden. Er zijn risico's voor de moeder en de foetus verbonden aan slecht gereguleerde diabetes tijdens de zwangerschap [zie Klinische overwegingen ].
Repaglidine bleek niet teratogeen te zijn in dierstudies (ratten en konijnen). Embryotoxiciteit, abnormale ontwikkeling van ledematen bij de foetus van de rat werd waargenomen bij vrouwelijke ratten die werden blootgesteld aan hoge doses in de laatste fase van de zwangerschap.
Het geschatte achtergrondrisico op ernstige geboorteafwijkingen is 6% tot 10% bij vrouwen met pre-zwangerschapsdiabetes met een HbA1c >7 en er is gerapporteerd dat het zo hoog is als 20% tot 25% bij vrouwen met een HbA1c >10. Het geschatte achtergrondrisico van een miskraam voor de aangegeven populatie is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo/foetale risico
Slecht gecontroleerde diabetes tijdens de zwangerschap verhoogt het maternale risico op diabetische ketoacidose, pre-eclampsie, spontane abortussen, vroeggeboorte, doodgeboorte en complicaties bij de bevalling. Slecht gecontroleerde diabetes verhoogt het foetale risico op ernstige geboorteafwijkingen, doodgeboorte en macrosomie-gerelateerde morbiditeit.
Gegevens
Menselijke gegevens
Er zijn onvoldoende gegevens over de ontwikkelingsrisico's die samenhangen met het gebruik van PRANDIN 2 mg bij zwangere vrouwen.
Dierlijke gegevens
Repaglinide was niet teratogeen bij ratten of konijnen bij doses van 40 maal (ratten) en ongeveer 0,8 maal (konijnen) klinische blootstelling (op basis van mg/m2) tijdens de zwangerschap. Nakomelingen van rattenmoeders die werden blootgesteld aan 15 maal de klinische blootstelling op mg/m2 basis aan repaglinide gedurende dag 17 tot 22 van de dracht en tijdens de lactatie, ontwikkelden niet-teratogene skeletmisvormingen bestaande uit verkorting, verdikking en buiging van de humerus tijdens de postnatale periode. Dit effect werd niet gezien bij doses tot 2,5 maal de klinische blootstelling (op basis van mg/m2) op dag 1 tot 22 van de zwangerschap of bij hogere doses gegeven tijdens dag 1 tot 16 van de zwangerschap.
Borstvoeding
Risico Samenvatting
Er is geen informatie over de aanwezigheid van PRANDIN 0,5 mg in moedermelk, de effecten op de zuigeling die borstvoeding geeft of de effecten op de melkproductie. Repaglinide werd aangetroffen in rattenmelk, maar als gevolg van soortspecifieke verschillen in lactatiefysiologie, kunnen diergegevens de geneesmiddelconcentraties in moedermelk mogelijk niet betrouwbaar voorspellen. De ontwikkeling en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan PRANDIN en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van PRANDIN of van onderliggende maternale aandoeningen.
Klinische overwegingen
Hoewel het niet bekend is of repaglinide in de moedermelk wordt uitgescheiden, is bekend dat sommige orale middelen langs deze weg worden uitgescheiden. Omdat het potentieel voor hypoglykemie bij zuigelingen kan bestaan en vanwege de effecten op zogende dieren, moet worden besloten of PRANDIN moet worden gestaakt bij moeders die borstvoeding geven, of dat moeders de borstvoeding moeten staken. Als PRANDIN wordt stopgezet en als een dieet alleen niet voldoende is om de bloedglucose onder controle te houden, moet insulinetherapie worden overwogen.
Gegevens
In reproductieonderzoeken bij ratten werden meetbare niveaus van repaglinide gedetecteerd in de moedermelk van de moederdieren en werden verlaagde bloedglucosespiegels waargenomen bij de jongen. Kruisbevorderende studies gaven aan dat veranderingen in het skelet [zie Zwangerschap ] kon worden opgewekt bij controle-pups die werden gezoogd door behandelde moederdieren, hoewel dit in mindere mate voorkwam dan bij in utero behandelde pups.
Pediatrisch gebruik
De veiligheid en werkzaamheid zijn niet vastgesteld bij pediatrische patiënten.
Geriatrisch gebruik
In klinische onderzoeken met een duur van 24 weken of langer waren 415 patiënten ouder dan 65 jaar en geen enkele patiënt was ouder dan 75 jaar. In een jaar durende, actief-gecontroleerde onderzoeken werden geen verschillen gezien in effectiviteit of bijwerkingen tussen deze proefpersonen en die van minder dan 65 jaar. Er was geen toename in frequentie of ernst van hypoglykemie bij oudere proefpersonen, maar een grotere gevoeligheid van sommige oudere personen voor Behandeling met PRANDIN 0,5 mg kan niet worden uitgesloten.
Nierfunctiestoornis
Er zijn farmacokinetische onderzoeken met repaglinide uitgevoerd bij patiënten met een lichte tot matige nierfunctiestoornis (CrCl = 40 tot 80 ml/min) en een ernstige nierfunctiestoornis (CrCl = 20 tot 40 ml/min). Aanpassing van de aanvangsdosis is niet nodig bij patiënten met een lichte tot matige nierfunctiestoornis. Patiënten met een ernstige nierfunctiestoornis dienen echter de behandeling met PRANDIN te starten met de dosis van 0,5 mg en zorgvuldig te worden getitreerd [zie DOSERING EN ADMINISTRATIE ].
Er zijn geen onderzoeken uitgevoerd bij patiënten met een creatinineklaring lager dan 20 ml/min of bij patiënten met nierfalen die hemodialyse nodig hadden.
Leverfunctiestoornis
Er werd een onderzoek met een enkele dosis uitgevoerd bij 12 patiënten met chronische leverziekte. Patiënten met een matige tot ernstige leverfunctiestoornis hadden hogere en langdurigere serumconcentraties. Daarom moet PRANDIN 0,5 mg met voorzichtigheid worden gebruikt bij patiënten met een verminderde leverfunctie. Langere intervallen tussen dosisaanpassingen kunnen nodig zijn om een volledige beoordeling van de respons mogelijk te maken.
OVERDOSERING
Ernstige hypoglykemische reacties met coma, toevallen of andere neurologische stoornissen kunnen optreden en vormen medische noodgevallen die onmiddellijke ziekenhuisopname vereisen. Hypoglykemische symptomen zonder bewustzijnsverlies of neurologische bevindingen moeten agressief worden behandeld met orale glucose en aanpassingen in de dosering van het geneesmiddel en/of maaltijdpatronen. Nauwlettende bewaking kan worden voortgezet totdat de arts zeker weet dat de patiënt buiten gevaar is. Patiënten moeten gedurende minimaal 24 tot 48 uur nauwlettend worden gevolgd, aangezien hypoglykemie kan terugkeren na schijnbaar klinisch herstel. Er is geen bewijs dat PRANDIN dialyseerbaar is met hemodialyse.
CONTRA-INDICATIES
PRANDIN is gecontra-indiceerd bij patiënten met:
- Gelijktijdig gebruik van gemfibrozil [zie DRUG-INTERACTIES ]
- Bekende overgevoeligheid voor repaglinide of andere inactieve ingrediënten
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Repaglinide verlaagt de bloedglucosespiegels door de afgifte van insuline door de alvleesklier te stimuleren. Deze actie is afhankelijk van functionerende bètacellen (ß) in de pancreaseilandjes. De afgifte van insuline is afhankelijk van glucose en neemt af bij lage glucoseconcentraties.
Repaglinide sluit ATP-afhankelijke kaliumkanalen in het ß-celmembraan door te binden op karakteriseerbare plaatsen. Deze blokkade van het kaliumkanaal depolariseert de ß-cel, wat leidt tot een opening van calciumkanalen. De resulterende verhoogde calciuminstroom induceert insulinesecretie. Het ionkanaalmechanisme is zeer weefselselectief met een lage affiniteit voor hart- en skeletspieren.
farmacodynamiek
Een vier weken durende, dubbelblinde, placebogecontroleerde dosis-responsstudie werd uitgevoerd bij 138 patiënten met type 2-diabetes met doses variërend van 0,25 (geen goedgekeurde dosis) tot 4 mg ingenomen bij elk van de drie maaltijden. PRANDIN-therapie resulteerde in dosisproportionele glucoseverlaging over het volledige dosisbereik. Plasma-insulinespiegels namen toe na de maaltijd en keerden terug naar de uitgangswaarde voor de volgende maaltijd. Het meeste van het nuchtere bloedglucoseverlagende effect werd aangetoond binnen 1 tot 2 weken.
In een dubbelblinde, placebogecontroleerde dosistitratiestudie van 3 maanden werden de doses PRANDIN 0,5 mg of placebo voor elke patiënt wekelijks verhoogd van 0,25 mg (geen goedgekeurde dosis) tot 0,5, 1 en 2 mg tot een maximum van 4 mg, totdat een nuchtere plasmaglucose (FPG)-spiegel
De dosering van PRANDIN 0, 5 mg ten opzichte van maaltijdgerelateerde insulineafgifte werd onderzocht in drie onderzoeken met 58 patiënten. De glycemische controle werd gehandhaafd gedurende een periode waarin het maaltijd- en doseringspatroon gevarieerd was (2, 3 of 4 maaltijden per dag; voor de maaltijd x 2, 3 of 4) vergeleken met een periode van 3 gewone maaltijden en 3 doses per dag ( voor de maaltijd x 3). Het bloedglucoseverlagende effect verschilde niet wanneer PRANDIN 0,5 mg werd toegediend aan het begin van een maaltijd, 15 minuten vóór of 30 minuten vóór de maaltijd.
Farmacokinetiek
De farmacokinetische parameters van repaglinide verkregen uit een cross-over-onderzoek met een enkelvoudige dosis bij gezonde proefpersonen en uit een onderzoek met meerdere doses, parallel, dosisproportioneel (0,5, 1, 2 en 4 mg) bij patiënten met type 2-diabetes zijn samengevat in tabellen 5 en 6. Deze gegevens geven aan dat repaglinide zich niet in serum ophoopte. De klaring van oraal repaglinide veranderde niet binnen het dosisbereik van 0,5 tot 4 mg, wat wijst op een lineair verband tussen de dosis en de plasmaspiegels van het geneesmiddel.
Absorptie
Na orale toediening wordt repaglinide volledig geabsorbeerd uit het maagdarmkanaal. Na enkelvoudige en meervoudige orale doses bij gezonde proefpersonen of bij patiënten, treden piekplasmaspiegels (Cmax) op binnen 1 uur (Tmax). Repaglinide wordt uit de bloedbaan geëlimineerd met een halfwaardetijd van ongeveer 1 uur. De gemiddelde absolute biologische beschikbaarheid is 56%. Wanneer repaglinide met voedsel werd gegeven, veranderde de gemiddelde Tmax niet, maar de gemiddelde Cmax en AUC (oppervlakte onder de tijd/plasmaconcentratiecurve) daalden met respectievelijk 20% en 12,4%.
Verdeling
Na intraveneuze (IV) dosering bij gezonde proefpersonen was het distributievolume bij steady-state (Vss) 31 l en de totale lichaamsklaring (CL) 38 l/u. Eiwitbinding en binding aan humaan serumalbumine was groter dan 98%.
Metabolisme en eliminatie
Repaglinide wordt volledig gemetaboliseerd door oxidatieve biotransformatie en directe conjugatie met glucuronzuur na een intraveneuze of orale dosis. De belangrijkste metabolieten zijn een geoxideerd dicarbonzuur (M2), het aromatische amine (M1) en het acylglucuronide (M7). Van het cytochroom P-450-enzymsysteem, met name 2C8 en 3A4, is aangetoond dat het betrokken is bij de N-dealkylering van repaglinide tot M2 en de verdere oxidatie tot M1. Metabolieten dragen niet bij aan het glucoseverlagende effect van repaglinide. Binnen 96 uur na toediening van 14C-repaglinide als een enkelvoudige, orale dosis, werd ongeveer 90% van het radiolabel teruggevonden in de feces en ongeveer 8% in de urine. Slechts 0,1% van de dosis wordt als moederverbinding in de urine uitgescheiden. De belangrijkste metaboliet (M2) was goed voor 60% van de toegediende dosis. Minder dan 2% van het oorspronkelijke geneesmiddel werd teruggevonden in de ontlasting. Repaglinide lijkt een substraat te zijn voor een actieve leveropnametransporter (organisch aniontransporterend eiwit OATP1B1).
Variabiliteit van blootstelling
De AUC van repaglinide na meerdere doses van 0,25 tot 4 mg bij elke maaltijd varieert over een groot bereik. De intra-individuele en interindividuele variatiecoëfficiënten waren respectievelijk 36% en 69%. De AUC over het therapeutische dosisbereik omvatte 69 tot 1005 ng/ml*uur, maar een AUC-blootstelling tot 5417 ng/ml*uur werd bereikt in dosisverhogingsstudies zonder duidelijke nadelige gevolgen.
Specifieke populaties
geriatrische
Gezonde vrijwilligers werden behandeld met een regime van 2 mg PRANDIN 0,5 mg vóór elk van de 3 maaltijden. Er waren geen significante verschillen in de farmacokinetiek van repaglinide tussen de groep patiënten Gebruik bij specifieke populaties ].
Geslacht
Een vergelijking van de farmacokinetiek bij mannen en vrouwen toonde aan dat de AUC over het dosisbereik van 0,5 mg tot 4 mg 15% tot 70% hoger was bij vrouwen met type 2-diabetes. Dit verschil werd niet weerspiegeld in de frequentie van hypoglykemische episodes (mannen: 16%; vrouwen: 17%) of andere bijwerkingen.
Ras
Er zijn geen farmacokinetische onderzoeken uitgevoerd om de effecten van ras te beoordelen, maar in een Amerikaanse 1-jarige studie bij patiënten met diabetes type 2 was het bloedglucoseverlagende effect vergelijkbaar tussen blanken (n=297) en Afro-Amerikanen (n= 33). In een dosis-responsonderzoek in de VS was er geen duidelijk verschil in blootstelling (AUC) tussen blanken (n=74) en Iberiërs (n=33).
Nierfunctiestoornis
De farmacokinetiek van een enkelvoudige dosis en steady-state van repaglinide werd vergeleken tussen patiënten met type 2-diabetes en een normale nierfunctie (CrCl > 80 ml/min), lichte tot matige nierfunctiestoornis (CrCl = 40 tot 80 ml/min) en ernstige nierfunctiestoornis (CrCl = 20 tot 40 ml/min). Zowel de AUC als de Cmax van repaglinide waren vergelijkbaar bij patiënten met een normale en lichte tot matige nierfunctiestoornis (gemiddelde waarden respectievelijk 56,7 ng/ml*uur versus 57,2 ng/ml*uur en 37,5 ng/ml versus 37,7 ng/ml). met een ernstig verminderde nierfunctie hadden verhoogde gemiddelde AUC- en Cmax-waarden (respectievelijk 98,0 ng/ml*uur en 50,7 ng/ml), maar deze studie toonde slechts een zwakke correlatie tussen repaglinidespiegels en creatinineklaring.
Leverfunctiestoornis
Er werd een open-labelonderzoek met een enkelvoudige dosis uitgevoerd bij 12 gezonde proefpersonen en 12 patiënten met chronische leverziekte (CLD), ingedeeld volgens de Child-Pugh-schaal en de cafeïneklaring. Patiënten met een matige tot ernstige leverfunctiestoornis hadden hogere en langere serumconcentraties van zowel totaal als ongebonden repaglinide dan gezonde proefpersonen (AUCgezond: 91,6 ng/ml*uur; AUCCLD-patiënten: 368,9 ng/ml*uur; Cmax, gezond: 46,7 ng/ml; Cmax, CLD-patiënten: 105,4 ng/ml). De AUC was statistisch gecorreleerd met de klaring van cafeïne. Er werd geen verschil in glucoseprofielen waargenomen tussen patiëntengroepen.
Geneesmiddel-geneesmiddelinteracties
Geneesmiddelinteractiestudies uitgevoerd bij gezonde vrijwilligers tonen aan dat PRANDIN 0,5 mg geen klinisch relevant effect had op de farmacokinetische eigenschappen van digoxine, theofylline of warfarine. Gelijktijdige toediening van cimetidine met PRANDIN 1 mg veranderde de absorptie en dispositie van repaglinide niet significant.
Bovendien werden de volgende geneesmiddelen onderzocht bij gezonde vrijwilligers met gelijktijdige toediening van PRANDIN.
Klinische studies
Monotherapie-proeven
Een dubbelblind, placebogecontroleerd onderzoek werd uitgevoerd bij 362 patiënten die gedurende 24 weken werden behandeld. HbA1c voor de met PRANDIN behandelde groepen (groepen van 1 en 4 mg gecombineerd) was aan het einde van het onderzoek verlaagd in vergelijking met de met placebo behandelde groep bij niet eerder behandelde patiënten en bij patiënten die eerder waren behandeld met orale bloedglucoseverlagende middelen met 2,1% en 1,7%, respectievelijk. In dit onderzoek met vaste dosis vertoonden patiënten die nog niet eerder waren behandeld met orale behandeling met hypoglycemische middelen en patiënten met een HbA1c van minder dan 8% bij baseline, een sterkere bloedglucoseverlaging.
Combinatieproeven
PRANDIN in combinatie met metformine
PRANDIN werd onderzocht in combinatie met metformine bij 83 patiënten die niet voldoende onder controle waren met lichaamsbeweging, dieet en metformine alleen. De dosering van PRANDIN 2 mg werd getitreerd gedurende 4 tot 8 weken, gevolgd door een onderhoudsperiode van 3 maanden. Combinatietherapie met PRANDIN 1 mg en metformine resulteerde in een statistisch significante verbetering van HbA1c en nuchtere plasmaglucose (FPG) vergeleken met PRANDIN 2 mg of metformine monotherapie (tabel 8). In deze studie, waarbij de metforminedosering constant werd gehouden, vertoonde de combinatietherapie van PRANDIN en metformine dosissparende effecten met betrekking tot PRANDIN. De verbetering in HbA1c en FPG van de combinatiegroep werd bereikt bij een lagere dagelijkse PRANDIN 0,5 mg dosering dan in de PRANDIN monotherapiegroep (tabel 8).
PRANDIN 1 mg in combinatie met pioglitazon
Een combinatietherapieregime van PRANDIN en pioglitazon (N=123) werd vergeleken met PRANDIN alleen (N=61) en pioglitazon alleen (N=62) in een 24 weken durend onderzoek waaraan 246 patiënten deelnamen die eerder waren behandeld met sulfonylureumderivaten of metformine als monotherapie (HbA1c > 7,0%). De dosering van PRANDIN 1 mg werd gedurende de eerste 12 weken getitreerd, gevolgd door een onderhoudsperiode van 12 weken. Combinatietherapie resulteerde in een statistisch significante verbetering van HbA1c en FPG in vergelijking met monotherapie (Figuur 1). De veranderingen ten opzichte van baseline voor voltooiers in FPG (mg/dL) en HbA1c (%), respectievelijk: -39,8 mg/dL en -0,1% voor PRANDIN, -35,3 mg/dL en -0,1% voor pioglitazon en -92,4 mg/ dL en -1,9% voor de combinatie. In deze studie, waarbij de pioglitazondosering constant werd gehouden, vertoonde de combinatietherapiegroep dosissparende effecten met betrekking tot PRANDIN (zie figuur 1 Legenda). De verbetering in HbA1c en FPG van de combinatiegroep werd bereikt bij een lagere dagelijkse PRANDIN-dosering dan in de PRANDIN-monotherapiegroep.
Figuur 1: PRANDIN in combinatie met Pioglitazon: HbA1c-waarden
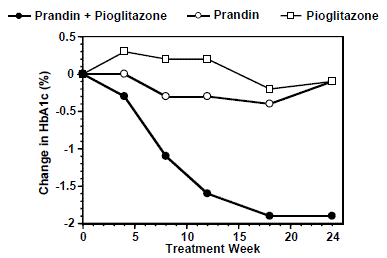
LEGENDE
HbA1c-waarden per studieweek voor patiënten die de studie hebben voltooid (combinatie, N = 101; PRANDIN 1 mg, N = 35, pioglitazon, N = 26). Proefpersonen met een FPG van meer dan 270 mg/dL werden uit het onderzoek teruggetrokken.
Dosis Pioglitazon: vastgesteld op 30 mg/dag; PRANDIN 1 mg mediane einddosis: 6 mg/dag voor combinatie en 10 mg/dag voor monotherapie.
PRANDIN in combinatie met rosiglitazon
Een combinatietherapieregime van PRANDIN en rosiglitazon werd vergeleken met monotherapie met een van beide middelen alleen in een 24 weken durende studie waaraan 252 patiënten deelnamen die eerder waren behandeld met sulfonylureumderivaat of metformine (HbA1c > 7,0%). Combinatietherapie resulteerde in een statistisch significante verbetering van HbA1c en FPG in vergelijking met monotherapie (tabel 9 hieronder). De glykemische effecten van de combinatietherapie waren dosissparend met betrekking tot zowel de totale dagelijkse dosering PRANDIN 1 mg als de totale dagelijkse dosering rosiglitazon (zie tabel 9 Legenda). De verbetering in HbA1c en FPG van de combinatietherapiegroep werd bereikt met een lagere dagelijkse dosis PRANDIN 1 mg en rosiglitazon, in vergelijking met de respectievelijke monotherapiegroepen.
PATIËNT INFORMATIE
Hypoglykemie
Informeer patiënten dat PRANDIN 2 mg hypoglykemie kan veroorzaken en instrueer patiënten en hun zorgverleners over zelfmanagementprocedures, waaronder glucosemonitoring en behandeling van hypoglykemie. Informeer patiënten dat hun concentratie- en reactievermogen verminderd kan zijn als gevolg van hypoglykemie. Bij patiënten met een hoger risico op hypoglykemie en bij patiënten met een verminderd symptomatisch bewustzijn van hypoglykemie, wordt een verhoogde frequentie van bloedglucosecontrole aanbevolen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Administratie
Instrueer patiënten om PRANDIN 0,5 mg binnen 30 minuten voor de maaltijd in te nemen. Instrueer patiënten om hun dosis PRANDIN over te slaan wanneer een maaltijd wordt overgeslagen [zie DOSERING EN ADMINISTRATIE ].
Geneesmiddelinteracties
Bespreek mogelijke geneesmiddelinteracties met patiënten en informeer hen over mogelijke geneesmiddelinteracties met PRANDIN [zie DRUG-INTERACTIES ].
