Actos 15mg, 30mg Pioglitazone Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Actos en hoe wordt het gebruikt?
Actos 15 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van diabetes mellitus type 2 te behandelen. Actos kan alleen of in combinatie met andere medicijnen worden gebruikt.
Actos is een middel tegen diabetes, thiazolidinedionen.
Het is niet bekend of Actos 15 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Actos 15 mg?
Actos kan ernstige bijwerkingen veroorzaken, waaronder:
- kortademigheid (vooral bij het liggen),
- ongebruikelijke vermoeidheid,
- zwelling,
- snelle gewichtstoename,
- roze of rode urine,
- pijnlijk of moeilijk plassen,
- nieuwe of verslechterende drang om te plassen,
- visie verandert, en
- plotselinge, ongewone pijn in uw hand, arm of voet
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Actos zijn:
- hoofdpijn,
- spierpijn, en
- verkoudheidsverschijnselen (verstopte neus, sinuspijn, niezen, keelpijn)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
Dit zijn niet alle mogelijke bijwerkingen van Actos. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
CONGESTIEF HARTFALEN
- Thiazolidinedionen, waaronder ACTOS 15 mg, veroorzaken of verergeren congestief hartfalen bij sommige patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Na het starten met ACTOS 30 mg en na dosisverhogingen, moet u de patiënten zorgvuldig controleren op tekenen en symptomen van hartfalen (bijv. overmatige, snelle gewichtstoename, kortademigheid en/of oedeem). Als zich hartfalen ontwikkelt, moet dit worden behandeld volgens de huidige zorgstandaarden en moet staken of dosisverlaging van ACTOS 15 mg worden overwogen.
- ACTOS wordt niet aanbevolen bij patiënten met symptomatisch hartfalen.
- Het starten van ACTOS bij patiënten met gevestigde New York Heart Association (NYHA) Klasse III of IV hartfalen is gecontra-indiceerd [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
OMSCHRIJVING
ACTOS-tabletten zijn een thiazolidinedion en een agonist voor peroxisoom proliferator-geactiveerde receptor (PPAR) gamma die een oraal antidiabetisch medicijn bevat: pioglitazon.
Pioglitazon [(±)-5-[[4-[2-(5-ethyl-2-pyridinyl)ethoxy]fenyl]methyl]-2,4-]thiazolidinedionmonohydrochloride bevat één asymmetrische koolstof en de verbinding wordt gesynthetiseerd en gebruikt als het racemische mengsel. De twee enantiomeren van pioglitazon zetten elkaar in vivo om. Er werden geen verschillen gevonden in de farmacologische activiteit tussen de twee enantiomeren. De structuurformule is als volgt:
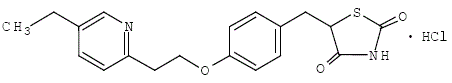
Pioglitazonhydrochloride is een geurloos wit kristallijn poeder met de molecuulformule C19H20N2O3S•HCl en een molecuulgewicht van 392,90 dalton. Het is oplosbaar in N, N-dimethylformamide, enigszins oplosbaar in watervrije ethanol, zeer slecht oplosbaar in aceton en acetonitril, praktisch onoplosbaar in water en onoplosbaar in ether.
ACTOS is verkrijgbaar als tablet voor orale toediening met 15 mg, 30 mg of 45 mg pioglitazon (als basis) geformuleerd met de volgende hulpstoffen: lactos 30mge monohydraat NF, hydroxypropylcellulose NF, carboxymethylcellulose calcium NF en magnesiumstearaat NF.
INDICATIES
Monotherapie en combinatietherapie
ACTOS 30 mg is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle te verbeteren bij volwassenen met type 2 diabetes mellitus in meerdere klinische settings [zie Klinische studies ].
Belangrijke gebruiksbeperkingen
ACTOS 15 mg oefent zijn antihyperglykemische werking alleen uit in aanwezigheid van endogene insuline. ACTOS 30 mg mag niet worden gebruikt voor de behandeling van type 1 diabetes of diabetische ketoacidose, omdat het in deze situaties niet effectief zou zijn.
Wees voorzichtig bij patiënten met een leverziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
DOSERING EN ADMINISTRATIE
Aanbevelingen voor alle patiënten
ACTOS 15 mg moet eenmaal daags worden ingenomen en kan zonder rekening worden gehouden met maaltijden.
De aanbevolen startdosering voor patiënten zonder congestief hartfalen is eenmaal daags 15 mg of 30 mg.
De aanbevolen startdosering voor patiënten met congestief hartfalen (NYHA klasse I of II) is eenmaal daags 15 mg.
De dosis kan worden getitreerd in stappen van 15 mg tot maximaal 45 mg eenmaal daags op basis van de glykemische respons zoals bepaald door HbA1c.
Controleer na het starten van ACTOS 30 mg of bij dosisverhoging de patiënten zorgvuldig op bijwerkingen die verband houden met vochtretentie, zoals gewichtstoename, oedeem en tekenen en symptomen van congestief hartfalen (zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Levertesten (serumalanine- en aspartaataminotransferasen, alkalische fosfatase en totaal bilirubine) moeten worden uitgevoerd voordat met ACTOS wordt begonnen. Routinematige periodieke controle van levertesten tijdens behandeling met ACTOS 30 mg wordt niet aanbevolen bij patiënten zonder leverziekte. Patiënten die afwijkende levertesten hebben voordat met ACTOS wordt gestart of bij wie abnormale levertesten worden vastgesteld tijdens het gebruik van ACTOS, moeten worden behandeld zoals beschreven onder Waarschuwingen en voorzorgsmaatregelen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Gelijktijdig gebruik met een insulinesecretagoog of insuline
Als hypoglykemie optreedt bij een patiënt die gelijktijdig ACTOS 30 mg en een insulinesecretagoog (bijv. sulfonylureumderivaat) krijgt toegediend, moet de dosis van het insulinesecretagoog worden verlaagd.
Als hypoglykemie optreedt bij een patiënt die gelijktijdig ACTOS 30 mg en insuline krijgt toegediend, moet de dosis insuline met 10% tot 25% worden verlaagd. Verdere aanpassingen van de insulinedosis moeten individueel worden bepaald op basis van de glykemische respons.
Gelijktijdig gebruik met sterke CYP2C8-remmers
Gelijktijdige toediening van ACTOS 30 mg en gemfibrozil, een sterke CYP2C8-remmer, verhoogt de blootstelling aan pioglitazon ongeveer driemaal. Daarom is de maximale aanbevolen dosis ACTOS 15 mg per dag bij gebruik in combinatie met gemfibrozil of andere sterke CYP2C8-remmers (zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
Ronde tablet bevat pioglitazon als volgt:
- 15 mg: wit tot gebroken wit, met de inscriptie "ACTOS" aan de ene kant en "15" aan de andere kant
- 30 mg: wit tot gebroken wit, met de inscriptie "ACTOS" aan de ene kant en "30" aan de andere kant
- 45 mg: wit tot gebroken wit, met de inscriptie "ACTOS" aan de ene kant en "45" aan de andere kant
Opslag en behandeling
ACTOS is als volgt verkrijgbaar in tabletten van 15 mg, 30 mg en 45 mg:
15 mg-tablet : Witte tot gebroken witte, ronde, convexe tablet zonder breukgleuf met aan de ene kant "ACTOS" en aan de andere kant "15", verkrijgbaar in:
NDC 64764-151-04 Flessen van 30 NDC 64764-151-05 Flessen van 90 NDC 64764-151-06 Flessen van 500
30 mg-tablet Witte tot gebroken witte, ronde, platte tablet zonder breukstreep met aan de ene kant "ACTOS" en aan de andere kant "30", verkrijgbaar in:
NDC 64764-301-14 Flessen van 30 NDC 64764-301-15 Flessen van 90 NDC 64764-301-16 Flessen van 500
45 mg-tablet : Witte tot gebroken witte, ronde, platte tablet zonder breukstreep met aan de ene kant "ACTOS" en aan de andere kant "45", verkrijgbaar in:
NDC 64764-451-24 Flessen van 30 NDC 64764-451-25 Flessen van 90 NDC 64764-451-26 Flessen van 500
Opslag
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30 ° C (59-86 ° F) [zie USP-gecontroleerde kamertemperatuur]. Verpakking goed gesloten houden en beschermen tegen licht, vocht en vochtigheid.
Gedistribueerd door: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Herzien: december 2017
BIJWERKINGEN
De volgende ernstige bijwerkingen worden elders in de etikettering besproken:
- Congestief hartfalen [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Oedeem [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- fracturen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Meer dan 8500 patiënten met diabetes type 2 zijn behandeld met ACTOS in gerandomiseerde, dubbelblinde, gecontroleerde klinische onderzoeken, waaronder 2605 patiënten met diabetes type 2 en macrovasculaire aandoeningen die werden behandeld met ACTOS 30 mg in de klinische proef PROactive. In deze onderzoeken zijn meer dan 6000 patiënten gedurende zes maanden of langer met ACTOS behandeld, meer dan 4500 patiënten zijn gedurende een jaar of langer met ACTOS 15 mg behandeld en meer dan 3000 patiënten zijn gedurende ten minste twee jaar met ACTOS behandeld.
In zes gepoolde placebogecontroleerde monotherapie-onderzoeken van 16 tot 26 weken en 16 tot 24 weken durende add-on combinatietherapie, was de incidentie van stopzettingen als gevolg van bijwerkingen 4,5% voor patiënten die werden behandeld met ACTOS 30 mg en 5,8% voor vergelijkingstherapieën. behandelde patiënten. De meest voorkomende bijwerkingen die tot ontwenning leidden, waren gerelateerd aan onvoldoende glykemische controle, hoewel de incidentie van deze bijwerkingen lager was (1,5%) met ACTOS 30 mg dan met placebo (3,0%).
In de PROactive-studie was de incidentie van stopzettingen als gevolg van bijwerkingen 9,0% voor patiënten die werden behandeld met ACTOS 30 mg en 7,7% voor met placebo behandelde patiënten. Congestief hartfalen was de meest voorkomende ernstige bijwerking die leidde tot ontwenning bij 1,3% van de patiënten die werden behandeld met ACTOS 30 mg en bij 0,6% van de patiënten die werden behandeld met placebo.
Veelvoorkomende bijwerkingen: monotherapie-onderzoeken van 16 tot 26 weken
Tabel 1 geeft een samenvatting van de incidentie en het type vaak voorkomende bijwerkingen die zijn gemeld in drie gepoolde 16 tot 26 weken durende placebogecontroleerde monotherapieonderzoeken met ACTOS. bij patiënten behandeld met ACTOS 15 mg dan bij patiënten die placebo kregen. Geen van deze bijwerkingen was gerelateerd aan de ACTOS-dosis.
Veelvoorkomende bijwerkingen: proeven van add-on-combinatietherapie van 16 tot 24 weken
Tabel 2 geeft een samenvatting van de totale incidentie en soorten veelvoorkomende bijwerkingen die zijn gemeld in onderzoeken met ACTOS als toevoeging aan sulfonylureumderivaten. dosis ACTOS.
Tabel 3 geeft een samenvatting van de totale incidentie en soorten veelvoorkomende bijwerkingen die zijn gemeld in onderzoeken met ACTOS 30 mg als aanvulling op metformine. geteste dosis ACTOS.
Tabel 4 geeft een samenvatting van de incidentie en soorten vaak voorkomende bijwerkingen die zijn gemeld in onderzoeken met ACTOS als aanvulling op insuline. Termen die worden vermeld, vertegenwoordigen termen die voorkwamen met een incidentie van >5% en vaker bij de hoogste geteste dosis ACTOS.
Tabel 5 geeft een samenvatting van de totale incidentie en typen veelvoorkomende bijwerkingen die in de PROactive-studie zijn gemeld. placebo gekregen.
Congestief hartfalen
Een samenvatting van de incidentie van bijwerkingen gerelateerd aan congestief hartfalen wordt gegeven in Tabel 6 voor de 16 tot 24 weken durende add-on bij sulfonylureumonderzoeken, voor de 16 tot 24 weken durende add-on bij insulineonderzoeken en voor de 16 tot 24 weken durende toevoeging aan metformineonderzoeken. Geen van de gebeurtenissen was fataal.
Patiënten met type 2-diabetes en NYHA klasse II of vroege klasse III congestief hartfalen werden gerandomiseerd en kregen 24 weken dubbelblinde behandeling met ofwel 30 mg ACTOS in een dagelijkse dosis van 30 mg tot 45 mg (n=262) ofwel glyburide in een dagelijkse dosis. van 10 mg tot 15 mg (n=256). Tabel 7 geeft een samenvatting van de incidentie van bijwerkingen gerelateerd aan congestief hartfalen die in dit onderzoek zijn gerapporteerd.
Voorvallen van congestief hartfalen die leidden tot ziekenhuisopname die plaatsvonden tijdens de PROactive-studie zijn samengevat in Tabel 8.
Cardiovasculaire veiligheid
In het PROactive-onderzoek werden 5238 patiënten met type 2-diabetes en een voorgeschiedenis van macrovasculaire ziekte gerandomiseerd naar ACTOS (N=2605), geforceerd getitreerd tot 45 mg per dag of placebo (N=2633) als aanvulling op de standaardbehandeling. Bijna alle patiënten (95%) kregen cardiovasculaire medicatie (bètablokkers, ACE-remmers, angiotensine II-receptorblokkers, calciumkanaalblokkers, nitraten, diuretica, aspirine, statines en fibraten). Bij aanvang hadden de patiënten een gemiddelde leeftijd van 62 jaar, een gemiddelde duur van diabetes van 9,5 jaar en een gemiddeld HbA1c van 8,1%. De gemiddelde duur van de follow-up was 34,5 maanden. Het primaire doel van deze studie was om het effect van ACTOS op mortaliteit en macrovasculaire morbiditeit te onderzoeken bij patiënten met type 2 diabetes mellitus die een hoog risico liepen op macrovasculaire gebeurtenissen. De primaire werkzaamheidsvariabele was de tijd tot het eerste optreden van een gebeurtenis in een cardiovasculair samengesteld eindpunt dat mortaliteit door alle oorzaken, niet-fataal myocardinfarct (MI) inclusief stille MI, beroerte, acuut coronair syndroom, hartinterventie inclusief coronaire bypass-transplantatie of percutane interventie, grote beenamputatie boven de enkel en bypassoperatie of revascularisatie in het been. Een totaal van 514 (19,7%) patiënten behandeld met ACTOS 15 mg en 572 (21,7%) met placebo behandelde patiënten ondervonden ten minste één voorval vanaf het primaire samengestelde eindpunt (hazard ratio 0,90; 95% betrouwbaarheidsinterval: 0,80; 1,02; p=0,10 ).
Hoewel er geen statistisch significant verschil was tussen ACTOS en placebo voor wat betreft de driejaarsincidentie van een eerste voorval binnen deze samenstelling, was er geen toename van de mortaliteit of van het totale aantal macrovasculaire voorvallen met ACTOS. Het aantal eerste voorvallen en het totale aantal individuele voorvallen dat bijdraagt aan het primaire samengestelde eindpunt wordt weergegeven in Tabel 9.
Gewichtstoename
Dosisgerelateerde gewichtstoename treedt op wanneer ACTOS 30 mg alleen of in combinatie met andere antidiabetica wordt gebruikt. Het mechanisme van gewichtstoename is onduidelijk, maar betreft waarschijnlijk een combinatie van vochtretentie en vetophoping.
Tabellen 10 en 11 geven een overzicht van de veranderingen in lichaamsgewicht met ACTOS en placebo in de 16 tot 26 weken durende gerandomiseerde, dubbelblinde monotherapie en 16 tot 24 weken durende combinatie-add-on-therapiestudies en in de PROactive-studie.
Oedeem
Oedeem veroorzaakt door het gebruik van ACTOS is omkeerbaar wanneer ACTOS wordt stopgezet. Het oedeem vereist meestal geen ziekenhuisopname, tenzij er gelijktijdig congestief hartfalen is. Tabel 12 geeft een samenvatting van de frequentie en soorten oedeembijwerkingen die optreden bij klinische onderzoeken van ACTOS 30 mg.
Levereffecten
Er is tot op heden geen bewijs van geïnduceerde hepatotoxiciteit met ACTOS in de ACTOS-database met gecontroleerde klinische onderzoeken. Een gerandomiseerde, dubbelblinde studie van 3 jaar waarin ACTOS 15 mg werd vergeleken met glyburide als aanvulling op metformine- en insulinetherapie, was specifiek ontworpen om de incidentie van serum-ALAT-verhoging tot meer dan driemaal de bovengrens van het referentiebereik te evalueren, gemeten elke acht weken gedurende de eerste 48 weken van de proef en daarna elke 12 weken. Een totaal van 3/1051 (0,3%) patiënten behandeld met ACTOS en 9/1046 (0,9%) patiënten behandeld met glyburide ontwikkelden ALT-waarden die hoger waren dan driemaal de bovengrens van het referentiebereik. Geen van de patiënten die tot op heden met ACTOS werden behandeld in de ACTOS-database van gecontroleerde klinische onderzoeken, had een serum-ALAT van meer dan driemaal de bovengrens van het referentiebereik en een corresponderend totaal bilirubine dat groter was dan tweemaal de bovengrens van het referentiebereik, een combinatie die voorspellend is voor het potentieel voor ernstige door geneesmiddelen veroorzaakte leverbeschadiging.
Hypoglykemie
In de klinische onderzoeken met ACTOS 15 mg werden bijwerkingen van hypoglykemie gemeld op basis van klinisch oordeel van de onderzoekers en hoefden ze niet te worden bevestigd met glucosetesten via een vingerprik.
In het 16 weken durende onderzoek naar toevoeging aan sulfonylureumderivaten was de incidentie van gerapporteerde hypoglykemie 3,7% met ACTOS 30 mg en 0,5% met placebo. In het 16 weken durende onderzoek naar toevoeging aan insuline was de incidentie van gerapporteerde hypoglykemie 7,9% met ACTOS 15 mg, 15,4% met ACTOS 30 mg en 4,8% met placebo.
De incidentie van gerapporteerde hypoglykemie was hoger met ACTOS 45 mg in vergelijking met ACTOS 30 mg in zowel het 24 weken durende onderzoek als add-on bij sulfonylureumderivaat (15,7% vs. 13,4%) en in het 24 weken durende onderzoek bij add-on bij insuline (47,8 % versus 43,5%.
Drie patiënten in deze vier onderzoeken werden in het ziekenhuis opgenomen vanwege hypoglykemie. Alle drie de patiënten kregen ACTOS 30 mg (0,9%) in het 24 weken durende add-on-insuline-onderzoek. Nog eens 14 patiënten meldden ernstige hypoglykemie (gedefinieerd als het veroorzaken van aanzienlijke interferentie met de gebruikelijke activiteiten van de patiënt) waarvoor geen ziekenhuisopname nodig was. Deze patiënten kregen ACTOS 45 mg in combinatie met sulfonylureumderivaat (n=2) of ACTOS 30 mg of 45 mg in combinatie met insuline (n=12).
Urineblaastumoren
Tumoren werden waargenomen in de urineblaas van mannelijke ratten in de twee jaar durende carcinogeniteitsstudie [zie: Niet-klinische toxicologie ]. Tijdens het driejarige klinische PROactive-onderzoek werd bij 14 van de 2605 (0,54%) gerandomiseerde naar ACTOS en 5 van de 2633 (0,19%) gerandomiseerde naar placebo blaaskanker gediagnosticeerd. Na uitsluiting van patiënten bij wie de blootstelling aan het onderzoeksgeneesmiddel minder dan één jaar was op het moment van de diagnose van blaaskanker, waren er 6 (0,23%) gevallen op ACTOS 15 mg en twee (0,08%) gevallen op placebo. Na voltooiing van het onderzoek werd een grote subgroep van patiënten gedurende maximaal 10 extra jaren geobserveerd, met weinig extra blootstelling aan ACTOS. Tijdens de 13 jaar van zowel PROactive als observationele follow-up, verschilde het optreden van blaaskanker niet tussen patiënten gerandomiseerd naar ACTOS of placebo (HR = 1,00; 95% BI: 0,59-1,72) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Laboratoriumafwijkingen
Hematologische effecten
ACTOS 15 mg kan verlagingen van hemoglobine en hematocriet veroorzaken. In placebogecontroleerde monotherapieonderzoeken daalden de gemiddelde hemoglobinewaarden met 2% tot 4% bij patiënten die met ACTOS werden behandeld, vergeleken met een gemiddelde verandering in hemoglobine van -1% tot +1% bij met placebo behandelde patiënten. Deze veranderingen traden voornamelijk op binnen de eerste 4 tot 12 weken van de therapie en bleven daarna relatief constant. Deze veranderingen kunnen verband houden met een verhoogd plasmavolume geassocieerd met ACTOS 30 mg-therapie en zijn waarschijnlijk niet geassocieerd met klinisch significante hematologische effecten.
Creatine fosfokinase
Tijdens in het protocol gespecificeerde meting van serumcreatinefosfokinase (CPK) in klinische onderzoeken met ACTOS 15 mg, werd een geïsoleerde verhoging van CPK tot meer dan 10 keer de bovengrens van het referentiebereik waargenomen bij negen (0,2%) patiënten die met ACTOS werden behandeld (waarden van 2150 tot 11400 IE/L) en bij patiënten die niet met een vergelijkingsmiddel werden behandeld. Zes van deze negen patiënten bleven ACTOS 15 mg krijgen, bij twee patiënten werd vastgesteld dat ze de CPK-verhoging hadden op de laatste dag van dosering en bij één patiënt stopte ACTOS vanwege de verhoging. Deze verhogingen verdwenen zonder duidelijke klinische gevolgen. De relatie tussen deze gebeurtenissen en de behandeling met ACTOS 30 mg is niet bekend.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van ACTOS na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het over het algemeen niet mogelijk om een betrouwbare schatting van hun frequentie te maken of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
- Nieuw ontstaan of verergerend diabetisch macula-oedeem met verminderde gezichtsscherpte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Fataal en niet-fataal leverfalen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Postmarketingmeldingen van congestief hartfalen zijn gemeld bij patiënten die met ACTOS werden behandeld, zowel met als zonder eerder bekende hartziekte en zowel met als zonder gelijktijdige toediening van insuline.
Tijdens postmarketingervaring zijn er meldingen geweest van ongewoon snelle gewichtstoenames en toenames die groter zijn dan die welke algemeen worden waargenomen in klinische onderzoeken. Patiënten die dergelijke verhogingen ervaren, moeten worden beoordeeld op vochtophoping en volumegerelateerde voorvallen zoals overmatig oedeem en congestief hartfalen [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
DRUG-INTERACTIES
Sterke CYP2C8-remmers
Een remmer van CYP2C8 (bijv. gemfibrozil) verhoogt significant de blootstelling (gebied onder de serumconcentratie-tijdcurve of AUC) en halfwaardetijd (t½) van pioglitazon. Daarom is de maximale aanbevolen dosis ACTOS 15 mg per dag indien gebruikt in combinatie met gemfibrozil of andere sterke CYP2C8-remmers [zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
CYP2C8-inductoren
Een inductor van CYP2C8 (bijv. rifampicine) kan de blootstelling (AUC) aan pioglitazon aanzienlijk verlagen. Als daarom een inductor van CYP2C8 wordt gestart of gestopt tijdens de behandeling met ACTOS 30 mg, kunnen veranderingen in de diabetesbehandeling nodig zijn op basis van de klinische respons zonder de maximaal aanbevolen dagelijkse dosis van 45 mg voor ACTOS te overschrijden (zie KLINISCHE FARMACOLOGIE ].
Topiramaat
Een afname van de blootstelling aan pioglitazon en zijn actieve metabolieten werd waargenomen bij gelijktijdige toediening van pioglitazon en topiramaat (zie KLINISCHE FARMACOLOGIE ]. De klinische relevantie van deze afname is niet bekend; wanneer ACTOS en topiramaat echter gelijktijdig worden gebruikt, moet u de patiënten controleren op adequate glykemische controle.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Congestief hartfalen
ACTOS 15 mg kan, net als andere thiazolidinedionen, dosisgerelateerde vochtretentie veroorzaken wanneer het alleen of in combinatie met andere antidiabetica wordt gebruikt en komt het meest voor wanneer ACTOS 30 mg wordt gebruikt in combinatie met insuline. Vochtretentie kan leiden tot congestief hartfalen of dit verergeren. Patiënten moeten worden geobserveerd op tekenen en symptomen van congestief hartfalen. Als zich congestief hartfalen ontwikkelt, moet dit worden behandeld volgens de huidige zorgstandaarden en moet staken of dosisverlaging van ACTOS worden overwogen [zie DOOS WAARSCHUWING: , CONTRA-INDICATIES , en ONGEWENSTE REACTIES ].
Hypoglykemie
Patiënten die ACTOS krijgen in combinatie met insuline of andere antidiabetica (met name insulinesecretagogen zoals sulfonylureumderivaten) kunnen een risico lopen op hypoglykemie. Een verlaging van de dosis van de gelijktijdig gebruikte antidiabetica kan nodig zijn om het risico op hypoglykemie te verminderen (zie DOSERING EN ADMINISTRATIE ].
Levereffecten
Er zijn postmarketingmeldingen geweest van fataal en niet-fataal leverfalen bij patiënten die ACTOS 15 mg gebruikten, hoewel de meldingen onvoldoende informatie bevatten om de waarschijnlijke oorzaak vast te stellen. Er is tot op heden geen bewijs van door geneesmiddelen geïnduceerde hepatotoxiciteit in de ACTOS 30 mg gecontroleerde klinische onderzoeksdatabase [zie ONGEWENSTE REACTIES ].
Patiënten met type 2-diabetes kunnen een leververvetting of hartziekte met episodisch congestief hartfalen hebben, die beide afwijkingen in de levertest kunnen veroorzaken, en ze kunnen ook andere vormen van leverziekte hebben, waarvan er vele kunnen worden behandeld of behandeld. Daarom wordt aanbevolen een levertestpanel te verkrijgen (serumalanineaminotransferase [ALT], aspartaataminotransferase [AST], alkalische fosfatase en totaal bilirubine) en de patiënt te beoordelen voordat de behandeling met ACTOS wordt gestart. Bij patiënten met afwijkende levertesten dient voorzichtig te worden gestart met ACTOS 15 mg.
Meet levertesten onmiddellijk bij patiënten die symptomen melden die kunnen wijzen op leverbeschadiging, waaronder vermoeidheid, anorexia, ongemak in de rechter bovenbuik, donkere urine of geelzucht. Als in deze klinische context wordt vastgesteld dat de patiënt abnormale levertesten heeft (ALAT groter dan 3 keer de bovengrens van het referentiebereik), moet de behandeling met ACTOS 15 mg worden onderbroken en moet onderzoek worden gedaan om de waarschijnlijke oorzaak vast te stellen. ACTOS mag bij deze patiënten niet opnieuw worden gestart zonder een andere verklaring voor de afwijkingen in de levertest.
Patiënten met een serum-ALAT van meer dan drie keer het referentiebereik met een totaal serumbilirubine van meer dan twee keer het referentiebereik zonder alternatieve etiologieën, lopen risico op ernstige door geneesmiddelen veroorzaakte leverbeschadiging en mogen niet opnieuw worden gestart met ACTOS. Voor patiënten met een geringere verhoging van serum-ALAT of bilirubine en met een andere waarschijnlijke oorzaak, kan behandeling met ACTOS met voorzichtigheid worden toegepast.
Urineblaastumoren
Tumoren werden waargenomen in de urineblaas van mannelijke ratten in de twee jaar durende carcinogeniteitsstudie [zie: Niet-klinische toxicologie ]. Bovendien werd tijdens het driejarige klinische PROactive-onderzoek bij 14 van de 2605 (0,54%) gerandomiseerde naar ACTOS 15 mg en 5 van de 2633 (0,19%) gerandomiseerde naar placebo blaaskanker gediagnosticeerd. Na uitsluiting van patiënten bij wie de blootstelling aan het onderzoeksgeneesmiddel minder dan één jaar was op het moment van de diagnose van blaaskanker, waren er 6 (0,23%) gevallen op ACTOS 30 mg en twee (0,08%) gevallen op placebo. Na voltooiing van het onderzoek werd een grote subgroep van patiënten gedurende maximaal 10 extra jaren geobserveerd, met weinig extra blootstelling aan ACTOS. Tijdens de 13 jaar van zowel PROactive als observationele follow-up, verschilde het optreden van blaaskanker niet tussen patiënten die waren gerandomiseerd naar ACTOS 30 mg of placebo (HR = 1,00; [95% BI: 0,59-1,72]).
Bevindingen met betrekking tot het risico op blaaskanker bij patiënten die zijn blootgesteld aan ACTOS variëren tussen observationele onderzoeken; sommigen vonden geen verhoogd risico op blaaskanker geassocieerd met ACTOS 30 mg, terwijl anderen dat wel deden.
Een grote prospectieve 10 jaar durende observationele cohortstudie, uitgevoerd in de Verenigde Staten, vond geen statistisch significante toename van het risico op blaaskanker bij diabetespatiënten die ooit waren blootgesteld aan ACTOS, vergeleken met degenen die nooit waren blootgesteld aan ACTOS (HR = 1,06 [95% BI 0,89-1,26 ]).
Een retrospectieve cohortstudie uitgevoerd met gegevens uit het Verenigd Koninkrijk vond een statistisch significant verband tussen ooit blootstelling aan ACTOS en blaaskanker (HR: 1,63; [95% BI: 1,22-2,19]).
Verbanden tussen cumulatieve dosis of cumulatieve duur van blootstelling aan ACTOS 15 mg en blaaskanker werden niet gevonden in sommige onderzoeken, waaronder de 10-jarige observationele studie in de VS, maar wel in andere. Inconsistente bevindingen en beperkingen die inherent zijn aan deze en andere onderzoeken, sluiten sluitende interpretaties van de observationele gegevens uit.
ACTOS kan in verband worden gebracht met een verhoogd risico op urineblaastumoren. Er zijn onvoldoende gegevens om te bepalen of pioglitazon een tumorpromotor is voor urineblaastumoren.
Bijgevolg dient ACTOS niet te worden gebruikt bij patiënten met actieve blaaskanker en moeten de voordelen van glykemische controle versus onbekende risico's voor het opnieuw optreden van kanker met ACTOS worden overwogen bij patiënten met een voorgeschiedenis van blaaskanker.
Oedeem
In gecontroleerde klinische onderzoeken werd oedeem vaker gemeld bij patiënten die werden behandeld met ACTOS 30 mg dan bij patiënten die met placebo werden behandeld en is dosisgerelateerd [zie ONGEWENSTE REACTIES ]. Tijdens postmarketingervaring zijn meldingen ontvangen van nieuw ontstaan of verergering van oedeem.
ACTOS 15 mg moet met voorzichtigheid worden gebruikt bij patiënten met oedeem. Omdat thiazolidinedionen, waaronder ACTOS, vochtretentie kunnen veroorzaken, wat kan leiden tot verergering van of kan leiden tot congestief hartfalen, moet ACTOS 30 mg met voorzichtigheid worden gebruikt bij patiënten met een risico op congestief hartfalen. Patiënten die met ACTOS worden behandeld, moeten worden gecontroleerd op tekenen en symptomen van congestief hartfalen [zie: DOOS WAARSCHUWING: , Congestief hartfalen en PATIËNT INFORMATIE ].
fracturen
In PROactive (de Prospective Pioglitazon Clinical Trial in Macrovascular Events) werden 5238 patiënten met diabetes type 2 en een voorgeschiedenis van macrovasculaire aandoeningen gerandomiseerd naar ACTOS (N=2605), geforceerd getitreerd tot 45 mg per dag of placebo (N=2633) naast de zorgstandaard. Tijdens een gemiddelde follow-up van 34,5 maanden was de incidentie van botbreuken bij vrouwen 5,1% (44/870) voor ACTOS 30 mg versus 2,5% (23/905) voor placebo. Dit verschil werd opgemerkt na het eerste jaar van de behandeling en hield aan in de loop van het onderzoek. De meeste fracturen die bij vrouwelijke patiënten werden waargenomen, waren niet-vertebrale fracturen, waaronder de onderste ledematen en de distale bovenste ledematen. Er werd geen toename van de incidentie van fracturen waargenomen bij mannen die werden behandeld met ACTOS (1,7%) versus placebo (2,1%). Bij de zorg voor patiënten, met name vrouwelijke patiënten, die met ACTOS worden behandeld, moet rekening worden gehouden met het risico op fracturen, en er moet aandacht worden besteed aan het beoordelen en behouden van de botgezondheid volgens de huidige zorgstandaarden.
Macula-oedeem
Macula-oedeem is gemeld tijdens postmarketingervaring bij diabetespatiënten die ACTOS of een ander thiazolidinedion gebruikten. Sommige patiënten vertoonden wazig zicht of verminderde gezichtsscherpte, maar anderen werden gediagnosticeerd bij routine oogheelkundig onderzoek.
De meeste patiënten hadden perifeer oedeem op het moment dat macula-oedeem werd vastgesteld. Sommige patiënten vertoonden verbetering van hun macula-oedeem na stopzetting van de thiazolidinedion.
Patiënten met diabetes dienen regelmatig oogonderzoek te ondergaan door een oogarts volgens de huidige zorgnormen. Patiënten met diabetes die visuele symptomen melden, moeten onmiddellijk worden doorverwezen naar een oogarts, ongeacht de onderliggende medicatie of andere fysieke bevindingen van de patiënt [zie ONGEWENSTE REACTIES ].
Macrovasculaire resultaten
Er zijn geen klinische onderzoeken geweest die overtuigend bewijs van macrovasculaire risicovermindering met ACTOS hebben aangetoond.
Informatie over patiëntbegeleiding
Zie FDA-goedgekeurde patiëntetikettering ( PATIËNT INFORMATIE ).
- Het is belangrijk om patiënten te instrueren om zich aan de voedingsinstructies te houden en om regelmatig bloedglucose en geglycosyleerde hemoglobine te laten testen. Tijdens perioden van stress, zoals koorts, trauma, infectie of operatie, kunnen de medicatievereisten veranderen en patiënten moeten eraan worden herinnerd om onmiddellijk medisch advies in te winnen.
- Patiënten die een ongewoon snelle gewichtstoename of oedeem ervaren of die kortademigheid of andere symptomen van hartfalen ontwikkelen terwijl ze ACTOS gebruiken, moeten deze symptomen onmiddellijk aan een arts melden.
- Vertel patiënten dat ze onmiddellijk moeten stoppen met het gebruik van ACTOS en onmiddellijk medisch advies moeten inwinnen als er onverklaarbare misselijkheid, braken, buikpijn, vermoeidheid, anorexia of donkere urine is, aangezien deze symptomen te wijten kunnen zijn aan hepatotoxiciteit.
- Vertel patiënten dat ze elk teken van macroscopische hematurie of andere symptomen zoals dysurie of aandrang tot urineren die zich ontwikkelen of toenemen tijdens de behandeling onmiddellijk moeten melden, aangezien deze te wijten kunnen zijn aan blaaskanker.
- Vertel patiënten om ACTOS 15 mg eenmaal daags in te nemen. ACTOS 15 mg kan met of zonder maaltijden worden ingenomen. Als op een dag een dosis wordt gemist, mag de dosis de volgende dag niet worden verdubbeld.
- Bij gebruik van combinatietherapie met insuline of andere antidiabetica moeten de risico's van hypoglykemie, de symptomen en behandeling ervan, en aandoeningen die vatbaar zijn voor de ontwikkeling ervan aan patiënten en hun familieleden worden uitgelegd.
- Informeer vrouwelijke patiënten dat behandeling met ACTOS 30 mg, net als andere thiazolidinedionen, kan leiden tot een onbedoelde zwangerschap bij sommige premenopauzale anovulatoire vrouwen vanwege het effect op de ovulatie [zie Gebruik bij specifieke populaties ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er is een twee jaar durend carcinogeniteitsonderzoek uitgevoerd bij mannelijke en vrouwelijke ratten met orale doses tot 63 mg/kg (ongeveer 14 keer de maximaal aanbevolen orale dosis voor de mens van 45 mg op basis van mg/m2). Geneesmiddelgeïnduceerde tumoren werden in geen enkel orgaan waargenomen, behalve in de urineblaas van mannelijke ratten. Goedaardige en/of kwaadaardige overgangscelneoplasmata werden waargenomen bij mannelijke ratten bij een dosering van 4 mg/kg/dag en hoger (ongeveer gelijk aan de maximaal aanbevolen orale dosis voor de mens op basis van mg/m2). Urinestenen met daaropvolgende irritatie en hyperplasie werden gepostuleerd als het mechanisme voor blaastumoren waargenomen bij mannelijke ratten. Een twee jaar durend mechanistisch onderzoek bij mannelijke ratten waarbij gebruik werd gemaakt van verzuring via de voeding om de vorming van stenen te verminderen, werd in 2009 voltooid. De verzuring van de voeding nam af, maar maakte geen einde aan de hyperplastische veranderingen in de blaas. De aanwezigheid van stenen verergerde de hyperplastische respons op pioglitazon, maar werd niet beschouwd als de primaire oorzaak van de hyperplastische veranderingen.
De relevantie voor de mens van de blaasbevindingen bij de mannelijke rat kan niet worden uitgesloten.
Er is ook een twee jaar durend carcinogeniteitsonderzoek uitgevoerd bij mannelijke en vrouwelijke muizen met orale doses tot 100 mg/kg/dag (ongeveer 11 keer de maximaal aanbevolen orale dosis voor de mens op basis van mg/m2). In geen enkel orgaan werden door geneesmiddelen geïnduceerde tumoren waargenomen.
Pioglitazonhydrochloride was niet mutageen in een reeks genetische toxicologische onderzoeken, waaronder de Ames-bacteriële test, een voorwaartse genmutatietest bij zoogdieren (CHO/HPRT en AS52/XPRT), een in vitro cytogenetische test met CHL-cellen, een ongeplande DNA-synthesetest en een in vivo micronucleus-assay.
Er werden geen nadelige effecten op de vruchtbaarheid waargenomen bij mannelijke en vrouwelijke ratten bij orale doses tot 40 mg/kg pioglitazonhydrochloride per dag voor en tijdens de paring en dracht (ongeveer negen keer de maximaal aanbevolen orale dosis voor de mens op basis van mg/m2).
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beperkte gegevens met ACTOS bij zwangere vrouwen zijn niet voldoende om een geneesmiddelgerelateerd risico op ernstige geboorteafwijkingen of miskraam vast te stellen. Er zijn risico's voor de moeder en de foetus verbonden aan slecht gereguleerde diabetes tijdens de zwangerschap [zie Klinische overwegingen ].
In reproductiestudies bij dieren werden geen nadelige ontwikkelingseffecten waargenomen wanneer pioglitazon werd toegediend aan drachtige ratten en konijnen tijdens de organogenese bij blootstellingen tot respectievelijk 5 en 35 keer de klinische dosis van 45 mg, gebaseerd op het lichaamsoppervlak [zie Gegevens ].
Het geschatte achtergrondrisico op ernstige geboorteafwijkingen is 6-10% bij vrouwen met pre-zwangerschapsdiabetes met een HbA1c >7 en er is gemeld dat het zo hoog is als 20-25% bij vrouwen met een HbA1c >10. Het geschatte achtergrondrisico van een miskraam voor de aangegeven populatie is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Slecht gecontroleerde diabetes tijdens de zwangerschap verhoogt het maternale risico op diabetische ketoacidose, pre-eclampsie, spontane abortussen, vroeggeboorte, doodgeboorte en complicaties bij de bevalling. Slecht gecontroleerde diabetes verhoogt het foetale risico op ernstige geboorteafwijkingen, doodgeboorte en macrosomie-gerelateerde morbiditeit.
Gegevens
Dierlijke gegevens
Pioglitazon toegediend aan drachtige ratten tijdens de organogenese veroorzaakte geen nadelige ontwikkelingseffecten bij een dosis van 20 mg/kg (~5 maal de klinische dosis van 45 mg), maar vertraagde de partus en verminderde embryofoetale levensvatbaarheid bij 40 en 80 mg/kg, of ≥ 9 keer de klinische dosis van 45 mg, per lichaamsoppervlak. Bij drachtige konijnen die pioglitazon kregen toegediend tijdens de organogenese, werden geen nadelige ontwikkelingseffecten waargenomen bij 80 mg/kg (~35 maal de klinische dosis van 45 mg), maar verminderde embryofoetale levensvatbaarheid bij 160 mg/kg, of ~69 maal de klinische dosis van 45 mg. dosis, per lichaamsoppervlak. Wanneer zwangere ratten pioglitazon kregen tijdens de late dracht en lactatie, trad een vertraagde postnatale ontwikkeling op, toegeschreven aan een verminderd lichaamsgewicht, bij nakomelingen bij maternale doses van 10 mg/kg en hoger of ≥2 maal de klinische dosis van 45 mg, per lichaamsoppervlak.
Borstvoeding
Risico Samenvatting
Er is geen informatie over de aanwezigheid van pioglitazon in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Pioglitazon is aanwezig in rattenmelk; vanwege soortspecifieke verschillen in lactatiefysiologie kunnen diergegevens echter de geneesmiddelniveaus in moedermelk mogelijk niet betrouwbaar voorspellen. De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan ACTOS 15 mg en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van ACTOS 30 mg of van de onderliggende maternale aandoening.
Vrouwtjes en mannetjes met reproductief potentieel
Bespreek de mogelijkheid van onbedoelde zwangerschap bij premenopauzale vrouwen, aangezien therapie met ACTOS, net als andere thiazolidinedionen, kan leiden tot ovulatie bij sommige anovulatoire vrouwen.
Pediatrisch gebruik
De veiligheid en werkzaamheid van ACTOS bij pediatrische patiënten zijn niet vastgesteld.
ACTOS 15 mg wordt niet aanbevolen voor gebruik bij pediatrische patiënten op basis van bijwerkingen die zijn waargenomen bij volwassenen, waaronder vochtretentie en congestief hartfalen, fracturen en urineblaastumoren [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geriatrisch gebruik
Een totaal van 92 patiënten (15,2%) die met ACTOS werden behandeld in de drie gepoolde 16 tot 26 weken durende dubbelblinde, placebogecontroleerde monotherapie-onderzoeken waren ≥65 jaar oud en twee patiënten (0,3%) waren ≥75 jaar oud. In de twee gepoolde onderzoeken van 16 tot 24 weken als aanvulling op sulfonylureumderivaten waren 201 patiënten (18,7%) die werden behandeld met ACTOS 30 mg ≥65 jaar oud en 19 (1,8%) waren ≥75 jaar oud. In de twee gepoolde onderzoeken van 16 tot 24 weken als aanvulling op metformine waren 155 patiënten (15,5%) die met ACTOS werden behandeld ≥65 jaar oud en 19 (1,9%) ≥75 jaar oud. In de twee gepoolde onderzoeken van 16 tot 24 weken als aanvulling op insuline waren 272 patiënten (25,4%) die met ACTOS werden behandeld ≥65 jaar oud en 22 (2,1%) ≥75 jaar oud.
In PROactive waren 1068 patiënten (41,0%) die werden behandeld met ACTOS ≥65 jaar oud en 42 (1,6%) waren ≥75 jaar oud.
In farmacokinetische onderzoeken met pioglitazon werden geen significante verschillen waargenomen in farmacokinetische parameters tussen oudere en jongere patiënten [zie KLINISCHE FARMACOLOGIE ].
Hoewel klinische ervaringen geen verschillen in werkzaamheid en veiligheid tussen ouderen (≥65 jaar) en jongere patiënten hebben aangetoond, zijn deze conclusies beperkt door de kleine steekproefomvang voor patiënten 75 jaar oud.
OVERDOSERING
Tijdens gecontroleerde klinische onderzoeken werd één geval van overdosering met ACTOS 30 mg gemeld. Een mannelijke patiënt nam 120 mg per dag gedurende vier dagen, daarna 180 mg per dag gedurende zeven dagen. De patiënt ontkende gedurende deze periode klinische symptomen.
In geval van overdosering dient een geschikte ondersteunende behandeling te worden gestart op basis van de klinische tekenen en symptomen van de patiënt.
CONTRA-INDICATIES
- Initiatie bij patiënten met vastgesteld NYHA klasse III of IV hartfalen [zie: DOOS WAARSCHUWING: ].
- Gebruik bij patiënten met een bekende overgevoeligheid voor pioglitazon of een ander bestanddeel van ACTOS.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
ACTOS 15 mg is een thiazolidinedion dat voor zijn werkingsmechanisme afhankelijk is van de aanwezigheid van insuline. ACTOS vermindert de insulineresistentie in de periferie en in de lever, wat resulteert in een verhoogde insulineafhankelijke glucoseafvoer en een verminderde leverglucoseproductie. Pioglitazon is geen insulinesecretagoog. Pioglitazon is een agonist voor peroxisoom proliferator-geactiveerde receptor-gamma (PPAR?). PPAR-receptoren worden aangetroffen in weefsels die belangrijk zijn voor de werking van insuline, zoals vetweefsel, skeletspieren en lever. Activering van PPAR? nucleaire receptoren moduleren de transcriptie van een aantal insulinegevoelige genen die betrokken zijn bij de controle van het glucose- en lipidemetabolisme.
In diermodellen van diabetes vermindert pioglitazon de hyperglykemie, hyperinsulinemie en hypertriglyceridemie die kenmerkend zijn voor insulineresistente toestanden zoals type 2 diabetes. De metabole veranderingen die door pioglitazon worden veroorzaakt, resulteren in een verhoogde respons van insulineafhankelijke weefsels en worden waargenomen in talrijke diermodellen van insulineresistentie.
Omdat pioglitazon de effecten van circulerende insuline versterkt (door de insulineresistentie te verminderen), verlaagt het de bloedglucose niet in diermodellen zonder endogene insuline.
farmacodynamiek
Klinische studies tonen aan dat ACTOS 15 mg de insulinegevoeligheid verbetert bij insulineresistente patiënten. ACTOS verbetert de cellulaire respons op insuline, verhoogt de insulineafhankelijke glucoseafvoer en verbetert de gevoeligheid van de lever voor insuline. Bij patiënten met type 2-diabetes resulteert de verminderde insulineresistentie geproduceerd door ACTOS in lagere plasmaglucoseconcentraties, lagere plasma-insulineconcentraties en lagere HbA1c-waarden. In gecontroleerde klinische onderzoeken had ACTOS een additief effect op de glykemische controle bij gebruik in combinatie met een sulfonylureumderivaat, metformine of insuline (zie Klinische studies ].
Patiënten met lipidenafwijkingen werden opgenomen in klinische onderzoeken met ACTOS. Over het algemeen hadden patiënten die werden behandeld met ACTOS 15 mg gemiddelde verlagingen van serumtriglyceriden, gemiddelde verhogingen van HDL-cholesterol en geen consistente gemiddelde veranderingen in LDL en totaal cholesterol. Er is geen sluitend bewijs van macrovasculair voordeel met ACTOS [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
In een 26 weken durend, placebogecontroleerd, dosisbereik monotherapieonderzoek, namen de gemiddelde serumtriglyceriden af in de 15 mg, 30 mg en 45 mg ACTOS 15 mg dosisgroepen vergeleken met een gemiddelde stijging in de placebogroep. Het gemiddelde HDL-cholesterol nam in sterkere mate toe bij patiënten die werden behandeld met ACTOS 30 mg dan bij de met placebo behandelde patiënten. Er waren geen consistente verschillen voor LDL en totaal cholesterol bij patiënten die met ACTOS werden behandeld in vergelijking met placebo (zie tabel 14).
In de twee andere monotherapieonderzoeken (16 weken en 24 weken) en in combinatietherapieonderzoeken met sulfonylureumderivaten (16 weken en 24 weken), metformine (16 weken en 24 weken) of insuline (16 weken en 24 weken) waren de resultaten over het algemeen overeenstemming met de bovenstaande gegevens.
Farmacokinetiek
Na eenmaal daagse toediening van ACTOS 15 mg worden binnen zeven dagen steady-state serumconcentraties van zowel pioglitazon als zijn belangrijkste actieve metabolieten, M-III (ketoderivaat van pioglitazon) en M-IV (hydroxylderivaat van pioglitazon), bereikt. Bij steady-state bereiken M-III en M-IV serumconcentraties gelijk aan of hoger dan die van pioglitazon. Bij steady-state omvat pioglitazon bij zowel gezonde vrijwilligers als patiënten met type 2-diabetes ongeveer 30% tot 50% van de maximale totale pioglitazon-serumconcentraties (pioglitazon plus actieve metabolieten) en 20% tot 25% van de totale AUC.
Cmax, AUC en dalserumconcentraties (Cmin) voor pioglitazon en M-III en M-IV namen evenredig toe met toegediende doses van 15 mg en 30 mg per dag.
Absorptie
Na orale toediening van pioglitazon was de Tmax van pioglitazon binnen twee uur. Voedsel vertraagt de Tmax tot drie tot vier uur, maar verandert de mate van absorptie (AUC) niet.
Verdeling
Het gemiddelde schijnbare distributievolume (Vd/F) van pioglitazon na toediening van een enkelvoudige dosis is 0,63 ± 0,41 (gemiddelde ± SD) l/kg lichaamsgewicht. Pioglitazon is in humaan serum grotendeels eiwitgebonden (>99%), voornamelijk aan serumalbumine. Pioglitazon bindt ook aan andere serumeiwitten, maar met een lagere affiniteit. M-III en M-IV zijn ook uitgebreid gebonden (>98%) aan serumalbumine.
Metabolisme
Pioglitazon wordt uitgebreid gemetaboliseerd door hydroxylering en oxidatie; de metabolieten worden ook gedeeltelijk omgezet in glucuronide- of sulfaatconjugaten. Metabolieten M-III en M-IV zijn de belangrijkste circulerende actieve metabolieten bij de mens.
In vitro-gegevens tonen aan dat meerdere CYP-isovormen betrokken zijn bij het metabolisme van pioglitazon, waaronder CYP2C8 en, in mindere mate, CYP3A4, met aanvullende bijdragen van een verscheidenheid aan andere isovormen, waaronder het voornamelijk extrahepatische CYP1A1. In vivo onderzoek van pioglitazon in combinatie met gemfibrozil, een sterke CYP2C8-remmer, toonde aan dat pioglitazon een CYP2C8-substraat is [zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ]. De 6β-hydroxycortisol/cortisol-verhoudingen in de urine, gemeten bij patiënten die werden behandeld met ACTOS 30 mg, toonden aan dat pioglitazon geen sterke CYP3A4-enzyminductor is.
Uitscheiding en eliminatie
Na orale toediening wordt ongeveer 15% tot 30% van de pioglitazondosis teruggevonden in de urine. De renale eliminatie van pioglitazon is verwaarloosbaar en het geneesmiddel wordt voornamelijk uitgescheiden als metabolieten en hun conjugaten. Aangenomen wordt dat het grootste deel van de orale dosis onveranderd of als metabolieten in de gal wordt uitgescheiden en in de feces wordt uitgescheiden.
De gemiddelde serumhalfwaardetijd (t1/2) van pioglitazon en zijn metabolieten (M-III en M-IV) variëren van respectievelijk drie tot zeven uur en van 16 tot 24 uur. Pioglitazon heeft een schijnbare klaring, CL/F, berekend op vijf tot zeven l/uur.
Nierfunctiestoornis
De serumeliminatiehalfwaardetijd van pioglitazon, M-III en M-IV blijft onveranderd bij patiënten met matige (creatinineklaring [CLcr] 30 tot 50 ml/min) en ernstige (CLcr
Leverfunctiestoornis
Vergeleken met gezonde controlepersonen hebben proefpersonen met een verminderde leverfunctie (Child-Turcotte-Pugh graad B/C) een afname van ongeveer 45% in pioglitazon en totale pioglitazon (pioglitazon, M-III en M-IV) gemiddelde Cmax maar geen verandering in de gemiddelde AUC-waarden. Daarom is er geen dosisaanpassing nodig bij patiënten met leverinsufficiëntie.
Er zijn postmarketingmeldingen van leverfalen met ACTOS en klinische onderzoeken hebben in het algemeen patiënten uitgesloten met serum-ALAT >2,5 keer de bovengrens van het referentiebereik. Wees voorzichtig bij patiënten met een leverziekte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geriatrische patiënten
Bij gezonde oudere proefpersonen was de Cmax van pioglitazon niet significant verschillend, maar de AUC-waarden waren ongeveer 21% hoger dan die bij jongere proefpersonen. De gemiddelde t1/2 van pioglitazon was ook verlengd bij oudere proefpersonen (ongeveer tien uur) in vergelijking met jongere proefpersonen (ongeveer zeven uur). Deze veranderingen waren niet van een omvang die als klinisch relevant zou worden beschouwd.
Pediatrische patiënten
De veiligheid en werkzaamheid van pioglitazon bij pediatrische patiënten zijn niet vastgesteld. ACTOS 15 mg wordt niet aanbevolen voor gebruik bij pediatrische patiënten [zie Gebruik bij specifieke populaties ].
Geslacht
De gemiddelde Cmax- en AUC-waarden van pioglitazon waren bij vrouwen met 20% tot 60% verhoogd in vergelijking met mannen. In gecontroleerde klinische onderzoeken waren de HbA1c-dalingen vanaf baseline over het algemeen groter voor vrouwen dan voor mannen (gemiddeld gemiddeld verschil in HbA1c 0,5%). Omdat de therapie voor elke patiënt individueel moet worden aangepast om glykemische controle te bereiken, wordt er geen dosisaanpassing aanbevolen op basis van alleen het geslacht.
etniciteit
Farmacokinetische gegevens over verschillende etnische groepen zijn niet beschikbaar.
Geneesmiddel-geneesmiddelinteracties
Dierlijke toxicologie en/of farmacologie
Hartvergroting is waargenomen bij muizen (100 mg/kg), ratten (4 mg/kg en hoger) en honden (3 mg/kg) die oraal werden behandeld met pioglitazonhydrochloride (ongeveer 11, 1 en 2 keer de maximaal aanbevolen orale dosering bij mensen). dosis voor respectievelijk muizen, ratten en honden, gebaseerd op mg/m2). In een eenjarig onderzoek bij ratten trad geneesmiddelgerelateerde vroegtijdige sterfte als gevolg van schijnbare hartdisfunctie op bij een orale dosis van 160 mg/kg/dag (ongeveer 35 maal de maximaal aanbevolen orale dosis voor mensen op basis van mg/m2). Hartvergroting werd gezien in een 13 weken durend onderzoek bij apen bij orale doses van 8,9 mg/kg en hoger (ongeveer vier keer de maximaal aanbevolen orale dosis voor mensen op basis van mg/m2), maar niet in een 52 weken durend onderzoek bij orale doses tot 32 mg/kg (ongeveer 13 keer de maximaal aanbevolen orale dosis voor mensen op basis van mg/m2).
Klinische studies
Monotherapie
Drie gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken met een duur van 16 tot 26 weken werden uitgevoerd om het gebruik van ACTOS als monotherapie bij patiënten met type 2-diabetes te evalueren. Deze onderzoeken onderzochten ACTOS 15 mg in doses tot 45 mg of placebo eenmaal daags bij in totaal 865 patiënten.
In een 26 weken durende studie met monotherapie met doseringen werden 408 patiënten met type 2-diabetes gerandomiseerd om eenmaal daags 7,5 mg, 15 mg, 30 mg of 45 mg ACTOS of placebo te krijgen. De therapie met een eerder antidiabetisch middel werd acht weken voorafgaand aan de dubbelblinde periode stopgezet. Behandeling met 15 mg, 30 mg en 45 mg ACTOS 30 mg gaf statistisch significante verbeteringen in HbA1c en nuchtere plasmaglucose (FPG) op het eindpunt in vergelijking met placebo (zie figuur 1, tabel 17).
Figuur 1 toont het tijdsverloop voor veranderingen in HbA1c in dit 26 weken durende onderzoek.
Afbeelding 1. Gemiddelde verandering ten opzichte van baseline voor HbA1c in een 26 weken durende placebo-gecontroleerde dosis-variërende studie (geobserveerde waarden)
In een 24-weekse placebogecontroleerde monotherapiestudie werden 260 patiënten met type 2-diabetes gerandomiseerd naar een van de twee ACTOS-behandelingsgroepen met geforceerde titratie of een placebogroep met schijntitratie. De therapie met een eerder antidiabetisch middel werd zes weken voorafgaand aan de dubbelblinde periode stopgezet. In één behandelingsgroep met ACTOS 15 mg kregen de patiënten een aanvangsdosis van 7,5 mg eenmaal daags. Na vier weken werd de dosis verhoogd tot 15 mg eenmaal daags en na nog eens vier weken werd de dosis verhoogd tot 30 mg eenmaal daags voor de rest van het onderzoek (16 weken). In de tweede ACTOS-behandelingsgroep kregen de patiënten een aanvangsdosis van 15 mg eenmaal daags en werden op vergelijkbare wijze getitreerd tot 30 mg eenmaal daags en 45 mg eenmaal daags. Behandeling met ACTOS 15 mg, zoals beschreven, leidde tot statistisch significante verbeteringen in HbA1c en FPG op het eindpunt in vergelijking met placebo (zie tabel 18).
In een 16 weken durende monotherapiestudie werden 197 patiënten met type 2-diabetes gerandomiseerd naar behandeling met 30 mg ACTOS of placebo eenmaal daags. De therapie met een eerder antidiabetisch middel werd zes weken voorafgaand aan de dubbelblinde periode stopgezet. Behandeling met 30 mg ACTOS gaf statistisch significante verbeteringen in HbA1c en FPG op het eindpunt in vergelijking met placebo (zie tabel 19).
Combinatietherapie
Er zijn drie 16 weken durende, gerandomiseerde, dubbelblinde, placebogecontroleerde klinische onderzoeken uitgevoerd om de effecten van ACTOS (15 mg en/of 30 mg) op de glykemische controle te evalueren bij patiënten met type 2-diabetes die onvoldoende onder controle waren (HbA1c ≥8 %) ondanks de huidige therapie met een sulfonylureumderivaat, metformine of insuline. Daarnaast werden drie 24 weken durende gerandomiseerde, dubbelblinde klinische onderzoeken uitgevoerd om de effecten van ACTOS 30 mg vs. ACTOS 45 mg op de glykemische controle te evalueren bij patiënten met diabetes type 2 die onvoldoende onder controle waren (HbA1c ≥8%) ondanks de huidige behandeling met een sulfonylureumderivaat, metformine of insuline. Eerdere diabetesbehandeling kan monotherapie of combinatietherapie zijn geweest.
Add-on voor sulfonylureumonderzoeken
Er zijn twee klinische onderzoeken uitgevoerd met ACTOS in combinatie met een sulfonylureumderivaat. Beide onderzoeken omvatten patiënten met type 2-diabetes die elke dosis van een sulfonylureumderivaat kregen, alleen of in combinatie met een ander antidiabeticum. Alle andere antidiabetica werden ten minste drie weken voor aanvang van de onderzoeksbehandeling stopgezet.
In de eerste studie werden 560 patiënten gerandomiseerd om gedurende 16 weken eenmaal daags 15 mg of 30 mg ACTOS 30 mg of placebo te krijgen als aanvulling op hun huidige sulfonylureumbehandeling. Behandeling met ACTOS als aanvulling op sulfonylureumderivaat produceerde statistisch significante verbeteringen in HbA1c en FPG op het eindpunt in vergelijking met placebo als aanvulling op sulfonylureumderivaat (zie tabel 20).
In de tweede studie werden 702 patiënten gerandomiseerd om gedurende 24 weken eenmaal daags 30 mg of 45 mg ACTOS te krijgen naast hun huidige sulfonylureumbehandeling. De gemiddelde afname vanaf baseline in week 24 in HbA1c was 1,6% voor de dosis van 30 mg en 1,7% voor de dosis van 45 mg (zie tabel 21). De gemiddelde afname vanaf baseline in week 24 in FPG was 52 mg/dL voor de dosis van 30 mg en 56 mg/dL voor de dosis van 45 mg.
Het therapeutische effect van ACTOS in combinatie met sulfonylureumderivaat werd waargenomen bij patiënten ongeacht de sulfonylureumdosis.
Add-on voor metformine-onderzoeken
Er zijn twee klinische onderzoeken uitgevoerd met ACTOS 30 mg in combinatie met metformine. Beide onderzoeken omvatten patiënten met type 2-diabetes die elke dosis metformine kregen, alleen of in combinatie met een ander antidiabeticum. Alle andere antidiabetica werden ten minste drie weken voor aanvang van de onderzoeksbehandeling stopgezet.
In de eerste studie werden 328 patiënten gerandomiseerd om gedurende 16 weken eenmaal daags 30 mg ACTOS of placebo te krijgen naast hun huidige metformineregime. Behandeling met ACTOS 30 mg als aanvulling op metformine leidde tot statistisch significante verbeteringen in HbA1c en FPG op het eindpunt vergeleken met placebo als aanvulling op metformine (zie tabel 22).
In de tweede studie werden 827 patiënten gerandomiseerd om gedurende 24 weken 30 mg of 45 mg ACTOS 30 mg eenmaal daags te krijgen naast hun huidige metformineregime. De gemiddelde afname vanaf baseline in week 24 in HbA1c was 0,8% voor de dosis van 30 mg en 1,0% voor de dosis van 45 mg (zie tabel 23). De gemiddelde afname vanaf baseline in week 24 in FPG was 38 mg/dL voor de dosis van 30 mg en 51 mg/dL voor de dosis van 45 mg.
Het therapeutische effect van ACTOS in combinatie met metformine werd waargenomen bij patiënten ongeacht de dosis metformine.
Add-on voor insulineonderzoeken
Er zijn twee klinische onderzoeken uitgevoerd met ACTOS 15 mg in combinatie met insuline. Beide onderzoeken omvatten patiënten met type 2-diabetes die insuline gebruikten, alleen of in combinatie met een ander antidiabeticum. Alle andere antidiabetica werden stopgezet voordat de onderzoeksbehandeling werd gestart. In de eerste studie werden 566 patiënten gerandomiseerd om gedurende 16 weken naast hun insulineregime eenmaal daags 15 mg of 30 mg ACTOS 15 mg of placebo te krijgen. Behandeling met ACTOS 30 mg als aanvulling op insuline produceerde statistisch significante verbeteringen in HbA1c en FPG op het eindpunt vergeleken met placebo als aanvulling op insuline (zie tabel 24). De gemiddelde dagelijkse insulinedosis bij baseline in elke behandelingsgroep was ongeveer 70 eenheden. De meerderheid van de patiënten (75% in totaal, 86% behandeld met placebo, 77% behandeld met ACTOS 15 mg en 61% behandeld met ACTOS 30 mg) had geen verandering in hun dagelijkse insulinedosis vanaf baseline tot het laatste onderzoeksbezoek. De gemiddelde verandering ten opzichte van de uitgangswaarde in de dagelijkse dosis insuline (inclusief patiënten zonder aanpassingen van de insulinedosis) was -3 eenheden bij de patiënten die werden behandeld met ACTOS 15 mg, -8 eenheden bij de patiënten die werden behandeld met ACTOS 30 mg en -1 eenheden bij patiënten behandeld met placebo.
In de tweede studie werden 690 patiënten die gemiddeld 60 eenheden insuline per dag kregen, gerandomiseerd om gedurende 24 weken 30 mg of 45 mg ACTOS eenmaal daags te krijgen naast hun huidige insulineregime. De gemiddelde afname vanaf baseline in week 24 in HbA1c was 1,2% voor de dosis van 30 mg en 1,5% voor de dosis van 45 mg. De gemiddelde afname vanaf baseline in week 24 in FPG was 32 mg/dL voor de dosis van 30 mg en 46 mg/dL voor de dosis van 45 mg (zie Tabel 25). De gemiddelde dagelijkse insulinedosis bij aanvang in beide behandelingsgroepen was ongeveer 70 eenheden. De meerderheid van de patiënten (55% in totaal, 58% behandeld met ACTOS 30 mg en 52% behandeld met ACTOS 45 mg) had geen verandering in hun dagelijkse insulinedosis vanaf baseline tot het laatste onderzoeksbezoek. De gemiddelde verandering ten opzichte van baseline in de dagelijkse dosis insuline (inclusief patiënten zonder aanpassingen van de insulinedosis) was -5 eenheden bij de patiënten die werden behandeld met ACTOS 30 mg en -8 eenheden bij de patiënten die werden behandeld met ACTOS 45 mg.
Het therapeutische effect van ACTOS in combinatie met insuline werd waargenomen bij patiënten, ongeacht de insulinedosis.
PATIËNT INFORMATIE
ACTOS (ak-TOS) (pioglitazon) Tabletten
Lees deze medicatiehandleiding zorgvuldig door voordat u begint met het innemen van ACTOS 15 mg en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of uw behandeling. Als u vragen heeft over ACTOS, neem dan contact op met uw arts of apotheker.
Wat is de belangrijkste informatie die ik over ACTOS moet weten?
ACTOS kan ernstige bijwerkingen veroorzaken, waaronder nieuw of erger hartfalen.
- ACTOS 15 mg kan ervoor zorgen dat uw lichaam extra vocht vasthoudt (vochtretentie), wat leidt tot zwelling (oedeem) en gewichtstoename. Extra lichaamsvocht kan sommige hartproblemen verergeren of tot hartfalen leiden. Hartfalen betekent dat uw hart het bloed niet goed genoeg rondpompt
- Gebruik ACTOS niet als u ernstig hartfalen heeft
- Als u hartfalen heeft met symptomen (zoals kortademigheid of zwelling), zelfs als deze symptomen niet ernstig zijn, is ACTOS mogelijk niet geschikt voor u
Bel onmiddellijk uw arts als u een van de volgende aandoeningen heeft:
- zwelling of vochtophoping, vooral in de enkels of benen
- kortademigheid of moeite met ademhalen, vooral als u gaat liggen
- een ongewoon snelle gewichtstoename
- ongewone vermoeidheid
ACTOS kan andere ernstige bijwerkingen hebben. Zie “Wat zijn de mogelijke bijwerkingen van ACTOS?”
Wat is ACTOS?
ACTOS 15 mg is een receptgeneesmiddel dat bij dieet en lichaamsbeweging wordt gebruikt om de bloedsuikerspiegel (glucose) onder controle te krijgen bij volwassenen met type 2-diabetes. ACTOS is een geneesmiddel tegen diabetes dat pioglitazon wordt genoemd en dat alleen of samen met andere geneesmiddelen tegen diabetes kan worden ingenomen.
Het is niet bekend of ACTOS veilig en effectief is bij kinderen onder de 18 jaar. ACTOS wordt niet aanbevolen voor gebruik bij kinderen.
ACTOS is niet voor mensen met type 1 diabetes.
ACTOS 30 mg is niet voor mensen met diabetische ketoacidose (verhoogde ketonen in uw bloed of urine).
Wie mag ACTOS niet gebruiken?
Zie "Wat is de belangrijkste informatie die ik moet weten over ACTOS 15 mg?"
Gebruik ACTOS 15 mg niet als u:
- ernstig hartfalen hebben
- allergisch bent voor een van de ingrediënten in ACTOS. Zie het einde van deze Medicatiegids voor een volledige lijst van ingrediënten in ACTOS
Neem contact op met uw arts voordat u ACTOS gebruikt als u een van deze aandoeningen heeft.
Wat moet ik mijn arts vertellen voordat ik ACTOS 30 mg inneem?
Vertel uw arts voordat u ACTOS inneemt als u:
- hartfalen hebben
- diabetes type 1 (“juveniele”) heeft of diabetische ketoacidose heeft gehad
- een type diabetische oogziekte heeft die zwelling aan de achterkant van het oog veroorzaakt (maculair oedeem)
- leverproblemen hebben
- blaaskanker heeft of heeft gehad
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of ACTOS 15 mg schadelijk kan zijn voor uw ongeboren baby. Neem contact op met uw arts als u zwanger bent of van plan bent zwanger te worden over de beste manier om uw bloedglucosewaarden tijdens de zwangerschap onder controle te houden
- een premenopauzale vrouw bent (vóór de "verandering van leven") die niet regelmatig of helemaal niet menstrueert. ACTOS 30 mg kan uw kans om zwanger te worden vergroten. Praat met uw arts over keuzes voor anticonceptie tijdens het gebruik van ACTOS. Vertel het uw arts meteen als u zwanger wordt terwijl u ACTOS gebruikt
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of ACTOS in uw melk terechtkomt en of het schadelijk kan zijn voor uw baby. Praat met uw arts over de beste manier om uw bloedglucosewaarden onder controle te houden tijdens het geven van borstvoeding
Vertel uw arts over alle medicijnen die u gebruikt inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
ACTOS 30 mg en sommige van uw andere geneesmiddelen kunnen elkaar beïnvloeden. Het kan zijn dat uw dosis ACTOS 15 mg of bepaalde andere geneesmiddelen moeten worden gewijzigd.
Weet welke medicijnen u gebruikt. Houd een lijst bij van uw geneesmiddelen en toon deze aan uw arts en apotheker voordat u met een nieuw geneesmiddel begint. Zij zullen u vertellen of het in orde is om ACTOS 15 mg samen met andere geneesmiddelen in te nemen.
Hoe moet ik ACTOS 15 mg innemen?
- Neem ACTOS 15 mg precies in zoals uw arts u zegt dat u het moet innemen
- Uw arts kan uw dosis ACTOS wijzigen. Verander uw ACTOS-dosis niet tenzij uw arts u dat zegt:
- ACTOS kan alleen of samen met andere diabetesgeneesmiddelen worden voorgeschreven. Dit hangt af van hoe goed uw bloedsuikerspiegel onder controle is
- Neem ACTOS 15 mg eenmaal per dag, met of zonder voedsel
- Als u een dosis ACTOS 15 mg overslaat, neem dan uw volgende dosis zoals voorgeschreven, tenzij uw arts u anders vertelt. Neem de volgende dag geen twee doses tegelijk in
- Als u te veel ACTOS heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ga direct naar de eerste hulp van het dichtstbijzijnde ziekenhuis
- Als uw lichaam onder stress staat, zoals koorts, infectie, ongeval of operatie, moet de dosis van uw diabetesgeneesmiddelen mogelijk worden aangepast. Bel onmiddellijk uw arts
- Blijf op uw dieet en trainingsprogramma's en test regelmatig uw bloedsuikerspiegel terwijl u ACTOS gebruikt
- Uw arts moet bepaalde bloedonderzoeken doen voordat u begint en terwijl u ACTOS gebruikt
- Uw arts moet ook hemoglobine A1C-testen doen om te controleren hoe goed uw bloedsuikerspiegel onder controle is met ACTOS
- Uw arts dient uw ogen regelmatig te controleren terwijl u ACTOS inneemt
Wat zijn de mogelijke bijwerkingen van ACTOS?
ACTOS kan ernstige bijwerkingen veroorzaken, waaronder:
- Zie "Wat is de belangrijkste informatie die ik over ACTOS moet weten?"
- lage bloedsuikerspiegel (hypoglykemie). Dit kan gebeuren als u maaltijden overslaat, als u ook een ander geneesmiddel gebruikt dat de bloedsuikerspiegel verlaagt, of als u bepaalde medische problemen heeft. Duizeligheid, duizeligheid, beverigheid of honger kunnen optreden als uw bloedsuikerspiegel te laag is. Bel uw arts als een lage bloedsuikerspiegel een probleem voor u is
- lever problemen. Bel onmiddellijk uw arts als u:
- misselijkheid of braken
- buikpijn
- ongebruikelijke of onverklaarbare vermoeidheid
- verlies van eetlust
- donkere urine
- geel worden van uw huid of het wit van uw ogen
- blaaskanker. Er kan een verhoogde kans zijn op blaaskanker als u ACTOS gebruikt. U mag ACTOS 15 mg niet gebruiken als u wordt behandeld voor blaaskanker. Vertel het uw arts meteen als u een van de volgende symptomen van blaaskanker heeft:
- bloed of een rode kleur in uw urine
- een verhoogde behoefte om te plassen
- pijn tijdens het plassen
- gebroken botten (breuken). Meestal in de hand, bovenarm of voet bij vrouwen. Praat met uw arts voor advies over hoe u uw botten gezond kunt houden.
- diabetische oogziekte met zwelling in de achterkant van het oog (maculair oedeem). Vertel het uw arts meteen als u veranderingen in uw gezichtsvermogen heeft. Uw arts moet uw ogen regelmatig controleren
- vrijkomen van een eicel uit een eierstok bij een vrouw (ovulatie) die tot zwangerschap leidt. Ovulatie kan optreden wanneer premenopauzale vrouwen die geen regelmatige maandelijkse menstruatie hebben, ACTOS gebruiken. Dit kan uw kans om zwanger te worden vergroten
- verkoudheidssymptomen (infectie van de bovenste luchtwegen)
- hoofdpijn
- sinus infectie
- spierpijn
- keelpijn
De meest voorkomende bijwerkingen van ACTOS zijn:
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle bijwerkingen van ACTOS. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik ACTOS 15 mg bewaren?
- Bewaar ACTOS 15 mg bij 20 °C tot 25 °C (68 °F tot 77 °F). ACTOS in de oorspronkelijke verpakking bewaren en beschermen tegen licht
- Houd de ACTOS-fles goed gesloten en houd de tabletten droog
- Houd ACTOS en alle geneesmiddelen buiten het bereik van kinderen
Algemene informatie over veilig en effectief gebruik van ACTOS
Medicijnen worden soms voorgeschreven voor andere doeleinden dan die in een Medicatiewijzer vermeld staan. Gebruik ACTOS niet voor een aandoening waarvoor het niet is voorgeschreven. Geef ACTOS niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze medicatiewijzer vat de belangrijkste informatie over ACTOS samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw arts of apotheker om informatie vragen over ACTOS dat is geschreven voor beroepsbeoefenaren in de gezondheidszorg. Ga voor meer informatie naar www.actos.com of bel 1-877-825-3327.
Wat zijn de ingrediënten in ACTOS 15mg?
Werkzaam bestanddeel: pioglitazon Inactieve ingrediënten: lactos 15 mg monohydraat, hydroxypropylcellulose, carboxymethylcellulosecalcium en magnesiumstearaat
Deze medicatiehandleiding is goedgekeurd door de Amerikaanse Food and Drug Administration.
