Amaryl 1mg, 2mg, 4mg Glimepiride Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Amaryl 1 mg en hoe wordt het gebruikt?
Amaryl 4 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van diabetes mellitus type 2 te behandelen. Amaryl 4 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Amaryl 2 mg behoort tot een klasse geneesmiddelen die antidiabetica, sulfonylureumderivaten worden genoemd.
Het is niet bekend of Amaryl veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Amaryl?
Amaryl kan ernstige bijwerkingen veroorzaken, waaronder:
- bleke of vergeelde huid,
- donker gekleurde urine,
- verwardheid,
- zwakte, en
- koorts
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Amaryl zijn:
- hoofdpijn,
- duizeligheid,
- zwakheid,
- misselijkheid, en
- lage bloedsuikerspiegel
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Amaryl. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
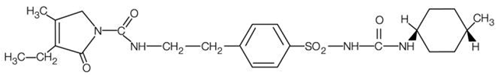
AMARYL is een oraal sulfonylureumderivaat dat de werkzame stof glimepiride bevat. Chemisch gezien wordt glimepiride geïdentificeerd als 1-[[p-[2-(3-ethyl-4-methyl-2-oxo-3-pyrroline-1-carboxamido) ethyl]fenyl]sulfonyl]-3-(trans-4- methylcyclohexyl)ureum (C24H34N4O5S) met een molecuulgewicht van 490,62. Glimepiride is een wit tot geelachtig wit, kristallijn, geurloos tot praktisch geurloos poeder en is praktisch onoplosbaar in water. De structuurformule is:
AMARYL-tabletten bevatten de werkzame stof glimepiride en de volgende inactieve ingrediënten: lactose (waterhoudend), natriumzetmeelglycolaat, povidon, microkristallijne cellulose en magnesiumstearaat. Daarnaast bevatten AMARYL 1 mg tabletten ijzeroxide rood, AMARYL 2 mg tabletten bevatten ijzeroxide geel en FD&C blauw #2 aluminiumlak, en AMARYL 4 mg tabletten bevatten FD&C blauw #2 aluminiumlak.
INDICATIES
AMARYL 2 mg is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle te verbeteren bij volwassenen met type 2 diabetes mellitus [zie Klinische studies ].
Belangrijke gebruiksbeperkingen
AMARYL mag niet worden gebruikt voor de behandeling van type 1 diabetes mellitus of diabetische ketoacidose, omdat het in deze situaties niet effectief zou zijn.
DOSERING EN ADMINISTRATIE
Aanbevolen dosering
AMARYL 1 mg moet worden toegediend bij het ontbijt of bij de eerste hoofdmaaltijd van de dag.
De aanbevolen startdosering van AMARYL is 1 mg of 2 mg eenmaal daags. Patiënten met een verhoogd risico op hypoglykemie (bijv. ouderen of patiënten met nierinsufficiëntie) dienen te worden gestart met 1 mg eenmaal daags [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik in specifieke populaties ].
Na het bereiken van een dagelijkse dosis van 2 mg, kunnen verdere dosisverhogingen worden gemaakt in stappen van 1 mg of 2 mg op basis van de glykemische respons van de patiënt. Optitratie mag niet vaker dan om de 1-2 weken plaatsvinden. Een conservatief titratieschema wordt aanbevolen voor patiënten met een verhoogd risico op hypoglykemie [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik in specifieke populaties ].
De maximale aanbevolen dosis is eenmaal daags 8 mg.
Patiënten die worden overgezet op AMARYL 1 mg van sulfonylureumderivaten met een langere halfwaardetijd (bijv. chloorpropamide) kunnen gedurende 1-2 weken een overlappend geneesmiddeleffect hebben en moeten adequaat worden gecontroleerd op hypoglykemie.
Wanneer colesevelam gelijktijdig wordt toegediend met glimepiride, worden de maximale plasmaconcentratie en de totale blootstelling aan glimepiride verminderd. Daarom moet AMARYL 2 mg ten minste 4 uur vóór colesevelam worden toegediend.
HOE GELEVERD
Doseringsvormen en sterke punten
AMARYL 4 mg is geformuleerd als tabletten van:
- 1 mg (roze, plat, langwerpig met ingekeepte zijkanten bij dubbele splitsing, bedrukt met "AMA RYL" aan één kant)
- 2 mg (groen, plat, langwerpig met ingekeepte zijkanten bij dubbele splitsing, bedrukt met "AMA RYL" aan één kant)
- 4 mg (blauw, plat, langwerpig met ingekeepte zijkanten bij dubbele splitsing, bedrukt met "AMA RYL" aan één kant)
Opslag en behandeling
AMARYL tabletten zijn verkrijgbaar in de volgende sterktes en verpakkingsgrootten:
1 mg (roze, plat, langwerpig met ingekeepte zijkanten bij dubbele bisectie, bedrukt met "AMA RYL" aan één kant) in flessen van 100 ( NDC 0039-0221-10)
2 mg (groen, plat, langwerpig met ingekeepte zijkanten bij dubbele bisectie, bedrukt met "AMA RYL" aan één kant) in flessen van 100 ( NDC 0039-0222-10)
4 mg (blauw, plat, langwerpig met ingekeepte zijkanten bij dubbele bisectie, bedrukt met "AMA RYL" aan één kant) in flessen van 100 ( NDC 0039-0223-10)
Bewaren bij 25°C (77°F); excursies toegestaan tot 20 - 25°C (68 - 77°F) (zie USP-gecontroleerde kamertemperatuur ).
Doseer in goed gesloten containers met veiligheidssluitingen.
sanofi-aventis US LLC, Bridgewater, NJ 08807, EEN SANOFI-BEDRIJF. Herzien december 2016
BIJWERKINGEN
De volgende ernstige bijwerkingen worden hieronder en elders in de etikettering in meer detail besproken:
- hypoglykemie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hemolytische anemie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
In klinische onderzoeken waren de meest voorkomende bijwerkingen met AMARYL 4 mg hypoglykemie, duizeligheid, asthenie, hoofdpijn en misselijkheid.
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
In de gecontroleerde klinische onderzoeken zijn ongeveer 2.800 patiënten met diabetes type 2 behandeld met AMARYL 4 mg. In deze onderzoeken werden ongeveer 1.700 patiënten gedurende ten minste 1 jaar met AMARYL behandeld.
Tabel 1 vat bijwerkingen samen, anders dan hypoglykemie, die werden gemeld in 11 gepoolde placebogecontroleerde onderzoeken, al dan niet beschouwd als mogelijk of waarschijnlijk gerelateerd aan onderzoeksmedicatie. De duur van de behandeling varieerde van 13 weken tot 12 maanden. Termen die worden gerapporteerd, vertegenwoordigen termen die optraden met een incidentie van ≥ 5% bij met AMARYL behandelde patiënten en vaker dan bij patiënten die placebo kregen.
Hypoglykemie
In een gerandomiseerde, dubbelblinde, placebogecontroleerde monotherapie-studie met een duur van 14 weken, ondergingen patiënten die al sulfonylureumderivaat kregen een uitwasperiode van 3 weken en werden vervolgens gerandomiseerd naar AMARYL 1 mg, 4 mg, 8 mg of placebo. Patiënten die waren gerandomiseerd naar AMARYL 4 mg of 8 mg ondergingen geforceerde titratie van een initiële dosis van 1 mg naar deze einddoses, zoals getolereerd [zie Klinische studies ]. De totale incidentie van mogelijke hypoglykemie (gedefinieerd door de aanwezigheid van ten minste één symptoom waarvan de onderzoeker dacht dat het verband hield met hypoglykemie; een gelijktijdige glucosemeting was niet vereist) was 4% voor AMARYL 1 mg, 17% voor AMARYL 4 mg, 16 % voor AMARYL 8 mg en 0% voor placebo. Al deze gebeurtenissen werden zelf behandeld.
In een gerandomiseerde, dubbelblinde, placebogecontroleerde monotherapie-studie met een duur van 22 weken kregen patiënten dagelijks een startdosis van 1 mg AMARYL of placebo. De dosis AMARYL 2 mg werd getitreerd tot een streefwaarde voor nuchtere plasmaglucose van 90-150 mg/dL. De uiteindelijke dagelijkse doses AMARYL 2 mg waren 1, 2, 3, 4, 6 of 8 mg [zie: Klinische studies ]. De totale incidentie van mogelijke hypoglykemie (zoals hierboven gedefinieerd voor de 14 weken durende studie) voor AMARYL versus placebo was 19,7% versus 3,2%. Al deze gebeurtenissen waren zelfbehandeling.
Gewichtstoename: AMARYL kan, net als alle sulfonylureumderivaten, gewichtstoename veroorzaken [zie Klinische studies ].
Allergische reacties: In klinische onderzoeken kwamen allergische reacties, zoals pruritus, erytheem, urticaria en morbilliforme of maculopapulaire uitbarstingen voor bij minder dan 1% van de met AMARYL behandelde patiënten. Deze kunnen verdwijnen ondanks voortgezette behandeling met AMARYL. Er zijn postmarketingmeldingen van ernstiger allergische reacties (bijv. dyspneu, hypotensie, shock) [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Laboratorium testen
Verhoogd serum alanine aminotransferase (ALT): In 11 gepoolde placebogecontroleerde onderzoeken met AMARYL ontwikkelde 1,9% van de met AMARYL behandelde patiënten en 0,8% van de met placebo behandelde patiënten serum-ALAT van meer dan 2 keer de bovengrens van het referentiebereik.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van AMARYL na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
- Ernstige overgevoeligheidsreacties, waaronder anafylaxie, angio-oedeem en Stevens-Johnson-syndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hemolytische anemie bij patiënten met en zonder G6PD-deficiëntie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Verslechtering van de leverfunctie (bijv. met cholestase en geelzucht), evenals hepatitis, die zich kan ontwikkelen tot leverfalen.
- Porphyria cutanea tarda, fotosensitiviteitsreacties en allergische vasculitis
- Leukopenie, agranulocytose, aplastische anemie en pancytopenie
- Trombocytopenie (inclusief ernstige gevallen met een aantal bloedplaatjes van minder dan 10.000/μl) en trombocytopenische purpura
- Leverporfyriereacties en disulfiram-achtige reacties
- Hyponatriëmie en syndroom van inadequate secretie van antidiuretisch hormoon (SIADH), meestal bij patiënten die andere medicijnen gebruiken of die medische aandoeningen hebben waarvan bekend is dat ze hyponatriëmie veroorzaken of de afgifte van antidiuretisch hormoon verhogen
- dysgeusie
- alopecia
DRUG-INTERACTIES
Geneesmiddelen die het glucosemetabolisme beïnvloeden
Een aantal medicijnen beïnvloedt het glucosemetabolisme en kan een dosisaanpassing van AMARYL 4 mg vereisen en in het bijzonder nauwlettende controle op hypoglykemie of verslechtering van de glykemische controle.
Hieronder volgen voorbeelden van medicijnen die het glucoseverlagende effect van sulfonylureumderivaten, waaronder AMARYL 2 mg, kunnen versterken, waardoor de gevoeligheid voor en/of de intensiteit van hypoglykemie toeneemt: orale antidiabetica, pramlintide-acetaat, insuline, angiotensineconverterend enzym (ACE)-remmers, H2-receptorantagonisten, fibraten, propoxyfeen, pentoxifylline, somatostatine-analogen, anabole steroïden en androgenen, cyclofosfamide, fenyramidol, guanethidine, fluconazol, sulfinpyrazon, tetracyclines, claritromycine, disopyramide, chinolonen, en geneesmiddelen die sterk aan eiwitten zijn gebonden niet-steroïde anti-inflammatoire geneesmiddelen, salicylaten, sulfonamiden, chlooramfenicol, coumarines, probenecide en monoamineoxidaseremmers. Wanneer deze medicijnen worden toegediend aan een patiënt die AMARYL krijgt, moet de patiënt nauwlettend worden gecontroleerd op hypoglykemie. Wanneer deze medicijnen worden gestaakt bij een patiënt die AMARYL 2 mg krijgt, moet de patiënt nauwlettend worden gecontroleerd op verslechtering van de glykemische controle.
Hieronder volgen voorbeelden van medicijnen die het glucoseverlagende effect van sulfonylureumderivaten, waaronder AMARYL, kunnen verminderen, wat leidt tot een verslechtering van de glykemische controle: danazol, glucagon, somatropine, proteaseremmers, atypische antipsychotica (bijv. olanzapine en clozapine), barbituraten, diazoxide, laxeermiddelen , rifampicine, thiaziden en andere diuretica, corticosteroïden, fenothiazinen, schildklierhormonen, oestrogenen, orale anticonceptiva, fenytoïne, nicotinezuur, sympathicomimetica (bijv. epinefrine, albuterol, terbutaline) en isoniazide. Wanneer deze medicijnen worden toegediend aan een patiënt die AMARYL 2 mg krijgt, moet de patiënt nauwlettend worden gecontroleerd op verslechtering van de glykemische controle. Wanneer deze medicijnen worden stopgezet bij een patiënt die AMARYL 2 mg krijgt, moet u de patiënt nauwlettend controleren op hypoglykemie.
Bètablokkers, clonidine en reserpine kunnen leiden tot versterking of verzwakking van het glucoseverlagende effect van AMARYL.
Zowel acute als chronische alcoholinname kan de glucoseverlagende werking van AMARYL 1 mg op onvoorspelbare wijze versterken of verzwakken.
De tekenen van hypoglykemie kunnen verminderd of afwezig zijn bij patiënten die sympathicolytica gebruiken, zoals bètablokkers, clonidine, guanethidine en reserpine.
Miconazol
Er is melding gemaakt van een mogelijke interactie tussen oraal miconazol en sulfonylureumderivaten die kan leiden tot ernstige hypoglykemie. Of deze interactie ook optreedt met andere doseringsvormen van miconazol is niet bekend.
Cytochroom P450 2C9-interacties
Er kan een interactie zijn tussen glimepiride en remmers (bijv. fluconazol) en inductoren (bijv. rifampicine) van cytochroom P450 2C9. Fluconazol kan het metabolisme van glimepiride remmen, wat leidt tot verhoogde plasmaconcentraties van glimepiride, wat kan leiden tot hypoglykemie. Rifampicine kan het metabolisme van glimepiride induceren, waardoor de plasmaconcentraties van glimepiride dalen, wat kan leiden tot een verslechtering van de glykemische controle.
Gelijktijdige toediening van Colesevelam
Colesevelam kan de maximale plasmaconcentratie en de totale blootstelling aan glimepiride verlagen wanneer de twee gelijktijdig worden toegediend. De absorptie wordt echter niet verminderd wanneer glimepiride 4 uur vóór colesevelam wordt toegediend. Daarom moet AMARYL ten minste 4 uur vóór colesevelam worden toegediend.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Hypoglykemie
Alle sulfonylureumderivaten, inclusief AMARYL, kunnen ernstige hypoglykemie veroorzaken [zie ONGEWENSTE REACTIES ]. Het concentratie- en reactievermogen van de patiënt kan verminderd zijn als gevolg van hypoglykemie. Deze beperkingen kunnen een risico vormen in situaties waarin deze vaardigheden bijzonder belangrijk zijn, zoals autorijden of andere machines bedienen. Ernstige hypoglykemie kan leiden tot bewusteloosheid of convulsies en kan leiden tot tijdelijke of permanente verslechtering van de hersenfunctie of overlijden.
Patiënten moeten worden opgeleid om hypoglykemie te herkennen en te behandelen. Wees voorzichtig bij het starten en verhogen van de doses AMARYL 2 mg bij patiënten die vatbaar kunnen zijn voor hypoglykemie (bijv. ouderen, patiënten met nierinsufficiëntie, patiënten die andere antidiabetica gebruiken). Verzwakte of ondervoede patiënten en patiënten met een bijnier-, hypofyse- of leverfunctiestoornis zijn bijzonder gevoelig voor de hypoglycemische werking van glucoseverlagende medicijnen. Hypoglykemie komt ook vaker voor wanneer de calorie-inname te laag is, na ernstige of langdurige inspanning, of wanneer alcohol wordt ingenomen.
Vroegtijdige waarschuwingssymptomen van hypoglykemie kunnen anders of minder uitgesproken zijn bij patiënten met autonome neuropathie, ouderen en bij patiënten die bèta-adrenerge blokkerende medicijnen of andere sympathicolytica gebruiken. Deze situaties kunnen leiden tot ernstige hypoglykemie voordat de patiënt zich bewust is van de hypoglykemie.
Overgevoeligheidsreacties
Er zijn postmarketingmeldingen geweest van overgevoeligheidsreacties bij patiënten die met AMARYL werden behandeld, waaronder ernstige reacties zoals anafylaxie, angio-oedeem en Stevens-Johnson-syndroom. Als een overgevoeligheidsreactie wordt vermoed, stop dan onmiddellijk met AMARYL, onderzoek naar andere mogelijke oorzaken voor de reactie en stel een alternatieve behandeling voor diabetes in.
Hemolytische anemie
Sulfonylureumderivaten kunnen hemolytische anemie veroorzaken bij patiënten met glucose-6-fosfaatdehydrogenase (G6PD)-deficiëntie. Omdat AMARYL 4 mg een sulfonylureumderivaat is, dient u voorzichtig te zijn bij patiënten met G6PD-deficiëntie en het gebruik van een niet-sulfonylureumdeficiëntie te overwegen. Er zijn ook postmarketingmeldingen van hemolytische anemie bij patiënten die AMARYL 1 mg kregen en die geen G6PD-deficiëntie hadden [zie ONGEWENSTE REACTIES ].
Verhoogd risico op cardiovasculaire mortaliteit met sulfonylureumderivaten
Er is gemeld dat de toediening van orale bloedglucoseverlagende geneesmiddelen gepaard gaat met een verhoogde cardiovasculaire mortaliteit in vergelijking met behandeling met alleen een dieet of een dieet plus insuline. Deze waarschuwing is gebaseerd op het onderzoek dat is uitgevoerd door het University Group Diabetes Program (UGDP), een prospectieve langetermijnstudie die is ontworpen om de effectiviteit van glucoseverlagende geneesmiddelen te evalueren bij het voorkomen of vertragen van vasculaire complicaties bij patiënten met niet-insulineafhankelijke suikerziekte. De studie omvatte 823 patiënten die willekeurig waren toegewezen aan een van de vier behandelingsgroepen. UGDP meldde dat patiënten die gedurende 5 tot 8 jaar werden behandeld met een dieet plus een vaste dosis tolbutamide (1,5 gram per dag) een cardiovasculaire mortaliteit hadden van ongeveer 2½ keer die van patiënten die alleen met een dieet worden behandeld. Er werd geen significante toename van de totale mortaliteit waargenomen, maar het gebruik van tolbutamide werd gestaakt op basis van de toename van de cardiovasculaire mortaliteit, waardoor de kans voor het onderzoek om een toename van de totale mortaliteit aan te tonen, werd beperkt. Ondanks controverse over de interpretatie van deze resultaten, bieden de bevindingen van de UGDP-studie een adequate basis voor deze waarschuwing. De patiënt moet worden geïnformeerd over de mogelijke risico's en voordelen van AMARYL 4 mg en over alternatieve therapievormen. Hoewel slechts één geneesmiddel in de klasse van sulfonylureumderivaten (tolbutamide) in deze studie werd opgenomen, is het vanuit veiligheidsoogpunt verstandig om te overwegen dat deze waarschuwing ook van toepassing kan zijn op andere orale bloedglucoseverlagende geneesmiddelen in deze klasse, gezien hun sterke overeenkomsten in de wijze van actie en chemische structuur.
Macrovasculaire resultaten
Er zijn geen klinische onderzoeken geweest die overtuigend bewijs hebben geleverd van macrovasculaire risicovermindering met AMARYL of een ander antidiabetisch geneesmiddel.
Niet-klinische toxicologie
Carcinogenese, mutagenese en verminderde vruchtbaarheid
Studies bij ratten met doses tot 5000 delen per miljoen (ppm) in volledig voer (ongeveer 340 keer de maximaal aanbevolen dosis voor de mens, gebaseerd op het oppervlak) gedurende 30 maanden toonden geen bewijs van carcinogenese. Bij muizen resulteerde toediening van glimepiride gedurende 24 maanden in een toename van de vorming van goedaardige pancreasadenoom die dosisgerelateerd was en waarvan werd gedacht dat het het resultaat was van chronische pancreasstimulatie. Bij muizen werd geen adenoomvorming waargenomen bij een dosis van 320 ppm in volledig voer, of 46-54 mg/kg lichaamsgewicht/dag. Dit is ongeveer 35 keer de maximaal aanbevolen dosis voor mensen van 8 mg eenmaal daags op basis van het oppervlak.
Glimepiride was niet-mutageen in een reeks in vitro en in vivo mutageniteitsonderzoeken (Ames-test, somatische celmutatie, chromosomale aberratie, ongeplande DNA-synthese en micronucleustest bij muizen).
Er was geen effect van glimepiride op de vruchtbaarheid van mannelijke muizen bij dieren die werden blootgesteld tot 2500 mg/kg lichaamsgewicht (> 1700 maal de maximaal aanbevolen dosis voor de mens op basis van het oppervlak). Glimepiride had geen effect op de vruchtbaarheid van mannelijke en vrouwelijke ratten die tot 4000 mg/kg lichaamsgewicht kregen toegediend (ongeveer 4000 keer de maximaal aanbevolen dosis voor de mens op basis van oppervlakte).
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie C
Er zijn geen adequate en goed gecontroleerde onderzoeken naar AMARYL 2 mg bij zwangere vrouwen. In dierstudies was er geen toename van aangeboren afwijkingen, maar een toename van foetale sterfte trad op bij ratten en konijnen bij doses glimepiride 50 maal (ratten) en 0,1 maal (konijnen) de maximaal aanbevolen dosis voor de mens (op basis van lichaamsoppervlak). Deze foetotoxiciteit, die alleen wordt waargenomen bij doses die hypoglykemie bij de moeder induceren, wordt verondersteld direct verband te houden met de farmacologische (hypoglykemische) werking van glimepiride en is op dezelfde manier waargenomen bij andere sulfonylureumderivaten. AMARYL mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus. Omdat gegevens suggereren dat abnormale bloedglucose tijdens de zwangerschap gepaard gaat met een hogere incidentie van aangeboren afwijkingen, moet diabetesbehandeling tijdens de zwangerschap de bloedglucose zo normaal mogelijk houden.
Nietteratogene effecten
Langdurige ernstige hypoglykemie (4 tot 10 dagen) is gemeld bij pasgeborenen van moeders die op het moment van de bevalling een sulfonylureumderivaat kregen.
Moeders die borstvoeding geven
Het is niet bekend of AMARYL 1 mg wordt uitgescheiden in de moedermelk. Tijdens pre- en postnatale onderzoeken bij ratten waren significante concentraties van glimepiride aanwezig in de moedermelk en het serum van de jongen. Nakomelingen van ratten die tijdens de zwangerschap en borstvoeding aan hoge niveaus van glimepiride waren blootgesteld, ontwikkelden skeletmisvormingen die bestonden uit verkorting, verdikking en buiging van de humerus tijdens de postnatale periode. Er werd vastgesteld dat deze skeletvervormingen het gevolg waren van borstvoeding door moeders die waren blootgesteld aan glimepiride. Op basis van deze diergegevens en het potentieel voor hypoglykemie bij een zuigeling, moet worden besloten of de borstvoeding moet worden gestaakt of dat AMARYL 2 mg moet worden gestaakt, rekening houdend met het belang van AMARYL voor de moeder.
Pediatrisch gebruik
De farmacokinetiek, werkzaamheid en veiligheid van AMARYL 4 mg zijn geëvalueerd bij pediatrische patiënten met type 2-diabetes, zoals hieronder beschreven. AMARYL 4 mg wordt niet aanbevolen bij pediatrische patiënten vanwege de nadelige effecten op het lichaamsgewicht en hypoglykemie.
De farmacokinetiek van een enkele dosis AMARYL van 1 mg werd geëvalueerd bij 30 patiënten met type 2-diabetes (mannelijk = 7; vrouwelijk = 23) in de leeftijd van 10 tot 17 jaar. De gemiddelde (± SD) AUC (339±203 ng·uur/ml), Cmax (102±48 ng/ml) en t½ (3,1±1,7 uur) voor glimepiride waren vergelijkbaar met historische gegevens van volwassenen (AUC(0-laatste ) 315±96 ng·uur/ml, Cmax 103±34 ng/ml en t½ 5,3±4,1 uur).
De veiligheid en werkzaamheid van AMARYL bij pediatrische patiënten werd geëvalueerd in een enkelblinde studie van 24 weken waarin 272 patiënten (8-17 jaar) met type 2-diabetes werden gerandomiseerd naar AMARYL (n=135) of metformine (n=137). ). Zowel behandelingsnaïeve patiënten (die ten minste 2 weken voorafgaand aan randomisatie werden behandeld met alleen dieet en lichaamsbeweging) als eerder behandelde patiënten (die eerder waren behandeld of momenteel worden behandeld met andere orale antidiabetica gedurende ten minste 3 maanden) kwamen in aanmerking voor deelname. Patiënten die orale antidiabetica kregen op het moment van deelname aan het onderzoek, stopten met deze medicatie vóór randomisatie zonder een wash-outperiode. AMARYL werd gestart met 1 mg en vervolgens getitreerd tot 2, 4 of 8 mg (gemiddelde laatste dosis 4 mg) tot en met week 12, gericht op een zelfgecontroleerde nuchtere bloedglucose met een vingerprik
Na 24 weken was het totale gemiddelde behandelingsverschil in HbA1c tussen AMARYL 4 mg en metformine 0,2%, in het voordeel van metformine (95% betrouwbaarheidsinterval -0,3% tot +0,6%). Op basis van deze resultaten voldeed het onderzoek niet aan het primaire doel van het aantonen van een vergelijkbare verlaging van HbA1c met AMARYL 4 mg in vergelijking met metformine.
Het profiel van bijwerkingen bij pediatrische patiënten die werden behandeld met AMARYL 2 mg was vergelijkbaar met dat waargenomen bij volwassenen [zie: ONGEWENSTE REACTIES ].
Hypoglykemische voorvallen gedocumenteerd door bloedglucosewaarden
Geriatrisch gebruik
In klinische onderzoeken met AMARYL 2 mg waren 1053 van de 3491 patiënten (30%) > 65 jaar. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze patiënten en jongere patiënten, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Er waren geen significante verschillen in de farmacokinetiek van glimepiride tussen patiënten met type 2-diabetes 65 jaar (n=49) en patiënten > 65 jaar (n=42) [zie KLINISCHE FARMACOLOGIE ].
Glimepiride wordt grotendeels uitgescheiden door de nieren. Oudere patiënten hebben meer kans op nierinsufficiëntie. Bovendien kan hypoglykemie bij ouderen moeilijk te herkennen zijn [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Wees voorzichtig bij het starten van AMARYL en het verhogen van de dosis AMARYL 1 mg bij deze patiëntenpopulatie.
Nierfunctiestoornis
Om het risico op hypoglykemie te minimaliseren, is de aanbevolen startdosering van AMARYL 1 mg per dag voor alle patiënten met type 2-diabetes en nierinsufficiëntie [zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Er werd een titratiestudie met meerdere doses uitgevoerd bij 16 patiënten met type 2-diabetes en nierinsufficiëntie met doses variërend van 1 mg tot 8 mg per dag gedurende 3 maanden. De baseline creatinineklaring varieerde van 10-60 ml/min. De farmacokinetiek van AMARYL werd geëvalueerd in het titratieonderzoek met meerdere doses en de resultaten waren consistent met die waargenomen bij patiënten die deelnamen aan een onderzoek met een enkele dosis. In beide onderzoeken nam de relatieve totale klaring van AMARYL toe wanneer de nierfunctie was aangetast. Beide onderzoeken toonden ook aan dat de eliminatie van de twee belangrijkste metabolieten was verminderd bij patiënten met nierinsufficiëntie [zie: KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Een overdosering van AMARYL 2 mg kan, net als bij andere sulfonylureumderivaten, ernstige hypoglykemie veroorzaken. Milde episoden van hypoglykemie kunnen worden behandeld met orale glucose. Ernstige hypoglykemische reacties vormen medische noodgevallen die onmiddellijke behandeling vereisen. Ernstige hypoglykemie met coma, toevallen of neurologische stoornis kan worden behandeld met glucagon of intraveneuze glucose. Voortgezette observatie en aanvullende inname van koolhydraten kan nodig zijn omdat hypoglykemie kan terugkeren na schijnbaar klinisch herstel [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CONTRA-INDICATIES
AMARYL is gecontra-indiceerd bij patiënten met een voorgeschiedenis van een overgevoeligheidsreactie op:
- Glimepiride of een van de ingrediënten van het product [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Sulfonamidederivaten: Patiënten die een allergische reactie op sulfonamidederivaten hebben ontwikkeld, kunnen een allergische reactie op AMARYL ontwikkelen. Gebruik AMARYL 4 mg niet bij patiënten met een voorgeschiedenis van een allergische reactie op sulfonamidederivaten.
Gerapporteerde overgevoeligheidsreacties omvatten huiduitslag met of zonder pruritus en ernstigere reacties (bijv. anafylaxie, angio-oedeem, Stevens-Johnson-syndroom, dyspneu) [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Glimepiride verlaagt voornamelijk de bloedglucose door de afgifte van insuline door bètacellen van de pancreas te stimuleren. Sulfonylurea binden aan de sulfonylureumreceptor in het bètacelplasmamembraan van de pancreas, wat leidt tot sluiting van het ATP-gevoelige kaliumkanaal, waardoor de afgifte van insuline wordt gestimuleerd.
farmacodynamiek
Bij gezonde proefpersonen was de tijd om het maximale effect te bereiken (minimale bloedglucoseconcentraties) ongeveer 2-3 uur na enkelvoudige orale doses AMARYL. De effecten van AMARYL op HbA1c, nuchtere plasmaglucose en postprandiale glucose zijn beoordeeld in klinische onderzoeken [zie Klinische studies ].
Farmacokinetiek
Absorptie
Studies met enkelvoudige orale doses glimepiride bij gezonde proefpersonen en met meervoudige orale doses bij patiënten met type 2-diabetes toonden piekconcentraties van het geneesmiddel (Cmax) 2 tot 3 uur na de dosis. Wanneer glimepiride bij de maaltijd werd gegeven, daalden de gemiddelde Cmax en AUC (oppervlakte onder de curve) met respectievelijk 8% en 9%.
Glimepiride accumuleert niet in serum na meervoudige dosering. De farmacokinetiek van glimepiride verschilt niet tussen gezonde proefpersonen en patiënten met type 2-diabetes. De klaring van glimepiride na orale toediening verandert niet binnen het doseringsbereik van 1 mg tot 8 mg, wat wijst op lineaire farmacokinetiek.
Bij gezonde proefpersonen waren de intra- en interindividuele variabiliteiten van de farmacokinetische parameters van glimepiride respectievelijk 15-23% en 24-29%.
Verdeling
Na intraveneuze toediening bij gezonde proefpersonen was het distributievolume (Vd) 8,8 l (113 ml/kg) en de totale lichaamsklaring (CL) 47,8 ml/min. Eiwitbinding was groter dan 99,5%.
Metabolisme
Glimepiride wordt volledig gemetaboliseerd door oxidatieve biotransformatie na een intraveneuze of orale dosis. De belangrijkste metabolieten zijn het cyclohexylhydroxymethylderivaat (M1) en het carboxylderivaat (M2). Cytochroom P450 2C9 is betrokken bij de biotransformatie van glimepiride naar M1. M1 wordt verder gemetaboliseerd tot M2 door een of meerdere cytosolische enzymen. M2 is inactief. Bij dieren bezit M1 ongeveer een derde van de farmacologische activiteit van glimepiride, maar het is onduidelijk of M1 leidt tot klinisch betekenisvolle effecten op de bloedglucose bij mensen.
uitscheiding
Wanneer 14C-glimepiride oraal werd toegediend aan 3 gezonde mannelijke proefpersonen, werd in 7 dagen ongeveer 60% van de totale radioactiviteit in de urine teruggevonden. M1 en M2 waren goed voor 80-90% van de radioactiviteit die in de urine werd teruggevonden. De verhouding van M1 tot M2 in de urine was ongeveer 3:2 bij twee proefpersonen en 4:1 bij één proefpersoon. Ongeveer 40% van de totale radioactiviteit werd teruggevonden in de feces. M1 en M2 waren goed voor ongeveer 70% (verhouding van M1 tot M2 was 1:3) van de radioactiviteit die in feces werd teruggevonden. Er werd geen oudergeneesmiddel teruggevonden in urine of uitwerpselen. Na intraveneuze toediening bij patiënten werd geen significante uitscheiding via de gal van glimepiride of zijn M1-metaboliet waargenomen.
Geriatrische patiënten
Een vergelijking van de farmacokinetiek van glimepiride bij patiënten met diabetes type 2 65 jaar en patiënten > 65 jaar werd geëvalueerd in een onderzoek met meervoudige doses waarbij AMARYL 6 mg per dag werd gebruikt. Er waren geen significante verschillen in de farmacokinetiek van glimepiride tussen de twee leeftijdsgroepen. De gemiddelde AUC bij steady-state voor de oudere patiënten was ongeveer 13% lager dan die voor de jongere patiënten; de gemiddelde, voor het gewicht gecorrigeerde klaring voor de oudere patiënten was ongeveer 11% hoger dan die voor de jongere patiënten.
Geslacht
Er waren geen verschillen tussen mannen en vrouwen in de farmacokinetiek van glimepiride wanneer er werd gecorrigeerd voor verschillen in lichaamsgewicht.
Ras
Er zijn geen onderzoeken uitgevoerd om de effecten van ras op de farmacokinetiek van glimepiride te beoordelen, maar in placebogecontroleerde onderzoeken met AMARYL 2 mg bij patiënten met type 2-diabetes was de verlaging van HbA vergelijkbaar bij blanken (n = 536), zwarten (n = 63) , en Iberiërs (n = 63).
Nierfunctiestoornis
Een open-label onderzoek met een enkelvoudige dosis AMARYL 3 mg werd toegediend aan patiënten met een lichte, matige en ernstige nierfunctiestoornis zoals geschat op basis van de creatinineklaring (CLcr): Groep I bestond uit 5 patiënten met een lichte nierfunctiestoornis (CLcr > 50 ml/min ), bestond Groep II uit 3 patiënten met een matige nierfunctiestoornis (CLcr = 20-50 ml/min) en Groep III bestond uit 7 patiënten met een ernstige nierfunctiestoornis (CLcr
Leverfunctiestoornis
Het is niet bekend of er een effect is van een leverfunctiestoornis op de farmacokinetiek van AMARYL 1 mg, omdat de farmacokinetiek van AMARYL 1 mg niet adequaat is beoordeeld bij patiënten met een leverfunctiestoornis.
Zwaarlijvige patiënten
De farmacokinetiek van glimepiride en zijn metabolieten werd gemeten in een onderzoek met een enkele dosis onder 28 patiënten met type 2-diabetes die ofwel een normaal lichaamsgewicht hadden of morbide obesitas hadden. Terwijl de tmax, de klaring en het distributievolume van glimepiride bij de patiënten met morbide obesitas vergelijkbaar waren met die in de groep met normaal gewicht, hadden de morbide obesitas een lagere Cmax en AUC dan die met een normaal lichaamsgewicht. De gemiddelde Cmax, AUC0-24, AUC0-∞-waarden van glimepiride bij normale vs. morbide obese patiënten waren 547 ± 218 ng/ml vs. 410 ± 124 ng/ml, 3210 ± 1030 uur·ng/ml vs. 2820 ± 1110 uur·ng/ml en 4000 ± 1320 uur·ng/ml vs. respectievelijk 3280 ± 1360 uur·ng/ml.
Geneesmiddelinteracties
Aspirine: In een gerandomiseerde, dubbelblinde, twee-periode, cross-over studie, kregen gezonde proefpersonen placebo of aspirine 1 gram driemaal daags gedurende een totale behandelingsperiode van 5 dagen. Op dag 4 van elke onderzoeksperiode werd een enkele dosis van 1 mg AMARYL 4 mg toegediend. De doses AMARYL 4 mg werden gescheiden door een uitwasperiode van 14 dagen. Gelijktijdige toediening van aspirine en AMARYL 4 mg resulteerde in een afname van 34% van de gemiddelde AUC van glimepiride en een afname van 4% van de gemiddelde Cmax van glimepiride.
Colesevelam: Gelijktijdige toediening van colesevelam en glimepiride resulteerde in verlagingen van de AUC0-∞ en Cmax van glimepiride met respectievelijk 18% en 8%. Wanneer glimepiride 4 uur voorafgaand aan colesevelam werd toegediend, was er geen significante verandering in de AUC0-∞ en Cmax van glimepiride, respectievelijk -6% en 3% [zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ].
Cimetidine en ranitidine: In een gerandomiseerde, open-label, 3-weg cross-over studie kregen gezonde proefpersonen ofwel een enkele dosis van 4 mg AMARYL alleen, AMARYL met ranitidine (150 mg tweemaal daags gedurende 4 dagen; AMARYL 2 mg werd toegediend op dag 3), of AMARYL 2 mg met cimetidine (800 mg per dag gedurende 4 dagen; AMARYL werd toegediend op dag 3). Gelijktijdige toediening van cimetidine of ranitidine met een enkele orale dosis van 4 mg AMARYL 4 mg veranderde de absorptie en dispositie van glimepiride niet significant.
Propranolol: In een gerandomiseerde, dubbelblinde cross-overstudie met twee perioden kregen gezonde proefpersonen driemaal daags een placebo of propranolol 40 mg gedurende een totale behandelingsperiode van 5 dagen. Op dag 4 of elke onderzoeksperiode werd een enkele dosis van 2 mg AMARYL 4 mg toegediend. De doses AMARYL 4 mg werden gescheiden door een uitwasperiode van 14 dagen. Gelijktijdige toediening van propranolol en AMARYL 1 mg verhoogde de Cmax, AUC en T van glimepiride significant met respectievelijk 23%, 22% en 15% en verlaagde de CL/f van glimepiride met 18%. De terugwinning van M1 en M2 uit urine was niet veranderd.
Warfarine: In een open-label, tweerichtings-crossover-onderzoek kregen gezonde proefpersonen gedurende 10 dagen 4 mg AMARYL 2 mg per dag. Enkelvoudige doses warfarine van 25 mg werden 6 dagen vóór aanvang van AMARYL en op dag 4 van de toediening van AMARYL toegediend. De gelijktijdige toediening van AMARYL veranderde de farmacokinetiek van R- en S-warfarine-enantiomeren niet. Er werden geen veranderingen waargenomen in de plasma-eiwitbinding van warfarine. AMARYL 1 mg resulteerde in een statistisch significante afname van de farmacodynamische respons op warfarine. De verlagingen van de gemiddelde oppervlakte onder de protrombinetijd (PT)-curve en de maximale PT-waarden tijdens AMARYL-behandeling waren respectievelijk 3,3% en 9,9%, en het is onwaarschijnlijk dat ze klinisch relevant zijn.
Klinische studies
Monotherapie
Een totaal van 304 patiënten met type 2-diabetes die al met sulfonylureumtherapie waren behandeld, namen deel aan een 14 weken durende, multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde studie ter evaluatie van de veiligheid en werkzaamheid van AMARYL 1 mg monotherapie. Patiënten stopten met hun sulfonylureumtherapie en gingen vervolgens een placebo-washoutperiode van 3 weken in, gevolgd door randomisatie in 1 van de 4 behandelingsgroepen: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) en AMARYL 8mg (n=76). Alle patiënten gerandomiseerd naar AMARYL 4 mg begonnen met 1 mg per dag. Patiënten die waren gerandomiseerd naar AMARYL 4 mg of 8 mg hadden geblindeerde, geforceerde titratie van de dosis AMARYL 2 mg met wekelijkse intervallen, eerst naar 4 mg en vervolgens naar 8 mg, zolang de dosis werd verdragen, totdat de gerandomiseerde dosis was bereikt. Patiënten die waren gerandomiseerd naar de dosis van 4 mg bereikten de toegewezen dosis in week 2. Patiënten die waren gerandomiseerd naar de dosis van 8 mg bereikten de toegewezen dosis in week 3. Zodra het gerandomiseerde dosisniveau was bereikt, moesten de patiënten die dosis behouden tot week 14. Ongeveer 66% van de met placebo behandelde patiënten voltooide het onderzoek, vergeleken met 81% van de patiënten die werden behandeld met glimepiride 1 mg en 92% van de patiënten die werden behandeld met glimepiride 4 mg of 8 mg. Vergeleken met placebo gaf behandeling met AMARYL 1 mg, 4 mg en 8 mg per dag statistisch significante verbeteringen in HbA1c in vergelijking met placebo (tabel 3).
Een totaal van 249 patiënten die nog niet eerder waren behandeld of die in het verleden een beperkte behandeling met antidiabetica hadden gekregen, werden gerandomiseerd naar een behandeling van 22 weken met AMARYL (n=123) of placebo (n=126) in een multicenter, gerandomiseerd , dubbelblinde, placebo-gecontroleerde, dosistitratiestudie. De startdosis AMARYL was 1 mg per dag en werd met tussenpozen van 2 weken naar boven of beneden getitreerd tot een doel-FPG van 90-150 mg/dL. Bloedglucosewaarden voor zowel FPG als PPG werden in het laboratorium geanalyseerd. Na 10 weken dosisaanpassing werden de patiënten gedurende de resterende 12 weken van het onderzoek op hun optimale dosis (1, 2, 3, 4, 6 of 8 mg) gehouden. Behandeling met AMARYL 2 mg gaf statistisch significante verbeteringen in HbA1c en FPG in vergelijking met placebo (Tabel 4).
PATIËNT INFORMATIE
Informeer patiënten over het belang van het opvolgen van dieetinstructies, van een regelmatig trainingsprogramma en van het regelmatig testen van de bloedglucose.
Informeer patiënten over de mogelijke bijwerkingen van AMARYL 1 mg, waaronder hypoglykemie en gewichtstoename.
Leg de symptomen en behandeling van hypoglykemie uit, evenals aandoeningen die vatbaar zijn voor hypoglykemie. Patiënten dienen geïnformeerd te worden dat het concentratie- en reactievermogen verminderd kan zijn als gevolg van hypoglykemie. Dit kan een risico vormen in situaties waarin deze vaardigheden bijzonder belangrijk zijn, zoals autorijden of het bedienen van andere machines.
Patiënten met diabetes moeten worden geadviseerd om hun zorgverlener te informeren als ze zwanger zijn, zwangerschap overwegen, borstvoeding geven of borstvoeding overwegen.
