Behandeling van diabetes: Glucophage 500mg, 850mg, 1000mg Metformin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Glucophage en hoe wordt het gebruikt?
Glucophage is een receptgeneesmiddel dat wordt gebruikt voor de behandeling ter verbetering van de bloedsuikerspiegel bij volwassenen met type 2 diabetes mellitus. Glucophage kan alleen of in combinatie met andere medicijnen worden gebruikt.
Glucophage 850 mg behoort tot een klasse geneesmiddelen die antidiabetica worden genoemd.
Het is niet bekend of Glucophage veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat zijn de mogelijke bijwerkingen van Glucophage?
- ongebruikelijke spierpijn,
- koud hebben,
- moeite met ademhalen,
- duizelig of licht in het hoofd voelen,
- vermoeidheid,
- zwakheid,
- buikpijn,
- braken, en
- langzame of onregelmatige hartslag
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Glucophage zijn:
- lage bloedsuikerspiegel,
- misselijkheid,
- maagklachten, en
- diarree
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Glucophage. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
MELKACIDOSE
Postmarketinggevallen van metformine-geassocieerde lactaatacidose hebben geleid tot overlijden, hypothermie, hypotensie en resistente bradyaritmieën. Het begin van metformine-geassocieerde lactaatacidose is vaak subtiel en gaat alleen gepaard met niet-specifieke symptomen zoals malaise, spierpijn, ademnood, slaperigheid en buikpijn. Metformina-geassocieerde lactaatacidose werd gekenmerkt door verhoogde lactaatspiegels in het bloed (>5 mmol/liter), anion gap acidose (zonder bewijs van ketonurie of ketonemie), een verhoogde lactaat/pyruvaatverhouding; en metformineplasmaspiegels in het algemeen> 5 mcg / ml (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Risicofactoren voor metformine-geassocieerde lactaatacidose zijn onder meer nierinsufficiëntie, gelijktijdig gebruik van bepaalde geneesmiddelen (bijv. koolzuuranhydraseremmers zoals topiramaat), 65 jaar of ouder, een radiologisch onderzoek met contrastmiddel, chirurgie en andere procedures, hypoxische toestanden (bijv. , acuut congestief hartfalen), overmatig alcoholgebruik en leverinsufficiëntie.
Er worden stappen gegeven om het risico op metformine-geassocieerde lactaatacidose bij deze risicogroepen te verminderen en te behandelen (zie DOSERING EN TOEDIENING, CONTRA-INDICATIES, WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
Als metformine-geassocieerde lactaatacidose wordt vermoed, stop dan onmiddellijk met GLUCOPHAGE of GLUCOPHAGE XR en stel algemene ondersteunende maatregelen in een ziekenhuisomgeving. Snelle hemodialyse wordt aanbevolen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
GLUCOPHAGE/GLUCOPHAGE 500 mg XR bevat het antihyperglycemische middel metformine, een biguanide, in de vorm van monohydrochloride. De chemische naam van metforminehydrochloride is N,N-dimethylimidodicarbonimidic diamidehydrochloride. De structuurformule ziet er als volgt uit:
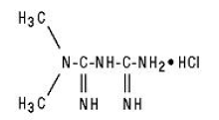
Metforminehydrochloride is een witte tot gebroken witte kristallijne verbinding met de molecuulformule C4H11N5 • HCl en een molecuulgewicht van 165,63. Het is vrij oplosbaar in water en is praktisch onoplosbaar in aceton, ether en chloroform. De pKa van metformine is 12,4. De pH van een 1% waterige oplossing van metforminehydrochloride is 6,68.
GLUCOPHAGE-tabletten bevatten 500 mg, 850 mg of 1000 mg metforminehydrochloride, wat overeenkomt met respectievelijk 389,93 mg, 662,88 mg, 779,86 mg metforminebase. Elke tablet bevat de inactieve ingrediënten povidon en magnesiumstearaat. Bovendien bevat de omhulling voor de tabletten van 500 mg en 850 mg hypromellose en bevat de omhulling voor de tablet van 1000 mg hypromellose en polyethyleenglycol.
GLUCOPHAGE 500 mg XR bevat 500 mg of 750 mg metforminehydrochloride, wat overeenkomt met respectievelijk 389,93 mg, 584,90 mg metforminebase.
GLUCOPHAGE XR 500 mg tabletten bevatten de inactieve ingrediënten hypromellose, microkristallijne cellulose, natriumcarboxymethylcellulose en magnesiumstearaat.
GLUCOPHAGE 850 mg XR 750 mg tabletten bevatten de inactieve ingrediënten hypromellose, natriumcarboxymethylcellulose, magnesiumstearaat en rood ijzeroxidepigment.
INDICATIES
GLUCOPHAGE 850 mg is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle te verbeteren bij volwassenen en pediatrische patiënten van 10 jaar en ouder met type 2 diabetes mellitus.
GLUCOPHAGE XR is geïndiceerd als aanvulling op dieet en lichaamsbeweging om de glykemische controle te verbeteren bij volwassenen met type 2 diabetes mellitus.
DOSERING EN ADMINISTRATIE
Dosering voor volwassenen
Glucofaag
- De aanbevolen startdosering van GLUCOPHAGE 850 mg is tweemaal daags 500 mg oraal of eenmaal daags 850 mg, bij de maaltijd gegeven.
- Verhoog de dosis in stappen van 500 mg per week of 850 mg elke 2 weken op basis van glykemische controle en verdraagbaarheid, tot een maximale dosis van 2550 mg per dag, verdeeld over verschillende doses.
- Doses hoger dan 2000 mg kunnen beter worden verdragen als ze 3 keer per dag bij de maaltijd worden gegeven.
Glucofaag XR
- Slik GLUCOPHAGE XR-tabletten in hun geheel door en verpulver, snijd of kauw nooit.
- De aanbevolen startdosering van GLUCOPHAGE XR is 500 mg oraal eenmaal daags bij de avondmaaltijd.
- Verhoog de dosis in stappen van 500 mg per week op basis van glykemische controle en verdraagbaarheid, tot een maximum van 2000 mg eenmaal daags bij de avondmaaltijd.
- Als glykemische controle niet wordt bereikt met GLUCOPHAGE XR 2000 mg eenmaal daags, overweeg dan een proef met GLUCOPHAGE 850 mg XR 1000 mg tweemaal daags. Als hogere doses nodig zijn, schakel dan over op GLUCOPHAGE 500 mg in totale dagelijkse doses tot 2550 mg, toegediend in verdeelde dagelijkse doses, zoals hierboven beschreven.
- Patiënten die GLUCOPHAGE 1000 mg krijgen, kunnen worden overgezet op GLUCOPHAGE 850 mg XR eenmaal daags met dezelfde totale dagelijkse dosis, tot maximaal 2000 mg eenmaal daags.
Pediatrische dosering voor glucofaag
- De aanbevolen startdosering van GLUCOPHAGE 850 mg voor pediatrische patiënten van 10 jaar en ouder is tweemaal daags 500 mg oraal, bij de maaltijd gegeven.
- Verhoog de dosering in stappen van 500 mg per week op basis van glykemische controle en verdraagbaarheid, tot een maximum van 2000 mg per dag, gegeven in verdeelde doses tweemaal daags.
Aanbevelingen voor gebruik bij nierinsufficiëntie
- Beoordeel de nierfunctie vóór aanvang van GLUCOPHAGE/GLUCOPHAGE 500 mg XR en periodiek daarna.
- GLUCOPHAGE/GLUCOPHAGE 500 mg XR is gecontra-indiceerd bij patiënten met een geschatte glomerulaire filtratiesnelheid (eGFR) van minder dan 30 ml/minuut/1,73 m2.
- Het starten van GLUCOPHAGE/GLUCOPHAGE 850 mg XR bij patiënten met een eGFR tussen 30 – 45 ml/minuut/1,73 m2 wordt niet aanbevolen.
- Bij patiënten die GLUCOPHAGE/GLUCOPHAGE 1000 mg XR gebruiken en bij wie de eGFR later daalt tot onder 45 ml/min/1,73 m2, moet u de voordelen en risico's beoordelen van voortzetting van de behandeling.
- Stop GLUCOPHAGE/GLUCOPHAGE 1000 mg XR als de eGFR van de patiënt later daalt tot onder 30 ml/minuut/1,73 m2 [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Stopzetting voor gejodeerde contrastbeeldvormingsprocedures
Stop GLUCOPHAGE/GLUCOPHAGE XR op het moment van of voorafgaand aan een jodiumhoudende contrastbeeldvormingsprocedure bij patiënten met een eGFR tussen 30 en 60 ml/min/1,73 m2; bij patiënten met een voorgeschiedenis van leverziekte, alcoholisme of hartfalen; of bij patiënten die intra-arterieel jodiumhoudend contrast krijgen toegediend. Evalueer de eGFR 48 uur na de beeldvormingsprocedure opnieuw; herstart GLUCOPHAGE/GLUCOPHAGE XR als de nierfunctie stabiel is.
HOE GELEVERD
Doseringsvormen en sterke punten
GLUCOPHAGE 850 mg is verkrijgbaar als:
- Tabletten: 500 mg rond, wit tot gebroken wit, filmomhuld met de inscriptie "BMS 6060" rond de omtrek aan de ene kant en "500" gegraveerd aan de andere kant.
- Tabletten: 850 mg rond, wit tot gebroken wit, filmomhuld met de inscriptie "BMS 6070" rond de omtrek aan de ene kant en "850" ingeslagen over de voorkant van de andere kant.
- Tabletten: 1000 mg wit, ovaal, biconvex, filmomhuld met "BMS 6071" ingeslagen aan de ene kant en "1000" ingeslagen aan de andere kant en met een halve lijn aan beide kanten.
GLUCOPHAGE XR is verkrijgbaar als:
- Tabletten met verlengde afgifte: 500 mg wit tot gebroken wit, capsulevormig, biconvex, met "BMS 6063" ingeslagen aan de ene kant en "500" ingeslagen over de voorkant van de andere kant.
- Tabletten met verlengde afgifte: 750 mg bleekrood en kan een gevlekt uiterlijk hebben, capsulevormig, biconvex, met "BMS 6064" ingeslagen aan de ene kant en "750" ingeslagen aan de andere kant.
Opslag en behandeling
Opslag
Bewaren bij 20°–25°C (68°–77°F); excursies toegestaan tot 15°–30°C (59°–86°F). [Zie USP-gecontroleerde kamertemperatuur.]
Doseer in lichtbestendige containers.
Gedistribueerd door: Bristol-Myers Squibb Company Princeton, NJ 08543 VS. Herzien: mei 2018.
BIJWERKINGEN
De volgende bijwerkingen worden ook elders in de etikettering besproken:
- Melkzuuracidose [zie DOOS WAARSCHUWING: en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Vitamine B12-tekort [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- hypoglykemie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring in klinische studies
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Glucofaag
In een klinisch onderzoek in de VS met GLUCOPHAGE 850 mg bij patiënten met diabetes mellitus type 2 kregen in totaal 141 patiënten GLUCOPHAGE 1000 mg tot 2550 mg per dag. Bijwerkingen die werden gemeld bij meer dan 5% van de met GLUCOPHAGE 500 mg behandelde patiënten en die vaker voorkwamen dan bij de met placebo behandelde patiënten, staan vermeld in Tabel 1.
Diarree leidde bij 6% van de patiënten tot stopzetting van GLUCOPHAGE 500 mg. Bovendien werden de volgende bijwerkingen gemeld bij ≥1% tot ≤5% van de met GLUCOPHAGE behandelde patiënten en werden ze vaker gemeld met GLUCOPHAGE dan met placebo: abnormale ontlasting, hypoglykemie, myalgie, licht gevoel in het hoofd, dyspneu, nagelaandoening, huiduitslag, toegenomen zweten, smaak aandoening, ongemak op de borst, koude rillingen, griepsyndroom, blozen, hartkloppingen.
In klinische onderzoeken met GLUCOPHAGE 500 mg met een duur van 29 weken werd bij ongeveer 7% van de patiënten een daling tot subnormale spiegels van voorheen normale vitamine B12-serumspiegels waargenomen.
Pediatrische patiënten
In klinische onderzoeken met GLUCOPHAGE bij pediatrische patiënten met diabetes mellitus type 2 was het profiel van bijwerkingen vergelijkbaar met dat waargenomen bij volwassenen.
Glucopage XR
In placebogecontroleerde onderzoeken kregen 781 patiënten GLUCOPHAGE 1000 mg XR toegediend. Bijwerkingen die zijn gemeld bij meer dan 5% van de GLUCOPHAGE 850 mg XR-patiënten en die vaker voorkwamen bij met GLUCOPHAGE XR behandelde patiënten dan bij met placebo behandelde patiënten, staan vermeld in Tabel 2.
Diarree leidde bij 0,6% van de patiënten tot stopzetting van GLUCOPHAGE XR. Bovendien werden de volgende bijwerkingen gemeld bij ≥ 1,0% tot ≤ 5,0% van de GLUCOPHAGE XR-patiënten en werden ze vaker gemeld met GLUCOPHAGE XR dan met placebo: buikpijn, constipatie, opgezette buik, dyspepsie/brandend maagzuur, winderigheid, duizeligheid, hoofdpijn, luchtweginfectie, smaakstoornis.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van metformine na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bij postmarketinggebruik van metformine zijn cholestatische, hepatocellulaire en gemengde hepatocellulaire leverbeschadiging gemeld.
DRUG-INTERACTIES
Tabel 3 toont klinisch significante geneesmiddelinteracties met GLUCOPHAGE/GLUCOPHAGE XR.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Melkzuuracidose
Er zijn postmarketing gevallen geweest van metformine-geassocieerde lactaatacidose, waaronder gevallen met fatale afloop. Deze gevallen begonnen subtiel en gingen gepaard met niet-specifieke symptomen zoals malaise, spierpijn, buikpijn, ademnood of toegenomen slaperigheid; hypotensie en resistente bradyaritmieën zijn echter opgetreden bij ernstige acidose. Metformina-geassocieerde lactaatacidose werd gekenmerkt door verhoogde lactaatconcentraties in het bloed (>5 mmol/L), anion gap acidose (zonder aanwijzingen voor ketonurie of ketonemie) en een verhoogde lactaat:pyruvaatverhouding; metformine plasmaspiegels waren over het algemeen >5 mcg/ml. Metformine vermindert de opname van lactaat door de lever en verhoogt de lactaatspiegels in het bloed, wat het risico op lactaatacidose kan verhogen, vooral bij risicopatiënten.
Als metformine-geassocieerde lactaatacidose wordt vermoed, moeten onmiddellijk algemene ondersteunende maatregelen worden genomen in een ziekenhuisomgeving, samen met onmiddellijke stopzetting van GLUCOPHAGE/GLUCOPHAGE 500 mg XR. Bij met GLUCOPHAGE/GLUCOPHAGE XR behandelde patiënten met een diagnose of een sterk vermoeden van lactaatacidose, wordt snelle hemodialyse aanbevolen om de acidose te corrigeren en opgehoopt metformine te verwijderen (metforminehydrochloride is dialyseerbaar met een klaring tot 170 ml/min onder goede hemodynamische omstandigheden). Hemodialyse heeft vaak geleid tot omkering van symptomen en herstel.
Informeer patiënten en hun families over de symptomen van lactaatacidose en, als deze symptomen optreden, instrueer hen om te stoppen met GLUCOPHAGE/GLUCOPHAGE 1000 mg XR en meld deze symptomen aan hun zorgverlener.
Voor elk van de bekende en mogelijke risicofactoren voor metformine-geassocieerde lactaatacidose worden hieronder aanbevelingen gegeven om het risico op en de behandeling van metformine-geassocieerde lactaatacidose te verminderen:
- Nierfunctiestoornis—De postmarketinggevallen van metformine-geassocieerde lactaatacidose traden voornamelijk op bij patiënten met een significante nierfunctiestoornis.
Het risico op accumulatie van metformine en metformine-geassocieerde lactaatacidose neemt toe met de ernst van de nierfunctiestoornis, omdat metformine grotendeels door de nieren wordt uitgescheiden. Klinische aanbevelingen op basis van de nierfunctie van de patiënt omvatten [zie: DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ]:
- Voordat u met GLUCOPHAGE/GLUCOPHAGE 850 mg XR begint, moet u een geschatte glomerulaire filtratiesnelheid (eGFR) verkrijgen.
- GLUCOPHAGE/GLUCOPHAGE XR is gecontra-indiceerd bij patiënten met een eGFR van minder dan 30 ml/min/1,73 m2 [zie CONTRA-INDICATIES ].
- Het starten van GLUCOPHAGE/GLUCOPHAGE XR wordt niet aanbevolen bij patiënten met een eGFR tussen 30-45 ml/min/1,73 m2.
- Verkrijg ten minste jaarlijks een eGFR bij alle patiënten die GLUCOPHAGE/GLUCOPHAGE 1000 mg XR gebruiken. Bij patiënten met een risico op het ontwikkelen van nierinsufficiëntie (bijv. ouderen), moet de nierfunctie vaker worden beoordeeld.
- Bij patiënten die GLUCOPHAGE/GLUCOPHAGE 500 mg XR gebruiken en bij wie de eGFR lager is dan 45 ml/min/1,73 m2, moet u de voordelen en het risico van voortzetting van de behandeling beoordelen.
- Geneesmiddelinteracties - Gelijktijdig gebruik van GLUCOPHAGE/GLUCOPHAGE XR met specifieke geneesmiddelen kan het risico op metformine-geassocieerde lactaatacidose verhogen: die welke de nierfunctie aantasten, resulteren in significante hemodynamische verandering, interfereren met de zuur-base balans, of de accumulatie van metformine verhogen. Overweeg frequentere monitoring van patiënten.
- Leeftijd 65 jaar of ouder - Het risico op metformine-geassocieerde lactaatacidose neemt toe met de leeftijd van de patiënt, omdat oudere patiënten een grotere kans hebben op lever-, nier- of hartfunctiestoornissen dan jongere patiënten. Beoordeel de nierfunctie vaker bij oudere patiënten.
- Radiologische onderzoeken met contrastmiddel — Toediening van intravasculaire jodiumhoudende contrastmiddelen bij metformine behandelde patiënten heeft geleid tot een acute afname van de nierfunctie en het optreden van lactaatacidose. Stop GLUCOPHAGE/GLUCOPHAGE XR op het moment van of voorafgaand aan een jodiumhoudende contrastbeeldvormingsprocedure bij patiënten met een eGFR tussen 30 en 60 ml/min/1,73 m2; bij patiënten met een voorgeschiedenis van leverinsufficiëntie, alcoholisme of hartfalen; of bij patiënten die intra-arterieel jodiumhoudend contrast krijgen toegediend. Evalueer de eGFR 48 uur na de beeldvormingsprocedure opnieuw en start GLUCOPHAGE/GLUCOPHAGE XR opnieuw als de nierfunctie stabiel is.
- Chirurgie en andere procedures - Het achterhouden van voedsel en vloeistoffen tijdens chirurgische of andere procedures kan het risico op volumedepletie, hypotensie en nierinsufficiëntie verhogen. GLUCOPHAGE/GLUCOPHAGE XR dient tijdelijk te worden gestaakt terwijl patiënten beperkte voedsel- en vochtinname hebben.
- Hypoxische toestanden - Een aantal van de postmarketinggevallen van metformine-geassocieerde lactaatacidose traden op in de setting van acuut congestief hartfalen (vooral in combinatie met hypoperfusie en hypoxemie). Cardiovasculaire collaps (shock), acuut myocardinfarct, sepsis en andere aandoeningen geassocieerd met hypoxemie zijn in verband gebracht met lactaatacidose en kunnen prerenale azotemie veroorzaken. Als een dergelijke gebeurtenis zich voordoet, stop dan met GLUCOPHAGE/GLUCOPHAGE 1000 mg XR.
- Overmatige alcoholinname - Alcohol versterkt het effect van metformine op het lactaatmetabolisme. Patiënten moeten worden gewaarschuwd voor overmatig alcoholgebruik tijdens het gebruik van GLUCOPHAGE/GLUCOPHAGE XR.
- Leverinsufficiëntie - Patiënten met leverinsufficiëntie hebben gevallen van metformine-geassocieerde lactaatacidose ontwikkeld. Dit kan te wijten zijn aan een verminderde lactaatklaring, wat resulteert in hogere lactaatbloedspiegels. Vermijd daarom het gebruik van GLUCOPHAGE/GLUCOPHAGE XR bij patiënten met klinische of laboratoriumgegevens van leverziekte.
Vitamine B12-tekort
In klinische onderzoeken met GLUCOPHAGE 1000 mg met een duur van 29 weken werd bij ongeveer 7% van de patiënten een daling tot subnormale spiegels van voorheen normale vitamine B12-serumspiegels waargenomen. Een dergelijke afname, mogelijk als gevolg van interferentie met de B12-absorptie door het B12-intrinsieke factorcomplex, kan in verband worden gebracht met bloedarmoede, maar lijkt snel omkeerbaar te zijn bij stopzetting van GLUCOPHAGE- of vitamine B12-suppletie. Bepaalde personen (die met onvoldoende vitamine B12- of calciuminname of -absorptie) lijken vatbaar te zijn voor het ontwikkelen van subnormale vitamine B12-spiegels. Meet hematologische parameters op jaarbasis en vitamine B12 met tussenpozen van 2 tot 3 jaar bij patiënten op GLUCOPHAGE/GLUCOPHAGE 500 mg XR en beheer eventuele afwijkingen [zie ONGEWENSTE REACTIES ].
Hypoglykemie bij gelijktijdig gebruik met insuline en insuline
Secretagogen
Van insuline en insulinesecretagogen (bijv. sulfonylureumderivaat) is bekend dat ze hypoglykemie veroorzaken. GLUCOPHAGE/GLUCOPHAGE XR kan het risico op hypoglykemie verhogen in combinatie met insuline en/of een insulinesecretagoog. Daarom kan een lagere dosis insuline of insulinesecretagoog nodig zijn om het risico op hypoglykemie te minimaliseren bij gebruik in combinatie met GLUCOPHAGE/GLUCOPHAGE XR (zie DRUG-INTERACTIES ].
Macrovasculaire resultaten
Er zijn geen klinische onderzoeken geweest die overtuigend bewijs van macrovasculaire risicovermindering met GLUCOPHAGE/GLUCOPHAGE 850 mg XR hebben aangetoond.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Melkzuuracidose
Leg de risico's van lactaatacidose uit, de symptomen en aandoeningen die vatbaar zijn voor de ontwikkeling ervan. Adviseer patiënten om onmiddellijk te stoppen met GLUCOPHAGE/GLUCOPHAGE XR en om hun zorgverlener onmiddellijk op de hoogte te stellen als onverklaarbare hyperventilatie, spierpijn, malaise, ongewone slaperigheid of andere niet-specifieke symptomen optreden. Adviseer patiënten tegen overmatige alcoholinname en informeer patiënten over het belang van regelmatig testen van de nierfunctie terwijl ze GLUCOPHAGE/GLUCOPHAGE XR krijgen. Instrueer patiënten om hun arts te informeren dat ze GLUCOPHAGE/GLUCOPHAGE 500 mg XR gebruiken voorafgaand aan een chirurgische of radiologische procedure, aangezien tijdelijke stopzetting noodzakelijk kan zijn [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hypoglykemie
Informeer patiënten dat hypoglykemie kan optreden wanneer GLUCOPHAGE/GLUCOPHAGE XR gelijktijdig wordt toegediend met orale sulfonylureumderivaten en insuline. Leg aan patiënten die gelijktijdige therapie krijgen de risico's van hypoglykemie uit, de symptomen en behandeling ervan, en aandoeningen die vatbaar zijn voor de ontwikkeling ervan [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Vitamine B12-tekort
Informeer patiënten over het belang van regelmatige hematologische parameters tijdens het ontvangen van GLUCOPHAGE / GLUCOPHAGE XR [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Vrouwtjes van reproductieve leeftijd
Informeer vrouwen dat behandeling met GLUCOPHAGE/GLUCOPHAGE XR kan leiden tot ovulatie bij sommige premenopauzale anovulatoire vrouwen, wat kan leiden tot onbedoelde zwangerschap [zie Gebruik bij specifieke populaties ].
Glucophage XR-toedieningsinformatie
Informeer patiënten dat GLUCOPHAGE 500 mg XR in zijn geheel moet worden doorgeslikt en niet mag worden fijngemaakt, gesneden of gekauwd, en dat de inactieve ingrediënten af en toe in de ontlasting kunnen worden geëlimineerd als een zachte massa die op de oorspronkelijke tablet kan lijken.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Langdurige carcinogeniteitsstudies zijn uitgevoerd bij ratten (doseringsduur van 104 weken) en muizen (doseringsduur van 91 weken) bij doses tot en met respectievelijk 900 mg/kg/dag en 1500 mg/kg/dag. Deze doses zijn beide ongeveer 3 keer de maximaal aanbevolen dagelijkse dosis voor mensen van 2550 mg op basis van vergelijkingen van het lichaamsoppervlak. Er werd geen bewijs van carcinogeniteit met metformine gevonden bij mannelijke of vrouwelijke muizen. Evenzo werd er geen tumorverwekkend potentieel waargenomen met metformine bij mannelijke ratten. Er was echter een verhoogde incidentie van goedaardige stromale baarmoederpoliepen bij vrouwelijke ratten die werden behandeld met 900 mg/kg/dag.
Er was geen bewijs van een mutageen potentieel van metformine in de volgende in-vitrotests: Ames-test (S. typhimurium), genmutatietest (muizenlymfoomcellen) of chromosomale aberratietest (menselijke lymfocyten). Resultaten in de in vivo micronucleustest bij muizen waren ook negatief.
De vruchtbaarheid van mannelijke of vrouwelijke ratten werd niet beïnvloed door metformine wanneer het werd toegediend in doses tot 600 mg/kg/dag, wat ongeveer 2 keer de maximaal aanbevolen dagelijkse dosis voor de mens van 2550 mg is op basis van vergelijkingen van het lichaamsoppervlak.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Beperkte gegevens over GLUCOPHAGE/GLUCOPHAGE XR bij zwangere vrouwen zijn niet voldoende om een geneesmiddelgerelateerd risico op ernstige geboorteafwijkingen of miskraam vast te stellen. Gepubliceerde onderzoeken met het gebruik van metformine tijdens de zwangerschap hebben geen duidelijke associatie met metformine en het risico op ernstige geboorteafwijkingen of miskramen gerapporteerd [zie Gegevens ]. Er zijn risico's voor de moeder en de foetus verbonden aan slecht gereguleerde diabetes mellitus tijdens de zwangerschap [zie: Klinische overwegingen ].
Er werden geen nadelige ontwikkelingseffecten waargenomen wanneer metformine werd toegediend aan zwangere Sprague Dawley-ratten en -konijnen tijdens de periode van organogenese in doses tot respectievelijk 2 en 5 keer een klinische dosis van 2550 mg, gebaseerd op het lichaamsoppervlak [zie Gegevens ].
Het geschatte achtergrondrisico op ernstige geboorteafwijkingen is 6-10% bij vrouwen met pre-zwangerschapsdiabetes mellitus met een HbA1C >7 en er is gemeld dat het zo hoog is als 20-25% bij vrouwen met een HbA1C >10. Het geschatte achtergrondrisico van een miskraam voor de aangegeven populatie is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Slecht gecontroleerde diabetes mellitus tijdens de zwangerschap verhoogt het maternale risico op diabetische ketoacidose, pre-eclampsie, spontane abortussen, vroeggeboorte, doodgeboorte en complicaties bij de bevalling. Slecht gecontroleerde diabetes mellitus verhoogt het foetale risico op ernstige geboorteafwijkingen, doodgeboorte en macrosomie-gerelateerde morbiditeit.
Gegevens
Menselijke gegevens
Gepubliceerde gegevens van postmarketingonderzoeken hebben geen duidelijk verband gemeld met metformine en ernstige geboorteafwijkingen, miskraam of nadelige maternale of foetale uitkomsten wanneer metformine tijdens de zwangerschap werd gebruikt. Deze onderzoeken kunnen echter niet met zekerheid de afwezigheid van enig metformine-geassocieerd risico vaststellen vanwege methodologische beperkingen, waaronder een kleine steekproefomvang en inconsistente vergelijkingsgroepen.
Dierlijke gegevens
Metforminehydrochloride had geen nadelige invloed op de ontwikkelingsresultaten bij toediening aan drachtige ratten en konijnen in doses tot 600 mg/kg/dag. Dit vertegenwoordigt een blootstelling van ongeveer 2 en 5 keer een klinische dosis van 2550 mg op basis van vergelijkingen van het lichaamsoppervlak voor respectievelijk ratten en konijnen. Bepaling van foetale concentraties toonde een gedeeltelijke placentaire barrière voor metformine aan.
Borstvoeding
Risico Samenvatting
Beperkte gepubliceerde onderzoeken melden dat metformine aanwezig is in moedermelk [zie Gegevens ]. Er is echter onvoldoende informatie om de effecten van metformine op de zuigeling die borstvoeding krijgt te bepalen en er is geen informatie beschikbaar over de effecten van metformine op de melkproductie. Daarom moeten de ontwikkelings- en gezondheidsvoordelen van borstvoeding worden overwogen, samen met de klinische behoefte van de moeder aan GLUCOPHAGE/GLUCOPHAGE 500 mg XR en eventuele nadelige effecten op het kind dat borstvoeding krijgt van GLUCOPHAGE/GLUCOPHAGE 850 mg XR of van de onderliggende maternale aandoening.
Gegevens
Gepubliceerde klinische lactatiestudies melden dat metformine aanwezig is in moedermelk, wat resulteerde in zuigelingendoses van ongeveer 0,11% tot 1% van de voor het gewicht van de moeder aangepaste dosering en een melk/plasmaverhouding tussen 0,13 en 1. De onderzoeken waren echter niet bedoeld om het risico van het gebruik van metformine tijdens borstvoeding zeker vaststellen vanwege de kleine steekproefomvang en de beperkte gegevens over bijwerkingen die bij zuigelingen zijn verzameld.
Vrouwtjes en mannetjes met reproductief potentieel
Bespreek de mogelijkheid van onbedoelde zwangerschap bij premenopauzale vrouwen, aangezien behandeling met GLUCOPHAGE/GLUCOPHAGE XR kan leiden tot ovulatie bij sommige anovulatoire vrouwen.
Pediatrisch gebruik
Glucofaag
De veiligheid en werkzaamheid van GLUCOPHAGE voor de behandeling van type 2 diabetes mellitus zijn vastgesteld bij pediatrische patiënten van 10 tot 16 jaar oud. De veiligheid en werkzaamheid van GLUCOPHAGE zijn niet vastgesteld bij pediatrische patiënten jonger dan 10 jaar.
Het gebruik van GLUCOPHAGE 850 mg bij pediatrische patiënten van 10 tot 16 jaar voor de behandeling van diabetes mellitus type 2 wordt ondersteund door gegevens uit adequate en goed gecontroleerde onderzoeken met GLUCOPHAGE bij volwassenen met aanvullende gegevens uit een gecontroleerd klinisch onderzoek bij pediatrische patiënten van 10 tot 16 jaar oud met diabetes mellitus type 2, die een vergelijkbare respons in glykemische controle vertoonde als die bij volwassenen [zie Klinische studies ]. In deze studie waren de bijwerkingen vergelijkbaar met die beschreven bij volwassenen. Een maximale dagelijkse dosis van 2000 mg GLUCOPHAGE 1000 mg wordt aanbevolen. [Zien DOSERING EN ADMINISTRATIE .]
Glucofaag 1000 mg XR
De veiligheid en werkzaamheid van GLUCOPHAGE XR bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Gecontroleerde klinische onderzoeken met GLUCOPHAGE/GLUCOPHAGE XR omvatten niet voldoende aantallen oudere patiënten om te bepalen of zij anders reageren dan jongere patiënten. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling en het hogere risico van lactaatacidose. Beoordeel de nierfunctie vaker bij oudere patiënten [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Nierfunctiestoornis
Metformine wordt grotendeels uitgescheiden door de nieren en het risico op accumulatie van metformine en lactaatacidose neemt toe met de mate van nierinsufficiëntie. GLUCOPHAGE/GLUCOPHAGE 850 mg XR is gecontra-indiceerd bij ernstige nierinsufficiëntie, patiënten met een geschatte glomerulaire filtratiesnelheid (eGFR) lager dan 30 ml/min/1,73 m2 [zie DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Het gebruik van metformine bij patiënten met een leverfunctiestoornis is in verband gebracht met enkele gevallen van lactaatacidose. GLUCOPHAGE/GLUCOPHAGE 500 mg XR wordt niet aanbevolen bij patiënten met leverinsufficiëntie. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].

OVERDOSERING
Overdosering van metforminehydrochloride is opgetreden, inclusief inname van hoeveelheden van meer dan 50 gram. Hypoglykemie werd in ongeveer 10% van de gevallen gemeld, maar er is geen causaal verband met metformine vastgesteld. Lactaatacidose is gemeld bij ongeveer 32% van de gevallen van overdosering met metformine [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Metformine is dialyseerbaar met een klaring tot 170 ml/min onder goede hemodynamische omstandigheden. Daarom kan hemodialyse nuttig zijn voor het verwijderen van opgehoopt geneesmiddel bij patiënten bij wie overdosering met metformine wordt vermoed.
CONTRA-INDICATIES
GLUCOPHAGE 1000 mg en GLUCOPHAGE 850 mg XR zijn gecontra-indiceerd bij patiënten met:
- Ernstige nierfunctiestoornis (eGFR lager dan 30 ml/min/1,73 m2) [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Overgevoeligheid voor metformine.
- Acute of chronische metabole acidose, inclusief diabetische ketoacidose, met of zonder coma.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Metformine is een antihyperglykemisch middel dat de glucosetolerantie verbetert bij patiënten met type 2 diabetes mellitus, door zowel basale als postprandiale plasmaglucose te verlagen. Metformine vermindert de glucoseproductie in de lever, vermindert de intestinale absorptie van glucose en verbetert de insulinegevoeligheid door de perifere opname en het gebruik van glucose te verhogen. Bij behandeling met metformine blijft de insulinesecretie onveranderd, terwijl nuchtere insulinespiegels en een daglange plasma-insulinerespons kunnen afnemen.
Farmacokinetiek
Absorptie
De absolute biologische beschikbaarheid van een GLUCOPHAGE 500 mg tablet gegeven in nuchtere toestand is ongeveer 50% tot 60%. Onderzoeken waarbij enkelvoudige orale doses GLUCOPHAGE 500 tot 1500 mg en 850 tot 2550 mg werden gebruikt, geven aan dat er een gebrek aan dosisproportionaliteit is bij toenemende doses, wat eerder te wijten is aan verminderde absorptie dan aan een verandering in eliminatie. Bij de gebruikelijke klinische doses en doseringsschema's van GLUCOPHAGE worden de steady-state plasmaconcentraties van metformine binnen 24 tot 48 uur bereikt en zijn over het algemeen
Na een enkele orale dosis GLUCOPHAGE 500 mg XR wordt de Cmax bereikt met een mediane waarde van 7 uur en een spreiding van 4 tot 8 uur. Piekplasmaspiegels zijn ongeveer 20% lager in vergelijking met dezelfde dosis GLUCOPHAGE 1000 mg, maar de mate van absorptie (zoals gemeten door AUC) is vergelijkbaar met die van GLUCOPHAGE.
Bij steady-state zijn de AUC en Cmax minder dan dosisproportioneel voor GLUCOPHAGE XR binnen het bereik van 500 tot 2000 mg eenmaal daags toegediend. Piekplasmaspiegels zijn ongeveer 0,6, 1,1, 1,4 en 1,8 mcg/ml voor respectievelijk 500, 1000, 1500 en 2000 mg eenmaal daagse doses. De mate van absorptie van metformine (zoals gemeten door AUC) van GLUCOPHAGE 500 mg XR bij een eenmaal daagse dosis van 2000 mg is vergelijkbaar met dezelfde totale dagelijkse dosis die wordt toegediend als GLUCOPHAGE 850 mg tabletten van 1000 mg tweemaal daags. Na herhaalde toediening van GLUCOPHAGE XR accumuleerde metformine niet in plasma.
Effect van voedsel:
Voedsel vermindert de mate van absorptie en vertraagt de absorptie van metformine enigszins, zoals blijkt uit een ongeveer 40% lagere gemiddelde piekplasmaconcentratie (Cmax), een 25% lagere oppervlakte onder de plasmaconcentratie versus tijdcurve (AUC) en een 35- minuten verlenging van de tijd tot piekplasmaconcentratie (Tmax) na toediening van een enkele 850 mg-tablet GLUCOPHAGE met voedsel, vergeleken met dezelfde tabletsterkte die nuchter wordt toegediend.
Hoewel de mate van absorptie van metformine (zoals gemeten door AUC) van de GLUCOPHAGE XR-tablet met ongeveer 50% toenam bij toediening met voedsel, was er geen effect van voedsel op de Cmax en Tmax van metformine. Zowel vetrijke als vetarme maaltijden hadden hetzelfde effect op de farmacokinetiek van GLUCOPHAGE XR.
Verdeling
Het schijnbare distributievolume (V/F) van metformine na enkelvoudige orale doses GLUCOPHAGE 850 mg was gemiddeld 654 ± 358 l. Metformine is verwaarloosbaar gebonden aan plasma-eiwitten. Metformine verdeelt zich in erytrocyten, hoogstwaarschijnlijk als functie van de tijd.
Metabolisme
Intraveneuze onderzoeken met enkelvoudige doses bij normale proefpersonen tonen aan dat metformine onveranderd in de urine wordt uitgescheiden en geen levermetabolisme ondergaat (er zijn geen metabolieten vastgesteld bij mensen) noch via de gal.
Eliminatie
De renale klaring (zie tabel 4) is ongeveer 3,5 keer groter dan de creatinineklaring, wat aangeeft dat tubulaire secretie de belangrijkste route is voor de eliminatie van metformine. Na orale toediening wordt ongeveer 90% van het geabsorbeerde geneesmiddel binnen de eerste 24 uur via de nieren geëlimineerd, met een plasma-eliminatiehalfwaardetijd van ongeveer 6,2 uur. In bloed is de eliminatiehalfwaardetijd ongeveer 17,6 uur, wat suggereert dat de erytrocytenmassa een distributiecompartiment kan zijn.
Specifieke populaties
Nierfunctiestoornis
Bij patiënten met een verminderde nierfunctie is de plasma- en bloedhalfwaardetijd van metformine verlengd en is de renale klaring verminderd (zie tabel 3) [Zie DOSERING EN ADMINISTRATIE , CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Leverfunctiestoornis
Er zijn geen farmacokinetische onderzoeken met metformine uitgevoerd bij patiënten met leverinsufficiëntie [Zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Geriatrie
Beperkte gegevens uit gecontroleerde farmacokinetische onderzoeken met GLUCOPHAGE 1000 mg bij gezonde oudere proefpersonen suggereren dat de totale plasmaklaring van metformine is afgenomen, de halfwaardetijd is verlengd en de Cmax is verhoogd in vergelijking met gezonde jonge proefpersonen. Het lijkt erop dat de verandering in de farmacokinetiek van metformine bij het ouder worden voornamelijk wordt verklaard door een verandering in de nierfunctie (zie tabel 4). [Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Kindergeneeskunde
Na toediening van een enkele orale GLUCOPHAGE 500 mg tablet met voedsel, verschilden de geometrische gemiddelde Cmax en AUC van metformine minder dan 5% tussen pediatrische type 2 diabetespatiënten (12-16 jaar) en gezonde volwassenen (20- 45 jaar), allen met een normale nierfunctie.
Geslacht
De farmacokinetische parameters van metformine verschilden niet significant tussen normale proefpersonen en patiënten met type 2 diabetes mellitus bij analyse naar geslacht (mannen=19, vrouwen=16).
Ras
Er zijn geen onderzoeken uitgevoerd naar de farmacokinetische parameters van metformine op basis van ras.
Geneesmiddelinteracties
In vivo beoordeling van geneesmiddelinteracties
Klinische studies
Glucofaag
Klinische studies bij volwassenen
Er werd een dubbelblind, placebogecontroleerd, multicenter klinisch onderzoek in de VS uitgevoerd met zwaarlijvige patiënten met type 2 diabetes mellitus bij wie de hyperglykemie niet voldoende onder controle kon worden gebracht met alleen dieetbehandeling (nuchtere plasmaglucose [FPG] van ongeveer 240 mg/dL) werd uitgevoerd. Patiënten werden gedurende 29 weken behandeld met GLUCOPHAGE (tot 2550 mg/dag) of placebo. De resultaten zijn weergegeven in tabel 7.
Het gemiddelde lichaamsgewicht bij baseline was respectievelijk 201 lbs en 206 lbs in de GLUCOPHAGE 850 mg- en placebo-armen. De gemiddelde verandering in lichaamsgewicht van baseline tot week 29 was -1,4 lbs en -2,4 lbs in respectievelijk de GLUCOPHAGE 1000 mg- en placebo-armen. Een 29 weken durende, dubbelblinde, placebogecontroleerde studie van GLUCOPHAGE en glyburide, alleen en in combinatie , werd uitgevoerd bij zwaarlijvige patiënten met type 2 diabetes mellitus die er niet in waren geslaagd een adequate glykemische controle te bereiken tijdens de maximale doses glyburide (FPG bij baseline van ongeveer 250 mg/dL). Patiënten gerandomiseerd naar de combinatie-arm begonnen met de behandeling met GLUCOPHAGE 500 mg en glyburide 20 mg. Aan het einde van elke week van de eerste 4 weken van het onderzoek werd bij deze patiënten de dosering van GLUCOPHAGE 500 mg verhoogd met 500 mg als ze er niet in waren geslaagd de beoogde nuchtere plasmaglucose te bereiken. Na week 4 werden dergelijke doseringsaanpassingen maandelijks gedaan, hoewel geen enkele patiënt GLUCOPHAGE 2500 mg mocht overschrijden. Patiënten in de arm met alleen GLUCOPHAGE (metformine plus placebo) stopten met glyburide en volgden hetzelfde titratieschema. Patiënten in de glyburide-arm gingen door met dezelfde dosis glyburide. Aan het einde van het onderzoek nam ongeveer 70% van de patiënten in de combinatiegroep GLUCOPHAGE 2000 mg/glyburide 20 mg of GLUCOPHAGE 2500 mg/glyburide 20 mg. De resultaten worden weergegeven in Tabel 8.
Het gemiddelde lichaamsgewicht bij baseline was respectievelijk 202 lbs, 203 lbs en 204 lbs in de GLUCOPHAGE/glyburide-, glyburide- en GLUCOPHAGE 500 mg-armen. De gemiddelde verandering in lichaamsgewicht van baseline tot week 29 was respectievelijk 0,9 lbs, -0,7 lbs en -8,4 lbs in de GLUCOPHAGE/glyburide-, glyburide- en GLUCOPHAGE 850 mg-armen.
Pediatrische klinische studies
Een dubbelblind, placebogecontroleerd onderzoek bij pediatrische patiënten van 10 tot 16 jaar met type 2 diabetes mellitus (gemiddelde FPG 182,2 mg/dl), behandeling met GLUCOPHAGE (tot 2000 mg/dag) gedurende maximaal 16 weken (gemiddelde duur behandeling 11 weken) werd uitgevoerd. De resultaten worden weergegeven in Tabel 9.
Het gemiddelde lichaamsgewicht bij baseline was respectievelijk 205 lbs en 189 lbs in de GLUCOPHAGE 850 mg- en placebo-armen. De gemiddelde verandering in lichaamsgewicht van baseline tot week 16 was respectievelijk -3,3 lbs en -2,0 lbs in de GLUCOPHAGE 500 mg- en placebo-armen.
Glucofaag XR
Een 24 weken durende, dubbelblinde, placebogecontroleerde studie van GLUCOPHAGE 1000 mg XR, eenmaal daags ingenomen bij de avondmaaltijd, werd uitgevoerd bij patiënten met type 2 diabetes mellitus die er niet in waren geslaagd de glykemische controle te bereiken met dieet en lichaamsbeweging. Patiënten die deelnamen aan het onderzoek hadden een gemiddelde baseline HbA1c van 8,0% en een gemiddelde baseline FPG van 176 mg/dL. De behandelingsdosis werd verhoogd tot 1500 mg eenmaal daags als in week 12 HbA1c ≥7,0% maar
Een 16 weken durende, dubbelblinde, placebogecontroleerde, dosis-responsstudie van GLUCOPHAGE 500 mg XR, eenmaal daags ingenomen bij de avondmaaltijd of tweemaal daags bij de maaltijd, werd uitgevoerd bij patiënten met type 2 diabetes mellitus die geen glykemische controle met dieet en lichaamsbeweging. De resultaten worden getoond in Tabel 10.
Het gemiddelde lichaamsgewicht bij baseline was 193 lbs, 192 lbs, 188 lbs, 196 lbs, 193 lbs en 194 lbs in respectievelijk de GLUCOPHAGE XR 500 mg, 1000 mg, 1500 mg en 2000 mg eenmaal daags, 1000 mg tweemaal daags en placebo-armen . De gemiddelde verandering in lichaamsgewicht van baseline tot week 16 was respectievelijk -1,3 lbs, -1,3 lbs, -0,7 lbs, -1,5 lbs, -2,2 lbs en -1,8 lbs.
Een dubbelblind, gerandomiseerd onderzoek van 24 weken van GLUCOPHAGE XR, eenmaal daags ingenomen bij de avondmaaltijd, en GLUCOPHAGE 500 mg, tweemaal daags ingenomen (bij het ontbijt en het avondeten), werd uitgevoerd bij patiënten met type 2 diabetes mellitus die waren behandeld met GLUCOPHAGE 500 mg tweemaal daags gedurende ten minste 8 weken voor aanvang van de studie. De resultaten worden getoond in Tabel 11.
Het gemiddelde lichaamsgewicht bij baseline was respectievelijk 210 lbs, 203 lbs en 193 lbs in de armen GLUCOPHAGE 500 mg tweemaal daags en GLUCOPHAGE XR 1000 mg en 1500 mg eenmaal daags. De gemiddelde verandering in lichaamsgewicht vanaf baseline tot week 24 was respectievelijk 0,9 lbs, 1,1 lbs en 0,9 lbs.
PATIËNT INFORMATIE
GLUCOFAGE® [gloo-ko-fahzh] (metforminehydrochloride) Tabletten
en
GLUCOPHAGE® XR [gloo-ko-fahzh XR] (metforminehydrochloride) tabletten met verlengde afgifte
Lees de patiënteninformatie die bij GLUCOPHAGE en GLUCOPHAGE 1000 mg XR wordt geleverd voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze bijsluiter vervangt niet het praten met uw zorgverlener over uw medische toestand of behandeling.
Wat is de belangrijkste informatie die ik moet weten over GLUCOPHAGE 1000 mg en GLUCOPHAGE 500 mg XR?
Ernstige bijwerkingen kunnen optreden bij mensen die GLUCOPHAGE of GLUCOPHAGE 1000 mg XR gebruiken, waaronder:
Melkzuuracidose. Metforminehydrochloride, het geneesmiddel in GLUCOPHAGE 500 mg en GLUCOPHAGE XR, kan een zeldzame, maar ernstige bijwerking veroorzaken, lactaatacidose genaamd (ophoping van melkzuur in het bloed), die de dood kan veroorzaken. Lactaatacidose is een medisch noodgeval en moet in een ziekenhuis worden behandeld.
Stop met het innemen van GLUCOPHAGE of GLUCOPHAGE 500 mg XR en bel onmiddellijk uw zorgverlener als u een van de volgende symptomen van lactaatacidose krijgt:
- voel me erg zwak en moe
- ongewone (niet-normale) spierpijn heeft
- moeite hebben met ademhalen
- ongewone slaperigheid hebben of langer slapen dan normaal
- onverklaarbare maag- of darmproblemen heeft met misselijkheid en braken, of diarree
- het koud hebben, vooral in je armen en benen
- duizelig of licht in het hoofd voelen
- een langzame of onregelmatige hartslag hebben
U heeft een grotere kans op het krijgen van lactaatacidose als u:
- nierproblemen hebben. Mensen van wie de nieren niet goed werken, mogen GLUCOPHAGE 850 mg OF GLUCOPHAGE XR niet gebruiken.
- leverproblemen hebben.
- congestief hartfalen heeft waarvoor behandeling met medicijnen nodig is.
- veel alcohol drinken (heel vaak of kortdurend "binge" drinken).
- uitgedroogd raken (een grote hoeveelheid lichaamsvloeistoffen verliezen). Dit kan gebeuren als u koorts heeft, moet braken of diarree heeft. Uitdroging kan ook optreden als u veel zweet bij activiteit of lichaamsbeweging en niet genoeg drinkt.
- bepaalde röntgenonderzoeken ondergaan met injecteerbare kleurstoffen of contrastmiddelen.
- operatie ondergaan.
- een hartaanval, ernstige infectie of beroerte heeft.
- 80 jaar of ouder bent en uw nierfunctie niet is getest.
Wat zijn GLUCOPHAGE en GLUCOPHAGE 1000 mg XR?
- GLUCOPHAGE en GLUCOPHAGE XR zijn geneesmiddelen op recept die metforminehydrochloride bevatten. GLUCOPHAGE 500 mg en GLUCOPHAGE 1000 mg XR worden gebruikt in combinatie met een dieet en lichaamsbeweging om een hoge bloedsuikerspiegel (hyperglykemie) onder controle te houden bij volwassenen met type 2-diabetes.
- GLUCOPHAGE 850 mg en GLUCOPHAGE 500 mg XR zijn niet voor mensen met type 1 diabetes.
- GLUCOPHAGE 850 mg en GLUCOPHAGE 500 mg XR zijn niet voor mensen met diabetische ketoacidose (verhoogde ketonen in uw bloed of urine).
GLUCOPHAGE 850 mg en GLUCOPHAGE 1000 mg XR hebben dezelfde werkzame stof. GLUCOPHAGE XR werkt echter langer in uw lichaam. Beide geneesmiddelen helpen uw bloedsuikerspiegel op een aantal manieren onder controle te houden. Deze omvatten het helpen van uw lichaam om beter te reageren op de insuline die het van nature aanmaakt, het verminderen van de hoeveelheid suiker die uw lever maakt en het verminderen van de hoeveelheid suiker die uw darmen opnemen. GLUCOPHAGE 1000 mg en GLUCOPHAGE 850 mg XR zorgen er niet voor dat uw lichaam meer insuline aanmaakt.
Wie mag GLUCOPHAGE of GLUCOPHAGE 850 mg XR niet gebruiken?
Sommige aandoeningen vergroten uw kans op het krijgen van lactaatacidose of veroorzaken andere problemen als u een van deze geneesmiddelen gebruikt. De meeste van de onderstaande aandoeningen kunnen uw kans op het krijgen van lactaatacidose vergroten.
Gebruik GLUCOPHAGE 1000 mg of GLUCOPHAGE 500 mg XR niet als u:
- nierproblemen hebben
- allergisch bent voor het metforminehydrochloride in GLUCOPHAGE of GLUCOPHAGE 850 mg XR of voor één van de ingrediënten in GLUCOPHAGE of GLUCOPHAGE XR. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in GLUCOPHAGE en GLUCOPHAGE XR.
- een injectie met kleurstof of contrastmiddelen krijgt voor een röntgenonderzoek of als u een operatie moet ondergaan en niet veel kunt eten of drinken. In deze situaties moet GLUCOPHAGE 1000 mg of GLUCOPHAGE XR voor een korte tijd worden stopgezet. Praat met uw zorgverlener over wanneer u moet stoppen met GLUCOPHAGE 850 mg of GLUCOPHAGE 850 mg XR en wanneer u opnieuw moet beginnen met GLUCOPHAGE of GLUCOPHAGE XR. Zien "Wat is de belangrijkste informatie die ik moet weten over GLUCOPHAGE of GLUCOPHAGE XR?"
Wat moet ik mijn zorgverlener vertellen voordat ik GLUCOPHAGE of GLUCOPHAGE 1000 mg XR inneem?
Vertel uw zorgverlener voordat u GLUCOPHAGE 500 mg of GLUCOPHAGE XR inneemt als u:
- diabetes type 1 hebben. GLUCOPHAGE 850 mg of GLUCOPHAGE 500 mg XR mogen niet worden gebruikt voor de behandeling van mensen met type 1-diabetes.
- een voorgeschiedenis of risico heeft op diabetische ketoacidose (hoge concentraties van bepaalde zuren, bekend als ketonen, in het bloed of de urine). GLUCOPHAGE 1000 mg of GLUCOPHAGE XR mogen niet worden gebruikt voor de behandeling van diabetische ketoacidose.
- nierproblemen hebben.
- leverproblemen hebben.
- hartproblemen heeft, waaronder congestief hartfalen.
- zijn ouder dan 80 jaar. Als u ouder bent dan 80 jaar, mag u GLUCOPHAGE 1000 mg of GLUCOPHAGE XR niet gebruiken tenzij uw nieren zijn gecontroleerd en deze normaal zijn.
- drink heel vaak alcohol, of drink veel alcohol bij kortdurend "binge" drinken.
- nemen insuline.
- andere medische aandoeningen heeft.
- zwanger bent of van plan bent zwanger te worden. Het is niet bekend of GLUCOPHAGE of GLUCOPHAGE 850 mg XR schadelijk is voor uw ongeboren baby. Als u zwanger bent, overleg dan met uw zorgverlener over de beste manier om uw bloedsuikerspiegel onder controle te houden terwijl u zwanger bent.
- borstvoeding geeft of van plan bent borstvoeding te geven. Het is niet bekend of GLUCOPHAGE 850 mg of GLUCOPHAGE XR in uw moedermelk terechtkomt. Praat met uw zorgverlener over de beste manier om uw baby te voeden terwijl u GLUCOPHAGE 500 mg of GLUCOPHAGE 500 mg XR gebruikt.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, waaronder geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. Weet welke medicijnen u gebruikt. Houd er een lijst van bij om uw zorgverlener en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
- GLUCOPHAGE of GLUCOPHAGE XR kan de werking van andere geneesmiddelen beïnvloeden, en andere geneesmiddelen kunnen de werking van GLUCOPHAGE of GLUCOPHAGE XR beïnvloeden.
Kan GLUCOPHAGE of GLUCOPHAGE 500 mg XR bij kinderen worden gebruikt?
Van GLUCOPHAGE 1000 mg is aangetoond dat het de glucosespiegels effectief verlaagt bij kinderen (leeftijd 10-16 jaar) met type 2-diabetes. GLUCOPHAGE 1000 mg is niet onderzocht bij kinderen jonger dan 10 jaar. GLUCOPHAGE 500 mg is niet onderzocht in combinatie met andere orale glucoseregulerende geneesmiddelen of insuline bij kinderen. Als u vragen heeft over het gebruik van GLUCOPHAGE 1000 mg bij kinderen, neem dan contact op met uw arts of andere zorgverlener.
GLUCOPHAGE XR is niet onderzocht bij kinderen.
Hoe moet ik GLUCOPHAGE of GLUCOPHAGE XR innemen?
- Neem GLUCOPHAGE 850 mg of GLUCOPHAGE 850 mg XR precies in zoals uw zorgverlener u dat heeft verteld.
- GLUCOPHAGE of GLUCOPHAGE 850 mg XR moet bij de maaltijd worden ingenomen om maagklachten te helpen verminderen.
- Slik GLUCOPHAGE of GLUCOPHAGE 500 mg XR heel door. GLUCOPHAGE 1000 mg XR niet pletten, snijden of kauwen.
- kunt soms een zachte massa in uw ontlasting krijgen (stoelgang) die lijkt op GLUCOPHAGE 850 mg of GLUCOPHAGE XR-tabletten. Dit is niet schadelijk en heeft geen invloed op de manier waarop GLUCOPHAGE 850 mg XR werkt om uw diabetes onder controle te houden.
- Wanneer uw lichaam onder bepaalde soorten stress staat, zoals koorts, trauma (zoals een auto-ongeluk), infectie of operatie, kan de hoeveelheid diabetesmedicatie die u nodig heeft veranderen. Vertel het uw zorgverlener meteen als u een van deze problemen heeft.
- Uw zorgverlener moet bloedonderzoek doen om te controleren hoe goed uw nieren werken voor en tijdens uw behandeling met GLUCOPHAGE 1000 mg of GLUCOPHAGE 500 mg XR.
- Uw zorgverlener zal uw diabetes controleren met regelmatige bloedtesten, inclusief uw bloedsuikerspiegels en uw hemoglobine A1C.
- Volg de instructies van uw zorgverlener voor de behandeling van een te lage bloedsuikerspiegel (hypoglykemie). Neem contact op met uw zorgverlener als een lage bloedsuikerspiegel een probleem voor u is. Zien "Wat zijn de mogelijke bijwerkingen van GLUCOPHAGE of GLUCOPHAGE XR?"
- Controleer uw bloedsuikerspiegel zoals uw zorgverlener u dat vertelt.
- Blijf op uw voorgeschreven dieet en trainingsprogramma terwijl u GLUCOPHAGE 850 mg of GLUCOPHAGE 850 mg XR gebruikt.
- Als u een dosis GLUCOPHAGE 1000 mg of GLUCOPHAGE 850 mg XR heeft overgeslagen, neem dan uw volgende dosis zoals voorgeschreven, tenzij uw zorgverlener u anders vertelt. Neem de volgende dag geen extra dosis.
- Als u te veel GLUCOPHAGE 500 mg of GLUCOPHAGE 500 mg XR heeft ingenomen, neem dan contact op met uw zorgverlener, het plaatselijke Antigifcentrum of ga onmiddellijk naar de eerste hulpafdeling van het dichtstbijzijnde ziekenhuis.
Wat moet ik vermijden tijdens het gebruik van GLUCOPHAGE of GLUCOPHAGE 1000 mg XR?
Drink niet veel alcoholische dranken terwijl u GLUCOPHAGE of GLUCOPHAGE XR gebruikt. Dit betekent dat je niet voor korte periodes moet bingedrinken en dat je niet regelmatig veel alcohol moet drinken. Alcohol kan de kans op het krijgen van lactaatacidose vergroten.
Wat zijn de bijwerkingen van GLUCOPHAGE en GLUCOPHAGE XR?
- Lactaatacidose. Metformine, het actieve ingrediënt in GLUCOPHAGE 1000 mg en GLUCOPHAGE 500 mg XR, kan een zeldzame maar ernstige aandoening veroorzaken, lactaatacidose genaamd (een ophoping van een zuur in het bloed), die de dood kan veroorzaken. Lactaatacidose is een medisch noodgeval en moet in het ziekenhuis worden behandeld.
Bel onmiddellijk uw arts als u een van de volgende symptomen heeft, die tekenen kunnen zijn van lactaatacidose:
- je het koud hebt in je handen of voeten
- u zich duizelig of licht in het hoofd voelt
- u een langzame of onregelmatige hartslag heeft
- je voelt je erg zwak of moe
- je hebt moeite met ademhalen
- je voelt je slaperig of slaperig
- u maagpijn, misselijkheid of braken heeft
De meeste mensen die lactaatacidose hebben gehad met metformine, hebben andere dingen die, in combinatie met metformine, hebben geleid tot lactaatacidose. Vertel het uw arts als u een van de volgende aandoeningen heeft, omdat u een grotere kans heeft om lactaatacidose te krijgen met GLUCOPHAGE 850 mg of GLUCOPHAGE 500 mg XR als u:
- ernstige nierproblemen heeft, of uw nieren zijn aangetast door bepaalde röntgenonderzoeken waarbij injecteerbare kleurstof wordt gebruikt
- leverproblemen hebben
- drink heel vaak alcohol, of drink veel alcohol tijdens kortdurend "binge" drinken
- uitgedroogd raken (een grote hoeveelheid lichaamsvloeistoffen verliezen). Dit kan gebeuren als u koorts heeft, moet braken of diarree heeft. Uitdroging kan ook optreden als u veel zweet bij activiteit of lichaamsbeweging en niet genoeg drinkt
- operatie ondergaan
- een hartaanval, ernstige infectie of beroerte heeft
Vaak voorkomende bijwerkingen van GLUCOPHAGE 500 mg en GLUCOPHAGE 1000 mg XR zijn diarree, misselijkheid en maagklachten. Deze bijwerkingen verdwijnen over het algemeen nadat u het geneesmiddel een tijdje heeft ingenomen. Het innemen van uw geneesmiddel bij de maaltijd kan deze bijwerkingen helpen verminderen. Vertel het uw arts als u veel last heeft van de bijwerkingen, langer dan een paar weken aanhoudt, terugkomt nadat ze zijn verdwenen of later in de therapie begint. Het kan zijn dat u een lagere dosis nodig heeft of dat u voor een korte periode of voorgoed moet stoppen met het gebruik van het geneesmiddel.
Ongeveer 3 op de 100 mensen die GLUCOPHAGE of GLUCOPHAGE 1000 mg XR gebruiken, hebben een onaangename metaalsmaak wanneer ze het geneesmiddel beginnen in te nemen. Het duurt een korte tijd.
GLUCOPHAGE 850 mg en GLUCOPHAGE 500 mg XR veroorzaken zelf zelden hypoglykemie (lage bloedsuikerspiegel). Hypoglykemie kan echter optreden als u niet genoeg eet, als u alcohol drinkt of als u andere geneesmiddelen gebruikt om de bloedsuikerspiegel te verlagen.
Hoe moet ik GLUCOPHAGE 500 mg en GLUCOPHAGE XR bewaren?
Bewaar GLUCOPHAGE en GLUCOPHAGE 850 mg XR bij 20 ° C tot 25 ° C (68 ° F tot 77 ° F).
Houd GLUCOPHAGE 850 mg en GLUCOPHAGE 500 mg XR en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het gebruik van GLUCOPHAGE 850 mg en GLUCOPHAGE 850 mg XR
Als u vragen of problemen heeft, neem dan contact op met uw arts of andere zorgverlener. U kunt uw arts of apotheker om informatie vragen over GLUCOPHAGE 850 mg en GLUCOPHAGE 500 mg XR die is geschreven voor beroepsbeoefenaren in de gezondheidszorg. Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in de bijsluiter. Gebruik GLUCOPHAGE 1000 mg of GLUCOPHAGE 1000 mg XR niet voor een aandoening waarvoor het niet is voorgeschreven. Deel uw geneesmiddel niet met andere mensen.
Wat zijn de ingrediënten van GLUCOPHAGE en GLUCOPHAGE 500 mg XR?
Actieve ingrediënten van GLUCOPHAGE: metforminehydrochloride.
Inactieve ingrediënten in elke tablet van GLUCOPHAGE: povidon en magnesiumstearaat. Daarnaast bevat de coating voor de 500 mg en 850 mg tabletten hypromellose en de coating voor de 1000 mg tablet hypromellose en polyethyleenglycol.
Actieve ingrediënten van GLUCOPHAGE 1000 mg XR: metforminehydrochloride.
Inactieve ingrediënten in elke tablet van GLUCOPHAGE 1000 mg XR 500 mg: natriumcarboxymethylcellulose, hypromellose, microkristallijne cellulose en magnesiumstearaat.
Inactieve ingrediënten in elke tablet van GLUCOPHAGE XR 750 mg: natriumcarboxymethylcellulose, hypromellose en magnesiumstearaat.
Wat is diabetes type 2?
Type 2-diabetes is een aandoening waarbij uw lichaam niet genoeg insuline aanmaakt en de insuline die uw lichaam aanmaakt niet zo goed werkt als zou moeten. Je lichaam kan ook te veel suiker maken. Wanneer dit gebeurt, hoopt zich suiker (glucose) op in het bloed. Dit kan leiden tot ernstige medische problemen.
Het belangrijkste doel van de behandeling van diabetes is om uw bloedsuikerspiegel tot een normaal niveau te verlagen.
Een hoge bloedsuikerspiegel kan worden verlaagd door een dieet en lichaamsbeweging, en indien nodig door bepaalde medicijnen.
Praat met uw zorgverlener over het voorkomen, herkennen en behandelen van een lage bloedsuikerspiegel (hypoglykemie), een hoge bloedsuikerspiegel (hyperglykemie) en problemen die u heeft vanwege uw diabetes.
