Zofran 4mg, 8mg Ondansetron Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zofran en hoe wordt het gebruikt?
Zofran 4 mg is een receptgeneesmiddel dat wordt gebruikt als profylaxe en voor de behandeling van symptomen van misselijkheid en braken als gevolg van bepaalde medicijnen of postoperatief. Zofran 8 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Zofran behoort tot een klasse geneesmiddelen die anti-emetica, selectieve 5-HT3-antagonist, wordt genoemd.
Het is niet bekend of Zofran 4 mg veilig en effectief is bij kinderen jonger dan 1 maand.
Wat zijn de mogelijke bijwerkingen van Zofran?
Zofran kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige constipatie,
- buikpijn,
- opgeblazen gevoel,
- hoofdpijn met pijn op de borst en ernstige duizeligheid,
- flauwvallen,
- snelle of bonzende hartslagen,
- geel worden van de huid of ogen (geelzucht)
- wazig zien,
- tijdelijk verlies van gezichtsvermogen,
- agitatie,
- hallucinaties,
- koorts,
- snelle hartslag,
- overactieve reflexen,
- misselijkheid,
- braken,
- diarree,
- verlies van coördinatie, en
- flauwvallen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zofran zijn:
- diarree,
- constipatie,
- slaperigheid, en
- vermoeid gevoel
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zofran. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
Het werkzame bestanddeel in ZOFRAN 4 mg tabletten en ZOFRAN drank is ondansetronhydrochloride als dihydraat, de racemische vorm van ondansetron en een selectieve blokker van het serotonine 5-HT3-receptortype. Chemisch is het (±) 1, 2, 3, 9-tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-carbazol-4-on, monohydrochloride, dihydraat . Het heeft de volgende structuurformule:
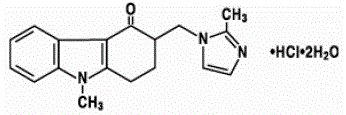
De empirische formule is C18H19N3O·HCl·2H2O, wat een molecuulgewicht van 365,9 vertegenwoordigt.
Ondansetronhydrochloridedihydraat is een wit tot gebroken wit poeder dat oplosbaar is in water en een normale zoutoplossing.
Het werkzame bestanddeel van ZOFRAN 4 mg ODT oraal uiteenvallende tabletten is ondansetron-base, de racemische vorm van ondansetron en een selectieve blokker van het serotonine 5-HT3-receptortype. Chemisch gezien is het (±) 1, 2, 3, 9tetrahydro-9-methyl-3-[(2-methyl-1H-imidazol-1-yl)methyl]-4H-carbazol-4-on. Het heeft de volgende structuurformule:
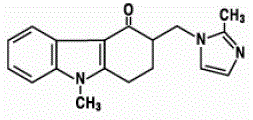
De empirische formule is C18H19N3O, wat een molecuulgewicht van 293,4 vertegenwoordigt.
Elke tablet van 4 mg ZOFRAN 8 mg voor orale toediening bevat ondansetronhydrochloridedihydraat overeenkomend met 4 mg ondansetron. Elke 8 mg ZOFRAN 8 mg tablet voor orale toediening bevat ondansetronhydrochloridedihydraat overeenkomend met 8 mg ondansetron. Elke tablet bevat ook de inactieve ingrediënten hypromellose, geel ijzeroxide (alleen 8 mg tablet), lactose, magnesiumstearaat, microkristallijne cellulose, gepregelatiniseerd zetmeel, triacetine en titaniumdioxide.
Elke oraal desintegrerende tablet van 4 mg ZOFRAN 8 mg ODT voor orale toediening bevat 4 mg ondansetronbase. Elke oraal desintegrerende tablet van 8 mg ZOFRAN 4 mg ODT voor orale toediening bevat 8 mg ondansetronbase. Elke ZOFRAN ODT-tablet bevat ook de inactieve ingrediënten aspartaam, gelatine, mannitol, methylparaben-natrium, propylparaben-natrium en aardbeiensmaak. ZOFRAN ODT-tabletten zijn een gevriesdroogde, oraal toegediende formulering van ondansetron die uiteenvalt op de tong en geen water nodig heeft om het oplossen of doorslikken te vergemakkelijken.
Elke 5 ml ZOFRAN drank bevat 5 mg ondansetronhydrochloridedihydraat overeenkomend met 4 mg ondansetron. ZOFRAN 8 mg drank bevat de inactieve ingrediënten watervrij citroenzuur, gezuiverd water, natriumbenzoaat, natriumcitraat, sorbitol en aardbeiensmaak.
INDICATIES
ZOFRAN is geïndiceerd voor de preventie van misselijkheid en braken geassocieerd met:
- zeer emetogene kankerchemotherapie, inclusief cisplatine groter dan of gelijk aan 50 mg/m²
- initiële en herhalingskuren van matig emetogene kankerchemotherapie
- radiotherapie bij patiënten die ofwel totale lichaamsbestraling, een enkelvoudige hoge dosisfractie naar de buik of dagelijkse fracties naar de buik krijgen
ZOFRAN is ook geïndiceerd voor de preventie van postoperatieve misselijkheid en/of braken.
DOSERING EN ADMINISTRATIE
Dosering
De aanbevolen doseringsschema's voor volwassen en pediatrische patiënten worden respectievelijk beschreven in Tabel 1 en Tabel 2. Overeenkomstige doses ZOFRAN tabletten, ZOFRAN ODT® oraal uiteenvallende tabletten en ZOFRAN drank kunnen onderling uitwisselbaar worden gebruikt.
Dosering bij leverinsufficiëntie
Bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh-score van 10 of hoger), mag de totale dagelijkse dosis van 8 mg niet worden overschreden (zie Gebruik bij specifieke populaties , KLINISCHE FARMACOLOGIE ].
Toedieningsinstructies voor ZOFRAN ODT oraal uiteenvallende tabletten
Probeer niet om ZOFRAN ODT oraal desintegrerende tabletten door de folierug te duwen. Met droge handen, SCHIL TERUG de folie achterkant van 1 blister en verwijder de tablet VOORZICHTIG. Plaats ONMIDDELLIJK de oraal desintegrerende tablet ZOFRAN 4 mg ODT bovenop de tong waar het in enkele seconden zal oplossen, en slik het dan door met speeksel. Toediening met vloeistof is niet nodig.
HOE GELEVERD
Doseringsvormen en sterke punten
ZOFRAN-tabletten zijn ovale, filmomhulde tabletten met aan één kant de inscriptie “Zofran” en zijn verkrijgbaar in de volgende sterktes:
- 4 mg - witte tablet met “4” gegraveerd aan de andere kant.
- 8 mg - gele tablet met “8” gegraveerd aan de andere kant.
ZOFRAN ODT oraal uiteenvallende tabletten zijn witte, ronde en platbolle tabletten verkrijgbaar in de volgende sterktes:
- 4 mg - aan één kant gegraveerd met "Z4".
- 8 mg - aan één kant gegraveerd met "Z8".
ZOFRAN 4 mg drank 4 mg/5 ml, is een heldere, kleurloze tot lichtgele vloeistof met een karakteristieke aardbeiengeur, verkrijgbaar in een fles van 50 ml.
Opslag en behandeling
ZOFRAN-tabletten
4 mg (ondansetronhydrochloridedihydraat overeenkomend met 4 mg ondansetron), zijn witte, ovale, filmomhulde tabletten met de inscriptie “Zofran” aan de ene kant en “4” aan de andere in flessen van 30 tabletten ( NDC 0078-0675-15 ).
Bewaren tussen 2 ° C en 30 ° C (36 ° F en 86 ° F). Bescherm tegen licht. Doseer in een strakke, lichtbestendige container zoals gedefinieerd in de USP.
8 mg (ondansetronhydrochloridedihydraat overeenkomend met 8 mg ondansetron), zijn gele, ovale, filmomhulde tabletten met de inscriptie “Zofran” aan de ene kant en “8” aan de andere in flessen van 30 tabletten ( NDC 0078-0676-15 ).
Bewaren tussen 2 ° C en 30 ° C (36 ° F en 86 ° F). Bescherm tegen licht. Doseer in een strakke, lichtbestendige container zoals gedefinieerd in de USP.
ZOFRAN 8 mg ODT oraal uiteenvallende tabletten
4 mg (als 4 mg ondansetron-base) zijn witte, ronde en platbolle tabletten met aan één kant de inscriptie “Z4” in eenheidsdosisverpakkingen van 30 tabletten (NDC 0078-0679-19).
mg (als 8 mg ondansetron-base) zijn witte, ronde en platbolle tabletten met aan één kant de inscriptie “Z8” in eenheidsdosisverpakkingen van 30 tabletten ( NDC 0078-0680-19).
Bewaren tussen 2 ° C en 30 ° C (36 ° F en 86 ° F).
ZOFRAN 4 mg orale oplossing
een heldere, kleurloze tot lichtgele vloeistof met een karakteristieke aardbeiengeur, bevat 5 mg ondansetronhydrochloridedihydraat overeenkomend met 4 mg ondansetron per 5 ml in amberkleurige glazen flessen van 50 ml met kindveilige sluitingen ( NDC 0078-0677-22) .
Rechtop bewaren tussen 15°C en 30°C (59°F en 86°F). Bescherm tegen licht. Bewaar flessen rechtop in kartonnen dozen.
Gedistribueerd door: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Herzien: april 2021
BIJWERKINGEN
De volgende klinisch significante bijwerkingen worden elders in de etikettering beschreven:
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- QT-verlenging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- serotoninesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Maskering van progressieve ileus en maagzwelling [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De volgende bijwerkingen zijn gemeld in klinische onderzoeken bij patiënten die werden behandeld met ondansetron, het werkzame bestanddeel van ZOFRAN. Een causaal verband met therapie met ZOFRAN was in veel gevallen onduidelijk.
Preventie van door chemotherapie veroorzaakte misselijkheid en braken
De meest voorkomende bijwerkingen gemeld bij meer dan of gelijk aan 4% van de 300 volwassenen die een enkelvoudige dosis van 24 mg ZOFRAN 4 mg oraal kregen in 2 onderzoeken ter preventie van misselijkheid en braken geassocieerd met zeer emetogene chemotherapie (cisplatine groter dan of gelijk aan 50 mg /m²) waren: hoofdpijn (11%) en diarree (4%).
De meest voorkomende bijwerkingen die zijn gemeld in 4 onderzoeken bij volwassenen voor de preventie van misselijkheid en braken in verband met matig emetogene chemotherapie (voornamelijk op cyclofosfamide gebaseerde regimes) worden weergegeven in tabel 3.
Minder vaak voorkomende bijwerkingen
Centraal zenuwstelsel
Extrapiramidale reacties (minder dan 1% van de patiënten).
lever
De waarden voor aspartaattransaminase (ASAT) en/of alaninetransaminase (ALAT) overschreden tweemaal de bovengrens van normaal bij ongeveer 1% tot 2% van de 723 patiënten die ZOFRAN 8 mg en op cyclofosfamide gebaseerde chemotherapie kregen in klinische onderzoeken in de VS. De verhogingen waren van voorbijgaande aard en leken niet gerelateerd te zijn aan de dosis of de duur van de therapie. Bij herhaalde blootstelling traden in sommige kuren vergelijkbare tijdelijke verhogingen van de transaminasewaarden op, maar symptomatische leverziekte trad niet op. De rol van kankerchemotherapie in deze biochemische veranderingen is onduidelijk.
Leverfalen en overlijden zijn gemeld bij kankerpatiënten die gelijktijdig medicatie kregen, waaronder mogelijk hepatotoxische cytotoxische chemotherapie en antibiotica. De etiologie van leverfalen is onduidelijk.
integumentair
Huiduitslag (ongeveer 1% van de patiënten).
Overige (minder dan 2%)
Anafylaxie, bronchospasme, tachycardie, angina, hypokaliëmie, elektrocardiografische veranderingen, vasculaire occlusieve gebeurtenissen en grand mal-aanvallen. Behalve voor bronchospasme en anafylaxie, is de relatie met ZOFRAN 4 mg onduidelijk.
Preventie van door straling veroorzaakte misselijkheid en braken
De meest voorkomende bijwerkingen (groter dan of gelijk aan 2%) gemeld bij patiënten die ZOFRAN en gelijktijdige radiotherapie kregen, waren vergelijkbaar met die gemeld bij patiënten die ZOFRAN en gelijktijdige chemotherapie kregen en waren hoofdpijn, constipatie en diarree.
Preventie van postoperatieve misselijkheid en braken
De meest voorkomende bijwerkingen die zijn gemeld bij volwassenen in onderzoek(en) ter preventie van postoperatieve misselijkheid en braken zijn weergegeven in tabel 4. In deze onderzoeken kregen patiënten meerdere gelijktijdige perioperatieve en postoperatieve medicatie in beide behandelingsgroepen.
In een cross-overonderzoek met 25 proefpersonen werd hoofdpijn gemeld bij 6 proefpersonen die ZOFRAN 8 mg ODT oraal desintegrerende tablet met water kregen (24%) in vergelijking met 2 proefpersonen die ZOFRAN 8 mg ODT oraal desintegrerende tablet zonder water kregen (8%).
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van ondansetron na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Cardiovasculair
Aritmieën (inclusief ventriculaire en supraventriculaire tachycardie, premature ventriculaire contracties en atriale fibrillatie), bradycardie, elektrocardiografische veranderingen (inclusief tweedegraads hartblok, QT/QTc-intervalverlenging en ST-segmentdepressie), hartkloppingen en syncope. Zelden en voornamelijk met intraveneus ondansetron zijn voorbijgaande ECG-veranderingen gemeld, waaronder verlenging van het QT-interval.
Algemeen
doorspoelen
Zeldzame gevallen van overgevoeligheidsreacties, soms ernstig (bijv. anafylactische reacties, angio-oedeem, bronchospasme, kortademigheid, hypotensie, larynxoedeem, stridor) zijn ook gemeld. Laryngospasme, shock en hartstilstand zijn opgetreden tijdens allergische reacties bij patiënten die injecteerbaar ondansetron kregen.
Lever- en gal
Leverenzymafwijkingen.
Lagere luchtwegen
Hik.
Neurologie
Oculogyrische crisis, die alleen verschijnt, evenals met andere dystonische reacties.
Huid
Urticaria, Stevens-Johnson-syndroom en toxische epidermale necrolyse.
Oogaandoeningen
Gevallen van voorbijgaande blindheid, voornamelijk tijdens intraveneuze toediening, zijn gemeld. Van deze gevallen van voorbijgaande blindheid werd gemeld dat ze binnen enkele minuten tot 48 uur verdwenen.
DRUG-INTERACTIES
Serotonerge geneesmiddelen
Het serotoninesyndroom (inclusief veranderde mentale toestand, autonome instabiliteit en neuromusculaire symptomen) is beschreven na gelijktijdig gebruik van 5-HT3-receptorantagonisten en andere serotonerge geneesmiddelen, waaronder SSRI's en SNRI's. Monitor voor het ontstaan van het serotoninesyndroom. Als er symptomen optreden, stop dan met ZOFRAN 4 mg en start een ondersteunende behandeling [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelen die van invloed zijn op cytochroom P-450-enzymen
Ondansetron lijkt zelf het cytochroom P-450 geneesmiddelmetaboliserende enzymsysteem van de lever niet te induceren of te remmen [zie KLINISCHE FARMACOLOGIE ]. Omdat ondansetron wordt gemetaboliseerd door hepatische cytochroom P450 geneesmiddelmetaboliserende enzymen (CYP3A4, CYP2D6, CYP1A2), kunnen inductoren of remmers van deze enzymen de klaring en daarmee de halfwaardetijd van ondansetron veranderen. Bij patiënten die werden behandeld met krachtige inductoren van CYP3A4 (dwz fenytoïne, carbamazepine en rifampicine), was de klaring van ondansetron significant verhoogd en waren de bloedconcentraties van ondansetron verlaagd. Op basis van de beschikbare gegevens wordt echter geen dosisaanpassing voor ZOFRAN 8 mg aanbevolen voor patiënten die deze geneesmiddelen gebruiken [zie: KLINISCHE FARMACOLOGIE ].
tramadol
Hoewel er geen farmacokinetische geneesmiddelinteractie tussen ondansetron en tramadol is waargenomen, geven gegevens van 2 kleine onderzoeken aan dat ZOFRAN 8 mg, indien samen gebruikt, de patiëntgecontroleerde toediening van tramadol kan verhogen. Patiënten controleren om te zorgen voor adequate pijnbestrijding wanneer ondansetron wordt toegediend met tramadol.
Chemotherapie
Carmustine, etoposide en cisplatine hebben geen invloed op de farmacokinetiek van ondansetron.
In een cross-overonderzoek bij 76 pediatrische patiënten verhoogde intraveneus ondansetron de systemische concentraties van hoge doses methotrexaat niet.
Alfentanil en Atracurium
Zofran 4 mg verandert niets aan de ademhalingsdepressieve effecten van alfentanil of de mate van neuromusculaire blokkade veroorzaakt door atracurium. Interacties met algemene of lokale anesthetica zijn niet onderzocht.
Drugsmisbruik en afhankelijkheid
Dierstudies hebben aangetoond dat ondansetron niet wordt gediscrimineerd als benzodiazepine en evenmin benzodiazepines vervangt in directe verslavingsstudies.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Overgevoeligheidsreacties
Overgevoeligheidsreacties, waaronder anafylaxie en bronchospasme, zijn gemeld bij patiënten die overgevoelig waren voor andere selectieve 5-HT3-receptorantagonisten. Als overgevoeligheidsreacties optreden, stop dan met het gebruik van ZOFRAN; behandel onmiddellijk volgens de standaardbehandeling en controleer totdat de tekenen en symptomen verdwijnen [zie CONTRA-INDICATIES ].
QT-verlenging
Veranderingen op het elektrocardiogram (ECG), waaronder verlenging van het QT-interval, zijn waargenomen bij patiënten die ondansetron kregen. Daarnaast zijn postmarketinggevallen van Torsade de Pointes gemeld bij patiënten die ZOFRAN gebruikten. Vermijd ZOFRAN 8 mg bij patiënten met een aangeboren lang QT-syndroom. ECG-monitoring wordt aanbevolen bij patiënten met elektrolytafwijkingen (bijv. hypokaliëmie of hypomagnesiëmie), congestief hartfalen, bradyaritmieën of patiënten die andere geneesmiddelen gebruiken die leiden tot QT-verlenging (zie KLINISCHE FARMACOLOGIE ].
serotonine syndroom
De ontwikkeling van het serotoninesyndroom is gemeld met alleen 5-HT3-receptorantagonisten. De meeste meldingen zijn in verband gebracht met gelijktijdig gebruik van serotonerge geneesmiddelen (bijv. selectieve serotonineheropnameremmers (SSRI's), serotonine- en noradrenalineheropnameremmers (SNRI's), monoamineoxidaseremmers, mirtazapine, fentanyl, lithium, tramadol en intraveneus methyleenblauw). Sommige van de gemelde gevallen waren dodelijk. Er is ook melding gemaakt van het serotoninesyndroom dat optreedt bij een overdosis ZOFRAN 4 mg alleen. Het merendeel van de meldingen van serotoninesyndroom gerelateerd aan het gebruik van 5-HT3-receptorantagonisten vond plaats in een post-anesthesieafdeling of een infusiecentrum.
Symptomen die verband houden met het serotoninesyndroom kunnen de volgende combinatie van tekenen en symptomen omvatten: veranderingen in de mentale toestand (bijv. agitatie, hallucinaties, delirium en coma), autonome instabiliteit (bijv. tachycardie, labiele bloeddruk, duizeligheid, diaforese, blozen, hyperthermie) , neuromusculaire symptomen (bijv. tremor, stijfheid, myoclonus, hyperreflexie, coördinatiestoornissen), toevallen, met of zonder gastro-intestinale symptomen (bijv. misselijkheid, braken, diarree). Patiënten moeten worden gecontroleerd op het optreden van het serotoninesyndroom, vooral bij gelijktijdig gebruik van Zofran 4 mg en andere serotonerge geneesmiddelen. Als symptomen van het serotoninesyndroom optreden, stop dan met ZOFRAN en start een ondersteunende behandeling. Patiënten moeten worden geïnformeerd over het verhoogde risico op het serotoninesyndroom, vooral als ZOFRAN gelijktijdig wordt gebruikt met andere serotonerge geneesmiddelen (zie DRUG-INTERACTIES , OVERDOSERING ].
Maskering van progressieve ileus en maagdistensie
Het gebruik van ZOFRAN bij patiënten na een buikoperatie of bij patiënten met door chemotherapie veroorzaakte misselijkheid en braken kan een progressieve ileus en/of maagopzetting maskeren. Controleer op verminderde darmactiviteit, vooral bij patiënten met risicofactoren voor gastro-intestinale obstructie.
ZOFRAN 8 mg is geen medicijn dat de maag- of darmperistaltiek stimuleert. Het mag niet worden gebruikt in plaats van nasogastrische afzuiging.
fenylketonurie
Fenylketonuriepatiënten moeten worden geïnformeerd dat ZOFRAN ODT oraal uiteenvallende tabletten fenylalanine (een bestanddeel van aspartaam) bevatten. Elke oraal desintegrerende tablet van 4 mg en 8 mg bevat minder dan 0,03 mg fenylalanine.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogene effecten werden niet gezien in 2-jarige studies bij ratten en muizen met orale doses ondansetron tot respectievelijk 10 mg/kg per dag en 30 mg/kg per dag (ongeveer 4 en 6 maal de maximaal aanbevolen orale dosis voor de mens van 24 mg). per dag, op basis van lichaamsoppervlak).
Ondansetron was niet mutageen in standaardtests voor mutageniteit.
Orale toediening van ondansetron tot 15 mg/kg per dag (ongeveer 6 maal de maximaal aanbevolen orale dosis voor mensen van 24 mg per dag, gebaseerd op het lichaamsoppervlak) had geen invloed op de vruchtbaarheid of de algemene reproductieprestaties van mannelijke en vrouwelijke ratten.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Gepubliceerde epidemiologische onderzoeken naar het verband tussen het gebruik van ondansetron en ernstige geboorteafwijkingen hebben inconsistente bevindingen gerapporteerd en hebben belangrijke methodologische beperkingen die conclusies over de veiligheid van het gebruik van ondansetron tijdens de zwangerschap in de weg staan (zie Gegevens ). Beschikbare postmarketinggegevens hebben geen geneesmiddelgerelateerd risico op een miskraam of nadelige maternale uitkomsten aangetoond. Voortplantingsonderzoeken bij ratten en konijnen hebben geen aanwijzingen opgeleverd voor schade aan de foetus wanneer ondansetron werd toegediend tijdens de organogenese van respectievelijk ongeveer 6 en 24 keer de maximaal aanbevolen orale dosis voor de mens van 24 mg/dag, gebaseerd op respectievelijk het lichaamsoppervlak (zie Gegevens ).
Het achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. Alle zwangerschappen hebben een achtergrondrisico op geboorteafwijkingen, miskramen of andere nadelige gevolgen. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Gegevens
Menselijke gegevens
Beschikbare gegevens over het gebruik van ondansetron bij zwangere vrouwen uit verschillende gepubliceerde epidemiologische onderzoeken sluiten een beoordeling van een geneesmiddel-geassocieerd risico op ongunstige foetale uitkomsten uit vanwege belangrijke methodologische beperkingen, waaronder de onzekerheid of vrouwen die een recept hadden voorgeschreven de medicatie daadwerkelijk namen, het gelijktijdige gebruik van andere medicijnen of behandelingen, recall-bias en andere ongecorrigeerde confounders.
Blootstelling aan ondansetron in utero is in geaggregeerde analyses niet in verband gebracht met algemene ernstige aangeboren afwijkingen. Een grote retrospectieve cohortstudie onderzocht 1970 vrouwen die een recept voor ondansetron kregen tijdens de zwangerschap en rapporteerde geen verband tussen blootstelling aan ondansetron en ernstige aangeboren afwijkingen, miskraam, doodgeboorte, vroeggeboorte, baby's met een laag geboortegewicht of baby's die klein waren voor de zwangerschapsduur.
Twee grote retrospectieve cohortstudies en één case-controlstudie hebben de blootstelling aan ondansetron in het eerste trimester en het risico op cardiovasculaire defecten beoordeeld met inconsistente bevindingen. Relatieve risico's (RR) varieerden van 0,97 (95% BI 0,86 tot 1,10) tot 1,62 (95% BI 1,04, 2,54). Een subset-analyse in een van de cohortstudies wees uit dat ondansetron specifiek geassocieerd was met hartseptumdefecten (RR 2,05, 95% BI 1,19, 3,28); deze associatie werd echter niet bevestigd in andere onderzoeken.
Verschillende onderzoeken hebben ondansetron en het risico op mondspleten beoordeeld met inconsistente bevindingen. Een retrospectieve cohortstudie van 1,8 miljoen zwangerschappen in de Amerikaanse Medicaid Database toonde een verhoogd risico op orale kloven aan bij 88.467 zwangerschappen waarbij oraal ondansetron werd voorgeschreven in het eerste trimester (RR 1,24, 95% BI 1,03, 1,48), maar een dergelijk verband werd niet gevonden. gemeld met intraveneus ondansetron bij 23.866 zwangerschappen (RR 0,95, 95% BI 0,63, 1,43). In de subgroep van vrouwen die beide toedieningsvormen kregen, was de RR 1,07 (95% BI 0,59; 1,93). Twee case-control-onderzoeken, waarbij gebruik werd gemaakt van gegevens van surveillanceprogramma's voor geboorteafwijkingen, rapporteerden tegenstrijdige associaties tussen het gebruik van ondansetron door de moeder en geïsoleerd gespleten gehemelte (OR 1,6 [95% BI 1,1, 2,3] en 0,5 [95% BI 0,3, 1,0]). Het is niet bekend of blootstelling aan ondansetron in utero in het geval van een gespleten gehemelte plaatsvond tijdens de vorming van het gehemelte (het gehemelte wordt gevormd tussen de 6e en 9e week van de zwangerschap).
Dierlijke gegevens
In embryo-foetale ontwikkelingsstudies bij ratten en konijnen kregen drachtige dieren orale doses ondansetron tot respectievelijk 15 mg/kg/dag en 30 mg/kg/dag gedurende de periode van organogenese. Met uitzondering van een lichte afname van de gewichtstoename van de moeder bij de konijnen, waren er geen significante effecten van ondansetron op de moederdieren of de ontwikkeling van de nakomelingen. Bij doses van 15 mg/kg/dag bij ratten en 30 mg/kg/dag bij konijnen was de maternale blootstellingsmarge ongeveer 6 en 24 maal de maximaal aanbevolen orale dosis voor de mens van respectievelijk 24 mg/dag, gebaseerd op het lichaamsoppervlak. .
In een pre- en postnatale ontwikkelingstoxiciteitsstudie kregen drachtige ratten orale doses ondansetron tot 15 mg/kg/dag vanaf dag 17 van de dracht tot dag 21 van de nest. Met uitzondering van een lichte afname van de gewichtstoename van de moeder, waren er geen effecten op de drachtige ratten en de pre- en postnatale ontwikkeling van hun nakomelingen, inclusief reproductieve prestaties van de gepaarde F1-generatie. Bij een dosis van 15 mg/kg/dag bij ratten was de maternale blootstellingsmarge ongeveer 6 keer de maximaal aanbevolen orale dosis voor de mens van 24 mg/dag, gebaseerd op het lichaamsoppervlak.
Borstvoeding
Risico Samenvatting
Het is niet bekend of ondansetron aanwezig is in moedermelk. Er zijn geen gegevens over de effecten van ZOFRAN 8 mg op de zuigeling die borstvoeding krijgt of de effecten op de melkproductie. Het is echter aangetoond dat ondansetron aanwezig is in de melk van ratten. Wanneer een geneesmiddel aanwezig is in dierlijke melk, is het waarschijnlijk dat het geneesmiddel ook in de moedermelk aanwezig zal zijn.
De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten in overweging worden genomen, samen met de klinische behoefte van de moeder aan ZOFRAN 4 mg en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van ZOFRAN of van de onderliggende maternale aandoening.
Pediatrisch gebruik
De veiligheid en werkzaamheid van oraal toegediende ZOFRAN zijn vastgesteld bij pediatrische patiënten van 4 jaar en ouder voor de preventie van misselijkheid en braken in verband met matig emetogene kankerchemotherapie. Het gebruik van ZOFRAN 4 mg in deze leeftijdsgroepen wordt ondersteund door bewijs uit adequate en goed gecontroleerde onderzoeken met ZOFRAN bij volwassenen met aanvullende gegevens uit 3 open-label, niet-gecontroleerde, niet-Amerikaanse onderzoeken bij 182 pediatrische patiënten van 4 tot 18 jaar met kanker die een verscheidenheid aan cisplatine- of noncisplatine-regimes kregen [zie: DOSERING EN ADMINISTRATIE , Klinische studies ].
Aanvullende informatie over het gebruik van ondansetron bij pediatrische patiënten kan worden gevonden in de voorschrijfinformatie van ZOFRAN-injectie.
De veiligheid en werkzaamheid van oraal toegediende ZOFRAN 4 mg zijn niet vastgesteld bij pediatrische patiënten voor:
- preventie van misselijkheid en braken geassocieerd met zeer emetogene kankerchemotherapie
- preventie van misselijkheid en braken geassocieerd met radiotherapie
- preventie van postoperatieve misselijkheid en/of braken
Geriatrisch gebruik
Van het totale aantal proefpersonen die deelnamen aan door kankerchemotherapie geïnduceerde en postoperatieve misselijkheid en braken in Amerikaanse en buitenlandse gecontroleerde klinische onderzoeken, waarvoor er subgroepanalyses waren, waren 938 (19%) 65 jaar en ouder.
Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen proefpersonen van 65 jaar en oudere en jongere proefpersonen. Een afname van de klaring en een toename van de eliminatiehalfwaardetijd werden gezien bij patiënten ouder dan 75 jaar in vergelijking met jongere proefpersonen [zie: KLINISCHE FARMACOLOGIE ]. Er was een onvoldoende aantal patiënten ouder dan 75 jaar en ouder in de klinische onderzoeken om conclusies over de veiligheid of werkzaamheid in deze leeftijdsgroep te kunnen trekken. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten. Bij oudere patiënten is geen dosisaanpassing nodig.
Leverfunctiestoornis
Er is geen dosisaanpassing nodig bij patiënten met een lichte of matige leverfunctiestoornis.
Bij patiënten met een ernstige leverfunctiestoornis is de klaring verminderd en het schijnbare distributievolume verhoogd, wat resulteert in een significante verlenging van de halfwaardetijd van ondansetron. Overschrijd daarom een totale dagelijkse dosis van 8 mg niet bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh-score van 10 of hoger) [zie DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Er wordt geen dosisaanpassing aanbevolen voor patiënten met enige mate van nierfunctiestoornis (licht, matig of ernstig). Er is geen ervaring na toediening van ondansetron op de eerste dag [zie: KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Er is geen specifiek antidotum voor een overdosis ondansetron. Patiënten moeten worden behandeld met geschikte ondersteunende therapie.
Naast de hierboven vermelde bijwerkingen zijn de volgende bijwerkingen beschreven bij overdosering met ondansetron: “plotselinge blindheid” (amaurosis) van 2 tot 3 minuten plus ernstige constipatie trad op bij één patiënt die 72 mg kreeg toegediend. van ondansetron intraveneus als een enkele dosis. Hypotensie (en flauwvallen) trad op bij een patiënt die 48 mg ZOFRAN-tabletten innam. Na infusie van 32 mg over een periode van slechts 4 minuten werd een vasovagale episode met een voorbijgaand tweedegraads hartblok waargenomen. In alle gevallen verdwenen de bijwerkingen volledig.
Pediatrische gevallen die overeenkomen met het serotoninesyndroom zijn gemeld na onbedoelde orale overdoses van ondansetron (overschrijding van de geschatte inname van 5 mg per kg) bij jonge kinderen. Gerapporteerde symptomen waren slaperigheid, agitatie, tachycardie, tachypneu, hypertensie, blozen, mydriasis, diaforese, myoclonische bewegingen, horizontale nystagmus, hyperreflexie en toevallen. Patiënten hadden ondersteunende zorg nodig, waaronder intubatie in sommige gevallen, met volledig herstel zonder gevolgen binnen 1 tot 2 dagen.
CONTRA-INDICATIES
ZOFRAN is gecontra-indiceerd bij patiënten:
- waarvan bekend is dat ze overgevoelig zijn (bijv. anafylaxie) voor ondansetron of voor een van de bestanddelen van de formulering [zie ONGEWENSTE REACTIES ]
- gelijktijdig apomorfine krijgen vanwege het risico op ernstige hypotensie en bewustzijnsverlies
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Ondansetron is een selectieve 5-HT3-receptorantagonist. Hoewel het werkingsmechanisme niet volledig is gekarakteriseerd, is ondansetron geen dopaminereceptorantagonist. Serotoninereceptoren van het 5-HT3-type zijn zowel perifeer aanwezig op de vagale zenuwuiteinden als centraal in de chemoreceptortriggerzone van het gebied postrema. Het is niet zeker of de anti-emetische werking van ondansetron centraal, perifeer of op beide plaatsen wordt gemedieerd. Cytotoxische chemotherapie lijkt echter geassocieerd te zijn met het vrijkomen van serotonine uit de enterochromaffiene cellen van de dunne darm. Bij mensen neemt de uitscheiding van 5-hydroxyindolazijnzuur (5-HIAA) via de urine toe na toediening van cisplatine, parallel aan het begin van braken. De vrijgekomen serotonine kan de vagale afferenten stimuleren via de 5-HT3-receptoren en de braakreflex initiëren.
farmacodynamiek
Bij gezonde proefpersonen hadden enkelvoudige intraveneuze doses van 0,15 mg/kg ondansetron geen effect op de slokdarmmotiliteit, maagmotiliteit, lagere druk van de slokdarmsfincter of de transittijd van de dunne darm. Het is aangetoond dat meerdaagse toediening van ondansetron de colontransit bij gezonde proefpersonen vertraagt. Ondansetron heeft geen effect op de plasmaprolactineconcentraties.
Cardiale elektrofysiologie
Verlenging van het QTc-interval werd onderzocht in een dubbelblinde, enkelvoudige intraveneuze dosis, placebo- en positief-gecontroleerde, cross-over studie bij 58 gezonde proefpersonen. Het maximale gemiddelde (95% bovenste betrouwbaarheidsgrens) verschil in QTcF ten opzichte van placebo na baseline-correctie was 19,5 (21,8) milliseconden en 5,6 (7,4) milliseconden na 15 minuten durende intraveneuze infusies van respectievelijk 32 mg en 8 mg ondansetron-injectie. Er werd een significante blootstelling-responsrelatie vastgesteld tussen de ondansetronconcentratie en ΔΔQTcF. Op basis van de vastgestelde blootstelling-responsrelatie had 24 mg intraveneus toegediend gedurende 15 minuten een gemiddelde voorspelde (95% bovenste voorspellingsinterval) ΔΔQTcF van 14,0 (16,3) milliseconden. Daarentegen had 16 mg intraveneus toegediend gedurende 15 minuten met hetzelfde model een gemiddelde voorspelde (95% bovenste voorspellingsinterval) ΔΔQTcF van 9,1 (11,2) milliseconden. In deze studie verlengde de 8 mg-dosis die gedurende 15 minuten werd toegediend het QT-interval niet in klinisch relevante mate.
Farmacokinetiek
Absorptie
Ondansetron wordt geabsorbeerd uit het maag-darmkanaal en ondergaat enig first-pass metabolisme. De gemiddelde biologische beschikbaarheid bij gezonde proefpersonen, na toediening van een enkele tablet van 8 mg, is ongeveer 56%.
De systemische blootstelling aan ondansetron neemt niet evenredig met de dosis toe. De oppervlakte onder de curve (AUC) van een tablet van 16 mg was 24% groter dan voorspeld op basis van een dosis van 8 mg tabletten. Dit kan wijzen op enige vermindering van het first-pass metabolisme bij hogere orale doses.
Voedseleffecten
De biologische beschikbaarheid wordt ook enigszins verbeterd door de aanwezigheid van voedsel.
Verdeling
De plasma-eiwitbinding van ondansetron zoals gemeten in vitro was 70% tot 76% over het concentratiebereik van 10 tot 500 ng/ml. Het circulerende medicijn verdeelt zich ook in erytrocyten.
Eliminatie
Metabolisme en uitscheiding
Ondansetron wordt uitgebreid gemetaboliseerd bij de mens, waarbij ongeveer 5% van een radioactief gelabelde dosis als de moederverbinding uit de urine wordt teruggevonden. De metabolieten worden waargenomen in de urine. De primaire metabole route is hydroxylering op de indolring gevolgd door daaropvolgende glucuronide- of sulfaatconjugatie.
In vitro metabolismestudies hebben aangetoond dat ondansetron een substraat is voor humane levercytochroom P-450-enzymen, waaronder CYP1A2, CYP2D6 en CYP3A4. Wat betreft de totale omzet van ondansetron, speelde CYP3A4 de overheersende rol. Vanwege de veelheid aan metabole enzymen die in staat zijn om ondansetron te metaboliseren, is het waarschijnlijk dat remming of verlies van één enzym (bijv. genetische CYP2D6-deficiëntie) wordt gecompenseerd door andere en kan resulteren in weinig verandering in de algehele snelheid van ondansetron-eliminatie.
Hoewel sommige niet-geconjugeerde metabolieten farmacologische activiteit hebben, worden deze niet in plasma aangetroffen in concentraties die waarschijnlijk significant bijdragen aan de biologische activiteit van ondansetron.
Specifieke populaties
Leeftijd: Geriatrische bevolking
Een afname van de klaring en een toename van de eliminatiehalfwaardetijd worden gezien bij patiënten ouder dan 75 jaar in vergelijking met jongere proefpersonen [zie: Gebruik bij specifieke populaties ].
Seks
Geslachtsverschillen werden aangetoond in de dispositie van ondansetron toegediend als een enkele dosis. De mate en snelheid van absorptie zijn groter bij vrouwen dan bij mannen. Een langzamere klaring bij vrouwen, een kleiner schijnbaar distributievolume (gecorrigeerd voor gewicht) en een hogere absolute biologische beschikbaarheid resulteerden in hogere plasmaconcentraties van ondansetron. Deze hogere plasmaconcentraties kunnen gedeeltelijk worden verklaard door verschillen in lichaamsgewicht tussen mannen en vrouwen. Het is niet bekend of deze seksegerelateerde verschillen klinisch belangrijk waren. Meer gedetailleerde farmacokinetische informatie is te vinden in tabellen 5 en 6.
Nierfunctiestoornis
Nierfunctiestoornis zal naar verwachting geen significante invloed hebben op de totale klaring van ondansetron, aangezien de nierklaring slechts 5% van de totale klaring vertegenwoordigt. De gemiddelde plasmaklaring van ondansetron was echter met ongeveer 50% verminderd bij patiënten met een ernstige nierfunctiestoornis (creatinineklaring minder dan 30 ml/min). De afname van de klaring was variabel en niet consistent met een toename van de halfwaardetijd [zie: Gebruik bij specifieke populaties ].
Leverfunctiestoornis
Bij patiënten met lichte tot matige leverinsufficiëntie is de klaring 2-voudig verminderd en is de gemiddelde halfwaardetijd verhoogd tot 11,6 uur vergeleken met 5,7 uur bij gezonde proefpersonen. Bij patiënten met ernstige leverinsufficiëntie (Child-Pugh-score van 10 of hoger) is de klaring 2-voudig tot 3-voudig verminderd en is het schijnbare distributievolume verhoogd met als gevolg een toename van de halfwaardetijd tot 20 uur [zie DOSERING EN ADMINISTRATIE , Gebruik bij specifieke populaties ].
Geneesmiddelinteractiestudies
CYP 3A4-inductoren
De eliminatie van ondansetron kan worden beïnvloed door cytochroom P-450-inductoren. In een farmacokinetisch onderzoek met 16 epileptische patiënten die chronisch CYP3A4-inductoren, carbamazepine of fenytoïne gebruikten, werd een verlaging van de AUC, Cmax en t½ van ondansetron waargenomen. Dit resulteerde in een significante toename van de klaring van ondansetron. Deze toename wordt echter niet klinisch relevant geacht [zie DRUG-INTERACTIES ].
Chemotherapeutische middelen
Carmustine, etoposide en cisplatine hebben geen invloed op de farmacokinetiek van ondansetron (zie DRUG-INTERACTIES ].
Antacida
Gelijktijdige toediening van antacida verandert de absorptie van ondansetron niet.
Klinische studies
Preventie van door chemotherapie veroorzaakte misselijkheid en braken
Zeer emetogene chemotherapie
In 2 gerandomiseerde, dubbelblinde monotherapie-onderzoeken was een enkele orale dosis van 24 mg ZOFRAN superieur aan een relevante historische placebocontrole bij de preventie van misselijkheid en braken geassocieerd met zeer emetogene kankerchemotherapie, waaronder cisplatine groter dan of gelijk aan 50 mg/m². De toediening van steroïden was uitgesloten van deze klinische onderzoeken. Meer dan 90% van de patiënten die een dosis cisplatine kregen van meer dan of gelijk aan 50 mg/m² in de historische placebo-comparator, had last van braken in afwezigheid van anti-emetische therapie.
De eerste studie vergeleek orale doses ondansetron 24 mg als een enkele dosis, 8 mg om de 8 uur voor 2 doses en 32 mg als een enkele dosis bij 357 volwassen kankerpatiënten die chemotherapie kregen met cisplatine groter dan of gelijk aan 50 mg/m² . De eerste of enkele dosis werd 30 minuten voorafgaand aan chemotherapie toegediend. In totaal voltooiden 66% van de patiënten in de groep van ondansetron 24 mg eenmaal daags, 55% in de groep van tweemaal daags ondansetron 8 mg en 55% in de groep van eenmaal daags 32 mg ondansetron. de proefperiode van 24 uur met 0 emetische episodes en geen rescue-anti-emetische medicatie, het primaire eindpunt van de werkzaamheid. Elk van de 3 behandelingsgroepen bleek statistisch significant superieur te zijn aan een historische placebocontrole.
In hetzelfde onderzoek ondervond 56% van de patiënten die een eenmalige orale dosis van 24 mg ondansetron kregen, geen misselijkheid tijdens de proefperiode van 24 uur, vergeleken met 36% van de patiënten in de groep die tweemaal daags 8 mg orale ondansetron kreeg ( P = 0,001) en 50% in de orale groep van 32 mg eenmaal daags ondansetron. Doseringsschema's van ZOFRAN 8 mg tweemaal daags en 32 mg eenmaal daags worden niet aanbevolen voor de preventie van misselijkheid en braken geassocieerd met zeer emetogene chemotherapie [zie DOSERING EN ADMINISTRATIE ].
In een tweede onderzoek werd de werkzaamheid van een enkele orale dosis van 24 mg ZOFRAN 4 mg voor de preventie van misselijkheid en braken geassocieerd met zeer emetogene kankerchemotherapie, waaronder cisplatine groter dan of gelijk aan 50 mg/m², bevestigd.
Matig emetogene chemotherapie
Een gerandomiseerde, placebogecontroleerde, dubbelblinde studie werd uitgevoerd in de VS bij 67 patiënten die een op cyclofosfamide gebaseerde chemotherapiebehandeling kregen die doxorubicine bevatte. De eerste dosis van 8 mg ZOFRAN 8 mg werd 30 minuten voor aanvang van de chemotherapie toegediend, met een volgende dosis 8 uur na de eerste dosis, gevolgd door 8 mg ZOFRAN 8 mg tweemaal daags gedurende 2 dagen na voltooiing van de chemotherapie. was significant effectiever dan placebo bij het voorkomen van braken. De respons op de behandeling was gebaseerd op het totale aantal emetische episodes gedurende de proefperiode van 3 dagen. De resultaten van deze proef zijn samengevat in Tabel 7.
In een dubbelblinde, Amerikaanse studie bij 336 patiënten die een op cyclofosfamide gebaseerde chemotherapie kregen die ofwel methotrexaat of doxorubicine bevatte, was ZOFRAN 8 mg tweemaal daags toegediend even effectief als ZOFRAN 8 mg toegediend 3 maal daags bij het voorkomen van misselijkheid en braken. Zofran 8 mg driemaal daags is geen aanbevolen regime voor de behandeling van matig emetogene chemotherapie [zie: DOSERING EN ADMINISTRATIE ].
De respons op de behandeling was gebaseerd op het totale aantal emetische episodes gedurende de proefperiode van 3 dagen. Zie Tabel 8 voor de details van de bestudeerde doseringsschema's en de resultaten van deze studie.
Herbehandeling
In eenarmige onderzoeken werden 148 patiënten die op cyclofosfamide gebaseerde chemotherapie kregen opnieuw behandeld met ZOFRAN 8 mg driemaal daags tijdens daaropvolgende chemotherapie voor een totaal van 396 herbehandelingskuren. In 314 (79%) van de herbehandelingskuren kwamen geen emetische episodes voor en slechts 1 tot 2 emetische episodes kwamen voor in 43 (11%) van de herbehandelingskuren.
Pediatrische proeven
Er zijn drie open-label, eenarmige, niet-Amerikaanse onderzoeken uitgevoerd met 182 pediatrische patiënten van 4 tot 18 jaar met kanker die een verscheidenheid aan cisplatine- of noncisplatine-regimes kregen. De aanvangsdosis van ZOFRAN 4 mg-injectie varieerde van 0,04 tot 0,87 mg per kg (totale dosis van 2,16 mg tot 12 mg), gevolgd door de toediening van orale doses ZOFRAN 4 mg variërend van 4 tot 24 mg per dag gedurende 3 dagen. In deze onderzoeken had 58% van de 170 evalueerbare patiënten een volledige respons (geen emetische episodes) op dag 1. In 2 onderzoeken waren de responspercentages op ZOFRAN 4 mg driemaal daags bij patiënten jonger dan 12 jaar vergelijkbaar met ZOFRAN 8 mg driemaal daags bij patiënten van 12 tot 18 jaar. Preventie van braken bij deze pediatrische patiënten was in wezen hetzelfde als bij volwassenen.
Door straling veroorzaakte misselijkheid en braken
Totale lichaamsbestraling
In een gerandomiseerde, placebogecontroleerde, dubbelblinde studie bij 20 patiënten was 8 mg ZOFRAN, 1,5 uur vóór elke fractie van de radiotherapie gedurende 4 dagen toegediend, significant effectiever dan placebo bij het voorkomen van braken veroorzaakt door totale lichaamsbestraling. De totale lichaamsbestraling bestond uit 11 fracties (120 cGy per fractie) gedurende 4 dagen voor een totaal van 1320 cGy. Patiënten kregen 3 fracties gedurende 3 dagen, daarna 2 fracties op dag 4.
Radiotherapie met enkele hoge dosisfractie
In een actief-gecontroleerde, dubbelblinde studie bij 105 patiënten die een enkelvoudige hoge dosis radiotherapie (800 tot 1.000 cGy) kregen over een anterieure of posterieure veldgrootte groter dan of gelijk aan 80 cm² naar de buik, was Zofran 4 mg significant effectiever dan metoclopramide met betrekking tot volledige controle van braken (0 emetische episodes). Patiënten kregen de eerste dosis ZOFRAN (8 mg) of metoclopramide (10 mg) 1 tot 2 uur vóór radiotherapie. Als radiotherapie 's morgens werd gegeven, werd in de late namiddag 8 mg ZOFRAN 8 mg of 10 mg metoclopramide toegediend en voor het slapengaan opnieuw herhaald. Als radiotherapie 's middags werd gegeven, namen patiënten slechts eenmaal voor het slapengaan 8 mg ZOFRAN 4 mg of 10 mg metoclopramide. Patiënten zetten de doses orale medicatie driemaal daags gedurende 3 dagen voort.
Dagelijkse gefractioneerde radiotherapie
In een actief-gecontroleerde, dubbelblinde studie bij 135 patiënten die een 1- tot 4-weekse kuur met gefractioneerde radiotherapie (180 cGy-doses) kregen over een veldgrootte groter dan of gelijk aan 100 cm² tot aan de buik, was ZOFRAN 4 mg significant effectiever dan prochlorperazine met betrekking tot volledige controle van braken (0 emetische episodes). Patiënten kregen de eerste dosis ZOFRAN (8 mg) of prochlorperazine (10 mg) 1 tot 2 uur vóór de eerste dagelijkse radiotherapiefractie, met daaropvolgende doses van 8 mg ongeveer elke 8 uur op elke dag van radiotherapie.
Postoperatieve misselijkheid en braken
In 2 placebogecontroleerde, dubbelblinde onderzoeken (één uitgevoerd in de VS en de andere buiten de VS) bij 865 vrouwen die klinische chirurgische ingrepen ondergingen, werd ZOFRAN 16 mg als een enkele dosis of placebo één uur vóór de inductie van algemeen gebalanceerde anesthesie (barbituraat, opioïde, lachgas, neuromusculaire blokkade en aanvullende isofluraan of enfluraan), was ZOFRAN-tabletten significant effectiever dan placebo bij het voorkomen van postoperatieve misselijkheid en braken.
Er zijn geen onderzoeken uitgevoerd bij mannen.
PATIËNT INFORMATIE
QT-verlenging
Informeer patiënten dat ZOFRAN ernstige hartritmestoornissen kan veroorzaken, zoals QT-verlenging. Instrueer patiënten om hun zorgverlener meteen op de hoogte te stellen als ze een verandering in hun hartslag waarnemen, als ze zich licht in het hoofd voelen of als ze een syncope episode hebben [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Overgevoeligheidsreacties
Informeer patiënten dat ZOFRAN 4 mg overgevoeligheidsreacties kan veroorzaken, sommige zo ernstig als anafylaxie en bronchospasmen. Instrueer patiënten om eventuele tekenen en symptomen van overgevoeligheidsreacties, waaronder koorts, koude rillingen, huiduitslag of ademhalingsproblemen, onmiddellijk aan hun zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Maskering van progressieve ileus en maagdistensie
Informeer patiënten na een buikoperatie of patiënten met door chemotherapie veroorzaakte misselijkheid en braken dat ZOFRAN 4 mg tekenen en symptomen van darmobstructie kan maskeren. Instrueer patiënten om onmiddellijk alle tekenen of symptomen die wijzen op een mogelijke darmobstructie aan hun zorgverlener te melden [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geneesmiddelinteracties
- Instrueer de patiënt om het gebruik van alle medicijnen, vooral apomorfine, aan hun zorgverlener te melden. Gelijktijdig gebruik van apomorfine en ZOFRAN kan een significante daling van de bloeddruk en bewustzijnsverlies veroorzaken.
- Adviseer patiënten over de mogelijkheid van serotoninesyndroom bij gelijktijdig gebruik van ZOFRAN 8 mg en een ander serotonerge middel, zoals medicijnen voor de behandeling van depressie en migraine. Adviseer patiënten om onmiddellijk medische hulp in te roepen als de volgende symptomen optreden: veranderingen in mentale toestand, autonome instabiliteit, neuromusculaire symptomen met of zonder gastro-intestinale symptomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Toediening van ZOFRAN 4 mg ODT oraal uiteenvallende tabletten
Instrueer patiënten om ZOFRAN 4 mg ODT oraal desintegrerende tabletten niet uit de blister te verwijderen tot vlak voor de dosering.
- Probeer niet om ZOFRAN 8 mg ODT oraal desintegrerende tabletten door de folierug te duwen.
- Trek met droge handen de folie aan de achterkant van 1 blister los en verwijder voorzichtig de tablet.
- Plaats de oraal desintegrerende tablet ZOFRAN ODT onmiddellijk op de tong waar deze binnen enkele seconden zal oplossen, en slik vervolgens door met speeksel.
- Toediening met vloeistof is niet nodig.
- Afpelbare geïllustreerde stickers zijn aangebracht op de productverpakking die bij het recept kan worden geleverd om een correct gebruik en behandeling van het product te garanderen.
