Hydrea 500mg Hydroxyurea Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Hydrea 500 mg en hoe wordt het gebruikt?
Hydrea (hydroxyurea) is een antineoplastisch (antikanker) middel dat wordt gebruikt voor de behandeling van melanoom, resistente chronische myelocytische leukemie en recidiverend, gemetastaseerd of inoperabel carcinoom van de eierstok en primaire plaveiselcelcarcinomen (epidermoïde) van het hoofd en de nek. Hydrea is beschikbaar in generieke vorm.
Wat zijn bijwerkingen van Hydrea?
Vaak voorkomende bijwerkingen van Hydrea zijn:
- misselijkheid,
- braken,
- maagklachten,
- diarree,
- constipatie,
- huidveranderingen zoals peeling of verkleuring,
- griepachtige symptomen,
- haaruitval,
- uitslag,
- hoofdpijn,
- duizeligheid,
- slaperigheid, of
- gewichtstoename.
Ernstige bijwerkingen van Hydrea zijn onder meer:
- Bloedarmoede,
- myelosuppressie, en
- leukemie.
OMSCHRIJVING
HYDREA (hydroxyurea-capsules, USP) is een antimetaboliet die beschikbaar is voor oraal gebruik als capsules die 500 mg hydroxyurea bevatten. Inactieve ingrediënten zijn citroenzuur, kleurstoffen (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 en D&C Red No. 28), gelatine, lactose, magnesiumstearaat, natriumfosfaat en titaniumdioxide.
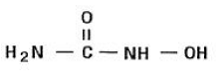
Hydroxyurea is een wit tot gebroken wit kristallijn poeder. Het is hygroscopisch en goed oplosbaar in water, maar praktisch onoplosbaar in alcohol. De empirische formule is CH4N2O2 en heeft een molecuulgewicht van 76,05. De structuurformule is:
INDICATIES
HYDREA 500 mg is geïndiceerd voor de behandeling van:
- Resistente chronische myeloïde leukemie.
- Lokaal gevorderde plaveiselcelcarcinomen van het hoofd-halsgebied (exclusief de lip) in combinatie met chemoradiatie.
DOSERING EN ADMINISTRATIE
Doseringsinformatie
HYDREA wordt alleen of in combinatie met andere antitumormiddelen of bestralingstherapie gebruikt om neoplastische ziekten te behandelen. Personaliseer de behandeling op basis van het tumortype, de ziektetoestand, de respons op de behandeling, de risicofactoren van de patiënt en de huidige klinische praktijknormen.
Baseer alle doseringen op het werkelijke of ideale gewicht van de patiënt, afhankelijk van wat het minst is.
HYDREA is een cytotoxisch medicijn. Volg de toepasselijke speciale procedures voor behandeling en verwijdering [zie REFERENTIES ].
Slik HYDREA-capsules heel door. De capsules NIET openen, breken of erop kauwen, omdat HYDREA een cytotoxisch medicijn is.
Profylactische toediening van foliumzuur wordt aanbevolen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Controleer het bloedbeeld ten minste eenmaal per week tijdens de behandeling met HYDREA 500 mg. Ernstige anemie moet worden gecorrigeerd voordat de behandeling met HYDREA wordt gestart.
Dosisaanpassingen voor toxiciteit
Controleer op het volgende en verlaag de dosis of stop dienovereenkomstig met HYDREA 500 mg:
- Myelosuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Cutane vasculitis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Overweeg dosisaanpassingen voor andere toxiciteiten.
Dosisaanpassingen voor nierinsufficiëntie
Verlaag de dosis HYDREA met 50% bij patiënten met een gemeten creatinineklaring van minder dan 60 ml/min of met terminale nierziekte (ESRD) (zie Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ].
Bij deze patiënten wordt nauwlettende controle van de hematologische parameters geadviseerd.
HOE GELEVERD
Doseringsvormen en sterke punten
Capsules
500 mg ondoorzichtige groene dop en ondoorzichtige roze romp bedrukt met "HYDREA" en "830".
Opslag en behandeling
HYDREA® (hydroxyurea-capsules, USP) wordt geleverd als capsules van 500 mg in HDPE-flessen met een plastic veiligheidsschroefdop. Elke fles bevat 100 capsules.
De dop is ondoorzichtig groen en het lichaam is ondoorzichtig roze. De capsules zijn op beide secties bedrukt met “HYDREA” en “830” in zwarte inkt ( NDC 0003-0830-50).
Opslag
Bewaren bij 20-25°C (68-77°F); excursies toegestaan tot 15°C-30°C (59°F-86°F) [zie USP Controlled RoomTemperature]. Goed gesloten bewaren.
Behandeling en verwijdering
HYDREA 500 mg is een cytotoxisch medicijn. Volg de toepasselijke speciale procedures voor behandeling en verwijdering [zie REFERENTIES ].
Om het risico op contact te verminderen, adviseren zorgverleners om wegwerphandschoenen te dragen bij het hanteren van HYDREA of flessen die HYDREA bevatten. Was de handen met water en zeep voor en na contact met de fles of capsules bij het hanteren van HYDREA. HYDREA 500 mg capsules niet openen. Vermijd blootstelling aan verpulverde of geopende capsules. Als contact met fijngemaakte of geopende capsules op de huid optreedt, was het getroffen gebied dan onmiddellijk en grondig met water en zeep. Als contact met gebroken of geopende capsules op het oog/de ogen optreedt, moet het getroffen gebied gedurende ten minste 15 minuten grondig worden gespoeld met water of isotone oogspoeling. Als het poeder uit de capsule is gemorst, veeg het dan onmiddellijk op met een vochtige wegwerphanddoek en gooi het weg in een gesloten container, zoals een plastic zak; net als de lege capsules. De gemorste plekken moeten vervolgens drie keer worden schoongemaakt met een reinigingsmiddel, gevolgd door schoon water. Houd de medicatie uit de buurt van kinderen en huisdieren. Neem contact op met uw arts voor instructies over het weggooien van verouderde capsules.
REFERENTIES
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Gefabriceerd voor: Bristol-Myers Squibb Company Princeton, New Jersey 08543 VS. Herzien: december 2020
BIJWERKINGEN
De volgende klinisch significante bijwerkingen worden in detail beschreven in andere rubrieken over de etikettering:
- Myelosuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Maligniteiten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Vasculitische toxiciteiten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Risico's bij gelijktijdig gebruik van antiretrovirale geneesmiddelen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- straling terugroepen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- macrocytose [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Longtoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van HYDREA na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om de frequentie ervan betrouwbaar in te schatten.
- Voortplantingsstelsel- en borstaandoeningen: azoöspermie en oligospermie
- Maagdarmstelselaandoeningen: stomatitis, misselijkheid, braken, diarree en constipatie
- Stofwisseling en Voedingsstoornissen: anorexia, tumorlysissyndroom
- Huid- en onderhuidaandoeningen: maculopapulaire uitslag, huidulceratie, cutane lupus erythematodes, dermatomyositis-achtige huidveranderingen, perifere en faciale erytheem, hyperpigmentatie, nagelhyperpigmentatie, atrofie van huid en nagels, schilfering, violette papels en alopecia
- Nier- en urinewegaandoeningen: dysurie, verhogingen van serumurinezuur, bloedureumstikstof (BUN) en creatininespiegels
- Zenuwstelselaandoeningen: hoofdpijn, duizeligheid, slaperigheid, desoriëntatie, hallucinaties en convulsies
- Algemene aandoeningen: koorts, koude rillingen, malaise, oedeem en asthenie
- Lever- en galaandoeningen: verhoging van leverenzymen, cholestase en hepatitis
- Ademhalingsstoornissen: diffuse longinfiltraten, dyspneu en longfibrose, interstitiële longziekte, pneumonitis, alveolitis, allergische alveolitis en hoesten
- Immuunziekten: systemische lupus erythematosus
- Overgevoeligheid: Geneesmiddelgeïnduceerde koorts (pyrexie) (>39°C, >102°F) die ziekenhuisopname vereist, is gelijktijdig gemeld met gastro-intestinale, pulmonale, musculoskeletale, hepatobiliaire, dermatologische of cardiovasculaire manifestaties. De aanvang trad meestal op binnen 6 weken na aanvang en verdween na stopzetting van hydroxyurea. Bij hernieuwde toediening trad koorts doorgaans binnen 24 uur weer op.
Bijwerkingen die zijn waargenomen bij gecombineerde hydroxyureum- en bestralingstherapie zijn vergelijkbaar met de bijwerkingen die zijn gemeld bij het gebruik van hydroxyureum of bestraling alleen. Deze effecten omvatten voornamelijk beenmergdepressie (anemie en leukopenie), maagirritatie en mucositis. Bijna alle patiënten die een adequate kuur van gecombineerde hydroxyureum- en bestralingstherapie krijgen, zullen gelijktijdige leukopenie vertonen. Bloedplaatjesdepressie (
DRUG-INTERACTIES
Verhoogde toxiciteit bij gelijktijdig gebruik van antiretrovirale geneesmiddelen
Pancreatitis
Bij patiënten met een HIV-infectie tijdens behandeling met hydroxyureum en didanosine, met of zonder stavudine, is fatale en niet-fatale pancreatitis opgetreden. Hydroxyurea is niet geïndiceerd voor de behandeling van HIV-infectie; als patiënten met een HIV-infectie echter worden behandeld met hydroxyureum, en in het bijzonder in combinatie met didanosine en/of stavudine, wordt nauwlettende controle op tekenen en symptomen van pancreatitis aanbevolen. Stop permanent met de behandeling met hydroxyurea bij patiënten die tekenen en symptomen van pancreatitis ontwikkelen.
Hepatotoxiciteit
Levertoxiciteit en leverfalen met de dood tot gevolg zijn gemeld tijdens postmarketingsurveillance bij patiënten met een hiv-infectie die werden behandeld met hydroxyurea en andere antiretrovirale geneesmiddelen. Fatale leveraandoeningen werden het vaakst gemeld bij patiënten die werden behandeld met de combinatie van hydroxyureum, didanosine en stavudine. Vermijd deze combinatie.
Perifere neuropathie
Perifere neuropathie, die in sommige gevallen ernstig was, is gemeld bij patiënten met een hiv-infectie die hydroxyurea kregen in combinatie met antiretrovirale geneesmiddelen, waaronder didanosine, met of zonder stavudine.
Interferentie laboratoriumtest
Interferentie met urinezuur-, ureum- of melkzuurassays
Studies hebben aangetoond dat er een analytische interferentie is van hydroxyureum met de enzymen (urease, uricase en lactaatdehydrogenase) die worden gebruikt bij de bepaling van ureum, urinezuur en melkzuur, waardoor de resultaten hiervan vals verhoogd zijn bij patiënten die met hydroxyureum worden behandeld.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Myelosuppressie
Hydroxyurea veroorzaakt ernstige myelosuppressie. Behandeling met hydroxyureum mag niet worden gestart als de beenmergfunctie duidelijk onderdrukt is. Beenmergsuppressie kan optreden en leukopenie is over het algemeen de eerste en meest voorkomende manifestatie. Trombocytopenie en anemie komen minder vaak voor en worden zelden gezien zonder voorafgaande leukopenie. Beenmergdepressie komt vaker voor bij patiënten die eerder radiotherapie of cytotoxische chemotherapeutische middelen tegen kanker hebben gekregen; gebruik hydroxyurea voorzichtig bij dergelijke patiënten.
Evalueer de hematologische status vóór en tijdens de behandeling met HYDREA. Bied ondersteunende zorg en pas de dosis aan of stop met HYDREA indien nodig. Herstel van myelosuppressie is gewoonlijk snel wanneer de therapie wordt onderbroken.
maligniteiten
Hydroxyurea is een kankerverwekkende stof voor de mens. Bij patiënten die langdurig hydroxyurea kregen voor myeloproliferatieve aandoeningen, is secundaire leukemie gemeld. Huidkanker is ook gemeld bij patiënten die langdurig hydroxyureum kregen. Adviseer bescherming tegen blootstelling aan de zon en controleer op de ontwikkeling van secundaire maligniteiten.
Embryo-foetale toxiciteit
Op basis van het werkingsmechanisme en de bevindingen bij dieren kan HYDREA 500 mg schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Hydroxyurea was embryotoxisch en teratogeen bij ratten en konijnen in doses van respectievelijk 0,8 maal en 0,3 maal de maximaal aanbevolen dagelijkse dosis voor mensen op basis van mg/m2. Adviseer zwangere vrouwen over het mogelijke risico voor een foetus [zie Gebruik bij specifieke populaties ].
Adviseer vrouwen in de vruchtbare leeftijd om effectieve anticonceptie te gebruiken tijdens en na de behandeling met HYDREA 500 mg gedurende ten minste 6 maanden na de behandeling. Adviseer mannen in de vruchtbare leeftijd om effectieve anticonceptie te gebruiken tijdens en na de behandeling met HYDREA 500 mg gedurende ten minste 1 jaar na de behandeling [zie Gebruik bij specifieke populaties ].

Vasculitische toxiciteit
Cutane vasculitische toxiciteiten, waaronder vasculitische ulceraties en gangreen, zijn opgetreden bij patiënten met myeloproliferatieve aandoeningen tijdens behandeling met hydroxyurea. Deze vasculitische toxiciteiten werden het vaakst gemeld bij patiënten met een voorgeschiedenis van, of die momenteel interferontherapie kregen. Als er vasculitis van de huid optreedt, start dan de behandeling en stop met HYDREA.
Levende vaccinaties
Vermijd het gebruik van levend vaccin bij patiënten die HYDREA gebruiken. Gelijktijdig gebruik van HYDREA met een levend virusvaccin kan de replicatie van het virus versterken en/of de bijwerking van het vaccin versterken, omdat normale afweermechanismen door HYDREA onderdrukt kunnen worden. Vaccinatie met levende vaccins bij een patiënt die HYDREA 500 mg krijgt, kan leiden tot een ernstige infectie. De antilichaamrespons van de patiënt op vaccins kan verminderd zijn. Overweeg overleg met een specialist.
Risico's bij gelijktijdig gebruik van antiretrovirale geneesmiddelen
Pancreatitis, hepatotoxiciteit en perifere neuropathie zijn opgetreden wanneer hydroxyurea gelijktijdig werd toegediend met antiretrovirale geneesmiddelen, waaronder didanosine en stavudine (zie DRUG-INTERACTIES ].
straling terugroepen
Patiënten die in het verleden bestralingstherapie hebben gekregen, kunnen een exacerbatie van erytheem na bestraling krijgen. Controleer op huiderytheem bij patiënten die eerder bestraling hebben gekregen en symptomatisch behandelen.
Macrocytose
HYDREA 500 mg kan macrocytose veroorzaken, die zelfbeperkend is, en wordt vaak vroeg in de behandeling gezien. De morfologische verandering lijkt op pernicieuze anemie, maar is niet gerelateerd aan vitamine B12- of foliumzuurdeficiëntie. Dit kan de diagnose pernicieuze anemie maskeren. Profylactische toediening van foliumzuur wordt aanbevolen.
Longtoxiciteit
Interstitiële longziekte waaronder longfibrose, longinfiltratie, pneumonitis en alveolitis/allergische alveolitis (inclusief fatale gevallen) zijn gemeld bij patiënten die werden behandeld voor myeloproliferatief neoplasma. Patiënten die koorts, hoesten, dyspnoe of andere ademhalingssymptomen ontwikkelen regelmatig controleren, onderzoeken en onmiddellijk behandelen. Stop met HYDREA 500 mg en behandel met corticosteroïden [zie ONGEWENSTE REACTIES ].
Interferentie laboratoriumtest
Interferentie met urinezuur-, ureum- of melkzuurassays is mogelijk, waardoor valselijk verhoogde resultaten hiervan worden verkregen bij patiënten die met hydroxyurea worden behandeld [zie DRUG-INTERACTIES ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen conventionele langetermijnstudies uitgevoerd om het carcinogene potentieel van hydroxyurea te evalueren. Intraperitoneale toediening van 125 tot 250 mg/kg hydroxyureum (ongeveer 0,6-1,2 keer de maximaal aanbevolen orale dagelijkse dosis voor de mens op basis van mg/m2) driemaal per week gedurende 6 maanden aan vrouwelijke ratten verhoogde de incidentie van borsttumoren bij ratten die nog in leven waren tot 18 maanden vergeleken met de controle. Hydroxyurea is in vitro mutageen voor bacteriën, schimmels, protozoa en zoogdiercellen. Hydroxyurea is clastogeen in vitro (hamstercellen, humane lymfoblasten) en in vivo (SCE-test bij knaagdieren, micronucleus-test bij muizen). Hydroxyurea veroorzaakt de transformatie van knaagdierembryocellen naar een tumorverwekkend fenotype.
Hydroxyurea toegediend aan mannelijke ratten in een dosis van 60 mg/kg/dag (ongeveer 0,3 maal de maximaal aanbevolen dagelijkse dosis voor de mens op basis van mg/m2) veroorzaakte testiculaire atrofie, verminderde spermatogenese en verminderde hun vermogen om vrouwtjes te impregneren aanzienlijk.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
HYDREA kan schade aan de foetus veroorzaken op basis van bevindingen uit dierstudies en het werkingsmechanisme van het medicijn [zie KLINISCHE FARMACOLOGIE ]. Er zijn geen gegevens over het gebruik van HYDREA bij zwangere vrouwen om een geneesmiddelgeassocieerd risico te informeren. In reproductiestudies bij dieren veroorzaakte toediening van hydroxyureum aan drachtige ratten en konijnen tijdens de organogenese embryotoxische en teratogene effecten bij doses van respectievelijk 0,8 maal en 0,3 maal de maximaal aanbevolen dagelijkse dosis voor de mens op basis van mg/m2 (zie Gegevens ). Adviseer vrouwen over het mogelijke risico voor een foetus en om te voorkomen dat u zwanger wordt tijdens de behandeling met HYDREA.
In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2%–4% en 15%–20%.
Gegevens
Dierlijke gegevens
Hydroxyurea is een krachtig teratogeen gebleken in een grote verscheidenheid aan diermodellen, waaronder muizen, hamsters, katten, miniatuurvarkens, honden en apen in doses die binnen het 1-voudige van de dosis voor de mens zijn gegeven op basis van mg/m2. Hydroxyurea is embryotoxisch en veroorzaakt foetale misvormingen (gedeeltelijk verbeende schedelbeenderen, afwezigheid van oogkassen, hydrocefalie, bipartiete sternebrae, ontbrekende lendenwervels) bij 180 mg/kg/dag (ongeveer 0,8 maal de maximaal aanbevolen dagelijkse dosis voor mensen op basis van mg/m2) bij ratten en bij 30 mg/kg/dag (ongeveer 0,3 maal de maximaal aanbevolen dagelijkse dosis voor de mens op basis van mg/m2) bij konijnen. Embryotoxiciteit werd gekenmerkt door verminderde foetale levensvatbaarheid, verminderde grootte van levende nesten en ontwikkelingsachterstanden. Hydroxyurea passeert de placenta. Enkelvoudige doses van ≥375 mg/kg (ongeveer 1,7 maal de maximaal aanbevolen dagelijkse dosis voor de mens op basis van mg/m2) aan ratten veroorzaakten groeiachterstand en verminderd leervermogen.
Borstvoeding
Risico Samenvatting
Hydroxyurea wordt uitgescheiden in de moedermelk. Vanwege het potentieel voor ernstige bijwerkingen van hydroxyurea bij een zuigeling die borstvoeding krijgt, waaronder carcinogeniteit, moet de borstvoeding worden gestaakt tijdens de behandeling met HYDREA.
Vrouwtjes en mannetjes met reproductief potentieel
Zwangerschapstesten
Controleer de zwangerschapsstatus van vruchtbare vrouwen voordat de behandeling met HYDREA wordt gestart.
anticonceptie
vrouwen
HYDREA kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw [zie Zwangerschap ]. Adviseer vrouwen in de vruchtbare leeftijd om effectieve anticonceptie te gebruiken tijdens en na de behandeling met HYDREA gedurende ten minste 6 maanden na de behandeling. Adviseer vrouwen om zwangerschap onmiddellijk te melden.
mannen
HYDREA 500 mg kan spermatozoa en testikelweefsel beschadigen, wat kan leiden tot mogelijke genetische afwijkingen. Mannen met vruchtbare seksuele partners moeten effectieve anticonceptie gebruiken tijdens en na de behandeling met HYDREA 500 mg gedurende ten minste 1 jaar na de behandeling [zie Niet-klinische toxicologie ].
Onvruchtbaarheid
mannen
Op basis van bevindingen bij dieren en mensen kan de mannelijke vruchtbaarheid worden aangetast door behandeling met HYDREA. Azoöspermie of oligospermie, soms reversibel, is waargenomen bij mannen. Informeer mannelijke patiënten over de mogelijkheid van spermaconservering vóór aanvang van de therapie [zie ONGEWENSTE REACTIES en Niet-klinische toxicologie ].
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Oudere patiënten kunnen gevoeliger zijn voor de effecten van hydroxyureum en kunnen een lager doseringsschema nodig hebben. Hydroxyurea wordt uitgescheiden door de nieren en het risico op bijwerkingen van dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren [zie DOSERING EN ADMINISTRATIE ].
Nierfunctiestoornis
De blootstelling aan hydroxyureum is hoger bij patiënten met een creatinineklaring van minder dan 60 ml/min of bij patiënten met terminale nierziekte (ESRD). Verlaag de dosering en houd de hematologische parameters nauwlettend in de gaten wanneer HYDREA 500 mg aan deze patiënten moet worden toegediend [zie DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
Er zijn geen gegevens die specifieke richtlijnen voor dosisaanpassing bij patiënten met leverinsufficiëntie ondersteunen. Bij deze patiënten wordt nauwlettende controle van de hematologische parameters geadviseerd.
OVERDOSERING
Acute mucocutane toxiciteit is gemeld bij patiënten die hydroxyurea kregen in doseringen die meerdere malen hoger waren dan de therapeutische dosis. Pijn, violet erytheem, oedeem op handpalmen en voetzolen gevolgd door schilfering van handen en voeten, ernstige gegeneraliseerde hyperpigmentatie van de huid en stomatitis zijn ook waargenomen.
CONTRA-INDICATIES
HYDREA 500 mg is gecontra-indiceerd bij patiënten die een eerdere overgevoeligheid voor hydroxyurea of een ander bestanddeel van de formulering hebben aangetoond.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het precieze mechanisme waarmee hydroxyurea zijn antineoplastische effecten teweegbrengt, kan op dit moment niet worden beschreven. De rapporten van verschillende onderzoeken naar weefselkweek bij ratten en mensen ondersteunen echter de hypothese dat hydroxyureum een onmiddellijke remming van de DNA-synthese veroorzaakt door te werken als een ribonucleotide-reductaseremmer, zonder de synthese van ribonucleïnezuur of eiwit te verstoren. Deze hypothese verklaart waarom hydroxyureum onder bepaalde omstandigheden teratogene effecten kan veroorzaken.
Er zijn drie werkingsmechanismen gepostuleerd voor de verhoogde effectiviteit van gelijktijdig gebruik van hydroxyureumtherapie met bestraling van plaveiselcelcarcinomen (epidermoïde) van het hoofd en de nek. In vitro-onderzoeken met Chinese hamstercellen suggereren dat hydroxyureum (1) dodelijk is voor normaal radioresistente cellen in het S-stadium, en (2) andere cellen van de celcyclus in het G1- of pre-DNA-synthesestadium houdt waar ze het meest vatbaar zijn voor de effecten van bestraling. Het derde werkingsmechanisme is getheoretiseerd op basis van in vitro studies van HeLa-cellen. Het lijkt erop dat hydroxyureum, door remming van de DNA-synthese, het normale herstelproces van cellen die door bestraling zijn beschadigd maar niet gedood, belemmert, waardoor hun overlevingspercentage afneemt; RNA- en eiwitsynthese hebben geen verandering laten zien.
Farmacokinetiek
Absorptie
Na orale toediening van HYDREA bereikt hydroxyureum de piekplasmaconcentraties in 1 tot 4 uur. De gemiddelde piekplasmaconcentraties en AUC's stijgen meer dan evenredig met de dosisverhoging.
Er zijn geen gegevens over het effect van voedsel op de absorptie van hydroxyureum.
Verdeling
Hydroxyurea wordt door het lichaam gedistribueerd met een distributievolume dat het totale lichaamswater benadert.
Hydroxyurea concentreert zich in leukocyten en erytrocyten.
Metabolisme
Tot 60% van een orale dosis wordt omgezet via een verzadigbaar levermetabolisme en een kleine afbraakroute door urease die wordt aangetroffen in darmbacteriën.
uitscheiding
Bij patiënten met sikkelcelanemie was de gemiddelde cumulatieve terugwinning van hydroxyureum in de urine ongeveer 40% van de toegediende dosis.
Specifieke populaties
Nierfunctiestoornis
Het effect van nierinsufficiëntie op de farmacokinetiek van hydroxyureum werd beoordeeld bij volwassen patiënten met sikkelcelziekte en nierinsufficiëntie. Patiënten met een normale nierfunctie (creatinineklaring [CrCl] >80 ml/min), licht (CrCl 50-80 ml/min), matig (CrCl = 30-60 ml/min). Verlaag de dosis HYDREA 500 mg wanneer het wordt toegediend aan patiënten met een creatinineklaring van DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
PATIËNT INFORMATIE
- Er bestaat een risico op myelosuppressie. Het wekelijks controleren van het bloedbeeld tijdens de duur van de behandeling moet worden benadrukt bij patiënten die HYDREA gebruiken [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Adviseer patiënten om tekenen en symptomen van infectie of bloeding onmiddellijk te melden.
- Adviseer patiënten dat er een risico is op cutane vasculitische toxiciteiten en secundaire maligniteiten, waaronder leukemie en huidkanker [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Adviseer vrouwen met reproductief vermogen over het potentiële risico voor een foetus en informeer hun zorgverlener over een bekende of vermoede zwangerschap. Adviseer vrouwen en mannen van reproductief vermogen om anticonceptie te gebruiken tijdens en na de behandeling met HYDREA [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
- Adviseer patiënten om hun zorgverlener te informeren als ze vaccinaties hebben gekregen of van plan zijn te krijgen terwijl ze HYDREA 500 mg gebruiken, omdat dit kan leiden tot een ernstige infectie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Adviseer vrouwen om te stoppen met borstvoeding tijdens de behandeling met HYDREA [zie Gebruik bij specifieke populaties ].
- Patiënten met een HIV-infectie moeten contact opnemen met hun arts voor tekenen en symptomen van pancreatitis, leveraandoeningen en perifere neuropathie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Erytheem na bestraling kan optreden bij patiënten die eerder bestralingstherapie hebben gekregen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Adviseer patiënten over de symptomen van mogelijke pulmonale toxiciteit en instrueer hen om onmiddellijk medische hulp in te roepen in het geval van koorts, hoesten, kortademigheid of andere ademhalingssymptomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
