Casodex 50mg Bicalutamide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Casodex en hoe wordt het gebruikt?
Casodex is een receptgeneesmiddel dat wordt gebruikt om de symptomen van prostaatkanker te behandelen. Casodex 50 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Casodex 50 mg behoort tot een klasse geneesmiddelen die antineoplastics, anti-androgeen worden genoemd; CYP3A4-remmer, matig.
Het is niet bekend of Casodex veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Casodex?
Casodex kan ernstige bijwerkingen veroorzaken, waaronder:
- pijn in de borst of zwelling,
- bloed in uw urine,
- koorts,
- rillingen,
- plotselinge pijn op de borst of ongemak,
- piepende ademhaling,
- droge hoest,
- kortademigheid,
- bleke huid,
- duizeligheid,
- snelle hartslag,
- moeite met concentreren,
- misselijkheid,
- pijn in de bovenbuik,
- zich moe voelen,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- verhoogde dorst,
- meer plassen,
- honger,
- droge mond,
- fruitige ademgeur,
- slaperigheid,
- droge huid,
- wazig zien, en
- gewichtsverlies
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Casodex 50 mg zijn:
- opvliegers,
- pijn in je rug,
- bekkenpijn,
- buikpijn,
- zwelling in uw handen, enkels of voeten,
- meer plassen 's nachts,
- zwakheid,
- duizeligheid,
- misselijkheid,
- diarree, en
- constipatie
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Casodex. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
CASODEX® (bicalutamide) tabletten bevatten 50 mg bicalutamide, een niet-steroïde androgeenreceptorremmer zonder andere bekende endocriene activiteit. De chemische naam is propaanamide, N [4 cyano-3-(trifluormethyl)fenyl]-3-[(4-fluorfenyl)sulfonyl]-2-hydroxy-2-methyl-,(+-). De structurele en empirische formules zijn:
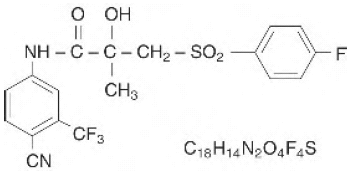
Bicalutamide heeft een molecuulgewicht van 430,37. De pKa' is ongeveer 12. Bicalutamide is een fijn wit tot gebroken wit poeder dat praktisch onoplosbaar is in water bij 37°C (5 mg per 1000 ml), slecht oplosbaar in chloroform en absolute ethanol, matig oplosbaar in methanol en oplosbaar in aceton en tetrahydrofuran.
CASODEX is een racemaat waarvan de anti-androgene activiteit bijna uitsluitend wordt vertoond door het R-enantiomeer van bicalutamide; het S-enantiomeer is in wezen inactief.
De inactieve ingrediënten van CASODEX 50 mg tabletten zijn lactose, magnesiumstearaat, hypromellose, polyethyleenglycol, polyvidon, natriumzetmeelglycolaat en titaniumdioxide.
INDICATIES
CASODEX 50 mg per dag is geïndiceerd voor gebruik in combinatietherapie met een luteïniserend hormoon-releasing hormoon (LHRH) analoog voor de behandeling van stadium D2 gemetastaseerd prostaatcarcinoom.
CASODEX 150 mg per dag is niet goedgekeurd voor gebruik alleen of met andere behandelingen [zie Klinische studies ].
DOSERING EN ADMINISTRATIE
Aanbevolen dosis en schema
De aanbevolen dosis voor een behandeling met CASODEX 50 mg in combinatie met een LHRH-analoog is één tablet van 50 mg eenmaal daags (ochtend of avond), met of zonder voedsel. Het wordt aanbevolen om CASODEX 50 mg elke dag op hetzelfde tijdstip in te nemen. De behandeling met CASODEX moet tegelijk met de behandeling met een LHRH-analoog worden gestart. Als een dosis CASODEX 50 mg is vergeten, neem dan de volgende dosis op het geplande tijdstip. Neem de gemiste dosis niet in en verdubbel de volgende dosis niet.
Dosisaanpassing bij nierinsufficiëntie
Er is geen dosisaanpassing nodig voor patiënten met nierinsufficiëntie [zie: Gebruik bij specifieke populaties ].
Dosisaanpassing bij leverinsufficiëntie
Er is geen dosisaanpassing nodig voor patiënten met een lichte tot matige leverfunctiestoornis. Bij patiënten met een ernstige leverfunctiestoornis (n=4), hoewel er een toename was van 76% in de halfwaardetijd (respectievelijk 5,9 en 10,4 dagen voor normale en gestoorde patiënten) van de actieve enantiomeer van bicalutamide, is geen dosisaanpassing nodig [ zien Gebruik bij specifieke populaties ].
HOE GELEVERD
Doseringsvormen en sterkte
CASODEX® (bicalutamide) 50 mg tabletten voor orale toediening.
Witte, filmomhulde tabletten (aan de ene kant geïdentificeerd met "CDX50" en aan de andere kant met het "CASODEX-logo") worden geleverd in eenheidsdosisflessen van 30 tabletten (0310-0705-30).
Opslag en behandeling
Bewaren bij een gecontroleerde kamertemperatuur, 20°-25°C (68°-77°F).
Gefabriceerd voor: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Herzien: maart 2017.
BIJWERKINGEN
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Ervaring met klinische proeven
Bij patiënten met gevorderde prostaatkanker die werden behandeld met CASODEX 50 mg in combinatie met een LHRH-analoog, was de meest voorkomende bijwerking opvliegers (53%).
In het multicenter, dubbelblinde, gecontroleerde klinische onderzoek waarin CASODEX 50 mg eenmaal daags werd vergeleken met flutamide 250 mg driemaal daags, elk in combinatie met een LHRH-analoog, werden de volgende bijwerkingen met een incidentie van 5% of meer, ongeacht causaliteit, zijn gemeld.
Andere bijwerkingen (groter dan of gelijk aan 2%, maar minder dan 5%) gemeld in de CASODEX-LHRH-analoogbehandelingsgroep worden hieronder vermeld per lichaamssysteem en zijn in volgorde van afnemende frequentie binnen elk lichaamssysteem, ongeacht de causaliteit.
Lichaam als geheel: Neoplasma; Nek pijn; Koorts; Rillingen; sepsis; Hernia; cyste
Cardiovasculair: Angina Pectoris; Congestief hartfalen; Myocardinfarct; Hartstilstand; Coronaire hartziekte; Syncope
spijsvertering: Melena; Rectale bloeding; Droge mond; dysfagie; Gastro-intestinale stoornis; Parodontaal abces; Gastro-intestinaal carcinoom
Metabool en voedingswaarde: Oedeem; BUN Verhoogd; Creatinine verhoogd; uitdroging; Jicht; hypercholesteremie
Musculoskeletaal: Spierpijn; Beenkrampen
Zenuwachtig: hypertonie; Verwardheid; Slaperigheid; Libido verminderd; neuropathie; Nervositeit
Ademhaling: Longaandoening; Astma; Epistaxis; sinusitis
Huid en aanhangsels: Droge huid; alopecia; jeuk; herpes zoster; Huidcarcinoom; Huid aandoening
Speciale zintuigen: Cataract gespecificeerd
Urogenitaal: dysurie; Urinaire urgentie; Hydronefrose; Urinewegaandoening
Abnormale laboratoriumtestwaarden:
Laboratoriumafwijkingen waaronder: verhoogde AST, ALT, bilirubine, BUN en creatinine; en verlaagd aantal hemoglobine en witte bloedcellen, zijn gemeld bij zowel patiënten behandeld met CASODEX-LHRH-analoog als behandeld met flutamide-LHRH-analoog.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van CASODEX na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Ademhalingsstoornissen: Interstitiële longziekte (sommige fataal) inclusief interstitiële pneumonitis en longfibrose, meestal bij doses hoger dan 50 mg.
Huid- en onderhuidaandoeningen: lichtgevoeligheid
DRUG-INTERACTIES
Klinische studies hebben geen geneesmiddelinteracties aangetoond tussen bicalutamide en LHRH-analogen (gosereline of leuprolide). Er is geen bewijs dat bicalutamide leverenzymen induceert.
In vitro-onderzoeken hebben aangetoond dat R-bicalutamide een remmer van CYP 3A4 is met minder remmende effecten op de activiteit van CYP 2C9, 2C19 en 2D6. Klinische onderzoeken hebben aangetoond dat bij gelijktijdige toediening van CASODEX de gemiddelde midazolamspiegels (een CYP 3A4-substraat) 1,5-voudig (voor Cmax) en 1,9-voudig (voor AUC) kunnen toenemen. Daarom is voorzichtigheid geboden wanneer CASODEX 50 mg gelijktijdig wordt toegediend met CYP 3A4-substraten.
In vitro eiwitbindingsonderzoeken hebben aangetoond dat bicalutamide cumarine-anticoagulantia van bindingsplaatsen kan verdringen. De protrombinetijd moet nauwlettend worden gecontroleerd bij patiënten die al cumarine-anticoagulantia krijgen en die beginnen met CASODEX 50 mg, en aanpassing van de dosis anticoagulantia kan nodig zijn.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Hepatitis
Gevallen van overlijden of ziekenhuisopname als gevolg van ernstig leverletsel (leverfalen) zijn postmarketing gemeld in verband met het gebruik van CASODEX. Levertoxiciteit in deze rapporten trad in het algemeen op binnen de eerste drie tot vier maanden van de behandeling. Hepatitis of duidelijke verhogingen van leverenzymen die leidden tot stopzetting van het geneesmiddel kwamen voor bij ongeveer 1% van de CASODEX-patiënten in gecontroleerde klinische onderzoeken.
De serumtransaminasespiegels moeten worden gemeten voordat de behandeling met CASODEX wordt gestart, met regelmatige tussenpozen gedurende de eerste vier maanden van de behandeling en daarna periodiek. Als zich klinische symptomen of tekenen voordoen die wijzen op leverdisfunctie (bijv. misselijkheid, braken, buikpijn, vermoeidheid, anorexia, "griepachtige" symptomen, donkere urine, geelzucht of gevoeligheid van het rechter bovenste kwadrant), de serumtransaminasen, in het bijzonder de serum ALT, moet onmiddellijk worden gemeten. Als een patiënt op enig moment geelzucht heeft, of als zijn ALT boven twee keer de bovengrens van de normaalwaarde stijgt, moet CASODEX onmiddellijk worden stopgezet met nauwgezette follow-up van de leverfunctie.
Gynaecomastie en pijn in de borst
In klinische onderzoeken met CASODEX 150 mg als monotherapie voor prostaatkanker zijn gynaecomastie en borstpijn gemeld bij respectievelijk maximaal 38% en 39% van de patiënten.
Glucosetolerantie
Een verlaging van de glucosetolerantie is waargenomen bij mannen die LHRH-agonisten kregen. Dit kan zich manifesteren als diabetes of verlies van glykemische controle bij mensen met reeds bestaande diabetes. Daarom moet worden overwogen om de bloedglucose te controleren bij patiënten die CASODEX 50 mg krijgen in combinatie met LHRH-agonisten.
Laboratorium testen
Regelmatige beoordelingen van serum prostaatspecifiek antigeen (PSA) kunnen nuttig zijn bij het controleren van de reactie van de patiënt. Als de PSA-spiegels stijgen tijdens de behandeling met CASODEX 50 mg, moet de patiënt worden beoordeeld op klinische progressie. Voor patiënten met objectieve progressie van de ziekte samen met een verhoogde PSA, kan een behandelingsvrije periode van antiandrogeen worden overwogen, terwijl de LHRH-analoog wordt voortgezet.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Dosis en schema
Informeer patiënten dat de therapie met CASODEX 50 mg en de LHRH-analoog tegelijkertijd moet worden gestart en dat ze deze medicijnen niet mogen onderbreken of stoppen zonder hun zorgverlener te raadplegen [zie DOSERING EN ADMINISTRATIE ].
Hepatitis
Informeer patiënten dat CASODEX hepatitis kan veroorzaken, wat kan leiden tot leverfalen en overlijden. Adviseer patiënten dat leverfunctietests regelmatig moeten worden gecontroleerd tijdens de behandeling en om tekenen en symptomen van hepatitis te melden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Glucosetolerantie
Informeer patiënten dat diabetes of verlies van glykemische controle bij patiënten met reeds bestaande diabetes is gemeld tijdens behandeling met LHRH-agonisten. Daarom moet worden overwogen om de bloedglucose te controleren bij patiënten die CASODEX krijgen in combinatie met LHRH-agonisten [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Slaperigheid
Tijdens de behandeling met CASODEX is slaperigheid gemeld. Adviseer patiënten die dit symptoom ervaren om voorzichtig te zijn bij het autorijden of het bedienen van machines [zie: ONGEWENSTE REACTIES ].
lichtgevoeligheid
Informeer patiënten dat er gevallen van fotosensitiviteit zijn gemeld tijdens de behandeling met CASODEX en dat ze directe blootstelling aan overmatig zonlicht of blootstelling aan UV-licht moeten vermijden. Het gebruik van zonnebrandcrème moet worden overwogen [zie ONGEWENSTE REACTIES ].
Anticonceptie en vruchtbaarheid
Adviseer mannelijke patiënten met vrouwelijke partners in de vruchtbare leeftijd om effectieve anticonceptie te gebruiken tijdens de behandeling en gedurende 130 dagen na de laatste dosis CASODEX 50 mg-therapie. Adviseer mannelijke patiënten dat CASODEX de vruchtbaarheid kan schaden [zie: Gebruik bij specifieke populaties ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn twee jaar durende orale carcinogeniteitsonderzoeken uitgevoerd bij zowel mannelijke als vrouwelijke ratten en muizen in doses van 5, 15 of 75 mg/kg/dag bicalutamide. Er werd een verscheidenheid aan effecten op de doelorganen van tumoren geïdentificeerd en deze werden toegeschreven aan de anti-androgene werking van bicalutamide, namelijk goedaardige interstitiële (Leydig) celtumoren van de testikels bij mannelijke ratten bij alle dosisniveaus (de steady-state plasmaconcentratie met de 5 mg/kg/dag dosis is ongeveer 0,7 keer de menselijke blootstelling bij de aanbevolen dosis) en baarmoederadenocarcinoom bij vrouwelijke ratten bij 75 mg/kg/dag (ongeveer 1,5 keer de menselijke blootstelling bij de aanbevolen dosis). Er zijn geen aanwijzingen voor Leydig-celhyperplasie bij patiënten; baarmoedertumoren zijn niet relevant voor de geïndiceerde patiëntenpopulatie.
Een kleine toename van de incidentie van hepatocellulair carcinoom bij mannelijke muizen die 75 mg/kg/dag bicalutamide kregen (ongeveer 4 keer de menselijke blootstelling bij de aanbevolen dosis) en een verhoogde incidentie van goedaardige adenomen van folliculaire schildkliercellen bij ratten die 5 mg/kg kregen /dag (ongeveer 0,7 keer de menselijke blootstelling bij de aanbevolen dosis) en hoger werden geregistreerd. Deze neoplastische veranderingen waren progressies van niet-neoplastische veranderingen gerelateerd aan de inductie van leverenzymen, waargenomen in toxiciteitsstudies bij dieren. Er is geen enzyminductie waargenomen na toediening van bicalutamide bij de mens. Er waren geen tumorverwekkende effecten die wijzen op genotoxische carcinogenese.
Een uitgebreide reeks zowel in vitro als in vivo genotoxiciteitstesten (gistgenconversie, Ames, E. coli, CHO/HGPRT, cytogenetische tests op menselijke lymfocyten, micronucleus bij muizen en cytogenetische beenmergonderzoeken bij ratten) heeft aangetoond dat bicalutamide geen genotoxische activiteit heeft. .
In toxicologische onderzoeken met herhaalde doses is bij alle onderzochte soorten atrofie van de tubuli seminiferi van de testikels waargenomen, wat een voorspeld klasse-effect is met antiandrogenen. In het 6 en 12 maanden durende onderzoek bij ratten werd testiculaire atrofie gezien bij ongeveer 2 keer de menselijke blootstelling bij de aanbevolen dosis. In de 12 maanden durende hondenstudie werd de incidentie van testiculaire atrofie gezien bij ongeveer 7 keer de menselijke blootstelling bij de aanbevolen dosis. Bij mannelijke ratten die 250 mg/kg/dag kregen toegediend (ongeveer 2 maal de menselijke blootstelling in de aanbevolen dosis), waren het precoïtale interval en de tijd tot succesvolle paring verlengd bij de eerste paring, maar er werden geen effecten op de vruchtbaarheid na succesvolle paring waargenomen. Deze effecten waren 7 weken na het einde van een doseringsperiode van 11 weken ongedaan gemaakt.
Vrouwelijke ratten die werden gedoseerd met 1, 10 en 250 mg/kg/dag (minder dan tot 2 maal de menselijke blootstelling bij de aanbevolen dosis) hadden een verhoogde onregelmatigheid van de oestrische cyclus, maar er was geen effect op de vruchtbaarheid.
In een peri- en postnatale ontwikkelingsstudie hadden vrouwelijke nakomelingen van ratten die doses van 10 mg/kg/dag (ongeveer 0,7 keer de menselijke blootstelling bij de aanbevolen klinische dosis) en hoger kregen, verminderde zwangerschapspercentages. Toediening van bicalutamide aan drachtige vrouwtjes resulteerde in feminisering van de mannelijke nakomelingen, wat leidde tot hypospadie bij doses van 10 mg/kg/dag (ongeveer 0,7 maal de menselijke blootstelling bij de aanbevolen dosis) en hoger. Aangetaste mannelijke nakomelingen waren ook impotent.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
CASODEX is gecontra-indiceerd voor gebruik bij zwangere vrouwen omdat het schade aan de foetus kan veroorzaken. CASODEX 50 mg is niet geïndiceerd voor gebruik bij vrouwen. Er zijn geen gegevens bij de mens over het gebruik van CASODEX 50 mg bij zwangere vrouwen. In reproductiestudies bij dieren veroorzaakte orale toediening van bicalutamide aan drachtige ratten tijdens de organogenese een abnormale ontwikkeling van de voortplantingsorganen bij mannelijke foetussen bij blootstellingen van ongeveer 0,7 tot 2 maal de blootstelling bij de mens bij de aanbevolen dosis (zie Gegevens ).
Gegevens
Dierlijke gegevens
In een embryo-foetale ontwikkelingsstudie bij zwangere ratten die werden gedoseerd tijdens de periode van organogenese vanaf dag 6-15 van de dracht, hadden mannelijke foetussen een verminderde anogenitale afstand bij doses van 10 mg/kg/dag en hoger (ongeveer 0,7 tot 2 keer de menselijke blootstelling bij de aanbevolen dosis).
In een pre- en postnatale ontwikkelingsstudie kregen vrouwelijke ratten een dosis vanaf dag 7-16 van de dracht en mochten ze strooien en hun nakomelingen grootbrengen tot ze spenen . Er werd waargenomen dat mannelijke nakomelingen van ratten die doses van 10 mg/kg/dag kregen (ongeveer 0,7 keer de menselijke blootstelling bij de aanbevolen dosis) en hoger, een verminderde anogenitale afstand hadden.
In een peri- en postnatale ontwikkelingsstudie werden vrouwelijke ratten gedoseerd vanaf dag 16 van de dracht tot dag 22 van lactatie en mochten ze strooien en hun nakomelingen grootbrengen tot ze spenen. Overleving en gewicht van nakomelingen tijdens de lactatie waren verminderd voor nesten van maternale ratten die doses van 250 mg/kg/dag kregen (ongeveer 2 keer de menselijke blootstelling bij de aanbevolen dosis). Bij mannelijke nakomelingen van ratten die doses van 10 mg/kg/dag (ongeveer 0,7 keer de menselijke blootstelling bij de aanbevolen dosis) en hoger kregen, werd waargenomen dat ze een verminderde anogenitale afstand, kleinere secundaire geslachtsorganen, cryptorchidisme en hypospadie hadden, resulterend in een onvermogen om te paren en hun vrouwelijke partners zwanger maken. Vrouwelijke nakomelingen van ratten die doses van 10 mg/kg/dag kregen (ongeveer 0,7 keer de blootstelling bij de mens bij de aanbevolen dosis) en hoger, hadden verminderde zwangerschapspercentages.
Borstvoeding
Risico Samenvatting
CASODEX 50 mg is niet geïndiceerd voor gebruik bij zwangere vrouwen. Er is geen informatie beschikbaar over de aanwezigheid van bicalutamide in moedermelk, of over de effecten op de zuigeling die borstvoeding krijgt of op de melkproductie. Bicalutamide is aangetroffen in rattenmelk.
Vrouwtjes en mannetjes met reproductief potentieel
anticonceptie
mannen
Antiandrogeentherapie kan morfologische veranderingen in spermatozoa veroorzaken [zie Niet-klinische toxicologie ]. Op basis van bevindingen in reproductiestudies bij dieren en het werkingsmechanisme, adviseer mannelijke patiënten met vrouwelijke partners van reproductief vermogen om effectieve anticonceptie te gebruiken tijdens de behandeling en gedurende 130 dagen na de laatste dosis CASODEX (zie Zwangerschap en KLINISCHE FARMACOLOGIE ].
Onvruchtbaarheid
mannen

Gebaseerd op dierstudies kan CASODEX 50 mg leiden tot remming van de spermatogenese en kan het de vruchtbaarheid bij mannen met reproductief vermogen verminderen. De langetermijneffecten van CASODEX 50 mg op de mannelijke vruchtbaarheid zijn niet onderzocht [zie: Niet-klinische toxicologie ].
Pediatrisch gebruik
De veiligheid en werkzaamheid van CASODEX 50 mg bij pediatrische patiënten zijn niet vastgesteld.
CASODEX (bicalutamide) orodispergeerbare tablet werd onderzocht in combinatie met ARIMIDEX (anastrozol) orodispergeerbare tablet in een open-label, niet-vergelijkend, multicenter onderzoek waarin de werkzaamheid en veiligheid van dit combinatieregime gedurende 12 maanden werd beoordeeld bij de behandeling van gonadotropine-onafhankelijke vroegrijpe puberteit bij jongens met familiale, mannelijk beperkte vroegrijpe puberteit, ook bekend als testotoxicose. Patiënten werden in het onderzoek opgenomen als ze een baseline-leeftijd van ≥ 2 jaar hadden en een diagnose van testotoxicose hadden op basis van klinische kenmerken van progressieve vroegtijdige puberteit, symmetrische testiculaire vergroting, gevorderde botleeftijd, puberale spiegels van serumtestosteron, prepuberaal patroon van gonadotropinesecretie na een GnRH-stimulatietest en afwezigheid van andere klinische en biochemische oorzaken van een teveel aan testosteron. Dertien van de 14 patiënten die deelnamen, voltooiden 12 maanden combinatiebehandeling (één patiënt ging verloren voor follow-up). Als centrale vroegtijdige puberteit (CPP) zich ontwikkelde, moest een LHRH-analoog worden toegevoegd. Vier patiënten werden gediagnosticeerd met CPP tijdens de 12 maanden durende studie en kregen een LHRH-analoge behandeling en 2 bijkomende patiënten werden gediagnosticeerd aan het einde van de 12 maanden en kregen daarna een behandeling. De gemiddelde ± SD-kenmerken bij baseline waren als volgt: chronologische leeftijd: 3,9 ± 1,9 jaar; botleeftijd 8,8 ± 2,5; verhouding botleeftijd/chronologische leeftijd: 2,06 ± 0,51; groeisnelheid (cm/jr): 10,81 ± 4,22; groeisnelheid standaarddeviatiescore (SDS): 0,41 ± 1,36.
De startdosering CASODEX was 12,5 mg. CASODEX werd bij elke patiënt getitreerd totdat de steady-state R-bicalutamide (de actieve isomeer van bicalutamide) dalplasmaconcentratie 5-15 mcg/ml bereikte, wat het bereik van therapeutische concentraties is dat wordt bereikt bij volwassenen met prostaatkanker na toediening van de huidige goedgekeurde CASODEX-dosis van 50 mg. De dagelijkse startdosering van anastrozol was 0,5 mg. Anastrozol werd bij elke patiënt onafhankelijk getitreerd totdat het bij steady-state een serumoestradiolconcentratie van
De primaire werkzaamheidsanalyse van het onderzoek was het beoordelen van de verandering in groeisnelheid na 12 maanden behandeling, ten opzichte van de groeisnelheid gedurende de ≥ 6 maanden voorafgaand aan deelname aan het onderzoek. De groeipercentages van vóór de studie werden retrospectief verkregen. Er was geen statistisch bewijs dat de groeisnelheid tijdens de behandeling was verminderd. Tijdens behandeling met CASODEX/ARIMIDEX nam de gemiddelde groeisnelheid (cm/jaar) af met 1,6 cm/jaar, 95% BI (-4,7 tot 1,5) p=0,28; de gemiddelde groeisnelheid SDS daalde met 0,1 SD, 95% BI (-1,2 tot 1,0) p=0,88. Tabel 2 toont beschrijvende gegevens voor groeisnelheden voor de totale populatie en voor subgroepen gedefinieerd door voorgeschiedenis van eerdere behandeling voor testotoxicose met ketoconazol, spironolacton, anastrozol of andere aromataseremmers.
De totale testosteronconcentraties stegen met gemiddeld 5 mmol/L gedurende de 12 maanden van behandeling vanaf een baseline gemiddelde van 10 mmol/L. Estradiolconcentraties waren op of onder het kwantificatieniveau (9,81 pmol/L) voor 11 van de 12 patiënten na 12 maanden behandeling. Zes van de 12 patiënten begonnen met de behandeling bij een estradiolconcentratie onder het kwantificeringsniveau.
Er waren geen sterfgevallen, ernstige bijwerkingen of stopzettingen als gevolg van bijwerkingen tijdens het onderzoek. Van de 14 patiënten die werden blootgesteld aan onderzoeksbehandeling, ondervonden 13 (92,9%) ten minste één bijwerking. De meest frequent gemelde (>3 patiënten) bijwerkingen waren gynaecomastie (7/14, 50%), centrale vroegtijdige puberteit (6/14, 43%), braken (5/14, 36%), hoofdpijn (3/14, 21%), koorts (3/14, 21%) en infectie van de bovenste luchtwegen (3/14, 21%). Bijwerkingen die door onderzoekers mogelijk verband hielden met bicalutamide waren gynaecomastie (6/14, 43%), centrale vroegtijdige puberteit (2/14, 14%), gevoelige borsten (2/14, 14%), pijn in de borst (1/14, 7%), asthenie (1/14, 7%), verhoogde alanineaminotransferase [ALT] (1/14, 7%), verhoogde aspartaataminotransferase [AST] (1/14, 7%) en musculoskeletale pijn op de borst (1 /14, 7%). Hoofdpijn was de enige bijwerking die door onderzoekers mogelijk verband hield met anastrozol. Voor de patiënt die verhoogde ALAT en ASAT ontwikkelde, was de verhoging
Geriatrisch gebruik
In twee onderzoeken bij patiënten die dagelijks 50 of 150 mg kregen, is geen significant verband aangetoond tussen leeftijd en steady-state-spiegels van totaal bicalutamide of het actieve R-enantiomeer.
Leverfunctiestoornis
CASODEX moet met voorzichtigheid worden gebruikt bij patiënten met een matige tot ernstige leverfunctiestoornis. CASODEX wordt uitgebreid gemetaboliseerd door de lever. Beperkte gegevens bij proefpersonen met een ernstige leverfunctiestoornis suggereren dat de uitscheiding van CASODEX vertraagd kan zijn en tot verdere accumulatie zou kunnen leiden. Bij patiënten met een leverfunctiestoornis die langdurig worden behandeld, moeten periodieke leverfunctietesten worden overwogen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Er werd geen klinisch significant verschil waargenomen in de farmacokinetiek van beide enantiomeer van bicalutamide bij patiënten met milde tot matige leverziekte in vergelijking met gezonde controlepersonen. De halfwaardetijd van de R-enantiomeer was echter met ongeveer 76% verhoogd (respectievelijk 5,9 en 10,4 dagen voor normale en gestoorde patiënten) bij patiënten met een ernstige leverziekte (n=4).
Nierfunctiestoornis
Nierfunctiestoornis (gemeten aan de hand van de creatinineklaring) had geen significant effect op de eliminatie van totaal bicalutamide of het actieve R-enantiomeer.
OVERDOSERING
Er zijn langdurige klinische onderzoeken uitgevoerd met doseringen tot 200 mg CASODEX 50 mg per dag en deze doseringen werden goed verdragen. Een enkele dosis CASODEX 50 mg die leidt tot symptomen van een overdosis die als levensbedreigend wordt beschouwd, is niet vastgesteld.
Er is geen specifiek tegengif; behandeling van een overdosis dient symptomatisch te zijn.
Bij de behandeling van een overdosis met CASODEX 50 mg kan braken worden opgewekt als de patiënt alert is. Er moet aan worden herinnerd dat in deze patiëntenpopulatie mogelijk meerdere geneesmiddelen zijn gebruikt. Dialyse zal waarschijnlijk niet helpen, aangezien CASODEX sterk aan eiwit gebonden is en uitgebreid wordt gemetaboliseerd. Algemene ondersteunende zorg, waaronder frequente controle van de vitale functies en nauwkeurige observatie van de patiënt, is geïndiceerd.
CONTRA-INDICATIES
Casodex is gecontra-indiceerd bij:
overgevoeligheid
CASODEX 50 mg is gecontra-indiceerd bij elke patiënt die een overgevoeligheidsreactie heeft vertoond op het geneesmiddel of op een van de componenten van de tablet. Overgevoeligheidsreacties waaronder angioneurotisch oedeem en urticaria zijn gemeld.
Vrouwen
CASODEX 50 mg heeft geen indicatie voor vrouwen en mag niet bij deze populatie worden gebruikt.
Zwangerschap
CASODEX 50 mg kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw [zie Gebruik bij specifieke populaties ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
CASODEX 50 mg is een niet-steroïde androgeenreceptorremmer. Het remt competitief de werking van androgenen door zich te binden aan cytosol-androgeenreceptoren in het doelweefsel. Van prostaatcarcinoom is bekend dat het androgeengevoelig is en reageert op een behandeling die het effect van androgeen tegengaat en/of de bron van androgeen verwijdert.
Wanneer CASODEX 50 mg wordt gecombineerd met LHRH-analoogtherapie, wordt de onderdrukking van serumtestosteron geïnduceerd door de LHRH-analoog niet beïnvloed. In klinische onderzoeken met CASODEX als monotherapie voor prostaatkanker zijn echter stijgingen van serumtestosteron en oestradiol waargenomen.
Bij een subgroep van patiënten die zijn behandeld met CASODEX en een LHRH-agonist, en die de behandeling met CASODEX 50 mg stopzetten vanwege progressieve gevorderde prostaatkanker, kan een verlaging van het prostaatspecifiek antigeen (PSA) en/of klinische verbetering (antiandrogeenonttrekkingsverschijnsel) optreden. opgemerkt.
Farmacokinetiek
Absorptie
Bicalutamide wordt goed geabsorbeerd na orale toediening, hoewel de absolute biologische beschikbaarheid niet bekend is. Gelijktijdige toediening van bicalutamide met voedsel heeft geen klinisch significant effect op de snelheid of mate van absorptie.
Verdeling
Bicalutamide is sterk eiwitgebonden (96%) [zie DRUG-INTERACTIES ].
Metabolisme/eliminatie
Bicalutamide ondergaat stereospecifiek metabolisme. De S (inactieve) isomeer wordt voornamelijk gemetaboliseerd door glucuronidering. De R (actieve) isomeer ondergaat ook glucuronidering, maar wordt voornamelijk geoxideerd tot een inactieve metaboliet, gevolgd door glucuronidering. Zowel de ouder- als metabolietglucuroniden worden uitgescheiden in de urine en feces. De S-enantiomeer wordt snel geklaard ten opzichte van de R-enantiomeer, waarbij de R-enantiomeer ongeveer 99% van de totale steady-state plasmaspiegels uitmaakt.
De farmacokinetiek van de actieve enantiomeer van CASODEX 50 mg bij normale mannen en patiënten met prostaatkanker wordt weergegeven in tabel 3.
Klinische studies
CASODEX 50 mg per dag in combinatie met een LHRH-A
In een dubbelblind, gecontroleerd klinisch onderzoek in meerdere centra werden 813 patiënten met niet eerder behandelde gevorderde prostaatkanker gerandomiseerd om eenmaal daags 50 mg CASODEX (404 patiënten) of 250 mg flutamide (409 patiënten) driemaal daags te krijgen, elk in combinatie met LHRH-analogen (ofwel gosereline-acetaatimplantaat of leuprolide-acetaatdepot).
In een analyse die werd uitgevoerd nadat een mediane follow-up van 160 weken was bereikt, waren 213 (52,7%) patiënten behandeld met CASODEX-LHRH-analoogtherapie en 235 (57,5%) patiënten behandeld met flutamide-LHRH-analoogtherapie overleden. Er was geen significant verschil in overleving tussen de behandelingsgroepen (zie figuur 1). De hazard ratio voor tijd tot overlijden (overleving) was 0,87 (95% betrouwbaarheidsinterval 0,72 tot 1,05).
Figuur 1 - De Kaplan-Meier-kans op overlijden voor beide antiandrogeenbehandelingsgroepen. 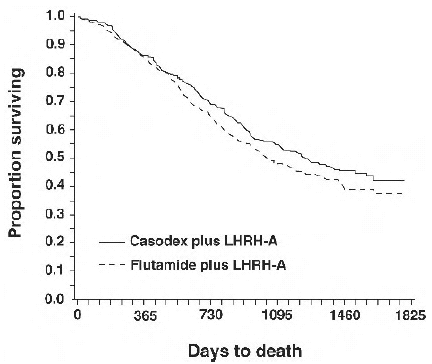
Er was geen significant verschil in tijd tot objectieve tumorprogressie tussen behandelingsgroepen (zie figuur 2). Objectieve tumorprogressie werd gedefinieerd als het verschijnen van eventuele botmetastasen of de verslechtering van bestaande botmetastasen op botscan toe te schrijven aan gemetastaseerde ziekte, of een toename met 25% of meer van bestaande meetbare extraskeletale metastasen. De hazard ratio voor tijd tot progressie van CASODEX plus LHRH-analoog tot die van flutamide plus LHRH-analoog was 0,93 (95% betrouwbaarheidsinterval, 0,79 tot 1,10).
Figuur 2 - Kaplan-Meier-curve voor tijd tot progressie voor beide antiandrogeenbehandelingsgroepen. 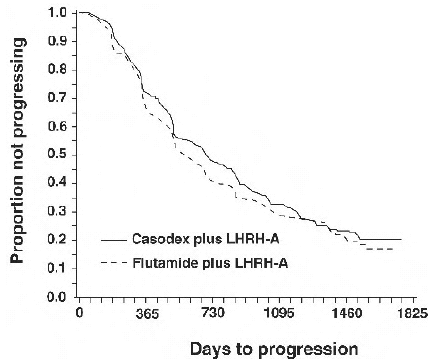
De kwaliteit van leven werd beoordeeld met zelf in te vullen vragenlijsten over pijn, sociaal functioneren, emotioneel welzijn, vitaliteit, activiteitsbeperking, bedongeschiktheid, algehele gezondheid, fysieke capaciteit, algemene symptomen en behandelingsgerelateerde symptomen. Beoordeling van de vragenlijsten over kwaliteit van leven wezen niet op consistente significante verschillen tussen de twee behandelingsgroepen.
Veiligheidsgegevens uit klinische onderzoeken met CASODEX 150 mg
CASODEX 150 mg is niet goedgekeurd voor gebruik alleen of met andere behandelingen.
Twee identieke multicenter, gerandomiseerde, open-label onderzoeken waarin CASODEX 150 mg per dag monotherapie werd vergeleken met castratie, werden uitgevoerd bij patiënten met lokaal gevorderde (T3-4, NX, M0) of gemetastaseerde (M1) prostaatkanker.
Monotherapie – M1-groep
CASODEX 150 mg per dag is niet goedgekeurd voor gebruik bij patiënten met M1-kanker van de prostaat. Op basis van een tussentijdse analyse van de twee onderzoeken naar overleving, adviseerde de Data Safety Monitoring Board om de behandeling met CASODEX te staken bij de M1-patiënten omdat het risico op overlijden 25% (HR 1,25, 95% BI 0,87 tot 1,81) en 31% ( HR 1,31, 95% BI 0,97 tot 1,77) hoger in respectievelijk de met CASODEX 50 mg behandelde groep dan in de gecastreerde groep.
Lokaal geavanceerde (T3-4, NX, M0) groep
CASODEX 150 mg per dag is niet goedgekeurd voor gebruik bij patiënten met lokaal gevorderde (T3-4, NX, M0) prostaatkanker. Na stopzetting van alle M1-patiënten werden de onderzoeken voortgezet met de T3-4, NX, M0-patiënten tot het einde van de studie. In de grotere studie (N=352) was het risico op overlijden 25% (HR 1,25, 95% BI 0,92 tot 1,71) hoger in de CASODEX-groep en in de kleinere studie (N=140) was het risico op overlijden 36 % (HR 0,64, 95% BI, 0,39 tot 1,03) lager in de CASODEX 50 mg-groep.
Naast de bovengenoemde twee onderzoeken zijn er drie andere lopende klinische onderzoeken die aanvullende veiligheidsinformatie opleveren voor CASODEX 150 mg, een dosis die niet is goedgekeurd voor gebruik. Dit zijn drie multicenter, gerandomiseerde, dubbelblinde onderzoeken met parallelle groepen waarin CASODEX 150 mg per dag monotherapie (adjuvans bij eerdere therapie of onder waakzaam wachten) wordt vergeleken met placebo, voor overlijden of tijd tot ziekteprogressie, in een populatie van 8113 patiënten met gelokaliseerde of lokaal gevorderde prostaatkanker.
CASODEX 150 mg per dag is niet goedgekeurd voor gebruik als therapie voor patiënten met gelokaliseerde prostaatkanker die in aanmerking komen voor waakzaam wachten. Gegevens van een geplande subgroepanalyse van twee van deze onderzoeken bij 1627 patiënten met gelokaliseerde prostaatkanker die waakzaam waren, onthulden een trend in de richting van verminderde overleving in de CASODEX-arm na een mediane follow-up van 7,4 jaar. Er waren 294 (37,7%) sterfgevallen bij de met CASODEX behandelde patiënten versus 279 (32,9%) sterfgevallen bij de met placebo behandelde patiënten (gelokaliseerde wachtgroep) voor een hazard ratio van 1,16 (95% BI 0,99 tot 1,37).
PATIËNT INFORMATIE
CASODEX® [cas-o-dex] (bicalutamide) Tablet
Lees deze patiënteninformatie voordat u begint met het innemen van CASODEX 50 mg en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze bijsluiter vervangt niet het praten met uw zorgverlener over uw medische toestand of uw behandeling.
Wat is CASODEX 50 mg?
CASODEX is een receptgeneesmiddel dat een androgeenreceptorremmer wordt genoemd en dat in combinatie met luteïniserend hormoon-releasing hormoon (LHRH)-geneesmiddelen wordt gebruikt om stadium D2-gemetastaseerde prostaatkanker te behandelen.
CASODEX is niet bedoeld voor gebruik bij vrouwen.
Het is niet bekend of CASODEX veilig en effectief is bij kinderen.
Wie mag CASODEX 50 mg niet gebruiken?
Gebruik CASODEX 50 mg niet als u:
- zijn een vrouw.
- zwanger bent of zwanger kunt worden. CASODEX kan uw ongeboren baby schaden.
- zijn allergisch voor een van de bestanddelen van CASODEX. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in CASODEX. Roep onmiddellijk medische hulp in als u een van de volgende symptomen van een allergische reactie krijgt: jeuk, netelroos (bultjes), zwelling van het gezicht, de lippen of tong, moeite met ademhalen of slikken.
Wat moet ik mijn zorgverlener vertellen voordat ik CASODEX inneem?
Voordat u CASODEX 50 mg inneemt, moet u uw zorgverlener op de hoogte stellen van al uw medische aandoeningen, ook als u:
- leverproblemen hebben.
- neem een geneesmiddel om uw bloed te verdunnen. Vraag uw zorgverlener of apotheker als u niet zeker weet of uw geneesmiddel een bloedverdunner is.
- diabetes heeft (slechte bloedsuikercontrole is gemeld bij mensen die CASODEX in combinatie met LHRH-geneesmiddelen gebruiken).
- een partner heeft die zwanger is of zwanger zou kunnen worden. U moet effectieve anticonceptiemethoden gebruiken terwijl u CASODEX 50 mg gebruikt en gedurende 130 dagen na het stoppen met CASODEX. Neem contact op met uw arts als u vragen heeft over anticonceptie.
Vertel uw zorgverlener over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen. CASODEX 50 mg en andere geneesmiddelen kunnen elkaar beïnvloeden en bijwerkingen veroorzaken. CASODEX kan de werking van andere geneesmiddelen beïnvloeden en andere geneesmiddelen kunnen de werking van CASODEX 50 mg beïnvloeden.
Weet welke medicijnen u gebruikt. Houd een lijst van uw medicijnen bij u om uw zorgverleners te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik CASODEX 50 mg innemen?
- Neem CASODEX precies in zoals uw zorgverlener u zegt dat u het moet innemen.
- Neem CASODEX elke dag op hetzelfde tijdstip in.
- Uw behandeling met CASODEX 50 mg dient gelijktijdig met uw behandeling met het LHRH-medicijn te beginnen.
- Als u een dosis bent vergeten, neem dan geen extra dosis, maar neem de volgende dosis op uw normale tijdstip. Neem geen 2 doses tegelijk.
- CASODEX 50 mg kan met of zonder voedsel worden ingenomen.
- Als u te veel CASODEX heeft ingenomen, bel dan uw zorgverlener of het Antigifcentrum of ga direct naar de dichtstbijzijnde eerstehulpafdeling van het ziekenhuis.
- Stop niet met het innemen van CASODEX tenzij uw zorgverlener u dat zegt.
- Uw zorgverlener kan bloedonderzoeken doen terwijl u CASODEX gebruikt.
- Uw prostaatkanker kan erger worden als u CASODEX in combinatie met LHRH-geneesmiddelen gebruikt.
Regelmatige controle van uw prostaatkanker met uw zorgverlener is belangrijk om te bepalen of uw ziekte erger is.
Wat moet ik vermijden tijdens het gebruik van CASODEX 50 mg?
Rijd niet, bedien geen machines of voer geen andere gevaarlijke activiteiten uit totdat u weet welke invloed CASODEX op u heeft.
Sommige mensen zijn tijdens het gebruik van CASODEX gevoelig geworden voor zonlicht. U moet zonlicht of zonnelampen en zonnebanken vermijden en overwegen om zonnebrandcrème te gebruiken terwijl u wordt behandeld met CASODEX.
Wat zijn de mogelijke bijwerkingen van CASODEX 50 mg?
CASODEX kan ernstige bijwerkingen veroorzaken, waaronder:
- Leverproblemen, waaronder leverfalen die mogelijk in een ziekenhuis moeten worden behandeld of die tot de dood kunnen leiden. Uw zorgverlener moet vóór en tijdens de behandeling met CASODEX bloedonderzoek doen om uw leverfunctie te controleren. Vertel het uw zorgverlener meteen als u tijdens de behandeling een van deze symptomen van een leverprobleem krijgt:
- geel worden van de huid en ogen (geelzucht)
- donkere urine
- pijn in de rechter bovenbuik
- misselijkheid
- braken
- vermoeidheid
- verlies van eetlust
- rillingen
- koorts
- Moeite met ademhalen met of zonder hoesten of koorts. Sommige mensen die CASODEX 50 mg gebruiken, krijgen een ontsteking in de longen die interstitiële longziekte wordt genoemd.
- Een allergische reactie. Symptomen van een allergische reactie zijn onder meer: jeuk aan de huid, netelroos (bultjes), zwelling van het gezicht, de lippen, tong, keel of moeite met slikken.
- Borstvergroting (gynaecomastie) en pijn in de borst.
- Een slechte bloedsuikercontrole kan optreden bij mensen die CASODEX 50 mg in combinatie met LHRH-geneesmiddelen gebruiken. Uw zorgverlener kan uw bloedsuikerspiegel controleren tijdens de behandeling met CASODEX 50 mg.
De meest voorkomende bijwerkingen van CASODEX 50 mg zijn:
- opvliegers, of korte perioden van warm gevoel en zweten
- pijn in uw hele lichaam in uw rug, bekken, maag
- zwak voelen
- constipatie
- infectie
- misselijkheid
- zwelling in uw enkels, benen of voeten
- diarree
- bloed in uw urine
- wakker worden uit de slaap om 's nachts te plassen
- een afname van het aantal rode bloedcellen (bloedarmoede)
- duizelig voelen
Vertel het uw zorgverlener als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van CASODEX. Vraag uw zorgverlener of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik CASODEX bewaren?
Bewaar CASODEX bij kamertemperatuur tussen 68 ° F en 77 ° F (20 ° C tot 25 ° C).
Bewaar CASODEX 50 mg en alle geneesmiddelen buiten het bereik van kinderen.
Algemene informatie over het veilige en effectieve gebruik van CASODEX.
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in de bijsluiter. Gebruik CASODEX niet voor een aandoening waarvoor het niet is voorgeschreven. Geef CASODEX 50 mg niet aan andere mensen, ook niet als zij dezelfde symptomen hebben als u. Het kan hen schaden.
Deze bijsluiter voor patiënten vat de belangrijkste informatie over CASODEX samen. Als u meer informatie wilt over CASODEX, neem dan contact op met uw zorgverlener. U kunt uw zorgverlener of apotheker om informatie vragen over CASODEX die is geschreven voor gezondheidswerkers. Ga voor meer informatie naar www.CASODEX.com of bel 1-800-236-9933.
Wat zijn de ingrediënten in CASODEX 50 mg?
Actief ingrediënt: bicalutamide.
Inactieve ingredienten: lactose, magnesiumstearaat, hypromellose, polyethyleenglycol, polyvidon, natriumzetmeelglycollaat, titaniumdioxide.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration.
