Leukeran 2mg, 5mg Chlorambucil Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Leukeran 5 mg en hoe wordt het gebruikt?
Leukeran 5 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van chronische lymfatische (lymfatische) leukemie en hodgkinlymfoom te behandelen. Leukeran 5 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Leukeran 5 mg behoort tot een klasse geneesmiddelen die antineoplastische middelen, alkylerend, worden genoemd.
Het is niet bekend of Leukeran veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Leukeran?
Leukeran kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- toevallen,
- ongebruikelijke massa of knobbel,
- ernstig braken of diarree,
- nieuwe of verergerende hoest,
- gemakkelijk blauwe plekken,
- ongebruikelijke bloeding (neus, mond, vagina of rectum),
- paarse of rode puntvlekken onder de huid,
- misselijkheid,
- pijn in de bovenbuik,
- jeuk,
- vermoeidheid,
- verlies van eetlust,
- donkere urine,
- kleikleurige ontlasting,
- geel worden van de huid of ogen (geelzucht),
- koorts,
- gezwollen tandvlees,
- pijnlijke zweertjes in de mond,
- pijn bij het slikken,
- huidzweren,
- verkoudheids- of griepsymptomen,
- hoesten,
- moeite met ademhalen,
- keelpijn,
- huidpijn, en
- een rode of paarse huiduitslag die zich uitbreidt (vooral in het gezicht of bovenlichaam) en blaarvorming en vervelling veroorzaakt
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Leukeran zijn:
- koorts,
- bloeden, en
- griep symptomen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Leukeran. Vraag uw arts of apotheker om meer informatie.
WAARSCHUWING
LEUKERAN (chloorambucil) kan de beenmergfunctie ernstig onderdrukken. Chloorambucil is kankerverwekkend bij de mens. Chloorambucil is waarschijnlijk mutageen en teratogeen bij mensen. Chloorambucil veroorzaakt menselijke onvruchtbaarheid (zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ).
OMSCHRIJVING
LEUKERAN (chloorambucil) werd voor het eerst gesynthetiseerd door Everett et al. Het is een bifunctioneel alkyleringsmiddel van het type stikstofmosterd waarvan is aangetoond dat het actief is tegen geselecteerde menselijke neoplastische ziekten. Chloorambucil is chemisch bekend als 4-[bis(2-chloorethyl)amino]benzeenbutaanzuur en heeft de volgende structuurformule:
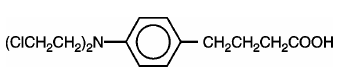
Chloorambucil hydrolyseert in water en heeft een pKa van 5,8.
LEUKERAN (chloorambucil) is verkrijgbaar in tabletvorm voor orale toediening. Elke filmomhulde tablet bevat 2 mg chloorambucil en de niet-werkzame bestanddelen colloïdaal siliciumdioxide, hypromellose, lactose (watervrij), macrogol/PEG 400, microkristallijne cellulose, rood ijzeroxide, stearinezuur, titaniumdioxide en geel ijzeroxide.
INDICATIES
LEUKERAN (chloorambucil) is geïndiceerd voor de behandeling van chronische lymfatische (lymfatische) leukemie, kwaadaardige lymfomen waaronder lymfosarcoom, reuzenfolliculair lymfoom en de ziekte van Hodgkin. Het is bij geen van deze aandoeningen genezend, maar kan klinisch bruikbare palliatie opleveren.
DOSERING EN ADMINISTRATIE
De gebruikelijke orale dosering is dagelijks 0,1 tot 0,2 mg/kg lichaamsgewicht gedurende 3 tot 6 weken, indien nodig. Dit bedraagt doorgaans 4 tot 10 mg per dag voor de gemiddelde patiënt. De volledige dagelijkse dosis kan in één keer worden gegeven. Deze doseringen zijn bedoeld voor het starten van de therapie of voor korte behandelingskuren. De dosering moet zorgvuldig worden aangepast aan de reactie van de patiënt en moet worden verlaagd zodra het aantal witte bloedcellen abrupt daalt. Patiënten met de ziekte van Hodgkin hebben gewoonlijk 0,2 mg/kg per dag nodig, terwijl patiënten met andere lymfomen of chronische lymfatische leukemie gewoonlijk slechts 0,1 mg/kg per dag nodig hebben. Wanneer lymfocytische infiltratie van het beenmerg aanwezig is, of wanneer het beenmerg hypoplastisch is, mag de dagelijkse dosis niet hoger zijn dan 0,1 mg/kg (ongeveer 6 mg voor de gemiddelde patiënt).
Alternatieve schema's voor de behandeling van chronische lymfatische leukemie waarbij gebruik wordt gemaakt van intermitterende, tweewekelijkse of maandelijkse pulsdoses chloorambucil zijn gemeld. Intermitterende schema's van chloorambucil beginnen met een initiële enkelvoudige dosis van 0,4 mg/kg. Doses worden over het algemeen verhoogd met 0,1 mg/kg totdat lymfocytose of toxiciteit onder controle is. Daaropvolgende doses worden aangepast om milde hematologische toxiciteit te veroorzaken. Men is van mening dat het responspercentage van chronische lymfatische leukemie op het tweewekelijkse of maandelijkse toedieningsschema van chloorambucil vergelijkbaar of beter is dan eerder gemeld bij dagelijkse toediening en dat de hematologische toxiciteit kleiner of gelijk was aan die welke werd aangetroffen in onderzoeken met dagelijkse toediening van chloorambucil. .
Bestraling en cytotoxische geneesmiddelen maken het beenmerg kwetsbaarder voor beschadiging, en chloorambucil moet met bijzondere voorzichtigheid worden gebruikt binnen 4 weken na een volledige kuur van bestralingstherapie of chemotherapie. Kleine doses palliatieve straling over geïsoleerde foci op afstand van het beenmerg zullen echter gewoonlijk het aantal neutrofielen en bloedplaatjes niet verlagen. In deze gevallen kan chloorambucil in de gebruikelijke dosering worden gegeven.
Momenteel wordt aangenomen dat korte behandelingskuren veiliger zijn dan continue onderhoudstherapie, hoewel beide methoden effectief zijn geweest. Erkend moet worden dat continue therapie de schijn kan wekken van "onderhoud" bij patiënten die daadwerkelijk in remissie zijn en geen onmiddellijke behoefte hebben aan verdere medicatie. Als een onderhoudsdosering wordt gebruikt, mag deze niet hoger zijn dan 0,1 mg/kg per dag en kan deze zelfs zo laag zijn als 0,03 mg/kg per dag. Een typische onderhoudsdosis is 2 mg tot 4 mg per dag, of minder, afhankelijk van de status van het bloedbeeld. Het kan daarom wenselijk zijn om het geneesmiddel te staken nadat maximale controle is bereikt, aangezien intermitterende therapie die opnieuw wordt ingesteld op het moment van terugval even effectief kan zijn als continue behandeling.
Er dienen procedures te worden gevolgd voor de juiste behandeling en verwijdering van geneesmiddelen tegen kanker. Er zijn verschillende richtlijnen over dit onderwerp gepubliceerd.1-4 Er is geen algemene overeenstemming dat alle procedures die in de richtlijnen worden aanbevolen, noodzakelijk of passend zijn.
Speciale populaties
Leverfunctiestoornis
Patiënten met leverinsufficiëntie moeten nauwlettend worden gecontroleerd op toxiciteit. Aangezien chloorambucil voornamelijk in de lever wordt gemetaboliseerd, kan dosisverlaging worden overwogen bij patiënten met leverinsufficiëntie die worden behandeld met LEUKERAN. Er zijn echter onvoldoende gegevens over patiënten met een leverfunctiestoornis om een specifiek doseringsadvies te geven.
HOE GELEVERD
LEUKERAN wordt geleverd als bruine, filmomhulde, ronde, biconvexe tabletten met 2 mg chloorambucil in amberkleurige glazen flessen met kindveilige sluitingen. De ene kant is gegraveerd met "GX EG3" en de andere kant is gegraveerd met een "L".
Fles van 25 ( NDC 76388-635-25)
Bewaren in de koelkast, 2 ° tot 8 ° C (36 ° tot 46 ° F).
REFERENTIES
1. NIOSH Alert: preventie van beroepsmatige blootstelling aan antineoplastische en andere gevaarlijke medicijnen in zorginstellingen. 2004. US Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) publicatie nr. 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Sectie VI: Hoofdstuk 2. Beheersing van beroepsmatige blootstelling aan gevaarlijke drugs. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Apothekers. ASHP-richtlijnen voor het omgaan met gevaarlijke drugs. Ben J Health-Syst Pharm. (2006) 63: 1172-1193.
4. Polovich, M., White, JM, & Kelleher, LO (eds.) 2005. Richtlijnen voor chemotherapie en biotherapie en aanbevelingen voor de praktijk (2e ed.) Pittsburgh, PA: Oncology Nursing Society.
Gefabriceerd door: Excella GmbH & Co. KG, Feucht, Duitsland. Herzien: maart 2017
BIJWERKINGEN
Om VERMOEDELIJKE ONGEWENSTE REACTIES te melden, neemt u contact op met Aspen Global Inc. Toll-Free op 1-855-800-8165 of FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.
hematologisch
De meest voorkomende bijwerking is beenmergsuppressie, bloedarmoede, leukopenie, neutropenie, trombocytopenie of pancytopenie. Hoewel beenmergsuppressie vaak voorkomt, is het meestal omkeerbaar als de chloorambucil vroeg genoeg wordt stopgezet. Er is echter onomkeerbaar beenmergfalen gemeld.
gastro-intestinaal
Gastro-intestinale stoornissen zoals misselijkheid en braken, diarree en mondzweren komen zelden voor.
CNS
Tremoren, spiertrekkingen, myoclonie, verwardheid, agitatie, ataxie, slappe parese en hallucinaties zijn gemeld als zeldzame bijwerkingen van chloorambucil die verdwijnen na stopzetting van het geneesmiddel. Zeldzame, focale en/of gegeneraliseerde aanvallen zijn gemeld bij zowel kinderen als volwassenen bij zowel therapeutische dagelijkse doses als pulsdoseringsschema's, en bij acute overdosering (zie PREVENTIEVE MAATREGELEN : Algemeen ).
dermatologisch
Allergische reacties zoals urticaria en angioneurotisch oedeem zijn gemeld na initiële of volgende dosering. Overgevoeligheid van de huid (waaronder zeldzame meldingen van huiduitslag die zich ontwikkelt tot erythema multiforme, toxische epidermale necrolyse en Stevens-Johnson-syndroom) is gemeld (zie WAARSCHUWINGEN ).
Diversen
Andere gemelde bijwerkingen zijn: longfibrose, hepatotoxiciteit en geelzucht, geneesmiddelkoorts, perifere neuropathie, interstitiële pneumonie, steriele cystitis, onvruchtbaarheid, leukemie en secundaire maligniteiten (zie WAARSCHUWINGEN ).

DRUG-INTERACTIES
Er zijn geen interacties tussen geneesmiddelen en geneesmiddelen bekend met chloorambucil.
WAARSCHUWINGEN
Vanwege de kankerverwekkende eigenschappen mag chloorambucil niet worden gegeven aan patiënten met andere aandoeningen dan chronische lymfatische leukemie of kwaadaardige lymfomen. Convulsies, onvruchtbaarheid, leukemie en secundaire maligniteiten zijn waargenomen wanneer chloorambucil werd gebruikt bij de behandeling van kwaadaardige en niet-maligne ziekten.
Er zijn veel meldingen van acute leukemie bij patiënten met zowel kwaadaardige als niet-maligne ziekten na behandeling met chloorambucil. In veel gevallen kregen deze patiënten ook andere chemotherapeutische middelen of een of andere vorm van bestralingstherapie. De kwantificering van het risico op chloorambucil-inductie van leukemie of carcinoom bij mensen is niet mogelijk. Evaluatie van gepubliceerde rapporten over het ontstaan van leukemie bij patiënten die chloorambucil (en andere alkylerende middelen) hebben gekregen, suggereert dat het risico op leukemogenese toeneemt met zowel de chronische behandeling als met hoge cumulatieve doses. Het is echter onmogelijk gebleken om een cumulatieve dosis vast te stellen waaronder er geen risico is op de inductie van secundaire maligniteit. De mogelijke voordelen van een behandeling met chloorambucil moeten op individuele basis worden afgewogen tegen het mogelijke risico van de inductie van een secundaire maligniteit.
Van chloorambucil is aangetoond dat het chromatide- of chromosoombeschadiging bij mensen veroorzaakt. Zowel omkeerbare als permanente steriliteit is waargenomen bij beide geslachten die chloorambucil kregen.
Een hoge incidentie van steriliteit is gedocumenteerd wanneer chloorambucil wordt toegediend aan prepuberale en puberale mannen. Langdurige of permanente azoöspermie is ook waargenomen bij volwassen mannen. Hoewel de meeste meldingen van gonadale disfunctie secundair aan chloorambucil betrekking hebben op mannen, is de inductie van amenorroe bij vrouwen met alkylerende middelen goed gedocumenteerd en is chloorambucil in staat amenorroe te produceren. Autopsiestudies van de eierstokken van vrouwen met maligne lymfoom die werden behandeld met combinatiechemotherapie, waaronder chloorambucil, hebben verschillende gradaties van fibrose, vasculitis en uitputting van primordiale follikels aangetoond.
Zeldzame gevallen van huiduitslag die zich ontwikkelt tot erythema multiforme, toxische epidermale necrolyse of Stevens-Johnson-syndroom zijn gemeld. Chloorambucil moet onmiddellijk worden stopgezet bij patiënten die huidreacties ontwikkelen.
Zwangerschap
Zwangerschap Categorie D
Chloorambucil kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Unilaterale renale agenese is waargenomen bij 2 nakomelingen van wie de moeders chloorambucil kregen tijdens het eerste trimester. Urogenitale misvormingen, waaronder het ontbreken van een nier, werden gevonden bij foetussen van ratten die chloorambucil kregen. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënte op de hoogte worden gesteld van het mogelijke gevaar voor de foetus. Vrouwen die zwanger kunnen worden, moet worden geadviseerd niet zwanger te worden.
PREVENTIEVE MAATREGELEN
Algemeen
Veel patiënten ontwikkelen tijdens de behandeling een langzaam progressieve lymfopenie. Het aantal lymfocyten keert gewoonlijk snel terug naar normale niveaus na voltooiing van de medicamenteuze behandeling. De meeste patiënten hebben enige neutropenie na de derde week van de behandeling en dit kan tot 10 dagen na de laatste dosis aanhouden. Vervolgens wordt het aantal neutrofielen meestal snel weer normaal. Ernstige neutropenie lijkt verband te houden met de dosering en treedt meestal alleen op bij patiënten die een totale dosering van 6,5 mg/kg of meer hebben gekregen in één behandelingskuur met continue dosering. Ongeveer een kwart van alle patiënten die het continue doseringsschema krijgen, en een derde van degenen die deze dosering in 8 weken of minder krijgen, kan naar verwachting ernstige neutropenie ontwikkelen.
Hoewel het niet nodig is om te stoppen met chloorambucil bij de eerste tekenen van een daling van het aantal neutrofielen, moet er rekening mee worden gehouden dat de daling tot 10 dagen na de laatste dosis kan aanhouden en dat als de totale dosis de 6,5 mg/kg nadert, er een risico op het veroorzaken van onomkeerbare beenmergbeschadiging. De dosis chloorambucil moet worden verlaagd als het aantal leukocyten of bloedplaatjes onder de normale waarden daalt en moet worden stopgezet bij een ernstigere depressie.
Chloorambucil zou moeten niet worden gegeven in volledige doseringen vóór 4 weken na een volledige kuur van bestralingstherapie of chemotherapie vanwege de kwetsbaarheid van het beenmerg voor beschadiging onder deze omstandigheden. Als het aantal leukocyten of bloedplaatjes vóór de therapie is verlaagd door het proces van beenmergziekte voordat de therapie wordt ingesteld, moet de behandeling met een lagere dosering worden ingesteld.
Aanhoudend lage aantallen neutrofielen en bloedplaatjes of perifere lymfocytose duiden op beenmerginfiltratie. Indien bevestigd door beenmergonderzoek, mag de dagelijkse dosering van chloorambucil niet hoger zijn dan 0,1 mg/kg. Chloorambucil lijkt relatief vrij te zijn van gastro-intestinale bijwerkingen of ander bewijs van toxiciteit, afgezien van de beenmergdepressieve werking. Bij mensen kunnen enkelvoudige orale doses van 20 mg of meer misselijkheid en braken veroorzaken.
Kinderen met nefrotisch syndroom en patiënten die hoge pulsdoses chloorambucil krijgen, kunnen een verhoogd risico op epileptische aanvallen hebben. Zoals met elk potentieel epileptogeen geneesmiddel, moet voorzichtigheid worden betracht bij het toedienen van chloorambucil aan patiënten met een voorgeschiedenis van convulsies of hoofdtrauma, of die andere potentieel epileptogene geneesmiddelen krijgen.
Toediening van levende vaccins aan immuungecompromitteerde patiënten moet worden vermeden.
Laboratorium testen
Patiënten moeten zorgvuldig worden gevolgd om levensbedreigende schade aan het beenmerg tijdens de behandeling te voorkomen. Wekelijks moet het bloed worden onderzocht om het hemoglobinegehalte, het totale en differentiële aantal leukocyten en het kwantitatieve aantal bloedplaatjes te bepalen. Ook wordt tijdens de eerste 3 tot 6 weken van de therapie aanbevolen om 3 of 4 dagen na elk van de wekelijkse volledige bloedtellingen de telling van de witte bloedcellen uit te voeren. Galton et al. hebben gesuggereerd dat het bij het volgen van patiënten nuttig is om de bloedtellingen in een grafiek uit te zetten terwijl tegelijkertijd het lichaamsgewicht, de temperatuur, de miltgrootte, enz. worden geregistreerd. Het wordt als gevaarlijk beschouwd om een patiënt tijdens de behandeling meer dan 2 weken te laten zonder hematologisch en klinisch onderzoek.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Zien WAARSCHUWINGEN rubriek voor informatie over carcinogenese, mutagenese en verminderde vruchtbaarheid.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie D
Zien WAARSCHUWINGEN sectie.
Moeders die borstvoeding geven
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden en vanwege de kans op ernstige bijwerkingen van chloorambucil bij zuigelingen, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met chloorambucil omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Gebruik bij patiënten met nierinsufficiëntie
De invloed van nierinsufficiëntie op de eliminatie van chloorambucil is niet formeel onderzocht. De renale eliminatie van onveranderd chloorambucil en zijn belangrijkste actieve metabolieten, fenylazijnzuurmosterd, vertegenwoordigt minder dan 1% van de toegediende dosis. Bovendien was er geen dosisaanpassing nodig bij 2 dialysepatiënten die chloorambucil kregen. Daarom wordt niet verwacht dat nierinsufficiëntie een significante invloed heeft op de eliminatie van chloorambucil.
Gebruik bij patiënten met leverinsufficiëntie
Er zijn geen formele onderzoeken uitgevoerd bij patiënten met leverinsufficiëntie. Aangezien chloorambucil voornamelijk in de lever wordt gemetaboliseerd, moeten patiënten met leverinsufficiëntie nauwlettend worden gecontroleerd op toxiciteit en kan dosisverlaging worden overwogen bij patiënten met leverinsufficiëntie die worden behandeld met LEUKERAN (zie DOSERING EN ADMINISTRATIE ).
OVERDOSERING
Reversibele pancytopenie was de belangrijkste bevinding van onbedoelde overdoses van chloorambucil. Neurologische toxiciteit variërend van geagiteerd gedrag en ataxie tot meerdere grand mal-aanvallen is ook opgetreden. Aangezien er geen antidotum bekend is, moet het bloedbeeld nauwlettend worden gecontroleerd en moeten algemene ondersteunende maatregelen worden genomen, zo nodig samen met passende bloedtransfusies. Chloorambucil is niet dialyseerbaar.
Orale LD50 enkelvoudige doses bij muizen zijn 123 mg/kg. Bij ratten veroorzaakt een enkele intraperitoneale dosis van 12,5 mg/kg chloorambucil typische stikstof-mosterdeffecten; deze omvatten atrofie van het darmslijmvlies en lymfoïde weefsels, ernstige lymfopenie die binnen 4 dagen maximaal wordt, anemie en trombocytopenie. Na deze dosis beginnen de dieren binnen 3 dagen te herstellen en zien ze er na ongeveer een week normaal uit, hoewel het beenmerg mogelijk niet volledig normaal wordt gedurende ongeveer 3 weken. Een intraperitoneale dosis van 18,5 mg/kg doodt ongeveer 50% van de ratten met de ontwikkeling van convulsies. Maar liefst 50 mg/kg is oraal toegediend aan ratten als een enkele dosis, met herstel. Een dergelijke dosis veroorzaakt bradycardie, overmatige speekselvloed, hematurie, convulsies en ademhalingsstoornissen.
CONTRA-INDICATIES
Chloorambucil zou moeten niet worden gebruikt bij patiënten bij wie de ziekte eerder resistentie tegen het middel heeft vertoond. Patiënten die overgevoeligheid voor chloorambucil hebben aangetoond, mogen het geneesmiddel niet krijgen. Er kan sprake zijn van kruisovergevoeligheid (huiduitslag) tussen chloorambucil en andere alkylerende middelen.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Chloorambucil, een aromatisch stikstofmosterdderivaat, is een alkyleringsmiddel. Chloorambucil interfereert met DNA-replicatie en induceert cellulaire apoptose via de accumulatie van cytosolisch p53 en daaropvolgende activering van Bax, een apoptose-promotor.
Farmacokinetiek
In een onderzoek onder 12 patiënten die enkelvoudige orale doses van 0,2 mg/kg LEUKERAN 5 mg kregen, was de gemiddelde dosis-aangepaste (±SD) plasmachloorambucil Cmax 492 ± 160 ng/ml, de AUC was 883 ± 329 ng.u/ml was de gemiddelde eliminatiehalfwaardetijd (t½) 1,3 ± 0,5 uur en de Tmax 0,83 ± 0,53 uur. Voor de belangrijkste metaboliet, fenylazijnzuurmosterd (PAAM), was de gemiddelde dosis-aangepaste (± SD) plasma Cmax 306 ± 73 ng/ml, de AUC was 1204 ± 285 ng.u/ml, gemiddelde t½ was 1,8 ± 0,4 uur en de Tmax was 1,9 ± 0,7 uur.
Na enkelvoudige orale doses van 0,6 tot 1,2 mg/kg worden binnen 1 uur piekplasmachloorambucilspiegels (Cmax) bereikt en wordt de terminale eliminatiehalfwaardetijd (tmax) van het oorspronkelijke geneesmiddel geschat op 1,5 uur.
Absorptie
Chloorambucil wordt snel en volledig (>70%) geabsorbeerd uit het maagdarmkanaal. In overeenstemming met de snelle, voorspelbare absorptie van chloorambucil, is aangetoond dat de interindividuele variabiliteit in de plasmafarmacokinetiek van chloorambucil relatief klein is na orale doseringen tussen 15 en 70 mg (2-voudige intrapatiëntvariabiliteit en een 2- tot 4-voudige interpatiëntvariabiliteit in AUC). De absorptie van chloorambucil wordt verminderd bij inname na voedsel. In een onderzoek bij tien patiënten verhoogde voedselinname de mediane Tmax met een factor 2 en verlaagde de voor de dosis aangepaste Cmax- en AUC-waarden met respectievelijk 55% en 20%.
Verdeling
Het schijnbare distributievolume was gemiddeld 0,31 l/kg na een enkele orale dosis chloorambucil van 0,2 mg/kg bij 11 kankerpatiënten met chronische lymfatische leukemie.
Chloorambucil en zijn metabolieten zijn in hoge mate gebonden aan plasma- en weefseleiwitten. In vitro is chloorambucil voor 99% gebonden aan plasma-eiwitten, met name albumine. Het gehalte aan chloorambucil in het hersenvocht is niet vastgesteld.
Metabolisme
Chloorambucil wordt uitgebreid in de lever gemetaboliseerd, voornamelijk tot fenylazijnzuurmosterd, dat antineoplastische activiteit heeft. Chloorambucil en zijn belangrijkste metaboliet ondergaan oxidatieve afbraak tot monohydroxy- en dihydroxyderivaten.
uitscheiding
Na een enkele dosis radioactief gelabeld chloorambucil (14C) verschijnt na 24 uur ongeveer 20% tot 60% van de radioactiviteit in de urine. Nogmaals, minder dan 1% van de radioactiviteit in de urine is in de vorm van chloorambucil of fenylazijnzuurmosterd.
PATIËNT INFORMATIE
Patiënten moeten worden geïnformeerd dat de belangrijkste toxiciteiten van chloorambucil verband houden met overgevoeligheid, geneesmiddelkoorts, myelosuppressie, hepatotoxiciteit, onvruchtbaarheid, toevallen, gastro-intestinale toxiciteit en secundaire maligniteiten. Patiënten mogen het medicijn nooit zonder medisch toezicht innemen en moeten hun arts raadplegen als ze huiduitslag, bloeding, koorts, geelzucht, aanhoudende hoest, toevallen, misselijkheid, braken, amenorroe of ongebruikelijke knobbels / massa's ervaren. Vrouwen die zwanger kunnen worden, moet worden geadviseerd niet zwanger te worden.
