Suprax 100mg, 200mg Cefixime Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Suprax 200 mg en hoe wordt het gebruikt?
Suprax (cefixime) voor orale suspensie is een cefalosporine-antibioticum dat wordt gebruikt voor de behandeling van veel verschillende soorten infecties veroorzaakt door bacteriën.
Wat zijn bijwerkingen van Suprax?
Vaak voorkomende bijwerkingen van Suprax 100 mg zijn:
- maagklachten/pijn,
- diarree,
- misselijkheid,
- constipatie,
- verlies van eetlust,
- gas,
- hoofdpijn,
- duizeligheid,
- ongerustheid,
- slaperigheid,
- meer plassen 's nachts,
- loopneus,
- keelpijn,
- hoesten, of
- vaginale jeuk of afscheiding.
Vertel het uw arts als u zeldzame maar zeer ernstige bijwerkingen van Suprax 200 mg ervaart, waaronder:
- ernstige maag- of buikpijn,
- aanhoudende misselijkheid of braken,
- gele ogen of huid,
- donkere urine,
- ongebruikelijke vermoeidheid,
- nieuwe tekenen van infectie (bijv. aanhoudende keelpijn, koorts),
- gemakkelijk blauwe plekken of bloedingen,
- verandering in de hoeveelheid urine, of
- mentale/stemmingswisselingen (zoals verwarring).
OMSCHRIJVING
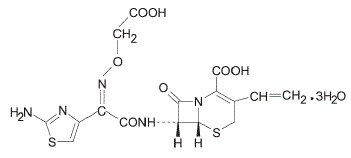
Cefixime is een semisynthetisch, cefalosporine antibacterieel middel voor orale toediening. Chemisch gezien is het (6R,7R)-7-[2-(2-Amino-4-thiazolyl)glyoxylamido]-8-oxo-3-vinyl-5-thia-1-azabicyclo [4.2.0] oct-2 -een-2-carbonzuur, 72-(Z)-[O-(carboxymethyl)oxim]trihydraat.
Molecuulgewicht = 507,50 als het trihydraat. Chemische formule is C16H15N5O7S2.3H2O
De structuurformule voor cefixime is:
- Inactieve ingrediënten in SUPRAX® (cefixime) 400 mg tabletten USP zijn: dibasisch calciumfosfaat, hypromellose, lactosemonohydraat, magnesiumstearaat, microkristallijne cellulose, polyethyleenglycol, voorgegelatineerd zetmeel, titaniumdioxide en triacetine.
- Inactieve ingrediënten in SUPRAX® (cefixime) 400 mg capsules zijn: colloïdaal siliciumdioxide, crospovidon, laag gesubstitueerde hydroxypropylcellulose, magnesiumstearaat en mannitol. Het omhulsel van de capsule bevat de volgende inactieve ingrediënten: zwart ijzeroxide, rood ijzeroxide, gelatine, kaliumhydroxide, propyleenglycol, schellak, natriumlaurylsulfaat en titaniumdioxide.
- Inactieve ingrediënten in SUPRAX® (cefixime) 100 mg of 150 mg of 200 mg kauwtabletten zijn: aspartaam, colloïdaal siliciumdioxide, crospovidon, FD&C Red # 40 Aluminium Lake, laag gesubstitueerde hydroxypropylcellulose, magnesiumstearaat, mannitol, fantasy flavour permaseal, en tutti frutti smaak.
- Inactieve ingrediënten in SUPRAX® (cefixime) poeder voor orale suspensie USP zijn: colloïdaal siliciumdioxide, natriumbenzoaat, aardbeiensmaak, sucralose (alleen in een sterkte van 500 mg / 5 ml), sucrose en xanthaangom.
INDICATIES
Ongecompliceerde urineweginfecties
SUPRAX is geïndiceerd voor de behandeling van volwassenen en pediatrische patiënten van zes maanden of ouder met ongecompliceerde urineweginfecties veroorzaakt door gevoelige isolaten van Escherichia coli en Proteus mirabilis.
otitis media
SUPRAX is geïndiceerd voor de behandeling van volwassenen en pediatrische patiënten van zes maanden of ouder met otitis media veroorzaakt door gevoelige isolaten van Haemophilus influenzae, Moraxella catarrhalis en Streptococcus pyogenes. (De werkzaamheid van Streptococcus pyogenes in dit orgaansysteem werd onderzocht bij minder dan 10 infecties.)
Opmerking
Bij patiënten met middenoorontsteking veroorzaakt door Streptococcus pneumoniae was de algehele respons ongeveer 10% lager voor cefixime dan voor de comparator [zie Klinische studies ].
Faryngitis en tonsillitis
SUPRAX is geïndiceerd voor de behandeling van volwassenen en pediatrische patiënten van zes maanden of oudermet faryngitis en tonsillitis veroorzaakt door gevoelige isolaten van Streptococcus pyogenes. (Opmerking: penicilline is het gebruikelijke geneesmiddel bij uitstek bij de behandeling van Streptococcus pyogenes-infecties. SUPRAX is over het algemeen effectief bij de uitroeiing van Streptococcus pyogenes uit de nasopharynx; gegevens die de werkzaamheid van SUPRAX 100 mg bij de daaropvolgende preventie van reumatische koorts bevestigen, zijn echter niet verkrijgbaar.)
Acute exacerbaties van chronische bronchitis
SUPRAX 200 mg is geïndiceerd voor de behandeling van volwassenen en pediatrische patiënten van zes maanden of ouder met acute exacerbaties van chronische bronchitis veroorzaakt door gevoelige isolaten van Streptococcus pneumoniae en Haemophilus influenzae.
Ongecompliceerde gonorroe (cervicaal/urethraal)
SUPRAX 100 mg is geïndiceerd voor de behandeling van volwassenen en pediatrische patiënten van zes maanden of ouder met ongecompliceerde gonorroe (cervicaal/urethraal) veroorzaakt door gevoelige isolaten van Neisseria gonorrhoeae (penicillinase- en niet-penicillinase-producerende isolaten).
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van SUPRAX 100 mg en andere antibacteriële geneesmiddelen te behouden, mag SUPRAX 100 mg alleen worden gebruikt voor de behandeling van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antimicrobiële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
volwassenen
De aanbevolen dosis cefixime is 400 mg per dag. Dit kan worden gegeven als een tablet of capsule van 400 mg per dag of de tablet van 400 mg kan worden gesplitst en elke 12 uur als een halve tablet worden gegeven. Voor de behandeling van ongecompliceerde cervicale/urethrale gonokokkeninfecties wordt een enkelvoudige orale dosis van 400 mg aanbevolen. De capsule en tablet kunnen worden toegediend zonder rekening te houden met voedsel.
Bij de behandeling van infecties veroorzaakt door Streptococcus pyogenes moet een therapeutische dosering cefixime gedurende ten minste 10 dagen worden toegediend.
Pediatrische patiënten (6 maanden of ouder)
De aanbevolen dosis is 8 mg/kg/dag van de suspensie. Dit kan worden toegediend als een enkele dagelijkse dosis of kan worden gegeven in twee verdeelde doses, als 4 mg/kg om de 12 uur.
Opmerking
Voor elk pediatrisch gewichtsbereik is een aanbevolen dosis bepaald. Raadpleeg tabel 1. Zorg ervoor dat alle bestellingen die een dosis in milliliter specificeren een concentratie bevatten, omdat SUPRAX voor orale suspensie verkrijgbaar is in drie verschillende concentraties (100 mg/5 ml, 200 mg/5 ml en 500 mg/5 ml).
Kinderen die meer dan 45 kg wegen of ouder dan 12 jaar moeten worden behandeld met de aanbevolen dosis voor volwassenen. SUPRAX (cefixime) kauwtabletten moeten worden gekauwd of fijngemaakt voordat ze worden ingeslikt.
Otitis media moet worden behandeld met de kauwtabletten of suspensie. Klinische onderzoeken naar otitis media zijn uitgevoerd met de kauwtabletten of suspensie, en de kauwtabletten of suspensie resulteren in hogere piekbloedspiegels dan de tablet bij toediening in dezelfde dosis.
Daarom mag de tablet of capsule niet de kauwtabletten of suspensie vervangen bij de behandeling van otitis media [zie KLINISCHE FARMACOLOGIE ].
Bij de behandeling van infecties veroorzaakt door Streptococcus pyogenes moet een therapeutische dosering cefixime gedurende ten minste 10 dagen worden toegediend.
Nierfunctiestoornis
SUPRAX 200 mg kan worden toegediend in aanwezigheid van een verminderde nierfunctie. Bij patiënten met een creatinineklaring van 60 ml/min of meer kan de normale dosis en het normale schema worden toegepast. Raadpleeg Tabel 2 voor dosisaanpassingen voor volwassenen met nierinsufficiëntie. Noch hemodialyse noch peritoneale dialyse verwijdert significante hoeveelheden geneesmiddel uit het lichaam.
Reconstitutie-instructies voor orale suspensie
Na reconstitutie kan de suspensie 14 dagen worden bewaard bij kamertemperatuur of in de koelkast, zonder significant verlies van potentie. Goed gesloten bewaren. Goed schudden voor gebruik. Gooi het ongebruikte deel na 14 dagen weg.
HOE GELEVERD
Doseringsvormen en sterke punten
SUPRAX is beschikbaar voor orale toediening in de volgende doseringsvormen en sterktes:
- Filmomhulde tabletten leveren 400 mg cefixime als trihydraat. Dit zijn witte tot gebroken witte, filmomhulde, capsulevormige tabletten met afgeschuinde randen en een gedeelde breukstreep aan elke kant. De tablet heeft aan de ene kant de inscriptie "SUPRAX" en aan de andere kant "LUPIN".
- Capsules leveren 400 mg cefixime als trihydraat. Dit zijn maat “00EL” capsules met roze ondoorzichtige dop en roze ondoorzichtige romp met “LU” op de dop en “U43” op de romp in zwarte inkt. Capsules bevatten wit tot geelachtig wit korrelig poeder.
- Kauwtabletten leveren 100 mg of 150 mg of 200 mg cefixime als trihydraat. De tablet van 100 mg is een roze, ronde tablet, met de inscriptie “SUPRAX 100” aan de ene kant en “LUPINE” aan de andere kant. De 150 mg tablet is een roze, ronde tablet, met aan de ene kant “SUPRAX 150” en aan de andere kant “LUPINE”. De tablet van 200 mg is een roze, ronde tablet, met aan de ene kant “SUPRAX 200” en aan de andere kant “LUPINE”.
- Poeder voor orale suspensie levert, na reconstitutie, 100 mg/5 ml of 200 mg/5 ml of 500 mg/5 ml cefixime als trihydraat. Voor 100 mg/5 ml en 200 mg/5 ml heeft het poeder een gebroken witte tot lichtgele kleur en heeft het een aardbeiensmaak. Voor 500 mg/5 ml heeft het poeder een gebroken witte tot crèmekleur en heeft het een aardbeiensmaak.
Opslag en behandeling
SUPRAX® is beschikbaar voor orale toediening in de volgende doseringsvormen, sterktes en verpakkingen die in de onderstaande tabel worden vermeld:
Gefabriceerd door: Lupine Limited Mandideep 462 046 India. Herzien: maart 2018.
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De meest voorkomende bijwerkingen in Amerikaanse onderzoeken naar de tabletformulering waren gastro-intestinale voorvallen, die werden gemeld bij 30% van de volwassen patiënten met ofwel het tweemaal daags ofwel het eenmaal daags regime. Vijf procent (5%) van de patiënten in de Amerikaanse klinische onderzoeken stopte met de behandeling vanwege geneesmiddelgerelateerde bijwerkingen. Individuele bijwerkingen waren diarree 16%, losse of frequente ontlasting 6%, buikpijn 3%, misselijkheid 7%, dyspepsie 3% en winderigheid 4%. De incidentie van gastro-intestinale bijwerkingen, waaronder diarree en dunne ontlasting, bij pediatrische patiënten die de suspensie kregen, was vergelijkbaar met de incidentie die werd gezien bij volwassen patiënten die tabletten kregen.
Postmarketingervaring
De volgende bijwerkingen zijn gemeld na het gebruik van cefixime na goedkeuring. De incidentie was minder dan 1 op 50 (minder dan 2%).
gastro-intestinaal
In klinische onderzoeken werden verschillende gevallen van gedocumenteerde pseudomembraneuze colitis vastgesteld. Symptomen van pseudomembraneuze colitis kunnen optreden tijdens of na de behandeling.
Overgevoeligheidsreacties
Anafylactische/anafylactoïde reacties (inclusief shock en dodelijke afloop), huiduitslag, urticaria, medicijnkoorts, pruritus, angio-oedeem en gezichtsoedeem. Erythema multiforme, Stevens-Johnson-syndroom en serumziekteachtige reacties zijn gemeld.
lever
ransient verhogingen van SGPT, SGOT, alkalische fosfatase, hepatitis, geelzucht.
nier
Voorbijgaande verhogingen van BUN of creatinine, acuut nierfalen.
Centraal zenuwstelsel
Hoofdpijn, duizeligheid, toevallen.
Hemic en lymfatisch systeem
Voorbijgaande trombocytopenie, leukopenie, neutropenie, verlenging van de protrombinetijd, verhoogd LDH, pancytopenie, agranulocytose en eosinofilie.
Abnormale laboratoriumtests
Hyperbilirubinemie.
Andere bijwerkingen
Genitale pruritus, vaginitis, candidiasis, toxische epidermale necrolyse.
Bijwerkingen gemeld voor geneesmiddelen uit de cefalosporineklasse
Allergische reacties, superinfectie, nierfunctiestoornis, toxische nefropathie, leverfunctiestoornis waaronder cholestase, aplastische anemie, hemolytische anemie, bloeding en colitis.
Verschillende cefalosporines zijn betrokken bij het uitlokken van epileptische aanvallen, vooral bij patiënten met nierinsufficiëntie wanneer de dosering niet werd verlaagd [zie DOSERING EN ADMINISTRATIE zien OVERDOSERING ]. Als er aanvallen optreden die verband houden met medicamenteuze behandeling, moet het medicijn worden stopgezet. Anticonvulsieve therapie kan worden gegeven indien klinisch geïndiceerd.
DRUG-INTERACTIES
Carbamazepine
In postmarketingervaring zijn verhoogde carbamazepinespiegels gemeld bij gelijktijdige toediening van cefixime. Het monitoren van geneesmiddelen kan behulpzaam zijn bij het opsporen van veranderingen in de plasmaconcentraties van carbamazepine.
Warfarine en anticoagulantia
Een verlengde protrombinetijd, met of zonder klinische bloeding, is gemeld bij gelijktijdige toediening van cefixime.
Geneesmiddel-/laboratoriumtestinteracties
Een vals-positieve reactie voor ketonen in de urine kan optreden bij tests met nitroprusside, maar niet bij tests met nitroferricyanide.
De toediening van cefixime kan resulteren in een vals-positieve reactie voor glucose in de urine bij gebruik van Clinitest®, Benedict's oplossing of Fehling's oplossing. Het wordt aanbevolen om glucosetesten te gebruiken op basis van enzymatische glucoseoxidasereacties (zoals Clinistix® of TesTape®). Een fout-positieve directe Coombs-test is gemeld tijdens behandeling met andere cefalosporines; daarom moet worden erkend dat een positieve Coombs-test te wijten kan zijn aan het medicijn.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Overgevoeligheidsreacties
Anafylactische/anafylactoïde reacties (inclusief shock en dodelijke afloop) zijn gemeld bij het gebruik van cefixime.
Voordat de behandeling met SUPRAX wordt ingesteld, moet zorgvuldig worden onderzocht of de patiënt eerder overgevoeligheidsreacties heeft gehad op cefalosporines, penicillines of andere geneesmiddelen. Als dit product moet worden gegeven aan penicillinegevoelige patiënten, is voorzichtigheid geboden omdat kruisovergevoeligheid tussen bètalactamantibacteriële geneesmiddelen duidelijk is gedocumenteerd en kan optreden bij maximaal 10% van de patiënten met een voorgeschiedenis van penicilline-allergie. Als een allergische reactie op SUPRAX 100 mg optreedt, stop dan met het medicijn.
Clostridium Difficile-geassocieerde diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder SUPRAX 200 mg, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende isolaten van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibacteriële geneesmiddelen. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestaakt met het voortdurende gebruik van antibacteriële geneesmiddelen dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële medicamenteuze behandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Dosisaanpassing bij nierfunctiestoornis
De dosis SUPRAX 100 mg moet worden aangepast bij patiënten met nierinsufficiëntie en bij patiënten die continue ambulante peritoneale dialyse (CAPD) en hemodialyse (HD) ondergaan. Patiënten die dialyse ondergaan, moeten zorgvuldig worden gecontroleerd [zie DOSERING EN ADMINISTRATIE ].
Coagulatie-effecten
Cefalosporines, waaronder SUPRAX 200 mg, kunnen in verband worden gebracht met een daling van de protrombine-activiteit. Tot de risicogroepen behoren patiënten met nier- of leverinsufficiëntie of een slechte voedingstoestand, evenals patiënten die een langdurige antimicrobiële therapie krijgen en patiënten die eerder gestabiliseerd waren op anticoagulantia. De protrombinetijd moet worden gecontroleerd bij risicopatiënten en exogene vitamine K moet worden toegediend zoals aangegeven.
Ontwikkeling van geneesmiddelresistente bacteriën
Het is onwaarschijnlijk dat het voorschrijven van SUPRAX (cefixime) bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie de patiënt voordelen oplevert en het risico op de ontwikkeling van geneesmiddelresistente bacteriën verhoogt.
Risico bij patiënten met fenylketonurie
Fenylalanine kan schadelijk zijn voor patiënten met fenylketonurie (PKU). SUPRAX 200 mg kauwtabletten bevatten aspartaam, een bron van fenylalanine. Elke sterkte van 100 mg, 150 mg en 200 mg bevat respectievelijk 3,3 mg, 5 mg en 6,7 mg fenylalanine. Voordat u SUPRAX kauwtabletten voorschrijft aan een patiënt met PKU, moet u rekening houden met de gecombineerde dagelijkse hoeveelheid fenylalanine uit alle bronnen, inclusief SUPRAX 200 mg kauwtabletten.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen levenslange studies bij dieren uitgevoerd om het carcinogene potentieel te evalueren. Cefixime veroorzaakte in vitro geen puntmutaties in bacteriën of zoogdiercellen, DNA-schade of chromosoomschade en vertoonde in vivo geen clastogeen potentieel in de micronucleustest bij muizen. Bij ratten werden de vruchtbaarheid en het reproductievermogen niet beïnvloed door cefixime bij doses tot 25 maal de therapeutische dosis voor volwassenen.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie B
Er zijn reproductieonderzoeken uitgevoerd bij muizen en ratten met doses tot 40 maal de dosis voor de mens en er zijn geen aanwijzingen gevonden voor schade aan de foetus als gevolg van cefixime. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Bevalling
Cefixime is niet onderzocht voor gebruik tijdens de bevalling en de bevalling. Behandeling mag alleen worden gegeven als dit duidelijk nodig is.
Moeders die borstvoeding geven
Het is niet bekend of cefixime wordt uitgescheiden in de moedermelk. Tijdens de behandeling met dit geneesmiddel moet worden overwogen om de borstvoeding tijdelijk te staken.
Pediatrisch gebruik
De veiligheid en werkzaamheid van cefixime bij kinderen jonger dan zes maanden zijn niet vastgesteld. De incidentie van gastro-intestinale bijwerkingen, waaronder diarree en dunne ontlasting, bij de pediatrische patiënten die de suspensie kregen, was vergelijkbaar met de incidentie die werd gezien bij volwassen patiënten die tabletten kregen.
Geriatrisch gebruik
Klinische onderzoeken omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Een farmacokinetische studie bij ouderen ontdekte verschillen in farmacokinetische parameters [zie: KLINISCHE FARMACOLOGIE ]. Deze verschillen waren klein en duiden er niet op dat de dosering van het geneesmiddel bij ouderen moet worden aangepast.
Nierfunctiestoornis
De dosis cefixime moet worden aangepast bij patiënten met nierinsufficiëntie en bij patiënten die continue ambulante peritoneale dialyse (CAPD) en hemodialyse (HD) ondergaan. Patiënten die dialyse ondergaan, moeten zorgvuldig worden gecontroleerd [zie DOSERING EN ADMINISTRATIE ].
OVERDOSERING
Maagspoeling kan geïndiceerd zijn; anders bestaat er geen specifiek tegengif. Cefixime wordt niet in significante hoeveelheden uit de bloedsomloop verwijderd door hemodialyse of peritoneale dialyse. Bijwerkingen bij kleine aantallen gezonde volwassen vrijwilligers die enkelvoudige doses tot 2 g cefixime kregen, verschilden niet van het profiel dat werd gezien bij patiënten die werden behandeld met de aanbevolen doses.
CONTRA-INDICATIES
Suprax (cefixime) is gecontra-indiceerd bij patiënten met een bekende allergie voor cefixime of andere cefalosporines.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Cefixime is een semisynthetisch cefalosporine antibacterieel geneesmiddel [zie Microbiologie ].
Farmacokinetiek
SUPRAX 200 mg kauwtabletten zijn bio-equivalent aan orale suspensie.
SUPRAX 200 mg tabletten en suspensie, oraal toegediend, worden voor ongeveer 40% tot 50% geabsorbeerd, ongeacht of het met of zonder voedsel wordt toegediend; de tijd tot maximale absorptie wordt echter met ongeveer 0,8 uur verlengd bij toediening met voedsel. Een enkele tablet cefixime van 200 mg produceert een gemiddelde piekserumconcentratie van ongeveer 2 mcg/ml (bereik 1 tot 4 mcg/ml); een enkele tablet van 400 mg produceert een gemiddelde piekconcentratie van ongeveer 3,7 mcg/ml (bereik 1,3 tot 7,7 mcg/ml). De orale suspensie produceert gemiddelde piekconcentraties die ongeveer 25% tot 50% hoger zijn dan de tabletten, wanneer getest bij normale volwassen vrijwilligers. Tweehonderd en 400 mg doses orale suspensie produceren gemiddelde piekconcentraties van respectievelijk 3 mcg/ml (bereik 1 tot 4,5 mcg/ml) en 4,6 mcg/ml (bereik 1,9 tot 7,7 mcg/ml), wanneer getest bij normale volwassen vrijwilligers . Het gebied onder de tijd versus concentratiecurve (AUC) is ongeveer 10% tot 25% groter met de orale suspensie dan met de tablet na doses van 100 tot 400 mg, wanneer getest bij normale volwassen vrijwilligers. Met deze verhoogde absorptie moet rekening worden gehouden als de orale suspensie de tablet moet vervangen. Vanwege het gebrek aan bio-equivalentie mogen tabletten niet worden vervangen door orale suspensie bij de behandeling van otitis media [zie DOSERING EN ADMINISTRATIE ]. Er zijn geen cross-over-onderzoeken van tablet versus suspensie uitgevoerd bij kinderen.
De capsule van 400 mg is bio-equivalent aan de tablet van 400 mg in nuchtere toestand. Voedsel vermindert echter de absorptie na toediening van de capsule met ongeveer 15% op basis van AUC en 25% op basis van Cmax.
Piekserumconcentraties treden op tussen 2 en 6 uur na orale toediening van een enkele tablet van 200 mg, een enkele tablet van 400 mg of 400 mg cefixime-suspensie. Piekserumconcentraties treden op tussen 2 en 5 uur na een enkelvoudige toediening van 200 mg suspensie. Piekserumconcentraties treden op tussen 3 en 8 uur na orale toediening van een enkele capsule van 400 mg.
Verdeling
De serumeiwitbinding is concentratie-onafhankelijk met een gebonden fractie van ongeveer 65%. In een onderzoek met meerdere doses, uitgevoerd met een onderzoeksformulering die minder biologisch beschikbaar is dan de tablet of suspensie, was er weinig accumulatie van het geneesmiddel in serum of urine na toediening gedurende 14 dagen. Adequate gegevens over CSF-niveaus van cefixime zijn niet beschikbaar.
Metabolisme en uitscheiding
Er is geen bewijs van metabolisme van cefixime in vivo. Ongeveer 50% van de geabsorbeerde dosis wordt binnen 24 uur onveranderd in de urine uitgescheiden. In dierstudies werd opgemerkt dat cefixime ook in meer dan 10% van de toegediende dosis in de gal wordt uitgescheiden. De serumhalfwaardetijd van cefixime bij gezonde proefpersonen is onafhankelijk van de doseringsvorm en bedraagt gemiddeld 3 tot 4 uur, maar kan bij sommige normale vrijwilligers oplopen tot 9 uur.
Speciale populaties
Geriatrie
De gemiddelde AUC's bij steady-state bij oudere patiënten zijn ongeveer 40% hoger dan de gemiddelde AUC's bij andere gezonde volwassenen. De verschillen in de farmacokinetische parameters tussen 12 jonge en 12 oudere proefpersonen die gedurende 5 dagen eenmaal daags 400 mg cefixime kregen, zijn als volgt samengevat:
Deze verhogingen waren echter niet klinisch significant [zie DOSERING EN ADMINISTRATIE ].
Nierfunctiestoornis
Bij proefpersonen met een matige nierfunctiestoornis (20 tot 40 ml/min creatinineklaring) is de gemiddelde serumhalfwaardetijd van cefixime verlengd tot 6,4 uur. Bij ernstige nierinsufficiëntie (5 tot 20 ml/min creatinineklaring) nam de halfwaardetijd toe tot gemiddeld 11,5 uur. Het medicijn wordt niet significant uit het bloed geklaard door hemodialyse of peritoneale dialyse. Uit een onderzoek bleek echter dat patiënten die hemodialyse ondergaan bij doses van 400 mg een vergelijkbaar bloedprofiel hebben als proefpersonen met een creatinineklaring van 21 tot 60 ml/min.
Microbiologie
Werkingsmechanisme
Net als bij andere cefalosporines is de bacteriedodende werking van cefixime het gevolg van remming van de celwandsynthese. Cefixime is stabiel in aanwezigheid van bepaalde bètalactamase-enzymen. Als gevolg hiervan kunnen bepaalde organismen die resistent zijn tegen penicillines en sommige cefalosporines vanwege de aanwezigheid van betalactamases gevoelig zijn voor cefixime.
Weerstand
Resistentie tegen cefixime in isolaten van Haemophilus influenzae en Neisseria gonorrhoeae wordt meestal geassocieerd met veranderingen in penicillinebindende eiwitten (PBP's). Cefixime kan een beperkte activiteit hebben tegen Enterobacteriaceae die bètalactamasen met een uitgebreid spectrum (ESBL's) produceren. Pseudomonas-soorten, Enterococcus-soorten, stammen van Groep D-streptokokken, Listeria monocytogenes, de meeste stammen van stafylokokken (inclusief methicilline-resistente stammen), de meeste stammen van Enterobacter-soorten, de meeste stammen van Bacteroides fragilis en de meeste stammen van Clostridium-soorten zijn resistent tegen cefixime.
Antimicrobiale activiteit
Van cefixime is aangetoond dat het actief is tegen de meeste isolaten van de volgende micro-organismen, zowel in vitro als bij klinische infecties [zie INDICATIES ].
Gram-positieve bacteriën
Streptococcus pneumoniae Streptococcus pyogenes
Gram-negatieve bacteriën
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Ten minste 90 procent van de volgende bacteriën vertoont een in vitro minimale remmende concentratie (MIC) die kleiner is dan of gelijk is aan het gevoelige breekpunt voor cefixime tegen isolaten van een vergelijkbaar geslacht of een vergelijkbare groep organismen. De werkzaamheid van cefixime bij de behandeling van klinische infecties veroorzaakt door deze bacteriën is echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Streptococcus agalactiae
Gram-negatieve bacteriën
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia-soort Salmonella-soort Serratia marcescens Shigella-soort
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: https://www.fda.gov/STIC.
Klinische studies
Vergelijkende klinische onderzoeken naar otitis media werden uitgevoerd bij bijna 400 kinderen in de leeftijd van 6 maanden tot 10 jaar. Streptococcus pneumoniae werd geïsoleerd bij 47% van de patiënten, Haemophilus influenzae bij 34%, Moraxella catarrhalis bij 15% en S. pyogenes bij 4%.
Het totale responspercentage van Streptococcus pneumoniae op cefixime was ongeveer 10% lager en dat van Haemophilus influenzae of Moraxella catarrhalis ongeveer 7% hoger (12% wanneer bètalactamase-positieve isolaten van H. influenzae worden meegerekend) dan de responspercentages van deze organismen op de actieve controlemedicijnen.
In deze onderzoeken werden patiënten gerandomiseerd en behandeld met ofwel cefixime in doseringsschema's van 4 mg/kg tweemaal daags of 8 mg/kg eenmaal daags, of met een comparator. Bij 69 tot 70% van de patiënten in elke groep verdwenen de tekenen en symptomen van middenoorontsteking bij evaluatie 2 tot 4 weken na de behandeling, maar aanhoudende effusie werd gevonden bij 15% van de patiënten. Bij evaluatie aan het einde van de therapie werd 17% van de patiënten die cefixime kregen en 14% van de patiënten die effectieve vergelijkende geneesmiddelen kregen (18% inclusief de patiënten die Haemophilus influenzae hadden die resistent was tegen het controlegeneesmiddel en die het antibacteriële controlemiddel kregen) beschouwd als mislukte behandelingen. Bij de follow-up van 2 tot 4 weken had in totaal 30-31% van de patiënten tekenen van falen van de behandeling of terugkerende ziekte.
Bacteriologisch resultaat van otitis media twee tot vier weken na therapie op basis van herhaald middenoor
PATIËNT INFORMATIE
Adviseer patiënten dat antibacteriële geneesmiddelen, waaronder cefixime, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Wanneer cefixime wordt voorgeschreven om een bacteriële infectie te behandelen, moet de patiënt worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan: (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en niet kunnen worden behandeld met cefixime voor orale suspensie of cefixime kauwtabletten of andere antibacteriële medicijnen in de toekomst.
Vertel patiënten met fenylketonurie dat SUPRAX 200 mg kauwtabletten aspartaam, een bron van fenylalanine, als volgt bevatten: Elke SUPRAX kauwtablet bevat respectievelijk 3,3 mg, 5 mg en 6,7 mg fenylalanine per 100 mg, 150 mg en 200 mg sterkte.
Adviseer patiënten dat diarree een veelvoorkomend probleem is dat wordt veroorzaakt door antibacteriële geneesmiddelen en dat meestal stopt wanneer het antibacteriële geneesmiddel wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibacteriële geneesmiddelen waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibacteriële geneesmiddel hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
