Ceftin 250mg, 500mg, 125mg Cefuroxime Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Ceftin 500 mg en hoe wordt het gebruikt?
Ceftin 500 mg is een receptgeneesmiddel dat wordt gebruikt om de symptomen van bacteriële infecties te behandelen. Ceftin kan alleen of in combinatie met andere medicijnen worden gebruikt.
Ceftin 250 mg is een cefalosporine-antibioticum.
Het is niet bekend of Ceftin veilig en effectief is bij kinderen jonger dan 3 maanden.
Wat zijn de mogelijke bijwerkingen van Ceftin?
Ceftin 250 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- diarree (met of zonder bloed),
- geel worden van de huid of de ogen,
- huiduitslag,
- blauwe plekken,
- ernstige tintelingen of gevoelloosheid,
- toevallen (convulsies),
- moeilijk of pijnlijk urineren,
- zwelling in uw voeten, enkels, gezicht of tong,
- vermoeidheid,
- kortademigheid,
- koorts,
- keelpijn,
- brandend in je ogen,
- huidpijn met een rode of paarse uitslag,
- huid blaren en peeling
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Ceftin zijn:
- diarree,
- misselijkheid,
- braken,
- ongebruikelijke of onaangename smaak in uw mond,
- luieruitslag bij een baby,
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Ceftin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
CEFTIN 500 mg tabletten en CEFTIN voor orale suspensie bevatten cefuroxim als cefuroximaxetil. CEFTIN is een semisynthetisch, cefalosporine antibacterieel geneesmiddel voor orale toediening.
De chemische naam van cefuroximaxetil (1-(acetyloxy)ethylester van cefuroxim) is (RS)-1- hydroxyethyl (6R,7R)-7-[2-(2-furyl)glyoxyl-amido]-3-(hydroxymethyl )-8-oxo-5-thia-1-azabicyclo[4.2.0]-oct-2-een-2-carboxylaat, 72-(Z)-(O-methyl-oxim), 1-acetaat 3-carbamaat. De molecuulformule is C20H22N4O10S en heeft een molecuulgewicht van 510,48.
Cefuroximaxetil is in de amorfe vorm en heeft de volgende structuurformule:
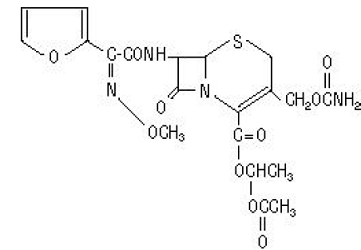
Tabletten zijn filmomhuld en bevatten het equivalent van 250 of 500 mg cefuroxim als cefuroximaxetil. Tabletten bevatten de inactieve ingrediënten colloïdaal siliciumdioxide, croscarmellosenatrium, gehydrogeneerde plantaardige olie, hypromellose, methylparaben, microkristallijne cellulose, propyleenglycol, propylparaben, natriumbenzoaat, natriumlaurylsulfaat en titaniumdioxide.
Orale suspensie levert, na reconstitutie met water, het equivalent van 125 mg of 250 mg cefuroxim (als cefuroximaxetil) per 5 ml. Orale suspensie bevat de inactieve ingrediënten acesulfaam-kalium, aspartaam, povidon K30, stearinezuur, sucrose, tutti-frutti-smaakstof en xanthaangom.
INDICATIES
Faryngitis/tonsillitis
CEFTIN 125 mg tabletten zijn geïndiceerd voor de behandeling van volwassen patiënten en pediatrische patiënten (13 jaar en ouder) met milde tot matige faryngitis/tonsillitis veroorzaakt door gevoelige stammen van Streptococcus pyogenes.
CEFTIN 500 mg voor orale suspensie is geïndiceerd voor de behandeling van pediatrische patiënten van 3 maanden tot 12 jaar met milde tot matige faryngitis/tonsillitis veroorzaakt door gevoelige stammen van Streptococcus pyogenes.
Beperkingen van gebruik
- De werkzaamheid van CEFTIN bij de preventie van reumatische koorts is niet vastgesteld in klinische onderzoeken.
- De werkzaamheid van CEFTIN 125 mg bij de behandeling van penicilline-resistente stammen van Streptococcus pyogenes is niet aangetoond in klinische onderzoeken.
Acute bacteriële otitis media
CEFTIN 125 mg tabletten zijn geïndiceerd voor de behandeling van pediatrische patiënten (die tabletten in hun geheel kunnen doorslikken) met acute bacteriële otitis media veroorzaakt door gevoelige stammen van Streptococcus pneumoniae, Haemophilus influenzae (inclusief β-lactamase-producerende stammen), Moraxella catarrhalis (inclusief β-lactamase -producerende stammen), of Streptococcus pyogenes.
CEFTIN voor orale suspensie is geïndiceerd voor de behandeling van pediatrische patiënten in de leeftijd van 3 maanden tot 12 jaar met acute bacteriële otitis media veroorzaakt door gevoelige stammen van Streptococcus pneumoniae, Haemophilus influenzae (inclusief β-lactamase-producerende stammen), Moraxella catarrhalis (inclusief β-lactamase). -producerende stammen), of Streptococcus pyogenes.
Acute bacteriële maxillaire sinusitis
CEFTIN-tabletten zijn geïndiceerd voor de behandeling van volwassen en pediatrische patiënten (13 jaar en ouder) met milde tot matige acute bacteriële maxillaire sinusitis veroorzaakt door gevoelige stammen van Streptococcus pneumoniae of Haemophilus influenzae (alleen niet-β-lactamase-producerende stammen).
CEFTIN 250 mg voor orale suspensie is geïndiceerd voor de behandeling van pediatrische patiënten in de leeftijd van 3 maanden tot 12 jaar met milde tot matige acute bacteriële maxillaire sinusitis veroorzaakt door gevoelige stammen van Streptococcus pneumoniae of Haemophilus influenzae (alleen niet-β-lactamase-producerende stammen) .
Beperkingen van gebruik
De werkzaamheid van CEFTIN voor sinusinfecties veroorzaakt door β-lactamase-producerende Haemophilus influenzae of Moraxella catarrhalis bij patiënten met acute bacteriële maxillaire sinusitis werd niet vastgesteld vanwege onvoldoende aantallen van deze isolaten in de klinische onderzoeken [zie Klinische studies ].
Acute bacteriële exacerbaties van chronische bronchitis
CEFTIN-tabletten zijn geïndiceerd voor de behandeling van volwassen patiënten en pediatrische patiënten (van 13 jaar en ouder) met milde tot matige acute bacteriële exacerbaties van chronische bronchitis veroorzaakt door gevoelige stammen van Streptococcus pneumoniae, Haemophilus influenzae (β-lactamase-negatieve stammen), of Haemophilus para influenzae (β-lactamase-negatieve stammen).
Ongecompliceerde huid- en huidstructuurinfecties
CEFTIN 250 mg tabletten zijn geïndiceerd voor de behandeling van volwassen patiënten en pediatrische patiënten (van 13 jaar en ouder) met ongecompliceerde huid- en huidstructuurinfecties veroorzaakt door gevoelige stammen van Staphylococcus aureus (inclusief β-lactamase-producerende stammen) of Streptococcus pyogenes.
Ongecompliceerde urineweginfecties
CEFTIN 500 mg tabletten zijn geïndiceerd voor de behandeling van volwassen patiënten en pediatrische patiënten (van 13 jaar en ouder) met ongecompliceerde urineweginfecties veroorzaakt door gevoelige stammen van Escherichia coli of Klebsiella pneumoniae.
Ongecompliceerde gonorroe
CEFTIN-tabletten zijn geïndiceerd voor de behandeling van volwassen patiënten en pediatrische patiënten (van 13 jaar en ouder) met ongecompliceerde gonorroe, urethraal en endocervicaal, veroorzaakt door penicillinase-producerende en niet-penicillinase-producerende gevoelige stammen van Neisseria gonorrhoeae en ongecompliceerde gonorroe, rectaal, bij vrouwen , veroorzaakt door niet-penicillinase-producerende gevoelige stammen van Neisseria gonorrhoeae.
Vroege ziekte van Lyme (erythema migrans)
CEFTIN-tabletten zijn geïndiceerd voor de behandeling van volwassen patiënten en pediatrische patiënten (van 13 jaar en ouder) met vroege ziekte van Lyme (erythema migrans) veroorzaakt door gevoelige Borrelia burgdorferi-stammen.
Impetigo
CEFTIN 250 mg voor orale suspensie is geïndiceerd voor de behandeling van pediatrische patiënten in de leeftijd van 3 maanden tot 12 jaar met impetigo veroorzaakt door gevoelige stammen van Staphylococcus aureus (inclusief Plaactamase-producerende stammen) of Streptococcus pyogenes.
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de effectiviteit van CEFTIN en andere antibacteriële geneesmiddelen te behouden, mag CEFTIN 500 mg alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
DOSERING EN ADMINISTRATIE
Belangrijke administratie-instructies
- CEFTIN-tabletten en CEFTIN voor orale suspensie zijn niet bio-equivalent en zijn daarom niet vervangbaar op milligram-per-milligram-basis [zie KLINISCHE FARMACOLOGIE ].
- Dien CEFTIN-tabletten of orale suspensie toe zoals beschreven in de juiste doseringsrichtlijnen [zie: Dosering voor CEFTIN 500 mg tabletten, dosering voor CEFTIN 250 mg voor orale suspensie en Bereiding en toediening van CEFTIN 125 mg voor orale suspensie ].
- Dien CEFTIN 500 mg tabletten met of zonder voedsel toe.
- Dien CEFTIN 500 mg voor orale suspensie toe met voedsel.
- Pediatrische patiënten (van 13 jaar en ouder) die de CEFTIN 125 mg-tabletten niet in hun geheel kunnen doorslikken, moeten CEFTIN voor orale suspensie krijgen omdat de tablet een sterke, aanhoudende bittere smaak heeft wanneer deze wordt fijngemaakt [zie Dosering voor CEFTIN-tabletten ].
Dosering voor CEFTIN 500 mg tabletten
Dien CEFTIN 250 mg tabletten toe zoals beschreven in de onderstaande tabel met doseringsrichtlijnen, met of zonder voedsel.
Dosering voor CEFTIN voor orale suspensie
Dien CEFTIN voor orale suspensie toe zoals beschreven in de onderstaande tabel met doseringsrichtlijnen met voedsel.
Voorbereiding en toediening van CEFTIN voor orale suspensie
Bereid een suspensie op het moment van afgifte als volgt:
- Schud de orale suspensie goed voor elk gebruik.
- Plaats de dop stevig terug na elke opening.
- Bewaar de gereconstitueerde suspensie gekoeld tussen 2 ° en 8 ° C (36 ° en 46 ° F).
- Gooi de gereconstitueerde suspensie na 10 dagen weg.
Dosering bij patiënten met een verminderde nierfunctie
Een aanpassing van het doseringsinterval is vereist voor patiënten bij wie de creatinineklaring minder is dan 30 ml/min, zoals vermeld in tabel 4 hieronder, omdat cefuroxim voornamelijk door de nieren wordt uitgescheiden [zie KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
CEFTIN-tabletten zijn witte, capsulevormige, filmomhulde tabletten, verkrijgbaar in de volgende sterktes:
- 250 mg cefuroxim (als cefuroximaxetil) met aan de ene kant “GX ES7” gegraveerd en aan de andere kant blanco.
- 500 mg cefuroxim (als cefuroximaxetil) met aan de ene kant “GX EG2” gegraveerd en aan de andere kant blanco.
CEFTIN voor orale suspensie wordt geleverd als droog, wit tot gebroken wit poeder met tutti-frutti-smaak. Na reconstitutie zoals aangegeven, levert de suspensie het equivalent van 125 mg of 250 mg cefuroxim (als cefuroximaxetil) per 5 ml.
Opslag en behandeling
CEFTIN-tabletten, 250 mg cefuroxim (als cefuroximaxetil), zijn witte, capsulevormige, filmomhulde tabletten met aan de ene kant “GX ES7” gegraveerd en aan de andere kant blanco als volgt: 20 tabletten/fles NDC 0173-0387-00
CEFTIN-tabletten, 500 mg cefuroxim (als cefuroximaxetil), zijn witte, capsulevormige, filmomhulde tabletten met aan de ene kant “GX EG2” gegraveerd en aan de andere kant blanco als volgt: 20 tabletten/fles NDC 0173-0394-00
Bewaar de tabletten tussen 15° en 30°C (59° en 86°F). Plaats de dop stevig terug na elke opening.
CEFTIN 500 mg voor orale suspensie wordt geleverd als droog, wit tot gebroken wit poeder met tutti-frutti-smaak. Na reconstitutie zoals aangegeven, levert de suspensie het equivalent van 125 mg of 250 mg cefuroxim (als cefuroximaxetil) per 5 ml. Het wordt als volgt geleverd in amberkleurige glazen flessen:
125 mg/5 ml
100 ml suspensie NDC 0173-0740-00
250 mg/5 ml
50 ml suspensie NDC 0173-0741-10 100 ml suspensie NDC 0173-0741-00
Bewaar droog poeder vóór reconstitutie tussen 2 ° en 30 ° C (36 ° en 86 ° F).
Na reconstitutie de suspensie onmiddellijk gekoeld bewaren tussen 2 ° en 8 ° C (36 ° en 46 ° F). WEG NA 10 DAGEN WEG.
GlaxoSmithKline, Research Triangle Park, NC 27709. Herzien: oktober 2017
BIJWERKINGEN
De volgende ernstige en anderszins belangrijke bijwerking wordt in meer detail beschreven in het gedeelte Waarschuwingen en voorzorgsmaatregelen op het etiket:
Anafylactische reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
Tabletten
Doseringsregimes met meerdere doses met een duur van 7 tot 10 dagen
In klinische onderzoeken met meerdere doses werden 912 proefpersonen behandeld met CEFTIN (125 tot 500 mg tweemaal daags). Opgemerkt wordt dat 125 mg tweemaal daags geen goedgekeurde dosering is. Twintig (2,2%) proefpersonen stopten met medicatie vanwege bijwerkingen. Zeventien (85%) van de 20 proefpersonen die de therapie staakten, deden dit vanwege gastro-intestinale stoornissen, waaronder diarree, misselijkheid, braken en buikpijn. Het percentage met CEFTIN behandelde proefpersonen dat het onderzoeksgeneesmiddel stopte vanwege bijwerkingen was vergelijkbaar bij dagelijkse doses van 1.000, 500 en 250 mg (respectievelijk 2,3%, 2,1% en 2,2%). De incidentie van gastro-intestinale bijwerkingen nam echter toe met de hogere aanbevolen doses.
De bijwerkingen in Tabel 5 zijn voor proefpersonen (n = 912) die in klinische onderzoeken met meerdere doses werden behandeld met CEFTIN 250 mg.
De volgende bijwerkingen traden op bij minder dan 1% maar meer dan 0,1% van de proefpersonen (n = 912) die werden behandeld met CEFTIN in klinische onderzoeken met meerdere doses.
Immuunsysteemaandoeningen Netelroos, gezwollen tong.
Metabolisme en voedingsstoornissen : Anorexia.
Zenuwstelselaandoeningen : Hoofdpijn.
Hartaandoeningen : Pijn op de borst.
Ademhalingsstoornissen : Kortademigheid.
Maagdarmstelselaandoeningen : Buikpijn, buikkrampen, winderigheid, indigestie, mondzweren.
Huid- en onderhuidaandoeningen : Huiduitslag, jeuk.
Nier- en urinewegaandoeningen : Dysurie.
Voortplantingsstelsel- en borstaandoeningen : Vaginitis, vulvaire jeuk.
Algemene aandoeningen en toedieningsplaatsvoorwaarden : Rillingen, slaperigheid, dorst.
onderzoeken : Positieve Coombs-test.
Vroege ziekte van Lyme met een regime van 20 dagen
Twee multicenter-onderzoeken beoordeelden CEFTIN 500 mg tweemaal daags gedurende 20 dagen. De meest voorkomende geneesmiddelgerelateerde bijwerkingen waren diarree (10,6%), Jarisch-Herxheimer-reactie (5,6%) en vaginitis (5,4%). Andere bijwerkingen traden op met frequenties die vergelijkbaar waren met die gemeld bij een dosering van 7 tot 10 dagen.
Regime met een enkele dosis voor ongecompliceerde gonorroe
In klinische onderzoeken met een enkele dosis van 1000 mg CEFTIN 250 mg werden 1061 proefpersonen behandeld voor ongecompliceerde gonorroe. De bijwerkingen in Tabel 6 waren voor proefpersonen die werden behandeld met een enkele dosis van 1000 mg CEFTIN in klinische onderzoeken in de VS.
De volgende bijwerkingen kwamen voor bij minder dan 1% maar meer dan 0,1% van de proefpersonen (n = 1.061) die werden behandeld met een enkele dosis CEFTIN 1.000 mg voor ongecompliceerde gonorroe in klinische onderzoeken in de VS.
Infecties en parasitaire aandoeningen : Vaginale candidiasis.
Zenuwstelselaandoeningen : Hoofdpijn, duizeligheid, slaperigheid.
Hartaandoeningen : Beklemming/pijn op de borst, tachycardie.
Maagdarmstelselaandoeningen : Buikpijn, dyspepsie.
Huid- en onderhuidaandoeningen : Erytheem, huiduitslag, pruritus.
Musculoskeletale en bindweefselaandoeningen : Spierkrampen, spierstijfheid, spierspasmen van nek, kaak-achtige reactie.
Nier- en urinewegaandoeningen : Bloeding/pijn in urethra, nierpijn.
Voortplantingsstelsel- en borstaandoeningen : Vaginale jeuk, vaginale afscheiding.
Orale suspensie
In klinische onderzoeken waarbij meerdere doses CEFTIN 250 mg werden gebruikt, werden pediatrische proefpersonen (96,7% was jonger dan 12 jaar) behandeld met CEFTIN (20 tot 30 mg/kg/dag tweemaal daags verdeeld tot een maximale dosis van 500 of 1.000 mg/dag, respectievelijk). Elf (1,2%) Amerikaanse proefpersonen staakten de medicatie vanwege bijwerkingen. De stopzettingen waren voornamelijk voor gastro-intestinale stoornissen, meestal diarree of braken. Dertien (1,4%) Amerikaanse pediatrische proefpersonen stopten met de behandeling vanwege de smaak en/of problemen met de toediening van het geneesmiddel.
De bijwerkingen in tabel 7 zijn voor Amerikaanse proefpersonen (n = 931) die werden behandeld met CEFTIN in klinische onderzoeken met meerdere doses.
De volgende bijwerkingen kwamen voor bij minder dan 1% maar meer dan 0,1% van de Amerikaanse proefpersonen (n = 931) die werden behandeld met CEFTIN voor orale suspensie in klinische onderzoeken met meerdere doses.
Infecties en parasitaire aandoeningen : Gastro-intestinale infectie, candidiasis, virale ziekte, bovenste luchtweginfectie, sinusitis, urineweginfectie.
Bloed- en lymfestelselaandoeningen : Eosinofilie.
Psychische stoornissen : Hyperactiviteit, prikkelbaar gedrag.
Maagdarmstelselaandoeningen : Buikpijn, winderigheid, ptyalisme.
Huid- en onderhuidaandoeningen : Uitslag.
Musculoskeletale en bindweefselaandoeningen : Gewrichtszwelling, artralgie.
Voortplantingsstelsel- en borstaandoeningen : Vaginale irritatie.
Algemene aandoeningen en toedieningsplaatsvoorwaarden : Hoesten, koorts.
onderzoeken : Verhoogde leverenzymen, positieve Coombs-test.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van CEFTIN na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bloed- en lymfestelselaandoeningen
Hemolytische anemie, leukopenie, pancytopenie, trombocytopenie.
Maagdarmstelselaandoeningen
Pseudomembraneuze colitis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Lever- en galaandoeningen
Leverfunctiestoornis waaronder hepatitis en cholestase, geelzucht.
Immuunsysteemaandoeningen
Anafylaxie, serumziekte-achtige reactie.
onderzoeken
Verhoogde protrombinetijd.
Zenuwstelselaandoeningen
Toevallen, encefalopathie.
Nier- en urinewegaandoeningen
Nierfunctiestoornis.
Huid- en onderhuidaandoeningen
Angio-oedeem, erythema multiforme, Stevens-Johnson-syndroom, toxische epidermale necrolyse, urticaria.
DRUG-INTERACTIES
Orale anticonceptiva
Cefuroximaxetil kan de darmflora beïnvloeden, wat leidt tot een lagere oestrogeenreabsorptie en verminderde werkzaamheid van gecombineerde orale oestrogeen/progesteron-anticonceptiva. Raad patiënten aan om alternatieve aanvullende (niet-hormonale) anticonceptiemaatregelen te overwegen tijdens de behandeling.
Geneesmiddelen die maagzuur verminderen
Geneesmiddelen die de maagzuurgraad verminderen, kunnen resulteren in een lagere biologische beschikbaarheid van CEFTIN in vergelijking met toediening in nuchtere toestand. Toediening van geneesmiddelen die de zuurgraad van de maag verminderen, kan het voedseleffect van een verhoogde absorptie van CEFTIN 250 mg tenietdoen bij toediening in de postprandiale toestand. Dien CEFTIN ten minste 1 uur vóór of 2 uur na toediening van kortwerkende maagzuurremmers toe. Histamine-2 (H2)-antagonisten en protonpompremmers moeten worden vermeden.
probenecide
Gelijktijdige toediening van probenecide met cefuroximaxetiltabletten verhoogt de serumconcentraties van cefuroxim (zie KLINISCHE FARMACOLOGIE ]. Gelijktijdige toediening van probenecide met cefuroximaxetil wordt niet aanbevolen.
Geneesmiddel-/laboratoriumtestinteracties
Een vals-positieve reactie voor glucose in de urine kan optreden bij koperreductietests (bijv. Benedict's of Fehling's oplossing), maar niet bij op enzymen gebaseerde tests voor glycosurie. Aangezien een vals-negatief resultaat kan optreden bij de ferricyanidetest, wordt aanbevolen om ofwel de glucose-oxidase- ofwel de hexokinasemethode te gebruiken om de bloed-/plasmaglucosespiegels te bepalen bij patiënten die cefuroximaxetil krijgen. De aanwezigheid van cefuroxim interfereert niet met de bepaling van serum- en urinecreatinine volgens de alkalische picraatmethode.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Anafylactische reacties
Ernstige en soms fatale overgevoeligheidsreacties (anafylactische) zijn gemeld bij patiënten die -lactamantibacteriële middelen kregen. Deze reacties komen vaker voor bij personen met een voorgeschiedenis van overgevoeligheid voor -lactam en/of een voorgeschiedenis van gevoeligheid voor meerdere allergenen. Er zijn meldingen geweest van personen met een voorgeschiedenis van overgevoeligheid voor penicilline die ernstige reacties hebben gehad bij behandeling met cefalosporines. CEFTIN 500 mg is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor CEFTIN of andere β-lactam antibacteriële geneesmiddelen [zie CONTRA-INDICATIES ]. Informeer voordat u begint met de behandeling met CEFTIN naar eerdere overgevoeligheidsreacties op penicillines, cefalosporines of andere allergenen. Als een allergische reactie optreedt, stop dan met CEFTIN en stel een geschikte therapie in.
Clostridium Difficile-geassocieerde diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder CEFTIN, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxineproducerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan 2 maanden na toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het gebruik van antibiotica dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
Potentieel voor microbiële overgroei
Tijdens de behandeling moet rekening worden gehouden met de mogelijkheid van superinfecties met schimmel- of bacteriële pathogenen.
Ontwikkeling van geneesmiddelresistente bacteriën
Het is onwaarschijnlijk dat het voorschrijven van CEFTIN bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie de patiënt voordeel zal opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
fenylketonurie
CEFTIN 125 mg voor orale suspensie 125 mg/5 ml bevat 11,8 mg fenylalanine per 5 ml (1 theelepel) gereconstitueerde suspensie. CEFTIN 250 mg voor orale suspensie 250 mg/5 ml bevat fenylalanine 25,2 mg per 5 ml (1 theelepel) gereconstitueerde suspensie.
Interferentie met glucosetests
Een vals-positief resultaat voor glucose in de urine kan optreden bij koperreductietests, en een vals-negatief resultaat voor bloed/plasmaglucose kan optreden bij ferricyanidetests bij proefpersonen die CEFTIN krijgen (zie DRUG-INTERACTIES ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Hoewel er geen levenslange studies bij dieren zijn uitgevoerd om het carcinogene potentieel te evalueren, werd er geen mutagene activiteit gevonden voor cefuroximaxetil in een reeks bacteriële mutatietests. Positieve resultaten werden verkregen in een in vitro chromosoomafwijkingstest; er werden echter negatieve resultaten gevonden in een in vivo micronucleustest bij doses tot 1,5 g/kg. Voortplantingsonderzoeken bij ratten met doses tot 1.000 mg/kg/dag (9 maal de aanbevolen maximale dosis voor de mens op basis van het lichaamsoppervlak) hebben geen verslechtering van de vruchtbaarheid aangetoond.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie B. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons bij de mens, mag CEFTIN alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Er zijn reproductieonderzoeken uitgevoerd bij muizen met doses tot 3.200 mg/kg/dag (14 maal de aanbevolen maximale dosis voor de mens op basis van het lichaamsoppervlak) en bij ratten met doses tot 1.000 mg/kg/dag (9 maal de aanbevolen maximale dosis). dosis voor de mens op basis van lichaamsoppervlak) en er zijn geen aanwijzingen gevonden voor verminderde vruchtbaarheid of schade aan de foetus als gevolg van cefuroximaxetil.
Moeders die borstvoeding geven
Omdat cefuroxim wordt uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer CEFTIN 500 mg wordt toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
De veiligheid en werkzaamheid van CEFTIN 250 mg zijn vastgesteld voor pediatrische patiënten in de leeftijd van 3 maanden tot 12 jaar voor acute bacteriële maxillaire sinusitis op basis van goedkeuring bij volwassenen. Het gebruik van CEFTIN bij pediatrische patiënten wordt ondersteund door farmacokinetische en veiligheidsgegevens bij volwassenen en pediatrische patiënten, en door klinische en microbiologische gegevens uit adequate en goed gecontroleerde onderzoeken naar de behandeling van acute bacteriële maxillaire sinusitis bij volwassenen en van acute otitis media met effusie in pediatrische patiënten. Het wordt ook ondersteund door postmarketing-surveillance van bijwerkingen. [Zien AANWIJZINGEN EN GEBRUIK , DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , KLINISCHE FARMACOLOGIE ]
Geriatrisch gebruik
Van het totale aantal proefpersonen dat CEFTIN 250 mg kreeg in 20 klinische onderzoeken, waren er 375 van 65 jaar en ouder en 151 van 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere volwassen proefpersonen. Gerapporteerde klinische ervaring heeft geen verschillen in respons tussen oudere en jongere volwassen patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Cefuroxim wordt grotendeels uitgescheiden door de nieren en het risico op bijwerkingen kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren.
Nierfunctiestoornis
Het verlagen van de dosering van CEFTIN 125 mg wordt aanbevolen voor volwassen patiënten met een ernstige nierfunctiestoornis (creatinineklaring DOSERING EN ADMINISTRATIE , KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Overdosering van cefalosporines kan cerebrale irritatie veroorzaken, wat kan leiden tot convulsies of encefalopathie. Serumspiegels van cefuroxim kunnen worden verlaagd door hemodialyse en peritoneale dialyse.
CONTRA-INDICATIES
CEFTIN is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid (bijv. anafylaxie) voor CEFTIN of voor andere -lactam-antibacteriële geneesmiddelen (bijv. penicillines en cefalosporines).
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
CEFTIN 250 mg is een antibacterieel medicijn [zie Microbiologie ].
Farmacokinetiek
Absorptie
Na orale toediening wordt cefuroximaxetil geabsorbeerd uit het maagdarmkanaal en snel gehydrolyseerd door niet-specifieke esterasen in het darmslijmvlies en het bloed tot cefuroxim. De farmacokinetische parameters van het serum voor cefuroxim na toediening van CEFTIN 250 mg tabletten aan volwassenen worden weergegeven in Tabel 8.
Voedseleffect
De absorptie van de tablet is groter bij inname na voedsel (absolute biologische beschikbaarheid stijgt van 37% tot 52%). Ondanks dit verschil in absorptie waren de klinische en bacteriologische reacties van proefpersonen onafhankelijk van voedselinname op het moment van toediening van de tablet in 2 onderzoeken waarin dit werd beoordeeld.
Alle farmacokinetische en klinische effectiviteits- en veiligheidsonderzoeken bij pediatrische proefpersonen die de suspensieformulering gebruikten, werden uitgevoerd in gevoede toestand. Er zijn geen gegevens beschikbaar over de absorptiekinetiek van de suspensieformulering bij toediening aan nuchtere pediatrische proefpersonen.
Gebrek aan bio-equivalentie
Orale suspensie was niet bio-equivalent aan tabletten bij testen bij gezonde volwassenen. De formuleringen voor tabletten en orale suspensies zijn NIET substitueerbaar op milligram-permilligram-basis. Het gebied onder de curve voor de suspensie was gemiddeld 91% van dat voor de tablet en de piekplasmaconcentratie voor de suspensie was gemiddeld 71% van de piekplasmaconcentratie van de tabletten. Daarom zijn de veiligheid en werkzaamheid van zowel de tablet- als de orale suspensieformulering vastgesteld in afzonderlijke klinische onderzoeken.
Verdeling
Cefuroxim wordt verdeeld over de extracellulaire vloeistoffen. Ongeveer 50% van het serumcefuroxim is gebonden aan eiwitten.
Metabolisme
De axetilgroep wordt gemetaboliseerd tot aceetaldehyde en azijnzuur.
uitscheiding
Cefuroxim wordt onveranderd in de urine uitgescheiden; bij volwassenen wordt ongeveer 50% van de toegediende dosis binnen 12 uur in de urine teruggevonden. De farmacokinetiek van cefuroxim bij pediatrische proefpersonen is niet onderzocht. Totdat er meer gegevens beschikbaar zijn, mag de renale eliminatie van cefuroximaxetil, vastgesteld bij volwassenen, niet worden geëxtrapoleerd naar pediatrische patiënten.
Specifieke populaties
Nierfunctiestoornis
In een onderzoek bij 28 volwassenen met een normale nierfunctie of een ernstige nierfunctiestoornis (creatinineklaring DOSERING EN ADMINISTRATIE ].
Pediatrische patiënten
De farmacokinetische parameters van het serum voor cefuroxim bij pediatrische patiënten die CEFTIN voor orale suspensie kregen toegediend, worden weergegeven in Tabel 9.
Geriatrische patiënten
In een onderzoek met 20 oudere proefpersonen (gemiddelde leeftijd = 83,9 jaar) met een gemiddelde creatinineklaring van 34,9 ml/min, was de gemiddelde serumeliminatiehalfwaardetijd verlengd tot 3,5 uur; ondanks de lagere eliminatie van cefuroxim bij geriatrische patiënten is een dosisaanpassing op basis van leeftijd echter niet nodig [zie Gebruik bij specifieke populaties ].
Geneesmiddelinteracties
Gelijktijdige toediening van probenecide met cefuroximaxetiltabletten verhoogt het cefuroxim-oppervlak onder de serumconcentratie-versus-tijdcurve en de maximale serumconcentratie met respectievelijk 50% en 21%.
Microbiologie
Werkingsmechanisme
Cefuroximaxetil is een bacteriedodend middel dat werkt door remming van de synthese van bacteriële celwanden. Cefuroximaxetil is werkzaam in aanwezigheid van sommige β-lactamasen, zowel penicillinasen als cefalosporinasen, van gramnegatieve en grampositieve bacteriën.
Mechanisme van weerstand
Resistentie tegen cefuroximaxetil vindt voornamelijk plaats door hydrolyse door β-lactamase, wijziging van penicillinebindende eiwitten (PBP's), verminderde permeabiliteit en de aanwezigheid van bacteriële effluxpompen.
De gevoeligheid voor cefuroximaxetil varieert met de geografische ligging en de tijd; lokale gevoeligheidsgegevens moeten worden geraadpleegd, indien beschikbaar. Bèta-lactamase-negatieve, ampicilline-resistente (BLNAR) isolaten van H. influenzae moeten als resistent worden beschouwd tegen cefuroximaxetil.
Van cefuroximaxetil is aangetoond dat het actief is tegen de meeste isolaten van de volgende bacteriën, zowel in vitro als bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK ]:
Gram-positieve bacteriën
Staphylococcus aureus (alleen meticilline-gevoelige isolaten) Streptococcus pneumoniae Streptococcus pyogenes
Gram-negatieve bacteriën
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a De meest uitgebreide spectrum -lactamase (ESBL)-producerende en carbapenemase-producerende isolaten zijn resistent tegen cefuroximaxetil. Spirocheten Borrelia Burgdorferi
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Ten minste 90 procent van de volgende micro-organismen vertoont een in vitro minimale remmende concentratie (MIC) die kleiner is dan of gelijk is aan het gevoelige breekpunt voor cefuroximaxetil van 1 mcg/ml. De werkzaamheid van cefuroximaxetil bij de behandeling van klinische infecties veroorzaakt door deze micro-organismen is echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve bacteriën
Staphylococcus epidermidis (alleen meticilline-gevoelige isolaten) Staphylococcus saprophyticus (alleen methicilline-gevoelige isolaten) Streptococcus agalactiae
Gram-negatieve bacteriën
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaërobe bacteriën Peptococcus niger
Gevoeligheidstestmethoden
Indien beschikbaar, moet het laboratorium voor klinische microbiologie de resultaten van in vitro gevoeligheidstests voor antimicrobiële geneesmiddelen die in lokale ziekenhuizen en praktijkruimten worden gebruikt, aan de arts verstrekken als periodieke rapporten die het gevoeligheidsprofiel van nosocomiale en door de gemeenschap verworven pathogenen beschrijven. Deze rapporten zouden de arts moeten helpen bij het selecteren van een antibacterieel geneesmiddel voor behandeling.
Verdunningstechnieken
Kwantitatieve methoden worden gebruikt om antimicrobiële MIC's te bepalen. Deze MIC's bieden reproduceerbare schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De MIC's moeten worden bepaald met behulp van een gestandaardiseerde testmethode (bouillon of agar).1, 2 De MIC-waarden moeten worden geïnterpreteerd volgens de criteria in tabel 10.2,3
Diffusietechnieken
Kwantitatieve methoden die het meten van zonediameters vereisen, bieden ook reproduceerbare schattingen van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte geeft een schatting van de gevoeligheid van bacteriën voor antimicrobiële verbindingen. De zonegrootte moet worden bepaald met behulp van een gestandaardiseerde testmethode.4 Bij deze procedure worden papieren schijven geïmpregneerd met 30 mcg cefuroximaxetil gebruikt om de gevoeligheid van micro-organismen voor cefuroximaxetil te testen. De interpretatieve criteria voor schijfdiffusie worden gegeven in Tabel 10.3
De gevoeligheid van stafylokokken voor cefuroxim kan worden afgeleid uit het testen van alleen penicilline en cefoxitine of oxacilline.
De gevoeligheid van Streptococcus pyogenes kan worden afgeleid uit het testen van penicilline
Een rapport van "Visbaar" geeft aan dat het antimicrobiële geneesmiddel waarschijnlijk de groei van de ziekteverwekker remt als het antimicrobiële geneesmiddel de concentratie bereikt die gewoonlijk op de plaats van infectie kan worden bereikt. Een rapport van "Intermediair" geeft aan dat het resultaat als dubbelzinnig moet worden beschouwd, en als het micro-organisme niet volledig vatbaar is voor alternatieve, klinisch haalbare geneesmiddelen, moet de test worden herhaald. Deze categorie impliceert mogelijke klinische toepasbaarheid op lichaamslocaties waar het medicijn fysiologisch geconcentreerd is of in situaties waar een hoge dosering van het medicijn kan worden gebruikt. Deze categorie biedt ook een bufferzone die voorkomt dat kleine ongecontroleerde technische factoren grote interpretatieverschillen veroorzaken. Een rapport van "Resistent" geeft aan dat het antimicrobiële geneesmiddel de groei van de ziekteverwekker waarschijnlijk niet remt als het antimicrobiële geneesmiddel de concentraties bereikt die gewoonlijk op de infectieplaats kunnen worden bereikt; andere therapie moet worden gekozen.
Kwaliteitscontrole
Gestandaardiseerde gevoeligheidstestprocedures vereisen het gebruik van laboratoriumcontroles om de nauwkeurigheid en precisie van de voorraden en reagentia die in de test worden gebruikt, en de technieken van de persoon die de test uitvoert, te bewaken en te verzekeren.1,2,4 De QC-bereiken voor MIC- en schijfdiffusie testen met de 30-mcg-schijf vindt u in tabel 11.3
Klinische studies
Acute bacteriële maxillaire sinusitis
Eén adequate en goed gecontroleerde studie werd uitgevoerd bij proefpersonen met acute bacteriële maxillaire sinusitis. In deze proef had elke proefpersoon een maxillaire sinus-aspiraat verzameld door sinuspunctie voordat de behandeling werd gestart voor vermoedelijke acute bacteriële sinusitis. Alle proefpersonen hadden radiografisch en klinisch bewijs van acute maxillaire sinusitis. In het onderzoek was de klinische effectiviteit van CEFTIN bij de behandeling van acute maxillaire sinusitis vergelijkbaar met die van een oraal antimicrobieel middel dat een specifieke β-lactamaseremmer bevat. Uit microbiologische gegevens bleek echter dat CEFTIN effectief is bij de behandeling van acute bacteriële maxillaire sinusitis die alleen veroorzaakt wordt door Streptococcus pneumoniae of niet-β-lactamase-producerende Haemophilus influenzae. In deze studie werden onvoldoende aantallen β-lactamase-producerende Haemophilus influenzae- en Moraxella catarrhalis-isolaten verkregen om de effectiviteit van CEFTIN bij de behandeling van acute bacteriële maxillaire sinusitis als gevolg van deze 2 organismen te evalueren.
Deze studie randomiseerde 317 volwassen proefpersonen, 132 proefpersonen in de VS en 185 proefpersonen in Zuid-Amerika. Tabel 12 toont de resultaten van de intent-to-treat-analyse.
In deze studie en in een ondersteunende maxillaire punctiestudie hadden 15 evalueerbare proefpersonen niet-β-lactamase-producerende Haemophilus influenzae als de geïdentificeerde ziekteverwekker. Hiervan had 67% (10/15) deze ziekteverwekker uitgeroeid. Achttien (18) evalueerbare proefpersonen hadden Streptococcus pneumoniae als het geïdentificeerde pathogeen. Van hen had 83% (15/18) deze ziekteverwekker uitgeroeid.
Vroege ziekte van Lyme
Er zijn twee adequate en goed gecontroleerde onderzoeken uitgevoerd bij proefpersonen met de vroege ziekte van Lyme. Alle proefpersonen vertoonden door een arts gedocumenteerde erythema migrans, met of zonder systemische manifestaties van infectie. De proefpersonen werden 1 maand na de behandeling beoordeeld op succes bij de behandeling van de vroege ziekte van Lyme (deel I) en op 1 jaar na de behandeling op succes bij het voorkomen van de progressie naar de gevolgen van de late ziekte van Lyme (deel II).
Een totaal van 355 volwassen proefpersonen (181 behandeld met cefuroximaxetil en 174 behandeld met doxycycline) werden gerandomiseerd in de 2 onderzoeken, waarbij de diagnose van vroege ziekte van Lyme werd bevestigd bij 79% (281/355). De klinische diagnose van vroege ziekte van Lyme bij deze proefpersonen werd gevalideerd door 1) blinde deskundige lezing van foto's, indien beschikbaar, van de huidlaesie van erythema migrans vóór de behandeling, en 2) serologische bevestiging (met behulp van enzyme-linked immunosorbent assay [ELISA] en immunoblot-assay [“Western” blot]) van de aanwezigheid van antilichamen die specifiek zijn voor Borrelia burgdorferi, het etiologische agens van de ziekte van Lyme. De werkzaamheidsgegevens in tabel 13 zijn specifiek voor deze "gevalideerde" patiëntensubgroep, terwijl de onderstaande veiligheidsgegevens de volledige patiëntenpopulatie voor de 2 onderzoeken weergeven. Klinische gegevens voor evalueerbare proefpersonen in de "gevalideerde" patiëntensubgroep worden weergegeven in Tabel 13.
CEFTIN en doxycycline waren effectief bij het voorkomen van de ontwikkeling van gevolgen van de late ziekte van Lyme.
Hoewel de incidentie van geneesmiddelgerelateerde gastro-intestinale bijwerkingen vergelijkbaar was in de 2 behandelingsgroepen (cefuroximaxetil - 13%; doxycycline - 11%), was de incidentie van geneesmiddelgerelateerde diarree hoger in de cefuroximaxetil-arm dan in de doxycycline-arm (11 % versus 3 %, respectievelijk).
REFERENTIES
1. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor verdunning Antimicrobiële gevoeligheidstests voor bacteriën die aeroob groeien; Goedgekeurde standaard - tiende editie. 2015. CLSI-document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
2. Instituut voor klinische en laboratoriumnormen (CLSI). Methoden voor antimicrobiële verdunning en schijfgevoeligheidstests voor zelden geïsoleerde of veeleisende bacteriën: goedgekeurde richtlijnen - tweede editie. 2010. CLSI-document M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
3. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor antimicrobiële gevoeligheidstesten; Vijfentwintigste informatief supplement. 2015. CLSI-document M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
4. Instituut voor klinische en laboratoriumnormen (CLSI). Prestatienormen voor gevoeligheidstests voor antimicrobiële schijfdiffusie; Goedgekeurde standaard - Twaalfde editie. 2015. CLSI-document M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, VS.
PATIËNT INFORMATIE
Allergische reacties
Informeer patiënten dat CEFTIN een cefalosporine is dat bij sommige personen allergische reacties kan veroorzaken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Clostridium Difficile-geassocieerde diarree
Informeer patiënten dat diarree een veelvoorkomend probleem is dat wordt veroorzaakt door antibacteriële middelen en dat het meestal stopt wanneer het antibacteriële middel wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibacteriële middelen waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas 2 maanden of langer nadat ze hun laatste dosis van het antibacteriële middel hebben ingenomen. Als dit gebeurt, adviseer patiënten dan om zo snel mogelijk contact op te nemen met hun arts.
fenylketonurie
Informeer patiënten en zorgverleners dat CEFTIN 125 mg voor orale suspensie fenylalanine (een bestanddeel van aspartaam) bevat (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Tabletten verpletteren
Instrueer patiënten om de tablet in zijn geheel door te slikken, zonder de tablet te pletten. Patiënten die de tablet niet in zijn geheel kunnen doorslikken, moeten de orale suspensie krijgen.
Orale suspensie
Instrueer patiënten om de orale suspensie voor elk gebruik goed te schudden, in de koelkast te bewaren en na 10 dagen weg te gooien. De orale suspensie moet met voedsel worden ingenomen.
Geneesmiddelresistentie
Informeer patiënten dat antibacteriële geneesmiddelen, waaronder CEFTIN, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Ze behandelen geen virale infecties (bijv. verkoudheid). Als CEFTIN 250 mg wordt voorgeschreven om een bacteriële infectie te behandelen, vertel de patiënten dan dat, hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies zoals voorgeschreven moet worden ingenomen. Het overslaan van doses of het niet voltooien van de volledige therapiekuur kan: (1) de effectiviteit van de onmiddellijke behandeling verminderen, en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet kunnen worden behandeld met CEFTIN 500 mg of andere antibacteriële geneesmiddelen .
