Furadantin 100mg Nitrofurantoin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Furadantin 100 mg en hoe wordt het gebruikt?
Furadantin (nitrofurantoïne suspensie voor oraal gebruik) is een antibioticum dat wordt gebruikt voor de behandeling van urineweginfecties. Furadantin is beschikbaar in generieke vorm.
Wat zijn bijwerkingen van Furadantin?
Vaak voorkomende bijwerkingen van Furadantin zijn onder meer:
- misselijkheid,
- braken,
- verlies van eetlust,
- maagklachten,
- diarree,
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- roestkleurige of bruinachtige urine, of
- vaginale jeuk of afscheiding.
Vertel het uw arts als u zeldzame maar zeer ernstige bijwerkingen van Furadantin heeft, waaronder:
- oogpijn,
- visie verandert,
- mentale / stemmingswisselingen,
- aanhoudende of ernstige hoofdpijn,
- nieuwe tekenen van infectie (bijv. koorts, aanhoudende keelpijn), of
- gemakkelijk blauwe plekken of bloedingen.
OMSCHRIJVING
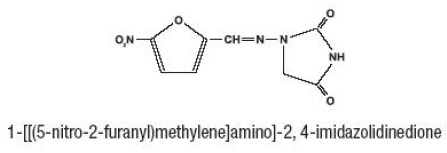
Furadantin (nitrofurantoïne), een synthetische chemische stof, is een stabiele, gele, kristallijne verbinding. Furadantin is een antibacterieel middel voor specifieke urineweginfecties. Furadantin is beschikbaar in 25 mg/5 ml vloeibare suspensie voor orale toediening.
inactieve ingredienten
Furadantin orale suspensie bevat carboxymethylcellulose-natrium, citroenzuur, smaakstoffen, glycerine, magnesiumaluminiumsilicaat, methylparaben, propylparaben, gezuiverd water, natriumcitraat en sorbitol.
INDICATIES
Furadantin is specifiek geïndiceerd voor de behandeling van urineweginfecties als gevolg van gevoelige stammen van Escherichia coli, enterokokken, Staphylococcus aureus en bepaalde gevoelige stammen van Klebsiella- en Enterobacter-soorten.
Nitrofurantoïne is niet geïndiceerd voor de behandeling van pyelonefritis of perinefrische abcessen.
Nitrofurantoïnen missen de bredere weefseldistributie van andere therapeutische middelen die zijn goedgekeurd voor urineweginfecties. Bijgevolg zijn veel patiënten die worden behandeld met Furadantin vatbaar zijn voor persistentie of terugkeer van bacteriurie. Urinemonsters voor kweek- en gevoeligheidstests moeten vóór en na voltooiing van de therapie worden verkregen. Als aanhoudende of terugkeer van bacteriurie optreedt na behandeling met: Furadantin , moeten andere therapeutische middelen met een bredere weefseldistributie worden geselecteerd. Bij het overwegen van het gebruik van Furadantin , moeten lagere uitroeiingspercentages worden afgewogen tegen het verhoogde potentieel voor systemische toxiciteit en voor de ontwikkeling van antimicrobiële resistentie wanneer middelen met een bredere weefseldistributie worden gebruikt.
DOSERING EN ADMINISTRATIE
Furadantin moet met voedsel worden gegeven om de absorptie van het geneesmiddel en, bij sommige patiënten, de tolerantie te verbeteren.
volwassenen
50-100 mg vier keer per dag - het lagere doseringsniveau wordt aanbevolen voor ongecompliceerde urineweginfecties.
Pediatrische patiënten
5-7 mg/kg lichaamsgewicht per 24 uur, verdeeld over vier doses (gecontra-indiceerd bij een leeftijd van minder dan één maand).
De volgende tabel is gebaseerd op een gemiddeld gewicht in elk bereik dat 5 tot 6 mg/kg lichaamsgewicht per 24 uur krijgt, verdeeld over vier doses. Het kan worden gebruikt om een gemiddelde dosis van Furadantin Orale suspensie (25 mg/5 ml) voor pediatrische patiënten.
De therapie moet worden voortgezet gedurende een week of gedurende ten minste 3 dagen nadat steriliteit van de urine is verkregen. Voortdurende infectie wijst op de noodzaak van herevaluatie.
Voor langdurige suppressieve therapie bij volwassenen kan een verlaging van de dosering tot 50-100 mg voor het slapengaan voldoende zijn. Voor langdurige suppressieve therapie bij pediatrische patiënten kunnen doses van slechts 1 mg/kg per 24 uur, gegeven in een enkele dosis of in twee verdeelde doses, voldoende zijn. ZIEN SECTIE WAARSCHUWINGEN MET BETREKKING TOT RISICO'S VERBONDEN AAN LANGDURIGE THERAPIE .
HOE GELEVERD
Furadantin Orale suspensie is beschikbaar in:
NDC 70199-006-32 PET amberkleurige fles van 230 ml
Vermijd blootstelling aan sterk licht dat het medicijn donkerder kan maken. Het is stabiel bij opslag tussen 20°- 25°C (68°-77°F); excursies toegestaan tot 15°-30°C (59°-86°F) [Zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen bevriezing. Schud krachtig. Doseer in een strakke, lichtbestendige, plastic (PET) of glazen container.
Gebruik binnen 30 dagen.
Buiten bereik van kinderen houden.
Gefabriceerd voor: Casper Pharma LLC, East Brunswick NJ 08816. Herzien: december 2020
BIJWERKINGEN
Ademhaling
CHRONISCHE, SUBACUTE OF ACUTE PULMONALE OVERGEVOELIGHEIDSREACTIES KUNNEN VOORKOMEN.
CHRONISCHE PULMONALE REACTIES KUNNEN IN HET ALGEMEEN VOORKOMEN BIJ PATINTEN DIE ZES MAANDEN OF LANGER EEN CONTINUE BEHANDELING HEBBEN. MALAISE, DYSPNEA BIJ INSPANNING, HOEST EN GEWIJZIGDE PULMONALE FUNCTIE ZIJN VEELVOORKOMENDE MANIFESTATIES DIE SLECHT KUNNEN VOORKOMEN. RADIOLOGISCHE EN HISTOLOGISCHE BEVINDINGEN VAN DIFFUSE INTERSTITIAL PNEUMONITIS OF FIBROSE, OF BEIDE, ZIJN OOK VEEL VOORKOMENDE MANIFESTATIES VAN DE CHRONISCHE PULMONALE REACTIE. KOORTS IS ZELDEN PROMINENT.
DE ERNST VAN CHRONISCHE PULMONALE REACTIES EN DE GRADEN VAN OPLOSSING LIJKEN GERELATEERD TE ZIJN MET DE DUUR VAN DE THERAPIE NADAT DE EERSTE KLINISCHE TEKENEN VERSCHIJNEN. DE PULMONALE FUNCTIE KAN PERMANENT WORDEN BESCHADIGD, ZELFS NA STOPZETTING VAN DE THERAPIE. HET RISICO IS GROTER WANNEER CHRONISCHE PULMONALE REACTIES NIET VROEG WORDEN ERKENNEN.
Bij subacute longreacties komen koorts en eosinofilie minder vaak voor dan in de acute vorm. Na stopzetting van de therapie kan het herstel enkele maanden duren. Als de symptomen niet als geneesmiddelgerelateerd worden herkend en de behandeling met nitrofurantoïne niet wordt stopgezet, kunnen de symptomen ernstiger worden.
Acute pulmonale reacties worden vaak gemanifesteerd door koorts, koude rillingen, hoesten, pijn op de borst, dyspneu, pulmonale infiltratie met consolidatie van pleurale effusie op röntgenfoto's en eosinofilie.
Acute reacties treden gewoonlijk op binnen de eerste week van de behandeling en zijn reversibel bij stopzetting van de behandeling. Resolutie is vaak dramatisch. (zien WAARSCHUWINGEN )
Veranderingen in ECG (bijv. niet-specifieke ST/T-golfveranderingen, bundeltakblok) zijn gemeld in verband met longreacties.
Cyanose is zelden gemeld.
lever
Leverreacties, waaronder hepatitis, cholestatische geelzucht, chronische actieve hepatitis en leverneurose, komen zelden voor. (zien WAARSCHUWINGEN )
neurologisch
Perifere neuropathie, die ernstig of onomkeerbaar kan worden, is opgetreden. Er zijn doden gemeld. Aandoeningen zoals nierfunctiestoornis (creatinineklaring minder dan 60 ml per minuut of klinisch significant verhoogd serumcreatinine), bloedarmoede, diabetes mellitus, verstoorde elektrolytenbalans, vitamine B-tekort en slopende ziekten kunnen de kans op perifere neuropathie vergroten (zie WAARSCHUWINGEN )
Asthenie, duizeligheid, nystagmus, duizeligheid, hoofdpijn en slaperigheid zijn ook gemeld bij het gebruik van nitrofurantoïne.
Goedaardige intracraniële hypertensie (pseudotumor cerebri), verwardheid, depressie, optische neuritis en psychotische reacties zijn zelden gemeld. Uitpuilende fontanellen, als teken van goedaardige intracraniële hypertensie bij zuigelingen, zijn zelden gemeld.
dermatologisch
Exfoliatieve dermatitis en erythema multiforme (inclusief Stevens-Johnson-syndroom) zijn zelden gemeld. Voorbijgaande alopecia is ook gemeld.
Allergisch
Er is melding gemaakt van een lupusachtig syndroom geassocieerd met pulmonale reacties op nitrofurantoïne. Ook angio-oedeem; maculopapulaire, erythemateuze of eczemateuze uitbarstingen; jeuk; netelroos; anafylaxie; artralgie; spierpijn; drugskoorts; en vasculitis (soms geassocieerd met pulmonale reacties) zijn gemeld. Overgevoeligheidsreacties zijn de meest voorkomende spontaan gemelde bijwerkingen in de wereldwijde postmarketingervaring met nitrofurantoïneformuleringen.
gastro-intestinaal
Misselijkheid, braken en anorexia komen het vaakst voor. Buikpijn en diarree zijn minder vaak voorkomende gastro-intestinale reacties. Deze dosisgerelateerde reacties kunnen tot een minimum worden beperkt door de dosering te verlagen. Sialadenitis en pancreatitis zijn gemeld. Er zijn sporadische meldingen geweest van pseudomembraneuze colitis bij gebruik van nitrofurantoïne. Symptomen van pseudomembraneuze colitis kunnen optreden tijdens of na antimicrobiële behandeling. (zien WAARSCHUWINGEN )
hematologisch
Cyanose secundair aan methemoglobinemie is zelden gemeld.
Diversen
Net als bij andere antimicrobiële middelen kunnen superinfecties optreden die worden veroorzaakt door resistente organismen, bijv. Pseudomonas-soorten of Candida-soorten. Er zijn sporadische meldingen van superinfecties met Clostridium difficile of pseudomembraneuze colitis bij gebruik van nitrofurantoïne.
Bijwerkingen in het laboratorium
De volgende laboratoriumbijwerkingen zijn gemeld bij het gebruik van nitrofurantoïne; verhoogd AST (SGOT), verhoogd ALT (SGPT), verlaagd hemoglobine, verhoogd serumfosfor, eosinofilie, glucose-6-fosfaatdehydrogenasedeficiëntie anemie (zie WAARSCHUWINGEN ), agranulocytose, leukopenie, granulocytopenie, hemolytische anemie, trombocytopenie, megaloblastaire anemie. In de meeste gevallen verdwenen deze hematologische afwijkingen na stopzetting van de therapie. Aplastische anemie is zelden gemeld.
Neem contact op met Casper Pharma LLC om VERMOEDELIJKE ONGEWENSTE REACTIES te melden. op 1-844-5-CASPER (1-844-522-7737) of FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.
DRUG-INTERACTIES
Antacida die magnesiumtrisilicaat bevatten, verminderen bij gelijktijdige toediening met nitrofurantoïne zowel de snelheid als de mate van absorptie. Het mechanisme voor deze interactie is waarschijnlijk de adsorptie van nitrofurantoïne op het oppervlak van magnesiumtrisilicaat.
Uricosurische geneesmiddelen, zoals probenecide en sulfinpyrazon, kunnen de renale tubulaire secretie van nitrofurantoïne remmen. De resulterende verhoging van de nitrofurantoïne-serumspiegels kan de toxiciteit verhogen en de verlaagde urinespiegels kunnen de werkzaamheid ervan als antibacterieel middel in de urinewegen verminderen.
Geneesmiddel-/laboratoriumtestinteracties
Als gevolg van de aanwezigheid van nitrofurantoïne kan een vals-positieve reactie voor glucose in de urine optreden. Dit is waargenomen met de oplossingen van Benedict en Fehling, maar niet met de glucose-enzymatische test.
WAARSCHUWINGEN
Pulmonale reacties
ACUTE, SUBACUTE OF CHRONISCHE PULMONALE REACTIES ZIJN WAARGENOMEN BIJ PATINTEN DIE MET NITROFURANTOIN BEHANDELD WORDEN. ALS DEZE REACTIES OPTREDEN, MOET FURADANTINE 100 mg WORDEN STOPGEZET EN DIENT U PASSENDE MAATREGELEN TE NEMEN. RAPPORTEN HEBBEN PULMONALE REACTIES AANGEVOERD ALS EEN BIJDRAGENDE DOODOORZAAK.
CHRONISCHE PULMONALE REACTIES (DIFFUSE INTERSTITIAL PNEUMONITIS OF PULMONALE FIBROSE, OF BEIDE) KUNNEN SLECHT ONTWIKKELEN. DEZE REACTIES KOMEN ZELDZAAM EN IN HET ALGEMEEN VOOR BIJ PATINTEN DIE THERAPIE KRIJGEN VOOR ZES MAANDEN OF LANGER. NAUWKEURIGE MONITORING VAN DE PULMONALE TOESTAND VAN PATINTEN DIE LANGDURIGE THERAPIE KRIJGEN IS GEGARANDEERD EN VEREIST DAT DE VOORDELEN VAN DE THERAPIE WORDEN afgewogen tegen POTENTILE RISICO'S. (zie ADEMHALINGSREACTIES.)
Hepatotoxiciteit
Leverreacties, waaronder hepatitis, cholestatische geelzucht, chronische actieve hepatitis en levernecrose, komen zelden voor. Er zijn doden gemeld. Het begin van chronische actieve hepatitis kan verraderlijk zijn en patiënten moeten periodiek worden gecontroleerd op veranderingen in biochemische tests die op leverbeschadiging zouden kunnen wijzen. Als hepatitis optreedt, moet het geneesmiddel onmiddellijk worden stopgezet en moeten passende maatregelen worden genomen.
neuropathie
Perifere neuropathie, die ernstig of onomkeerbaar kan worden, is opgetreden. Er zijn doden gemeld. Aandoeningen zoals nierfunctiestoornis (creatinineklaring minder dan 60 ml per minuut of klinisch significant verhoogd serumcreatinine), bloedarmoede, diabetes mellitus, verstoorde elektrolytenbalans, vitamine B-tekort en slopende ziekte kunnen het optreden van perifere neuropathie versterken. Patiënten die langdurig worden behandeld, moeten periodiek worden gecontroleerd op veranderingen in de nierfunctie.
Optische neuritis is zelden gemeld tijdens postmarketingervaring met nitrofurantoïneformuleringen.
Hemolytische anemie
Gevallen van hemolytische anemie van het primaquine-gevoeligheidstype zijn geïnduceerd door nitrofurantoïne. Hemolyse lijkt verband te houden met een glucose-6-fosfaatdehydrogenasedeficiëntie in de rode bloedcellen van de getroffen patiënten. Dit tekort komt voor bij 10 procent van de zwarten en een klein percentage van etnische groepen van mediterrane en oosterse afkomst. Hemolyse is een indicatie om te stoppen Furadantin hemolyse stopt wanneer het medicijn wordt stopgezet.
Clostridium Difficile-geassocieerde diarree
Clostridium difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder: Furadantin Orale suspensie, en kan in ernst variëren van milde diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na gebruik van antibiotica. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het gebruik van antibiotica dat niet is gericht tegen C. difficile. Gepast vocht- en elektrolytenbeheer, eiwitsuppletie, antibioticabehandeling van C. difficile en chirurgische evaluatie moeten worden ingesteld zoals klinisch geïndiceerd.
PREVENTIEVE MAATREGELEN
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Nitrofurantoïne was niet kankerverwekkend wanneer het werd gevoerd aan vrouwelijke Holtzman-ratten gedurende 44,5 weken of aan vrouwelijke Sprague-Dawley-ratten gedurende 75 weken. Twee chronische bioassays bij knaagdieren met mannelijke en vrouwelijke Sprague-Dawley-ratten en twee chronische bioassays bij Zwitserse muizen en BDF1-muizen lieten geen bewijs van carcinogeniteit zien.
Nitrofurantoïne leverde bewijs van carcinogene activiteit bij vrouwelijke B6C3F1-muizen, zoals blijkt uit een verhoogde incidentie van tubulaire adenomen, goedaardige gemengde tumoren en granulosaceltumoren van de eierstok. Bij mannelijke F344/N-ratten waren er verhoogde incidenties van soms voorkomende tubulaire niercelneoplasmata, osteosarcomen van het bot en neoplasmata van het onderhuidse weefsel. In één onderzoek met subcutane toediening van 75 mg/kg nitrofurantoïne aan zwangere vrouwelijke muizen, werden papillaire longadenomen van onbekende betekenis waargenomen bij de F1-generatie.
Van nitrofurantoïne is aangetoond dat het puntmutaties induceert in bepaalde stammen van Salmonella typhimurium en voorwaartse mutaties op L5178Y-lymfoomcellen van muizen. Nitrofurantoïne veroorzaakte verhoogde aantallen uitwisselingen van zusterchromatiden en chromosomale afwijkingen in ovariumcellen van Chinese hamsters, maar niet in menselijke cellen in kweek. Resultaten van de geslachtsgebonden recessieve letale test in Drosophila waren negatief na toediening van nitrofurantoïne via voeding of injectie. Nitrofurantoïne induceerde geen erfelijke mutatie in de onderzochte knaagdiermodellen.
Het belang van carcinogeniteits- en mutageniteitsbevindingen met betrekking tot het therapeutische gebruik van nitrofurantoïne bij mensen is niet bekend.
De toediening van hoge doses nitrofurantoïne aan ratten veroorzaakt een tijdelijke stopzetting van de spermatogenese; dit is omkeerbaar bij het stoppen met het medicijn. Doses van 10 mg/kg/dag of meer bij gezonde menselijke mannen kunnen, in bepaalde onvoorspelbare gevallen, een lichte tot matige spermatogene stilstand veroorzaken met een afname van het aantal zaadcellen.
Zwangerschap
Teratogene effecten
Er zijn verschillende reproductieonderzoeken uitgevoerd bij konijnen en ratten met doses tot zes keer de dosis voor de mens en er zijn geen aanwijzingen gevonden voor verminderde vruchtbaarheid of schade aan de foetus als gevolg van nitrofurantoïne. In een enkele gepubliceerde studie uitgevoerd bij muizen met 68 keer de dosis voor de mens (gebaseerd op mg/kg toegediend aan de moeder), werden groeiachterstand en een lage incidentie van kleine en veel voorkomende misvormingen waargenomen. Bij 25 maal de dosis voor de mens werden echter geen foetale misvormingen waargenomen; de relevantie van deze bevindingen voor de mens is onzeker. Er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Niet-teratogene effecten
Nitrofurantoïne is aangetoond in een gepubliceerde transplacentale carcinogeniteitsstudie om papillaire longadenomen te induceren bij muizen van de F1-generatie in doses die 19 maal de dosis voor de mens zijn op basis van mg/kg. De relatie tussen deze bevinding en mogelijke carcinogenese bij de mens is momenteel niet bekend. Vanwege de onzekerheid over de menselijke implicaties van deze diergegevens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Bevalling
Zien CONTRA-INDICATIES .
Moeders die borstvoeding geven
Nitrofurantoïne is in sporenhoeveelheden aangetroffen in moedermelk. Vanwege het potentieel voor ernstige bijwerkingen van nitrofurantoïne bij zuigelingen jonger dan één maand, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder. (zien CONTRA-INDICATIES )
Pediatrisch gebruik
Veiligheid en effectiviteit van Furadantin bij pasgeborenen jonger dan één maand zijn niet vastgesteld. (zien CONTRA-INDICATIES )
OVERDOSERING
Incidentele gevallen van acute overdosering van Furadantin hebben niet geleid tot andere specifieke symptomen dan braken. Inductie van braken wordt aanbevolen. Er is geen specifiek antidotum, maar een hoge vochtinname moet worden gehandhaafd om de uitscheiding van het geneesmiddel via de urine te bevorderen. Het is dialyseerbaar.
CONTRA-INDICATIES
Anurie, oligurie of significante nierfunctiestoornis (creatinineklaring minder dan 60 ml per minuut of klinisch significant verhoogd serumcreatinine) zijn contra-indicaties. Behandeling van dit type patiënt brengt een verhoogd risico op toxiciteit met zich mee vanwege een verminderde uitscheiding van het geneesmiddel.
Vanwege de mogelijkheid van hemolytische anemie als gevolg van onvolgroeide erytrocyten-enzymsystemen (glutathion-instabiliteit), is het medicijn gecontra-indiceerd bij zwangere patiënten op termijn (38-42 weken zwangerschap), tijdens de bevalling en de bevalling, of wanneer het begin van de bevalling op handen is. Om dezelfde reden is het medicijn gecontra-indiceerd bij pasgeborenen jonger dan een maand.
Furadantin is gecontra-indiceerd bij patiënten met een voorgeschiedenis van cholestatische geelzucht/leverdisfunctie geassocieerd met nitrofurantoïne. Furadantin is ook gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor nitrofurantoïne.
KLINISCHE FARMACOLOGIE
Oraal toegediend Furadantin wordt gemakkelijk geabsorbeerd en snel uitgescheiden in de urine. Bloedconcentraties bij therapeutische dosering zijn meestal laag. Het is zeer goed oplosbaar in urine, waaraan het een bruine kleur kan geven.
Na een doseringsschema van 100 mg eenmaal per dag gedurende 7 dagen, waren de gemiddelde recuperaties van geneesmiddelen in de urine (0-24 uur) op dag 1 en dag 7 42,7% en 43,6%.
In tegenstelling tot veel medicijnen kan de aanwezigheid van voedsel of middelen die de maaglediging vertragen de biologische beschikbaarheid van Furadantin , vermoedelijk door een betere oplossing in maagsappen mogelijk te maken.
Microbiologie
Actie modus
Nitrofurantoïne wordt door een groot aantal enzymen, waaronder bacteriële flavoproteïnen, gereduceerd tot reactieve tussenproducten die schadelijk zijn voor macromoleculen zoals DNA en eiwitten.
Kruisweerstand
Hoewel kruisresistentie met andere antimicrobiële middelen kan optreden, is er geen kruisresistentie met sulfonamiden waargenomen.
Interactie met andere antimicrobiële middelen
Antagonisme is in vitro aangetoond tussen nitrofurantoïne en chinolon-antimicrobiële middelen. Nitrofurantoïne, in de vorm van nitrofurantoïne suspensie voor oraal gebruik, is werkzaam gebleken tegen de meeste van de volgende bacteriën, zowel in vitro als bij klinische infecties: (Zie AANWIJZINGEN EN GEBRUIK ).
Gram-positieve aeroben
Staphylococcus aureusEnterococcus soorten
Gram-negatieve aeroben
Escherichia coli
OPMERKING: Sommige stammen van Enterobacter-soorten en Klebsiella-soorten zijn resistent tegen nitrofurantoïne.
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Nitrofurantoïne vertoont in vitro activiteit tegen de volgende bacteriën; de veiligheid en werkzaamheid van nitrofurantoïne bij de behandeling van klinische infecties veroorzaakt door deze bacteriën zijn echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Gram-positieve aeroben
Coagulase-negatieve stafylokokken (inclusief Staphylococcus epidermidis en Staphylococcus saprophyticus) Streptococcus agalactiae Streptokokken van de Viridans-groep
Gram-negatieve aeroben
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
Nitrofurantoïne is niet actief tegen de meeste stammen van Proteus- of Serratia-soorten. Het heeft geen activiteit tegen Pseudomonas-soorten.
Gevoeligheidstesten
Voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn, zie: http://www.fda.gov/STIC.
PATIËNT INFORMATIE
Patiënten moeten worden geadviseerd om Furadantin met voedsel om de tolerantie verder te verbeteren en de opname van geneesmiddelen te verbeteren. Patiënten moeten de instructie krijgen om de volledige therapiekuur af te maken; ze moeten echter worden geadviseerd contact op te nemen met hun arts als zich tijdens de behandeling ongebruikelijke symptomen voordoen.
Diarree is een veelvoorkomend probleem veroorzaakt door antibiotica dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
Patiënten dienen te worden geadviseerd geen antacidumpreparaten te gebruiken die magnesiumtrisilicaat bevatten tijdens het gebruik Furadantin .
