Asacol 400mg Mesalamine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Asacol 400 mg en hoe wordt het gebruikt?
Asacol is een receptgeneesmiddel dat wordt gebruikt om de symptomen van colitis ulcerosa te behandelen. Asacol 400 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Asacol behoort tot een klasse geneesmiddelen die 5-aminosalicylzuurderivaten worden genoemd.
Het is niet bekend of Asacol 400 mg veilig en effectief is bij kinderen jonger dan 5 jaar.
Wat zijn de mogelijke bijwerkingen van Asacol 400 mg?
Asacol kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige maagpijn,
- maagkrampen,
- bloederige diarree,
- koorts,
- hoofdpijn,
- huiduitslag,
- bloederige of teerachtige ontlasting,
- bloed ophoesten,
- braaksel dat op koffiedik lijkt,
- weinig of geen plassen,
- pijnlijk of moeilijk plassen,
- zwelling in uw voeten of enkels,
- zich moe voelen,
- kortademigheid,
- verlies van eetlust,
- pijn in de bovenbuik,
- gemakkelijk blauwe plekken of bloedingen,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Asacol zijn onder meer:
- misselijkheid,
- braken,
- buikpijn,
- diarree,
- indigestie,
- gas,
- hoofdpijn,
- uitslag, en
- abnormale leverfunctietesten
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Asacol. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
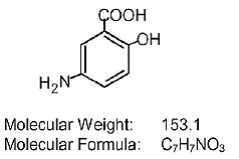
Elke Asacol (mesalamine) tablet met vertraagde afgifte voor orale toediening bevat 400 mg mesalamine, een aminosalicylaat. Asacol (mesalamine) tabletten met vertraagde afgifte bevatten hars op acrylbasis, Eudragit S (methacrylzuurcopolymeer type B, NF), dat oplost bij pH 7 of hoger en mesalamine afgeeft in het terminale ileum en daarbuiten voor plaatselijke ontstekingsremmende werking in de dikke darm . Mesalamine (ook wel 5-aminosalicylzuur of 5-ASA genoemd) heeft de chemische naam 5-amino-2-hydroxybenzoëzuur. De structuurformule is:
Inactieve ingredienten: Elke tablet bevat colloïdaal siliciumdioxide, dibutylftalaat, eetbare zwarte inkt, rood ijzeroxide, geel ijzeroxide, lactosemonohydraat, magnesiumstearaat, methacrylzuurcopolymeer B (Eudragit S), polyethyleenglycol, povidon, natriumzetmeelglycolaat en talk.
INDICATIES
Behandeling van licht tot matig actieve colitis ulcerosa
Asacol® (mesalamine) tabletten met vertraagde afgifte zijn geïndiceerd voor de behandeling van licht tot matig actieve colitis ulcerosa bij patiënten van 5 jaar en ouder.
Onderhoud van remissie van colitis ulcerosa bij volwassenen
Asacol (mesalamine) tabletten met vertraagde afgifte zijn geïndiceerd voor het behoud van remissie van colitis ulcerosa bij volwassenen. De veiligheid en werkzaamheid van Asacol voor het in stand houden van de remissie van colitis ulcerosa bij pediatrische patiënten zijn niet vastgesteld.
DOSERING EN ADMINISTRATIE
Dosering voor de behandeling van licht tot matig actieve colitis ulcerosa
volwassenen
Voor volwassenen is de aanbevolen dosering van Asacol 400 mg twee tabletten van 400 mg, driemaal daags in te nemen met of zonder voedsel (totale dagelijkse dosis van 2,4 gram), gedurende 6 weken [zie Klinische studies ].
Kindergeneeskunde
Voor pediatrische patiënten is de aanbevolen totale dagelijkse dosis Asacol gebaseerd op het gewicht (tot maximaal 2,4 gram/dag) (zie tabel 1). Asacol 400 mg tabletten moeten gedurende 6 weken tweemaal daags met of zonder voedsel worden ingenomen [zie Klinische studies ].
Dosering voor het behoud van remissie van colitis ulcerosa bij volwassenen
Voor volwassenen is de aanbevolen dosering van Asacol 1,6 gram per dag, in verdeelde doses, met of zonder voedsel [zie Klinische studies ].
Belangrijke administratie-instructies
Slik Asacol-tabletten heel door. De tabletten niet snijden, breken of kauwen.
Er is niet aangetoond dat twee Asacol 400 mg tabletten bio-equivalent zijn aan één Asacol® HD (mesalamine) 800 mg tablet met vertraagde afgifte en mogen niet door elkaar worden gebruikt.
Testen voorafgaand aan toediening van Asacol 400 mg
Evalueer de nierfunctie voordat met Asacol wordt gestart [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
HOE GELEVERD
Doseringsvormen en sterke punten
Asacol (mesalamine) Tabletten met vertraagde afgifte: 400 mg (roodbruin, capsulevormig en bedrukt met "0752 DR" in het zwart).
Opslag en behandeling
Asacol (mesalamine) tabletten met vertraagde afgifte zijn verkrijgbaar als roodbruine, capsulevormige tabletten met 400 mg mesalamine en bedrukt met “0752 DR” in het zwart.
NDC 0430-0752-27 Fles met 180 tabletten
Bewaren bij 20° tot 25° C (68° tot 77° F); excursies toegestaan 15° tot 30° C (59° tot 86° F) [Zie USP-gecontroleerde kamertemperatuur ].
Gefabriceerd door: Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Duitsland. Op de markt gebracht door: Warner Chilcott (VS), LLC Rockaway, NJ 07866. Herzien: oktober 2013
BIJWERKINGEN
De ernstigste bijwerkingen die zijn waargenomen in klinische onderzoeken met Asacol of met andere producten die mesalamine bevatten of worden gemetaboliseerd tot mesalamine zijn:
- Nierfunctiestoornis, inclusief nierfalen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Acuut intolerantiesyndroom [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leverfalen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
In totaal zijn Asacol 400 mg tabletten geëvalueerd bij 2.690 patiënten met colitis ulcerosa in gecontroleerde en open-label onderzoeken. Bijwerkingen die in de volgende rubrieken worden beschreven, kunnen optreden ongeacht de duur van de behandeling en soortgelijke reacties zijn gemeld in korte- en langetermijnstudies en in de postmarketingsetting.
Klinische onderzoeken ter ondersteuning van het gebruik van Asacol 400 mg voor de behandeling van licht tot matig actieve colitis ulcerosa omvatten twee 6 weken durende, placebogecontroleerde, gerandomiseerde, dubbelblinde onderzoeken bij volwassenen met licht tot matig actieve colitis ulcerosa (onderzoeken 1 en 2), en één 6 weken durende, gerandomiseerde, dubbelblinde studie van 2 dosisniveaus bij kinderen met licht tot matig actieve colitis ulcerosa. Klinische onderzoeken ter ondersteuning van het gebruik van Asacol 400 mg tabletten bij het handhaven van remissie van colitis ulcerosa omvatten een 6 maanden durende, gerandomiseerde, dubbelblinde, placebogecontroleerde, multicenter studie en vier actief gecontroleerde onderhoudsonderzoeken waarin Asacol 400 mg tabletten werden vergeleken met sulfasalazine . Asacol 400 mg is geëvalueerd bij 427 volwassenen en 82 kinderen met colitis ulcerosa in deze gecontroleerde onderzoeken.
Behandeling van licht tot matig actieve colitis ulcerosa bij volwassenen
In twee 6 weken durende placebogecontroleerde klinische onderzoeken (onderzoeken 1 en 2) met 245 patiënten, van wie 155 gerandomiseerd naar Asacol [zie Klinische studies ], 3,2 procent van de met Asacol behandelde patiënten stopte met de behandeling vanwege bijwerkingen in vergelijking met 2,2 procent van de met placebo behandelde patiënten. De gemiddelde leeftijd van de patiënten in onderzoek 1 was 42 jaar en 48 procent van de patiënten was man. De gemiddelde leeftijd van de patiënten in onderzoek 2 was 42 jaar en 59 procent van de patiënten was man. Bijwerkingen die leidden tot stopzetting van Asacol omvatten (elk op één patiënt): diarree en colitis opflakkering; duizeligheid, misselijkheid, gewrichtspijn en hoofdpijn; uitslag, lethargie en constipatie; droge mond, malaise, lage rugklachten, lichte desoriëntatie, lichte indigestie en krampen; hoofdpijn, misselijkheid, pijn, braken, spierkrampen, een verstopt hoofd, verstopte oren en koorts.
Bijwerkingen bij patiënten die met Asacol werden behandeld, die met een frequentie van ten minste 2 procent en met een hogere frequentie dan placebo in 6 weken durende, dubbelblinde, placebogecontroleerde onderzoeken (onderzoeken 1 en 2) voorkomen, worden vermeld in tabel 2 hieronder.
Behandeling van licht tot matig actieve colitis ulcerosa bij pediatrische patiënten van 5 tot 17 jaar
Een gerandomiseerde, dubbelblinde studie van 6 weken met 2 dosisniveaus van Asacol (onderzoek 3) werd uitgevoerd bij 82 pediatrische patiënten van 5 tot 17 jaar met licht tot matig actieve colitis ulcerosa. Alle patiënten werden ingedeeld naar lichaamsgewichtscategorie (17 tot minder dan 33 kg, 33 tot minder dan 54 kg en 54 tot 90 kg) en werden willekeurig toegewezen aan een lage dosis (1,2, 2,0 en 2,4 g/dag voor de respectievelijke lichaamsgewicht) of een hoge dosis (2,0, 3,6 en 4,8 g/dag).
De hoge dosis is geen goedgekeurde dosering omdat deze niet effectiever bleek te zijn dan de goedgekeurde dosis [zie DOSERING EN ADMINISTRATIE en Klinische studies ].
De duur van de blootstelling aan mesalamine bij de 82 patiënten in het onderzoek varieerde van 12 tot 50 dagen (gemiddeld 40 dagen in elke dosisgroep). De meerderheid (88 procent) van de patiënten in elke groep werd langer dan 5 weken behandeld. Tabel 3 geeft een samenvatting van de specifiek gemelde bijwerkingen (AR's).
Twaalf procent van de patiënten in de groep met de lage dosis en 5 procent van de patiënten in de groep met de hoge dosis had ernstige bijwerkingen. Colitis ulcerosa werd gemeld als een ernstige AR bij één proefpersoon in elke groep. Andere ernstige AR's bestonden uit sinusitis, buikpijn, verlaagde body mass index, adenovirusinfectie, bloederige diarree, scleroserende cholangitis en pancreatitis bij één proefpersoon elk in de lage dosisgroep en bloedarmoede en syncope bij één proefpersoon elk in de hoge dosisgroep.
Zeven patiënten werden uit het onderzoek teruggetrokken vanwege AR's: 5 (12 procent) in de lage dosisgroep (colitis ulcerosa, adenovirusinfectie, scleroserende cholangitis, pancreatitis) en 2 (5 procent) in de hoge dosisgroep (verhoogd amylase en verhoogd lipase , pijn in de bovenbuik).
Over het algemeen waren de aard en ernst van de reacties bij de pediatrische populatie vergelijkbaar met die gemeld bij volwassen populaties van patiënten met colitis ulcerosa.
Onderhoud van remissie van colitis ulcerosa bij volwassenen
In een 6 maanden durende placebogecontroleerde onderhoudsstudie met 264 patiënten (onderzoek 4), van wie 177 gerandomiseerd werden naar Asacol, stopten zes (3,4 procent) van de patiënten die Asacol gebruikten de behandeling vanwege bijwerkingen, vergeleken met vier (4,6 procent) van de patiënten die placebo gebruikten [zie Klinische studies ]. De gemiddelde leeftijd van de patiënten in onderzoek 4 was 42 jaar en 55 procent van de patiënten was man. Bijwerkingen die leidden tot stopzetting van het onderzoek bij patiënten die Asacol gebruikten, omvatten (elk op één patiënt): angst; hoofdpijn; jeuk; verminderd libido; Reumatoïde artritis; en stomatitis en asthenie.
Naast de reacties vermeld in tabel 2, traden de volgende bijwerkingen op bij patiënten die Asacol gebruikten met een frequentie van 2 procent of meer in onderzoek 4: abdominale vergroting, gastro-enteritis, gastro-intestinale bloeding, infectie, gewrichtsaandoening, migraine, nervositeit, paresthesie, rectale stoornis, rectale bloeding, stoelgangafwijkingen, tenesmus, urinaire frequentie, vasodilatatie en afwijkingen van het gezichtsvermogen.
Bij 3342 patiënten in ongecontroleerde klinische onderzoeken traden de volgende bijwerkingen op met een frequentie van 5 procent of meer en leken vaker toe te nemen met toenemende dosis: asthenie, koorts, griepsyndroom, pijn, buikpijn, rugpijn, winderigheid, gastro-intestinale bloeding , artralgie en rhinitis.
Postmarketingervaring
Naast de bijwerkingen die hierboven zijn gemeld in klinische onderzoeken met Asacol, zijn de onderstaande bijwerkingen vastgesteld tijdens het gebruik van Asacol 400 mg en andere mesalaminebevattende producten na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Lichaam als geheel: Nekpijn, gezichtsoedeem, oedeem, lupusachtig syndroom, medicijnkoorts.
Cardiovasculair: Pericarditis, myocarditis [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Gastro-intestinaal: Anorexia, pancreatitis, gastritis, verhoogde eetlust, cholecystitis, droge mond, mondzweren, geperforeerde maagzweer bloederige diarree.
Hematologische: Agranulocytose aplastische anemie, trombocytopenie, eosinofilie, leukopenie, anemie, lymfadenopathie.
Musculoskeletaal: Jicht.
Zenuwachtig: Depressie, slaperigheid, emotionele labiliteit, hyperesthesie, duizeligheid, verwardheid, tremor, perifere neuropathie, myelitis transversa, syndroom van Guillain-Barré.
nier: Nierfalen, interstitiële nefritis, nefropathie met minimale verandering [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Ademhaling/long: Eosinofiele pneumonie, interstitiële pneumonitis, astma-exacerbatie, pleuritis.
Huid: Alopecia, psoriasis, pyoderma gangrenosus, droge huid, erythema nodosum, urticaria.
Speciale zintuigen: Oogpijn, smaakvervorming, wazig zien, tinnitus.
Urogenitaal: Dysurie, urinaire urgentie, hematurie, epididymitis, menorragie, reversibele oligospermie.
Laboratoriumafwijkingen: Verhoogde AST (SGOT) of ALT (SGPT), verhoogde alkalische fosfatase, verhoogde GGT, verhoogde LDH, verhoogde bilirubine, verhoogde serumcreatinine en BUN.

DRUG-INTERACTIES
Er zijn geen formele onderzoeken naar geneesmiddelinteracties uitgevoerd waarbij Asacol 400 mg samen met andere geneesmiddelen werd gebruikt. De volgende interacties tussen mesalaminebevattende producten en andere geneesmiddelen zijn echter gemeld.
Nefrotoxische middelen, waaronder niet-steroïde anti-inflammatoire geneesmiddelen
Gelijktijdig gebruik van mesalamine met bekende nefrotoxische middelen, waaronder niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) kan het risico op nierreacties verhogen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Azathioprine of 6-mercaptopurine
Gelijktijdig gebruik van mesalamine met azathioprine of 6-mercaptopurine kan het risico op bloedaandoeningen verhogen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Nierfunctiestoornis
Nierfunctiestoornissen, waaronder nefropathie met minimale verandering, acute en chronische interstitiële nefritis en nierfalen, zijn gemeld bij patiënten die producten gebruikten zoals Asacol 400 mg die mesalamine bevatten of worden omgezet in mesalamine.
Het wordt aanbevolen dat patiënten de nierfunctie laten beoordelen voordat met Asacol 400 mg wordt gestart en periodiek tijdens de behandeling.
Voorschrijvers dienen de risico's en voordelen zorgvuldig te evalueren bij het gebruik van Asacol bij patiënten met een bekende nierfunctiestoornis of een voorgeschiedenis van nierziekte [zie DRUG-INTERACTIES en Niet-klinische toxicologie ].
Door mesalamine geïnduceerd acuut intolerantiesyndroom
Mesalamine is in verband gebracht met een acuut intolerantiesyndroom dat moeilijk te onderscheiden is van een verergering van colitis ulcerosa. Hoewel de exacte frequentie van voorkomen niet is vastgesteld, is het voorgekomen in 3 procent van de gecontroleerde klinische onderzoeken met mesalamine of sulfasalazine. Symptomen zijn onder meer krampen, buikpijn, bloederige diarree en soms koorts, hoofdpijn en huiduitslag. Observeer patiënten nauwlettend op verergering van deze symptomen tijdens de behandeling. Als een acuut intolerantiesyndroom wordt vermoed, stop dan onmiddellijk met de behandeling met Asacol.
Overgevoeligheidsreacties
Sommige patiënten die een overgevoeligheidsreactie op sulfasalazine hebben gehad, kunnen een vergelijkbare reactie hebben op Asacol 400 mg of op andere verbindingen die mesalamine bevatten of worden omgezet in mesalamine.
Door mesalamine geïnduceerde cardiale overgevoeligheidsreacties (myocarditis en pericarditis) zijn gemeld met Asacol en andere mesalaminemedicijnen. Voorzichtigheid is geboden bij het voorschrijven van dit geneesmiddel aan patiënten met aandoeningen die hen vatbaar maken voor de ontwikkeling van myocarditis of pericarditis.
Leverfalen
Er zijn meldingen geweest van leverfalen bij patiënten met een reeds bestaande leverziekte die mesalamine kregen toegediend. Voorzichtigheid is geboden bij het toedienen van Asacol aan patiënten met een leverziekte.
Langdurige maagretentie bij patiënten met bovenste gastro-intestinale obstructie
Organische of functionele obstructie in het bovenste maagdarmkanaal kan langdurige maagretentie van Asacol 400 mg veroorzaken, wat de afgifte van mesalamine in de dikke darm zou vertragen.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Mesalamine was niet kankerverwekkend bij dieetdoses tot 480 mg/kg/dag bij ratten en 2000 mg/kg/dag bij muizen, wat ongeveer 2,9 en 6,1 maal de maximaal aanbevolen onderhoudsdosis van Asacol 400 mg van 1,6 g/dag of 26,7 is. mg/kg/dag, gebaseerd op respectievelijk 60 kg lichaamsgewicht, gebaseerd op lichaamsoppervlak.
Mutagenese
Mesalamine was negatief in de Ames-assay voor mutagenese, negatief voor inductie van uitwisseling van zusterchromatiden (SCE) en chromosomale afwijkingen in ovariumcellen van Chinese hamsters in vitro, en negatief voor inductie van micronuclei (MN) in polychromatische erytrocyten van muisbeenmerg.
Aantasting van de vruchtbaarheid
Mesalamine bleek bij orale doses tot 480 mg/kg/dag (ongeveer 1,9 maal de aanbevolen dosis voor menselijke behandeling op basis van het lichaamsoppervlak) geen effect te hebben op de vruchtbaarheid of reproductieve prestaties van mannelijke en vrouwelijke ratten.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie C
Risico Samenvatting
Er zijn geen adequate en goed gecontroleerde onderzoeken naar het gebruik van Asacol 400 mg bij zwangere vrouwen. Beperkte gepubliceerde gegevens over mesalamine bij de mens laten geen toename zien van het totale aantal aangeboren afwijkingen. Sommige gegevens tonen een verhoogd aantal vroeggeboorten, doodgeboorten en een laag geboortegewicht; deze nadelige zwangerschapsuitkomsten zijn echter ook geassocieerd met actieve inflammatoire darmaandoeningen. Bovendien hebben alle zwangerschappen, ongeacht de blootstelling aan geneesmiddelen, een achtergrondpercentage van 2 tot 4 procent voor ernstige misvormingen en 15 tot 20 procent voor zwangerschapsverlies. Er werden geen aanwijzingen voor schade aan de foetus waargenomen in reproductiestudies bij dieren van mesalamine bij ratten en konijnen bij orale doses van ongeveer 1,9 maal (rat) en 3,9 maal (konijn) de aanbevolen dosis voor de mens. Dibutylftalaat (DBP) is echter een inactief ingrediënt in de enterische coating van Asacol, en in dierstudies bij ratten met doses die hoger waren dan 190 maal de dosis voor mensen op basis van het lichaamsoppervlak, werd maternale DBP geassocieerd met uitwendige en skeletmisvormingen en nadelige effecten op het mannelijke voortplantingssysteem. Asacol 400 mg mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Menselijke gegevens
Mesalamine passeert de placenta. In prospectieve en retrospectieve onderzoeken van meer dan 600 vrouwen die tijdens de zwangerschap aan mesalamine werden blootgesteld, was het waargenomen aantal aangeboren afwijkingen niet hoger dan het achtergrondpercentage in de algemene populatie. Sommige gegevens laten een verhoogd aantal vroeggeboorten, doodgeboorten en een laag geboortegewicht zien, maar het is onduidelijk of dit te wijten was aan onderliggende maternale ziekte, blootstelling aan geneesmiddelen of beide, aangezien actieve inflammatoire darmaandoeningen ook worden geassocieerd met nadelige zwangerschapsuitkomsten.
Diergegevens
Reproductiestudies met mesalamine werden uitgevoerd tijdens de organogenese bij ratten en konijnen bij orale doses tot 480 mg/kg/dag. Er was geen bewijs van verminderde vruchtbaarheid of schade aan de foetus. Deze mesalaminedoses waren ongeveer 1,9 keer (rat) en 3,9 keer (konijn) de aanbevolen dosis voor mensen, gebaseerd op het lichaamsoppervlak.
Dibutylftalaat (DBP) is een inactief ingrediënt in de enterische coating van Asacol. De dagelijkse inname van DBP bij de mens van de maximaal aanbevolen dosis Asacol-tabletten is ongeveer 21 mg. Uit gepubliceerde rapporten bij ratten blijkt dat nakomelingen van mannelijke ratten die in utero zijn blootgesteld aan DBP (groter dan of gelijk aan 100 mg/kg/dag, ongeveer 39 maal de dosis voor de mens op basis van het lichaamsoppervlak), afwijkingen in het voortplantingssysteem vertonen die compatibel zijn met een verstoring van de androgene afhankelijke ontwikkeling. De klinische betekenis van deze bevinding bij ratten is niet bekend. Bij hogere doseringen (groter dan of gelijk aan 500 mg/kg/dag, ongeveer 194 maal de dosis voor de mens op basis van lichaamsoppervlak), bijkomende effecten, waaronder cryptorchidie, hypospadie, atrofie of agenese van geslachtsorganen, testiculaire verwonding, dagelijkse vermindering spermaproductie, permanent vasthouden van tepels en verminderde anogenitale afstand worden opgemerkt. Vrouwelijke nakomelingen zijn onaangetast. Hoge doses DBP, toegediend aan drachtige ratten, werden in verband gebracht met een verhoogde incidentie van ontwikkelingsafwijkingen, zoals een gespleten gehemelte (groter dan of gelijk aan 630 mg/kg/dag, ongeveer 244 maal de dosis voor de mens, gebaseerd op het lichaamsoppervlak) en afwijkingen (groter dan of gelijk aan 750 mg/kg/dag, ongeveer 290 maal de dosis voor de mens op basis van lichaamsoppervlak) bij het nageslacht.
Moeders die borstvoeding geven
Mesalamine en zijn N-acetylmetaboliet zijn aanwezig in de moedermelk. In gepubliceerde lactatiestudies varieerden de doses mesalamine van de moeder van verschillende orale en rectale formuleringen en producten van 500 mg tot 3 g per dag. De concentratie mesalamine in melk varieerde van niet-detecteerbaar tot 0,11 mg/L. De concentratie van de N-acetyl-5-aminosalicylzuurmetaboliet varieerde van 5 tot 18,1 mg/L. Op basis van deze concentraties zijn de geschatte dagelijkse zuigelingendoses voor een zuigeling die uitsluitend borstvoeding krijgt 0 tot 0,017 mg/kg/dag mesalamine en 0,75 tot 2,72 mg/kg/dag N-acetyl-5-aminosalicylzuur.
Dibutylftalaat (DBP), een inactief ingrediënt in de enterische coating van Asacol 400 mg tabletten, en zijn primaire metaboliet monobutylftalaat (MBP) worden uitgescheiden in de moedermelk. De klinische betekenis hiervan is niet vastgesteld.
De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten worden overwogen, samen met de klinische behoefte van de moeder aan Asacol 400 mg en eventuele nadelige effecten op het kind dat borstvoeding krijgt van het geneesmiddel of van de onderliggende maternale aandoening. Wees voorzichtig wanneer Asacol 400 mg wordt toegediend aan een zogende vrouw.
Pediatrisch gebruik
De veiligheid en werkzaamheid van Asacol 400 mg bij pediatrische patiënten van 5 tot 17 jaar voor de behandeling van licht tot matig actieve colitis ulcerosa zijn vastgesteld over een periode van 6 weken. Het gebruik van Asacol in deze leeftijdsgroepen wordt ondersteund door bewijs uit adequate en goed gecontroleerde onderzoeken met Asacol 400 mg bij volwassenen en een enkel onderzoek bij pediatrische patiënten [zie ONGEWENSTE REACTIES , KLINISCHE FARMACOLOGIE en Klinische studies ].
Asacol 400 mg werd onderzocht in een gerandomiseerde, dubbelblinde, parallelle groep, 6 weken durende behandelingsstudie met twee dosisniveaus van Asacol 400 mg bij 82 pediatrische patiënten van 5 tot 17 jaar met licht tot matig actieve colitis ulcerosa. Alle patiënten werden ingedeeld naar gewichtscategorie (17 tot minder dan 33 kg, 33 tot minder dan 54 kg en 54 tot 90 kg) en werden willekeurig toegewezen aan een lage dosis (1,2, 2,0 en 2,4 g/dag voor het respectieve gewicht). categorie) of een hoge dosis (2,0, 3,6 en 4,8 g/dag). Baseline- en screeningsbezoeken werden gevolgd door een behandelingsperiode van 6 weken [zie DOSERING EN ADMINISTRATIE ]. De hoge dosis was niet effectiever dan de lage dosis en is geen goedgekeurde dosering [zie Klinische studies ].
De veiligheid en werkzaamheid van Asacol bij pediatrische patiënten jonger dan 5 jaar zijn niet vastgesteld. De veiligheid en werkzaamheid van Asacol bij het in stand houden van de remissie van colitis ulcerosa bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met Asacol omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet bij het voorschrijven van Asacol rekening worden gehouden met de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling bij oudere patiënten. Rapporten uit ongecontroleerde klinische onderzoeken en postmarketingrapportagesystemen suggereren een hogere incidentie van bloeddyscrasieën, dat wil zeggen agranulocytose, neutropenie, pancytopenie, bij personen die Asacol kregen en die 65 jaar of ouder zijn. Voorzichtigheid is geboden om het aantal bloedcellen tijdens de behandeling met Asacol nauwlettend te volgen.
Nierfunctiestoornis
Van mesalamine is bekend dat het grotendeels door de nieren wordt uitgescheiden, en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten meer kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het voorschrijven van deze medicamenteuze behandeling. Het wordt aanbevolen dat alle patiënten de nierfunctie evalueren voordat de behandeling met Asacol wordt gestart en periodiek tijdens de behandeling met Asacol [zie DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
OVERDOSERING
Er is geen specifiek antidotum voor overdosering van mesalamine en behandeling van vermoede acute ernstige toxiciteit met Asacol dient symptomatisch en ondersteunend te zijn. Dit kan het voorkomen van verdere absorptie van het maagdarmkanaal, het corrigeren van een verstoorde vocht-elektrolytenbalans en het in stand houden van een adequate nierfunctie omvatten. Asacol 400 mg is een pH-afhankelijk product met vertraagde afgifte en met deze factor moet rekening worden gehouden bij de behandeling van een vermoedelijke overdosis.
CONTRA-INDICATIES
Asacol is gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor salicylaten of aminosalicylaten of voor een van de bestanddelen van Asacol [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES , en OMSCHRIJVING ].
ASACOL (mesalamine) tabletten met vertraagde afgifte, voor oraal gebruik
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Het werkingsmechanisme van mesalamine is onbekend, maar lijkt eerder actueel dan systemisch te zijn. De mucosale productie van arachidonzuurmetabolieten, zowel via de cyclo-oxygenaseroutes, dat wil zeggen prostanoïden, als via de lipoxygenaseroutes, dat wil zeggen leukotriënen en hydroxyeicosatetraeenzuren, is verhoogd bij patiënten met chronische colitis ulcerosa, en het is mogelijk dat mesalamine de ontsteking vermindert door het blokkeren van cyclo-oxygenase en het remmen van de productie van prostaglandine in de dikke darm.
Farmacokinetiek
Absorptie
Ongeveer 28 procent van mesalamine in Asacol 400 mg tabletten wordt geabsorbeerd na orale inname. De absorptie van mesalamine is vergelijkbaar bij nuchtere en gevoede proefpersonen. De Tmax voor mesalamine en zijn metaboliet is gewoonlijk vertraagd, als gevolg van de vertraagde afgifte, en varieert van 4 tot 16 uur.
Metabolisme
Het geabsorbeerde mesalamine wordt snel geacetyleerd in de darmslijmvlieswand en door de lever tot N-acetyl-5aminosalicylzuur.
uitscheiding
Geabsorbeerd mesalamine wordt voornamelijk door de nieren uitgescheiden als N-acetyl-5-aminosalicylzuur. Niet-geabsorbeerd mesalamine wordt uitgescheiden in de ontlasting.
Na intraveneuze toediening is de eliminatiehalfwaardetijd van mesalamine ongeveer 40 minuten. Na orale toediening zijn de terminale t½-waarden voor mesalamine en N-acetyl-5-aminosalicylzuur gewoonlijk ongeveer 12 uur, maar variëren van 2 tot 15 uur. Er is een grote inter-individuele en intra-individuele variabiliteit in de plasmaconcentraties van mesalamine en N-acetyl-5-aminosalicylzuur en in hun eliminatiehalfwaardetijden na toediening van Asacol.
Specifieke populaties
Pediatrische patiënten
In een farmacokinetisch onderzoek met dosisbereik waarin 30, 60 en 90 mg/kg/dag doses Asacol 400 mg tweemaal daags gedurende vier weken werden geëvalueerd, varieerden de gemiddelde Cavg-waarden van mesalamine bij pediatrische patiënten met colitis ulcerosa van ongeveer 400 ng/ml tot 2100 ng /mL op basis van gegevens van alle dosisniveaus.
In een onderzoek bij pediatrische patiënten met colitis ulcerosa (onderzoek 3) waren de gemiddelde plasmaconcentraties van mesalamine (op basis van schaarse steekproeven) 820 tot 988 ng/ml bij het lage dosisniveau (dat wil zeggen 1,2, 2,0 of 2,4 g/dag op basis van lichaamsgewichtlagen van respectievelijk 17 tot meer dan 33 kg, 33 tot minder dan 54 kg en 54 tot minder dan 90 kg).
Dierlijke toxicologie en/of farmacologie
In dierstudies (ratten, muizen, honden) was de nier het belangrijkste orgaan voor toxiciteit. (In het volgende zijn vergelijkingen van dosering bij dieren met de aanbevolen dosering voor mensen gebaseerd op het lichaamsoppervlak en een dosis van 2,4 g/dag voor een persoon van 60 kg.)
Mesalamine veroorzaakt renale papillaire necrose bij ratten bij enkelvoudige doses van ongeveer 750 mg/kg tot 1000 mg/kg (ongeveer 3 tot 4 keer de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak). Doses van 170 en 360 mg/kg/dag (ongeveer 0,7 en 1,5 maal de aanbevolen dosis voor de mens op basis van lichaamsoppervlak) die gedurende zes maanden aan ratten werden gegeven, veroorzaakten papillaire necrose, papillair oedeem, tubulaire degeneratie, tubulaire mineralisatie en urotheelhyperplasie.
Bij muizen veroorzaakten orale doses van 4000 mg/kg/dag mesalamine (ongeveer 8 keer de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) gedurende drie maanden tubulaire nefrose, multifocale/diffuse tubulo-interstitiële ontsteking en multifocale/diffuse papillaire necrose.
Bij honden resulteerden enkelvoudige doses van 6000 mg (ongeveer 8 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) van mesalaminetabletten met vertraagde afgifte in renale papillaire necrose, maar waren niet dodelijk. Nierveranderingen zijn opgetreden bij honden die chronische toediening van mesalamine in doses van 80 mg/kg/dag (1,1 maal de aanbevolen dosis voor de mens op basis van het lichaamsoppervlak) kregen.
Klinische studies
Behandeling van licht tot matig actieve colitis ulcerosa
volwassenen
Twee placebogecontroleerde onderzoeken (onderzoeken 1 en 2) hebben de werkzaamheid van Asacol-tabletten aangetoond bij patiënten met licht tot matig actieve colitis ulcerosa.
In één gerandomiseerde, dubbelblinde, multicenter studie met 158 patiënten (onderzoek 1) werden Asacol-doses van 1,6 g/dag en 2,4 g/dag gedurende 6 weken vergeleken met placebo. Het scoresysteem voor het bepalen van de werkzaamheid van de behandeling omvatte beoordeling van de stoelgangfrequentie, rectale bloeding, sigmoïdoscopiebevindingen, functionele beoordeling van de patiënt en algemene beoordeling door de arts. Bij een dosis van 2,4 g/dag vertoonden 21 van de 43 (49 procent) patiënten die Asacol-tabletten gebruikten een verbetering van het sigmoïdoscopische uiterlijk van de darm in vergelijking met 12 van de 44 (27 procent) patiënten die placebo gebruikten (p = 0,048). Bovendien vertoonden significant meer patiënten in de groep met Asacol-tabletten van 2,4 g/dag een verbetering van de rectale bloeding en de frequentie van ontlasting. De dosis van 1,6 g/dag leverde geen consistent bewijs van effectiviteit op.
In een tweede gerandomiseerde, dubbelblinde, placebogecontroleerde klinische studie met een duur van 6 weken bij 87 patiënten (onderzoek 2), resulteerden Asacol-tabletten, in een dosis van 4,8 g/dag, gedurende 6 weken in sigmoïdscopische verbetering bij 28 van de 38 (74 procent) patiënten vergeleken met 10 van de 38 (26 procent) placebopatiënten (p minder dan 0,001). Ook vertoonden meer patiënten in de Asacol 400 mg tabletten 4,8 g/dag-groep dan de placebogroep verbetering van de algemene symptomen.
De dosis van 4,8 g/dag is geen goedgekeurde dosering voor de behandeling van licht tot matig actieve colitis ulcerosa.
Kindergeneeskunde
De veiligheid en werkzaamheid van Asacol 400 mg bij pediatrische patiënten van 5 tot 17 jaar voor de behandeling van licht tot matig actieve colitis ulcerosa worden ondersteund door gegevens uit adequate en goed gecontroleerde onderzoeken met Asacol 400 mg bij volwassenen en een enkele studie bij pediatrische patiënten.
Een gerandomiseerde, dubbelblinde studie van 6 weken met 2 dosisniveaus van Asacol (onderzoek 3) werd uitgevoerd bij 82 pediatrische patiënten van 5 tot 17 jaar met licht of matig actieve colitis ulcerosa. Alle patiënten werden ingedeeld naar gewichtscategorie (17 tot minder dan 33 kg, 33 tot minder dan 54 kg en 54 tot 90 kg) en werden willekeurig toegewezen aan een lage dosis (1,2, 2,0 en 2,4 g/dag voor het respectieve gewicht). categorie) of een hoge dosis (2,0, 3,6 en 4,8 g/dag). Doses werden elke 12 uur toegediend.
Het percentage patiënten dat succes boekte op basis van de afgeknotte Mayo-score (TM-Mayo) (gebaseerd op de ontlastingsfrequentie en de subscores van rectale bloedingen van de Mayo-score) en op basis van de Pediatric Colitis Ulcerative Colitis Activity Index (PUCAI) (die de beoordeling van buikpijn, rectale bloeding, consistentie en frequentie van ontlasting, aanwezigheid van nachtelijke stoelgang en activiteitsniveau) werd gemeten na 6 weken behandeling. Succes op basis van TM-Mayo werd gedefinieerd als ofwel een gedeeltelijke respons (verbetering ten opzichte van de uitgangswaarde in de frequentie van ontlasting of subscores van rectale bloedingen zonder verslechtering van de andere) of volledige respons (subscores voor zowel stoelgangfrequentie als rectale bloeding zijn gelijk aan 0). Succes op basis van PUCAI werd gedefinieerd als ofwel een gedeeltelijke respons (PUCAI-reductie van meer dan of gelijk aan 20 punten vanaf baseline tot week 6 met week 6-score groter dan of gelijk aan 10) of volledige respons (PUCAI minder dan 10 in week 6).
Er waren 41 patiënten in de groep met een lage dosis en 41 patiënten in de groep met een hoge dosis die ten minste één dosis Asacol kregen; 36 patiënten in elke dosisgroep voltooiden het onderzoek. Patiënten werden beschouwd als mislukte behandeling als ze geen succes boekten of stopten vanwege een bijwerking of gebrek aan werkzaamheid.
In week 6 behaalde 73,2 procent van de patiënten in de lage dosisgroep en 70,0 procent van de patiënten in de hoge dosisgroep succes op basis van de TM-Mayo; 34,1 procent van de patiënten in de groep met de lage dosis en 42,5 procent van de patiënten in de groep met de hoge dosis bereikten een volledige respons. In week 6 behaalde 56,1 procent van de patiënten in de groep met de lage dosis en 55,0 procent van de patiënten in de groep met de hoge dosis succes op basis van de PUCAI; 46,3 procent van de patiënten in de groep met de lage dosis en 42,5 procent van de patiënten in de groep met de hoge dosis bereikten een volledige respons.
De hoge dosis was niet effectiever dan de lage dosis en is geen goedgekeurde dosering [zie DOSERING EN ADMINISTRATIE ].
Onderhoud van remissie van colitis ulcerosa bij volwassenen
Een 6 maanden durende, gerandomiseerde, dubbelblinde, placebogecontroleerde, multicenter studie (onderzoek 4) omvatte 264 patiënten die werden behandeld met Asacol 400 mg tabletten 0,8 g/dag (n = 90), 1,6 g/dag (n = 87) , of placebo (n = 87). In de 0,8 g/dag-arm kregen de patiënten tweemaal daags een dosis; in de arm van 1,6 g/dag kregen de patiënten viermaal daags een dosis. Het deel van de met 0,8 g/dag behandelde patiënten die endoscopische remissie behielden, was niet statistisch significant in vergelijking met placebo. Het percentage patiënten dat Asacol-tabletten 1,6 g/dag gebruikte en endoscopische remissie van colitis ulcerosa behield, was bij 61 van de 87 (70,1 procent) vergeleken met 42 van de 87 (48,3 procent) van de placebopatiënten (p = 0,005).
Een gepoolde werkzaamheidsanalyse van 4 onderhoudsonderzoeken vergeleek Asacol 400 mg tabletten, in doses van 0,8 g/dag tot 2,8 g/dag, in verdeelde doses variërend van tweemaal daags tot viermaal daags, met sulfasalazine, in doses van 2 g/dag tot 4 gram/dag. Het succes van de behandeling werd gezien bij 59 van de 98 (59 procent) patiënten die Asacol-tabletten gebruikten en 70 van de 102 (69 procent) van de patiënten die sulfasalazine gebruikten, een niet-significant verschil.
PATIËNT INFORMATIE
- Instrueer patiënten om de Asacol-tabletten heel door te slikken en zorg ervoor dat ze de tabletten niet breken, snijden of kauwen, omdat de coating een belangrijk onderdeel is van de formulering met vertraagde afgifte.
- Informeer patiënten dat als ze overschakelen van een eerdere orale mesalaminetherapie naar Asacol, ze hun eerdere orale mesalaminetherapie moeten stopzetten en de doseringsinstructies voor Asacol moeten volgen. Informeer patiënten dat ze twee Asacol 400 mg tabletten niet mogen vervangen door één Asacol 400 mg HD 800 mg tablet [zie DOSERING EN ADMINISTRATIE ].
- Informeer patiënten dat intacte, gedeeltelijk intacte en/of tabletomhulsels zijn gemeld in de ontlasting. Instrueer patiënten om contact op te nemen met hun arts als dit herhaaldelijk voorkomt.
- Instrueer patiënten om Asacol 400 mg tabletten te beschermen tegen vocht. Instrueer patiënten om de container goed te sluiten en eventuele zakjes met droogmiddel in de fles samen met de tabletten te laten.
- Adviseer vrouwen die zwanger zijn, borstvoeding geven of zwanger kunnen worden dat Asacol 400 mg dibutylftalaat bevat, dat in dierstudies in verband werd gebracht met misvormingen en nadelige effecten op het mannelijke voortplantingssysteem. Dibutylftalaat wordt uitgescheiden in de moedermelk.
