Neoral 25mg, 100mg Cyclosporine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Neoral 25 mg en hoe wordt het gebruikt?
Neoral 25 mg is een receptgeneesmiddel dat wordt gebruikt als profylaxe om orgaanafstoting na transplantatie te voorkomen en om de symptomen van reumatoïde artritis en psoriasis te behandelen. Neoral kan alleen of in combinatie met andere medicijnen worden gebruikt.
Neoral behoort tot een klasse geneesmiddelen die DMARD's, immunomodulatoren, worden genoemd; Immunosuppressiva; Calcineurine-remmers.
Het is niet bekend of Neoral 25 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Neoral?
Neoral kan ernstige bijwerkingen veroorzaken, waaronder:
- netelroos,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- problemen met spraak, denken, zien of spierbewegingen,
- hartinfarct,
- ernstige hoofdpijn,
- wazig zien,
- bonzen in je nek of oren,
- bleke huid,
- gemakkelijk blauwe plekken,
- ongewone bloeding,
- misselijkheid,
- zwakheid,
- tintelend gevoel,
- pijn op de borst,
- onregelmatige hartslagen,
- verlies van beweging,
- weinig of geen plassen,
- zwelling in uw voeten of enkels,
- zich moe voelen,
- kortademigheid,
- verlies van eetlust,
- maagpijn (rechtsboven),
- geel worden van de huid of ogen,
- koorts,
- rillingen,
- griep symptomen,
- zweertjes in de mond,
- huidzweren,
- keelpijn, en
- hoesten
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Neoral zijn:
- trillingen of beven,
- acne,
- verhoogde groei van gezichts- of lichaamshaar,
- verhoogde bloeddruk,
- misselijkheid,
- diarree, en
- gezwollen of pijnlijk tandvlees
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Neoral. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
WAARSCHUWING
Alleen artsen met ervaring in de behandeling van systemische immunosuppressieve therapie voor de aangegeven ziekte mogen Neoral® voorschrijven. Bij doseringen die worden gebruikt bij transplantatie van solide organen, mogen alleen artsen met ervaring in immunosuppressieve therapie en behandeling van ontvangers van orgaantransplantaties Neoral® voorschrijven. Patiënten die het medicijn krijgen, moeten worden behandeld in faciliteiten die zijn uitgerust en bemand met adequate laboratorium- en ondersteunende medische middelen. De arts die verantwoordelijk is voor de onderhoudstherapie dient over de volledige informatie te beschikken die nodig is voor de follow-up van de patiënt. Neoral®, een systemisch immunosuppressivum, kan de gevoeligheid voor infecties en de ontwikkeling van neoplasie verhogen. Bij nier-, lever- en harttransplantatiepatiënten kan Neoral® samen met andere immunosuppressiva worden toegediend. Een verhoogde gevoeligheid voor infecties en de mogelijke ontwikkeling van lymfoom en andere neoplasmata kan het gevolg zijn van de verhoogde mate van immunosuppressie bij transplantatiepatiënten.
Neoral® zachte gelatinecapsules (ciclosporinecapsules, USP) GEMODIFICEERD en Neoral® drank (cyclosporine orale oplossing, USP) GEMODIFICEERD hebben een verhoogde biologische beschikbaarheid in vergelijking met Sandimmune® zachte gelatinecapsules (cyclosporinecapsules, USP) en Sandimmune® orale oplossing (orale ciclosporine oplossing, USP). Neoral® en Sandimmun® zijn niet bio-equivalent en kunnen niet door elkaar worden gebruikt zonder toezicht van een arts. Bij een gegeven dalconcentratie zal de blootstelling aan ciclosporine groter zijn met Neoral® dan met Sandimmune®. Als een patiënt die uitzonderlijk hoge doses Sandimmune® krijgt, wordt omgezet naar Neoral®, moet bijzondere voorzichtigheid worden betracht. De bloedconcentraties van ciclosporine moeten worden gecontroleerd bij transplantatiepatiënten en patiënten met reumatoïde artritis die Neoral® gebruiken om toxiciteit als gevolg van hoge concentraties te voorkomen. Bij transplantatiepatiënten dienen dosisaanpassingen te worden gedaan om mogelijke orgaanafstoting als gevolg van lage concentraties tot een minimum te beperken. Vergelijking van bloedconcentraties in de gepubliceerde literatuur met bloedconcentraties die zijn verkregen met behulp van huidige tests, moet worden gedaan met gedetailleerde kennis van de gebruikte testmethoden.
Voor Psoriasis-patiënten (zie ook OMKADERDE WAARSCHUWINGEN hierboven)
Psoriasispatiënten die eerder zijn behandeld met PUVA en, in mindere mate, methotrexaat of andere immunosuppressiva, UVB, koolteer of bestralingstherapie, lopen een verhoogd risico op het ontwikkelen van huidmaligniteiten wanneer ze Neoral® gebruiken.
Cyclosporine, het actieve ingrediënt in Neoral®, kan in aanbevolen doseringen systemische hypertensie en nefrotoxiciteit veroorzaken. Het risico neemt toe met toenemende dosis en duur van de behandeling met ciclosporine. Nierdisfunctie, inclusief structurele nierbeschadiging, is een mogelijk gevolg van ciclosporine en daarom moet de nierfunctie tijdens de behandeling worden gecontroleerd.
OMSCHRIJVING
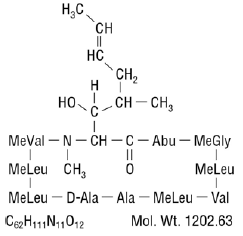
Neoral® is een orale formulering van cyclosporine die onmiddellijk een micro-emulsie vormt in een waterige omgeving.
Cyclosporine, het actieve bestanddeel in Neoral®, is een cyclisch polypeptide immunosuppressivum dat bestaat uit 11 aminozuren. Het wordt geproduceerd als een metaboliet door de schimmelsoort Beauveria nivea.
Chemisch gezien wordt cyclosporine aangeduid als [R-[R*,R*-(E)]]-cyclisch-(L-alanyl-D-alanyl-N-methyl-L-leucylN-methyl-L-leucyl-N-methyl -L-valyl-3-hydroxy-N,4-dimethyl-L-2-amino-6-octenoyl-L-α-aminobutyryl-N-methylglycyl-N-methyl-L-leucyl-L-valyl-N-methyl -L-leucyl).
Neoral® zachte gelatinecapsules (cyclosporinecapsules, USP) GEMODIFICEERD zijn verkrijgbaar in sterkten van 25 mg en 100 mg.
Elke capsule van 25 mg bevat:
ciclosporine……………………………………25 mg alcohol, USP gedehydrateerd............................11,9% v/v (9,5% gew/vol.)
Elke capsule van 100 mg bevat:
ciclosporine…………………………...100 mg alcohol, USP gedehydrateerd............................11,9 % v/v (9,5% gew/vol.)
Inactieve ingredienten: Maïsolie-mono-di-triglyceriden, polyoxyl 40 gehydrogeneerde ricinusolie NF, DL-αtocoferol USP, gelatine NF, glycerol, ijzeroxide zwart, propyleenglycol USP, titaniumdioxide USP, karmijn en andere ingrediënten.
Neoral® orale oplossing (ciclosporine drank, USP) GEMODIFICEERD is verkrijgbaar in flessen van 50 ml.
Elke ml bevat:
ciclosporine……………………..................100 mg/ml alcohol, USP gedehydrateerd.................. ...........11,9% v/v (9,5% wt/vol.)
Inactieve ingredienten: Maïsolie-mono-di-triglyceriden, polyoxyl 40 gehydrogeneerde ricinusolie NF, DL-α-tocoferol USP, propyleenglycol USP.
De chemische structuur van cyclosporine (ook bekend als cyclosporine A) is:
INDICATIES
Nier-, lever- en harttransplantatie
Neoral 25 mg is geïndiceerd voor de profylaxe van orgaanafstoting bij allogene nier-, lever- en harttransplantaties. Neoral 100 mg is gebruikt in combinatie met azathioprine en corticosteroïden.
Reumatoïde artritis
Neoral is geïndiceerd voor de behandeling van patiënten met ernstige actieve reumatoïde artritis bij wie de ziekte niet adequaat heeft gereageerd op methotrexaat. Neoral kan worden gebruikt in combinatie met methotrexaat bij patiënten met reumatoïde artritis die niet adequaat reageren op methotrexaat alleen.
Psoriasis
Neoral is geïndiceerd voor de behandeling van volwassen, niet-immuungecompromitteerde patiënten met ernstige (dwz uitgebreide en/of invaliderende), recalcitrante plaque psoriasis die niet hebben gereageerd op ten minste één systemische therapie (bijv. PUVA, retinoïden of methotrexaat) of patiënten voor wie andere systemische therapieën gecontra-indiceerd zijn of niet kunnen worden verdragen.
Hoewel rebound zelden optreedt, zullen de meeste patiënten na stopzetting van de behandeling een terugval ervaren met Neoral 100 mg, net als met andere therapieën.
DOSERING EN ADMINISTRATIE
Neoral 25 mg zachte gelatinecapsules (ciclosporinecapsules, USP) GEMODIFICEERD en Neoral drank (ciclosporine orale oplossing, USP) MODIFIE D
Neoral heeft een verhoogde biologische beschikbaarheid in vergelijking met Sandimmune. Neoral 25 mg en Sandimmune zijn niet bio-equivalent en kunnen niet door elkaar worden gebruikt zonder toezicht van een arts.
De dagelijkse dosis Neoral 100 mg moet altijd in twee verdeelde doses (BID) worden gegeven. Het wordt aanbevolen Neoral toe te dienen volgens een consistent schema met betrekking tot het tijdstip van de dag en de maaltijden. Grapefruit en grapefruitsap beïnvloeden het metabolisme, waardoor de bloedconcentratie van ciclosporine wordt verhoogd, dus moet worden vermeden.
Specifieke populaties
Nierfunctiestoornis bij nier-, lever- en harttransplantatie
Ciclosporine ondergaat minimale eliminatie via de nieren en de farmacokinetiek ervan lijkt niet significant te veranderen bij patiënten met terminale nierziekte die routinematige hemodialysebehandelingen krijgen (zie KLINISCHE FARMACOLOGIE ). Vanwege het nefrotoxische potentieel (zie: WAARSCHUWINGEN ), wordt een zorgvuldige controle van de nierfunctie aanbevolen; De dosering van ciclosporine moet indien geïndiceerd worden verlaagd (zie: WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN ).
Nierfunctiestoornis bij reumatoïde artritis en psoriasis
Patiënten met een verminderde nierfunctie mogen geen ciclosporine krijgen (zie: CONTRA-INDICATIES , WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN ).
Leverfunctiestoornis
De klaring van ciclosporine kan significant verminderd zijn bij patiënten met ernstige leverziekte (zie: KLINISCHE FARMACOLOGIE ). Dosisverlaging kan nodig zijn bij patiënten met een ernstige leverfunctiestoornis om de bloedconcentraties binnen het aanbevolen streefbereik te houden (zie: WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN ).
Pas getransplanteerde patiënten
De initiële orale dosis Neoral 25 mg kan 4 tot 12 uur voorafgaand aan de transplantatie of postoperatief worden gegeven. De aanvangsdosis van Neoral 25 mg varieert afhankelijk van het getransplanteerde orgaan en de andere immunosuppressiva die in het immunosuppressieve protocol zijn opgenomen. Bij nieuw getransplanteerde patiënten is de initiële orale dosis Neoral hetzelfde als de initiële orale dosis Sandimmune. Voorgestelde aanvangsdoses zijn beschikbaar op basis van de resultaten van een onderzoek uit 1994 naar het gebruik van Sandimmune in Amerikaanse transplantatiecentra. De gemiddelde ± SD initiële doses waren 9 ± 3 mg/kg/dag voor niertransplantatiepatiënten (75 centra), 8 ± 4 mg/kg/dag voor levertransplantatiepatiënten (30 centra) en 7 ± 3 mg/kg/dag voor harttransplantatiepatiënten (24 centra). De totale dagelijkse doses werden verdeeld in twee gelijke dagelijkse doses. De dosis Neoral wordt vervolgens aangepast om een vooraf gedefinieerde ciclosporine-bloedconcentratie te bereiken (zie: Bloedconcentratiebewaking bij transplantatiepatiënten onderstaand). Als ciclosporine-dalconcentraties in het bloed worden gebruikt, is het streefbereik voor Neoral 100 mg hetzelfde als voor Sandimmune. Het gebruik van hetzelfde streefbereik voor de dalconcentratie voor Neoral 100 mg als voor Sandimmune resulteert in een grotere blootstelling aan ciclosporine wanneer Neoral wordt toegediend (zie Farmacokinetiek, absorptie ). De dosering moet worden getitreerd op basis van klinische beoordelingen van afstoting en verdraagbaarheid. Lagere doses Neoral 100 mg kunnen voldoende zijn als onderhoudstherapie.
In eerste instantie wordt een aanvullende therapie met bijniercorticosteroïden aanbevolen. Verschillende afbouwende doseringsschema's van prednison lijken vergelijkbare resultaten te bereiken. Een representatief doseringsschema op basis van het gewicht van de patiënt begon met 2,0 mg/kg/dag gedurende de eerste 4 dagen, aflopend tot 1,0 mg/kg/dag na 1 week, 0,6 mg/kg/dag na 2 weken, 0,3 mg/kg/dag na 1 maand en 0,15 mg/kg/dag na 2 maanden en daarna als onderhoudsdosis. De dosis steroïden kan verder worden afgebouwd op individuele basis, afhankelijk van de status van de patiënt en de functie van het transplantaat. Aanpassingen in de dosering van prednison moeten worden gemaakt in overeenstemming met de klinische situatie.
Conversie van Sandimmune naar Neoral 25 mg bij transplantatiepatiënten
Bij getransplanteerde patiënten die in aanmerking komen voor conversie naar Neoral van Sandimmune, moet Neoral worden gestart met dezelfde dagelijkse dosis als eerder werd gebruikt met Sandimmune (1:1 dosisconversie). De dosis Neoral moet vervolgens worden aangepast om de dalconcentratie van ciclosporine in het bloed vóór de conversie te bereiken. Het gebruik van hetzelfde streefbereik voor de dalconcentratie voor Neoral 100 mg als voor Sandimmune resulteert in een grotere blootstelling aan ciclosporine wanneer Neoral wordt toegediend (zie Farmacokinetiek, absorptie ). Patiënten met een vermoedelijke slechte absorptie van Sandimmune hebben verschillende doseringsstrategieën nodig (zie: Transplantatiepatiënten met slechte absorptie van Sandimmune, onderstaand). Bij sommige patiënten is de verhoging van de bloeddalconcentratie meer uitgesproken en kan deze van klinische betekenis zijn.
Totdat de bloeddalconcentratie de pre-conversiewaarde bereikt, wordt sterk aanbevolen om de ciclosporine-bloeddalconcentratie elke 4 tot 7 dagen na conversie naar Neoral te controleren. Bovendien dienen klinische veiligheidsparameters, zoals serumcreatinine en bloeddruk, gedurende de eerste twee maanden na conversie om de twee weken te worden gecontroleerd. Als de bloeddalconcentraties buiten het gewenste bereik liggen en/of als de klinische veiligheidsparameters verslechteren, moet de dosering van Neoral 100 mg dienovereenkomstig worden aangepast.
Transplantatiepatiënten met slechte absorptie van Sandimmune
Patiënten met lager dan verwachte ciclosporine-dalconcentraties in het bloed in verhouding tot de orale dosis Sandimmune kunnen een slechte of inconsistente absorptie van ciclosporine uit Sandimmune hebben. Na conversie naar Neoral hebben patiënten vaak hogere ciclosporineconcentraties. Als gevolg van de toename van de biologische beschikbaarheid van ciclosporine na conversie naar Neoral, kan de ciclosporine-dalconcentratie in het bloed het streefbereik overschrijden. Bijzondere voorzichtigheid is geboden bij het overschakelen van patiënten op Neoral 100 mg in doses hoger dan 10 mg/kg/dag. De dosis Neoral moet individueel worden getitreerd op basis van ciclosporinedalconcentraties, verdraagbaarheid en klinische respons. Bij deze populatie moet de ciclosporine-dalconcentratie in het bloed vaker worden gemeten, ten minste tweemaal per week (dagelijks, als de aanvangsdosis hoger is dan 10 mg/kg/dag) totdat de concentratie zich binnen het gewenste bereik stabiliseert.
Reumatoïde artritis
De aanvangsdosis van Neoral is 2,5 mg/kg/dag, tweemaal daags ingenomen als een verdeelde (BID) orale dosis. Salicylaten, NSAID's en orale corticosteroïden kunnen worden voortgezet (zie: WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ). Het begin van de werking treedt over het algemeen op tussen 4 en 8 weken. Als onvoldoende klinisch voordeel wordt waargenomen en de verdraagbaarheid goed is (inclusief serumcreatinine minder dan 30% boven de uitgangswaarde), kan de dosis worden verhoogd met 0,5 tot 0,75 mg/kg/dag na 8 weken en opnieuw na 12 weken tot een maximum van 4 mg /kg/dag. Als na 16 weken therapie geen voordeel wordt waargenomen, moet de behandeling met Neoral 25 mg worden stopgezet.
Dosisverlagingen met 25% tot 50% moeten op elk moment worden gedaan om bijwerkingen onder controle te houden, bijv. verhoogde hypertensie in serumcreatinine (30% boven het niveau van vóór de behandeling van de patiënt) of klinisch significante laboratoriumafwijkingen (zie WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN ).
Als dosisverlaging niet effectief is om afwijkingen onder controle te krijgen of als de bijwerking of afwijking ernstig is, moet Neoral 25 mg worden stopgezet. Dezelfde aanvangsdosis en hetzelfde doseringsbereik moeten worden gebruikt als Neoral 25 mg wordt gecombineerd met de aanbevolen dosis methotrexaat. De meeste patiënten kunnen worden behandeld met doses Neoral 25 mg van 3 mg/kg/dag of lager in combinatie met doses methotrexaat tot 15 mg/week (zie KLINISCHE FARMACOLOGIE , Klinische proeven ).
Er zijn beperkte gegevens over langdurige behandeling. Herhaling van de ziekteactiviteit van reumatoïde artritis is over het algemeen duidelijk binnen 4 weken na het stoppen met ciclosporine.
Psoriasis
De aanvangsdosis van Neoral 100 mg moet 2,5 mg/kg/dag zijn. Neoral moet tweemaal daags worden ingenomen, als een verdeelde (1,25 mg/kg BID) orale dosis. Patiënten dienen gedurende ten minste 4 weken op die dosis te worden gehouden, behoudens bijwerkingen. Als er tegen die tijd geen significante klinische verbetering is opgetreden bij patiënten, moet de dosering van de patiënt met tussenpozen van 2 weken worden verhoogd. Op basis van de respons van de patiënt dienen dosisverhogingen van ongeveer 0,5 mg/kg/dag te worden doorgevoerd tot een maximum van 4,0 mg/kg/dag.
Dosisverlagingen met 25% tot 50% moeten op elk moment worden gedaan om bijwerkingen, bijv. hypertensie, verhogingen van het serumcreatinine (≥ 25% boven het niveau van voor de behandeling van de patiënt) of klinisch significante laboratoriumafwijkingen onder controle te houden. Als dosisverlaging niet effectief is om afwijkingen onder controle te krijgen, of als de bijwerking of afwijking ernstig is, moet Neoral 25 mg worden stopgezet (zie Speciale monitoring van psoriasispatiënten ).
Patiënten vertonen over het algemeen enige verbetering in de klinische manifestaties van psoriasis in 2 weken. Het kan 12 tot 16 weken duren voordat een bevredigende controle en stabilisatie van de ziekte wordt bereikt. Resultaten van een klinisch onderzoek naar dosistitratie met Neoral 25 mg geven aan dat een verbetering van psoriasis met 75% of meer (op basis van PASI) werd bereikt bij 51% van de patiënten na 8 weken en bij 79% van de patiënten na 16 weken. De behandeling dient te worden gestaakt als na 6 weken geen bevredigende respons kan worden bereikt bij 4 mg/kg/dag of de door de patiënt maximaal getolereerde dosis. Zodra een patiënt voldoende onder controle is en stabiel lijkt te zijn, moet de dosis Neoral 25 mg worden verlaagd en moet de patiënt worden behandeld met de laagste dosis die een adequate respons handhaaft (dit hoeft niet noodzakelijk volledige genezing van de patiënt te zijn). In klinische onderzoeken waren ciclosporinedoses aan de onderkant van het aanbevolen doseringsbereik effectief bij het handhaven van een bevredigende respons bij 60% van de patiënten. Doses lager dan 2,5 mg/kg/dag kunnen ook even effectief zijn.
Na stopzetting van de behandeling met ciclosporine zal een recidief optreden na ongeveer 6 weken (50% van de patiënten) tot 16 weken (75% van de patiënten). Bij de meeste patiënten treedt geen rebound op na stopzetting van de behandeling met ciclosporine. Dertien gevallen van transformatie van chronische plaque psoriasis naar ernstigere vormen van psoriasis zijn gemeld. Er waren 9 gevallen van pustuleuze en 4 gevallen van erythrodermische psoriasis. Langdurige ervaring met Neoral bij psoriasispatiënten is beperkt en continue behandeling gedurende langere perioden langer dan een jaar wordt niet aanbevolen. Afwisseling met andere vormen van behandeling moet worden overwogen bij de langetermijnbehandeling van patiënten met deze levenslange ziekte.
Neoral 25 mg orale oplossing (ciclosporine orale oplossing, USP) GEMODIFICEERD - Aanbevelingen voor toediening
Om Neoral 25 mg orale oplossing (ciclosporine drank, USP) MODIFIED smakelijker te maken, moet het worden verdund met sinaasappel- of appelsap dat op kamertemperatuur is. Patiënten moeten vermijden om vaak van verdunningsmiddel te wisselen. Grapefruitsap beïnvloedt het metabolisme van ciclosporine en moet worden vermeden. De combinatie van Neoral-oplossing met melk kan onsmakelijk zijn. Het effect van melk op de biologische beschikbaarheid van ciclosporine bij toediening als Neoral 100 mg drank is niet onderzocht.
Neem de voorgeschreven hoeveelheid Neoral 25 mg orale oplossing (cyclosporine drank, USP) GEWIJZIGD uit de container met behulp van de meegeleverde doseerspuit, na verwijdering van de beschermkap, en breng de oplossing over in een glas sinaasappel- of appelsap. Goed roeren en in één keer opdrinken. Laat de verdunde drank niet staan alvorens te drinken. Gebruik een glazen container (geen plastic). Spoel het glas met meer verdunningsmiddel om ervoor te zorgen dat de totale dosis wordt verbruikt. Droog na gebruik de buitenkant van de doseerspuit af met een schone handdoek en plaats de beschermkap terug. Spoel de doseerspuit niet af met water of andere reinigingsmiddelen. Als de spuit moet worden gereinigd, moet deze volledig droog zijn voordat het gebruik wordt hervat.
Bloedconcentratiebewaking bij transplantatiepatiënten
Transplantatiecentra hebben geconstateerd dat het monitoren van de bloedconcentratie van ciclosporine een essentieel onderdeel is van de behandeling van patiënten. Van belang voor de analyse van de bloedconcentratie zijn het type test dat wordt gebruikt, het getransplanteerde orgaan en andere immunosuppressieve middelen die worden toegediend. Hoewel er geen vaste relatie is vastgesteld, kan monitoring van de bloedconcentratie helpen bij de klinische evaluatie van afstoting en toxiciteit, dosisaanpassingen en de beoordeling van de naleving.
Er zijn verschillende testen gebruikt om de bloedconcentraties van cyclosporine te meten. Oudere onderzoeken die een niet-specifieke test gebruikten, noemden vaak concentraties die ruwweg twee keer zo hoog waren als die van de specifieke testen. Daarom moet een vergelijking tussen concentraties in de gepubliceerde literatuur en een individuele patiëntconcentratie met behulp van huidige tests worden gemaakt met gedetailleerde kennis van de gebruikte testmethoden. De huidige testresultaten zijn ook niet uitwisselbaar en het gebruik ervan moet worden geleid door de goedgekeurde etikettering. Een bespreking van de verschillende testmethoden is opgenomen in Annals of Clinical Biochemistry 1994; 31: 420-446. Hoewel er verschillende assays en assaymatrices beschikbaar zijn, is er een consensus dat parent-verbinding-specifieke assays het beste correleren met klinische gebeurtenissen. Hiervan is HPLC de standaardreferentie, maar de monoklonale antilichaam RIA's en de monoklonale antilichaam FPIA bieden gevoeligheid, reproduceerbaarheid en gemak. De meeste clinici baseren hun monitoring op dalconcentraties van ciclosporine. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) bevat een brede bespreking van de farmacokinetiek van ciclosporine en technieken voor het monitoren van geneesmiddelen. Monitoring van de bloedconcentratie is geen vervanging voor monitoring van de nierfunctie of weefselbiopten.
HOE GELEVERD
Neoral® zachte gelatinecapsules (cyclosporinecapsules, USP) GEWIJZIGD
25 mg
Ovaal, blauwgrijs bedrukt in rood, "Neoral" boven "25 mg."
Verpakkingen van 30 eenheidsblisterverpakkingen ( NDC 0078-0246-15).
100 mg
Langwerpig, blauwgrijs bedrukt in rood, "NEORAL" boven "100 mg."
Verpakkingen van 30 eenheidsblisterverpakkingen ( NDC 0078-0248-15).
Opslaan en afgeven
In de originele verpakking met eenheidsdosering bij een gecontroleerde kamertemperatuur van 20 °C tot 25 °C (68 °F tot 77 °F).
Neoral® orale oplossing (cyclosporine orale oplossing, USP) GEWIJZIGD
Een heldere, gele vloeistof geleverd in flessen van 50 ml met 100 mg/ml ( NDC 0078-0274-22).
Opslaan en afgeven
In de originele verpakking bij een gecontroleerde kamertemperatuur van 20 tot 25 °C (68 °F tot 77 °F). Niet in de koelkast bewaren. Na opening moet de inhoud binnen twee maanden worden gebruikt. Bij temperaturen onder 68 °F (20 °C) kan de oplossing geleren; lichte uitvlokking of de vorming van een licht sediment kan ook optreden. Er is geen invloed op de productprestaties of dosering met de meegeleverde spuit. Laat opwarmen tot kamertemperatuur (25°C) om deze veranderingen ongedaan te maken.
Neoral® zachte gelatinecapsules (cyclosporinecapsules, USP) GEWIJZIGD
Neoral® orale oplossing (ciclosporine orale oplossing, USP) GEWIJZIGD
Gedistribueerd door: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Herzien juni 2021.
BIJWERKINGEN
Nier-, lever- en harttransplantatie
De belangrijkste bijwerkingen van ciclosporinetherapie zijn nierdisfunctie, tremor, hirsutisme, hypertensie en tandvleeshyperplasie.
Hypertensie
Hypertensie, die gewoonlijk licht tot matig is, kan optreden bij ongeveer 50% van de patiënten na een niertransplantatie en bij de meeste harttransplantatiepatiënten.
Glomerulaire capillaire trombose
Glomerulaire capillaire trombose is gevonden bij patiënten die werden behandeld met ciclosporine en kan evolueren tot transplantaatfalen. De pathologische veranderingen leken op die waargenomen bij het hemolytisch-uremisch syndroom en omvatten trombose van de renale microvasculatuur, met bloedplaatjes-fibrinetrombi die de glomerulaire capillairen en afferente arteriolen afsluiten, microangiopathische hemolytische anemie, trombocytopenie en verminderde nierfunctie. Soortgelijke bevindingen zijn waargenomen wanneer na de transplantatie andere immunosuppressiva zijn gebruikt.
Hypomagnesiëmie
Hypomagnesiëmie is gemeld bij sommige, maar niet bij alle, patiënten die convulsies vertoonden tijdens behandeling met ciclosporine. Hoewel magnesiumdepletiestudies bij normale proefpersonen suggereren dat hypomagnesiëmie geassocieerd is met neurologische aandoeningen, lijken meerdere factoren, waaronder hypertensie, hoge doses methylprednisolon, hypocholesterolemie en nefrotoxiciteit geassocieerd met hoge plasmaconcentraties van cyclosporine, verband te houden met de neurologische manifestaties van cyclosporinetoxiciteit.
DRUG-INTERACTIES
Effect van geneesmiddelen en andere middelen op de farmacokinetiek en/of veiligheid van cyclosporine
Van alle afzonderlijke geneesmiddelen die hieronder worden genoemd, is goed onderbouwd dat ze een interactie aangaan met cyclosporine. Bovendien kan gelijktijdig gebruik van NSAID's met ciclosporine, met name bij uitdroging, de nierfunctiestoornis versterken. Voorzichtigheid is geboden bij het gebruik van andere geneesmiddelen waarvan bekend is dat ze de nierfunctie verslechteren (zie: WAARSCHUWINGEN , Nefrotoxiciteit ).
Geneesmiddelen die nierfunctiestoornissen kunnen versterken
Bij gelijktijdig gebruik van een geneesmiddel dat een additieve of synergetische nierfunctiestoornis met ciclosporine kan vertonen, moet de nierfunctie (in het bijzonder serumcreatinine) nauwlettend worden gecontroleerd. Als er een significante verslechtering van de nierfunctie optreedt, moet de dosering van het gelijktijdig toegediende geneesmiddel worden verlaagd of moet een alternatieve behandeling worden overwogen.
Cyclosporine wordt uitgebreid gemetaboliseerd door CYP 3A iso-enzymen, in het bijzonder CYP3A4, en is een substraat van de multidrug efflux transporter P-glycoproteïne. Van verschillende middelen is bekend dat ze de plasma- of volbloedconcentraties van ciclosporine verhogen of verlagen, gewoonlijk door remming of inductie van CYP3A4- of P-glycoproteïnetransporteiwit of beide. Verbindingen die de absorptie van cyclosporine verminderen, zoals orlistat, moeten worden vermeden. Een juiste dosisaanpassing van Neoral 100 mg om de gewenste ciclosporineconcentraties te bereiken is essentieel wanneer gelijktijdig geneesmiddelen worden gebruikt die de ciclosporineconcentraties significant veranderen (zie B overstroming Concentratie Monitoring ).
1. Geneesmiddelen die de ciclosporineconcentraties verhogen
HIV-proteaseremmers
Van de hiv-proteaseremmers (bijv. indinavir, nelfinavir, ritonavir en saquinavir) is bekend dat ze cytochroom P-450 3A remmen en dus mogelijk de concentraties van ciclosporine kunnen verhogen, maar er zijn geen formele onderzoeken naar de interactie beschikbaar. Voorzichtigheid is geboden wanneer deze geneesmiddelen gelijktijdig worden toegediend.
Grapefruit SAP
Grapefruit en grapefruitsap beïnvloeden het metabolisme, waardoor de bloedconcentraties van ciclosporine toenemen en moeten daarom worden vermeden.
2. Geneesmiddelen/voedingssupplementen die de ciclosporineconcentraties verlagen
Bosentan
Gelijktijdige toediening van bosentan (250 tot 1000 mg om de 12 uur op basis van verdraagbaarheid) en ciclosporine (300 mg om de 12 uur gedurende 2 dagen, daarna dosering om een Cmax van 200 tot 250 ng/ml te bereiken) gedurende 7 dagen bij gezonde proefpersonen resulteerde in een afname van de de gemiddelde dosis-genormaliseerde AUC, Cmax en dalconcentratie van ciclosporine van respectievelijk ongeveer 50%, 30% en 60%, vergeleken met wanneer ciclosporine alleen werd gegeven (zie Effect van cyclosporine op de farmacokinetiek en/of veiligheid van andere geneesmiddelen of middelen ). Gelijktijdige toediening van ciclosporine met bosentan moet worden vermeden.
Boceprevir
Gelijktijdige toediening van boceprevir (800 mg driemaal daags gedurende 7 dagen) en ciclosporine (100 mg enkelvoudige dosis) bij gezonde proefpersonen resulteerde in verhogingen van de gemiddelde AUC en Cmax van ciclosporine respectievelijk ongeveer 2,7- en 2-voudig vergeleken met wanneer ciclosporine alleen werd gegeven.
Telaprevir
Gelijktijdige toediening van telaprevir (750 mg om de 8 uur gedurende 11 dagen) met ciclosporine (10 mg op dag 8) bij gezonde proefpersonen resulteerde in verhogingen van de gemiddelde dosisgenormaliseerde AUC en Cmax van ciclosporine, respectievelijk ongeveer 4,5-voudig en 1,3-voudig. vergeleken met wanneer ciclosporine (enkelvoudige dosis van 100 mg) alleen werd gegeven.
Sint-janskruid
Er zijn meldingen geweest van een ernstige geneesmiddelinteractie tussen ciclosporine en het kruidenvoedingssupplement sint-janskruid. Er is gemeld dat deze interactie een duidelijke verlaging van de bloedconcentraties van ciclosporine veroorzaakt, resulterend in subtherapeutische spiegels, afstoting van getransplanteerde organen en verlies van transplantaten.
Rifabutine
Van rifabutine is bekend dat het het metabolisme verhoogt van andere geneesmiddelen die worden gemetaboliseerd door het cytochroom P-450-systeem. De interactie tussen rifabutine en ciclosporine is niet onderzocht. Voorzichtigheid is geboden wanneer deze twee geneesmiddelen gelijktijdig worden toegediend.
Effect van cyclosporine op de farmacokinetiek en/of veiligheid van andere geneesmiddelen of middelen
Cyclosporine is een remmer van CYP3A4 en van meerdere effluxtransporters van geneesmiddelen (bijv. P-glycoproteïne) en kan de plasmaconcentraties verhogen van comedicaties die substraten zijn van CYP3A4, P-glycoproteïne of organische aniontransporteiwitten.
Cyclosporine kan de klaring van digoxine, colchicine, prednisolon, HMG-CoA-reductaseremmers (statines) en aliskiren, bosentan, dabigatran, repaglinide, NSAID's, sirolimus, etoposide en andere geneesmiddelen verminderen.
Zie de volledige voorschrijfinformatie van het andere geneesmiddel voor meer informatie en specifieke aanbevelingen. De beslissing over gelijktijdige toediening van ciclosporine met andere geneesmiddelen of middelen moet worden genomen door de zorgverlener na een zorgvuldige beoordeling van de voordelen en risico's.
Digoxine
Ernstige digitalistoxiciteit is waargenomen binnen enkele dagen na het starten van ciclosporine bij verschillende patiënten die digoxine gebruikten. Als digoxine gelijktijdig met ciclosporine wordt gebruikt, moeten de serumconcentraties van digoxine worden gecontroleerd.
Colchicine
Er zijn meldingen over het potentieel van ciclosporine om de toxische effecten van colchicine, zoals myopathie en neuropathie, te versterken, vooral bij patiënten met nierdisfunctie. Gelijktijdige toediening van ciclosporine en colchicine leidt tot significante verhogingen van de plasmaconcentraties van colchicine. Als colchicine gelijktijdig met ciclosporine wordt gebruikt, wordt een verlaging van de dosering van colchicine aanbevolen.
HMG-CoA-reductaseremmers (statines)
Literatuur en postmarketinggevallen van myotoxiciteit, waaronder spierpijn en spierzwakte, myositis en rabdomyolyse, zijn gemeld bij gelijktijdige toediening van ciclosporine met lovastatine, simvastatine, atorvastatine, pravastatine en, in zeldzame gevallen, fluvastatine. Bij gelijktijdige toediening met ciclosporine moet de dosering van deze statines worden verlaagd volgens de aanbevelingen op het etiket. De behandeling met statines moet tijdelijk worden onderbroken of stopgezet bij patiënten met tekenen en symptomen van myopathie of bij patiënten met risicofactoren die predisponeren tot ernstig nierletsel, waaronder nierfalen, secundair aan rabdomyolyse.
Repaglinide
Cyclosporine kan de plasmaconcentraties van repaglinide verhogen en daardoor het risico op hypoglykemie verhogen. Bij 12 gezonde mannelijke proefpersonen die twee doses van 100 mg ciclosporinecapsule oraal kregen met een tussenpoos van 12 uur met een enkele dosis van 0,25 mg repaglinidetablet (de helft van een 0,5 mg tablet) oraal 13 uur na de startdosis ciclosporine, was de gemiddelde Cmax van repaglinide en AUC waren respectievelijk 1,8 maal verhoogd (bereik: 0,6 tot 3,7 maal) en 2,4 maal (bereik 1,2 tot 5,3 maal). Nauwgezette controle van de bloedglucosespiegel is raadzaam voor een patiënt die gelijktijdig ciclosporine en repaglinide gebruikt.
Ambrisentan
Gelijktijdige toediening van ambrisentan (5 mg per dag) en ciclosporine (aanvankelijk 100 tot 150 mg tweemaal daags, daarna dosering om Cmax 150 tot 200 ng/ml te bereiken) gedurende 8 dagen bij gezonde proefpersonen resulteerde in gemiddelde verhogingen van de ambrisentan AUC en Cmax van ongeveer 2 respectievelijk 1,5-voudig in vergelijking met ambrisentan alleen. Bij gelijktijdige toediening van ambrisentan met ciclosporine mag de dosis ambrisentan niet worden getitreerd tot de aanbevolen maximale dagelijkse dosis
Antracycline-antibiotica
Hoge doses ciclosporine (bijv. bij een intraveneuze startdosis van 16 mg/kg/dag) kunnen de blootstelling aan antracycline-antibiotica (bijv. doxorubicine, mitoxantron, daunorubicine) bij kankerpatiënten verhogen.
Aliskiren
Cyclosporine verandert de farmacokinetiek van aliskiren, een substraat van P-glycoproteïne en CYP3A4. Bij 14 gezonde proefpersonen die gelijktijdig enkelvoudige doses ciclosporine (200 mg) en een verlaagde dosis aliskiren (75 mg) kregen, was de gemiddelde Cmax van aliskiren ongeveer 2,5 maal verhoogd (90% BI: 1,96 tot 3,17) en de gemiddelde AUC met ongeveer 4,3-voudig (90% BI: 3,52 tot 5,21), vergeleken met wanneer deze proefpersonen alleen aliskiren kregen. De gelijktijdige toediening van aliskiren met ciclosporine verlengde de mediane eliminatiehalfwaardetijd van aliskiren (26 uur versus 43 tot 45 uur) en de Tmax (0,5 uur versus 1,5 tot 2,0 uur). De gemiddelde AUC en Cmax van ciclosporine waren vergelijkbaar met de gerapporteerde literatuurwaarden. Gelijktijdige toediening van ciclosporine en aliskiren bij deze proefpersonen resulteerde ook in een toename van het aantal en/of de intensiteit van bijwerkingen, voornamelijk hoofdpijn, opvliegers, misselijkheid, braken en slaperigheid. Gelijktijdige toediening van ciclosporine met aliskiren wordt niet aanbevolen.
Bosentan
Bij gezonde proefpersonen resulteerde gelijktijdige toediening van bosentan en ciclosporine in tijdsafhankelijke gemiddelde verhogingen van de dosis genormaliseerd
bosentan dalconcentraties (dwz ongeveer 21-voudig op dag 1 en 2-voudig op dag 8 (steady state)) vergeleken met wanneer bosentan alleen werd gegeven als een enkele dosis op dag 1 (zie Effect van geneesmiddelen en andere middelen op de farmacokinetiek en/of veiligheid van cyclosporine ). Gelijktijdige toediening van ciclosporine met bosentan moet worden vermeden.
Dabigatran
Het effect van ciclosporine op de dabigatranconcentraties was niet formeel onderzocht. Gelijktijdige toediening van dabigatran en ciclosporine kan leiden tot verhoogde plasmaconcentraties van dabigatran vanwege de P-gp-remmende activiteit van ciclosporine. Gelijktijdige toediening van ciclosporine met dabigatran moet worden vermeden.
Kaliumsparende diuretica
Cyclosporine mag niet worden gebruikt met kaliumsparende diuretica omdat hyperkaliëmie kan optreden. Voorzichtigheid is ook geboden wanneer ciclosporine gelijktijdig wordt toegediend met kaliumsparende geneesmiddelen (bijv. angiotensineconverterende enzymremmers, angiotensine II-receptorantagonisten), kaliumbevattende geneesmiddelen en bij patiënten die een kaliumrijk dieet volgen. Controle van de kaliumspiegels in deze situaties is aan te raden.
Interacties met niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's)
Klinische status en serumcreatinine moeten nauwlettend worden gecontroleerd wanneer ciclosporine wordt gebruikt met NSAID's bij patiënten met reumatoïde artritis (zie WAARSCHUWINGEN ).
Er is gemeld dat farmacodynamische interacties optreden tussen ciclosporine en zowel naproxen als sulindac, in die zin dat gelijktijdig gebruik gepaard gaat met additieve dalingen van de nierfunctie, zoals bepaald door 99mTc-diethyleentriaminepenta-azijnzuur (DTPA) en (p-aminohippuurzuur) PAK-klaringen. Hoewel gelijktijdige toediening van diclofenac geen invloed heeft op de bloedconcentraties van ciclosporine, is het in verband gebracht met ongeveer een verdubbeling van de diclofenac-bloedconcentraties en incidentele meldingen van omkeerbare afname van de nierfunctie. Daarom moet de dosis diclofenac aan de onderkant van het therapeutische bereik liggen.
Methotrexaat interactie
Voorlopige gegevens geven aan dat wanneer methotrexaat en ciclosporine gelijktijdig werden toegediend aan patiënten met reumatoïde artritis (N = 20), de methotrexaatconcentraties (AUC's) met ongeveer 30% werden verhoogd en de concentraties (AUC's) van zijn metaboliet, 7-hydroxymethotrexaat, met ongeveer 80 werden verlaagd. %. De klinische betekenis van deze interactie is niet bekend. De ciclosporineconcentraties lijken niet te zijn veranderd (N = 6).
Sirolimus
Verhogingen van serumcreatinine werden waargenomen in onderzoeken met sirolimus in combinatie met volledige dosis ciclosporine. Dit effect is vaak omkeerbaar bij verlaging van de dosis ciclosporine. Gelijktijdige gelijktijdige toediening van ciclosporine verhoogt de bloedspiegels van sirolimus significant. Om verhogingen van sirolimusconcentraties tot een minimum te beperken, wordt aanbevolen om sirolimus 4 uur na toediening van ciclosporine te geven.
Nifedipine
Frequente gingivale hyperplasie bij gelijktijdige toediening van nifedipine met ciclosporine is gemeld. Gelijktijdig gebruik van nifedipine moet worden vermeden bij patiënten bij wie gingivale hyperplasie optreedt als bijwerking van ciclosporine.
Methylprednisolon
Er zijn convulsies gemeld bij gelijktijdige toediening van een hoge dosis methylprednisolon met ciclosporine.
Andere immunosuppressieve geneesmiddelen en middelen
Psoriasispatiënten die andere immunosuppressiva of bestralingstherapie (inclusief PUVA en UVB) krijgen, mogen niet gelijktijdig ciclosporine krijgen vanwege de mogelijkheid van overmatige immunosuppressie.
Effect van cyclosporine op de werkzaamheid van levende vaccins
Tijdens de behandeling met ciclosporine kan vaccinatie minder effectief zijn. Het gebruik van levende vaccins moet worden vermeden.
Voor meer informatie over cyclosporine-geneesmiddelinteracties kunt u contact opnemen met Novartis Medical Affairs Department op 1-888-NOW-NOVA [1-888-669-6682].
WAARSCHUWINGEN
(Zie ook GEVAARLIJKE WAARSCHUWING: )
Alle patiënten
Cyclosporine, het werkzame bestanddeel van Neoral 25 mg, kan nefrotoxiciteit en hepatotoxiciteit veroorzaken. Het risico neemt toe met toenemende doses ciclosporine. Nierdisfunctie, inclusief structurele nierbeschadiging, is een mogelijk gevolg van Neoral 100 mg en daarom moet de nierfunctie tijdens de behandeling worden gecontroleerd. Voorzichtigheid is geboden bij het gebruik van ciclosporine met nefrotoxische geneesmiddelen (zien PREVENTIEVE MAATREGELEN ).
Patiënten die Neoral krijgen, moeten het serumcreatinine regelmatig controleren (zie: Speciale bewaking onder DOSERING EN ADMINISTRATIE ). Oudere patiënten moeten met bijzondere zorg worden gecontroleerd, aangezien een afname van de nierfunctie ook optreedt met de leeftijd. Als patiënten niet goed worden gecontroleerd en de doseringen niet goed worden aangepast, kan behandeling met ciclosporine gepaard gaan met het optreden van structurele nierbeschadiging en aanhoudende nierfunctiestoornis.
Een verhoging van serumcreatinine en BUN kan optreden tijdens de behandeling met Neoral en weerspiegelt een verlaging van de glomerulaire filtratiesnelheid. Een gestoorde nierfunctie vereist op elk moment nauwlettend toezicht en frequente aanpassing van de dosering kan aangewezen zijn. De frequentie en ernst van verhogingen van serumcreatinine nemen toe met de dosis en de duur van de behandeling met ciclosporine. Deze verhogingen zullen waarschijnlijk meer uitgesproken worden zonder dosisverlaging of stopzetting.
Omdat Neoral 100 mg niet bio-equivalent is aan Sandimmune, kan conversie van Neoral naar Sandimmune met een verhouding van 1:1 (mg/kg/dag) resulteren in lagere ciclosporine-bloedconcentraties. Overschakeling van Neoral naar Sandimmune dient plaats te vinden onder intensievere controle om mogelijke onderdosering te voorkomen.
Nier-, lever- en harttransplantatie
Nefrotoxiciteit
Cyclosporine, het werkzame bestanddeel van Neoral, kan nefrotoxiciteit en hepatotoxiciteit veroorzaken bij gebruik in hoge doses. Het is niet ongebruikelijk dat de serumcreatinine- en BUN-spiegels verhoogd zijn tijdens ciclosporinetherapie. Deze verhogingen bij niertransplantatiepatiënten duiden niet noodzakelijkerwijs op afstoting, en elke patiënt moet volledig worden geëvalueerd voordat de dosering wordt aangepast.
Op basis van de historische ervaring van Sandimmune met drank, werd nefrotoxiciteit geassocieerd met ciclosporine opgemerkt in 25% van de gevallen van niertransplantatie, 38% van de gevallen van harttransplantatie en 37% van de gevallen van levertransplantatie. Milde nefrotoxiciteit werd over het algemeen 2 tot 3 maanden na niertransplantatie opgemerkt en bestond uit een arrestatie in de herfst van de pre-operatieve verhogingen van BUN en creatinine met een bereik van respectievelijk 35 tot 45 mg/dL en 2,0 tot 2,5 mg/dL. Deze verhogingen reageerden vaak op verlaging van de ciclosporinedosering.
Meer openlijke nefrotoxiciteit werd vroeg na transplantatie waargenomen en werd gekenmerkt door een snel stijgende BUN en creatinine. Aangezien deze gebeurtenissen vergelijkbaar zijn met episodes van nierafstoting, moet er goed op worden gelet dat er onderscheid tussen wordt gemaakt. Deze vorm van nefrotoxiciteit reageert gewoonlijk op verlaging van de dosering van ciclosporine.
Hoewel er geen specifieke diagnostische criteria zijn gevonden die afstoting van niertransplantaten op betrouwbare wijze onderscheiden van geneesmiddeltoxiciteit, zijn een aantal parameters significant geassocieerd met de een of de ander. Er moet echter worden opgemerkt dat tot 20% van de patiënten gelijktijdige nefrotoxiciteit en afstoting kan hebben.
Een vorm van ciclosporine-geassocieerde nefropathie wordt gekenmerkt door seriële verslechtering van de nierfunctie en morfologische veranderingen in de nieren. Van 5% tot 15% van de ontvangers van transplantaties die ciclosporine hebben gekregen, zal ondanks een verlaging of stopzetting van de behandeling met ciclosporine geen verlaging van het stijgende serumcreatinine optreden. Nierbiopten van deze patiënten zullen een of meer van de volgende veranderingen aantonen: tubulaire vacuolisatie, tubulaire microcalcificaties, peritubulaire capillaire congestie, arteriolopathie en een gestreepte vorm van interstitiële fibrose met tubulaire atrofie. Hoewel geen van deze morfologische veranderingen volledig specifiek is, vereist een diagnose van ciclosporine-geassocieerde structurele nefrotoxiciteit bewijs van deze bevindingen.
Bij het beschouwen van de ontwikkeling van ciclosporine-geassocieerde nefropathie, is het opmerkelijk dat verschillende auteurs een verband hebben gemeld tussen het optreden van interstitiële fibrose en hogere cumulatieve doses of aanhoudend hoge circulerende dalconcentraties van ciclosporine. Dit geldt met name tijdens de eerste 6 maanden na de transplantatie, wanneer de dosering de neiging heeft het hoogst te zijn en wanneer het orgaan bij nierontvangers het meest kwetsbaar lijkt te zijn voor de toxische effecten van ciclosporine. Andere factoren die bijdragen aan de ontwikkeling van interstitiële fibrose bij deze patiënten zijn verlengde perfusietijd, warme ischemietijd, evenals episodes van acute toxiciteit en acute en chronische afstoting. De reversibiliteit van interstitiële fibrose en de correlatie met de nierfunctie zijn nog niet vastgesteld. Reversibiliteit van arteriolopathie is gemeld na het stoppen met ciclosporine of het verlagen van de dosering.
Een gestoorde nierfunctie vereist op elk moment nauwlettend toezicht en frequente aanpassing van de dosering kan aangewezen zijn.
In het geval van ernstige en aanhoudende afstoting, wanneer reddingstherapie met pulssteroïden en monoklonale antilichamen de afstotingsepisode niet omkeert, kan het de voorkeur hebben om over te schakelen op een alternatieve immunosuppressieve therapie in plaats van de dosis Neoral te verhogen tot te hoge bloedconcentraties.
Vanwege de mogelijkheid van additieve of synergetische verslechtering van de nierfunctie, is voorzichtigheid geboden bij gelijktijdige toediening van Neoral met andere geneesmiddelen die de nierfunctie kunnen aantasten (zie PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ).
Trombotische microangiopathie
Af en toe hebben patiënten een syndroom van trombocytopenie en microangiopathische hemolytische anemie ontwikkeld, wat kan leiden tot transplantaatfalen. De vasculopathie kan optreden in afwezigheid van afstoting en gaat gepaard met een gretige consumptie van bloedplaatjes in het transplantaat, zoals aangetoond door met Indium 111 gelabelde bloedplaatjesonderzoeken. Noch de pathogenese, noch de behandeling van dit syndroom is duidelijk. Hoewel herstel is opgetreden na verlaging of stopzetting van ciclosporine en 1) toediening van streptokinase en heparine of 2) plasmaferese, lijkt dit af te hangen van vroege detectie met met Indium 111 gelabelde bloedplaatjesscans (zie ONGEWENSTE REACTIES ).
Hyperkaliëmie
Significante hyperkaliëmie (soms geassocieerd met hyperchloremische metabole acidose) en hyperurikemie zijn af en toe waargenomen bij individuele patiënten.
Hepatotoxiciteit
Gevallen van hepatotoxiciteit en leverbeschadiging, waaronder cholestase, geelzucht, hepatitis en leverfalen, zijn gemeld bij patiënten die met ciclosporine werden behandeld. De meeste meldingen omvatten patiënten met significante comorbiditeiten, onderliggende aandoeningen en andere verstorende factoren, waaronder infectieuze complicaties en comedicaties met hepatotoxisch potentieel. In sommige gevallen, voornamelijk bij transplantatiepatiënten, zijn fatale uitkomsten gemeld (zie: ONGEWENSTE REACTIES , Postmarketingervaring, nier-, lever- en harttransplantatie ).
Levertoxiciteit, die zich gewoonlijk manifesteert door verhogingen van leverenzymen en bilirubine, werd gemeld bij patiënten die met ciclosporine werden behandeld in klinische onderzoeken: 4% bij niertransplantatie, 7% bij harttransplantatie en 4% bij levertransplantatie. Dit werd meestal opgemerkt tijdens de eerste maand van de behandeling wanneer hoge doses ciclosporine werden gebruikt. De chemieverhogingen namen gewoonlijk af met een verlaging van de dosering.
maligniteiten
Net als bij patiënten die andere immunosuppressiva krijgen, lopen die patiënten die ciclosporine krijgen een verhoogd risico op de ontwikkeling van lymfomen en andere maligniteiten, met name die van de huid. Patiënten die ciclosporine gebruiken, moeten worden gewaarschuwd om overmatige blootstelling aan ultraviolet licht te vermijden. Het verhoogde risico lijkt eerder verband te houden met de intensiteit en duur van immunosuppressie dan met het gebruik van specifieke middelen. Vanwege het gevaar van oversuppressie van het immuunsysteem, resulterend in een verhoogd risico op infectie of maligniteit, moet voorzichtigheid worden betracht bij een behandelingsschema dat meerdere immunosuppressiva bevat. Sommige maligniteiten kunnen dodelijk zijn. Transplantatiepatiënten die ciclosporine krijgen, lopen een verhoogd risico op een ernstige infectie met fatale afloop.
Ernstige infecties
Patiënten die immunosuppressiva krijgen, waaronder Neoral 100 mg, lopen een verhoogd risico op het ontwikkelen van bacteriële, virale, schimmel- en protozoaire infecties, waaronder opportunistische infecties. Deze infecties kunnen leiden tot ernstige, waaronder fatale, gevolgen (zie: GEVAARLIJKE WAARSCHUWING: , en ONGEWENSTE REACTIES ).
Polyoma-virusinfecties
Patiënten die immunosuppressiva krijgen, waaronder Neoral 100 mg, lopen een verhoogd risico op opportunistische infecties, waaronder polyomavirusinfecties. Polyomavirusinfecties bij transplantatiepatiënten kunnen ernstige en soms fatale gevolgen hebben. Deze omvatten gevallen van JC-virus-geassocieerde progressieve multifocale leuko-encefalopathie (PML) en polyomavirus-geassocieerde nefropathie (PVAN), vooral als gevolg van BK-virusinfectie, die zijn waargenomen bij patiënten die ciclosporine kregen. PVAN wordt in verband gebracht met ernstige gevolgen, waaronder verslechtering van de nierfunctie en verlies van niertransplantaten (zie: ONGEWENSTE REACTIES , Postmarketingervaring, nier-, lever- en harttransplantatie ). Patiëntmonitoring kan helpen bij het opsporen van patiënten die risico lopen op PVAN.
Er zijn gevallen van PML gemeld bij patiënten die met Neoral werden behandeld. PML, dat soms fataal is, presenteert zich vaak met hemiparese, apathie, verwardheid, cognitieve deficiënties en ataxie. Risicofactoren voor PML zijn onder meer behandeling met immunosuppressieve therapieën en verslechtering van de immuunfunctie. Bij patiënten met immunosuppressie dienen artsen PML in overweging te nemen in de differentiële diagnose bij patiënten die neurologische symptomen melden en dient overleg met een neuroloog te worden overwogen als klinisch geïndiceerd.
Bij transplantatiepatiënten die PML of PVAN ontwikkelen, moet worden overwogen de totale immunosuppressie te verminderen. Een verminderde immunosuppressie kan het transplantaat echter in gevaar brengen.
Neurotoxiciteit
Er zijn meldingen geweest van convulsies bij volwassen en pediatrische patiënten die ciclosporine kregen, vooral in combinatie met een hoge dosis methylprednisolon.
Encefalopathie, waaronder posterieur reversibel encefalopathiesyndroom (PRES), is zowel in postmarketingrapporten als in de literatuur beschreven. Manifestaties zijn onder meer verminderd bewustzijn, convulsies, visuele stoornissen (inclusief blindheid), verlies van motorische functie, bewegingsstoornissen en psychiatrische stoornissen. In veel gevallen zijn veranderingen in de witte stof gedetecteerd met behulp van beeldvormingstechnieken en pathologische monsters. Predisponerende factoren, zoals hypertensie, hypomagnesiëmie, hypocholesterolemie, hoge doses corticosteroïden, hoge ciclosporine-bloedconcentraties en graft-versus-host-ziekte, zijn in veel, maar niet in alle gemelde gevallen opgemerkt. De veranderingen waren in de meeste gevallen reversibel na stopzetting van ciclosporine, en in sommige gevallen werd verbetering waargenomen na verlaging van de dosis. Het lijkt erop dat patiënten die een levertransplantatie ondergaan, gevoeliger zijn voor encefalopathie dan degenen die een niertransplantatie ondergaan. Een andere zeldzame manifestatie van door ciclosporine geïnduceerde neurotoxiciteit, die vaker voorkomt bij transplantatiepatiënten dan bij andere indicaties, is oedeem van de optische schijf, inclusief papiloedeem, met mogelijke visuele stoornis, secundair aan goedaardige intracraniële hypertensie.
Voorzichtigheid is geboden bij het gebruik van ciclosporine met nefrotoxische geneesmiddelen (zie: PREVENTIEVE MAATREGELEN ).
Reumatoïde artritis
Cyclosporine-nefropathie werd gedetecteerd in nierbiopten van 6 van de 60 (10%) patiënten met reumatoïde artritis na een gemiddelde behandelingsduur van 19 maanden. Slechts één patiënt, van deze 6 patiënten, werd behandeld met een dosis ≤ 4 mg/kg/dag. Serumcreatinine verbeterde bij op één na alle patiënten na stopzetting van ciclosporine. De "maximale toename van creatinine" lijkt een factor te zijn bij het voorspellen van ciclosporine-nefropathie.
Net als bij andere immunosuppressiva is er een kans op een toename van het optreden van maligne lymfomen met ciclosporine. Het is niet duidelijk of het risico met ciclosporine groter is dan dat bij patiënten met reumatoïde artritis of bij patiënten met reumatoïde artritis die voor deze indicatie een cytotoxische behandeling ondergaan. Er werden vijf gevallen van lymfoom gedetecteerd: vier in een onderzoek onder ongeveer 2.300 patiënten die werden behandeld met ciclosporine voor reumatoïde artritis, en een ander geval van lymfoom werd gemeld in een klinische studie. Hoewel andere tumoren (12 huidkankers, 24 solide tumoren van verschillende typen en 1 multipel myeloom) ook in dit onderzoek werden gemeld, ondersteunden epidemiologische analyses geen ander verband met cyclosporine dan voor kwaadaardige lymfomen.
Patiënten moeten vóór en tijdens de behandeling met Neoral 25 mg grondig worden onderzocht op de ontwikkeling van maligniteiten. Bovendien kan het gebruik van Neoral 25 mg-therapie met andere immunosuppressiva een overmatige immunosuppressie veroorzaken waarvan bekend is dat deze het risico op maligniteit verhoogt.
Psoriasis
(Zie ook OMKADERDE WAARSCHUWING voor Psoriasis )
Aangezien ciclosporine een krachtig immunosuppressivum is met een aantal potentieel ernstige bijwerkingen, moeten de risico's en voordelen van het gebruik van Neoral 100 mg worden overwogen vóór de behandeling van patiënten met psoriasis. Cyclosporine, het werkzame bestanddeel van Neoral, kan nefrotoxiciteit en hypertensie veroorzaken (zie: PREVENTIEVE MAATREGELEN ) en het risico neemt toe met toenemende dosis en duur van de therapie. Patiënten met een verhoogd risico, zoals patiënten met een abnormale nierfunctie, ongecontroleerde hypertensie of maligniteiten, mogen Neoral niet krijgen.
Nierdisfunctie is een mogelijk gevolg van Neoral, daarom moet de nierfunctie tijdens de behandeling worden gecontroleerd.
Patiënten die Neoral 100 mg krijgen, moeten het serumcreatinine regelmatig controleren (zie: Speciale bewaking onder DOSERING EN ADMINISTRATIE ). Oudere patiënten moeten met bijzondere zorg worden gecontroleerd, aangezien een afname van de nierfunctie ook optreedt met de leeftijd. Als patiënten niet goed worden gecontroleerd en de doseringen niet goed worden aangepast, kan behandeling met ciclosporine structurele nierbeschadiging en aanhoudende nierdisfunctie veroorzaken.
Een verhoging van serumcreatinine en BUN kan optreden tijdens behandeling met Neoral 25 mg en weerspiegelt een verlaging van de glomerulaire filtratiesnelheid.
Nierbiopten van 86 psoriasispatiënten die gedurende een gemiddelde duur van 23 maanden met 1,2 tot 7,6 mg/kg/dag ciclosporine werden behandeld, toonden bewijs van ciclosporine-nefropathie bij 18/86 (21%) van de patiënten. De pathologie bestond uit renale tubulaire atrofie en interstitiële fibrose. Bij herhaalde biopsie van 13 van deze patiënten die gemiddeld nog 2 jaar op verschillende doseringen ciclosporine werden gehouden, steeg het aantal met ciclosporine-geïnduceerde nefropathie tot 26/86 (30%). De meerderheid van de patiënten (19/26) kreeg een dosis van ≥ 5,0 mg/kg/dag (de hoogste aanbevolen dosis is 4 mg/kg/dag). De patiënten kregen ook langer dan 15 maanden (18/26) ciclosporine en/of hadden een klinisch significante stijging van het serumcreatinine gedurende meer dan 1 maand (21/26). De creatininespiegels keerden terug naar het normale bereik bij 7 van de 11 patiënten bij wie de behandeling met ciclosporine werd stopgezet.
Er is een verhoogd risico op de ontwikkeling van huid- en lymfoproliferatieve maligniteiten bij met ciclosporine behandelde psoriasispatiënten. Het relatieve risico op maligniteiten is vergelijkbaar met dat waargenomen bij psoriasispatiënten die met andere immunosuppressiva worden behandeld.
Tumoren werden gemeld bij 32 (2,2%) van de 1439 psoriasispatiënten die wereldwijd werden behandeld met ciclosporine uit klinische onderzoeken. Bij 7 patiënten zijn postmarketingervaringen met ciclosporine gemeld. Bij 16 (1,1%) van deze patiënten werden huidmaligniteiten gemeld; op 2 na hadden ze allemaal eerder PUVA-therapie gekregen. Methotrexaat werd door 7 patiënten ontvangen.
UVB en koolteer waren gebruikt door respectievelijk 2 en 3 patiënten. Zeven patiënten hadden een voorgeschiedenis van huidkanker of een potentieel predisponerende laesie was aanwezig voorafgaand aan blootstelling aan ciclosporine. Van de 16 patiënten met huidkanker hadden 11 patiënten 18 plaveiselcelcarcinomen en 7 patiënten 10 basaalcelcarcinomen.
Er waren twee lymfoproliferatieve maligniteiten; één geval van non-Hodgkin-lymfoom waarvoor chemotherapie nodig was, en één geval van mycosis fungoides die spontaan achteruitgingen na stopzetting van ciclosporine. Er waren vier gevallen van goedaardige lymfocytische infiltratie: 3 gingen spontaan achteruit na stopzetting van ciclosporine, terwijl de vierde achteruitging ondanks voortzetting van het geneesmiddel. Bij de rest van de maligniteiten, 13 gevallen (0,9%), waren verschillende organen betrokken.
Patiënten mogen niet gelijktijdig worden behandeld met ciclosporine en PUVA of UVB, andere bestralingstherapie of andere immunosuppressiva, vanwege de mogelijkheid van overmatige immunosuppressie en het daaruit voortvloeiende risico op maligniteiten (zien CONTRA-INDICATIES ). Patiënten moeten ook worden gewaarschuwd om zichzelf adequaat te beschermen in de zon en om overmatige blootstelling aan de zon te vermijden. Patiënten dienen voor en tijdens de behandeling grondig te worden onderzocht op de aanwezigheid van maligniteiten, waarbij bedacht moet worden dat kwaadaardige laesies verborgen kunnen worden door psoriatische plaques. Bij huidlaesies die niet typisch zijn voor psoriasis, moet een biopsie worden genomen voordat de behandeling wordt gestart. Patiënten mogen alleen met Neoral worden behandeld nadat verdachte laesies volledig zijn verdwenen en alleen als er geen andere behandelingsopties zijn (zie: Speciale monitoring voor psoriasispatiënten ).
Speciale hulpstoffen
Alcohol (ethanol)
Het alcoholgehalte (zie OMSCHRIJVING Neoral 100 mg dient in acht te worden genomen wanneer het wordt gegeven aan patiënten bij wie alcoholgebruik moet worden vermeden of geminimaliseerd, bijv. zwangere vrouwen of vrouwen die borstvoeding geven, bij patiënten met leverziekte of epilepsie, bij alcoholische patiënten of pediatrische patiënten. Voor een volwassene die 70 kg weegt, zou de maximale dagelijkse orale dosis ongeveer 1 gram alcohol opleveren, wat ongeveer 6% is van de hoeveelheid alcohol in een standaarddrank.
PREVENTIEVE MAATREGELEN
Algemeen
Hypertensie
Cyclosporine is het actieve bestanddeel van Neoral. Hypertensie is een vaak voorkomende bijwerking van ciclosporinetherapie die kan aanhouden (zie: ONGEWENSTE REACTIES en DOSERING EN ADMINISTRATIE voor monitoringaanbevelingen). Milde of matige hypertensie komt vaker voor dan ernstige hypertensie en de incidentie neemt in de loop van de tijd af. Bij ontvangers van nier-, lever- en harttransplantaten die met ciclosporine worden behandeld, kan antihypertensieve therapie nodig zijn (zie Speciale monitoring van reumatoïde artritis en Psoriasispatiënten ). Omdat ciclosporine hyperkaliëmie kan veroorzaken, mogen kaliumsparende diuretica echter niet worden gebruikt. Hoewel calciumantagonisten effectieve middelen kunnen zijn bij de behandeling van ciclosporine-geassocieerde hypertensie, kunnen ze interfereren met het ciclosporinemetabolisme (zie DRUG-INTERACTIES ).
Vaccinatie
Tijdens de behandeling met ciclosporine kan vaccinatie minder effectief zijn; en het gebruik van levende verzwakte vaccins moet worden vermeden.
Speciale monitoring van patiënten met reumatoïde artritis
Voordat de behandeling wordt gestart, moet een zorgvuldig lichamelijk onderzoek worden uitgevoerd, inclusief bloeddrukmetingen (ten minste twee keer) en twee creatininespiegels om de uitgangswaarde te schatten. Bloeddruk en serumcreatinine moeten gedurende de eerste 3 maanden elke 2 weken worden geëvalueerd en daarna maandelijks als de patiënt stabiel is. Het is raadzaam om het serumcreatinine en de bloeddruk altijd te controleren na een verhoging van de dosis niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's) en na het starten van een nieuwe NSAID-therapie tijdens de behandeling met Neoral 25 mg. Indien gelijktijdig toegediend met methotrexaat, worden CBC- en leverfunctietests aanbevolen om maandelijks te worden gecontroleerd (zie: PREVENTIEVE MAATREGELEN , Algemeen, Hypertensie ).
Bij patiënten die ciclosporine krijgen, moet de dosis Neoral met 25% tot 50% worden verlaagd als hypertensie optreedt. Als hypertensie aanhoudt, moet de dosis Neoral 100 mg verder worden verlaagd of moet de bloeddruk onder controle worden gehouden met antihypertensiva. In de meeste gevallen keerde de bloeddruk terug naar de uitgangswaarde toen ciclosporine werd stopgezet.
In placebogecontroleerde onderzoeken bij patiënten met reumatoïde artritis kwamen systolische hypertensie (gedefinieerd als het optreden van twee systolische bloeddrukmetingen > 140 mmHg) en diastolische hypertensie (gedefinieerd als twee diastolische bloeddrukmetingen > 90 mmHg) voor bij 33% en 19% van de patiënten die respectievelijk met ciclosporine werden behandeld. De overeenkomstige placebopercentages waren 22% en 8%.
Speciale monitoring voor psoriasispatiënten
Alvorens met de behandeling te beginnen, moet een zorgvuldig dermatologisch en lichamelijk onderzoek, inclusief bloeddrukmetingen (ten minste twee keer) worden uitgevoerd. Aangezien Neoral een immunosuppressivum is, moeten patiënten worden onderzocht op de aanwezigheid van een occulte infectie bij hun eerste lichamelijk onderzoek en op de aanwezigheid van tumoren in het begin en tijdens de behandeling met Neoral. Bij huidlaesies die niet typisch zijn voor psoriasis, moet een biopsie worden genomen voordat met Neoral wordt gestart. Patiënten met maligne of premaligne huidveranderingen mogen alleen met Neoral 100 mg worden behandeld na een passende behandeling van dergelijke laesies en als er geen andere behandelingsoptie bestaat.
Baseline-laboratoria moeten serumcreatinine (bij twee gelegenheden), BUN, CBC, serummagnesium, kalium, urinezuur en lipiden bevatten.
Het risico op ciclosporine-nefropathie wordt verminderd wanneer de aanvangsdosis laag is (2,5 mg/kg/dag), de maximale dosis niet hoger is dan 4,0 mg/kg/dag, het serumcreatinine regelmatig wordt gecontroleerd terwijl ciclosporine wordt toegediend, en de dosis Neoral 25 mg wordt verlaagd wanneer de stijging van het creatinine groter is dan of gelijk is aan 25% boven het niveau van vóór de behandeling van de patiënt. De toename van creatinine is over het algemeen reversibel na tijdige verlaging van de dosis Neoral of stopzetting ervan.
Serumcreatinine en BUN moeten elke 2 weken worden geëvalueerd tijdens de eerste 3 maanden van de behandeling en daarna maandelijks als de patiënt stabiel is. Als het serumcreatinine meer dan of gelijk aan 25% boven het niveau van voor de behandeling van de patiënt ligt, moet het serumcreatinine binnen twee weken worden herhaald. Als de verandering in serumcreatinine groter dan of gelijk aan 25% boven de uitgangswaarde blijft, moet Neoral 25 mg met 25% tot 50% worden verlaagd. Ik dik elk moment het serumcreatinine stijgt met meer dan of gelijk aan 50% boven het niveau van vóór de behandeling, Neoral 25 mg moet met 25% tot 50% worden verlaagd. Neoral moet worden stopgezet als reversibiliteit (binnen 25% van de uitgangswaarde) van serumcreatinine niet haalbaar is na twee dosisaanpassingen. Het is raadzaam om het serumcreatinine te controleren na een verhoging van de dosis niet-steroïde anti-inflammatoire geneesmiddelen en na het starten van een nieuwe niet-steroïde anti-inflammatoire therapie tijdens de behandeling met Neoral 25 mg.
De bloeddruk moet elke 2 weken worden geëvalueerd tijdens de eerste 3 maanden van de behandeling en daarna maandelijks als de patiënt stabiel is, of vaker wanneer de dosering wordt aangepast. Bij patiënten zonder een voorgeschiedenis van eerdere hypertensie vóór aanvang van de behandeling met Neoral, moet het geneesmiddel met 25% tot 50% worden verlaagd als blijkt dat ze aanhoudende hypertensie hebben. Als de patiënt hypertensief blijft ondanks meerdere verlagingen van Neoral 25 mg, moet de behandeling met Neoral worden stopgezet. Voor patiënten met behandelde hypertensie, moet hun medicatie worden aangepast om hypertensie onder controle te houden voordat met de behandeling met Neoral 100 mg wordt begonnen. Neoral 100 mg moet worden stopgezet als een verandering in de behandeling van hypertensie niet effectief of verdraagbaar is.
CBC, urinezuur, kalium, lipiden en magnesium moeten ook elke 2 weken worden gecontroleerd gedurende de eerste 3 maanden van de behandeling en daarna maandelijks als de patiënt stabiel is of vaker wanneer de dosering wordt aangepast. De dosering van Neoral 25 mg moet met 25% tot 50% worden verlaagd voor elke afwijking die klinisch zorgwekkend is.
In gecontroleerde onderzoeken met ciclosporine bij psoriasispatiënten correleerden de bloedconcentraties van ciclosporine niet goed met verbetering of met bijwerkingen zoals nierdisfunctie.
Laboratorium testen
Bij alle patiënten die met ciclosporine worden behandeld, moeten de nier- en leverfuncties herhaaldelijk worden beoordeeld door meting van serumcreatinine, BUN, serumbilirubine en leverenzymen. Serumlipiden, magnesium en kalium moeten ook worden gecontroleerd.
De bloedconcentraties van ciclosporine moeten routinematig worden gecontroleerd bij transplantatiepatiënten (zie: DOSERING EN ADMINISTRATIE , Bloedconcentratiebewaking bij transplantatiepatiënten ), en periodiek gecontroleerd bij patiënten met reumatoïde artritis.
Carcinogenese, mutagenese en verminderde vruchtbaarheid
Carcinogeniteitsonderzoeken werden uitgevoerd bij mannelijke en vrouwelijke ratten en muizen. In de 78 weken durende muisstudie werd bewijs gevonden voor een statistisch significante trend voor lymfatische lymfomen bij vrouwen, en de incidentie van hepatocellulaire carcinomen bij mannetjes met een gemiddelde dosis was significant hoger dan de controlewaarde. In het 24-maanden durende onderzoek bij ratten overschreden adenomen van eilandjescellen in de pancreas significant de controlesnelheid bij het lage dosisniveau. De doses die in de onderzoeken met muizen en ratten werden gebruikt, waren 0,01 tot 0,16 maal de klinische onderhoudsdosis (6 mg/kg). De hepatocellulaire carcinomen en adenomen van de eilandjes van de pancreas waren niet dosisgerelateerd. Gepubliceerde rapporten geven aan dat gelijktijdige behandeling van haarloze muizen met UV-bestraling en cyclosporine of andere immunosuppressiva de tijd tot huidtumorvorming verkort in vergelijking met alleen UV-bestraling.
Cyclosporine was niet mutageen in geschikte testsystemen. Ciclosporine is niet mutageen/genotoxisch gebleken in de Ames-test, de V79-HGPRT-test, de micronucleustest bij muizen en Chinese hamsters, de chromosoomafwijkingstests in het beenmerg van de Chinese hamster, de muis dominante letale test en de DNA-reparatietest in sperma van behandelde muizen. Een recente studie waarin de inductie van de uitwisseling van zusterchromatiden (SCE) door cyclosporine met behulp van menselijke lymfocyten in vitro werd geanalyseerd, gaf een indicatie van een positief effect (dwz inductie van SCE), bij hoge concentraties in dit systeem. In twee gepubliceerde onderzoeken toonden konijnen die in utero (10 mg/kg/dag subcutaan) werden blootgesteld aan ciclosporine een verminderd aantal nefronen, nierhypertrofie, systemische hypertensie en progressieve nierinsufficiëntie tot een leeftijd van 35 weken. Zwangere ratten die 12 mg/kg/dag cyclosporine intraveneus kregen (tweemaal de aanbevolen intraveneuze dosis voor de mens) hadden foetussen met een verhoogde incidentie van ventrikelseptumdefect. Deze bevindingen zijn niet aangetoond bij andere soorten en hun relevantie voor de mens is niet bekend.
In onderzoeken bij mannelijke en vrouwelijke ratten werd geen verslechtering van de vruchtbaarheid aangetoond.
Wijdverspreide papillomatose van de huid werd waargenomen na chronische behandeling van honden met ciclosporine met 9 maal de initiële behandelingsdosis voor psoriasis bij mensen van 2,5 mg/kg, waarbij de doses worden uitgedrukt op basis van het lichaamsoppervlak. Deze papillomatose vertoonde een spontane regressie na stopzetting van ciclosporine.
Een verhoogde incidentie van maligniteiten is een erkende complicatie van immunosuppressie bij ontvangers van orgaantransplantaties en patiënten met reumatoïde artritis en psoriasis. De meest voorkomende vormen van neoplasmata zijn non-Hodgkin-lymfoom en huidcarcinomen. Het risico op maligniteiten bij ontvangers van ciclosporine is hoger dan bij de normale, gezonde populatie, maar vergelijkbaar met dat bij patiënten die andere immunosuppressieve therapieën krijgen. Vermindering of stopzetting van immunosuppressie kan ertoe leiden dat de laesies achteruitgaan.
Bij psoriasispatiënten die ciclosporine gebruiken, is de ontwikkeling van maligniteiten, vooral die van de huid, gemeld (zie: WAARSCHUWINGEN ). Bij huidlaesies die niet typisch zijn voor psoriasis, moet een biopsie worden genomen voordat de behandeling met ciclosporine wordt gestart. Patiënten met maligne of premaligne veranderingen van de huid mogen alleen met ciclosporine worden behandeld na een passende behandeling van dergelijke laesies en als er geen andere behandelingsoptie bestaat.
Zwangerschap
Dierstudies hebben reproductietoxiciteit aangetoond bij ratten en konijnen. Cyclosporine gaf geen aanwijzingen voor mutagene of teratogene effecten in de standaard testsystemen met orale toediening (ratten tot 17 mg/kg en konijnen tot 30 mg/kg per dag oraal). Alleen bij doseringen die toxisch waren voor moederdieren, werden nadelige effecten waargenomen in reproductiestudies bij ratten. Van ciclosporine is aangetoond dat het embryo- en foetotoxisch is bij ratten en konijnen na orale toediening in maternaal toxische doses. Foetale toxiciteit werd waargenomen bij ratten bij 0,8 en konijnen bij 5,4 maal de transplantatiedoses bij mensen van 6,0 mg/kg, waarbij dosiscorrecties gebaseerd zijn op het lichaamsoppervlak. Ciclosporine was embryo- en foetotoxisch, zoals blijkt uit een verhoogde pre- en postnatale mortaliteit en een verminderd foetaal gewicht in combinatie met gerelateerde skeletvertraging.
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Daarom mag Neoral niet tijdens de zwangerschap worden gebruikt, tenzij het mogelijke voordeel voor de moeder het mogelijke risico voor de foetus rechtvaardigt.
Bij zwangere transplantatiepatiënten die worden behandeld met immunosuppressiva is het risico op vroeggeboorte verhoogd. De volgende gegevens vertegenwoordigen de gerapporteerde uitkomsten van 116 zwangerschappen bij vrouwen die ciclosporine kregen tijdens de zwangerschap, van wie 90% transplantatiepatiënten waren en van wie de meesten ciclosporine kregen gedurende de gehele zwangerschapsperiode. De enige consistente patronen van afwijkingen waren vroeggeboorte (draagtijd van 28 tot 36 weken) en een laag geboortegewicht voor de zwangerschapsduur. Zestien foetale verliezen kwamen voor. De meeste zwangerschappen (85 van de 100) werden gecompliceerd door aandoeningen; waaronder pre-eclampsie, eclampsie, vroegtijdige bevalling, abruptio placentae, oligohydramnion, Rh-incompatibiliteit en foetoplacentale disfunctie. Vroegtijdige bevalling vond plaats bij 47%. Zeven misvormingen werden gemeld bij 5 levensvatbare zuigelingen en in 2 gevallen van foetaal verlies. Achtentwintig procent van de baby's was klein voor de zwangerschapsduur. Neonatale complicaties traden op bij 27%. Daarom moeten de risico's en voordelen van het gebruik van Neoral tijdens de zwangerschap zorgvuldig worden afgewogen.
Er is een beperkt aantal waarnemingen beschikbaar bij kinderen die in utero aan ciclosporine zijn blootgesteld, tot een leeftijd van ongeveer 7 jaar. De nierfunctie en bloeddruk bij deze kinderen waren normaal.
Vanwege de mogelijke verstoring van de maternale-foetale interactie, moet de risico-batenverhouding van het gebruik van Neoral bij psoriasispatiënten tijdens de zwangerschap zorgvuldig worden afgewogen met ernstige overweging voor stopzetting van Neoral.
Bij zwangere vrouwen moet ook rekening worden gehouden met het alcoholgehalte van de Neoral-formuleringen van 100 mg (zie: WAARSCHUWINGEN , Speciale hulpstoffen ).
Moeders die borstvoeding geven
Cyclosporine is aanwezig in moedermelk. Vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding krijgen van Neoral 100 mg, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder. Neoral bevat ethanol. Ethanol zal in moedermelk aanwezig zijn in niveaus die vergelijkbaar zijn met die gevonden in maternale serum en indien aanwezig in moedermelk zal oraal worden geabsorbeerd door een zuigeling (zie WAARSCHUWINGEN ).
Pediatrisch gebruik
Hoewel er geen adequate en goed gecontroleerde onderzoeken zijn uitgevoerd bij kinderen, hebben ontvangers van een transplantaat vanaf de leeftijd van één jaar Neoral gekregen zonder ongebruikelijke bijwerkingen. De veiligheid en werkzaamheid van behandeling met Neoral bij kinderen met juveniele reumatoïde artritis of psoriasis onder de 18 jaar zijn niet vastgesteld.
Geriatrisch gebruik
In klinische onderzoeken naar reumatoïde artritis met ciclosporine was 17,5% van de patiënten 65 jaar of ouder. Deze patiënten hadden meer kans op het ontwikkelen van systolische hypertensie tijdens de behandeling en hadden meer kans op een stijging van het serumcreatinine ≥ 50% boven de uitgangswaarde na 3 tot 4 maanden therapie.
Klinische onderzoeken met Neoral 100 mg bij transplantatie- en psoriasispatiënten omvatten niet een voldoende aantal proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
OVERDOSERING
Er is een minimale ervaring met overdosering met ciclosporine. Gedwongen braken en maagspoeling kunnen tot 2 uur na toediening van Neoral zinvol zijn. Voorbijgaande hepatotoxiciteit en nefrotoxiciteit kunnen optreden, die zouden moeten verdwijnen na stopzetting van het geneesmiddel. Orale doses ciclosporine tot 10 g (ongeveer 150 mg/kg) werden verdragen met relatief kleine klinische gevolgen, zoals braken, slaperigheid, hoofdpijn, tachycardie en, bij enkele patiënten, matig ernstige, omkeerbare nierfunctiestoornis. Ernstige symptomen van intoxicatie zijn echter gemeld na accidentele parenterale overdosering met ciclosporine bij premature pasgeborenen. In alle gevallen van overdosering dienen algemene ondersteunende maatregelen en symptomatische behandeling te worden gevolgd. Cyclosporine is niet in hoge mate dialyseerbaar en wordt ook niet goed geklaard door houtskoolhemoperfusie. De orale dosering waarbij naar schatting de helft van de proefdieren sterft, is 31 keer, 39 keer en > 54 keer de menselijke onderhoudsdosis voor transplantatiepatiënten (6 mg/kg; correcties op basis van lichaamsoppervlak) bij muizen, ratten en konijnen .
CONTRA-INDICATIES
Algemeen
Neoral 100 mg is gecontra-indiceerd bij patiënten met een overgevoeligheid voor ciclosporine of voor een van de bestanddelen van de formulering.
Reumatoïde artritis
Patiënten met reumatoïde artritis met een abnormale nierfunctie, ongecontroleerde hypertensie of maligniteiten mogen Neoral niet krijgen.
Psoriasis
Psoriasispatiënten die worden behandeld met Neoral 100 mg mogen geen gelijktijdige PUVA- of UVB-therapie, methotrexaat of andere immunosuppressiva, koolteer of bestralingstherapie krijgen. Psoriasispatiënten met een abnormale nierfunctie, ongecontroleerde hypertensie of maligniteiten mogen Neoral niet krijgen.
KLINISCHE FARMACOLOGIE
Cyclosporine is een krachtig immunosuppressivum dat bij dieren de overleving van allogene transplantaties waarbij huid, nier, lever, hart, pancreas, beenmerg, dunne darm en long betrokken zijn, verlengt. Van ciclosporine is aangetoond dat het enige humorale immuniteit onderdrukt en in grotere mate celgemedieerde immuunreacties zoals transplantaatafstoting, vertraagde overgevoeligheid, experimentele allergische encefalomyelitis, Freund's adjuvante artritis en graft-versus-hostziekte bij veel diersoorten voor een verscheidenheid aan organen .
De effectiviteit van ciclosporine is het resultaat van specifieke en omkeerbare remming van immunocompetente lymfocyten in de G0- en G1-fase van de celcyclus. T-lymfocyten worden bij voorkeur geremd. De T-helpercel is het belangrijkste doelwit, hoewel de Tsuppressor-cel ook onderdrukt kan worden. Cyclosporine remt ook de productie en afgifte van lymfokines, waaronder interleukine-2.
Bij dieren zijn geen effecten op de fagocytische functie (veranderingen in enzymsecretie, chemotactische migratie van granulocyten, macrofaagmigratie, koolstofklaring in vivo) waargenomen. Cyclosporine veroorzaakt geen beenmergsuppressie in diermodellen of de mens.
Farmacokinetiek
De immunosuppressieve activiteit van cyclosporine is voornamelijk te wijten aan het oorspronkelijke geneesmiddel. Na orale toediening is de absorptie van ciclosporine onvolledig. De mate van absorptie van ciclosporine is afhankelijk van de individuele patiënt, de patiëntenpopulatie en de formulering. Eliminatie van ciclosporine vindt voornamelijk via de gal plaats, waarbij slechts 6% van de dosis (oudergeneesmiddel en metabolieten) in de urine wordt uitgescheiden. De dispositie van ciclosporine uit het bloed is over het algemeen bifasisch, met een terminale halfwaardetijd van ongeveer 8,4 uur (bereik 5 tot 18 uur). Na intraveneuze toediening is de bloedklaring van ciclosporine (assay: HPLC) ongeveer 5 tot 7 ml/min/kg bij volwassen ontvangers van nier- of levertransplantaten. De klaring van ciclosporine in het bloed lijkt iets langzamer te zijn bij harttransplantatiepatiënten.
De Neoral Soft Gelatine Capsules (cyclosporine capsules, USP) GEMODIFICEERD en Neoral Oral Solution (ciclosporine orale oplossing, USP) GEMODIFICEERD zijn bio-equivalent. Neoral 25 mg drank verdund met sinaasappelsap of appelsap is biologisch gelijkwaardig aan Neoral drank verdund met water. Het effect van melk op de biologische beschikbaarheid van ciclosporine bij toediening als Neoral drank is niet onderzocht.
De relatie tussen toegediende dosis en blootstelling (gebied onder de concentratie-versus-tijdcurve, AUC) is lineair binnen het therapeutische dosisbereik. De interindividuele variabiliteit (totaal, %CV) van blootstelling aan ciclosporine (AUC) bij toediening van Neoral of Sandimmune varieert van ongeveer 20% tot 50% bij niertransplantatiepatiënten. Deze interindividuele variabiliteit draagt bij aan de noodzaak van individualisering van het doseringsregime voor optimale therapie (zie: DOSERING EN ADMINISTRATIE ).
De intra-individuele variabiliteit van de AUC bij ontvangers van een niertransplantatie (%CV) was 9% tot 21% voor Neoral en 19% tot 26% voor Sandimmune. In dezelfde onderzoeken was de intra-individuele variabiliteit van dalconcentraties (%CV) 17% tot 30% voor Neoral en 16% tot 38% voor Sandimmune.
Absorptie
Neoral heeft een verhoogde biologische beschikbaarheid in vergelijking met Sandimmune. De absolute biologische beschikbaarheid van ciclosporine toegediend als Sandimmune is afhankelijk van de patiëntenpopulatie, geschat op minder dan 10% bij levertransplantatiepatiënten en tot 89% bij sommige niertransplantatiepatiënten. De absolute biologische beschikbaarheid van ciclosporine toegediend als Neoral is niet vastgesteld bij volwassenen. In onderzoeken met niertransplantatiepatiënten, patiënten met reumatoïde artritis en psoriasis was de gemiddelde AUC van ciclosporine ongeveer 20% tot 50% hoger en was de piekconcentratie van ciclosporine in het bloed ongeveer 40% tot 106% hoger na toediening van Neoral 100 mg vergeleken met na toediening van Sandimmune. . De dosisgenormaliseerde AUC bij de novo levertransplantatiepatiënten die Neoral 28 dagen na transplantatie toegediend kregen, was 50% hoger en de Cmax was 90% hoger dan bij die patiënten die Sandimmune kregen. De AUC en Cmax zijn ook verhoogd (Neoral ten opzichte van Sandimmune) bij harttransplantatiepatiënten, maar de gegevens zijn zeer beperkt. Hoewel de AUC- en Cmax-waarden hoger zijn bij Neoral 100 mg dan bij Sandimmune, zijn de predosisdalconcentraties (dosis-genormaliseerd) vergelijkbaar voor de twee formuleringen.
Na orale toediening van Neoral varieerde de tijd tot piekconcentraties van ciclosporine in het bloed (Tmax) van 1,5 tot 2,0 uur. De toediening van voedsel met Neoral 25 mg verlaagt de AUC en Cmax van ciclosporine. Een vetrijke maaltijd (669 kcal, 45 gram vet) die binnen een half uur vóór toediening van Neoral 25 mg werd ingenomen, verminderde de AUC met 13% en de Cmax met 33%. De effecten van een vetarme maaltijd (667 kcal, 15 gram vet) waren vergelijkbaar.
Het effect van T-buisomleiding van gal op de absorptie van ciclosporine uit Neoral 25 mg werd onderzocht bij elf de novo levertransplantatiepatiënten. Toen de patiënten Neoral kregen toegediend met en zonder T-buisomleiding van gal, werd zeer weinig verschil in absorptie waargenomen, zoals gemeten aan de hand van de verandering in maximale ciclosporine-bloedconcentraties ten opzichte van pre-dosiswaarden met de T-buis gesloten ten opzichte van toen het was open: 6,9 ± 41% (bereik 55% tot 68%).
PatiëntenpopulatieVerdeling
Cyclosporine wordt grotendeels buiten het bloedvolume gedistribueerd. Het steady-state distributievolume tijdens intraveneuze toediening is gemeld als 3 tot 5 l/kg bij ontvangers van een orgaantransplantaat. In bloed is de verdeling concentratieafhankelijk. Ongeveer 33% tot 47% bevindt zich in plasma, 4% tot 9% in lymfocyten, 5% tot 12% in granulocyten en 41% tot 58% in erytrocyten. Bij hoge concentraties raakt het bindingsvermogen van leukocyten en erytrocyten verzadigd. In plasma is ongeveer 90% gebonden aan eiwitten, voornamelijk lipoproteïnen. Cyclosporine wordt uitgescheiden in de moedermelk (zie: PREVENTIEVE MAATREGELEN , Moeders die borstvoeding geven ).
Metabolisme
Cyclosporine wordt uitgebreid gemetaboliseerd door het cytochroom P-450 3A-enzymsysteem in de lever, en in mindere mate in het maagdarmkanaal en de nier. Het metabolisme van ciclosporine kan worden veranderd door de gelijktijdige toediening van verschillende middelen (zie: PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ). Ten minste 25 metabolieten zijn geïdentificeerd uit menselijke gal, uitwerpselen, bloed en urine. De biologische activiteit van de metabolieten en hun bijdragen aan de toxiciteit zijn aanzienlijk minder dan die van de moederverbinding. De belangrijkste metabolieten (M1, M9 en M4N) zijn het gevolg van oxidatie op respectievelijk de 1-beta-, 9-gamma- en 4-N-gedemethyleerde posities. Bij steady-state na orale toediening van Sandimmune zijn de gemiddelde AUC's voor bloedconcentraties van M1, M9 en M4N respectievelijk ongeveer 70%, 21% en 7,5% van de AUC voor bloedciclosporineconcentraties. Op basis van bloedconcentratiegegevens van stabiele niertransplantatiepatiënten (13 patiënten die Neoral en Sandimmun kregen toegediend in een cross-overonderzoek) en galconcentratiegegevens van de novo levertransplantatiepatiënten (4 toegediend Neoral 100 mg, 3 toegediend Sandimmune), is het percentage van de aanwezige dosis als M1-, M9- en M4N-metabolieten zijn vergelijkbaar wanneer Neoral 25 mg of Sandimmune wordt toegediend.
uitscheiding
Slechts 0,1% van een dosis ciclosporine wordt onveranderd in de urine uitgescheiden. Eliminatie vindt voornamelijk via de gal plaats, waarbij slechts 6% van de dosis (oudergeneesmiddel en metabolieten) in de urine wordt uitgescheiden. Noch dialyse, noch nierfalen verandert de klaring van ciclosporine significant.
Geneesmiddelinteracties
(Zien PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ) Wanneer diclofenac of methotrexaat gelijktijdig werd toegediend met ciclosporine bij patiënten met reumatoïde artritis, was de AUC van diclofenac en methotrexaat elk significant verhoogd (zie PREVENTIEVE MAATREGELEN , DRUG-INTERACTIES ). Er zijn geen klinisch significante farmacokinetische interacties opgetreden tussen ciclosporine en aspirine, ketoprofen, piroxicam of indomethacine.
Specifieke populaties
Nierfunctiestoornis
In een studie uitgevoerd bij 4 proefpersonen met terminale nierziekte (creatinineklaring
Leverfunctiestoornis
Cyclosporine wordt uitgebreid gemetaboliseerd door de lever. Aangezien een ernstige leverfunctiestoornis kan leiden tot een significant verhoogde blootstelling aan ciclosporine, moet de dosering van ciclosporine bij deze patiënten mogelijk worden verlaagd.
Pediatrische bevolking
De farmacokinetische gegevens van pediatrische patiënten die Neoral of Sandimmune kregen toegediend, zijn zeer beperkt. Bij 15 niertransplantatiepatiënten in de leeftijd van 3-16 jaar was de klaring van volbloed van ciclosporine na intraveneuze toediening van Sandimmune 10,6 ± 3,7 ml/min/kg (test: Cyclo-trac-specifieke RIA). In een onderzoek bij 7 niertransplantatiepatiënten van 2 tot 16 jaar varieerde de ciclosporineklaring van 9,8 tot 15,5 ml/min/kg. Bij 9 levertransplantatiepatiënten in de leeftijd van 0,6 tot 5,6 jaar was de klaring 9,3 ± 5,4 ml/min/kg (test: HPLC).
Bij de pediatrische populatie vertoont Neoral ook een verhoogde biologische beschikbaarheid in vergelijking met Sandimmune. Bij 7 de novo levertransplantatiepatiënten in de leeftijd van 1,4 tot 10 jaar was de absolute biologische beschikbaarheid van Neoral 43% (spreiding 30% tot 68%) en voor Sandimmune bij dezelfde personen was de absolute biologische beschikbaarheid 28% (spreiding 17% tot 42%).
geriatrische populatie
Vergelijking van enkelvoudige dosisgegevens van zowel normale oudere vrijwilligers (N = 18, gemiddelde leeftijd 69 jaar) als oudere patiënten met reumatoïde artritis (N = 16, gemiddelde leeftijd 68 jaar) met enkelvoudige dosisgegevens bij jonge volwassen vrijwilligers (N = 16, gemiddelde leeftijd 26 jaar) toonden geen significant verschil in de farmacokinetische parameters.
Klinische proeven
Reumatoïde artritis
De werkzaamheid van Sandimmune en Neoral 100 mg bij de behandeling van ernstige reumatoïde artritis werd geëvalueerd in 5 klinische onderzoeken met in totaal 728 met ciclosporine behandelde patiënten en 273 met placebo behandelde patiënten.
Er wordt een samenvatting van de resultaten gepresenteerd voor de percentages "responder" per behandelingsgroep, waarbij een responder wordt gedefinieerd als een patiënt die het onderzoek heeft voltooid met een verbetering van 20% in het aantal gevoelige en gezwollen gewrichten en een verbetering van 20% in 2 van de 4 van de globale onderzoeker, de globale patiënt, de invaliditeit en de erytrocytsedimentatiesnelheden (ESR) voor de onderzoeken 651 en 652 en 3 van 5 van de onderzoeker global, de globale patiënt, de invaliditeit, visueel analoge pijn en de ESR voor de onderzoeken 2008, 654 en 302.
In onderzoek 651 werden 264 patiënten opgenomen met actieve reumatoïde artritis met ten minste 20 aangedane gewrichten, bij wie ten minste één belangrijk geneesmiddel tegen RA had gefaald, met behulp van een 3:3:2 randomisatie naar een van de volgende drie groepen: (1) ciclosporine gedoseerd op 2,5 tot 5 mg/kg/dag, (2) methotrexaat van 7,5 tot 15 mg/week, of (3) placebo. De behandelingsduur was 24 weken. De gemiddelde dosis ciclosporine bij het laatste bezoek was 3,1 mg/kg/dag. Zie onderstaande grafiek.
Onderzoek 652 nam 250 patiënten op met actieve RA met > 6 actieve pijnlijke of gevoelige gewrichten bij wie ten minste één belangrijk RA-medicijn had gefaald. Patiënten werden gerandomiseerd met behulp van een 3:3:2 randomisatie naar 1 van de 3 behandelarmen: (1) 1,5 tot 5 mg/kg/dag ciclosporine, (2) 2,5 tot 5 mg/kg/dag ciclosporine, en (3) placebo. De behandelingsduur was 16 weken. De gemiddelde dosis ciclosporine voor groep 2 bij het laatste bezoek was 2,92 mg/kg/dag. Zie onderstaande grafiek.
Studie 2008 nam 144 patiënten op met actieve RA en > 6 actieve gewrichten die onsuccesvolle behandelingskuren met aspirine en goud of penicillamine hadden ondergaan. Patiënten werden gerandomiseerd naar 1 van de 2 behandelingsgroepen (1) ciclosporine 2,5 tot 5 mg/kg/dag met aanpassingen na de eerste maand om een beoogde dalspiegel te bereiken en (2) placebo. De behandelingsduur was 24 weken. De gemiddelde dosis ciclosporine bij het laatste bezoek was 3,63 mg/kg/dag. Zie onderstaande grafiek.
Aan onderzoek 654 namen 148 patiënten deel die een actieve gewrichtstelling van 6 of meer hadden ondanks behandeling met maximaal verdraagbare doses methotrexaat gedurende ten minste drie maanden. Patiënten bleven hun huidige dosis methotrexaat innemen en werden gerandomiseerd om daarnaast een van de volgende medicijnen te krijgen: (1) ciclosporine 2,5 mg/kg/dag met dosisverhogingen van 0,5 mg/kg/dag in week 2 en 4 indien er was geen bewijs van toxiciteit en verdere verhogingen van 0,5 mg/kg/dag in week 8 en 16 als een afname van
Aan onderzoek 302 namen 299 patiënten deel met ernstige actieve RA, van wie 99% niet reageerde of intolerant was voor ten minste één eerder belangrijk geneesmiddel tegen RA. Patiënten werden gerandomiseerd naar 1 van de 2 behandelingsgroepen (1) Neoral 25 mg en (2) ciclosporine, die beide begonnen met 2,5 mg/kg/dag en na 4 weken werden verhoogd wegens ineffectiviteit in stappen van 0,5 mg/kg/dag tot een maximaal 5 mg/kg/dag en kan op elk moment worden verlaagd wegens toxiciteit. De behandelingsduur was 24 weken. De gemiddelde dosis ciclosporine bij het laatste bezoek was 2,91 mg/kg/dag (bereik: 0,72 tot 5,17) voor Neoral en 3,27 mg/kg/dag (bereik: 0,73 tot 5,68) voor ciclosporine. Zie onderstaande grafiek.
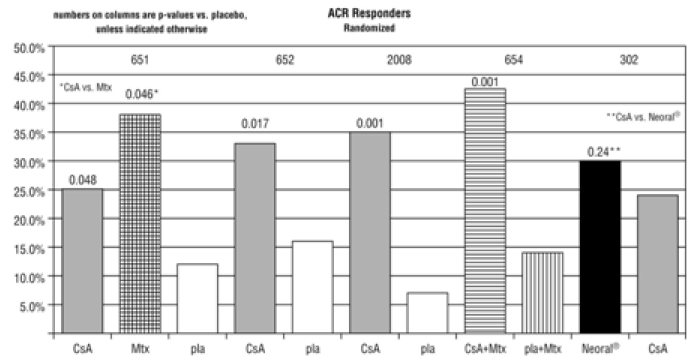
Klinische studies
In gecontroleerde onderzoeken waren de aard, ernst en incidentie van de bijwerkingen die werden waargenomen bij 493 getransplanteerde patiënten die werden behandeld met Neoral vergelijkbaar met die waargenomen bij 208 getransplanteerde patiënten die Sandimmune kregen in dezelfde onderzoeken toen de dosering van de twee geneesmiddelen werd aangepast. om dezelfde ciclosporine-dalconcentraties in het bloed te bereiken.
Op basis van de historische ervaring met Sandimmune, traden de volgende reacties op bij 3% of meer van 892 patiënten die betrokken waren bij klinische onderzoeken naar nier-, hart- en levertransplantaties.
Van de 705 niertransplantatiepatiënten die in klinische onderzoeken werden behandeld met ciclosporine-drank (Sandimmune) was de reden voor stopzetting van de behandeling niertoxiciteit bij 5,4%, infectie bij 0,9%, gebrek aan werkzaamheid bij 1,4%, acute tubulaire necrose bij 1,0%, lymfoproliferatieve aandoeningen bij 0,3%, hypertensie bij 0,3% en andere redenen bij 0,7% van de patiënten.
De volgende reacties kwamen voor bij 2% of minder van de met ciclosporine behandelde patiënten: allergische reacties, anemie, anorexia, verwardheid, conjunctivitis, oedeem, koorts, broze vingernagels, gastritis, gehoorverlies, hikken, hyperglykemie, migraine (Neoral), spierpijn, maagzweer, trombocytopenie, oorsuizen.
De volgende reacties kwamen zelden voor: angst, pijn op de borst, constipatie, depressie, haarbreuk, hematurie, gewrichtspijn, lethargie, zweertjes in de mond, myocardinfarct, nachtelijk zweten, pancreatitis, pruritus, slikproblemen, tintelingen, bloeding in het bovenste deel van het maagdarmkanaal, visuele stoornis, zwakte, gewichtsverlies.
Patiënten die immunosuppressieve therapieën krijgen, waaronder ciclosporine en ciclosporine-bevattende regimes, lopen een verhoogd risico op infecties (viraal, bacterieel, schimmel, parasitair). Zowel gegeneraliseerde als gelokaliseerde infecties kunnen voorkomen. Reeds bestaande infecties kunnen ook verergeren. Er zijn fatale gevolgen gemeld (zie WAARSCHUWINGEN ).
Postmarketingervaring, nier-, lever- en harttransplantatie
Hepatotoxiciteit
Gevallen van hepatotoxiciteit en leverbeschadiging, waaronder cholestase, geelzucht, hepatitis en leverfalen; ernstige en/of fatale gevolgen zijn gemeld (zie: WAARSCHUWINGEN , Hepatotoxiciteit ).
Verhoogd risico op infecties
Gevallen van JC-virus-geassocieerde progressieve multifocale leuko-encefalopathie (PML), soms fataal; en polyomavirus-geassocieerde nefropathie (PVAN), vooral BK-virus resulterend in transplantaatverlies, zijn gemeld (zie WAARSCHUWINGEN , Polyoma-virusinfectie ).
Hoofdpijn, inclusief migraine
Er zijn gevallen van migraine gemeld. In sommige gevallen waren patiënten niet in staat om door te gaan met ciclosporine, maar de uiteindelijke beslissing over stopzetting van de behandeling moet worden genomen door de behandelend arts na zorgvuldige afweging van voordelen versus risico's.
Pijn van de onderste ledematen
Er zijn geïsoleerde gevallen van pijn in de onderste ledematen gemeld in verband met ciclosporine. Pijn van de onderste ledematen is ook opgemerkt als onderdeel van door calcineurine-inhibitor geïnduceerd pijnsyndroom (CIPS), zoals beschreven in de literatuur.
Reumatoïde artritis
De belangrijkste bijwerkingen die verband houden met het gebruik van ciclosporine bij reumatoïde artritis zijn nierdisfunctie (zie: WAARSCHUWINGEN ), hypertensie (zie PREVENTIEVE MAATREGELEN ), hoofdpijn, gastro-intestinale stoornissen en hirsutisme/hypertrichose.
Bij patiënten met reumatoïde artritis die in klinische onderzoeken binnen het aanbevolen dosisbereik werden behandeld, werd de behandeling met ciclosporine stopgezet bij 5,3% van de patiënten vanwege hypertensie en bij 7% van de patiënten vanwege verhoogde creatinine. Deze veranderingen zijn meestal omkeerbaar met tijdige dosisverlaging of stopzetting van het geneesmiddel. De frequentie en ernst van verhogingen van serumcreatinine nemen toe met de dosis en de duur van de behandeling met ciclosporine. Deze verhogingen zullen waarschijnlijk meer uitgesproken worden zonder dosisverlaging of stopzetting.
De volgende bijwerkingen traden op in gecontroleerde klinische onderzoeken:
Daarnaast zijn de volgende bijwerkingen gemeld bij 1% tot
Autonoom zenuwstelsel: droge mond, meer zweten
Lichaam als geheel: allergie, asthenie, opvliegers, malaise, overdosering, procedure NOS*, tumor NOS*, gewichtsafname, gewichtstoename
Cardiovasculair: abnormale harttonen, hartfalen, myocardinfarct, perifere ischemie
Centraal en perifeer zenuwstelsel: hypesthesie, neuropathie, vertigo
Endocrien: struma
Gastro-intestinaal: constipatie, dysfagie, enantheem, oprispingen, oesofagitis, maagzweer, gastritis, gastro-enteritis, tandvleesbloeding, glossitis, maagzweer, speekselkliervergroting, tongaandoening, tandaandoening
Infectie: abces, bacteriële infectie, cellulitis, folliculitis, schimmelinfectie, herpes simplex, herpes zoster, nierabces, moniliasis, tonsillitis, virale infectie
Hematologische: bloedarmoede, epistaxis, leukopenie, lymfadenopathie
Lever en galwegen: bilirubinemie
Metabool en voedingswaarde: diabetes mellitus, hyperkaliëmie, hyperurikemie, hypoglykemie
Musculoskeletaal systeem: artralgie, botbreuk, bursitis, gewrichtsdislocatie, myalgie, stijfheid, synoviale cyste, peesaandoening
Neoplasmata: borstfibroadenose, carcinoom
Psychiatrisch: angst, verwardheid, verminderd libido, emotionele labiliteit, verminderde concentratie, verhoogd libido, nervositeit, paroniria, slaperigheid
Reproductief (vrouwelijk): pijn in de borst, baarmoederbloeding
Ademhalingssysteem: abnormale geluiden op de borst, bronchospasme
Huid en aanhangsels: abnormale pigmentatie, angio-oedeem, dermatitis, droge huid, eczeem, nagelaandoening, pruritus, huidaandoening, urticaria
Speciale zintuigen: abnormaal zicht, cataract, conjunctivitis, doofheid, oogpijn, smaakverstoring, tinnitus, vestibulaire stoornis
Urinewegen: abnormale urine, hematurie, verhoogde BUN, mictiedrang, nocturie, polyurie, pyelonefritis, urine-incontinentie
*NOS = niet anders vermeld
Psoriasis
De belangrijkste bijwerkingen die verband houden met het gebruik van ciclosporine bij patiënten met psoriasis zijn nierfunctiestoornissen, hoofdpijn, hypertensie, hypertriglyceridemie, hirsutisme/hypertrichose, paresthesie of hyperesthesie, griepachtige symptomen, misselijkheid/braken, diarree, buikpijn, lethargie en musculoskeletale of gewrichtspijn.
Bij psoriasispatiënten die werden behandeld in gecontroleerde klinische onderzoeken in de VS binnen het aanbevolen doseringsbereik, werd de behandeling met ciclosporine stopgezet bij 1,0% van de patiënten vanwege hypertensie en bij 5,4% van de patiënten vanwege verhoogde creatinine. In de meeste gevallen waren deze veranderingen omkeerbaar na dosisverlaging of stopzetting van ciclosporine.
Er is één overlijden gemeld in verband met het gebruik van ciclosporine bij psoriasis. Een 27-jarige man ontwikkelde een nierverslechtering en werd voortgezet op ciclosporine. Hij had progressief nierfalen met de dood tot gevolg.
Frequentie en ernst van serumcreatinine nemen toe met de dosis en de duur van de behandeling met ciclosporine. Deze verhogingen zullen waarschijnlijk meer uitgesproken worden en kunnen leiden tot onomkeerbare nierschade zonder dosisverlaging of stopzetting.
De volgende voorvallen traden op bij 1% tot minder dan 3% van de psoriasispatiënten die werden behandeld met ciclosporine:
Lichaam als geheel: koorts, opvliegers, opvliegers
Cardiovasculair: pijn op de borst
Centraal en perifeer zenuwstelsel: toegenomen eetlust, slapeloosheid, duizeligheid, nervositeit, vertigo
Gastro-intestinaal: opgezette buik, constipatie, tandvleesbloeding
Lever en galwegen: hyperbilirubinemie
Neoplasmata: huidmaligniteiten [plaveiselcelcarcinomen (0,9%) en basaalcelcarcinomen (0,4%)]
reticulo-endotheliaal: bloedplaatjes-, bloedings- en stollingsstoornissen, rode bloedcelstoornis
Ademhaling: infectie, virale en andere infectie
Huid en aanhangsels: acne, folliculitis, keratose, pruritus, huiduitslag, droge huid
Urinewegen: mictie frequentie
Visie: abnormaal zicht
Milde hypomagnesiëmie en hyperkaliëmie kunnen optreden, maar zijn asymptomatisch. Verhogingen van urinezuur kunnen optreden en aanvallen van jicht zijn zelden gemeld. Een lichte en dosisgerelateerde hyperbilirubinemie is waargenomen bij afwezigheid van hepatocellulaire schade. Behandeling met ciclosporine kan gepaard gaan met een bescheiden verhoging van serumtriglyceriden of cholesterol. Verhogingen van triglyceriden (> 750 mg/dL) komen voor bij ongeveer 15% van de psoriasispatiënten; verhogingen van cholesterol (> 300 mg/dl) worden waargenomen bij minder dan 3% van de psoriasispatiënten. Over het algemeen zijn deze laboratoriumafwijkingen omkeerbaar na dosisverlaging of stopzetting van ciclosporine.
Postmarketingervaring, psoriasis
Gevallen van transformatie naar erythrodermische psoriasis of gegeneraliseerde pustuleuze psoriasis na stopzetting of vermindering van ciclosporine bij patiënten met chronische plaque psoriasis zijn gemeld.
PATIËNT INFORMATIE
Patiënten moeten erop worden gewezen dat elke wijziging van de formulering van ciclosporine voorzichtig moet gebeuren en alleen onder toezicht van een arts, omdat dit ertoe kan leiden dat de dosering moet worden gewijzigd.
Patiënten moeten worden geïnformeerd over de noodzaak van herhaalde laboratoriumtests terwijl ze ciclosporine krijgen. Patiënten moeten worden geïnformeerd over de mogelijke risico's tijdens de zwangerschap en moeten worden geïnformeerd over het verhoogde risico op neoplasie. Patiënten moeten ook worden geïnformeerd over het risico op hypertensie en nierdisfunctie.
Patiënten moeten erop worden gewezen dat vaccinatie tijdens de behandeling met ciclosporine minder effectief kan zijn en dat het gebruik van verzwakte levende vaccins moet worden vermeden.
Patiënten dienen zorgvuldige doseringsinstructies te krijgen. Neoral drank (ciclosporine drank, USP) MODIFIED moet worden verdund, bij voorkeur met sinaasappel- of appelsap dat op kamertemperatuur is. De combinatie van Neoral Oral Solution (ciclosporine drank, USP) GEMODIFICEERD met melk kan onverteerbaar zijn.
Patiënten moeten worden geadviseerd Neoral 100 mg in te nemen volgens een consistent schema met betrekking tot het tijdstip van de dag en de maaltijden. Grapefruit en grapefruitsap beïnvloeden het metabolisme, waardoor de bloedconcentratie van ciclosporine wordt verhoogd, dus moet worden vermeden.
