Behandeling van bacteriële infecties: Bactrim 400/80mg, 800/160mg Trimethoprim Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Merknaam: Bactrim
Generieke naam: Sulfamethoxazol en Trimethoprim-injectie voor intraveneuze infusie
Wat is Bactrim 800 mg?
Bactrim (sulfamethoxazol en trimethoprim) DS is een combinatie van twee antibiotica die worden gebruikt voor de behandeling van urineweginfecties, acute middenoorontsteking, bronchitis, Shigellose, Pneumocystis-pneumonie, reizigersdiarree, methicilline-resistente Staphylococcus aureus (MRSA) en andere bacteriële infecties die gevoelig zijn voor dit antibioticum.
Wat zijn bijwerkingen van Bactrim?
Vaak voorkomende bijwerkingen van Bactrim zijn onder meer:
- verlies van eetlust,
- misselijkheid,
- braken,
- pijnlijke of gezwollen tong,
- duizeligheid,
- ronddraaiend gevoel,
- in je oren rinkelen,
- vermoeidheid, of
- slaapproblemen (slapeloosheid).
Vertel het uw arts als u ernstige bijwerkingen van Bactrim 800 mg ervaart, waaronder:
- blauwe plekken of bloedingen,
- aplastische bloedarmoede,
- geelzucht,
- levernecrose,
- zweertjes in de mond,
- gewrichtspijn,
- ernstige huiduitslag,
- jeuk, en
- keelpijn.
OMSCHRIJVING
BACTRIM ™ (trimethoprim en sulfamethoxazol) injectie, een steriele oplossing voor alleen intraveneuze infusie, is een combinatie van sulfamethoxazol, een antimicrobieel middel op sulfonamide, en trimethoprim, een antibacteriële dihydrofolaatreductaseremmer. Elke 5 ml bevat 80 mg trimethoprim (16 mg/ml) en 400 mg sulfamethoxazol (80 mg/ml) vermengd met 40% propyleenglycol, 10% ethylalcohol en 0,3% diethanolamine; 1% benzylalcohol en 0,1% natriummetabisulfiet toegevoegd als conserveermiddelen, water voor injectie en pH aangepast tot ongeveer 10 met natriumhydroxide.
Trimethoprim is 2,4-diamino-5-(3,4,5-trimethoxybenzyl)pyrimidine. Het is een witte tot lichtgele, geurloze, bittere verbinding met een molecuulgewicht van 290,3 en de volgende structuurformule:
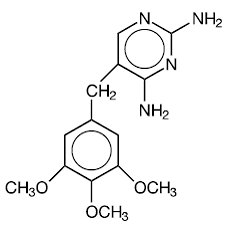
C14H18N4O3 MW 290,3
Sulfamethoxazol is N1-(5-methyl-3-isoxazolyl)sulfanilamide. Het is een bijna witte, geurloze, smaakloze verbinding met een molecuulgewicht van 253,28 en de volgende structuurformule:
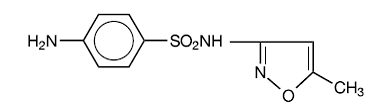
C10H11N3O3S MW 253.28
INDICATIES
Pneumocystis jirovecii Longontsteking
BACTRIM is geïndiceerd voor de behandeling van Pneumocystis jirovecii-pneumonie bij volwassenen en pediatrische patiënten van twee maanden en ouder.
Shigellose
BACTRIM 400 mg is geïndiceerd voor de behandeling van enteritis veroorzaakt door gevoelige stammen van Shigella flexneri en Shigella sonnei bij volwassenen en pediatrische patiënten van twee maanden en ouder.
Urineweginfecties
BACTRIM is geïndiceerd voor de behandeling van ernstige of gecompliceerde urineweginfecties bij volwassenen en pediatrische patiënten van twee maanden en ouder als gevolg van gevoelige stammen van Escherichia coli, Klebsiella-soorten, Enterobacter-soorten, Morganella morganii, Proteus mirabilis en Proteus vulgaris bij orale toediening van BACTRIM is niet haalbaar en wanneer het organisme niet vatbaar is voor antibacteriële enkelvoudige middelen die effectief zijn in de urinewegen.
Gebruik
Om de ontwikkeling van resistente bacteriën te verminderen en de werkzaamheid van BACTRIM en andere antibacteriële geneesmiddelen te behouden, mag BACTRIM alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of waarvan wordt vermoed dat ze worden veroorzaakt door gevoelige bacteriën. Wanneer informatie over cultuur en gevoeligheid beschikbaar is, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
Hoewel geschikte kweek- en gevoeligheidsonderzoeken moeten worden uitgevoerd, kan de behandeling worden gestart in afwachting van de resultaten van deze onderzoeken.
DOSERING EN ADMINISTRATIE
Dosering bij volwassenen en pediatrische patiënten (twee maanden en ouder)
De maximale aanbevolen dagelijkse dosis is 60 ml (960 mg trimethoprim) per dag.
Doseringsaanpassingen bij patiënten met een verminderde nierfunctie
Als de nierfunctie is aangetast, moet een lagere dosering worden gebruikt, zoals weergegeven in tabel 2.
Belangrijke administratie-instructies
Dien de oplossing toe via intraveneuze infusie gedurende een periode van 60 tot 90 minuten. Vermijd toediening via snelle infusie of bolusinjectie. Dien BACTRIM 400 mg NIET intramusculair toe.
Inspecteer parenterale geneesmiddelen visueel op deeltjes en verkleuring voorafgaand aan toediening, wanneer de oplossing en de container dit toelaten.
Methode van voorbereiden
Verdunning van injectieflacons met één of meerdere doses
BACTRIM moet worden verdund. Elke 5 ml moet worden toegevoegd aan 125 ml 5% dextrose in water. Na verdunning met 5% dextrose in water, mag de oplossing niet worden gekoeld en binnen 6 uur worden gebruikt.
Als een verdunning van 5 ml per 100 ml 5% dextrose in water gewenst is, moet deze binnen 4 uur worden gebruikt. In die gevallen waar vloeistofbeperking wenselijk is, kan elke 5 ml worden toegevoegd aan 75 ml 5% dextrose in water. Onder deze omstandigheden moet de oplossing vlak voor gebruik worden gemengd en binnen 2 uur worden toegediend.
Als er bij visuele inspectie troebelheid of tekenen van kristallisatie zijn na het mengen, moet de oplossing worden weggegooid en een verse oplossing worden bereid.
Doen NIET meng Bactrim in 5% dextrose in water met medicijnen of oplossingen in dezelfde container.
Injectieflacons met meerdere doses (verwerking)
Na de eerste opname in de injectieflacon moet de resterende inhoud binnen 48 uur worden gebruikt.
Infusiesystemen voor intraveneuze toediening
De volgende infusiesystemen zijn getest en bevredigend bevonden: glazen verpakkingen met eenheidsdosis; eenheidsdosis polyvinylchloride en polyolefine containers. Er zijn geen andere systemen getest en daarom kunnen er geen andere worden aanbevolen.
HOE GELEVERD
Doseringsvormen en sterke punten
BACTRIM is verkrijgbaar als een injectie met 80 mg/ml sulfamethoxazol en 16 mg/ml trimethoprim in injectieflacons van 10 ml voor eenmalig gebruik en 30 ml voor meervoudige doses.
Opslag en behandeling
BACTRIM ™ (sulfamethoxazol en trimethoprim) injectie wordt als volgt geleverd:
injectieflacons van 10 ml bevattende 160 mg trimethoprim (16 mg/ml) en 800 mg sulfamethoxazol (80 mg/ml) voor infusie met 5% dextrose in water.
10 ml injectieflacon: NDC 49708-001-4210 ml injectieflacon (doos van 10): NDC 49708-001-45
30 ml injectieflacons met meerdere doses , elke 5 ml met 80 mg trimethoprim (16 mg/ml) en 400 mg sulfamethoxazol (80 mg/ml) voor infusie met 5% dextrose in water.
30 ml injectieflacon (doos van 1): NDC 49708-002-47
Bewaren bij kamertemperatuur (15°C – 30°C of 59°F – 86°F). NIET KOELEN.
REFERENTIES
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimethoprim-Sulfamethoxazol voor de behandeling van Pneumocystis carinii-pneumonie. Ann Stagiair Med. Juni 1980;92:762-769.
Gedistribueerd door: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Herzien: juli 2020
BIJWERKINGEN
De volgende ernstige bijwerkingen worden elders in de etikettering beschreven:
- Embryo-foetale toxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheid en andere fatale reacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Trombocytopenie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Clostridioides difficile-geassocieerde diarree [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Sulfietgevoeligheid [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Risico geassocieerd met gelijktijdig gebruik van leucovorine voor Pneumocystis jirovecii Longontsteking [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Propyleenglycol toxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ]
- Infusiereacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- hypoglykemie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Elektrolytafwijkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
De meest voorkomende bijwerkingen zijn gastro-intestinale stoornissen (misselijkheid, braken en anorexia) en allergische huidreacties (zoals uitslag en urticaria).
Lokale reacties, pijn en lichte irritatie bij intraveneuze (IV) toediening komen niet vaak voor. Tromboflebitis is waargenomen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van BACTRIM na goedkeuring. Omdat deze reacties vrijwillig werden gemeld door een populatie van onbekende grootte, is het niet mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen:
- Trombotische trombocytopenie purpura
- Idiopathische trombocytopenische purpura
- QT-verlenging resulterend in ventriculaire tachycardie en torsade de pointes
- Metabole acidose
DRUG-INTERACTIES
Potentieel voor BACTRIM 400 mg om andere geneesmiddelen te beïnvloeden
Trimethoprim is een remmer van zowel CYP2C8 als OCT2-transporteiwitten. Sulfamethoxazol is een remmer van CYP2C9. Vermijd gelijktijdige toediening van BACTRIM 80 mg met geneesmiddelen die substraten zijn van CYP2C8 en 2C9 of OCT2.
Interacties met laboratorium- of diagnostische tests
BACTRIM, met name de trimethoprim-component, kan interfereren met een serummethotrexaat-assay zoals bepaald door de competitieve bindingseiwittechniek (CBPA) wanneer een bacterieel dihydrofolaatreductase wordt gebruikt als het bindende eiwit. Er treedt echter geen interferentie op als methotrexaat wordt gemeten met een radioimmunoassay (RIA).
De aanwezigheid van BACTRIM kan ook interfereren met de Jaffe alkalische picraatreactie-assay voor creatinine, wat resulteert in overschattingen van ongeveer 10% in het bereik van normale waarden.
REFERENTIES
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Wat clinici moeten weten over het QT-interval. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Ooievaar C, Wang RY. Review: de farmacologie en toxicologie van dofetilide. Int J Med Toxicol. 2001;4(2):16.
5. Londen NJ, Garg SJ, Moorthy RS, Cunningham ET. Geneesmiddelgeïnduceerde uveïtis. J Oogontsteking Infecteren. 2013;3:43.
6. Marinella MA. Door trimethoprim geïnduceerde hyperkaliëmie: een analyse van gerapporteerde gevallen. Gerontol. 1999;45:209-212.
7. Margassery S, Bastani B. Levensbedreigende hyperkaliëmie en acidose secundair aan behandeling met trimethoprimsulfamethoxazol. J. Nephrol. 2001;14(5):410-414.
8. MohR, et al. Hematologische veranderingen bij volwassenen die een zidovudine-bevattend HAART-regime krijgen in combinatie met cotrimoxazol in Ivoorkust. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr, Vlasses PH. Trimethoprim verandert de dispositie van procaïnamide en Nacetylprocaïnamide. Clin Pharmacol Ther. Okt 1988;44(4):467-77.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Embryo-foetale toxiciteit
Sommige epidemiologische onderzoeken suggereren dat blootstelling aan BACTRIM tijdens de zwangerschap gepaard kan gaan met een verhoogd risico op aangeboren afwijkingen, met name neurale buisdefecten, cardiovasculaire misvormingen, urinewegdefecten, mondspleten en klompvoet. Als BACTRIM 400 mg tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt worden geïnformeerd over de mogelijke gevaren voor de foetus [zie Gebruik bij specifieke populaties ].
Overgevoeligheid en andere fatale reacties
Sterfgevallen geassocieerd met de toediening van sulfonamiden zijn opgetreden als gevolg van ernstige reacties, waaronder Stevens-Johnson-syndroom, toxische epidermale necrolyse, fulminante levernecrose, agranulocytose, aplastische anemie en andere bloeddyscrasieën.
Sulfonamiden, inclusief sulfonamide-bevattende producten zoals BACTRIM, dienen te worden gestaakt bij het eerste optreden van huiduitslag of enig teken van een bijwerking. Klinische symptomen, zoals huiduitslag, keelpijn, koorts, artralgie, hoesten, kortademigheid, bleekheid, purpura of geelzucht kunnen vroege indicaties zijn van ernstige reacties. Een huiduitslag kan worden gevolgd door ernstigere reacties, zoals het Stevens-Johnson-syndroom, toxische epidermale necrolyse, levernecrose of een ernstige bloedaandoening. Bij patiënten die sulfonamiden krijgen, moet regelmatig een volledige bloedtelling worden uitgevoerd. Hoesten, kortademigheid en longinfiltraten zijn overgevoeligheidsreacties van de luchtwegen die zijn gemeld in verband met behandeling met sulfonamide.
Trombocytopenie
Door BACTRIM geïnduceerde trombocytopenie kan een immuungemedieerde aandoening zijn. Ernstige gevallen van trombocytopenie die fataal of levensbedreigend zijn, zijn gemeld. Patiënten controleren op hematologische toxiciteit. Trombocytopenie verdwijnt gewoonlijk binnen een week na stopzetting van BACTRIM.
Streptokokkeninfecties en reumatische koorts
Vermijd het gebruik van BACTRIM bij de behandeling van faryngitis door streptokokken. Klinische studies hebben aangetoond dat patiënten met groep A β-hemolytische streptokokken tonsillofaryngitis een grotere incidentie van bacteriologisch falen hebben bij behandeling met BACTRIM 800 mg dan bij patiënten die met penicilline worden behandeld, zoals blijkt uit het falen om dit organisme uit het tonsillofaryngeale gebied uit te roeien. Daarom zal BACTRIM geen gevolgen zoals reumatische koorts voorkomen.
Clostridioides Difficile-geassocieerde diarree
Clostridioides difficile-geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, inclusief BACTRIM 80 mg, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm, wat leidt tot overgroei van C. difficile.
C. difficile produceert de toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig kunnen zijn voor antimicrobiële therapie en mogelijk colectomie vereisen. CDAD moet worden overwogen bij alle patiënten die diarree krijgen na antibacterieel gebruik. Een zorgvuldige medische voorgeschiedenis is noodzakelijk, aangezien is gemeld dat CDAD meer dan twee maanden na de toediening van antibacteriële middelen optreedt.
Als CDAD wordt vermoed of bevestigd, moet mogelijk worden gestopt met het lopende antibacteriële gebruik dat niet is gericht tegen C. difficile. Passend vocht- en elektrolytenbeheer, eiwitsuppletie, antibacteriële behandeling van
C. difficile, en chirurgische evaluatie moet worden ingesteld zoals klinisch geïndiceerd.
Sulfietgevoeligheid
BACTRIM 400 mg bevat natriummetabisulfiet, een sulfiet dat allergische reacties kan veroorzaken, waaronder anafylactische symptomen en levensbedreigende of minder ernstige astmatische episodes bij bepaalde gevoelige personen. De algemene prevalentie van sulfietgevoeligheid in de algemene bevolking is onbekend. Sulfietgevoeligheid wordt vaker gezien bij astmatische dan bij niet-astmatische mensen.
Toxiciteit van benzylalcohol bij pediatrische patiënten ("hijgensyndroom")
BACTRIM 160 mg bevat benzylalcohol als conserveermiddel. Ernstige en fatale bijwerkingen, waaronder het "hijgsyndroom" kunnen optreden bij pasgeborenen en zuigelingen met een laag geboortegewicht die worden behandeld met formuleringen met conservering van benzylalcohol in infusieoplossingen, waaronder BACTRIM. Het "hijgsyndroom" wordt gekenmerkt door depressie van het centrale zenuwstelsel, metabole acidose en hijgende ademhaling. BACTRIM 160 mg is gecontra-indiceerd bij pediatrische patiënten jonger dan twee maanden [zie: CONTRA-INDICATIES ].
Houd bij het voorschrijven van BACTRIM 400 mg aan pediatrische patiënten (van twee maanden en ouder) rekening met de gecombineerde dagelijkse metabole belasting van benzylalcohol uit alle bronnen, inclusief BACTRIM (bevat 10 mg benzylalcohol per ml) en andere geneesmiddelen die benzylalcohol bevatten. De minimale hoeveelheid benzylalcohol waarbij ernstige bijwerkingen kunnen optreden, is niet bekend [zie: Gebruik bij specifieke populaties ].
Risico verbonden aan gelijktijdig gebruik van leucovorine voor Pneumocystis jirovecii Longontsteking
In een gerandomiseerde placebogecontroleerde studie werden behandelingsfalen en overmatige mortaliteit waargenomen wanneer BACTRIM gelijktijdig met leucovorine werd gebruikt voor de behandeling van HIV-positieve patiënten met Pneumocystis jirovecii-pneumonie.4 Vermijd gelijktijdige toediening van BACTRIM en leucovorine tijdens de behandeling van Pneumocystis jirovecii-pneumonie.
Propyleenglycol toxiciteit
BACTRIM bevat propyleenglycol als oplosmiddel (40% v/v). Bij toediening in hoge doses zoals voor de behandeling van P. jirovecii-pneumonie en gelijktijdig met andere producten die propyleenglycol bevatten, kan hyperosmolariteit met anion gap metabole acidose, waaronder lactaatacidose, optreden. Propyleenglycol-toxiciteit kan leiden tot acuut nierletsel, CZS-toxiciteit en multi-orgaanfalen. Controleer op de totale dagelijkse inname van propyleenglycol uit alle bronnen en op zuur-base-verstoringen. Stop met BACTRIM 400 mg als propyleenglycoltoxiciteit wordt vermoed [zie ONGEWENSTE REACTIES ].
Foliumzuurtekort
Vermijd het gebruik van BACTRIM 160 mg bij patiënten met een verminderde nier- of leverfunctie, bij patiënten met een mogelijke folaatdeficiëntie (bijv. ouderen, chronische alcoholisten, patiënten die anticonvulsiva krijgen, patiënten met malabsorptiesyndroom en patiënten in ondervoeding) en bij patiënten met ernstige allergieën of bronchiale astma.
Hematologische veranderingen die wijzen op foliumzuurdeficiëntie kunnen optreden bij oudere patiënten of bij patiënten met reeds bestaande foliumzuurdeficiëntie of nierfalen. Deze effecten zijn omkeerbaar door folinezuurtherapie [zie Gebruik bij specifieke populaties ].
Hemolyse
Bij personen met glucose-6-fosfaatdehydrogenasedeficiëntie kan hemolyse optreden. Deze reactie is vaak dosisafhankelijk.
Infusiereacties
Lokale irritatie en ontsteking als gevolg van extravasculaire infiltratie van de infusie zijn waargenomen met BACTRIM. Als deze zich voordoen, moet de infusie worden stopgezet en op een andere plaats opnieuw worden gestart.
Hypoglykemie
Er zijn gevallen van hypoglykemie waargenomen bij niet-diabetische patiënten die werden behandeld met BACTRIM 400 mg, gewoonlijk optredend na een paar dagen therapie. Patiënten met nierdisfunctie, leverziekte, ondervoeding of patiënten die hoge doses BACTRIM 800 mg krijgen, lopen een bijzonder risico.
Verslechterd fenylalaninemetabolisme
Van trimethoprim, een bestanddeel van BACTRIM, is vastgesteld dat het het fenylalaninemetabolisme verslechtert, maar dit is niet van belang bij patiënten met fenylketonurie die de juiste dieetbeperkingen ondergaan.

Porfyrie en hypothyreoïdie
Net als andere geneesmiddelen die sulfonamiden bevatten, kan BACTRIM een porfyriecrisis en hypothyreoïdie veroorzaken. Vermijd het gebruik van BACTRIM bij patiënten met porfyrie of schildklierdisfunctie.
Potentieel risico bij de behandeling van Pneumocystis jirovecii Longontsteking bij patiënten met verworven immunodeficiëntiesyndroom (AIDS)
Het is mogelijk dat AIDS-patiënten BACTRIM niet op dezelfde manier verdragen of erop reageren als niet-AIDS-patiënten. Er is gemeld dat de incidentie van bijwerkingen, met name huiduitslag, koorts, leukopenie en verhoogde aminotransferase (transaminase) waarden, bij behandeling met BACTRIM bij AIDS-patiënten die worden behandeld voor Pneumocystis jirovecii-pneumonie sterk is toegenomen vergeleken met de incidentie die normaal wordt geassocieerd met de gebruik van BACTRIM 800 mg bij niet-aidspatiënten. Als een patiënt huiduitslag of enig teken van een bijwerking ontwikkelt, moet de behandeling met BACTRIM opnieuw worden geëvalueerd [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Vermijd gelijktijdige toediening van BACTRIM 80 mg en leucovorine tijdens de behandeling van Pneumocystis jirovecii-pneumonie (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Elektrolytafwijkingen
Een hoge dosis trimethoprim, zoals gebruikt bij patiënten met P. jirovecii-pneumonie, veroorzaakt bij een aanzienlijk aantal patiënten een progressieve maar omkeerbare verhoging van de serumkaliumconcentraties. Zelfs behandeling met aanbevolen doses kan hyperkaliëmie veroorzaken wanneer trimethoprim wordt toegediend aan patiënten met onderliggende stoornissen van het kaliummetabolisme, met nierinsufficiëntie, of als gelijktijdig geneesmiddelen worden gegeven waarvan bekend is dat ze hyperkaliëmie veroorzaken. Bij deze patiënten is nauwgezette controle van het serumkalium noodzakelijk.
Ernstige en symptomatische hyponatriëmie kan optreden bij patiënten die BACTRIM 800 mg krijgen, met name voor de behandeling van P. jirovecii-pneumonie. Evaluatie van hyponatriëmie en passende correctie is noodzakelijk bij symptomatische patiënten om levensbedreigende complicaties te voorkomen.
Zorg tijdens de behandeling voor voldoende vochtinname en urineproductie om kristalurie te voorkomen. Patiënten die "langzame acetyleerders" zijn, kunnen meer vatbaar zijn voor idiosyncratische reacties op sulfonamiden.
Monitoring van laboratoriumtests
Bij patiënten die BACTRIM krijgen, moet vaak een volledig bloedbeeld worden uitgevoerd. Stop met BACTRIM 800 mg als een significante vermindering van het aantal gevormde bloedelementen wordt opgemerkt. Voer urineanalyses uit met zorgvuldig microscopisch onderzoek en nierfunctietesten tijdens de therapie, vooral bij patiënten met een verminderde nierfunctie.
Ontwikkeling van geneesmiddelresistente bacteriën
Het voorschrijven van BACTRIM bij afwezigheid van een bewezen of sterk vermoede bacteriële infectie of een profylactische indicatie zal de patiënt waarschijnlijk geen voordeel opleveren en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Sulfamethoxazol was niet carcinogeen bij beoordeling in een 26 weken durende tumorverwekkende muis (Tg-rasH2) studie bij doses tot 400 mg/kg/dag sulfamethoxazol; equivalent aan het 2-voudige van de systemische blootstelling bij de mens (bij een dagelijkse dosis van 800 mg sulfamethoxazol tweemaal daags (tweemaal per dag).
Mutagenese
In vitro reverse-mutatie-bacteriële tests volgens het standaardprotocol zijn niet uitgevoerd met sulfamethoxazol en trimethoprim in combinatie. Een in vitro chromosoomafwijkingstest in humane lymfocyten met sulfamethoxazol/trimethoprim was negatief. In in-vitro- en in-vivotests bij diersoorten beschadigde sulfamethoxazol/trimethoprim de chromosomen niet. In vivo micronucleus-assays waren positief na orale toediening van sulfamethoxazol/trimethoprim. Waarnemingen van leukocyten verkregen van patiënten die werden behandeld met sulfamethoxazol en trimethoprim lieten geen chromosomale afwijkingen zien.
Sulfamethoxazol alleen was positief in een in vitro bacterietest met omgekeerde mutatie en in in vitro micronucleustests met behulp van gekweekte menselijke lymfocyten.
Trimethoprim alleen was negatief in in vitro bacterietesten met omgekeerde mutatie en in in vitro chromosomale aberratietesten met eierstok- of longcellen van Chinese hamsters met of zonder S9-activering. In in vitro Comet-, micronucleus- en chromosomale schade-assays met behulp van gekweekte menselijke lymfocyten, was trimethoprim positief. Bij muizen werd na orale toediening van trimethoprim geen DNA-schade in Comet-assays van lever, nier, long, milt of beenmerg geregistreerd.
Aantasting van de vruchtbaarheid
Er werden geen nadelige effecten op de vruchtbaarheid of de algemene reproductieve prestatie waargenomen bij ratten die orale doseringen kregen van wel 350 mg/kg/dag sulfamethoxazol plus 70 mg/kg/dag trimethoprim, doses die ongeveer twee keer de aanbevolen dagelijkse dosis voor de mens waren op basis van het lichaamsoppervlak. .
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
BACTRIM kan schade aan de foetus veroorzaken als het wordt toegediend aan een zwangere vrouw. Sommige epidemiologische onderzoeken suggereren dat blootstelling aan BACTRIM 400 mg tijdens de zwangerschap gepaard kan gaan met een verhoogd risico op aangeboren afwijkingen, met name neurale buisdefecten, cardiovasculaire afwijkingen, urinewegdefecten, mondspleten en klompvoet (zie Menselijke gegevens ).
Een van de 3 onderzoeken bij ratten toonde een gespleten gehemelte aan bij doses die ongeveer 5 keer de aanbevolen dosis voor de mens waren op basis van het lichaamsoppervlak; de andere 2 onderzoeken lieten geen teratogeniteit zien bij vergelijkbare doses. Studies bij drachtige konijnen lieten een toegenomen foetaal verlies zien bij ongeveer 6 maal de dosis voor de mens op basis van het lichaamsoppervlak (zie: Dierlijke gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen voor de aangegeven populatie is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%. Adviseer zwangere vrouwen over de mogelijke schade van BACTRIM 400 mg voor de foetus (zie: Klinische overwegingen ).
Klinische overwegingen
Ziekte-geassocieerd maternale en/of embryo-/foetale risico
Urineweginfectie tijdens de zwangerschap is geassocieerd met nadelige perinatale uitkomsten zoals vroeggeboorte, laag geboortegewicht en pre-eclampsie, en verhoogde mortaliteit bij de zwangere vrouw. P. jirovecii-pneumonie tijdens de zwangerschap wordt geassocieerd met vroeggeboorte en verhoogde morbiditeit en mortaliteit voor de zwangere vrouw. BACTRIM mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Gegevens
Menselijke gegevens
Hoewel er geen grote, prospectieve, goed gecontroleerde onderzoeken zijn bij zwangere vrouwen en hun baby's, suggereren sommige retrospectieve epidemiologische onderzoeken een verband tussen blootstelling aan BACTRIM 80 mg in het eerste trimester en een verhoogd risico op aangeboren afwijkingen, met name neurale buisdefecten, cardiovasculaire afwijkingen, kanaaldefecten, mondspleten en klompvoet. Deze studies werden echter beperkt door het kleine aantal blootgestelde gevallen en het gebrek aan correctie voor meerdere statistische vergelijkingen en confounders. Deze onderzoeken worden verder beperkt door vooroordelen over herinnering, selectie en informatie, en door beperkte generaliseerbaarheid van hun bevindingen. Ten slotte varieerden de uitkomstmaten tussen studies, waardoor vergelijkingen tussen verschillende studies werden beperkt. Als alternatief hebben andere epidemiologische onderzoeken geen statistisch significante associaties gevonden tussen blootstelling aan BACTRIM 160 mg en specifieke misvormingen. Brumfitt en Pursell10 rapporteerden in een retrospectief onderzoek de uitkomst van 186 zwangerschappen waarbij de moeder ofwel placebo ofwel oraal trimethoprim en sulfamethoxazol kreeg. De incidentie van aangeboren afwijkingen was 4,5% (3 van de 66) bij degenen die placebo kregen en 3,3% (4 van de 120) bij degenen die trimethoprim en sulfamethoxazol kregen. Er waren geen afwijkingen bij de 10 kinderen van wie de moeder het medicijn kreeg tijdens het eerste trimester. In een afzonderlijk onderzoek vonden Brumfitt en Pursell ook geen aangeboren afwijkingen bij 35 kinderen van wie de moeder oraal trimethoprim en sulfamethoxazol had gekregen op het moment van conceptie of kort daarna.
Dierlijke gegevens
Bij ratten veroorzaakten orale doses van ofwel 533 mg/kg sulfamethoxazol of 200 mg/kg trimethoprim teratologische effecten die zich voornamelijk manifesteerden als gespleten gehemelte. Deze doses zijn ongeveer 5 en 6 maal de aanbevolen totale dagelijkse dosis voor de mens op basis van het lichaamsoppervlak. In twee studies bij ratten werd geen teratologie waargenomen bij gebruik van 512 mg/kg sulfamethoxazol in combinatie met 128 mg/kg trimethoprim. In sommige onderzoeken bij konijnen werd een algehele toename van foetaal verlies (dood en geresorbeerd conceptus) geassocieerd met doses trimethoprim die zesmaal de therapeutische dosis voor de mens waren, gebaseerd op het lichaamsoppervlak.
Borstvoeding
Risico Samenvatting
Niveaus van BACTRIM in moedermelk zijn ongeveer 2 tot 5% van de aanbevolen dagelijkse dosis voor pediatrische patiënten ouder dan twee maanden. Er is geen informatie over het effect van BACTRIM op de zuigeling die borstvoeding krijgt of het effect op de melkproductie. Vanwege het potentiële risico op verplaatsing van bilirubine en kernicterus bij het kind dat borstvoeding krijgt [zie: CONTRA-INDICATIES ], adviseren vrouwen om borstvoeding te vermijden tijdens de behandeling met BACTRIM.
Pediatrisch gebruik
BACTRIM is gecontra-indiceerd bij pediatrische patiënten jonger dan twee maanden vanwege het mogelijke risico op bilirubineverdringing en kernicterus (zie CONTRA-INDICATIES ].
Ernstige bijwerkingen, waaronder fatale reacties en het "hijgsyndroom" kwamen voor bij premature pasgeborenen en zuigelingen met een laag geboortegewicht op de neonatale intensive care die benzylalcohol kregen als conserveermiddel in infusieoplossingen. In deze gevallen produceerden benzylalcoholdoseringen van 99 tot 234 mg/kg/dag hoge niveaus van benzylalcohol en zijn metabolieten in het bloed en de urine (bloedwaarden van benzylalcohol waren 0,61 tot 1,378 mmol/l). Bijkomende bijwerkingen waren onder meer geleidelijke neurologische achteruitgang, toevallen, intracraniële bloeding, hematologische afwijkingen, huidafbraak, lever- en nierfalen, hypotensie, bradycardie en cardiovasculaire collaps. Premature baby's met een laag geboortegewicht hebben meer kans om deze reacties te ontwikkelen, omdat ze mogelijk minder goed in staat zijn om benzylalcohol te metaboliseren.
Houd bij het voorschrijven van BACTRIM 800 mg aan pediatrische patiënten rekening met de gecombineerde dagelijkse metabole belasting van benzylalcohol uit alle bronnen, inclusief BACTRIM (BACTRIM 160 mg bevat 10 mg benzylalcohol per ml) en andere geneesmiddelen die benzylalcohol bevatten. De minimale hoeveelheid benzylalcohol waarbij ernstige bijwerkingen kunnen optreden, is niet bekend [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Geriatrisch gebruik
Klinische onderzoeken met BACTRIM omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen.
Er kan een verhoogd risico zijn op ernstige bijwerkingen bij oudere patiënten, vooral wanneer er sprake is van complicerende aandoeningen, bijv. verminderde nier- en/of leverfunctie, of gelijktijdig gebruik van andere geneesmiddelen. Ernstige huidreacties, gegeneraliseerde beenmergsuppressie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , ONGEWENSTE REACTIES ], een specifieke afname van het aantal bloedplaatjes (met of zonder purpura) en hyperkaliëmie zijn de meest gemelde ernstige bijwerkingen bij oudere patiënten.
Bij degenen die gelijktijdig bepaalde diuretica kregen, voornamelijk thiaziden, is een verhoogde incidentie van trombocytopenie met purpura gemeld. Verhoogde bloedspiegels van digoxine kunnen optreden bij gelijktijdige behandeling met BACTRIM 80 mg, vooral bij oudere patiënten. Serumdigoxinespiegels moeten worden gecontroleerd [zie DRUG-INTERACTIES ].
Bij oudere patiënten kunnen hematologische veranderingen optreden die wijzen op foliumzuurdeficiëntie. Deze effecten zijn omkeerbaar door folinezuurtherapie. Bij patiënten met een verminderde nierfunctie moeten de juiste doseringsaanpassingen worden gedaan en de gebruiksduur moet zo kort mogelijk zijn om het risico op ongewenste reacties te minimaliseren [zie DOSERING EN ADMINISTRATIE ].
De trimethoprim-component van BACTRIM kan hyperkaliëmie veroorzaken wanneer het wordt toegediend aan patiënten met onderliggende stoornissen van het kaliummetabolisme, met nierinsufficiëntie of wanneer het gelijktijdig wordt gegeven met geneesmiddelen waarvan bekend is dat ze hyperkaliëmie induceren, zoals angiotensineconverterende enzymremmers. Bij deze patiënten is nauwgezette controle van het serumkalium noodzakelijk. Stopzetting van de behandeling met BACTRIM 160 mg wordt aanbevolen om de kaliumserumspiegels te helpen verlagen.
De farmacokinetische parameters voor sulfamethoxazol waren vergelijkbaar voor geriatrische proefpersonen en jongere volwassen proefpersonen. De gemiddelde maximale trimethoprim-serumconcentratie was hoger en de gemiddelde renale klaring van trimethoprim was lager bij geriatrische proefpersonen in vergelijking met jongere proefpersonen [zie KLINISCHE FARMACOLOGIE ].
REFERENTIES
4. Safrin S, Lee BL, Sande MA. Aanvullende folinezuur met trimethoprim-sulfamethoxazol voor Pneumocystis carinii-pneumonie bij AIDS-patiënten is geassocieerd met een verhoogd risico op therapeutisch falen en overlijden. J Infecteren Dis. Okt 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Trimethoprim/Sulfamethoxazol bij de behandeling van bacteriurie bij vrouwen. J Infecteren Dis. Nov 1973; 128 (Suppl): S657-S663.
OVERDOSERING
acuut
Aangezien er geen uitgebreide ervaring is bij mensen met enkelvoudige doses BACTRIM 160 mg van meer dan 25 ml (400 mg trimethoprim en 2000 mg sulfamethoxazol), is de maximaal getolereerde dosis bij de mens onbekend.
Tekenen en symptomen van overdosering gemeld met sulfonamiden zijn onder meer anorexia, koliek, misselijkheid, braken, duizeligheid, hoofdpijn, slaperigheid en bewusteloosheid. Pyrexie, hematurie en kristalurie kunnen worden opgemerkt. Bloeddyscrasieën en geelzucht zijn mogelijke late manifestaties van overdosering.
Tekenen van acute overdosering met trimethoprim zijn misselijkheid, braken, duizeligheid, hoofdpijn, mentale depressie, verwardheid en beenmergdepressie.
Algemene behandelingsprincipes omvatten de toediening van intraveneuze vloeistoffen als de urineproductie laag is en de nierfunctie normaal is. Verzuring van de urine zal de renale eliminatie van trimethoprim verhogen. De patiënt moet worden gecontroleerd met bloedtellingen en geschikte bloedchemie, inclusief elektrolyten. Als er een significante bloeddyscrasie of geelzucht optreedt, moet voor deze complicaties een specifieke therapie worden ingesteld. Peritoneale dialyse is niet effectief en hemodialyse is slechts matig effectief bij het elimineren van trimethoprim en sulfamethoxazol.
chronisch
Gebruik van BACTRIM 800 mg in hoge doses en/of gedurende langere tijd kan beenmergdepressie veroorzaken die zich manifesteert als trombocytopenie, leukopenie en/of megaloblastaire anemie. Als er tekenen van beenmergdepressie optreden, moet de patiënt leucovorine 5 tot 15 mg per dag krijgen totdat de normale hematopoëse is hersteld.
CONTRA-INDICATIES
BACTRIM is gecontra-indiceerd in de volgende gevallen:
- Bekende overgevoeligheid voor trimethoprim of sulfonamiden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Geschiedenis van door geneesmiddelen geïnduceerde immuuntrombocytopenie bij gebruik van trimethoprim en/of sulfonamiden [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Patiënten met gedocumenteerde megaloblastaire anemie als gevolg van folaatdeficiëntie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Pediatrische patiënten jonger dan twee maanden [zie Gebruik bij specifieke populaties ]
- Duidelijke leverbeschadiging [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Ernstige nierinsufficiëntie wanneer de nierfunctiestatus niet kan worden gecontroleerd [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Gelijktijdige toediening met dofetilide2,3 [zie DRUG-INTERACTIES ]
REFERENTIES
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Wat clinici moeten weten over het QT-interval. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Ooievaar C, Wang RY. Review: de farmacologie en toxicologie van dofetilide. Int J Med Toxicol. 2001;4(2):16.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
BACTRIM is een antimicrobieel middel [zie Microbiologie ].
Farmacokinetiek
Na een 1 uur durende intraveneuze infusie van een enkele dosis van 160 mg trimethoprim en 800 mg sulfamethoxazol bij 11 patiënten met een gewicht van 105 lbs tot 165 lbs (gemiddeld 143 lbs), waren de piekplasmaconcentraties van trimethoprim en sulfamethoxazol 3,4 ± 0,3 respectievelijk μg/ml en 46,3 ± 2,7 g/ml. Na herhaalde intraveneuze toediening van dezelfde dosis met tussenpozen van 8 uur waren de gemiddelde plasmaconcentraties vlak voor en onmiddellijk na elke infusie bij steady state 5,6 ± 0,6 g/ml en 8,8 ± 0,9 g/ml voor trimethoprim en 70,6 ± 7,3 g /ml en 105,6 ± 10,9 g/ml voor sulfamethoxazol. De gemiddelde plasmahalfwaardetijd was 11,3 ± 0,7 uur voor trimethoprim en 12,8 ± 1,8 uur voor sulfamethoxazol. Al deze 11 patiënten hadden een normale nierfunctie en hun leeftijd varieerde van 17 tot 78 jaar (mediaan 60 jaar).11
Farmacokinetische studies bij kinderen en volwassenen suggereren een leeftijdsafhankelijke halfwaardetijd van trimethoprim, zoals aangegeven in tabel 5.12
Patiënten met een ernstig gestoorde nierfunctie vertonen een toename van de halfwaardetijden van beide componenten, waardoor aanpassing van het doseringsschema nodig is [zie: DOSERING EN ADMINISTRATIE ].
Verdeling
Zowel trimethoprim als sulfamethoxazol komen in het bloed voor als ongebonden, eiwitgebonden en gemetaboliseerde vormen; sulfamethoxazol bestaat ook als de geconjugeerde vorm.
Ongeveer 44% van trimethoprim en 70% van sulfamethoxazol is gebonden aan plasma-eiwitten. De aanwezigheid van 10 mg procent sulfamethoxazol in plasma vermindert de eiwitbinding van trimethoprim in een onbeduidende mate; trimethoprim heeft geen invloed op de eiwitbinding van sulfamethoxazol.
Zowel trimethoprim als sulfamethoxazol verspreiden zich naar sputum en vaginaal vocht; trimethoprim wordt ook gedistribueerd naar bronchiale secreties, en beide passeren de placentabarrière en worden uitgescheiden in de moedermelk.
Eliminatie
Metabolisme
Sulfamethoxazol wordt bij mensen gemetaboliseerd tot ten minste 5 metabolieten: de N4-acetyl-, N4-hydroxy-, 5methylhydroxy-, N4-acetyl-5-methylhydroxy-sulfamethoxazol-metabolieten en een N-glucuronideconjugaat. De vorming van N4-hydroxymetaboliet wordt gemedieerd via CYP2C9.
Trimethoprim wordt in vitro gemetaboliseerd tot 11 verschillende metabolieten, waarvan vijf glutathionadducten en zes oxidatieve metabolieten, waaronder de belangrijkste metabolieten, 1- en 3-oxiden en de 3- en 4-hydroxyderivaten.
De vrije vormen van trimethoprim en sulfamethoxazol worden beschouwd als de therapeutisch actieve vormen. In vitro-onderzoeken suggereren dat trimethoprim een substraat is van P-glycoproteïne, OCT1 en OCT2 en dat sulfamethoxazol geen substraat is van P-glycoproteïne.
uitscheiding
De uitscheiding van trimethoprim en sulfamethoxazol vindt voornamelijk plaats door de nieren via zowel glomerulaire filtratie als tubulaire secretie. De urineconcentraties van zowel trimethoprim als sulfamethoxazol zijn aanzienlijk hoger dan de concentraties in het bloed. Het percentage van de dosis dat werd uitgescheiden in de urine gedurende een periode van 12 uur na de intraveneuze toediening van de eerste dosis van 240 mg trimethoprim en 1200 mg sulfamethoxazol op dag 1 varieerde van 17% tot 42,4% als vrij trimethoprim; 7% tot 12,7% als vrij sulfamethoxazol; en 36,7% tot 56% als totaal (vrij plus de N4-geacetyleerde metaboliet) sulfamethoxazol. Bij gelijktijdige toediening als BACTRIM 400 mg, heeft noch trimethoprim noch sulfamethoxazol invloed op het urinaire excretiepatroon van de ander.
Specifieke populaties
Geriatrische patiënten
De farmacokinetiek van sulfamethoxazol 800 mg en trimethoprim 160 mg werd onderzocht bij zes geriatrische proefpersonen (gemiddelde leeftijd: 78,6 jaar) en zes jonge gezonde proefpersonen (gemiddelde leeftijd: 29,3 jaar) met behulp van een niet in de VS goedgekeurde formulering. De farmacokinetische waarden voor sulfamethoxazol bij geriatrische proefpersonen waren vergelijkbaar met die waargenomen bij jongvolwassen proefpersonen. De gemiddelde renale klaring van trimethoprim was significant lager bij geriatrische proefpersonen in vergelijking met jonge volwassen proefpersonen (19 ml/u/kg vs. 55 ml/u/kg). Na normalisatie op lichaamsgewicht was de schijnbare totale lichaamsklaring van trimethoprim echter gemiddeld 19% lager bij geriatrische proefpersonen in vergelijking met jongvolwassen proefpersonen.
Microbiologie
Werkingsmechanisme
Sulfamethoxazol remt de bacteriële synthese van dihydrofoliumzuur door te concurreren met para-aminobenzoëzuur (PABA). Trimethoprim blokkeert de productie van tetrahydrofoliumzuur uit dihydrofoliumzuur door binding aan en reversibele remming van het vereiste enzym, dihydrofolaatreductase. Sulfamethoxazol en trimethoprim blokkeren dus twee opeenvolgende stappen in de biosynthese van nucleïnezuren en eiwitten die essentieel zijn voor veel bacteriën.
Weerstand
In vitro-onderzoeken hebben aangetoond dat bacteriële resistentie zich langzamer ontwikkelt met zowel sulfamethoxazol als trimethoprim in combinatie dan met sulfamethoxazol of trimethoprim alleen.
Antimicrobiale activiteit
Van BACTRIM is aangetoond dat het actief is tegen de meeste isolaten van de volgende micro-organismen, zowel in vitro als bij klinische infecties [zie AANWIJZINGEN EN GEBRUIK ].
Aerobe Gram-negatieve bacteriën
Escherichia coliKlebsiella speciesEnterobacter speciesMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Andere micro-organismen
Pneumocystis jirovecii
De volgende in vitro gegevens zijn beschikbaar, maar hun klinische betekenis is niet bekend. Ten minste 90 procent van de volgende bacteriën vertoont een in vitro minimale remmende concentratie (MIC) die kleiner is dan of gelijk is aan het gevoelige breekpunt voor BACTRIM 160 mg tegen isolaten van een vergelijkbaar geslacht of een vergelijkbare organismegroep. De werkzaamheid van BACTRIM 400 mg bij de behandeling van klinische infecties veroorzaakt door deze bacteriën is echter niet vastgesteld in adequate en goed gecontroleerde klinische onderzoeken.
Aerobe grampositieve bacteriën
Streptococcus pneumoniae
Aerobe Gram-negatieve bacteriën
Haemophilus influenzae
Gevoeligheidstesten
Zie https://www.fda.gov/STIC voor specifieke informatie over interpretatieve criteria voor gevoeligheidstests en bijbehorende testmethoden en kwaliteitscontrolenormen die door de FDA zijn erkend voor dit medicijn.
REFERENTIES
11. Grose WE, Bodey GP, Loo TL. Klinische farmacologie van intraveneus toegediend trimethoprim-sulfamethoxazol. Antimicrob-middelen Chemother. maart 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Farmacologie van intraveneus trimethoprim-sulfamethoxazol bij kinderen en volwassenen. Huidige chemotherapie en infectieziekten. American Society for Microbiology, Washington, DC 1980; Vol. 1, blz. 691-692.
PATIËNT INFORMATIE
Embryo foetale toxiciteit
Adviseer vrouwelijke patiënten met voortplantingsvermogen dat BACTRIM schade aan de foetus kan veroorzaken en informeer hun zorgverlener over een bekende of vermoede zwangerschap [zie Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen die borstvoeding geven borstvoeding te vermijden tijdens de behandeling met BACTRIM.
Antibacteriële resistentie
Adviseer patiënten dat antibacteriële geneesmiddelen, waaronder BACTRIM, alleen mogen worden gebruikt om bacteriële infecties te behandelen. Het behandelt geen virale infecties (bijv. verkoudheid).
Instrueer patiënten om voldoende vocht in te nemen om kristalurie en steenvorming te voorkomen.
Diarree
Adviseer patiënten dat diarree een veelvoorkomend probleem is dat wordt veroorzaakt door antibiotica en dat meestal stopt wanneer het antibioticum wordt stopgezet. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting ontwikkelen (met of zonder maagkrampen en koorts), zelfs pas twee of meer maanden nadat ze de laatste dosis van het antibioticum hebben ingenomen. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
