Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zocor en hoe wordt het gebruikt?
Zocor (simvastatine) is een receptgeneesmiddel dat wordt gebruikt om het 'slechte' cholesterolgehalte (lipoproteïne met lage dichtheid of LDL) te verlagen en het gehalte aan 'goed' cholesterol (lipoproteïne met hoge dichtheid of HDL) te verhogen en om triglycerine te verlagen, het risico op beroerte en hartaanvallen verminderen. Zocor kan alleen of in combinatie met andere medicijnen worden gebruikt.
Zocor behoort tot een klasse geneesmiddelen die lipidenverlagende middelen, statines en HMG-CoA-reductaseremmers worden genoemd.
Het is niet bekend of Zocor veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat zijn mogelijke bijwerkingen van Zocor?
Zocor 20 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- verlies van eetlust,
- maagpijn rechtsboven,
- vermoeidheid,
- jeuk,
- donkere urine,
- kleikleurige ontlasting, en
- geel worden van de huid of ogen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zocor zijn:
- hoofdpijn,
- misselijkheid,
- buikpijn,
- constipatie, en
- verkoudheidsverschijnselen (verstopte neus, niezen of keelpijn)
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zocor. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
ZOCOR (simvastatine) is een lipidenverlagend middel dat synthetisch is afgeleid van een fermentatieproduct van Aspergillus terreus. Na orale inname wordt simvastatine, een inactief lacton, gehydrolyseerd tot de overeenkomstige β-hydroxyzuurvorm. Dit is een remmer van 3-hydroxy-3-methylglutaryl-co-enzym A (HMG-CoA)-reductase. Dit enzym katalyseert de omzetting van HMG-CoA in mevalonaat, wat een vroege en snelheidsbepalende stap is in de biosynthese van cholesterol.
Simvastatine is butaanzuur, 2,2-dimethyl-,1,2,3,7,8,8a-hexahydro-3,7-dimethyl-8-[2-(tetrahydro-4hydroxy-6-oxo-2H-pyran- 2-yl)-ethyl]-1-naftalenylester, [1S-[1α,3α,7β,8β(2S*,4S*),-8aβ]]. De empirische formule van simvastatine is C25H38O5 en het molecuulgewicht is 418,57. De structuurformule is:
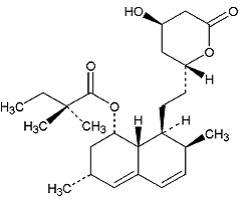
Simvastatine is een wit tot gebroken wit, niet-hygroscopisch, kristallijn poeder dat praktisch onoplosbaar is in water en vrij oplosbaar is in chloroform, methanol en ethanol.
Tabletten ZOCOR voor orale toediening bevatten 5 mg, 10 mg, 20 mg, 40 mg of 80 mg simvastatine en de volgende inactieve ingrediënten: ascorbinezuur, citroenzuur, hydroxypropylcellulose, hypromellose, ijzeroxiden, lactose, magnesiumstearaat, microkristallijne cellulose , zetmeel, talk en titaandioxide. Gebutyleerd hydroxyanisol wordt toegevoegd als conserveermiddel.
INDICATIES
Therapie met lipidenveranderende middelen zou slechts één onderdeel moeten zijn van interventie met meerdere risicofactoren bij personen met een significant verhoogd risico op atherosclerotische vaatziekte als gevolg van hypercholesterolemie. Medicamenteuze therapie is geïndiceerd als aanvulling op een dieet wanneer de respons op een dieet met een beperkt gehalte aan verzadigd vet en cholesterol en andere niet-farmacologische maatregelen alleen onvoldoende is geweest. Bij patiënten met coronaire hartziekte (CHD) of met een hoog risico op CHD kan ZOCOR® gelijktijdig met een dieet worden gestart.
Vermindering van het risico op CHD-sterfte en cardiovasculaire gebeurtenissen
Bij patiënten met een hoog risico op coronaire aandoeningen vanwege bestaande coronaire hartziekte, diabetes, perifere vaatziekte, voorgeschiedenis van een beroerte of andere cerebrovasculaire ziekte, is ZOCOR 5 mg geïndiceerd voor:
- Verminder het risico van totale mortaliteit door CHD-sterfgevallen te verminderen.
- Verminder het risico op niet-fataal myocardinfarct en beroerte.
- Verminder de noodzaak van coronaire en niet-coronaire revascularisatieprocedures.
Hyperlipidemie
ZOCOR is geïndiceerd voor:
- Vermindering van verhoogd totaal cholesterol (total-C), low-density lipoproteïne-cholesterol (LDL-C), apolipoproteïne B (Apo B) en triglyceriden (TG), en verhoging van high-density lipoproteïne-cholesterol (HDL-C) bij patiënten met primaire hyperlipidemie (Fredrickson type IIa, heterozygoot familiaal en niet-familiaal) of gemengde dyslipidemie (Fredrickson type IIb).
- Verminder verhoogde TG bij patiënten met hypertriglyceridemie (Fredrickson type IV hyperlipidemie).
- Vermindering van verhoogde TG en VLDL-C bij patiënten met primaire dysbetalipoproteïnemie (Fredrickson type III hyperlipidemie).
- Verminder totaal-C en LDL-C bij patiënten met homozygote familiaire hypercholesterolemie (HoFH) als aanvulling op andere lipidenverlagende behandelingen (bijv. LDL-aferese) of als dergelijke behandelingen niet beschikbaar zijn.
Adolescente patiënten met heterozygote familiaire hypercholesterolemie (HeFH)
ZOCOR is geïndiceerd als aanvulling op een dieet om de totale C-, LDL-C- en Apo B-spiegels te verlagen bij adolescente jongens en meisjes die ten minste één jaar postmenarchaal zijn, 10-17 jaar oud, met HeFH, indien na een adequate proef van dieettherapie de volgende bevindingen zijn aanwezig:
- Er is een positieve familiegeschiedenis van premature hart- en vaatziekten (CVD) of
- Twee of meer andere cardiovasculaire risicofactoren zijn aanwezig bij de adolescente patiënt.
Het minimale doel van de behandeling bij pediatrische en adolescente patiënten is het bereiken van een gemiddelde LDL-C
Beperkingen van gebruik
ZOCOR 20 mg is niet onderzocht bij aandoeningen waarbij de belangrijkste afwijking een verhoging van chylomicronen is (dwz hyperlipidemie Fredrickson type I en V).
DOSERING EN ADMINISTRATIE
Aanbevolen dosering
Het gebruikelijke doseringsbereik is 5 tot 40 mg/dag. Bij patiënten met CHD of met een hoog risico op CHD kan ZOCOR gelijktijdig met een dieet worden gestart. De aanbevolen gebruikelijke startdosering is 10 of 20 mg eenmaal daags 's avonds. Voor patiënten met een hoog risico op een CHD als gevolg van bestaande CHD, diabetes, perifere vaatziekte, een voorgeschiedenis van een beroerte of een andere cerebrovasculaire aandoening, is de aanbevolen startdosering 40 mg/dag. Lipidebepalingen moeten worden uitgevoerd na 4 weken therapie en daarna periodiek.
Beperkte dosering voor 80 mg
Vanwege het verhoogde risico op myopathie, waaronder rabdomyolyse, met name tijdens het eerste jaar van de behandeling, moet het gebruik van de dosis van 80 mg ZOCOR worden beperkt tot patiënten die simvastatine 80 mg chronisch gebruiken (bijv. gedurende 12 maanden of langer). zonder bewijs van spiertoxiciteit [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Patiënten die momenteel de 80 mg-dosis ZOCOR verdragen en die moeten worden gestart met een interactief geneesmiddel dat gecontra-indiceerd is of is geassocieerd met een dosislimiet voor simvastatine, moeten worden overgezet naar een alternatieve statine met minder kans op interactie tussen geneesmiddelen.
Vanwege het verhoogde risico op myopathie, waaronder rabdomyolyse, geassocieerd met de dosis van 80 mg ZOCOR 40 mg, mogen patiënten die hun LDL-C-doel niet kunnen bereiken met de dosis van 40 mg ZOCOR 5 mg niet worden getitreerd tot de dosis van 80 mg , maar moet op alternatieve LDL-C-verlagende behandeling(en) worden geplaatst die een grotere LDL-C-verlaging geven.
Gelijktijdige toediening met andere geneesmiddelen
Patiënten die verapamil, diltiazem of dronedarone gebruiken
- De dosis ZOCOR mag niet hoger zijn dan 10 mg / dag [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
Patiënten die amiodaron, amlodipine of ranolazine gebruiken
- De dosis ZOCOR 10 mg mag niet hoger zijn dan 20 mg/dag [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES , en KLINISCHE FARMACOLOGIE ].
Patiënten met homozygote familiaire hypercholesterolemie
De aanbevolen dosering is 40 mg/dag 's avonds [Zie DOSERING EN ADMINISTRATIE , Beperkte dosering voor 80 mg ]. ZOCOR 5 mg moet bij deze patiënten worden gebruikt als aanvulling op andere lipidenverlagende behandelingen (bijv. LDL-aferese) of als dergelijke behandelingen niet beschikbaar zijn.
Blootstelling aan simvastatine wordt ongeveer verdubbeld bij gelijktijdig gebruik van lomitapide; daarom moet de dosis ZOCOR met 50% worden verlaagd als lomitapide wordt gestart. De dosering van ZOCOR 5 mg mag niet hoger zijn dan 20 mg/dag (of 40 mg/dag voor patiënten die eerder ZOCOR 80 mg/dag chronisch hebben gebruikt, bijv. gedurende 12 maanden of langer, zonder bewijs van spiertoxiciteit) tijdens het gebruik van lomitapide.
Adolescenten (10-17 jaar) met heterozygote familiaire hypercholesterolemie
De aanbevolen gebruikelijke startdosering is eenmaal daags 10 mg 's avonds. Het aanbevolen doseringsbereik is 10 tot 40 mg/dag; de maximale aanbevolen dosis is 40 mg/dag. Doses moeten worden aangepast aan het aanbevolen doel van de therapie [zie: Richtlijnen NCEP Pediatric Panel1 en Klinische studies ]. Aanpassingen moeten worden gemaakt met tussenpozen van 4 weken of meer.
Patiënten met nierinsufficiëntie
Omdat ZOCOR 5 mg geen significante renale excretie ondergaat, zou aanpassing van de dosering niet nodig moeten zijn bij patiënten met lichte tot matige nierinsufficiëntie. Voorzichtigheid is echter geboden wanneer ZOCOR 20 mg wordt toegediend aan patiënten met een ernstige nierfunctiestoornis; dergelijke patiënten moeten worden gestart met 5 mg/dag en nauwlettend worden gevolgd [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
- Tabletten ZOCOR 5 mg zijn bleekgele, ovale, filmomhulde tabletten, gecodeerd MSD 726 aan de ene kant en ZOCOR 5 aan de andere.
- Tabletten ZOCOR 10 mg zijn perzikkleurige, ovale, filmomhulde tabletten, gecodeerd MSD 735 aan de ene kant en glad aan de andere kant.
- Tabletten ZOCOR 20 mg zijn lichtbruine, ovale, filmomhulde tabletten, gecodeerd met MSD 740 aan de ene kant en glad aan de andere kant.
- Tabletten ZOCOR 40 mg zijn steenrode, ovale, filmomhulde tabletten, aan de ene kant gecodeerd met MSD 749 en glad aan de andere kant.
- Tabletten ZOCOR 80 mg zijn steenrode, capsulevormige, filmomhulde tabletten, aan de ene kant gecodeerd met 543 en aan de andere kant met 80.
Opslag en behandeling
Nr. 8146 - Tabletten ZOCOR 10 mg zijn perzikkleurige, ovale, filmomhulde tabletten, gecodeerd MSD 735 aan de ene kant en glad aan de andere kant. Ze worden als volgt geleverd:
NDC 0006-0735-31 gebruikseenheid flessen van 30 NDC 0006-0735-54 gebruikseenheid flessen van 90.
Nr. 8147 - Tabletten ZOCOR 20 mg zijn geelbruine, ovale, filmomhulde tabletten, gecodeerd MSD 740 aan de ene kant en glad aan de andere kant. Ze worden als volgt geleverd:
NDC 0006-0740-31 gebruikseenheid flessen van 30 NDC 0006-0740-54 gebruikseenheid flessen van 90.
Nr. 8148 - Tabletten ZOCOR 40 mg zijn steenrode, ovale, filmomhulde tabletten, gecodeerd MSD 749 aan de ene kant en glad aan de andere kant. Ze worden als volgt geleverd:
NDC 0006-0749-31 gebruikseenheid flessen van 30 NDC 0006-0749-54 gebruikseenheid flessen van 90.
Nr. 6577 - Tabletten ZOCOR 80 mg zijn steenrode, capsulevormige, filmomhulde tabletten, gecodeerd 543 aan de ene kant en 80 aan de andere. Ze worden als volgt geleverd:
NDC 0006-0543-31 gebruikseenheid flessen van 30 NDC 0006-0543-54 gebruikseenheid flessen van 90.
Opslag
Bewaren tussen 5-30 ° C (41-86 ° F).
1 Nationaal Cholesteroleducatieprogramma (NCEP): Hoogtepunten van het rapport van het deskundigenpanel voor bloedcholesterolniveaus bij kinderen en adolescenten. Kindergeneeskunde. 89(3):495-501. 1992.
Gefabriceerd door: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, VK NE23 3JU. Herzien: september 2020
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
In de pre-marketing gecontroleerde klinische onderzoeken en hun open verlengingen (2.423 patiënten met een mediane follow-upduur van ongeveer 18 maanden), werd de behandeling van 1,4% van de patiënten stopgezet vanwege bijwerkingen. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren: gastro-intestinale stoornissen (0,5%), myalgie (0,1%) en artralgie (0,1%). De meest gemelde bijwerkingen (incidentie ≥ 5%) in gecontroleerde klinische onderzoeken met simvastatine waren: infecties van de bovenste luchtwegen (9,0%), hoofdpijn (7,4%), buikpijn (7,3%), constipatie (6,6%) en misselijkheid (5,4). %).
Scandinavisch simvastatine-overlevingsonderzoek
In 4S met 4.444 (leeftijdsbereik 35-71 jaar, 19% vrouwen, 100% blanken) behandeld met 20-40 mg/dag ZOCOR (n=2.221) of placebo (n=2.223) gedurende een mediaan van 5,4 jaar, reacties gemeld bij ≥ 2% van de patiënten en met een snelheid groter dan bij placebo worden weergegeven in tabel 2.
Onderzoek naar hartbescherming
In de Heart Protection Study (HPS), waarbij 20.536 patiënten betrokken waren (leeftijdscategorie 40-80 jaar, 25% vrouwen, 97% blanken, 3% andere rassen) behandeld met ZOCOR 40 mg/dag (n=10.269) of placebo (n= 10.267) over een gemiddelde van 5 jaar werden alleen ernstige bijwerkingen en stopzettingen als gevolg van bijwerkingen geregistreerd. Het percentage stopzettingen als gevolg van bijwerkingen was 4,8% bij patiënten die werden behandeld met ZOCOR 10 mg, vergeleken met 5,1% bij patiënten die werden behandeld met placebo. De incidentie van myopathie/rabdomyolyse was
Andere klinische onderzoeken
In een klinische studie waarin 12.064 patiënten met een voorgeschiedenis van een myocardinfarct werden behandeld met ZOCOR (gemiddelde follow-up 6,7 jaar), werd de incidentie van myopathie (gedefinieerd als onverklaarde spierzwakte of pijn met een serumcreatinekinase [CK] >10 keer bovengrens van normaal [ULN]) bij patiënten die 80 mg/dag kregen, was ongeveer 0,9% vergeleken met 0,02% voor patiënten die 20 mg/dag kregen. De incidentie van rabdomyolyse (gedefinieerd als myopathie met een CK >40 maal ULN) bij patiënten die 80 mg/dag kregen, was ongeveer 0,4% vergeleken met 0% voor patiënten die 20 mg/dag kregen. De incidentie van myopathie, waaronder rabdomyolyse, was het hoogst tijdens het eerste jaar en nam daarna aanzienlijk af tijdens de daaropvolgende jaren van behandeling. In dit onderzoek werden patiënten zorgvuldig gecontroleerd en werden sommige geneesmiddelen die een wisselwerking hadden, uitgesloten.
Andere bijwerkingen die in klinische onderzoeken zijn gemeld, waren: diarree, huiduitslag, dyspepsie, winderigheid en asthenie.
Laboratorium testen
Er zijn duidelijke aanhoudende verhogingen van levertransaminasen waargenomen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Verhoogde alkalische fosfatase en γ-glutamyltranspeptidase zijn ook gemeld. Ongeveer 5% van de patiënten had bij een of meer gelegenheden verhogingen van de CK-spiegels van 3 of meer keer de normale waarde. Dit was toe te schrijven aan de niet-cardiale fractie van CK. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Adolescente patiënten (leeftijd 10-17 jaar)
In een 48 weken durende, gecontroleerde studie bij adolescente jongens en meisjes die ten minste 1 jaar postmenarchaal waren, 10-17 jaar oud (43,4% vrouw, 97,7% blanken, 1,7% Iberiërs, 0,6% multiraciaal) met heterozygote familiale hypercholesterolemie (n=175), behandeld met placebo of ZOCOR (10-40 mg per dag), de meest voorkomende bijwerkingen die in beide groepen werden waargenomen, waren infectie van de bovenste luchtwegen, hoofdpijn, buikpijn en misselijkheid (zie Gebruik bij specifieke populaties en Klinische studies ].
Postmarketingervaring
Omdat de onderstaande reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het over het algemeen niet mogelijk om een betrouwbare schatting van hun frequentie te maken of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen. De volgende aanvullende bijwerkingen zijn vastgesteld tijdens het gebruik van simvastatine na goedkeuring: pruritus, alopecia, verschillende huidveranderingen (bijv. knobbeltjes, verkleuring, droge huid/slijmvliezen, veranderingen in haar/nagels), duizeligheid, spierkrampen, spierpijn , pancreatitis, paresthesie, perifere neuropathie, braken, bloedarmoede, erectiestoornissen, interstitiële longziekte, rabdomyolyse, hepatitis/geelzucht, fataal en niet-fataal leverfalen en depressie.
Er zijn zeldzame meldingen geweest van immuungemedieerde necrotiserende myopathie geassocieerd met statinegebruik [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Een schijnbaar overgevoeligheidssyndroom is zelden gemeld dat enkele van de volgende kenmerken omvatte: anafylaxie, angio-oedeem, lupus erythematous-achtig syndroom, polymyalgia rheumatica, dermatomyositis, vasculitis, purpura, trombocytopenie, leukopenie, hemolytische anemie, positieve ANA, BSE-verhoging, eosinofilie , artritis, artralgie, urticaria, asthenie, lichtgevoeligheid, koorts, koude rillingen, blozen, malaise, dyspneu, toxische epidermale necrolyse, erythema multiforme, inclusief Stevens-Johnson-syndroom.
Er zijn zeldzame postmarketingmeldingen geweest van cognitieve stoornissen (bijv. geheugenverlies, vergeetachtigheid, amnesie, geheugenstoornis, verwardheid) geassocieerd met statinegebruik. Deze cognitieve problemen zijn gemeld voor alle statines. De meldingen zijn over het algemeen niet-ernstig en reversibel na stopzetting van de statine, met variabele tijden tot het begin van de symptomen (1 dag tot jaren) en het verdwijnen van de symptomen (mediaan van 3 weken).
DRUG-INTERACTIES
Sterke CYP3A4-remmers, cyclosporine of danazol
Sterke CYP3A4-remmers: Simvastatine is, net als verschillende andere remmers van HMG-CoA-reductase, een substraat van CYP3A4. Simvastatine wordt gemetaboliseerd door CYP3A4 maar heeft geen CYP3A4-remmende activiteit; daarom wordt niet verwacht dat het de plasmaconcentraties van andere geneesmiddelen die door CYP3A4 worden gemetaboliseerd, beïnvloedt.
Verhoogde plasmaspiegels van HMG-CoA-reductaseremmende activiteit verhogen het risico op myopathie en rabdomyolyse, vooral bij hogere doses simvastatine. [zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ] Gelijktijdig gebruik van geneesmiddelen waarvan het label een sterk remmend effect op CYP3A4 heeft, is gecontra-indiceerd [zie CONTRA-INDICATIES ]. Als behandeling met itraconazol, ketoconazol, posaconazol, voriconazol, erytromycine, claritromycine of telitromycine onvermijdelijk is, moet de behandeling met simvastatine tijdens de behandeling worden onderbroken.
Cyclosporine of danazol: Het risico op myopathie, inclusief rabdomyolyse, wordt verhoogd door gelijktijdige toediening van ciclosporine of danazol. Daarom is gelijktijdig gebruik van deze geneesmiddelen gecontra-indiceerd [zie: CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Lipidenverlagende geneesmiddelen die myopathie kunnen veroorzaken wanneer ze alleen worden gegeven?
Gemfibrozil
Gecontra-indiceerd met simvastatine [zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Andere Fibraten
Voorzichtigheid is geboden bij het voorschrijven van simvastatine [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Amiodaron, dronedarone, ranolazine of calciumkanaalblokkers
Het risico op myopathie, waaronder rabdomyolyse, wordt verhoogd door gelijktijdige toediening van amiodaron, dronedaron, ranolazine of calciumkanaalblokkers zoals verapamil, diltiazem of amlodipine [Zie DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en Tabel 3 in KLINISCHE FARMACOLOGIE ].
niacine
Er zijn gevallen van myopathie/rabdomyolyse waargenomen bij gelijktijdige toediening van simvastatine met lipidenmodificerende doses (≥1 g/dag niacine) van niacinebevattende producten. Het risico op myopathie is groter bij Chinese patiënten. In een klinische studie (mediane follow-up 3,9 jaar) met patiënten met een hoog risico op cardiovasculaire ziekte en met goed gecontroleerde LDL-C-spiegels op simvastatine 40 mg/dag met of zonder ezetimibe 10 mg/dag, was er geen toenemend voordeel op cardiovasculaire uitkomsten met toevoeging van lipidenmodificerende doses (≥1 g/dag) niacine. Gelijktijdige toediening van ZOCOR met lipidenmodificerende doses (≥1 g/dag) niacine wordt niet aanbevolen bij Chinese patiënten. Het is niet bekend of dit risico ook van toepassing is op andere Aziatische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Digoxine
In één onderzoek resulteerde gelijktijdige toediening van digoxine en simvastatine in een lichte verhoging van de digoxineconcentraties in plasma. Patiënten die digoxine gebruiken, moeten op passende wijze worden gecontroleerd wanneer simvastatine wordt gestart [zie: KLINISCHE FARMACOLOGIE ].
Coumarine anticoagulantia
In twee klinische onderzoeken, één bij normale vrijwilligers en één bij patiënten met hypercholesterolemie, versterkte simvastatine 20-40 mg/dag het effect van cumarine-anticoagulantia matig: de protrombinetijd, gerapporteerd als International Normalised Ratio (INR), nam toe vanaf een uitgangswaarde van 1,7 tot 1,8 en van 2,6 tot 3,4 in respectievelijk de vrijwilligers- en patiëntenstudies. Met andere statines zijn klinisch duidelijke bloedingen en/of verlengde protrombinetijd gemeld bij enkele patiënten die gelijktijdig cumarine-anticoagulantia gebruikten. Bij dergelijke patiënten moet de protrombinetijd worden bepaald voordat met simvastatine wordt begonnen en vaak genoeg tijdens de vroege behandeling om ervoor te zorgen dat er geen significante verandering van de protrombinetijd optreedt. Zodra een stabiele protrombinetijd is gedocumenteerd, kan de protrombinetijd worden gecontroleerd met de intervallen die gewoonlijk worden aanbevolen voor patiënten die cumarine-anticoagulantia gebruiken. Als de dosis simvastatine wordt gewijzigd of stopgezet, moet dezelfde procedure worden herhaald. Simvastatinetherapie is niet in verband gebracht met bloedingen of met veranderingen in de protrombinetijd bij patiënten die geen anticoagulantia gebruiken.
Colchicine
Gevallen van myopathie, waaronder rabdomyolyse, zijn gemeld bij gelijktijdige toediening van simvastatine en colchicine, en voorzichtigheid is geboden bij het voorschrijven van simvastatine met colchicine.
Daptomycine
Er zijn gevallen van rabdomyolyse gemeld met simvastatine toegediend met daptomycine. Zowel simvastatine als daptomycine kunnen myopathie en rabdomyolyse veroorzaken wanneer ze alleen worden gegeven en het risico op myopathie en rabdomyolyse kan worden verhoogd bij gelijktijdige toediening. Zet ZOCOR tijdelijk stop bij patiënten die daptomycine gebruiken [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Myopathie/Rhabdomyolyse
Simvastatine veroorzaakt soms myopathie die zich manifesteert als spierpijn, gevoeligheid of zwakte met creatinekinase (CK) boven tien keer de bovengrens van normaal (ULN). Myopathie neemt soms de vorm aan van rabdomyolyse met of zonder acuut nierfalen secundair aan myoglobinurie, en er zijn zeldzame gevallen met dodelijke afloop. Het risico op myopathie wordt verhoogd door verhoogde plasmaspiegels van simvastatine en simvastatinezuur. Predisponerende factoren voor myopathie zijn onder meer hoge leeftijd (≥65 jaar), vrouwelijk geslacht, ongecontroleerde hypothyreoïdie en nierfunctiestoornis. Chinese patiënten lopen mogelijk een verhoogd risico op myopathie [zie Gebruik bij specifieke populaties ].
Het risico op myopathie, inclusief rabdomyolyse, is dosisafhankelijk. In een database van klinische onderzoeken waarin 41.413 patiënten werden behandeld met ZOCOR 10 mg, van wie 24.747 (ongeveer 60%) deelnamen aan onderzoeken met een mediane follow-up van ten minste 4 jaar, was de incidentie van myopathie ongeveer 0,03% en 0,08% bij respectievelijk 20 en 40 mg/dag. De incidentie van myopathie met 80 mg (0,61%) was onevenredig hoger dan die waargenomen bij de lagere doses. In deze onderzoeken werden patiënten nauwlettend gevolgd en werden sommige geneesmiddelen die een wisselwerking hadden, uitgesloten.
In een klinische studie waarin 12.064 patiënten met een voorgeschiedenis van een myocardinfarct werden behandeld met ZOCOR (gemiddelde follow-up 6,7 jaar), werd de incidentie van myopathie (gedefinieerd als onverklaarde spierzwakte of pijn met een serumcreatinekinase [CK] >10 keer bovengrens van normaal [ULN]) bij patiënten die 80 mg/dag kregen, was ongeveer 0,9% vergeleken met 0,02% voor patiënten die 20 mg/dag kregen. De incidentie van rabdomyolyse (gedefinieerd als myopathie met een CK >40 maal ULN) bij patiënten die 80 mg/dag kregen, was ongeveer 0,4% vergeleken met 0% voor patiënten die 20 mg/dag kregen. De incidentie van myopathie, waaronder rabdomyolyse, was het hoogst tijdens het eerste jaar en nam daarna aanzienlijk af tijdens de daaropvolgende jaren van behandeling. In dit onderzoek werden patiënten zorgvuldig gecontroleerd en werden sommige geneesmiddelen die een wisselwerking hadden, uitgesloten.
Het risico op myopathie, waaronder rabdomyolyse, is groter bij patiënten die simvastatine 80 mg gebruiken in vergelijking met andere statinetherapieën met vergelijkbare of grotere LDL-C-verlagende werkzaamheid en vergeleken met lagere doses simvastatine. Daarom mag de dosis van 80 mg ZOCOR alleen worden gebruikt bij patiënten die simvastatine 80 mg chronisch hebben gebruikt (bijv. gedurende 12 maanden of langer) zonder bewijs van spiertoxiciteit. [Zien DOSERING EN ADMINISTRATIE , Beperkte dosering voor 80 mg ]. Als een patiënt die momenteel de 80 mg-dosis ZOCOR verdraagt, echter moet worden gestart met een geneesmiddel dat interactie vertoont dat gecontra-indiceerd is of gepaard gaat met een dosislimiet voor simvastatine, moet die patiënt worden overgezet op een alternatieve statine met minder kans op de geneesmiddel-geneesmiddel interactie. Patiënten dienen geïnformeerd te worden over het verhoogde risico op myopathie, waaronder rabdomyolyse, en onverklaarbare spierpijn, gevoeligheid of zwakte onmiddellijk te melden. Als er symptomen optreden, moet de behandeling onmiddellijk worden stopgezet. [zien Immuun-gemedieerde necrotiserende myopathie ]
Alle patiënten die beginnen met de behandeling met ZOCOR 20 mg, of van wie de dosis ZOCOR wordt verhoogd, moeten worden geïnformeerd over het risico op myopathie, waaronder rabdomyolyse, en moeten worden verteld om onverklaarde spierpijn, gevoeligheid of zwakte onmiddellijk te melden, vooral als deze gepaard gaat met malaise of koorts of spiersymptomen. en de symptomen blijven bestaan na het stoppen met ZOCOR. De behandeling met ZOCOR dient onmiddellijk te worden gestaakt als myopathie wordt gediagnosticeerd of vermoed. In de meeste gevallen verdwenen spiersymptomen en CK-verhogingen wanneer de behandeling onmiddellijk werd stopgezet. Periodieke CK-bepalingen kunnen worden overwogen bij patiënten die beginnen met de behandeling met ZOCOR 5 mg of van wie de dosis wordt verhoogd, maar er is geen zekerheid dat een dergelijke controle myopathie zal voorkomen.
Veel van de patiënten die rabdomyolyse hebben ontwikkeld onder behandeling met simvastatine, hadden een gecompliceerde medische geschiedenis, waaronder nierinsufficiëntie, meestal als gevolg van langdurige diabetes mellitus. Dergelijke patiënten verdienen nauwlettend toezicht. De behandeling met ZOCOR moet worden stopgezet als er duidelijk verhoogde CPK-spiegels optreden of als myopathie wordt gediagnosticeerd of vermoed. De behandeling met ZOCOR moet ook tijdelijk worden onderbroken bij elke patiënt die een acute of ernstige aandoening ervaart die vatbaar is voor de ontwikkeling van nierfalen secundair aan rabdomyolyse, bijv. sepsis; hypotensie; zware operatie; trauma; ernstige stofwisselings-, endocriene of elektrolytenstoornissen; of ongecontroleerde epilepsie.
Geneesmiddelinteracties
Het risico op myopathie en rabdomyolyse wordt verhoogd door verhoogde plasmaspiegels van simvastatine en simvastatinezuur. Simvastatine wordt gemetaboliseerd door de cytochroom P450 isovorm 3A4. Bepaalde geneesmiddelen die deze metabole route remmen, kunnen de plasmaspiegels van simvastatine verhogen en kunnen het risico op myopathie verhogen. Deze omvatten itraconazol, ketoconazol, posaconazol, voriconazol, de macrolide-antibiotica erytromycine en claritromycine, en het ketolide-antibioticum telitromycine, hiv-proteaseremmers, boceprevir, telaprevir, het antidepressivum nefazodon, cobicistat-bevattende producten, of grapefruitsap-bevattende producten. KLINISCHE FARMACOLOGIE ]. Combinatie van deze geneesmiddelen met simvastatine is gecontra-indiceerd. Als een kortdurende behandeling met sterke CYP3A4-remmers onvermijdelijk is, moet de behandeling met simvastatine tijdens de behandeling worden gestaakt [zie CONTRA-INDICATIES en DRUG-INTERACTIES ].
Het gecombineerde gebruik van simvastatine met gemfibrozil, ciclosporine of danazol is gecontra-indiceerd [zie CONTRA-INDICATIES en DRUG-INTERACTIES ].
Voorzichtigheid is geboden bij het voorschrijven van andere fibraten met simvastatine, aangezien deze middelen myopathie kunnen veroorzaken wanneer ze alleen worden gegeven en het risico groter is wanneer ze gelijktijdig worden toegediend [zie DRUG-INTERACTIES ].
Gevallen van myopathie, waaronder rabdomyolyse, zijn gemeld bij gelijktijdige toediening van simvastatine en colchicine, en voorzichtigheid is geboden bij het voorschrijven van simvastatine met colchicine [zie DRUG-INTERACTIES ].
De voordelen van het gecombineerde gebruik van simvastatine met de volgende geneesmiddelen moeten zorgvuldig worden afgewogen tegen de mogelijke risico's van combinaties: andere lipideverlagende geneesmiddelen (fibraten of, voor patiënten met HoFH, lomitapide), amiodaron, dronedarone, verapamil, diltiazem, amlodipine, of ranolazine [Zie DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES ].
Gevallen van myopathie, waaronder rabdomyolyse, zijn waargenomen bij gelijktijdige toediening van simvastatine met lipidenmodificerende doses (≥1 g/dag niacine) van niacinebevattende producten (zie DRUG-INTERACTIES ].
Er zijn gevallen van rabdomyolyse gemeld met simvastatine toegediend met daptomycine. Zet ZOCOR tijdelijk stop bij patiënten die daptomycine gebruiken [zie DRUG-INTERACTIES ].
Voorschrijfaanbevelingen voor interagerende middelen zijn samengevat in tabel 1 [zie ook: DOSERING EN ADMINISTRATIE , DRUG-INTERACTIES , KLINISCHE FARMACOLOGIE ].
Immuun-gemedieerde necrotiserende myopathie
Er zijn zeldzame meldingen geweest van immuungemedieerde necrotiserende myopathie (IMNM), een auto-immuunmyopathie, geassocieerd met statinegebruik. IMNM wordt gekenmerkt door: proximale spierzwakte en verhoogd serumcreatinekinase, die aanhouden ondanks stopzetting van de statinebehandeling; positief anti-HMG CoA-reductase-antilichaam; spierbiopsie die necrotiserende myopathie toont; en verbetering met immunosuppressiva. Aanvullende neuromusculaire en serologische tests kunnen nodig zijn. Behandeling met immunosuppressiva kan nodig zijn. Overweeg zorgvuldig het risico op IMNM voordat u begint met een andere statine. Als de therapie wordt gestart met een andere statine, controleer dan op tekenen en symptomen van IMNM.
Lever disfunctie
Aanhoudende stijgingen (tot meer dan 3x de ULN) van serumtransaminasen zijn opgetreden bij ongeveer 1% van de patiënten die simvastatine kregen in klinische onderzoeken. Wanneer de medicamenteuze behandeling bij deze patiënten werd onderbroken of stopgezet, daalden de transaminasespiegels gewoonlijk langzaam tot de niveaus van voor de behandeling. De verhogingen waren niet geassocieerd met geelzucht of andere klinische tekenen of symptomen. Er waren geen aanwijzingen voor overgevoeligheid.
In de Scandinavische Simvastatine Survival Study (4S) [zie Klinische studies ], was het aantal patiënten met meer dan één transaminaseverhoging tot >3X ULN in de loop van het onderzoek niet significant verschillend tussen de simvastatine- en placebogroep (14 [0,7%] vs. 12 [0,6%]). Verhoogde transaminasen leidden tot stopzetting van de behandeling van 8 patiënten in de simvastatinegroep (n=2.221) en 5 in de placebogroep (n=2.223). Van de 1.986 met simvastatine behandelde patiënten in 4S met normale leverfunctietests (LFT's) bij aanvang, ontwikkelden 8 (0,4%) opeenvolgende LFT-verhogingen tot >3X ULN en/of werden gestaakt vanwege transaminaseverhogingen gedurende de 5,4 jaar (mediane follow-up ) van de studie. Van deze 8 patiënten ontwikkelden 5 aanvankelijk deze afwijkingen binnen het eerste jaar. Alle patiënten in deze studie kregen een startdosis van 20 mg simvastatine; 37% werd getitreerd tot 40 mg.
In 2 gecontroleerde klinische onderzoeken bij 1.105 patiënten was de 12 maanden durende incidentie van aanhoudende verhoging van levertransaminase, ongeacht de geneesmiddelrelatie, 0,9% en 2,1% bij respectievelijk de dosis van 40 en 80 mg. Geen van de patiënten ontwikkelde aanhoudende afwijkingen van de leverfunctie na de eerste 6 maanden van behandeling met een bepaalde dosis.
Het wordt aanbevolen om leverfunctietests uit te voeren vóór de start van de behandeling en daarna wanneer dit klinisch geïndiceerd is. Er zijn zeldzame postmarketingmeldingen geweest van fataal en niet-fataal leverfalen bij patiënten die statines gebruikten, waaronder simvastatine. Als tijdens de behandeling met ZOCOR 5 mg ernstige leverbeschadiging met klinische symptomen en/of hyperbilirubinemie of geelzucht optreedt, moet de behandeling onmiddellijk worden onderbroken. Als er geen alternatieve etiologie wordt gevonden, start ZOCOR dan niet opnieuw. Merk op dat ALT afkomstig kan zijn van spieren, daarom kan ALT stijgend met CK myopathie aangeven [zie Myopathie/Rhabdomyolyse ].
Het geneesmiddel moet met voorzichtigheid worden gebruikt bij patiënten die aanzienlijke hoeveelheden alcohol consumeren en/of een voorgeschiedenis van leverziekte hebben. Actieve leveraandoeningen of onverklaarbare transaminaseverhogingen zijn contra-indicaties voor het gebruik van simvastatine.
Matige (minder dan 3x ULN) verhogingen van serumtransaminasen zijn gemeld na behandeling met simvastatine. Deze veranderingen traden kort na aanvang van de therapie met simvastatine op, waren vaak van voorbijgaande aard, gingen niet gepaard met symptomen en vereisten geen onderbreking van de behandeling.
Endocriene functie
Verhogingen van HbA1c en nuchtere serumglucosespiegels zijn gemeld met HMG-CoA-reductaseremmers, waaronder ZOCOR.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 72 weken durende carcinogeniteitsstudie kregen muizen dagelijkse doses simvastatine van 25, 100 en 400 mg/kg lichaamsgewicht toegediend, wat resulteerde in gemiddelde plasmaspiegels van het geneesmiddel die ongeveer 1, 4 en 8 keer hoger waren dan het gemiddelde geneesmiddel in menselijk plasma. (als totale remmende activiteit op basis van AUC) na een orale dosis van 80 mg. Levercarcinomen waren significant verhoogd bij vrouwen met een hoge dosis en mannen met een gemiddelde en hoge dosis, met een maximale incidentie van 90% bij mannen. De incidentie van adenomen van de lever was significant verhoogd bij vrouwen met een gemiddelde en hoge dosis. Medicamenteuze behandeling verhoogde ook significant de incidentie van longadenomen bij mannen en vrouwen met een gemiddelde en hoge dosis. Adenomen van de klier van Harder (een klier van het oog van knaagdieren) waren significant hoger bij muizen met een hoge dosis dan bij controles. Er werd geen bewijs van een tumorverwekkend effect waargenomen bij 25 mg/kg/dag.
In een afzonderlijk 92 weken durend carcinogeniteitsonderzoek bij muizen bij doses tot 25 mg/kg/dag werd geen bewijs van een tumorverwekkend effect waargenomen (de gemiddelde plasmaspiegels van het geneesmiddel waren 1 keer hoger dan bij mensen die 80 mg simvastatine kregen, zoals gemeten aan de hand van de AUC).
In een twee jaar durend onderzoek bij ratten met 25 mg/kg/dag was er een statistisch significante toename in de incidentie van folliculaire adenomen van de schildklier bij vrouwelijke ratten die werden blootgesteld aan ongeveer 11 keer hogere niveaus van simvastatine dan bij mensen die 80 mg simvastatine kregen (als gemeten door AUC).
Een tweede twee jaar durende carcinogeniteitsstudie bij ratten met doses van 50 en 100 mg/kg/dag produceerde hepatocellulaire adenomen en carcinomen (bij vrouwelijke ratten bij beide doses en bij mannetjes bij 100 mg/kg/dag). Adenomen van folliculaire schildkliercellen waren bij beide doses verhoogd bij mannen en vrouwen; folliculaire celcarcinomen van de schildklier waren verhoogd bij vrouwen bij 100 mg/kg/dag. De verhoogde incidentie van schildklierneoplasmata lijkt consistent te zijn met bevindingen van andere statines. Deze behandelingsniveaus vertegenwoordigden plasmageneesmiddelniveaus (AUC) van ongeveer 7 en 15 keer (mannen) en 22 en 25 keer (vrouwen) de gemiddelde menselijke plasmageneesmiddelblootstelling na een dagelijkse dosis van 80 milligram.
Er werd geen bewijs van mutageniteit waargenomen in een microbiële mutageniteitstest (Ames) met of zonder metabolische activering van de lever bij ratten of muizen. Bovendien werd er geen bewijs van schade aan genetisch materiaal waargenomen in een in vitro alkalische elutietest met rattenhepatocyten, een V-79-onderzoek naar voorwaartse mutatie van zoogdiercellen, een in vitro onderzoek naar chromosoomafwijkingen in CHO-cellen of een in vivo chromosomale aberratietest in het beenmerg van de muis.
Er was een verminderde vruchtbaarheid bij mannelijke ratten die werden behandeld met simvastatine gedurende 34 weken bij 25 mg/kg lichaamsgewicht (4 maal het maximale menselijke blootstellingsniveau, gebaseerd op AUC, bij patiënten die 80 mg/dag kregen); dit effect werd echter niet waargenomen tijdens een daaropvolgend vruchtbaarheidsonderzoek waarin simvastatine gedurende 11 weken in dezelfde dosis werd toegediend aan mannelijke ratten (de volledige cyclus van spermatogenese inclusief epididymale rijping). Er werden geen microscopische veranderingen waargenomen in de testikels van ratten uit beide onderzoeken. Bij 180 mg/kg/dag (wat resulteert in blootstellingsniveaus die 22 keer hoger zijn dan die bij mensen die 80 mg/dag nemen op basis van oppervlakte, mg/m2), werd degeneratie van de tubuli seminiferi (necrose en verlies van spermatogeen epitheel) waargenomen. Bij honden was er geneesmiddelgerelateerde testiculaire atrofie, verminderde spermatogenese, spermatocytische degeneratie en vorming van reuzencellen bij 10 mg/kg/dag (ongeveer 2 maal de blootstelling bij de mens, gebaseerd op de AUC, bij 80 mg/dag). De klinische betekenis van deze bevindingen is onduidelijk.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie X [Zie CONTRA-INDICATIES ]
ZOCOR is gecontra-indiceerd bij vrouwen die zwanger zijn of kunnen worden. Lipidenverlagende medicijnen bieden geen voordeel tijdens de zwangerschap, omdat cholesterol en cholesterolderivaten nodig zijn voor een normale ontwikkeling van de foetus. Atherosclerose is een chronisch proces en stopzetting van lipidenverlagende geneesmiddelen tijdens de zwangerschap zou weinig invloed moeten hebben op de langetermijnresultaten van primaire hypercholesterolemietherapie. Er zijn geen adequate en goed gecontroleerde onderzoeken naar het gebruik van ZOCOR tijdens de zwangerschap; er zijn echter zeldzame meldingen van aangeboren afwijkingen bij zuigelingen die in utero aan statines zijn blootgesteld. Reproductieonderzoeken bij dieren van simvastatine bij ratten en konijnen toonden geen bewijs van teratogeniteit. Serumcholesterol en triglyceriden nemen toe tijdens een normale zwangerschap en cholesterol of cholesterolderivaten zijn essentieel voor de ontwikkeling van de foetus. Omdat statines de cholesterolsynthese verlagen en mogelijk de synthese van andere biologisch actieve stoffen afgeleid van cholesterol, kan ZOCOR schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Als ZOCOR 5 mg tijdens de zwangerschap wordt gebruikt of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte zijn van het mogelijke gevaar voor de foetus.
Er zijn zeldzame meldingen van aangeboren afwijkingen na intra-uteriene blootstelling aan statines. In een review2 van ongeveer 100 prospectief gevolgde zwangerschappen bij vrouwen die waren blootgesteld aan simvastatine of een andere structureel verwante statine, was de incidentie van aangeboren afwijkingen, spontane abortussen en foetale sterfte/doodgeboorte niet hoger dan verwacht in de algemene bevolking. De studie kon echter alleen een 3- tot 4-voudig verhoogd risico op aangeboren afwijkingen ten opzichte van het achtergrondpercentage uitsluiten. In 89% van deze gevallen werd de medicamenteuze behandeling gestart voorafgaand aan de zwangerschap en werd deze stopgezet tijdens het eerste trimester toen zwangerschap werd vastgesteld.
Simvastatine was niet teratogeen bij ratten of konijnen in doses (respectievelijk 25, 10 mg/kg/dag) die resulteerden in 3 maal de menselijke blootstelling op basis van mg/m2 oppervlakte. In onderzoeken met een andere structureel verwante statine werden echter misvormingen van het skelet waargenomen bij ratten en muizen.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing-surveillance van blootstelling aan lovastatine en simvastatine tijdens de zwangerschap, reproductieve toxicologie, 10 (6): 439-446, 1996.
Vrouwen die zwanger kunnen worden en die behandeling met ZOCOR 5 mg nodig hebben voor een lipidenstoornis, moeten worden geadviseerd effectieve anticonceptie te gebruiken. Voor vrouwen die proberen zwanger te worden, moet worden overwogen om de behandeling met ZOCOR te staken. Als zwangerschap optreedt, moet ZOCOR onmiddellijk worden stopgezet.
Moeders die borstvoeding geven
Het is niet bekend of simvastatine wordt uitgescheiden in de moedermelk. Omdat een kleine hoeveelheid van een ander geneesmiddel in deze klasse wordt uitgescheiden in de moedermelk en vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding geven, dienen vrouwen die simvastatine gebruiken hun zuigelingen niet te voeden. Er moet worden besloten of de borstvoeding moet worden gestaakt of dat het medicijn moet worden gestaakt, rekening houdend met het belang van het medicijn voor de moeder [zie CONTRA-INDICATIES ].
Pediatrisch gebruik
De veiligheid en werkzaamheid van simvastatine bij patiënten van 10-17 jaar met heterozygote familiaire hypercholesterolemie zijn geëvalueerd in een gecontroleerd klinisch onderzoek bij adolescente jongens en bij meisjes die ten minste 1 jaar postmenarchaal waren. Patiënten die met simvastatine werden behandeld, hadden een bijwerkingenprofiel dat vergelijkbaar was met dat van patiënten die met placebo werden behandeld. Doses hoger dan 40 mg zijn bij deze populatie niet onderzocht. In deze beperkte gecontroleerde studie was er geen significant effect op de groei of seksuele rijping bij adolescente jongens of meisjes, of op de lengte van de menstruatiecyclus bij meisjes. [Zien DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , Klinische studies ] Adolescente vrouwen moeten worden geadviseerd over geschikte anticonceptiemethoden tijdens simvastatinetherapie [zie: CONTRA-INDICATIES en Zwangerschap ]. Simvastatine is niet onderzocht bij patiënten jonger dan 10 jaar, noch bij premenarchale meisjes.
Geriatrisch gebruik
Van de 2.423 patiënten die ZOCOR 5 mg kregen in klinische fase III-onderzoeken en de 10.269 patiënten in het onderzoek naar hartbescherming die ZOCOR 40 mg kregen, waren respectievelijk 363 (15%) en 5.366 (52%), ≥ 65 jaar oud. Bij HPS waren 615 (6%) ≥75 jaar oud. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten. Aangezien hoge leeftijd (≥65 jaar) een predisponerende factor is voor myopathie, dient ZOCOR met voorzichtigheid te worden voorgeschreven aan ouderen. [Zien KLINISCHE FARMACOLOGIE ]
Een farmacokinetische studie met simvastatine toonde aan dat de gemiddelde plasmaspiegel van statineactiviteit ongeveer 45% hoger was bij oudere patiënten tussen 70-78 jaar in vergelijking met patiënten tussen 18-30 jaar. In 4S waren 1.021 (23%) van de 4.444 patiënten 65 jaar of ouder. De lipidenverlagende werkzaamheid was minstens zo groot bij oudere patiënten als bij jongere patiënten, en ZOCOR verminderde de totale mortaliteit en CHD-mortaliteit significant bij oudere patiënten met een voorgeschiedenis van CHD. Bij HPS was 52% van de patiënten bejaard (4.891 patiënten van 65-69 jaar en 5.806 patiënten van 70 jaar of ouder). De relatieve risicoreducties van overlijden door CHD, niet-fataal MI, coronaire en niet-coronaire revascularisatieprocedures en beroerte waren vergelijkbaar bij oudere en jongere patiënten [zie Klinische studies ]. Bij HPS waren er onder 32.145 patiënten die de actieve inloopperiode ingingen, 2 gevallen van myopathie/rabdomyolyse; deze patiënten waren 67 en 73 jaar oud. Van de 7 gevallen van myopathie/rabdomyolyse onder 10.269 patiënten toegewezen aan simvastatine, waren er 4 65 jaar of ouder (bij baseline), van wie één ouder dan 75 jaar. Er waren geen algemene verschillen in veiligheid tussen oudere en jongere patiënten in 4S of HPS.
Omdat hoge leeftijd (≥65 jaar) een predisponerende factor is voor myopathie, waaronder rabdomyolyse, dient ZOCOR 40 mg met voorzichtigheid te worden voorgeschreven aan ouderen. In een klinisch onderzoek bij patiënten die werden behandeld met simvastatine 80 mg/dag, hadden patiënten ≥65 jaar een verhoogd risico op myopathie, waaronder rabdomyolyse, in vergelijking met patiënten WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ]
Nierfunctiestoornis
Voorzichtigheid is geboden wanneer ZOCOR 20 mg wordt toegediend aan patiënten met een ernstige nierfunctiestoornis DOSERING EN ADMINISTRATIE ]
Leverfunctiestoornis
ZOCOR 10 mg is gecontra-indiceerd bij patiënten met een actieve leverziekte, waaronder onverklaarbare aanhoudende verhogingen van levertransaminasespiegels (zie CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Chinese patiënten
In een klinische studie waarin patiënten met een hoog risico op hart- en vaatziekten werden behandeld met simvastatine 40 mg/dag (mediane follow-up 3,9 jaar), was de incidentie van myopathie ongeveer 0,05% voor niet-Chinese patiënten (n=7367) vergeleken met 0,24% voor Chinese patiënten (n=5468). De incidentie van myopathie bij Chinese patiënten die simvastatine 40 mg/dag of ezetimibe/simvastatine 10/40 mg/dag gelijktijdig toegediend kregen met niacine met verlengde afgifte 2 g/dag was 1,24%.
Chinese patiënten lopen mogelijk een hoger risico op myopathie, controleer patiënten op de juiste manier. Gelijktijdige toediening van ZOCOR 10 mg met lipidenmodificerende doses (≥ 1 g/dag niacine) van niacinebevattende producten wordt niet aanbevolen bij Chinese patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES ].
OVERDOSERING
Significante letaliteit werd waargenomen bij muizen na een enkelvoudige orale dosis van 9 g/m2. Er werden geen aanwijzingen voor letaliteit waargenomen bij ratten of honden die werden behandeld met respectievelijk doses van 30 en 100 g/m2. Er werden geen specifieke diagnostische symptomen waargenomen bij knaagdieren. Bij deze doses waren de enige tekenen die bij honden werden waargenomen braken en slijmerige ontlasting.
Er zijn enkele gevallen van overdosering met ZOCOR gemeld; de maximale ingenomen dosis was 3,6 g. Alle patiënten herstelden zonder gevolgen. Bij overdosering dienen ondersteunende maatregelen te worden genomen. De dialyseerbaarheid van simvastatine en zijn metabolieten bij de mens is op dit moment niet bekend.
CONTRA-INDICATIES
ZOCOR 40 mg is gecontra-indiceerd bij de volgende aandoeningen:
- Gelijktijdige toediening van sterke CYP3A4-remmers (bijv. itraconazol, ketoconazol, posaconazol, voriconazol, HIV-proteaseremmers, boceprevir, telaprevir, erytromycine, claritromycine, telitromycine, nefazodon en cobicistat-bevattende producten) (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Gelijktijdige toediening van gemfibrozil, ciclosporine of danazol [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Overgevoeligheid voor een van de bestanddelen van dit medicijn [zie ONGEWENSTE REACTIES ].
- Actieve leverziekte, waaronder mogelijk onverklaarbare aanhoudende verhogingen van levertransaminasespiegels [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- Vrouwen die zwanger zijn of zwanger kunnen worden. Serumcholesterol en triglyceriden nemen toe tijdens een normale zwangerschap en cholesterol of cholesterolderivaten zijn essentieel voor de ontwikkeling van de foetus. Omdat HMG-CoA-reductaseremmers (statines) de cholesterolsynthese en mogelijk de synthese van andere biologisch actieve stoffen afgeleid van cholesterol verlagen, kan ZOCOR 40 mg schade aan de foetus veroorzaken bij toediening aan een zwangere vrouw. Atherosclerose is een chronisch proces en het stopzetten van lipidenverlagende geneesmiddelen tijdens de zwangerschap zou weinig invloed moeten hebben op de uitkomst van langdurige behandeling van primaire hypercholesterolemie. Er zijn geen adequate en goed gecontroleerde onderzoeken naar het gebruik van ZOCOR tijdens de zwangerschap; in zeldzame gevallen werden echter aangeboren afwijkingen waargenomen na intra-uteriene blootstelling aan statines. In reproductieonderzoeken bij ratten en konijnen bracht simvastatine geen bewijs van teratogeniteit aan het licht. ZOCOR mag alleen aan vrouwen in de vruchtbare leeftijd worden toegediend wanneer het zeer onwaarschijnlijk is dat dergelijke patiënten zwanger zullen worden. Als de patiënt zwanger wordt tijdens het gebruik van dit geneesmiddel, moet ZOCOR onmiddellijk worden stopgezet en moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de foetus (zie Gebruik bij specifieke populaties ].
- Moeders die borstvoeding geven. Het is niet bekend of simvastatine wordt uitgescheiden in de moedermelk; een kleine hoeveelheid van een ander geneesmiddel in deze klasse gaat echter over in de moedermelk. Omdat statines mogelijk ernstige bijwerkingen kunnen veroorzaken bij zuigelingen die borstvoeding geven, mogen vrouwen die een behandeling met ZOCOR nodig hebben hun zuigelingen geen borstvoeding geven [zie Gebruik bij specifieke populaties ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Simvastatine is een prodrug en wordt na toediening gehydrolyseerd tot zijn actieve β-hydroxyzuurvorm, simvastatinezuur. Simvastatine is een specifieke remmer van 3-hydroxy-3-methylglutaryl-co-enzym A (HMG-CoA)-reductase, het enzym dat de omzetting van HMG-CoA in mevalonaat katalyseert, een vroege en snelheidsbeperkende stap in de biosyntheseroute voor cholesterol. Bovendien verlaagt simvastatine VLDL en TG en verhoogt het HDL-C.
farmacodynamiek
Epidemiologische studies hebben aangetoond dat verhoogde niveaus van totaal-C, LDL-C, evenals verlaagde niveaus van HDL-C geassocieerd zijn met de ontwikkeling van atherosclerose en een verhoogd cardiovasculair risico. Verlaging van LDL-C vermindert dit risico. Het onafhankelijke effect van het verhogen van HDL-C of het verlagen van TG op het risico op coronaire en cardiovasculaire morbiditeit en mortaliteit is echter niet vastgesteld.
Farmacokinetiek
Simvastatine is een lacton dat in vivo gemakkelijk wordt gehydrolyseerd tot het overeenkomstige -hydroxyzuur, een krachtige remmer van HMG-CoA-reductase. Remming van HMG-CoA-reductase is de basis voor een test in farmacokinetische onderzoeken van de β-hydroxyzuurmetabolieten (actieve remmers) en, na basehydrolyse, actieve plus latente remmers (totaalremmers) in plasma na toediening van simvastatine.
Na een orale dosis van 14C-gelabeld simvastatine bij de mens, werd 13% van de dosis uitgescheiden in de urine en 60% in de feces. Plasmaconcentraties van totale radioactiviteit (simvastatine plus 14C-metabolieten) bereikten een piek na 4 uur en daalden snel tot ongeveer 10% van de piek 12 uur na de dosis. Aangezien simvastatine uitgebreide first-pass-extractie in de lever ondergaat, is de beschikbaarheid van het geneesmiddel voor de algemene bloedsomloop laag (
Zowel simvastatine als zijn β-hydroxyzuurmetaboliet zijn sterk gebonden (ongeveer 95%) aan humane plasma-eiwitten. Onderzoeken bij ratten geven aan dat wanneer radioactief gelabeld simvastatine werd toegediend, simvastatine afgeleide radioactiviteit de bloed-hersenbarrière passeerde.
De belangrijkste actieve metabolieten van simvastatine in humaan plasma zijn het -hydroxyzuur van simvastatine en zijn 6′-hydroxy-, 6′-hydroxymethyl- en 6′-exomethyleenderivaten. Piekplasmaconcentraties van zowel actieve als totale remmers werden binnen 1,3 tot 2,4 uur na toediening bereikt. Hoewel het aanbevolen therapeutische dosisbereik 5 tot 40 mg/dag is, was er geen substantiële afwijking van de lineariteit van de AUC van remmers in de algemene bloedsomloop met een dosisverhoging tot wel 120 mg. Ten opzichte van nuchtere toestand werd het plasmaprofiel van remmers niet beïnvloed wanneer simvastatine werd toegediend vlak voordat een American Heart Association een vetarme maaltijd aanbeveelde.
In een onderzoek onder 16 oudere patiënten tussen 70 en 78 jaar die ZOCOR 40 mg/dag kregen, was de gemiddelde plasmaspiegel van HMG-CoA-reductaseremmende activiteit met ongeveer 45% verhoogd in vergelijking met 18 patiënten tussen 18-30 jaar. Ervaring uit klinisch onderzoek bij ouderen (n=1522) suggereert dat er geen algemene verschillen waren in veiligheid tussen oudere en jongere patiënten [zie Gebruik bij specifieke populaties ].
Kinetische studies met een andere statine, met een vergelijkbare voornaamste eliminatieroute, hebben gesuggereerd dat voor een bepaalde dosis een hogere systemische blootstelling kan worden bereikt bij patiënten met ernstige nierinsufficiëntie (gemeten aan de hand van de creatinineklaring).
Simvastatinezuur is een substraat van het transporteiwit OATP1B1. Gelijktijdige toediening van geneesmiddelen die remmers zijn van het transporteiwit OATP1B1 kan leiden tot verhoogde plasmaconcentraties van simvastatinezuur en een verhoogd risico op myopathie. Van ciclosporine is bijvoorbeeld aangetoond dat het de AUC van statines verhoogt; hoewel het mechanisme niet volledig wordt begrepen, is de toename van de AUC van simvastatinezuur vermoedelijk gedeeltelijk te wijten aan remming van CYP3A4 en/of OATP1B1.
Het risico op myopathie wordt verhoogd door hoge niveaus van HMG-CoA-reductaseremmende activiteit in plasma. Remmers van CYP3A4 kunnen de plasmaspiegels van HMG-CoA-reductaseremmende activiteit verhogen en het risico op myopathie verhogen (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
In een onderzoek met 12 gezonde vrijwilligers had simvastatine in de dosis van 80 mg geen effect op het metabolisme van de probe cytochroom P450 isovorm 3A4 (CYP3A4) substraten midazolam en erytromycine. Dit geeft aan dat simvastatine geen remmer van CYP3A4 is en daarom naar verwachting geen invloed zal hebben op de plasmaspiegels van andere geneesmiddelen die door CYP3A4 worden gemetaboliseerd.
Gelijktijdige toediening van simvastatine (40 mg QD gedurende 10 dagen) resulteerde in een verhoging van de maximale gemiddelde spiegels van cardioactief digoxine (toegediend als een enkelvoudige dosis van 0,4 mg op dag 10) met ongeveer 0,3 ng/ml.
Dierlijke toxicologie en/of farmacologie
CNS-toxiciteit
Degeneratie van de oogzenuw werd gezien bij klinisch normale honden die gedurende 14 weken met 180 mg/kg/dag werden behandeld met simvastatine, een dosis die gemiddelde plasmaspiegels van het geneesmiddel produceerde die ongeveer 12 keer hoger waren dan de gemiddelde plasmageneesmiddelspiegel bij mensen die 80 mg/dag innamen.
Een chemisch vergelijkbaar geneesmiddel in deze klasse veroorzaakte ook degeneratie van de oogzenuw (Walleriaanse degeneratie van retinogene vezels) bij klinisch normale honden op een dosisafhankelijke manier vanaf 60 mg/kg/dag, een dosis die gemiddelde plasmaspiegels van het geneesmiddel produceerde die ongeveer 30 keer hoger waren. dan het gemiddelde plasmageneesmiddelniveau bij mensen die de hoogste aanbevolen dosis gebruiken (gemeten aan de hand van de totale enzymremmende activiteit). Ditzelfde medicijn veroorzaakte ook vestibulocochleaire Walleriaans-achtige degeneratie en retinale ganglioncelchromatolyse bij honden die 14 weken werden behandeld met 180 mg/kg/dag, een dosis die resulteerde in een gemiddeld plasmageneesmiddelniveau vergelijkbaar met dat gezien bij de 60 mg/kg/dag. dag dosis.
CZS-vasculaire laesies, gekenmerkt door perivasculaire bloeding en oedeem, mononucleaire celinfiltratie van perivasculaire ruimten, perivasculaire fibrineafzettingen en necrose van kleine bloedvaten werden waargenomen bij honden die werden behandeld met simvastatine in een dosis van 360 mg/kg/dag, een dosis die gemiddeld plasma produceerde geneesmiddelspiegels die ongeveer 14 keer hoger waren dan de gemiddelde plasmageneesmiddelspiegels bij mensen die 80 mg/dag innamen. Soortgelijke vasculaire laesies van het CZS zijn waargenomen met verschillende andere geneesmiddelen van deze klasse.
Er was cataract bij vrouwelijke ratten na twee jaar behandeling met 50 en 100 mg/kg/dag (respectievelijk 22 en 25 maal de humane AUC bij 80 mg/dag) en bij honden na drie maanden bij 90 mg/kg/dag ( 19 keer) en na twee jaar bij 50 mg/kg/dag (5 keer).
Klinische studies
Klinische studies bij volwassenen
Vermindering van het risico op CHD-sterfte en cardiovasculaire gebeurtenissen
In 4S werd het effect van therapie met 20 mg ZOCOR op de totale mortaliteit beoordeeld bij 4.444 patiënten met CHD en baseline totaal cholesterol 212-309 mg/dL (5,5-8,0 mmol/L). In dit multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoek werden patiënten behandeld met standaardzorg, inclusief dieet, en ofwel ZOCOR 20-40 mg/dag (n=2.221) of placebo (n=2.223) voor een mediane duur van 5,4 jaar. In de loop van het onderzoek leidde behandeling met ZOCOR tot gemiddelde verlagingen van totaal-C, LDL-C en TG van respectievelijk 25%, 35% en 10%, en een gemiddelde toename van HDL-C van 8%. ZOCOR verminderde het risico op mortaliteit significant met 30% (p=0,0003, 182 sterfgevallen in de ZOCOR 40 mg-groep versus 256 sterfgevallen in de placebogroep). Het risico op overlijden door CHD was significant verminderd met 42% (p=0,00001, 111 vs. 189 sterfgevallen). Er was geen statistisch significant verschil tussen de groepen in niet-cardiovasculaire mortaliteit. ZOCOR verminderde het risico op ernstige coronaire voorvallen (CHZ-mortaliteit plus in het ziekenhuis geverifieerd en stil niet-fataal myocardinfarct [MI]) significant met 34% (p
De Heart Protection Study (HPS) was een groot, multicenter, placebogecontroleerd, dubbelblind onderzoek met een gemiddelde duur van 5 jaar bij 20.536 patiënten (10.269 op ZOCOR 40 mg en 10.267 op placebo). Patiënten werden toegewezen aan behandeling met behulp van een covariabele adaptieve methode3 die rekening hield met de verdeling van 10 belangrijke baselinekenmerken van patiënten die al waren ingeschreven en de onbalans van die kenmerken over de groepen minimaliseerde. De patiënten hadden een gemiddelde leeftijd van 64 jaar (spreiding 40-80 jaar), waren 97% blank en hadden een hoog risico op het ontwikkelen van een ernstig coronair voorval vanwege bestaande CHD (65%), diabetes (type 2, 26%; type 1 , 3%), voorgeschiedenis van beroerte of andere cerebrovasculaire ziekte (16%), perifere vaatziekte (33%) of hypertensie bij mannen ≥65 jaar (6%). Bij aanvang hadden 3.421 patiënten (17%) LDL-C-spiegels lager dan 100 mg/dL, van wie 953 (5%) LDL-C-spiegels lager dan 80 mg/dL; 7.068 patiënten (34%) hadden niveaus tussen 100 en 130 mg/dL; en 10.047 patiënten (49%) hadden niveaus hoger dan 130 mg/dL.
DR Taves, Minimalisatie: een nieuwe methode om patiënten toe te wijzen aan behandelings- en controlegroepen. clin. Pharmacol. daar. 15 (1974), blz. 443-453
De HPS-resultaten toonden aan dat ZOCOR 40 mg/dag significant verminderde: totale en CHD-mortaliteit; niet-fataal MI, beroerte en revascularisatieprocedures (coronair en niet-coronair) (zie tabel 4).
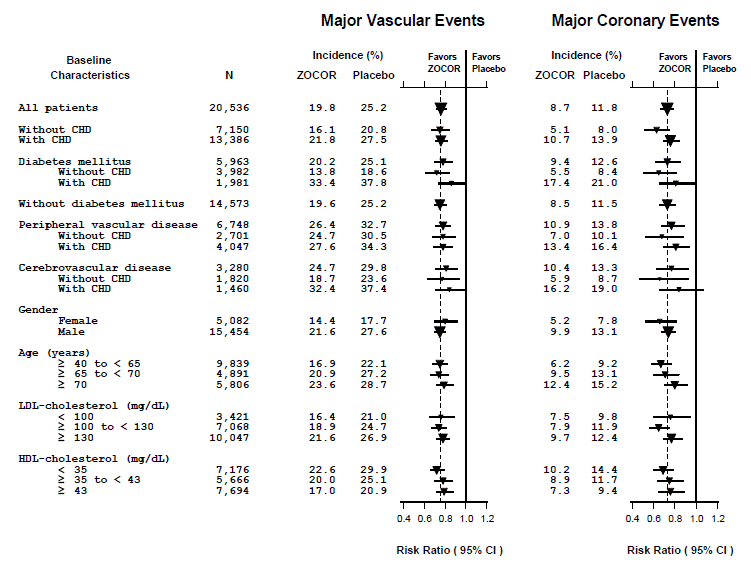
Er werden twee samengestelde eindpunten gedefinieerd om voldoende voorvallen te hebben om relatieve risicoreducties over een reeks basislijnkenmerken te beoordelen (zie afbeelding 1). Een samenstelling van ernstige coronaire voorvallen (MCE) bestond uit CHD-mortaliteit en niet-fataal MI (geanalyseerd op tijd tot het eerste voorval; 898 patiënten behandeld met ZOCOR 5 mg hadden voorvallen en 1.212 patiënten op placebo hadden voorvallen). Een samenstelling van majeure vasculaire voorvallen (MVE) bestond uit MCE-, beroerte- en revascularisatieprocedures, waaronder coronaire, perifere en andere niet-coronaire procedures (geanalyseerd op tijd tot het eerste voorval; 2.033 patiënten behandeld met ZOCOR 10 mg hadden voorvallen en 2.585 patiënten op placebo had voorvallen). Er werden significante relatieve risicoreducties waargenomen voor beide samengestelde eindpunten (27% voor MCE en 24% voor MVE, p
Afbeelding 1 De effecten van behandeling met ZOCOR 5 mg op ernstige vasculaire voorvallen en ernstige coronaire voorvallen bij HPS
Angiografische studies
In de Multicenter Anti-Atheroma Study werd het effect van simvastatine op atherosclerose beoordeeld door kwantitatieve coronaire angiografie bij hypercholesterolemische patiënten met CHD. In deze gerandomiseerde, dubbelblinde, gecontroleerde studie werden patiënten behandeld met simvastatine 20 mg/dag of placebo. Angiogrammen werden geëvalueerd bij baseline, twee en vier jaar. De eindpunten van de co-primaire studie waren de gemiddelde verandering per patiënt in minimale en gemiddelde lumendiameters, wat respectievelijk wijst op focale en diffuse ziekte. ZOCOR vertraagde significant de progressie van laesies zoals gemeten in het jaar 4 angiogram door beide parameters, evenals door verandering in procentuele diameterstenose. Bovendien verminderde simvastatine het aantal patiënten met nieuwe laesies en met nieuwe totale occlusies significant.
Modificaties van lipidenprofielen
Primaire hyperlipidemie (Fredrickson type lla en llb)
Van ZOCOR is aangetoond dat het effectief is bij het verlagen van totaal-C en LDL-C bij heterozygote familiale en niet-familiale vormen van hyperlipidemie en bij gemengde hyperlipidemie. Maximale tot bijna maximale respons wordt over het algemeen bereikt binnen 4-6 weken en blijft behouden tijdens chronische therapie. ZOCOR verminderde significant de totaal-C, LDL-C, totaal-C/HDL-C-ratio en LDL-C/HDL-C-ratio; ZOCOR verlaagde ook de TG en verhoogde HDL-C (zie tabel 5).
Hypertriglyceridemie (Fredrickson Type IV)
De resultaten van een subgroepanalyse bij 74 patiënten met type IV hyperlipidemie uit een dubbelblinde, placebogecontroleerde cross-overstudie met 130 patiënten en 3 perioden worden weergegeven in Tabel 6.
Dysbetalipoproteïnemie (Fredrickson Type III)
De resultaten van een subgroepanalyse bij 7 patiënten met type III hyperlipidemie (dysbetalipoproteïnemie) (apo E2/2) (VLDL-C/TG>0,25) uit een dubbelblind, placebogecontroleerd, 3-periode cross-over onderzoek met 130 patiënten worden weergegeven in tabel 7.
Homozygote familiale hypercholesterolemie
In een gecontroleerd klinisch onderzoek kregen 12 patiënten van 15-39 jaar met homozygote familiaire hypercholesterolemie simvastatine 40 mg/dag in een enkele dosis of in 3 verdeelde doses, of 80 mg/dag in 3 verdeelde doses. Bij 11 patiënten met LDL-C-verlagingen waren de gemiddelde LDL-C-veranderingen voor de doses van 40 en 80 mg 14% (bereik 8% tot 23%, mediaan 12%) en 30% (bereik 14% tot 46%). , mediaan 29%), respectievelijk. Eén patiënt had een toename van 15% in LDL-C. Een andere patiënt met afwezige LDL-C-receptorfunctie had een LDL-C-verlaging van 41% met de dosis van 80 mg.
Endocriene functie
In klinische onderzoeken verminderde simvastatine de bijnierreserve niet en verminderde het de basale plasmacortisolconcentratie niet significant. In klinische onderzoeken met simvastatine werden kleine verlagingen ten opzichte van baseline van basaal plasmatestosteron bij mannen waargenomen, een effect dat ook werd waargenomen bij andere statines en het galzuurbindende hars colestyramine. Er was geen effect op de plasmagonadotropinespiegels. In een placebogecontroleerd onderzoek van 12 weken was er geen significant effect van simvastatine 80 mg op de plasmatestosteronrespons op humaan choriongonadotrofine. In een ander onderzoek van 24 weken had simvastatine 20-40 mg geen waarneembaar effect op de spermatogenese. In 4S, waarin 4.444 patiënten werden gerandomiseerd naar simvastatine 20-40 mg/dag of placebo voor een mediane duur van 5,4 jaar, was de incidentie van mannelijke seksuele bijwerkingen in de twee behandelingsgroepen niet significant verschillend. Vanwege deze factoren is het onwaarschijnlijk dat de kleine veranderingen in plasmatestosteron klinisch significant zijn. De eventuele effecten op de hypofyse-gonadale as bij premenopauzale vrouwen zijn niet bekend.
Klinische studies bij adolescenten
In een dubbelblind, placebogecontroleerd onderzoek werden 175 patiënten (99 adolescente jongens en 76 postmenarchale meisjes) van 10-17 jaar (gemiddelde leeftijd 14,1 jaar) met heterozygote familiaire hypercholesterolemie (HeFH) gerandomiseerd naar simvastatine (n= 106) of placebo (n=67) gedurende 24 weken (basisonderzoek). Opname in de studie vereiste een baseline LDL-C-spiegel tussen 160 en 400 mg/dL en ten minste één ouder met een LDL-C-spiegel >189 mg/dL. De dosering van simvastatine (eenmaal daags 's avonds) was 10 mg gedurende de eerste 8 weken, 20 mg gedurende de tweede 8 weken en daarna 40 mg. In een verlenging van 24 weken kozen 144 patiënten ervoor om de behandeling met simvastatine 40 mg of placebo voort te zetten.
ZOCOR 20 mg verlaagde de plasmaspiegels van totaal-C, LDL-C en Apo B significant (zie tabel 8). De resultaten van de verlenging na 48 weken waren vergelijkbaar met die waargenomen in het basisonderzoek.
Na 24 weken behandeling was de gemiddelde bereikte LDL-C-waarde 124,9 mg/dL (bereik: 64.0289,0 mg/dL) in de ZOCOR 40 mg-groep vergeleken met 207,8 mg/dL (bereik: 128,0-334,0 mg/dL) in de placebogroep.
De veiligheid en werkzaamheid van doses hoger dan 40 mg per dag zijn niet onderzocht bij kinderen met HeFH. De werkzaamheid op lange termijn van simvastatinetherapie bij kinderen om de morbiditeit en mortaliteit op volwassen leeftijd te verminderen, is niet vastgesteld.
PATIËNT INFORMATIE
Patiënten moeten worden geadviseerd zich te houden aan het door het National Cholesterol Education Program (NCEP) aanbevolen dieet, een regelmatig trainingsprogramma en periodieke tests van een nuchter lipidenpanel.
Patiënten moeten worden geïnformeerd over stoffen die ze niet gelijktijdig met simvastatine mogen gebruiken [zien CONTRA-INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. Patiënten moeten ook worden geadviseerd om andere beroepsbeoefenaren in de gezondheidszorg die een nieuw medicijn voorschrijven of de dosis van een bestaand medicijn verhogen, te informeren dat ze ZOCOR gebruiken.
Spierpijn
Alle patiënten die een behandeling met ZOCOR starten, moeten worden geïnformeerd over het risico op myopathie, waaronder rabdomyolyse, en moeten worden verteld om onverklaarbare spierpijn, -gevoeligheid of -zwakte onmiddellijk te melden, vooral als deze gepaard gaat met malaise of koorts of als deze spierverschijnselen of -symptomen aanhouden na het stoppen met ZOCOR. Patiënten die de dosis van 80 mg gebruiken, moeten worden geïnformeerd dat het risico op myopathie, waaronder rabdomyolyse, groter is bij gebruik van de dosis van 80 mg. Het risico op myopathie, waaronder rabdomyolyse, die optreedt bij gebruik van ZOCOR 40 mg is verhoogd bij het nemen van bepaalde soorten medicijnen of het consumeren van grapefruitsap. Patiënten moeten alle medicatie, zowel op recept als vrij verkrijgbaar, met hun zorgverlener bespreken.
Lever enzymen
Het wordt aanbevolen om leverfunctietests uit te voeren vóór de start van ZOCOR 20 mg, en daarna wanneer dit klinisch geïndiceerd is. Alle patiënten die met ZOCOR worden behandeld, moeten worden geadviseerd om onmiddellijk alle symptomen te melden die kunnen wijzen op leverbeschadiging, waaronder vermoeidheid, anorexia, ongemak in de rechter bovenbuik, donkere urine of geelzucht.
Zwangerschap
Vrouwen in de vruchtbare leeftijd moeten worden geadviseerd om een effectieve anticonceptiemethode te gebruiken om zwangerschap te voorkomen tijdens het gebruik van ZOCOR. Bespreek toekomstige zwangerschapsplannen met uw patiënten en bespreek wanneer ze moeten stoppen met het gebruik van ZOCOR 40 mg als ze proberen zwanger te worden. Patiënten moeten erop worden gewezen dat als ze zwanger worden, ze moeten stoppen met het gebruik van ZOCOR en hun zorgverlener moeten bellen.
Borstvoeding
Vrouwen die borstvoeding geven, mogen ZOCOR niet gebruiken. Patiënten die een lipidenstoornis hebben en borstvoeding geven, moeten worden geadviseerd om de opties met hun beroepsbeoefenaar in de gezondheidszorg te bespreken.
