Zetia 10mg Ezetimibe Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zetia en hoe wordt het gebruikt?
Zetia is een receptgeneesmiddel dat wordt gebruikt om de symptomen van een hoog cholesterolgehalte te behandelen en het cholesterol te verlagen. Zetia kan alleen of in combinatie met andere medicijnen worden gebruikt.
Zetia behoort tot een klasse geneesmiddelen die lipidenverlagende middelen, 2-azetidinonen, worden genoemd.
Het is niet bekend of Zetia 10 mg veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat zijn de mogelijke bijwerkingen van Zetia?
Zetia kan ernstige bijwerkingen veroorzaken, waaronder:
- spierpijn,
- spiergevoeligheid of zwakte,
- koorts,
- ongewone vermoeidheid, en
- donker gekleurde urine
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zetia 10 mg zijn:
- spier- of gewrichtspijn,
- verstopte neus,
- sinuspijn,
- keelpijn,
- diarree, en
- pijn in een arm of been
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zetia. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
ZETIA (ezetimibe) zit in een klasse van lipidenverlagende verbindingen die selectief de intestinale absorptie van cholesterol en verwante fytosterolen remt. De chemische naam van ezetimibe is 1-(4-fluorfenyl)-3(R)-[3-(4-fluorfenyl)-3(S)-hydroxypropyl]-4(S)-(4-hydroxyfenyl)-2-azetidinon . De empirische formule is C24H21F2NO3. Het molecuulgewicht is 409,4 en de structuurformule is:
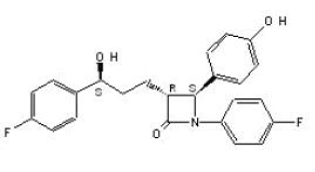
Ezetimibe is een wit, kristallijn poeder dat vrij tot zeer goed oplosbaar is in ethanol, methanol en aceton en praktisch onoplosbaar is in water. Ezetimibe heeft een smeltpunt van ongeveer 163°C en is stabiel bij omgevingstemperatuur. ZETIA 10 mg is verkrijgbaar als tablet voor orale toediening met 10 mg ezetimibe en de volgende inactieve ingrediënten: croscarmellosenatrium NF, lactosemonohydraat NF, magnesiumstearaat NF, microkristallijne cellulose NF, povidon USP en natriumlaurylsulfaat NF.
INDICATIES
Therapie met lipidenveranderende middelen zou slechts één onderdeel moeten zijn van interventie met meerdere risicofactoren bij personen met een significant verhoogd risico op atherosclerotische vaatziekte als gevolg van hypercholesterolemie. Medicamenteuze therapie is geïndiceerd als aanvulling op een dieet wanneer de respons op een dieet met een beperkt gehalte aan verzadigd vet en cholesterol en andere niet-farmacologische maatregelen alleen onvoldoende is geweest.
Primaire hyperlipidemie
Monotherapie
ZETIA®, alleen toegediend, is geïndiceerd als aanvullende therapie bij een dieet voor de verlaging van verhoogd totaal cholesterol (totaal-C), low-density lipoproteïne-cholesterol (LDL-C), apolipoproteïne B (Apo B) en non-high-density lipoproteïne-cholesterol (niet-HDL-C) bij patiënten met primaire (heterozygote familiale en niet-familiaire) hyperlipidemie.
Combinatietherapie met HMG-CoA-reductaseremmers (statines)
ZETIA 10 mg, toegediend in combinatie met een 3-hydroxy-3-methylglutaryl-co-enzym A (HMG-CoA) reductaseremmer (statine), is geïndiceerd als aanvullende therapie bij een dieet voor de verlaging van verhoogde totaal-C, LDL-C, Apo B en niet-HDL-C bij patiënten met primaire (heterozygote familiale en niet-familiale) hyperlipidemie.
Combinatietherapie met fenofibraat
ZETIA 10 mg, toegediend in combinatie met fenofibraat, is geïndiceerd als aanvullende therapie bij een dieet voor de verlaging van verhoogd totaal-C, LDL-C, Apo B en niet-HDL-C bij volwassen patiënten met gemengde hyperlipidemie.
Homozygote familiaire hypercholesterolemie (HoFH)
De combinatie van ZETIA 10 mg en atorvastatine of simvastatine is geïndiceerd voor de verlaging van verhoogde totaal-C- en LDL-C-spiegels bij patiënten met HoFH, als aanvulling op andere lipidenverlagende behandelingen (bijv. LDL-aferese) of als dergelijke behandelingen niet beschikbaar zijn .
Homozygote sitosterolemie
ZETIA 10 mg is geïndiceerd als aanvullende therapie bij een dieet voor de verlaging van verhoogde sitosterol- en campesterolspiegels bij patiënten met homozygote familiaire sitosterolemie.
Beperkingen van gebruik
Het effect van ZETIA op cardiovasculaire morbiditeit en mortaliteit is niet vastgesteld.
ZETIA is niet onderzocht bij dyslipidemieën van Fredrickson Type I, III, IV en V.
DOSERING EN ADMINISTRATIE
Algemene doseringsinformatie
De aanbevolen dosis ZETIA is 10 mg eenmaal daags.
ZETIA 10 mg kan met of zonder voedsel worden toegediend.
Gelijktijdige lipidenverlagende therapie
ZETIA 10 mg kan worden toegediend met een statine (bij patiënten met primaire hyperlipidemie) of met fenofibraat (bij patiënten met gemengde hyperlipidemie) voor een toenemend effect. Voor het gemak kan de dagelijkse dosis ZETIA tegelijkertijd met de statine of fenofibraat worden ingenomen, volgens de doseringsaanbevelingen voor de respectieve medicijnen.
Coadminis met galzuurbindende harsen
Dosering van ZETIA dient ofwel ≥2 uur vóór of ≥4 uur na toediening van een galzuurbindend hars plaats te vinden [zie DRUG-INTERACTIES ].
Patiënten met leverinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met een lichte leverfunctiestoornis [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Patiënten met nierinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met nierinsufficiëntie [zie: KLINISCHE FARMACOLOGIE ]. Wanneer simvastatine samen met simvastatine wordt gegeven aan patiënten met een matige tot ernstige nierfunctiestoornis (geschatte glomerulaire filtratiesnelheid Gebruik in specifieke populaties ].
Geriatrische patiënten
Bij geriatrische patiënten is geen dosisaanpassing nodig [zie: KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
Tabletten van 10 mg zijn witte tot gebroken witte, capsulevormige tabletten met aan één kant de inscriptie “414”.
Opslag en behandeling
Nr. 3861 - Tabletten ZETIA, 10 mg , zijn witte tot gebroken witte, capsulevormige tabletten met aan één kant de inscriptie “414”. Ze worden als volgt geleverd:
NDC 66582-414-31 flessen van 30 NDC 66582-414-54 flessen van 90 NDC 66582-414-74 flessen van 500 NDC 66582-414-76 flessen van 5000 NDC 66582-414-28 eenheidsdosisverpakkingen van 100.
Opslag
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30 ° C (59-86 ° F). [Zien USP-gecontroleerde kamertemperatuur .] Tegen vocht beschermen.
Merck Sharp & Dohme Corp., een dochteronderneming van MERCK & CO., INC., Whitehouse Station, NJ 08889, VS. Herzien: aug 2013
BIJWERKINGEN
De volgende ernstige bijwerkingen worden in meer detail besproken in andere rubrieken van het etiket:
- Leverenzymafwijkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Rabdomyolyse en myopathie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Monotherapiestudies
In de database met gecontroleerde klinische onderzoeken van ZETIA 10 mg (placebogecontroleerd) van 2396 patiënten met een mediane behandelingsduur van 12 weken (bereik 0 tot 39 weken), stopten 3,3% van de patiënten op ZETIA 10 mg en 2,9% van de patiënten op placebo vanwege bijwerkingen reacties. De meest voorkomende bijwerkingen in de groep patiënten die met ZETIA 10 mg werden behandeld en die leidden tot stopzetting van de behandeling en die vaker voorkwamen dan bij placebo waren:
- Artralgie (0,3%)
- Duizeligheid (0,2%)
- Gamma-glutamyltransferase verhoogd (0,2%)
De meest gemelde bijwerkingen (incidentie ≥2% en meer dan placebo) in de database van gecontroleerd klinisch onderzoek ZETIA monotherapie van 2396 patiënten waren: infectie van de bovenste luchtwegen (4,3%), diarree (4,1%), artralgie (3,0%), sinusitis (2,8%) en pijn in extremiteit (2,7%).
Onderzoek naar gelijktijdige toediening van statines
In de database van ZETIA + statine gecontroleerde klinische onderzoeken van 11.308 patiënten met een mediane behandelingsduur van 8 weken (bereik 0 tot 112 weken), stopten 4,0% van de patiënten op ZETIA + statine en 3,3% van de patiënten op statine alleen vanwege bijwerkingen. De meest voorkomende bijwerkingen in de groep patiënten die met ZETIA + statine werden behandeld en die leidden tot stopzetting van de behandeling en die vaker voorkwamen dan bij statine alleen waren:
- Alanine-aminotransferase verhoogd (0,6%)
- Myalgie (0,5%)
- Vermoeidheid, verhoogd aspartaataminotransferase, hoofdpijn en pijn in extremiteit (elk met 0,2%)
De meest gemelde bijwerkingen (incidentie ≥2% en meer dan alleen statine) in de database van gecontroleerd klinisch onderzoek ZETIA + statine van 11.308 patiënten waren: nasofaryngitis (3,7%), myalgie (3,2%), infectie van de bovenste luchtwegen (2,9% ), artralgie (2,6%) en diarree (2,5%).
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die zijn waargenomen in de klinische onderzoeken van een geneesmiddel niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen deze mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Monotherapie
In 10 dubbelblinde, placebogecontroleerde klinische onderzoeken, 2396 patiënten met primaire hyperlipidemie (leeftijdsbereik 9-86 jaar, 50% vrouwen, 90% blanken, 5% zwarten, 3% Iberiërs, 2% Aziaten) en verhoogd LDL-C werden behandeld met ZETIA 10 mg/dag gedurende een mediane behandelingsduur van 12 weken (bereik 0 tot 39 weken).
Bijwerkingen die zijn gemeld bij ≥2% van de patiënten die met ZETIA werden behandeld en met een incidentie hoger dan bij placebo in placebogecontroleerde onderzoeken met ZETIA 10 mg, ongeacht de beoordeling van de causaliteit, worden weergegeven in tabel 1.
TABEL 1: Klinische bijwerkingen die optreden bij ≥2% van de patiënten behandeld met ZETIA 10 mg en met een incidentie groter dan placebo, ongeacht de causaliteit
De frequentie van minder vaak voorkomende bijwerkingen was vergelijkbaar tussen ZETIA 10 mg en placebo.
Combinatie met een Statine
In 28 dubbelblinde, gecontroleerde (placebo of actief-gecontroleerde) klinische onderzoeken, 11.308 patiënten met primaire hyperlipidemie (leeftijdscategorie 10-93 jaar, 48% vrouwen, 85% blanken, 7% zwarten, 4% Iberiërs, 3% Aziaten) en verhoogde LDL-C werden behandeld met ZETIA 10 mg/dag gelijktijdig met of toegevoegd aan lopende statinetherapie voor een mediane behandelingsduur van 8 weken (bereik 0 tot 112 weken).
De incidentie van opeenvolgende verhoogde transaminasen (≥ 3 ULN) was hoger bij patiënten die ZETIA 10 mg kregen toegediend met statines (1,3%) dan bij patiënten die werden behandeld met alleen statines (0,4%). [Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Klinische bijwerkingen die zijn gemeld bij ≥2% van de patiënten die werden behandeld met ZETIA + statine en met een incidentie hoger dan die van een statine, ongeacht de beoordeling van de causaliteit, worden weergegeven in Tabel 2.
TABEL 2: Klinische bijwerkingen die optreden bij ≥2% van de patiënten behandeld met ZETIA 10 mg gelijktijdig toegediend met een statine en met een grotere incidentie dan statine, ongeacht de causaliteit
Combinatie met Fenofibraat
Deze klinische studie onder 625 patiënten met gemengde dyslipidemie (leeftijdscategorie 20-76 jaar, 44% vrouwen, 79% blanken, 0,1% zwarten, 11% Hispanics, 5% Aziaten) die gedurende maximaal 12 weken werden behandeld en 576 patiënten die gedurende maximaal 12 weken werden behandeld. nog eens 48 weken evalueerde gelijktijdige toediening van ZETIA en fenofibraat. Deze studie was niet bedoeld om behandelingsgroepen te vergelijken voor zeldzame gebeurtenissen. De incidentiepercentages (95% BI) voor klinisch belangrijke verhogingen (≥ 3 - ULN, opeenvolgend) van levertransaminasespiegels waren 4,5% (1,9, 8,8) en 2,7% (1,2, 5,4) voor monotherapie met fenofibraat (n=188) en gelijktijdig toegediende ZETIA. met respectievelijk fenofibraat (n=183), aangepast voor blootstelling aan de behandeling. Overeenkomstige incidentiecijfers voor cholecystectomie waren respectievelijk 0,6% (95%-BI: 0,0%, 3,1%) en 1,7% (95%-BI: 0,6%, 4,0%) voor fenofibraatmonotherapie en ZETIA 10 mg gelijktijdig toegediend met fenofibraat [zie DRUG-INTERACTIES ]. Het aantal patiënten dat werd blootgesteld aan gelijktijdige toediening en aan fenofibraat en ezetimibe als monotherapie was onvoldoende om het risico op galblaasaandoeningen te beoordelen. Er waren geen CPK-verhogingen > 10 - ULN in een van de behandelingsgroepen.
Postmarketingervaring
Omdat de onderstaande reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het over het algemeen niet mogelijk om een betrouwbare schatting van hun frequentie te maken of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
De volgende aanvullende bijwerkingen zijn vastgesteld tijdens het gebruik van ZETIA na goedkeuring:
Overgevoeligheidsreacties, waaronder anafylaxie, angio-oedeem, huiduitslag en urticaria; erythema multiforme; artralgie; spierpijn; verhoogde creatinefosfokinase; myopathie/rabdomyolyse [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]; verhogingen van levertransaminasen; hepatitis; buikpijn; trombocytopenie; pancreatitis; misselijkheid; duizeligheid; paresthesie; depressie; hoofdpijn; cholelithiase; cholecystitis.
DRUG-INTERACTIES
[Zien KLINISCHE FARMACOLOGIE ]
Cyclosporine
Voorzichtigheid is geboden bij gelijktijdig gebruik van ZETIA 10 mg en ciclosporine vanwege een verhoogde blootstelling aan zowel ezetimibe als ciclosporine. De ciclosporineconcentraties moeten worden gecontroleerd bij patiënten die ZETIA en ciclosporine krijgen.
De mate van toename van de blootstelling aan ezetimibe kan groter zijn bij patiënten met ernstige nierinsufficiëntie. Bij patiënten die met ciclosporine worden behandeld, moeten de mogelijke effecten van de verhoogde blootstelling aan ezetimibe bij gelijktijdig gebruik zorgvuldig worden afgewogen tegen de voordelen van veranderingen in de lipidenspiegels die door ezetimibe worden veroorzaakt.
Fibraten
De werkzaamheid en veiligheid van gelijktijdige toediening van ezetimibe met andere fibraten dan fenofibraat zijn niet onderzocht.
Fibraten kunnen de uitscheiding van cholesterol in de gal verhogen, wat kan leiden tot cholelithiasis. In een preklinische studie bij honden verhoogde ezetimibe het cholesterol in de galblaas [zie Niet-klinische toxicologie ]. Gelijktijdige toediening van ZETIA met andere fibraten dan fenofibraat wordt niet aanbevolen totdat het gebruik bij patiënten voldoende is onderzocht.
Fenofibraat
Als cholelithiase wordt vermoed bij een patiënt die ZETIA 10 mg en fenofibraat krijgt, zijn galblaasonderzoeken geïndiceerd en moet een alternatieve lipidenverlagende therapie worden overwogen [zie ONGEWENSTE REACTIES en de productetikettering voor fenofibraat].
cholestyramine
Gelijktijdige toediening van colestyramine verminderde de gemiddelde oppervlakte onder de curve (AUC) van totaal ezetimibe met ongeveer 55%. De toenemende LDL-C-verlaging door toevoeging van ezetimibe aan colestyramine kan door deze interactie worden verminderd.
Coumarine anticoagulantia
Als ezetimibe wordt toegevoegd aan warfarine, een cumarine-anticoagulans, moet de International Normalised Ratio (INR) adequaat worden gecontroleerd.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Gebruik met statines of fenofibraat
Gelijktijdige toediening van ZETIA met een specifieke statine of fenofibraat moet in overeenstemming zijn met de productetikettering voor dat medicijn.
Lever enzymen
In gecontroleerde klinische monotherapiestudies was de incidentie van opeenvolgende verhogingen (≥3 x de bovengrens van normaal [ULN]) van levertransaminasespiegels vergelijkbaar tussen ZETIA (0,5%) en placebo (0,3%).
In gecontroleerde klinische combinatiestudies van ZETIA 10 mg die gelijktijdig met een statine gestart werden, was de incidentie van opeenvolgende verhogingen (≥3 x ULN) van levertransaminasespiegels 1,3% voor patiënten behandeld met ZETIA toegediend met statines en 0,4% voor patiënten behandeld met alleen statines. Deze verhogingen in transaminasen waren over het algemeen asymptomatisch, gingen niet gepaard met cholestase, en keerden terug naar de uitgangswaarde na stopzetting van de therapie of bij voortzetting van de behandeling. Wanneer ZETIA gelijktijdig wordt toegediend met een statine, moeten levertesten worden uitgevoerd bij aanvang van de therapie en volgens de aanbevelingen van de statine. Als een verhoging van ALT of AST ≥ 3 x ULN aanhoudt, overweeg dan om ZETIA 10 mg en/of de statine stop te zetten.
Myopathie/Rhabdomyolyse
In klinische onderzoeken was er geen overmaat aan myopathie of rabdomyolyse geassocieerd met ZETIA 10 mg in vergelijking met de relevante controle-arm (placebo of statine alleen). Myopathie en rabdomyolyse zijn echter bekende bijwerkingen van statines en andere lipidenverlagende geneesmiddelen. In klinische onderzoeken was de incidentie van creatinefosfokinase (CPK) > 10 x ULN 0,2% voor ZETIA vs. 0,1% voor placebo, en 0,1% voor ZETIA samen toegediend met een statine vs. 0,4% voor statines alleen. Het risico op skeletspiertoxiciteit neemt toe met hogere doses statine, gevorderde leeftijd (> 65), hypothyreoïdie, nierfunctiestoornis en, afhankelijk van de gebruikte statine, gelijktijdig gebruik van andere geneesmiddelen.
Tijdens postmarketingervaring met ZETIA zijn gevallen van myopathie en rabdomyolyse gemeld. De meeste patiënten die rabdomyolyse ontwikkelden, gebruikten een statine voordat ze met ZETIA begonnen. Rabdomyolyse is echter gemeld bij ZETIA 10 mg monotherapie en bij toevoeging van ZETIA 10 mg aan middelen waarvan bekend is dat ze in verband worden gebracht met een verhoogd risico op rabdomyolyse, zoals fibraten. ZETIA en elke statine of fibraat die de patiënt gelijktijdig gebruikt, moet onmiddellijk worden stopgezet als myopathie wordt gediagnosticeerd of vermoed. De aanwezigheid van spiersymptomen en een CPK-waarde > 10 x de ULN duidt op myopathie.
Leverfunctiestoornis
Vanwege de onbekende effecten van de verhoogde blootstelling aan ezetimibe bij patiënten met een matige tot ernstige leverfunctiestoornis, wordt ZETIA niet aanbevolen bij deze patiënten. [Zien KLINISCHE FARMACOLOGIE ]
Informatie over patiëntbegeleiding
Zien Door de FDA goedgekeurde etikettering van patiënten (PATINTINFORMATIE).
Patiënten moeten worden geadviseerd zich te houden aan hun door het National Cholesterol Education Program (NCEP) aanbevolen dieet, een regelmatig trainingsprogramma en periodieke tests van een nuchter lipidenpanel.
Spierpijn
Alle patiënten die met ezetimibe beginnen, moeten worden geïnformeerd over het risico op myopathie en moeten worden verteld om onverklaarbare spierpijn, gevoeligheid of zwakte onmiddellijk te melden. Het risico hierop is groter bij het nemen van bepaalde soorten medicijnen. Patiënten moeten alle medicatie, zowel op recept als vrij verkrijgbaar, met hun arts bespreken.
Lever enzymen
Levertesten moeten worden uitgevoerd wanneer ZETIA 10 mg wordt toegevoegd aan statinetherapie en volgens de statineaanbevelingen.
Zwangerschap
Vrouwen in de vruchtbare leeftijd dienen geadviseerd te worden om een effectieve anticonceptiemethode te gebruiken om zwangerschap te voorkomen tijdens het gebruik van ZETIA toegevoegd aan statinetherapie. Bespreek toekomstige zwangerschapsplannen met uw patiënten en bespreek wanneer de combinatie ZETIA 10 mg en statinetherapie moet worden stopgezet als ze proberen zwanger te worden. Patiënten moeten erop worden gewezen dat als ze zwanger worden, ze moeten stoppen met het gebruik van de combinatie ZETIA 10 mg en statinetherapie en hun beroepsbeoefenaar in de gezondheidszorg moeten bellen.
Borstvoeding
Vrouwen die borstvoeding geven, dienen te worden geadviseerd ZETIA niet te gebruiken als toevoeging aan statinetherapie. Patiënten die een lipidenstoornis hebben en borstvoeding geven, moeten worden geadviseerd om de opties met hun beroepsbeoefenaren in de gezondheidszorg te bespreken.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er is een 104 weken durende carcinogeniteitsstudie met ezetimibe via de voeding uitgevoerd bij ratten in doses tot 1500 mg/kg/dag (mannetjes) en 500 mg/kg/dag (vrouwtjes) (~20 x de menselijke blootstelling bij 10 mg per dag op basis van AUC0 -24 uur voor totaal ezetimibe). Er werd ook een 104 weken durende carcinogeniteitsstudie via de voeding met ezetimibe uitgevoerd bij muizen in doses tot 500 mg/kg/dag (> 150 x de menselijke blootstelling bij 10 mg per dag op basis van AUC0-24 uur voor totaal ezetimibe). Er waren geen statistisch significante verhogingen van tumorincidenties bij met geneesmiddelen behandelde ratten of muizen.
Er is in vitro geen bewijs van mutageniteit waargenomen in een microbiële mutageniteitstest (Ames) met Salmonella typhimurium en Escherichia coli met of zonder metabolische activering. Er werd in vitro geen bewijs van clastogeniciteit waargenomen in een chromosomale aberratietest in humane lymfocyten van perifeer bloed met of zonder metabole activering. Bovendien was er geen bewijs van genotoxiciteit in de in vivo micronucleustest bij muizen.
In orale (gavage) vruchtbaarheidsonderzoeken van ezetimibe bij ratten, was er geen bewijs van reproductietoxiciteit bij doses tot 1000 mg/kg/dag bij mannelijke of vrouwelijke ratten (~7 x de menselijke blootstelling bij 10 mg per dag gebaseerd op AUC0- 24 uur voor totaal ezetimibe).
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschap Categorie C
Er zijn geen adequate en goed gecontroleerde onderzoeken naar ezetimibe bij zwangere vrouwen. Ezetimibe mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het risico voor de foetus.
In orale (maagsonde) embryo-foetale ontwikkelingsstudies van ezetimibe, uitgevoerd bij ratten en konijnen tijdens de organogenese, waren er geen aanwijzingen voor embryoletale effecten bij de geteste doses (250, 500, 1000 mg/kg/dag). Bij ratten werd een verhoogde incidentie van veelvoorkomende foetale skeletbevindingen (extra paar thoracale ribben, niet-verstarde cervicale wervelcentra, verkorte ribben) waargenomen bij 1000 mg/kg/dag (~10 x de menselijke blootstelling bij 10 mg per dag op basis van AUC0-24hr voor totaal ezetimibe). Bij konijnen die met ezetimibe werden behandeld, werd een verhoogde incidentie van extra thoracale ribben waargenomen bij 1000 mg/kg/dag (150 x de menselijke blootstelling bij 10 mg per dag op basis van AUC0-24 uur voor totaal ezetimibe). Ezetimibe passeerde de placenta wanneer drachtige ratten en konijnen meerdere orale doses kregen.
Onderzoeken met meerdere doses ezetimibe gegeven in combinatie met statines bij ratten en konijnen tijdens de organogenese resulteren in hogere blootstellingen aan ezetimibe en statine. Reproductieve bevindingen treden op bij lagere doses bij combinatietherapie in vergelijking met monotherapie.
Alle statines zijn gecontra-indiceerd bij zwangere vrouwen en vrouwen die borstvoeding geven. Wanneer ZETIA 10 mg wordt toegediend met een statine bij een vrouw die zwanger kan worden, raadpleeg dan de zwangerschapscategorie en de productetikettering van de statine. [Zie CONTRA-INDICATIES]
Moeders die borstvoeding geven
Het is niet bekend of ezetimibe wordt uitgescheiden in de moedermelk. In onderzoeken bij ratten was de blootstelling aan totaal ezetimibe bij zogende pups tot de helft van die waargenomen in maternaal plasma. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer ZETIA 10 mg wordt toegediend aan een vrouw die borstvoeding geeft. ZETIA mag niet worden gebruikt bij moeders die borstvoeding geven, tenzij het mogelijke voordeel opweegt tegen het mogelijke risico voor het kind.
Pediatrisch gebruik
De effecten van ZETIA samen met simvastatine (n=126) vergeleken met simvastatine als monotherapie (n=122) zijn geëvalueerd bij adolescente jongens en meisjes met heterozygote familiaire hypercholesterolemie (HeFH). In een multicenter, dubbelblinde, gecontroleerde studie gevolgd door een open-label fase, 142 jongens en 106 postmenarchale meisjes, 10 tot 17 jaar (gemiddelde leeftijd 14,2 jaar, 43% vrouwen, 82% blanken, 4% Aziatisch, 2% zwarten , 13% multiraciaal) met HeFH werden gerandomiseerd naar ZETIA 10 mg gelijktijdig toegediend met simvastatine of simvastatine als monotherapie. Opname in het onderzoek vereiste 1) een baseline LDL-C-niveau tussen 160 en 400 mg/dL en 2) een medische voorgeschiedenis en klinische presentatie consistent met HeFH. De gemiddelde baseline LDL-C-waarde was 225 mg/dL (bereik: 161-351 mg/dL) in de groep ZETIA 10 mg gelijktijdig toegediend met simvastatine vergeleken met 219 mg/dL (bereik: 149-336 mg/dL) in de simvastatine monotherapie groep. De patiënten kregen gelijktijdig ZETIA en simvastatine (10 mg, 20 mg of 40 mg) of simvastatine monotherapie (10 mg, 20 mg of 40 mg) gedurende 6 weken, gelijktijdig toegediend ZETIA en 40 mg simvastatine of 40 mg simvastatine monotherapie voor de volgende 27 weken, en open-label gelijktijdig toegediend ZETIA en simvastatine (10 mg, 20 mg of 40 mg) gedurende 20 weken daarna.
De resultaten van het onderzoek in week 6 zijn samengevat in tabel 3. De resultaten in week 33 waren consistent met die in week 6.
TABEL 3: Gemiddeld percentage verschil in week 6 tussen de gepoolde ZETIA 10 mg gelijktijdig toegediend met de simvastatinegroep en de gepoolde simvastatinemonotherapiegroep bij adolescente patiënten met heterozygote familiaire hypercholesterolemie
Vanaf het begin van het onderzoek tot het einde van week 33 werden stopzettingen als gevolg van een bijwerking opgetreden bij 7 (6%) patiënten in de ZETIA-groep die gelijktijdig met simvastatine werd toegediend en bij 2 (2%) patiënten in de groep met simvastatine als monotherapie.
Tijdens het onderzoek traden levertransaminaseverhogingen (twee opeenvolgende metingen voor ALAT en/of ASAT ≥ 3 x ULN) op bij vier (3%) personen in de groep ZETIA 10 mg gelijktijdig toegediend met simvastatine en bij twee (2%) personen in de monotherapie met simvastatine groep. Verhogingen van CPK (≥10 x ULN) traden op bij twee (2%) personen in de ZETIA-groep die gelijktijdig met simvastatine werd toegediend en bij nul personen in de groep met simvastatine als monotherapie.
In deze beperkte gecontroleerde studie was er geen significant effect op de groei of seksuele rijping bij adolescente jongens of meisjes, of op de lengte van de menstruatiecyclus bij meisjes.
Gelijktijdige toediening van ZETIA 10 mg met simvastatine in doses hoger dan 40 mg/dag is niet onderzocht bij adolescenten. Ook is ZETIA 10 mg niet onderzocht bij patiënten jonger dan 10 jaar of bij premenarchale meisjes.
Op basis van totaal ezetimibe (ezetimibe + ezetimibe-glucuronide) zijn er geen farmacokinetische verschillen tussen adolescenten en volwassenen. Farmacokinetische gegevens bij pediatrische patiënten
Geriatrisch gebruik
Monotherapiestudies
Van de 2396 patiënten die ZETIA 10 mg kregen in klinische onderzoeken, waren 669 (28%) 65 jaar en ouder en 111 (5%) 75 jaar en ouder.
Onderzoek naar gelijktijdige toediening van statines
Van de 11.308 patiënten die in klinische onderzoeken ZETIA + statine kregen, waren 3587 (32%) 65 jaar en ouder en 924 (8%) waren 75 jaar en ouder.
Er werden geen algemene verschillen in veiligheid en werkzaamheid waargenomen tussen deze patiënten en jongere patiënten, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten [zie KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Bij gebruik als monotherapie is geen dosisaanpassing van ZETIA 10 mg nodig.
In het onderzoek naar hart- en nierbescherming (SHARP) bij 9270 patiënten met matige tot ernstige nierfunctiestoornis (6247 niet-dialysepatiënten met mediane serumcreatinine 2,5 mg/dl en mediane geschatte glomerulaire filtratiesnelheid 25,6 ml/min/1,73 m², en 3023 dialysepatiënten), was de incidentie van ernstige bijwerkingen, bijwerkingen die leidden tot stopzetting van de onderzoeksbehandeling, of bijwerkingen van speciaal belang (musculoskeletale bijwerkingen, leverenzymafwijkingen, incidentele kanker) vergelijkbaar tussen patiënten die ooit ezetimibe 10 mg plus kregen toegewezen. simvastatine 20 mg (n=4650) of placebo (n=4620) gedurende een mediane follow-up van 4,9 jaar. Omdat nierinsufficiëntie echter een risicofactor is voor statine-geassocieerde myopathie, moeten doses simvastatine hoger dan 20 mg met voorzichtigheid worden gebruikt en nauwlettend worden gecontroleerd bij gelijktijdige toediening met ZETIA bij patiënten met matige tot ernstige nierinsufficiëntie.
Leverfunctiestoornis
ZETIA wordt niet aanbevolen bij patiënten met een matige tot ernstige leverfunctiestoornis [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
ZETIA 10 mg gelijktijdig gegeven met een statine is gecontra-indiceerd bij patiënten met actieve leverziekte of onverklaarbare aanhoudende verhogingen van levertransaminasespiegels [zie CONTRA-INDICATIES ; WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
In klinische onderzoeken is toediening van ezetimibe 50 mg/dag aan 15 gezonde proefpersonen gedurende maximaal 14 dagen, 40 mg/dag aan 18 patiënten met primaire hyperlipidemie gedurende maximaal 56 dagen en 40 mg/dag aan 27 patiënten met homozygote sitosterolemie gedurende 26 weken werd over het algemeen goed verdragen. Eén vrouwelijke patiënt met homozygote sitosterolemie nam een accidentele overdosis ezetimibe 120 mg/dag gedurende 28 dagen zonder gerapporteerde klinische of laboratoriumbijwerkingen.
In geval van overdosering dienen symptomatische en ondersteunende maatregelen te worden genomen.
CONTRA-INDICATIES
ZETIA is gecontra-indiceerd onder de volgende omstandigheden:
- De combinatie van ZETIA 10 mg met een statine is gecontra-indiceerd bij patiënten met actieve leverziekte of onverklaarbare aanhoudende verhogingen van levertransaminasespiegels.
- Vrouwen die zwanger zijn of zwanger kunnen worden. Omdat statines de cholesterolsynthese verlagen en mogelijk de synthese van andere biologisch actieve stoffen afgeleid van cholesterol, kan ZETIA in combinatie met een statine schade aan de foetus veroorzaken bij toediening aan zwangere vrouwen. Bovendien is er geen duidelijk voordeel van therapie tijdens de zwangerschap en is de veiligheid bij zwangere vrouwen niet vastgesteld. Als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de foetus en het ontbreken van bekende klinische voordelen bij voortgezet gebruik tijdens de zwangerschap. [Zien Gebruik in specifieke populaties ]
- Moeders die borstvoeding geven. Omdat statines kunnen overgaan in de moedermelk en omdat statines ernstige bijwerkingen kunnen veroorzaken bij zuigelingen die borstvoeding geven, moeten vrouwen die behandeling met ZETIA nodig hebben in combinatie met een statine worden geadviseerd hun zuigelingen niet te voeden [zie Gebruik in specifieke populaties ].
- Patiënten met een bekende overgevoeligheid voor een van de bestanddelen van dit product. Overgevoeligheidsreacties waaronder anafylaxie, angio-oedeem, huiduitslag en urticaria zijn gemeld bij ZETIA (zie ONGEWENSTE REACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Ezetimibe verlaagt het cholesterolgehalte in het bloed door de opname van cholesterol door de dunne darm te remmen. In een 2 weken durende klinische studie bij 18 patiënten met hypercholesterolemie remde ZETIA 10 mg de intestinale cholesterolabsorptie met 54%, vergeleken met placebo. ZETIA had geen klinisch betekenisvol effect op de plasmaconcentraties van de in vet oplosbare vitamines A, D en E (in een onderzoek onder 113 patiënten) en had geen nadelige invloed op de productie van bijnierschorssteroïden (in een onderzoek onder 118 patiënten).
Het cholesterolgehalte van de lever is voornamelijk afkomstig van drie bronnen. De lever kan cholesterol synthetiseren, cholesterol uit het bloed opnemen uit circulerende lipoproteïnen of cholesterol opnemen dat door de dunne darm wordt opgenomen. Intestinaal cholesterol wordt voornamelijk afgeleid van cholesterol dat wordt uitgescheiden in de gal en uit cholesterol uit de voeding.
Ezetimibe heeft een werkingsmechanisme dat verschilt van dat van andere klassen van cholesterolverlagende verbindingen (statines, galzuurbindende harsen [harsen], fibrinezuurderivaten en plantenstanolen). Het moleculaire doelwit van ezetimibe is de steroltransporter, Niemann-Pick C1-Like 1 (NPC1L1), die betrokken is bij de intestinale opname van cholesterol en fytosterolen.
Ezetimibe remt de cholesterolsynthese in de lever niet en verhoogt de galzuurexcretie niet. In plaats daarvan lokaliseert ezetimibe zich aan de borstelrand van de dunne darm en remt het de absorptie van cholesterol, wat leidt tot een afname van de afgifte van darmcholesterol aan de lever. Dit veroorzaakt een vermindering van de cholesterolvoorraden in de lever en een toename van de klaring van cholesterol uit het bloed; dit aparte mechanisme is complementair aan dat van statines en van fenofibraat [zie: Klinische studies ].
farmacodynamiek
Klinische studies hebben aangetoond dat verhoogde niveaus van totaal-C, LDL-C en Apo B, het belangrijkste eiwitbestanddeel van LDL, menselijke atherosclerose bevorderen. Bovendien zijn verlaagde niveaus van HDL-C geassocieerd met de ontwikkeling van atherosclerose. Epidemiologische studies hebben aangetoond dat cardiovasculaire morbiditeit en mortaliteit direct variëren met het niveau van totaal-C en LDL-C en omgekeerd met het niveau van HDL-C. Net als LDL kunnen cholesterolverrijkte triglyceriderijke lipoproteïnen, waaronder zeer lage dichtheid lipoproteïnen (VLDL), intermediate-density lipoproteïnen (IDL) en restanten, ook atherosclerose bevorderen. Het onafhankelijke effect van het verhogen van HDL-C of het verlagen van TG op het risico op coronaire en cardiovasculaire morbiditeit en mortaliteit is niet vastgesteld.
ZETIA verlaagt totaal-C, LDL-C, Apo B, niet-HDL-C en TG en verhoogt HDL-C bij patiënten met hyperlipidemie. Toediening van ZETIA 10 mg met een statine is effectief bij het verbeteren van serum totaal-C, LDL-C, Apo B, niet-HDL-C, TG en HDL-C naast beide behandelingen alleen. Toediening van ZETIA 10 mg met fenofibraat is effectief bij het verbeteren van serum totaal-C, LDL-C, Apo B en niet-HDL-C bij patiënten met gemengde hyperlipidemie in vergelijking met beide behandelingen alleen. De effecten van ezetimibe, alleen of als aanvulling op een statine of fenofibraat, op cardiovasculaire morbiditeit en mortaliteit zijn niet vastgesteld.
Farmacokinetiek
Absorptie
Na orale toediening wordt ezetimibe geabsorbeerd en uitgebreid geconjugeerd tot een farmacologisch actief fenolglucuronide (ezetimibe-glucuronide). Na een enkelvoudige dosis van 10 mg ZETIA 10 mg aan nuchtere volwassenen, werden gemiddelde ezetimibe-piekplasmaconcentraties (Cmax) van 3,4 tot 5,5 ng/ml bereikt binnen 4 tot 12 uur (Tmax). Gemiddelde Cmax-waarden voor ezetimibe-glucuronide van 45 tot 71 ng/ml werden bereikt tussen 1 en 2 uur (Tmax). Er was geen substantiële afwijking van de dosisproportionaliteit tussen 5 en 20 mg. De absolute biologische beschikbaarheid van ezetimibe kan niet worden bepaald, aangezien de verbinding vrijwel onoplosbaar is in waterige media die geschikt zijn voor injectie.
Effect van voedsel op orale absorptie
Gelijktijdige toediening van voedsel (vetrijke of vetarme maaltijden) had geen effect op de mate van absorptie van ezetimibe bij toediening als ZETIA 10-mg-tabletten. De C-waarde van ezetimibe steeg met 38% bij consumptie van vetrijke maaltijden. ZETIA kan met of zonder voedsel worden toegediend.
Verdeling
Ezetimibe en ezetimibe-glucuronide zijn sterk gebonden (> 90%) aan humane plasma-eiwitten.
Metabolisme en uitscheiding
Ezetimibe wordt voornamelijk gemetaboliseerd in de dunne darm en de lever via glucuronideconjugatie (een fase II-reactie) met daaropvolgende uitscheiding via de gal en de nieren. Bij alle geëvalueerde soorten is een minimaal oxidatief metabolisme (een fase I-reactie) waargenomen.
Bij mensen wordt ezetimibe snel gemetaboliseerd tot ezetimibe-glucuronide. Ezetimibe en ezetimibeglucuronide zijn de belangrijkste van het geneesmiddel afgeleide verbindingen die in plasma worden gedetecteerd, die respectievelijk ongeveer 10 tot 20% en 80 tot 90% van het totale geneesmiddel in plasma uitmaken. Zowel ezetimibe als ezetimibeglucuronide worden uit het plasma geëlimineerd met een halfwaardetijd van ongeveer 22 uur voor zowel ezetimibe als ezetimibeglucuronide. Plasmaconcentratie-tijdprofielen vertonen meerdere pieken, wat duidt op enterohepatische recycling.
Na orale toediening van 14C-ezetimibe (20 mg) aan menselijke proefpersonen was totaal ezetimibe (ezetimibe + ezetimibe-glucuronide) goed voor ongeveer 93% van de totale radioactiviteit in plasma. Na 48 uur waren er geen detecteerbare niveaus van radioactiviteit in het plasma.
Ongeveer 78% en 11% van de toegediende radioactiviteit werd teruggevonden in respectievelijk de feces en urine over een verzamelperiode van 10 dagen. Ezetimibe was de belangrijkste component in de feces en was goed voor 69% van de toegediende dosis, terwijl ezetimibe-glucuronide de belangrijkste component in de urine was en goed was voor 9% van de toegediende dosis.
Specifieke populaties
Geriatrische patiënten: In een onderzoek met meervoudige doses waarbij ezetimibe 10 mg eenmaal daags gedurende 10 dagen werd gegeven, waren de plasmaconcentraties van totaal ezetimibe ongeveer 2 maal hoger bij oudere (≥65 jaar) gezonde proefpersonen in vergelijking met jongere proefpersonen.
Pediatrische patiënten: [Zien Gebruik in specifieke populaties ]
Geslacht: In een onderzoek met meervoudige doses waarbij ezetimibe 10 mg eenmaal daags gedurende 10 dagen werd gegeven, waren de plasmaconcentraties van totaal ezetimibe bij vrouwen iets hoger (
Ras: Op basis van een meta-analyse van farmacokinetische onderzoeken met meerdere doses waren er geen farmacokinetische verschillen tussen zwarte en blanke proefpersonen. Studies bij Aziatische proefpersonen gaven aan dat de farmacokinetiek van ezetimibe vergelijkbaar was met die bij blanke proefpersonen.
Leverfunctiestoornis: Na een enkelvoudige dosis van 10 mg ezetimibe was de gemiddelde AUC van totaal ezetimibe bij patiënten met een lichte leverfunctiestoornis (Child-Pugh-score 5 tot 6) ongeveer 1,7 maal hoger dan bij gezonde proefpersonen. De gemiddelde AUC-waarden voor totaal ezetimibe en ezetimibe waren respectievelijk ongeveer 3- tot 4-voudig en 5- tot 6-voudig verhoogd bij patiënten met een matige (Child-Pugh-score 7 tot 9) of ernstige leverfunctiestoornis (Child-Pugh-score 10 tot 15). In een 14-daagse studie met meervoudige doses (10 mg per dag) bij patiënten met een matige leverfunctiestoornis, waren de gemiddelde AUC-waarden voor totaal ezetimibe en ezetimibe op dag 1 en dag 14 ongeveer 4-voudig verhoogd in vergelijking met gezonde proefpersonen. Vanwege de onbekende effecten van de verhoogde blootstelling aan ezetimibe bij patiënten met een matige of ernstige leverfunctiestoornis, wordt ZETIA niet aanbevolen bij deze patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Nierfunctiestoornis: Na een enkelvoudige dosis van 10 mg ezetimibe bij patiënten met ernstige nierziekte (n=8; gemiddelde CrCl ≥ 30 ml/min/1,73 m²), waren de gemiddelde AUC-waarden voor totaal ezetimibe, ezetimibeglucuronide en ezetimibe met ongeveer 1,5 verhoogd. -voudig, vergeleken met gezonde proefpersonen (n=9).
Geneesmiddelinteracties
[Zie ook DRUG-INTERACTIES ]
ZETIA 10 mg had geen significant effect op een reeks probe-geneesmiddelen (cafeïne, dextromethorfan, tolbutamide en IV-midazolam) waarvan bekend is dat ze worden gemetaboliseerd door cytochroom P450 (1A2, 2D6, 2C8/9 en 3A4) in een “cocktail”-onderzoek van twaalf gezonde volwassen mannen. Dit geeft aan dat ezetimibe geen remmer of inductor is van deze cytochroom P450-iso-zymen, en het is onwaarschijnlijk dat ezetimibe het metabolisme van geneesmiddelen die door deze enzymen worden gemetaboliseerd, zal beïnvloeden.
TABEL 4: Effect van gelijktijdig toegediende geneesmiddelen op totaal ezetimibe
TABEL 5: Effect van gelijktijdige toediening van ezetimibe op systemische blootstelling aan andere geneesmiddelen
Dierlijke toxicologie en/of farmacologie
Het hypocholesterolemische effect van ezetimibe werd geëvalueerd bij met cholesterol gevoede resusapen, honden, ratten en muismodellen van het cholesterolmetabolisme bij de mens. Ezetimibe bleek een ED50-waarde van 0,5 g/kg/dag te hebben voor het remmen van de stijging van het plasmacholesterolgehalte bij apen. De ED50-waarden bij honden, ratten en muizen waren respectievelijk 7, 30 en 700 g/kg/dag. Deze resultaten zijn consistent met het feit dat ZETIA een krachtige cholesterolabsorptieremmer is.
In een rattenmodel, waarbij de glucuronidemetaboliet van ezetimibe (SCH 60663) intraduodenaal werd toegediend, was de metaboliet even krachtig als de moederverbinding (SCH 58235) bij het remmen van de absorptie van cholesterol, wat suggereert dat de glucuronidemetaboliet een vergelijkbare activiteit had als de ouderverbinding. medicijn.
In onderzoeken van 1 maand bij honden die ezetimibe (0,03 tot 300 mg/kg/dag) kregen, nam de cholesterolconcentratie in de galblaas met ~2- tot 4-voudig toe. Een dosis van 300 mg/kg/dag toegediend aan honden gedurende één jaar resulteerde echter niet in galsteenvorming of andere nadelige hepatobiliaire effecten. In een 14-daagse studie bij muizen die ezetimibe (0,3 tot 5 mg/kg/dag) kregen en een vetarm of cholesterolrijk dieet kregen, was de cholesterolconcentratie in de galblaas respectievelijk niet beïnvloed of verlaagd tot normale niveaus.
Er is een reeks acute preklinische onderzoeken uitgevoerd om de selectiviteit van ZETIA voor het remmen van cholesterolabsorptie te bepalen. Ezetimibe remde de absorptie van 14C-cholesterol zonder effect op de absorptie van triglyceriden, vetzuren, galzuren, progesteron, ethinylestradiol of de in vet oplosbare vitamines A en D.
In toxiciteitsonderzoeken van 4 tot 12 weken bij muizen induceerde ezetimibe geen cytochroom P450 geneesmiddelmetaboliserende enzymen. In toxiciteitsstudies werd een farmacokinetische interactie van ezetimibe met statines (ouders of hun actieve hydroxyzuurmetabolieten) gezien bij ratten, honden en konijnen.
Klinische studies
Primaire hyperlipidemie
ZETIA 10 mg vermindert totaal-C, LDL-C, Apo B, niet-HDL-C en TG en verhoogt HDL-C bij patiënten met hyperlipidemie. Maximale tot bijna maximale respons wordt over het algemeen binnen 2 weken bereikt en blijft behouden tijdens chronische therapie.
Monotherapie
In twee multicenter, dubbelblinde, placebogecontroleerde, 12 weken durende onderzoeken bij 1719 patiënten met primaire hyperlipidemie, verlaagde ZETIA significant het totaal-C, LDL-C, Apo B, niet-HDL-C en TG, en verhoogde het HDL- C in vergelijking met placebo (zie tabel 6). Verlaging van LDL-C was consistent over leeftijd, geslacht en baseline LDL-C.
TABEL 6: Respons op ZETIA 10 mg bij patiënten met primaire hyperlipidemie (gemiddelde % verandering ten opzichte van onbehandelde baseline†)
Combinatie met statines
ZETIA 10 mg toegevoegd aan lopende statinetherapie
In een multicenter, dubbelblinde, placebo-gecontroleerde, 8 weken durende studie, 769 patiënten met primaire hyperlipidemie, bekende coronaire hartziekte of meerdere cardiovasculaire risicofactoren die al statine monotherapie kregen, maar die hun NCEP ATP II doel LDL niet hadden bereikt -C-doel werden gerandomiseerd om ofwel ZETIA 10 mg of placebo te krijgen naast hun lopende statine.
ZETIA 10 mg, toegevoegd aan lopende statinetherapie, verlaagde het totaal-C, LDL-C, Apo B, niet-HDL-C en TG significant en verhoogde HDL-C in vergelijking met een statine die alleen werd toegediend (zie tabel 7). LDL-C-verlagingen geïnduceerd door ZETIA 10 mg waren over het algemeen consistent voor alle statines.
TABEL 7: Reactie op toevoeging van ZETIA 10 mg aan lopende statinetherapie bij patiënten met hyperlipidemie (gemiddeld % verandering ten opzichte van de behandelde baseline‡)
ZETIA gelijktijdig gestart met een statine
In vier multicenter, dubbelblinde, placebogecontroleerde, 12 weken durende onderzoeken, bij 2382 hyperlipidemische patiënten, werd ZETIA of placebo alleen of met verschillende doses atorvastatine, simvastatine, pravastatine of lovastatine toegediend.
Toen alle patiënten die ZETIA kregen met een statine werden vergeleken met alle patiënten die alleen de overeenkomstige statine kregen, verlaagde ZETIA 10 mg significant het totaal-C, LDL-C, Apo B, niet-HDL-C en TG, en, met uitzondering van pravastatine , verhoogde HDL-C in vergelijking met de statine die alleen werd toegediend. LDL-C-verlagingen geïnduceerd door ZETIA 10 mg waren over het algemeen consistent voor alle statines. (Zie voetnoot, tabellen 8 t/m 11.)
TABEL 8: Respons op ZETIA 10 mg en gelijktijdig gestart met atorvastatine bij patiënten met primaire hyperlipidemie (gemiddeld % verandering ten opzichte van onbehandelde baseline†)
TABEL 9: Respons op ZETIA 10 mg en gelijktijdig gestart met simvastatine bij patiënten met primaire hyperlipidemie (gemiddeld % verandering ten opzichte van onbehandelde baseline†)
TABEL 10: Respons op gelijktijdig gestart ZETIA en pravastatine bij patiënten met primaire hyperlipidemie (gemiddeld % verandering ten opzichte van onbehandelde baseline†)
TABEL 11: Respons op gelijktijdig gestart ZETIA en lovastatine bij patiënten met primaire hyperlipidemie (gemiddeld % verandering ten opzichte van onbehandelde baseline†)
Combinatie met Fenofibraat
In een multicenter, dubbelblind, placebogecontroleerd, klinisch onderzoek bij patiënten met gemengde hyperlipidemie werden 625 patiënten gedurende maximaal 12 weken behandeld en 576 gedurende maximaal 48 weken. Patiënten werden gerandomiseerd om placebo, ZETIA alleen, 160 mg fenofibraat alleen, of ZETIA 10 mg en 160 mg fenofibraat te krijgen in de 12 weken durende studie. Na voltooiing van de 12 weken durende studie werden in aanmerking komende patiënten toegewezen aan ZETIA gelijktijdig toegediend met fenofibraat of fenofibraatmonotherapie voor nog eens 48 weken.
ZETIA 10 mg gelijktijdig toegediend met fenofibraat verlaagde het totaal-C, LDL-C, Apo B en non-HDL-C significant in vergelijking met alleen fenofibraat. De procentuele afname van TG en procentuele toename van HDLC voor ZETIA gelijktijdig toegediend met fenofibraat waren vergelijkbaar met die voor fenofibraat alleen toegediend (zie tabel 12).
TABEL 12: Respons op ZETIA 10 mg en gelijktijdig gestart met fenofibraat bij patiënten met gemengde hyperlipidemie (gemiddelde % verandering ten opzichte van onbehandelde baseline† na 12 weken†)
De veranderingen in lipide-eindpunten na nog eens 48 weken behandeling met ZETIA gelijktijdig toegediend met fenofibraat of met alleen fenofibraat waren consistent met de 12 weken durende gegevens die hierboven zijn weergegeven.
Homozygote familiaire hypercholesterolemie (HoFH)
Er is een onderzoek uitgevoerd om de werkzaamheid van ZETIA bij de behandeling van HoFH te beoordelen. Aan deze dubbelblinde, gerandomiseerde studie van 12 weken namen 50 patiënten deel met een klinische en/of genotypische diagnose van HoFH, met of zonder gelijktijdige LDL-aferese, die al atorvastatine of simvastatine (40 mg) kregen. Patiënten werden gerandomiseerd naar een van de drie behandelingsgroepen, atorvastatine of simvastatine (80 mg), ZETIA 10 mg toegediend met atorvastatine of simvastatine (40 mg), of ZETIA toegediend met atorvastatine of simvastatine (80 mg). Vanwege de verminderde biologische beschikbaarheid van ezetimibe bij patiënten die gelijktijdig colestyramine krijgen (zie DRUG-INTERACTIES ], werd ezetimibe ten minste 4 uur voor of na toediening van harsen gedoseerd. De gemiddelde baseline LDL-C was 341 mg/dL bij de patiënten gerandomiseerd naar atorvastatine 80 mg of simvastatine 80 mg alleen en 316 mg/dL in de groep gerandomiseerd naar ZETIA 10 mg plus atorvastatine 40 of 80 mg of simvastatine 40 of 80 mg. ZETIA 10 mg, toegediend met atorvastatine of simvastatine (40- en 80-mg statinegroepen, gepoold), verminderde significant LDL-C (21%) vergeleken met het verhogen van de dosis simvastatine of atorvastatine monotherapie van 40 naar 80 mg (7%). Bij degenen die werden behandeld met ZETIA 10 mg plus 80 mg atorvastatine of met ZETIA 10 mg plus 80 mg simvastatine, was LDL-C verminderd met 27%.
Homozygote sitosterolemie (fytosterolemie)
Er is een onderzoek uitgevoerd om de werkzaamheid van ZETIA bij de behandeling van homozygote sitosterolemie te beoordelen. In dit multicenter, dubbelblinde, placebogecontroleerde, 8 weken durende onderzoek werden 37 patiënten met homozygote sitosterolemie met verhoogde plasma-sitosterolspiegels (> 5 mg/dl) op hun huidige therapeutische regime (dieet, galzuurbindende harsen, statines, ileale bypass-chirurgie en/of LDL-aferese), werden gerandomiseerd naar ZETIA (n=30) of placebo (n=7). Vanwege de verminderde biologische beschikbaarheid van ezetimibe bij patiënten die gelijktijdig colestyramine krijgen (zie DRUG-INTERACTIES ], werd ezetimibe gedoseerd ten minste 2 uur vóór of 4 uur na toediening van de harsen. Met uitzondering van de enige persoon die LDL-aferese kreeg, verlaagde ZETIA het plasma sitosterol en campesterol significant, met respectievelijk 21% en 24% ten opzichte van baseline. Daarentegen hadden patiënten die placebo kregen een toename van sitosterol en campesterol van respectievelijk 4% en 3% ten opzichte van baseline. Bij patiënten die met ZETIA 10 mg werden behandeld, werden de gemiddelde plasmaspiegels van plantensterolen in de loop van het onderzoek progressief verlaagd. De effecten van verlaging van sitosterol en campesterol in plasma op het verminderen van de risico's op cardiovasculaire morbiditeit en mortaliteit zijn niet vastgesteld.
Verlagingen van sitosterol en campesterol waren consistent tussen patiënten die ZETIA 10 mg gelijktijdig gebruikten met galzuurbindende harsen (n=8) en patiënten die geen gelijktijdige behandeling met galzuurbindende harsen kregen (n=21).
Beperkingen van gebruik
Het effect van ZETIA 10 mg op cardiovasculaire morbiditeit en mortaliteit is niet vastgesteld.
PATIËNT INFORMATIE
ZETIA® (ezetimibe) Tabletten
Patiënteninformatie over ZETIA (zet´-ea)
Generieke naam: ezetimibe (e-zet´-e-mib)
Lees deze informatie zorgvuldig door voordat u start met het gebruik van ZETIA® en elke keer dat u meer ZETIA krijgt. Mogelijk is er nieuwe informatie. Deze informatie vervangt niet het praten met uw arts over uw medische toestand of uw behandeling. Als u vragen heeft over ZETIA, neem dan contact op met uw arts. Alleen uw arts kan bepalen of ZETIA geschikt voor u is.
Wat is ZETIA?
ZETIA is een geneesmiddel dat wordt gebruikt om de niveaus van totaal cholesterol en LDL (slechte) cholesterol in het bloed te verlagen. ZETIA is bedoeld voor patiënten die hun cholesterolgehalte niet onder controle kunnen krijgen door alleen een dieet en lichaamsbeweging. Het kan op zichzelf of in combinatie met andere geneesmiddelen worden gebruikt om een hoog cholesterolgehalte te behandelen. U dient tijdens het gebruik van dit geneesmiddel een cholesterolverlagend dieet te volgen.
ZETIA werkt om de hoeveelheid cholesterol die uw lichaam opneemt te verminderen. ZETIA 10 mg helpt u niet om af te vallen. Het is niet aangetoond dat ZETIA 10 mg hartaandoeningen of hartaanvallen voorkomt.
Voor meer informatie over cholesterol, zie de rubriek "Wat moet ik weten over hoog cholesterol?" sectie die volgt.
Wie mag ZETIA 10 mg niet gebruiken?
- Gebruik ZETIA 10 mg niet als u allergisch bent voor ezetimibe, het actieve bestanddeel van ZETIA, of voor de inactieve ingrediënten. Voor een lijst met inactieve ingrediënten, zie de sectie “Inactieve ingrediënten” die volgt.
- Als u een actieve leverziekte heeft, neem ZETIA 10 mg dan niet in terwijl u cholesterolverlagende geneesmiddelen gebruikt die statines worden genoemd.
- Als u zwanger bent of borstvoeding geeft, neem ZETIA dan niet in terwijl u een statine gebruikt.
- Als u een vrouw bent in de vruchtbare leeftijd, moet u een effectieve anticonceptiemethode gebruiken om zwangerschap te voorkomen terwijl u ZETIA gebruikt als aanvulling op statinetherapie.
ZETIA is niet onderzocht bij kinderen jonger dan 10 jaar.
Wat moet ik mijn arts vertellen voor en tijdens het gebruik van ZETIA 10 mg?
Vertel uw arts over alle voorgeschreven en niet-voorgeschreven geneesmiddelen die u gebruikt of van plan bent te gebruiken, inclusief natuurlijke of kruidengeneesmiddelen.
Vertel uw arts over al uw medische aandoeningen, inclusief allergieën.
Vertel het uw arts als u:
- ooit leverproblemen gehad. ZETIA 10 mg is mogelijk niet geschikt voor u.
- zwanger bent of van plan bent zwanger te worden. Uw arts zal met u bespreken of ZETIA 10 mg geschikt voor u is.
- zijn borstvoeding. We weten niet of ZETIA 10 mg via uw melk aan uw baby kan worden doorgegeven. Uw arts zal met u bespreken of ZETIA 10 mg geschikt voor u is.
- onverklaarbare spierpijn, gevoeligheid of zwakte ervaart.
Hoe moet ik ZETIA 10 mg innemen?
- Neem ZETIA eenmaal per dag in, met of zonder voedsel. Het kan gemakkelijker zijn om te onthouden dat u uw dosis moet innemen als u deze elke dag op hetzelfde tijdstip doet, zoals bij het ontbijt, het avondeten of voor het slapengaan. Als u ook een ander geneesmiddel gebruikt om uw cholesterol te verlagen, vraag dan uw arts of u dit tegelijkertijd kunt innemen.
- Als u bent vergeten ZETIA in te nemen, neem het dan in zodra u het zich herinnert. Neem echter niet meer dan één dosis ZETIA per dag in.
- Blijf een cholesterolverlagend dieet volgen terwijl u ZETIA gebruikt. Vraag uw arts of u dieetinformatie nodig heeft.
- Blijf ZETIA 10 mg innemen tenzij uw arts u zegt te stoppen. Het is belangrijk dat u ZETIA 10 mg blijft gebruiken, ook als u zich niet ziek voelt.
- Raadpleeg uw arts regelmatig om uw cholesterolgehalte te controleren en op bijwerkingen te controleren. Uw arts kan bloedonderzoeken doen om uw lever te controleren voordat u start met het gebruik van ZETIA met een statine en tijdens de behandeling.
Wat zijn de mogelijke bijwerkingen van ZETIA?
In klinische onderzoeken rapporteerden patiënten weinig bijwerkingen tijdens het gebruik van ZETIA. Deze omvatten diarree, gewrichtspijn en vermoeidheid.
Patiënten hebben ernstige spierproblemen gehad tijdens het gebruik van ZETIA 10 mg, meestal wanneer ZETIA 10 mg werd toegevoegd aan een statine. Als u onverklaarbare spierpijn, gevoeligheid of zwakte ervaart tijdens het gebruik van ZETIA, neem dan onmiddellijk contact op met uw arts. U moet dit snel doen, want in zeldzame gevallen kunnen deze spierproblemen ernstig zijn, met spierafbraak die nierbeschadiging tot gevolg heeft.
Daarnaast zijn de volgende bijwerkingen gemeld bij algemeen gebruik: allergische reacties (waarvoor onmiddellijke behandeling nodig kan zijn) waaronder zwelling van het gezicht, de lippen, tong en/of keel die ademhalings- of slikproblemen kan veroorzaken, huiduitslag en netelroos ; verheven rode uitslag, soms met doelvormige laesies; gewrichtspijn; spierpijn; veranderingen in sommige laboratoriumbloedonderzoeken; leverproblemen; buikpijn; ontsteking van de alvleesklier; misselijkheid; duizeligheid; tintelend gevoel; depressie; hoofdpijn; galstenen; ontsteking van de galblaas.
Vertel het uw arts als u deze of andere medische problemen heeft terwijl u ZETIA gebruikt. Vraag uw arts of apotheker om een volledige lijst van bijwerkingen.
Wat moet ik weten over een hoog cholesterolgehalte?
Cholesterol is een type vet dat in uw bloed wordt aangetroffen. Uw totale cholesterol bestaat uit LDL- en HDL-cholesterol.
LDL-cholesterol wordt "slechte" cholesterol genoemd omdat het zich in de wand van uw bloedvaten kan ophopen en plaque kan vormen. Na verloop van tijd kan de opbouw van plaque een vernauwing van de slagaders veroorzaken. Deze vernauwing kan de bloedtoevoer naar uw hart, hersenen en andere organen vertragen of blokkeren. Een hoog LDL-cholesterol is een belangrijke oorzaak van hartaandoeningen en een van de oorzaken van een beroerte.
HDL-cholesterol wordt "goede" cholesterol genoemd omdat het voorkomt dat het slechte cholesterol zich ophoopt in de bloedvaten.
Triglyceriden zijn ook vetten die in uw bloed worden aangetroffen.
Algemene informatie over ZETIA
Soms worden medicijnen voorgeschreven voor aandoeningen die niet in de patiëntenbijsluiter staan. Gebruik ZETIA 10 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef ZETIA niet aan andere mensen, ook niet als zij dezelfde aandoening hebben als u. Het kan hen schaden.
Dit vat de belangrijkste informatie over ZETIA samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw apotheker of arts om informatie vragen over ZETIA 10 mg die is geschreven voor gezondheidswerkers.
Inactieve ingredienten :
Croscarmellosenatrium, lactosemonohydraat, magnesiumstearaat, microkristallijne cellulose, povidon en natriumlaurylsulfaat.
