Lopid 300mg Gemfibrozil Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Lopid 300 mg en hoe wordt het gebruikt?
Lopid (gemfibrozil) is een lipidenregulerend middel dat wordt gebruikt voor de behandeling van zeer hoge cholesterol- en triglyceridenspiegels bij mensen met pancreatitis, en wordt ook gebruikt om het risico op een beroerte, een hartaanval of andere hartcomplicaties te verlagen bij mensen met een hoog cholesterol- en triglyceridengehalte die niet geholpen door andere behandelingen. Lopid is beschikbaar in generieke vorm.
Wat zijn bijwerkingen van Lopid 300 mg?
Vaak voorkomende bijwerkingen van Lopid 300 mg zijn:
- buikpijn,
- maag/buikpijn,
- misselijkheid,
- braken,
- diarree,
- hoofdpijn,
- duizeligheid,
- slaperigheid,
- gewrichts- of spierpijn,
- verlies van interesse in seks,
- impotentie,
- moeite hebben met een orgasme,
- gevoelloosheid of tintelend gevoel,
- ongebruikelijke smaak, of
- verkoudheidsverschijnselen zoals verstopte neus, niezen, keelpijn.
Lopid 300 mg kan zelden galstenen en leverproblemen veroorzaken.
Vertel het uw arts als u een van de volgende onwaarschijnlijke, maar ernstige bijwerkingen van Lopid 300 mg opmerkt, waaronder:
- ernstige maag-/buikpijn,
- aanhoudende misselijkheid of braken,
- gele ogen of huid, en
- donkere urine.
OMSCHRIJVING
LOPID® (gemfibrozil-tabletten, USP) is een lipidenregulerend middel. Het is verkrijgbaar in de vorm van tabletten voor orale toediening. Elke tablet bevat 600 mg gemfibrozil. Elke tablet bevat ook calciumstearaat, NF; candelillawas, FCC; microkristallijne cellulose, NF; hydroxypropylcellulose, NF; hypromellose, USP; methylparabeen, NF; Opaspray wit; polyethyleenglycol, NF; polysorbaat 80, NF; propylparabeen, NF; colloïdaal siliciumdioxide, NF; voorgegelatineerd zetmeel, NF. De chemische naam is 5-(2,5-dimethylfenoxy)-2,2-dimethylpentaanzuur, met de volgende structuurformule:
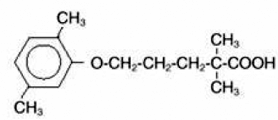
De empirische formule is C15H22O3 en het molecuulgewicht is 250,35; de oplosbaarheid in water en zuur is 0,0019% en in verdunde base is deze groter dan 1%. Het smeltpunt is 58° –61°C. Gemfibrozil is een witte vaste stof die stabiel is onder normale omstandigheden.
INDICATIES
LOPID (gemfibrozil-tabletten, USP) is geïndiceerd als aanvullende therapie bij een dieet voor:
In een subgroepanalyse van patiënten in de Helsinki Heart Study met boven-mediane HDL-cholesterolwaarden bij baseline (hoger dan 46,4 mg/dL), was de incidentie van ernstige coronaire voorvallen vergelijkbaar voor gemfibrozil- en placebo-subgroepen (zie tabel I).
De initiële behandeling voor dyslipidemie is een dieettherapie die specifiek is voor het type lipoproteïne-afwijking. Overmatig lichaamsgewicht en overmatige alcoholinname kunnen belangrijke factoren zijn bij hypertriglyceridemie en moeten voorafgaand aan een medicamenteuze behandeling worden behandeld. Lichaamsbeweging kan een belangrijke aanvullende maatregel zijn en is in verband gebracht met een stijging van het HDL-cholesterol. Ziekten die bijdragen aan hyperlipidemie, zoals hypothyreoïdie of diabetes mellitus, moeten worden opgespoord en adequaat worden behandeld. Oestrogeentherapie wordt soms geassocieerd met enorme stijgingen van plasmatriglyceriden, vooral bij personen met familiale hypertriglyceridemie. In dergelijke gevallen kan het staken van de oestrogeentherapie de noodzaak van specifieke medicamenteuze behandeling van hypertriglyceridemie overbodig maken. Het gebruik van medicijnen mag alleen worden overwogen als er redelijke pogingen zijn gedaan om bevredigende resultaten te verkrijgen met niet-medicamenteuze methoden. Als de beslissing wordt genomen om medicijnen te gebruiken, moet de patiënt worden geïnstrueerd dat dit het belang van het volgen van een dieet niet vermindert.
DOSERING EN ADMINISTRATIE
De aanbevolen dosis voor volwassenen is 1200 mg, toegediend in twee verdeelde doses 30 minuten vóór de ochtend- en avondmaaltijd (zie: KLINISCHE FARMACOLOGIE ).
HOE GELEVERD
LOPID (Tablet 737), witte, elliptische, filmomhulde tabletten met breukgleuf, die elk 600 mg gemfibrozil bevatten, zijn als volgt verkrijgbaar:
NDC 0071-0737-20: Flessen van 60 NDC 0071-0737-30: Flessen van 500
Bewaren bij een gecontroleerde kamertemperatuur van 20 ° - 25 ° C (68 ° - 77 ° F) [zie USP]. Beschermen tegen licht en vocht.
Gedistribueerd door Parke-Davis Division van Pfizer Inc, NY, NY 10017. Herzien: december 2020
BIJWERKINGEN
In de dubbelblinde gecontroleerde fase van de primaire preventiecomponent van de Helsinki Heart Study kregen 2046 patiënten LOPID gedurende maximaal vijf jaar. In dat onderzoek kwamen de volgende bijwerkingen statistisch vaker voor bij proefpersonen in de LOPID-groep:
Galblaasoperatie werd uitgevoerd bij 0,9% van de LOPID 300 mg en 0,5% van de placebopatiënten in de primaire preventiecomponent, een overmaat van 64%, die niet statistisch verschilt van de overmaat aan galblaasoperaties waargenomen in de clofibraatgroep vergeleken met de placebogroep van het WHO-onderzoek . Galblaasoperaties werden ook vaker uitgevoerd in de LOPID-groep dan in de placebogroep (1,9% versus 0,3%, p=0,07) in de secundaire preventiecomponent. Een statistisch significante toename van appendectomie in de gemfibrozilgroep werd ook gezien in de secundaire preventiecomponent (6 op gemfibrozil versus 0 op placebo, p=0,014).
Bijwerkingen van het zenuwstelsel en speciale zintuigen kwamen vaker voor in de LOPID 300 mg-groep. Deze omvatten hypesthesie, paresthesieën en smaakperversie. Andere bijwerkingen die vaker voorkwamen bij proefpersonen in de LOPID 300 mg-behandelingsgroep, maar waarbij geen oorzakelijk verband werd vastgesteld, zijn cataracten, perifere vasculaire aandoeningen en intracerebrale bloeding.
Uit andere onderzoeken lijkt het waarschijnlijk dat LOPID 300 mg causaal verband houdt met het optreden van SYMPTOMEN VAN HET MUSPELLETJE (zie WAARSCHUWINGEN ), en op ABNORMALE LEVERFUNCTIETESTS en HEMATOLOGISCHE VERANDERINGEN (zie PREVENTIEVE MAATREGELEN ).
Meldingen van virale en bacteriële infecties (verkoudheid, hoesten, urineweginfecties) kwamen vaker voor bij met gemfibrozil behandelde patiënten in andere gecontroleerde klinische onderzoeken met 805 patiënten. Aanvullende bijwerkingen die zijn gemeld voor gemfibrozil worden hieronder per systeem weergegeven. Deze zijn gecategoriseerd naargelang een causaal verband met de behandeling met LOPID waarschijnlijk is of niet:
Bijkomende bijwerkingen die zijn gemeld, zijn onder meer cholecystitis en cholelithiasis (zien WAARSCHUWINGEN ).
DRUG-INTERACTIES
HMG-CoA-reductaseremmers
Gelijktijdige toediening van LOPID 300 mg met simvastatine is gecontra-indiceerd (zie: CONTRA-INDICATIES en WAARSCHUWINGEN ). Vermijd gelijktijdig gebruik van LOPID met rosuvastatine. Als gelijktijdig gebruik niet kan worden vermeden, start dan met rosuvastatine met eenmaal daags 5 mg. De dosis rosuvastatine mag niet hoger zijn dan 10 mg eenmaal daags. Het risico op myopathie en rabdomyolyse is verhoogd bij gecombineerde behandeling met gemfibrozil en HMG-CoA-reductaseremmers. Myopathie of rabdomyolyse met of zonder acuut nierfalen zijn al drie weken na het starten van de combinatietherapie of na enkele maanden gemeld (zie WAARSCHUWINGEN ). Er is geen garantie dat periodieke controle van creatinekinase het optreden van ernstige myopathie en nierbeschadiging zal voorkomen.
anticoagulantia
VOORZICHTIGHEID MOET WORDEN GEBRUIKT WANNEER WARFARIN WORDT TOEGEDIEND IN SAMENVATTING MET LOPID. DE DOSERING VAN WARFARIN MOET WORDEN VERLAAGD OM DE PROTHROMBINETIJD OP HET GEWENSTE NIVEAU TE HOUDEN OM COMPLICATIES VAN BLOEDING TE VOORKOMEN. VEELVOUDIGE PROTHROMBINEBEPALINGEN ZIJN AANBEVOLEN TOTDAT HET ZEKER IS BEPAALD DAT HET PROTHROMBINENIVEAU IS GESTABILISEERD.
CYP2C8-substraten
Gemfibrozil is een sterke remmer van CYP2C8 en kan de blootstelling verhogen aan geneesmiddelen die voornamelijk door CYP2C8 worden gemetaboliseerd (bijv. dabrafenib, enzalutamide, loperamide, montelukast, paclitaxel, pioglitazon, rosiglitazon). Daarom kan een verlaging van de dosering van geneesmiddelen die voornamelijk worden gemetaboliseerd door het CYP2C8-enzym nodig zijn wanneer gemfibrozil gelijktijdig wordt gebruikt (zie WAARSCHUWINGEN ).
Repaglinide
Bij gezonde vrijwilligers resulteerde gelijktijdige toediening met gemfibrozil (600 mg tweemaal daags gedurende 3 dagen) in een 8,1-voudig (bereik 5,5 tot 15,0-voudig) hogere AUC van repaglinide en een 28,6-voudig (bereik 18,5- tot 80,1-voudig) hogere plasmaconcentratie van repaglinide 7 uur na de dosis. In hetzelfde onderzoek resulteerde gemfibrozil (600 mg tweemaal daags gedurende 3 dagen) + itraconazol (200 mg 's morgens en 100 mg' s avonds op dag 1, daarna 100 mg tweemaal daags op dag 2-3) in een 19,4-( bereik 12,9 tot 24,7 maal) hogere repaglinide AUC en een 70,4 maal (bereik 42,9 tot 119,2 maal) hogere plasmaconcentratie van repaglinide 7 uur na de dosis. Bovendien verlengden gemfibrozil alleen of gemfibrozil + itraconazol de hypoglykemische effecten van repaglinide. Gelijktijdige toediening van gemfibrozil en repaglinide verhoogt het risico op ernstige hypoglykemie en is gecontra-indiceerd (zie CONTRA-INDICATIES ).
Dasabuvir
Gelijktijdige toediening van gemfibrozil met dasabuvir verhoogde de AUC en Cmax van dasabuvir (verhoudingen: respectievelijk 11,3 en 2,01) als gevolg van CYP2C8-remming. Een verhoogde blootstelling aan dasabuvir kan het risico op QT-verlenging verhogen, daarom is gelijktijdige toediening van gemfibrozil en dasabuvir gecontra-indiceerd (zie CONTRA-INDICATIES ).
Selexipag
Gelijktijdige toediening van gemfibrozil met selexipag verdubbelde de blootstelling aan selexipag en verhoogde de blootstelling aan de actieve metaboliet met ongeveer een factor 11. Gelijktijdige toediening van gemfibrozil met selexipag is gecontra-indiceerd (zie: CONTRA-INDICATIES ).
Enzalutamide
Bij gezonde vrijwilligers die een enkelvoudige dosis van 160 mg enzalutamide kregen na tweemaal daags 600 mg gemfibrozil, was de AUC van enzalutamide plus actieve metaboliet (N-desmethyl-enzalutamide) 2,2 maal hoger en de overeenkomstige Cmax daalde met 16%. Een verhoogde blootstelling aan enzalutamide kan het risico op epileptische aanvallen verhogen. Als gelijktijdige toediening noodzakelijk wordt geacht, moet de dosis enzalutamide worden verlaagd (zie: WAARSCHUWINGEN ).
OATP1B1-substraten
Gemfibrozil is een remmer van de OATP1B1-transporter en kan de blootstelling aan geneesmiddelen die substraten zijn van OATP1B1 verhogen (bijv. atrasentan, atorvastatine, bosentan, ezetimibe, fluvastatine, glyburide, SN-38 [actieve metaboliet van irinotecan], rosuvastatine, pitavastatine, praampavastatine, , valsartan, olmesartan). Daarom kunnen dosisverlagingen van geneesmiddelen die substraten zijn van OATP1B1 nodig zijn wanneer gemfibrozil gelijktijdig wordt gebruikt (zie WAARSCHUWINGEN ). Combinatietherapie van gemfibrozil met simvastatine of met repaglinide, die OATP1B1-substraten zijn, is gecontra-indiceerd (zie CONTRA-INDICATIES ).
In vitro studies van CYP-enzymen, UGTA-enzymen en OATP1B1-transporter
In vitro-onderzoeken hebben aangetoond dat gemfibrozil een remmer is van CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 en UDP-glucuronosyltransferase (UGT) 1A1 en 1A3 (zie WAARSCHUWINGEN ).
Galzuurbindende harsen
De AUC van gemfibrozil werd met 30% verlaagd wanneer gemfibrozil (600 mg) gelijktijdig werd gegeven met geneesmiddelen in harsgranulaat zoals colestipol (5 g). Toediening van de geneesmiddelen met een tussenpoos van twee uur of meer wordt aanbevolen, omdat de blootstelling aan gemfibrozil niet significant werd beïnvloed wanneer het twee uur na colestipol werd toegediend.
Colchicine
Myopathie, waaronder rabdomyolyse, is gemeld bij chronische toediening van colchicine in therapeutische doses. Gelijktijdig gebruik van LOPID kan de ontwikkeling van myopathie versterken. Patiënten met nierfunctiestoornissen en oudere patiënten lopen een verhoogd risico. Voorzichtigheid is geboden bij het voorschrijven van LOPID samen met colchicine, vooral bij oudere patiënten of patiënten met nierfunctiestoornissen.
WAARSCHUWINGEN
Vanwege de beperktere omvang van de Helsinki Heart Study, is het waargenomen verschil in mortaliteit door welke oorzaak dan ook tussen de LOPID 300 mg- en placebogroepen niet statistisch significant verschillend van de 29% extra mortaliteit die werd gerapporteerd in de clofibraatgroep in de afzonderlijke WHO-studie aan de negen jaar follow-up (zie KLINISCHE FARMACOLOGIE ). Niet-coronaire hartziekte-gerelateerde mortaliteit vertoonde een overmaat in de groep die oorspronkelijk was gerandomiseerd naar LOPID, voornamelijk als gevolg van sterfgevallen door kanker die werden waargenomen tijdens de open-label verlenging.
Tijdens de vijf jaar durende primaire preventiecomponent van de Helsinki Heart Study was de mortaliteit door welke oorzaak dan ook 44 (2,2%) in de LOPID 300 mg-groep en 43 (2,1%) in de placebogroep; inclusief de 3,5 jaar follow-up periode sinds de studie werd afgerond, was de cumulatieve mortaliteit door welke oorzaak dan ook 101 (4,9%) in de LOPID-groep en 83 (4,1%) in de groep die oorspronkelijk was gerandomiseerd naar placebo (hazard ratio 1:20 in het voordeel van placebo). Vanwege de beperktere omvang van de Helsinki Heart Study is het waargenomen verschil in mortaliteit door welke oorzaak dan ook tussen de LOPID 300 mg- en placebogroepen in jaar 5 of in jaar 8,5 niet statistisch significant verschillend van de 29% extra sterfte gerapporteerd in de clofibraatgroep in de afzonderlijke WHO-studie bij de follow-up van negen jaar. Niet-coronaire hartziekte-gerelateerde mortaliteit vertoonde een overmaat in de groep die oorspronkelijk was gerandomiseerd naar LOPID 300 mg bij de follow-up van 8,5 jaar (65 LOPID 300 mg versus 45 placebo niet-coronaire sterfgevallen).
De incidentie van kanker (exclusief basaalcelcarcinoom) ontdekt tijdens de studie en in de 3,5 jaar na voltooiing van de studie was 51 (2,5%) in beide oorspronkelijk gerandomiseerde groepen. Daarnaast waren er 16 basaalcelcarcinomen in de groep die oorspronkelijk was gerandomiseerd naar LOPID 300 mg en 9 in de groep die oorspronkelijk was gerandomiseerd naar placebo (p=0,22). Er waren 30 (1,5%) sterfgevallen toegeschreven aan kanker in de groep die oorspronkelijk was gerandomiseerd naar LOPID 300 mg en 18 (0,9%) in de groep die oorspronkelijk was gerandomiseerd naar placebo (p=0,11). Bijwerkingen, waaronder coronaire voorvallen, waren hoger bij gemfibrozilpatiënten in een overeenkomstige studie bij mannen met een voorgeschiedenis van bekende of vermoede coronaire hartziekte in de secundaire preventiecomponent van de Helsinki Heart Study (zie KLINISCHE FARMACOLOGIE ).
Er werd ook een vergelijkende carcinogeniteitsstudie gedaan bij ratten waarbij drie geneesmiddelen in deze klasse werden vergeleken: fenofibraat (respectievelijk 10 en 60 mg/kg; 0,3 en 1,6 maal de dosis voor de mens), clofibraat (400 mg/kg; 1,6 maal de dosis voor de mens), en gemfibrozil (250 mg/kg; 1,7 maal de dosis voor de mens). Acinaire adenomen van de pancreas waren verhoogd bij mannen en vrouwen die fenofibraat kregen; hepatocellulair carcinoom en acinaire adenomen van de pancreas waren verhoogd bij mannen en hepatische neoplastische knobbeltjes bij vrouwen die werden behandeld met clofibraat; hepatische neoplastische knobbeltjes waren verhoogd bij mannen en vrouwen die werden behandeld met clofibraat; neoplastische hepatische knobbeltjes waren verhoogd bij mannen en vrouwen die werden behandeld met gemfibrozil, terwijl het aantal interstitiële celtumoren (Leydig-cel) van de testikels bij mannen op alle drie de geneesmiddelen was toegenomen.
PREVENTIEVE MAATREGELEN
Initiële therapie
Er moeten laboratoriumonderzoeken worden uitgevoerd om vast te stellen dat de lipideniveaus consequent abnormaal zijn. Alvorens met LOPID-therapie te beginnen, moet elke poging worden gedaan om de serumlipiden onder controle te houden met een geschikt dieet, lichaamsbeweging, gewichtsverlies bij obese patiënten en controle van medische problemen zoals diabetes mellitus en hypothyreoïdie die bijdragen aan de lipide-afwijkingen.
Voortgezette therapie
Periodieke bepaling van serumlipiden moet worden verkregen en het geneesmiddel moet worden stopgezet als de lipidenrespons na drie maanden therapie onvoldoende is.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn langetermijnstudies uitgevoerd bij ratten bij 0,2 en 1,3 maal de menselijke blootstelling (op basis van AUC). De incidentie van goedaardige leverknobbeltjes en levercarcinomen was significant verhoogd bij mannelijke ratten met een hoge dosis. De incidentie van levercarcinomen nam ook toe bij mannen met een lage dosis, maar deze toename was niet statistisch significant (p=0,1). Mannelijke ratten hadden een dosisgerelateerde en statistisch significante toename van goedaardige Leydig-celtumoren. De hogere dosis vrouwelijke ratten vertoonden een significante toename van de gecombineerde incidentie van goedaardige en kwaadaardige leverneoplasmata.
Er zijn langetermijnstudies uitgevoerd bij muizen bij 0,1 en 0,7 maal de menselijke blootstelling (op basis van AUC). Er waren geen statistisch significante verschillen met controles in de incidentie van levertumoren, maar de geteste doses waren lager dan de doses waarvan werd aangetoond dat ze kankerverwekkend waren met andere fibraten.
Elektronenmicroscopie-onderzoeken hebben een bloemrijke proliferatie van leverperoxisoom aangetoond na toediening van LOPID aan de mannelijke rat. Er is geen adequaat onderzoek gedaan om peroxisoomproliferatie te testen bij mensen, maar er zijn veranderingen in de peroxisoommorfologie waargenomen. Er is aangetoond dat peroxisoomproliferatie bij mensen optreedt met een van de twee andere geneesmiddelen van de fibraatklasse wanneer leverbiopten voor en na de behandeling bij dezelfde persoon werden vergeleken.
Toediening van ongeveer 2 keer de dosis voor de mens (op basis van oppervlakte) aan mannelijke ratten gedurende 10 weken resulteerde in een dosisgerelateerde afname van de vruchtbaarheid. Daaropvolgende onderzoeken toonden aan dat dit effect na een medicijnvrije periode van ongeveer acht weken omkeerde en niet werd overgedragen op het nageslacht.
Zwangerschap
Van LOPID 300 mg is aangetoond dat het bijwerkingen veroorzaakt bij ratten en konijnen bij doses tussen 0,5 en 3 maal de dosis voor de mens (op basis van het oppervlak). Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. LOPID 300 mg mag alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Toediening van LOPID 300 mg aan vrouwelijke ratten in een dosis van 2 keer de dosis voor de mens (op basis van het oppervlak) vóór en tijdens de dracht veroorzaakte een dosisafhankelijke afname van de conceptiesnelheid, een toename van doodgeborenen en een lichte afname van het gewicht van de jongen tijdens de lactatie. Er waren ook dosisgerelateerde verhoogde skeletvariaties. Anoftalmie trad op, maar zelden.
Toediening van 0,6 en 2 maal de humane dosis (op basis van oppervlakte) van LOPID aan vrouwelijke ratten vanaf dag 15 van de dracht tot aan het spenen veroorzaakte dosisgerelateerde verlagingen van het geboortegewicht en onderdrukking van de groei van de pups tijdens de lactatie.
Toediening van 1 en 3 keer de humane dosis (op basis van oppervlakte) van LOPID 300 mg aan vrouwelijke konijnen tijdens de organogenese veroorzaakte een dosisgerelateerde afname van de worpgrootte en, bij de hoge dosis, een verhoogde incidentie van pariëtale botvariaties.
Moeders die borstvoeding geven
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk en vanwege het potentieel voor tumorigeniciteit dat is aangetoond voor LOPID in dierstudies, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Hematologische veranderingen
Milde hemoglobine-, hematocriet- en witte bloedceldalingen zijn waargenomen bij occasionele patiënten na het starten van de LOPID-therapie. Deze niveaus stabiliseren echter tijdens langdurige toediening. Zelden zijn ernstige anemie, leukopenie, trombocytopenie en beenmerghypoplasie gemeld.
Daarom wordt een periodieke bloedtelling aanbevolen tijdens de eerste 12 maanden van toediening van LOPID 300 mg.
Lever functie
Af en toe zijn abnormale leverfunctietesten waargenomen tijdens toediening van LOPID, waaronder verhogingen van ASAT, ALT, LDH, bilirubine en alkalische fosfatase. Deze zijn gewoonlijk reversibel wanneer LOPID 300 mg wordt stopgezet. Daarom worden periodieke leverfunctieonderzoeken aanbevolen en moet de LOPID 300 mg-therapie worden stopgezet als de afwijkingen aanhouden.
Nierfunctie
Er zijn meldingen geweest van verergering van nierinsufficiëntie na toevoeging van LOPID-therapie bij personen met een baseline plasmacreatinine > 2,0 mg/dl. Bij dergelijke patiënten moet het gebruik van alternatieve therapie worden afgewogen tegen de risico's en voordelen van een lagere dosis LOPID.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
OVERDOSERING
Er zijn gevallen van overdosering met LOPID gemeld. In één geval herstelde een 7-jarig kind na inname van maximaal 9 gram LOPID. Symptomen die bij overdosering werden gemeld, waren buikkrampen, abnormale leverfunctietesten, diarree, verhoogde CPK, gewrichts- en spierpijn, misselijkheid en braken. Indien een overdosis optreedt, dienen symptomatische ondersteunende maatregelen te worden genomen.
CONTRA-INDICATIES
KLINISCHE FARMACOLOGIE
LOPID is een lipidenregulerend middel dat serumtriglyceriden en zeer lage dichtheid lipoproteïne (VLDL) cholesterol verlaagt, en hoge dichtheid lipoproteïne (HDL) cholesterol verhoogt. Hoewel een bescheiden daling van het totale en lage-dichtheid-lipoproteïne (LDL)-cholesterol kan worden waargenomen bij behandeling met LOPID 300 mg, resulteert de behandeling van patiënten met verhoogde triglyceriden als gevolg van hyperlipoproteïnemie van type IV vaak in een stijging van het LDL-cholesterol. LDL-cholesterolspiegels bij type IIb-patiënten met verhogingen van zowel serum LDL-cholesterol als triglyceriden worden in het algemeen minimaal beïnvloed door LOPID 300 mg-behandeling; LOPID 300 mg verhoogt echter gewoonlijk het HDL-cholesterol aanzienlijk in deze groep. LOPID 300 mg verhoogt de niveaus van high-density lipoproteïne (HDL) subfracties HDL2 en HDL3, evenals apolipoproteïnen AI en AII. Epidemiologische studies hebben aangetoond dat zowel een laag HDL-cholesterol als een hoog LDL-cholesterol onafhankelijke risicofactoren zijn voor coronaire hartziekten.
In de primaire preventiecomponent van de Helsinki Heart Study, waarin 4081 mannelijke patiënten tussen de 40 en 55 jaar werden onderzocht op een gerandomiseerde, dubbelblinde, placebogecontroleerde manier, werd de behandeling met LOPID 300 mg geassocieerd met significante verlagingen van de totale plasmatriglyceriden en een significante toename van lipoproteïne-cholesterol met hoge dichtheid. Matige verlagingen van totaal plasmacholesterol en lipoproteïne-cholesterol met lage dichtheid werden waargenomen voor de LOPID-behandelingsgroep als geheel, maar de lipidenrespons was heterogeen, vooral bij verschillende Fredrickson-types. De studie omvatte proefpersonen met een serum non-HDL-cholesterol van meer dan 200 mg/dL en geen voorgeschiedenis van coronaire hartziekte. Gedurende de onderzoeksperiode van vijf jaar ondervond de LOPID-groep van 300 mg een absolute daling van 1,4% (34% relatief) in het aantal ernstige coronaire voorvallen (plotselinge hartdood plus fatale en niet-fatale myocardinfarcten) vergeleken met placebo, p=0,04 (zie Tabel I). Er was een relatieve afname van 37% in het percentage niet-fataal myocardinfarct vergeleken met placebo, wat overeenkomt met een behandelingsgerelateerd verschil van 13,1 voorvallen per duizend personen. Sterfgevallen door welke oorzaak dan ook tijdens het dubbelblinde deel van het onderzoek bedroegen 44 (2,2%) in de LOPID 300 mg randomisatiegroep en 43 (2,1%) in de placebogroep.
Van de Fredrickson-types trad tijdens het 5 jaar durende dubbelblinde deel van de primaire preventiecomponent van de Helsinki Heart Study de grootste afname van de incidentie van ernstige coronaire voorvallen op bij type IIb-patiënten met verhogingen van zowel LDL-cholesterol als totaal plasma. triglyceriden. Deze subgroep van type IIb-patiënten in de gemfibrozilgroep had een lager gemiddeld HDL-cholesterolgehalte bij baseline dan de type IIa-subgroep met verhogingen van LDL-cholesterol en normale plasmatriglyceriden. De gemiddelde toename van HDL-cholesterol bij de Type IIb-patiënten in deze studie was 12,6% in vergelijking met placebo. De gemiddelde verandering in LDL-cholesterol bij type IIb-patiënten was -4,1% met LOPID vergeleken met een stijging van 3,9% in de placebo-subgroep. De Type IIb-proefpersonen in de Helsinki Heart Study hadden 26 minder coronaire voorvallen per duizend personen gedurende vijf jaar in de gemfibrozil-groep vergeleken met placebo. Het verschil in coronaire voorvallen was aanzienlijk groter tussen LOPID 300 mg en placebo voor die subgroep van patiënten met de triade van LDL-cholesterol >175 mg/dL (>4,5 mmol), triglyceriden >200 mg/dL (>2,2 mmol) en HDL -cholesterol
Nadere informatie is beschikbaar uit een 3,5 jaar (8,5 jaar cumulatieve) follow-up van alle proefpersonen die hadden deelgenomen aan de Helsinki Heart Study. Bij de voltooiing van de Helsinki Heart Study konden proefpersonen kiezen om LOPID te starten, te stoppen of door te gaan; zonder kennis van hun eigen lipidewaarden of dubbelblinde behandeling, begon 60% van de patiënten die oorspronkelijk waren gerandomiseerd naar placebo, de therapie met LOPID 300 mg en 60% van de patiënten die oorspronkelijk waren gerandomiseerd naar LOPID, zette de medicatie voort. Ongeveer 6,5 jaar na randomisatie werden alle patiënten geïnformeerd over hun oorspronkelijke behandelingsgroep en lipidewaarden gedurende de vijf jaar van de dubbelblinde behandeling. Na verdere electieve veranderingen in de LOPID-behandelingsstatus, nam 61% van de patiënten in de groep die oorspronkelijk was gerandomiseerd naar LOPID medicijnen; in de groep die oorspronkelijk was gerandomiseerd naar placebo, nam 65% LOPID. Het aantal voorvallen per 1000 tijdens de open-label follow-upperiode wordt gedetailleerd weergegeven in tabel II.
Cumulatieve mortaliteit gedurende 8,5 jaar toonde een relatieve toename van 20% van het aantal sterfgevallen in de groep die oorspronkelijk was gerandomiseerd naar LOPID 300 mg versus de oorspronkelijk gerandomiseerde placebogroep en een relatieve afname van 20% in cardiale gebeurtenissen in de groep die oorspronkelijk was gerandomiseerd naar LOPID 300 mg versus de oorspronkelijk gerandomiseerde placebogroep (zie Tabel III). Deze analyse van de oorspronkelijk gerandomiseerde 'intent-to-treat'-populatie negeert de mogelijke complicerende effecten van het wisselen van behandeling tijdens de open-label fase. Aanpassing van hazard ratio's, rekening houdend met de status van open-label behandeling van jaar 6.5 naar 8.5, zou de gerapporteerde hazard ratio's voor sterfte in de richting van eenheid kunnen veranderen.
Het is niet duidelijk in hoeverre de bevindingen van de primaire preventiecomponent van de Helsinki Heart Study kunnen worden geëxtrapoleerd naar andere segmenten van de dyslipidemische populatie die niet zijn onderzocht (zoals vrouwen, jongere of oudere mannen, of degenen met lipidenafwijkingen die uitsluitend beperkt zijn tot HDL). -cholesterol) of andere lipidenveranderende geneesmiddelen.
De secundaire preventiecomponent van de Helsinki Heart Study werd gedurende vijf jaar parallel en in dezelfde centra in Finland uitgevoerd bij 628 mannen van middelbare leeftijd die werden uitgesloten van de primaire preventiecomponent van de Helsinki Heart Study vanwege een voorgeschiedenis van angina, myocardinfarct, of onverklaarbare ECG-veranderingen. Het primaire eindpunt voor de werkzaamheid van het onderzoek waren cardiale voorvallen (de som van fatale en niet-fatale myocardinfarcten en plotselinge hartdood). De hazard ratio (LOPID:placebo) voor cardiale gebeurtenissen was 1,47 (95% betrouwbaarheidsgrenzen 0,88-2,48, p=0,14). Van de 35 patiënten in de LOPID 300 mg-groep die cardiale voorvallen hadden, kregen 12 patiënten last van voorvallen na stopzetting van het onderzoek. Van de 24 patiënten in de placebogroep met cardiale voorvallen, kregen 4 patiënten last van voorvallen na stopzetting van de studie. Er waren 17 hartdoden in de LOPID-groep en 8 in de placebogroep (hazard ratio 2,18; 95% betrouwbaarheidslimieten 0,94-5,05, p=0,06). Tien van deze sterfgevallen in de LOPID-groep en 3 in de placebogroep traden op na stopzetting van de therapie. In deze studie van patiënten met bekende of vermoede coronaire hartziekte werd geen voordeel van LOPID 300 mg-behandeling waargenomen bij het verminderen van hartaandoeningen of hartdood. LOPID 300 mg heeft dus alleen voordeel getoond bij geselecteerde dyslipidemische patiënten zonder vermoede of vastgestelde coronaire hartziekte. Zelfs bij patiënten met coronaire hartziekte en de triade van verhoogd LDL-cholesterol, verhoogde triglyceriden plus laag HDL-cholesterol, is het mogelijke effect van LOPID op coronaire events niet voldoende onderzocht.
Er werd geen werkzaamheid waargenomen bij patiënten met vastgestelde coronaire hartziekte tijdens het Coronary Drug Project met het chemisch en farmacologisch verwante geneesmiddel clofibraat. Het Coronary Drug Project was een 6 jaar durend gerandomiseerd, dubbelblind onderzoek met 1000 clofibraat-, 1000 nicotinezuur- en 3000 placebopatiënten met bekende coronaire hartziekte. Er werd een klinisch en statistisch significante vermindering van myocardinfarcten gezien in de gelijktijdige nicotinezuurgroep vergeleken met placebo; met clofibraat werd geen vermindering gezien.
Het werkingsmechanisme van gemfibrozil is niet definitief vastgesteld. Bij de mens is aangetoond dat LOPID 300 mg perifere lipolyse remt en de hepatische extractie van vrije vetzuren vermindert, waardoor de productie van hepatische triglyceriden wordt verminderd. LOPID 300 mg remt de synthese en verhoogt de klaring van VLDL-drager apolipoproteïne B, wat leidt tot een afname van de VLDL-productie.
Dierstudies suggereren dat gemfibrozil, naast het verhogen van HDL-cholesterol, de opname van vetzuren met lange ketens in nieuw gevormde triglyceriden kan verminderen, de omzetting en verwijdering van cholesterol uit de lever kan versnellen en de uitscheiding van cholesterol in de feces kan verhogen. LOPID 300 mg wordt na orale toediening goed geabsorbeerd uit het maagdarmkanaal. Piekplasmaspiegels treden op binnen 1 tot 2 uur met een plasmahalfwaardetijd van 1,5 uur na meerdere doses.
Gemfibrozil wordt volledig geabsorbeerd na orale toediening van LOPID 300 mg tabletten, waarbij de piekplasmaconcentraties 1 tot 2 uur na toediening worden bereikt. De farmacokinetiek van gemfibrozil wordt beïnvloed door het tijdstip van maaltijden in verhouding tot het tijdstip van toediening. In één onderzoek (ref. 4) waren zowel de snelheid als de mate van absorptie van het geneesmiddel significant verhoogd wanneer het 0,5 uur vóór de maaltijd werd toegediend. De gemiddelde AUC werd met 14–44% verlaagd wanneer LOPID na de maaltijd werd toegediend in vergelijking met 0,5 uur vóór de maaltijd. In een daaropvolgend onderzoek was de absorptiesnelheid van LOPID 300 mg maximaal bij toediening 0,5 uur vóór de maaltijd met een Cmax van 50-60% hoger dan bij toediening tijdens de maaltijd of bij vasten. In deze studie waren er geen significante effecten op de AUC van de timing van de dosis ten opzichte van maaltijden (zie: DOSERING EN ADMINISTRATIE ).
LOPID ondergaat voornamelijk oxidatie van een ringmethylgroep om achtereenvolgens een hydroxymethyl- en een carboxylmetaboliet te vormen. Ongeveer zeventig procent van de toegediende dosis bij de mens wordt uitgescheiden in de urine, meestal als het glucuronideconjugaat, en minder dan 2% wordt uitgescheiden als onveranderd gemfibrozil. Zes procent van de dosis komt voor rekening van de ontlasting. Gemfibrozil is sterk gebonden aan plasma-eiwitten en er is kans op verdringingsinteracties met andere geneesmiddelen (zie: PREVENTIEVE MAATREGELEN ).
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN secties.
