Crestor 10mg, 20mg, 5mg Rosuvastatin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Crestor en hoe wordt het gebruikt?
Crestor is een receptgeneesmiddel dat wordt gebruikt om het LDL-cholesterol (lipoproteïne met lage dichtheid) en triglyceriden in het bloed te verlagen, de progressie van plaque in de bloedvaten te vertragen en het risico op een beroerte en een hartaanval te verminderen. Crestor 20 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Crestor is een lipidenverlagend middel, statines, HMG-CoA-reductaseremmers.
Het is niet bekend of Crestor veilig en effectief is bij kinderen jonger dan 8 jaar.
Wat zijn de mogelijke bijwerkingen van Crestor?
Crestor kan ernstige bijwerkingen veroorzaken, waaronder:
- onverklaarbare spierpijn
- spiergevoeligheid
- spier zwakte
- verwardheid
- geheugenproblemen
- pijn in de bovenbuik
- vermoeidheid
- verlies van eetlust
- donkere urine
- geel worden van de huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Crestor zijn:
- hoofdpijn
- zwakheid
- spierpijn
- misselijkheid
- buikpijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Crestor. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
CRESTOR (rosuvastatine calcium) is een synthetisch lipidenverlagend middel voor orale toediening.
De chemische naam voor rosuvastatinecalcium is bis[(E)-7-[4-(4-fluorfenyl)-6-isopropyl-2- [methyl(methylsulfonyl)amino]pyrimidine-5-yl](3R,5S)-3 ,5-dihydroxyhept-6-eenzuur] calciumzout met de volgende structuurformule:
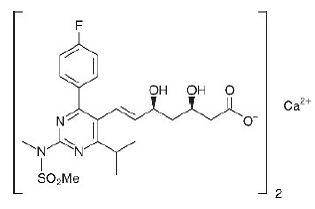
De empirische formule voor rosuvastatinecalcium is (C22H27FN3O6S)2Ca en het molecuulgewicht is 1001,14. Rosuvastatine calcium is een wit amorf poeder dat matig oplosbaar is in water en methanol, en slecht oplosbaar in ethanol. Rosuvastatine calcium is een hydrofiele verbinding met een verdelingscoëfficiënt (octanol/water) van 0,13 bij een pH van 7,0.
CRESTOR-tabletten voor orale toediening bevatten 5, 10, 20 of 40 mg rosuvastatine en de volgende inactieve ingrediënten: Elke tablet bevat: microkristallijne cellulose NF, lactosemonohydraat NF, tribasisch calciumfosfaat NF, crospovidon NF, magnesiumstearaat NF, hypromellose NF, triacetine NF, titaniumdioxide USP, geel ijzeroxide en rood ijzeroxide NF.
INDICATIES
Hyperlipidemie en gemengde dyslipidemie
CRESTOR is geïndiceerd als aanvullende therapie bij een dieet om verhoogde Total-C, LDL-C, ApoB, nonHDL-C en triglyceriden te verlagen en om HDL-C te verhogen bij volwassen patiënten met primaire hyperlipidemie of gemengde dyslipidemie. Lipideveranderende middelen moeten worden gebruikt naast een dieet met een beperkt gehalte aan verzadigd vet en cholesterol wanneer de respons op een dieet en niet-farmacologische interventies alleen onvoldoende is gebleken.
Pediatrische patiënten met familiaire hypercholesterolemie
CRESTOR 10 mg is geïndiceerd als aanvulling op een dieet om:
- de Total-C-, LDL-C- en ApoB-spiegels verlagen bij kinderen en adolescenten van 8 tot 17 jaar met heterozygote familiaire hypercholesterolemie als na een adequate proef met dieettherapie de volgende bevindingen aanwezig zijn: LDL-C >190 mg/dL, of >160 mg/dL samen met een positieve familiegeschiedenis van vroegtijdige cardiovasculaire ziekte (CVD) of twee of meer andere CVD-risicofactoren.
- verlaging van LDL-C, Total-C, nonHDL-C en ApoB bij kinderen en adolescenten van 7 tot 17 jaar met homozygote familiaire hypercholesterolemie, alleen of in combinatie met andere lipideverlagende behandelingen (bijv. LDL-aferese).
Hypertriglyceridemie
CRESTOR is geïndiceerd als aanvullende therapie bij een dieet voor de behandeling van volwassen patiënten met hypertriglyceridemie.
Primaire dysbetalipoproteïnemie (type III hyperlipoproteïnemie)
CRESTOR is geïndiceerd als aanvulling op een dieet voor de behandeling van volwassen patiënten met primaire dysbetalipoproteïnemie (type III hyperlipoproteïnemie).
Volwassen patiënten met homozygote familiaire hypercholesterolemie
CRESTOR is geïndiceerd als aanvullende therapie bij andere lipidenverlagende behandelingen (bijv. LDL-aferese) of alleen als dergelijke behandelingen niet beschikbaar zijn om LDL-C, Total-C en ApoB te verlagen bij volwassen patiënten met homozygote familiaire hypercholesterolemie.
Vertraging van de progressie van atherosclerose
CRESTOR 5 mg is geïndiceerd als aanvullende therapie bij een dieet om de progressie van atherosclerose bij volwassen patiënten te vertragen als onderdeel van een behandelingsstrategie om het totaal-C en LDL-c te verlagen tot de streefwaarden.
Primaire preventie van hart- en vaatziekten
Bij personen zonder klinisch evidente coronaire hartziekte maar met een verhoogd risico op hart- en vaatziekten op basis van leeftijd ≥50 jaar bij mannen en ≥60 jaar bij vrouwen, hsCRP ≥2 mg/L, en de aanwezigheid van ten minste één bijkomende cardiovasculaire aandoening risicofactor zoals hypertensie, laag HDL-C, roken of een familiegeschiedenis van vroegtijdige coronaire hartziekte, is CRESTOR geïndiceerd voor:
- het risico op een beroerte verminderen
- het risico op een hartinfarct verminderen
- het risico op arteriële revascularisatieprocedures verminderen
Beperkingen van gebruik
CRESTOR is niet onderzocht bij dyslipidemieën van Fredrickson Type I en V.
DOSERING EN ADMINISTRATIE
Algemene doseringsinformatie
Het doseringsbereik voor CRESTOR 5 mg bij volwassenen is eenmaal daags 5 tot 40 mg oraal. De gebruikelijke startdosering is eenmaal daags 10 tot 20 mg. De gebruikelijke startdosering bij volwassen patiënten met homozygote familiaire hypercholesterolemie is eenmaal daags 20 mg.
De maximale CRESTOR-dosis van 20 mg van 40 mg mag alleen worden gebruikt voor die patiënten die hun LDL-C-doel niet hebben bereikt met de dosis van 20 mg [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CRESTOR 5 mg kan als een enkele dosis op elk moment van de dag worden toegediend, met of zonder voedsel. De tablet moet heel worden doorgeslikt.
Bij het starten van CRESTOR-therapie of bij het overschakelen van een andere HMG-CoA-reductaseremmertherapie, moet eerst de juiste CRESTOR 10 mg-startdosis worden gebruikt en pas daarna worden getitreerd volgens de respons van de patiënt en het individuele doel van de therapie.
Na het starten of na titratie van CRESTOR moeten de lipideniveaus binnen 2 tot 4 weken worden geanalyseerd en moet de dosering dienovereenkomstig worden aangepast.
Pediatrische dosering
Bij heterozygote familiaire hypercholesterolemie is het aanbevolen doseringsbereik 5 tot 10 mg oraal eenmaal daags bij patiënten van 8 tot jonger dan 10 jaar en 5 tot 20 mg oraal eenmaal daags bij patiënten van 10 tot 17 jaar.
Bij homozygote familiaire hypercholesterolemie is de aanbevolen dosis 20 mg oraal eenmaal daags bij patiënten van 7 tot 17 jaar.
Dosering bij Aziatische patiënten
Overweeg bij Aziatische patiënten om de behandeling met CRESTOR 20 mg te starten met 5 mg eenmaal daags vanwege de verhoogde plasmaconcentraties van rosuvastatine. De verhoogde systemische blootstelling moet in overweging worden genomen bij de behandeling van Aziatische patiënten die niet voldoende onder controle zijn met doses tot 20 mg/dag [zie: Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ].
Gebruik met gelijktijdige therapie
Patiënten die ciclosporine gebruiken
De dosis CRESTOR 20 mg mag niet hoger zijn dan 5 mg eenmaal daags [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Patiënten die Gemfibrozil gebruiken
Vermijd gelijktijdig gebruik van CRESTOR met gemfibrozil. Als gelijktijdig gebruik niet kan worden vermeden, start dan met CRESTOR met eenmaal daags 5 mg. De dosis CRESTOR mag niet hoger zijn dan 10 mg eenmaal daags [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Patiënten die atazanavir en ritonavir, lopinavir en ritonavir of simeprevir gebruiken
Start de behandeling met CRESTOR 10 mg met eenmaal daags 5 mg. De dosis CRESTOR mag niet hoger zijn dan 10 mg eenmaal daags [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Dosering bij patiënten met ernstige nierinsufficiëntie
Voor patiënten met een ernstige nierfunctiestoornis (CLcr Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ].
HOE GELEVERD
Doseringsvormen en sterke punten
5 mg: gele, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "5" aan één kant van de tablet.
10 mg: roze, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "10" aan één kant van de tablet.
20 mg: roze, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "20" aan één kant van de tablet.
40 mg: roze, ovale, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" aan de ene kant en "40" aan de andere kant van de tablet.
Opslag en behandeling
CRESTOR® (rosuvastatine calcium) tabletten worden geleverd als:
NDC 0310-0755-90: 5mg. Gele, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "5" aan één kant; fles van 90 tabletten
NDC 0310-0751-90: 10 mg. Roze, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "10" aan één kant; fles van 90 tabletten
NDC 0310-0751-39: 10 mg. Roze, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "10" aan één kant; eenheidsdosisverpakkingen van 100
NDC 030-0752-90: 20 mg. Roze, ronde, biconvexe, omhulde tabletten. Ingeslagen "CRESTOR" en "20" aan één kant; flessen van 90
NDC 0310-0752-39: 20 mg. Roze, ronde, biconvexe, omhulde tabletten. Inscriptie "CRESTOR" en "20" aan één kant; eenheidsdosisverpakkingen van 100
NDC 0310-0754-30: 40 mg. Roze, ovale, biconvexe, omhulde tabletten. Ingeslagen "CRESTOR" aan de ene kant en "40" aan de andere kant; flessen van 30
Opslag
Bewaren bij een gecontroleerde kamertemperatuur, 20-25 ° C (68-77 ° F) [zie USP-gecontroleerde kamertemperatuur ]. Beschermen tegen vocht.
Gedistribueerd door: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Herzien: september 2018
BIJWERKINGEN
De volgende ernstige bijwerkingen worden in meer detail besproken in andere rubrieken van het etiket:
- Rabdomyolyse met myoglobinurie en acuut nierfalen en myopathie (inclusief myositis) [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leverenzymafwijkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring in klinische studies
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die zijn waargenomen in de klinische onderzoeken van een geneesmiddel niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen deze mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
In de CRESTOR-database met gecontroleerde klinische onderzoeken (placebo of actief gecontroleerd) van 5394 patiënten met een gemiddelde behandelingsduur van 15 weken, stopte 1,4% van de patiënten vanwege bijwerkingen. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren:
- spierpijn
- buikpijn
- misselijkheid
De meest gemelde bijwerkingen (incidentie ≥2%) in de CRESTOR 5 mg gecontroleerde klinische studiedatabase van 5394 patiënten waren:
- hoofdpijn
- spierpijn
- buikpijn
- asthenie
- misselijkheid
Bijwerkingen die zijn gemeld bij ≥2% van de patiënten in placebogecontroleerde klinische onderzoeken en met een hogere frequentie dan bij placebo, worden weergegeven in tabel 1. Deze onderzoeken hadden een behandelingsduur van maximaal 12 weken.
Andere bijwerkingen die in klinische onderzoeken zijn gemeld, waren buikpijn, duizeligheid, overgevoeligheid (waaronder uitslag, pruritus, urticaria en angio-oedeem) en pancreatitis. De volgende laboratoriumafwijkingen zijn ook gemeld: dipstick-positieve proteïnurie en microscopische hematurie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]; verhoogde creatinefosfokinase, transaminasen, glucose, glutamyltranspeptidase, alkalische fosfatase en bilirubine; en afwijkingen van de schildklierfunctie.
In de METEOR-studie, waaraan 981 deelnemers deelnamen die werden behandeld met rosuvastatine 40 mg (n=700) of placebo (n=281) met een gemiddelde behandelingsduur van 1,7 jaar, werd 5,6% van de proefpersonen behandeld met CRESTOR 5 mg versus 2,8% van de met placebo behandelde proefpersonen gestopt vanwege bijwerkingen. De meest voorkomende bijwerkingen die leidden tot stopzetting van de behandeling waren: myalgie, verhoogde leverenzymen, hoofdpijn en misselijkheid [zie Klinische studies ].
Bijwerkingen die bij ≥2% van de patiënten werden gemeld en met een hogere frequentie dan bij placebo, worden weergegeven in tabel 2.
In de JUPITER-studie werden 17.802 deelnemers behandeld met rosuvastatine 20 mg (n=8901) of placebo (n=8901) voor een gemiddelde duur van 2 jaar. Een hoger percentage van met rosuvastatine behandelde patiënten versus met placebo behandelde patiënten, respectievelijk 6,6% en 6,2%, stopte met de studiemedicatie vanwege een bijwerking, ongeacht de causaliteit van de behandeling. Myalgie was de meest voorkomende bijwerking die leidde tot stopzetting van de behandeling.
In JUPITER werd een significant hogere frequentie van diabetes mellitus gemeld bij patiënten die rosuvastatine gebruikten (2,8%) dan bij patiënten die placebo kregen (2,3%). Het gemiddelde HbA1c was significant verhoogd met 0,1% bij met rosuvastatine behandelde patiënten vergeleken met met placebo behandelde patiënten. Het aantal patiënten met een HbA1c > 6,5% aan het einde van de studie was significant hoger bij met rosuvastatine behandelde dan met placebo behandelde patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Klinische studies ].
Bijwerkingen die bij ≥2% van de patiënten werden gemeld en met een hogere frequentie dan bij placebo, worden weergegeven in tabel 3.
Pediatrische patiënten met heterozygote familiaire hypercholesterolemie
In een 12 weken durende gecontroleerde studie bij jongens en postmenarchale meisjes van 10 tot 17 jaar met heterozygote familiaire hypercholesterolemie met CRESTOR 5 tot 20 mg per dag [zie Gebruik bij specifieke populaties en Klinische studies ], werden verhogingen van serumcreatinefosfokinase (CK) >10 x ULN vaker waargenomen bij rosuvastatine dan bij met placebo behandelde kinderen. Vier van de 130 (3%) kinderen die werden behandeld met rosuvastatine (2 behandeld met 10 mg en 2 behandeld met 20 mg) hadden een verhoogde CK >10 x ULN, vergeleken met 0 van de 46 kinderen die placebo kregen.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van CRESTOR na goedkeuring: artralgie, fataal en niet-fataal leverfalen, hepatitis, geelzucht, trombocytopenie, depressie, slaapstoornissen (waaronder slapeloosheid en nachtmerries), perifere neuropathie, interstitiële longziekte en gynaecomastie. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Er zijn zeldzame meldingen geweest van immuungemedieerde necrotiserende myopathie geassocieerd met statinegebruik [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Er zijn zeldzame postmarketingmeldingen geweest van cognitieve stoornissen (bijv. geheugenverlies, vergeetachtigheid, amnesie, geheugenstoornis en verwardheid) geassocieerd met statinegebruik. Deze cognitieve problemen zijn gemeld voor alle statines. De meldingen zijn over het algemeen niet-ernstig en reversibel na stopzetting van de statine, met variabele tijden tot het begin van de symptomen (1 dag tot jaren) en het verdwijnen van de symptomen (mediaan van 3 weken).
DRUG-INTERACTIES
Cyclosporine
Ciclosporine verhoogde de blootstelling aan rosuvastatine en kan leiden tot een verhoogd risico op myopathie. Daarom mag bij patiënten die ciclosporine gebruiken de dosis CRESTOR 10 mg niet hoger zijn dan 5 mg eenmaal daags [zie: DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Gemfibrozil
Gemfibrozil verhoogde de blootstelling aan rosuvastatine significant. Vanwege een waargenomen verhoogd risico op myopathie/rabdomyolyse moet combinatietherapie met CRESTOR en gemfibrozil worden vermeden. Indien samen gebruikt, mag de dosis CRESTOR 10 mg niet hoger zijn dan 10 mg eenmaal daags [zie: KLINISCHE FARMACOLOGIE ].
Proteaseremmers
Gelijktijdige toediening van rosuvastatine met bepaalde proteaseremmers heeft verschillende effecten op de blootstelling aan rosuvastatine en kan het risico op myopathie verhogen. Simeprevir, dat een hepatitis C-virus (HCV)-proteaseremmer is, of combinaties van atazanavir/ritonavir of lopinavir/ritonavir, die hiv-1-proteaseremmers zijn, verhogen de blootstelling aan rosuvastatine (zie tabel 4 - KLINISCHE FARMACOLOGIE ]. Voor deze proteaseremmers mag de dosis CRESTOR 5 mg niet hoger zijn dan 10 mg eenmaal daags. De combinaties van fosamprenavir/ritonavir of tipranavir/ritonavir, die HIV-1-proteaseremmers zijn, veroorzaken weinig of geen verandering in de blootstelling aan rosuvastatine. Voorzichtigheid is geboden wanneer rosuvastatine gelijktijdig wordt toegediend met proteaseremmers [zie: DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Coumarine anticoagulantia
CRESTOR 20 mg verhoogde de INR significant bij patiënten die cumarine-anticoagulantia kregen. Daarom is voorzichtigheid geboden wanneer cumarine-anticoagulantia in combinatie met CRESTOR worden gegeven. Bij patiënten die gelijktijdig cumarine-anticoagulantia en CRESTOR gebruiken, moet de INR worden bepaald voordat met CRESTOR wordt gestart en vaak genoeg tijdens de vroege behandeling om ervoor te zorgen dat er geen significante verandering van de INR optreedt (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
niacine
Het risico op effecten op de skeletspieren kan verhoogd zijn wanneer CRESTOR 5 mg wordt gebruikt in combinatie met lipidenmodificerende doses (≥1 g/dag) niacine; voorzichtigheid is geboden bij het voorschrijven met CRESTOR [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Fenofibraat
Wanneer CRESTOR 20 mg gelijktijdig werd toegediend met fenofibraat, werd geen klinisch significante toename van de AUC van rosuvastatine of fenofibraat waargenomen. Omdat bekend is dat het risico op myopathie tijdens behandeling met HMG-CoA-reductaseremmers verhoogd is bij gelijktijdig gebruik van fenofibraten, is voorzichtigheid geboden bij het voorschrijven van fenofibraten met CRESTOR (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Colchicine
Gevallen van myopathie, waaronder rabdomyolyse, zijn gemeld met HMG-CoA-reductaseremmers, waaronder rosuvastatine, gelijktijdig toegediend met colchicine, en voorzichtigheid is geboden bij het voorschrijven van CRESTOR met colchicine [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Skeletspiereffecten
Gevallen van myopathie en rabdomyolyse met acuut nierfalen secundair aan myoglobinurie zijn gemeld met HMG-CoA-reductaseremmers, waaronder CRESTOR. Deze risico's kunnen bij elk dosisniveau optreden, maar nemen toe bij de hoogste dosis (40 mg).
CRESTOR 5 mg moet met voorzichtigheid worden voorgeschreven aan patiënten met predisponerende factoren voor myopathie (bijv. leeftijd ≥ 65 jaar, onvoldoende behandelde hypothyreoïdie, nierfunctiestoornis). Het risico op myopathie tijdens behandeling met CRESTOR 5 mg kan toenemen bij gelijktijdige toediening van enkele andere lipidenverlagende therapieën (fibraten of niacine), gemfibrozil, ciclosporine, atazanavir/ritonavir, lopinavir/ritonavir of simeprevir (zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ]. Gevallen van myopathie, waaronder rabdomyolyse, zijn gemeld met HMG-CoA-reductaseremmers, waaronder rosuvastatine, gelijktijdig toegediend met colchicine, en voorzichtigheid is geboden bij het voorschrijven van CRESTOR met colchicines [zie DRUG-INTERACTIES ].
De therapie met CRESTOR moet worden stopgezet als er duidelijk verhoogde creatinekinasespiegels optreden of als myopathie wordt gediagnosticeerd of vermoed. Behandeling met CRESTOR 5 mg moet ook tijdelijk worden onderbroken bij elke patiënt met een acute, ernstige aandoening die op myopathie wijst of die vatbaar is voor de ontwikkeling van nierfalen secundair aan rabdomyolyse (bijv. sepsis, hypotensie, dehydratie, grote operatie, trauma, ernstige metabole, endocriene, en elektrolytenstoornissen, of ongecontroleerde aanvallen).
Er zijn zeldzame meldingen geweest van immuungemedieerde necrotiserende myopathie (IMNM), een auto-immuunmyopathie, geassocieerd met statinegebruik. IMNM wordt gekenmerkt door: proximale spierzwakte en verhoogd serumcreatinekinase, die aanhouden ondanks stopzetting van de statinebehandeling; spierbiopsie die necrotiserende myopathie toont zonder significante ontsteking; verbetering met immunosuppressiva.
Alle patiënten moeten worden geadviseerd om onverklaarbare spierpijn, gevoeligheid of zwakte onmiddellijk aan hun arts te melden, vooral als deze gepaard gaat met malaise of koorts of als spiertekens en -symptomen aanhouden na het stoppen met CRESTOR.
Leverenzymafwijkingen
Het wordt aanbevolen om leverenzymtests uit te voeren voordat met CRESTOR 10 mg wordt gestart en als er tekenen of symptomen van leverbeschadiging optreden.
Verhogingen van serumtransaminasen [AST (SGOT) of ALT (SGPT)] zijn gemeld met HMG-CoA-reductaseremmers, waaronder CRESTOR. In de meeste gevallen waren de verhogingen van voorbijgaande aard en verdwenen of verbeterden ze bij voortzetting van de therapie of na een korte onderbreking van de therapie. Er waren twee gevallen van geelzucht, waarvoor geen verband met de CRESTOR-therapie kon worden vastgesteld, die verdween na stopzetting van de therapie. Er waren geen gevallen van leverfalen of onomkeerbare leverziekte in deze onderzoeken. In een gepoolde analyse van placebogecontroleerde onderzoeken traden verhogingen van serumtransaminasen tot >3 maal de bovengrens van normaal op bij 1,1% van de patiënten die CRESTOR 5 mg gebruikten versus 0,5% van de patiënten die met placebo werden behandeld.
Er zijn zeldzame postmarketingmeldingen geweest van fataal en niet-fataal leverfalen bij patiënten die statines gebruikten, waaronder rosuvastatine. Als tijdens de behandeling met CRESTOR 20 mg ernstige leverbeschadiging met klinische symptomen en/of hyperbilirubinemie of geelzucht optreedt, moet de behandeling onmiddellijk worden onderbroken. Als er geen alternatieve etiologie wordt gevonden, start CRESTOR dan niet opnieuw.
CRESTOR 5 mg moet met voorzichtigheid worden gebruikt bij patiënten die aanzienlijke hoeveelheden alcohol consumeren en/of een voorgeschiedenis hebben van chronische leverziekte [zie KLINISCHE FARMACOLOGIE ]. Actieve leverziekte, die onverklaarbare aanhoudende transaminaseverhogingen kan omvatten, is een contra-indicatie voor het gebruik van CRESTOR (zie CONTRA-INDICATIES ].
Gelijktijdige cumarine-anticoagulantia
Voorzichtigheid is geboden wanneer anticoagulantia worden gegeven in combinatie met CRESTOR vanwege de versterking van het effect van anticoagulantia van het cumarine-type bij het verlengen van de protrombinetijd/INR. Bij patiënten die gelijktijdig cumarine-anticoagulantia en CRESTOR gebruiken, moet de INR worden bepaald voordat met CRESTOR 10 mg wordt gestart en vaak genoeg tijdens de vroege behandeling om ervoor te zorgen dat er geen significante verandering van de INR optreedt [zie DRUG-INTERACTIES ].
Proteïnurie en hematurie
In het klinische studieprogramma met CRESTOR werden dipstick-positieve proteïnurie en microscopische hematurie waargenomen bij met CRESTOR behandelde patiënten. Deze bevindingen kwamen vaker voor bij patiënten die CRESTOR 40 mg gebruikten, in vergelijking met lagere doses CRESTOR 20 mg of HMG-CoA-reductaseremmers ter vergelijking, hoewel dit over het algemeen van voorbijgaande aard was en niet gepaard ging met een verslechtering van de nierfunctie. Hoewel de klinische betekenis van deze bevinding onbekend is, dient een dosisverlaging te worden overwogen voor patiënten die CRESTOR-therapie ondergaan met onverklaarbare aanhoudende proteïnurie en/of hematurie tijdens routinematig urineonderzoek.
Endocriene effecten
Verhogingen van HbA1c en nuchtere serumglucosespiegels zijn gemeld met HMG-CoA-reductaseremmers, waaronder CRESTOR. Op basis van gegevens uit klinische onderzoeken met CRESTOR kunnen deze verhogingen in sommige gevallen de drempel voor de diagnose diabetes mellitus overschrijden [zie ONGEWENSTE REACTIES ].
Hoewel klinische studies hebben aangetoond dat CRESTOR 10 mg alleen de basale plasmacortisolconcentratie niet verlaagt of de bijnierreserve niet schaadt, is voorzichtigheid geboden als CRESTOR gelijktijdig wordt toegediend met geneesmiddelen die de spiegels of activiteit van endogene steroïde hormonen zoals ketoconazol, spironolacton en cimetidine.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Patiënten dienen te worden geïnstrueerd om binnen 12 uur na elkaar geen 2 doses CRESTOR in te nemen.
Skeletspiereffecten
Patiënten moeten worden geadviseerd onverklaarbare spierpijn, gevoeligheid of zwakte onmiddellijk te melden, vooral als deze gepaard gaat met malaise of koorts of als deze spiertekenen of -symptomen aanhouden na het stoppen met CRESTOR.
Gelijktijdig gebruik van antacida
Als CRESTOR 5 mg wordt ingenomen met een antacidum met een combinatie van aluminium en magnesiumhydroxide, moet het antacidum ten minste 2 uur na toediening van CRESTOR 10 mg worden ingenomen.
Embryofetale toxiciteit
Adviseer vrouwen met reproductief vermogen over het risico voor een foetus, om effectieve anticonceptie te gebruiken tijdens de behandeling en om hun zorgverlener op de hoogte te stellen van een bekende of vermoede zwangerschap. [zien CONTRA-INDICATIES en Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen geen borstvoeding te geven tijdens de behandeling met CRESTOR [zie CONTRA-INDICATIES en Gebruik bij specifieke populaties ].
Lever enzymen
Het wordt aanbevolen om leverenzymtests uit te voeren voordat met CRESTOR wordt gestart en als er tekenen of symptomen van leverbeschadiging optreden. Alle patiënten die met CRESTOR worden behandeld, moeten worden geadviseerd om onmiddellijk alle symptomen te melden die kunnen wijzen op leverbeschadiging, waaronder vermoeidheid, anorexia, ongemak in de rechter bovenbuik, donkere urine of geelzucht.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 104 weken durende carcinogeniteitsstudie bij ratten met doseringen van 2, 20, 60 of 80 mg/kg/dag via orale sondevoeding, was de incidentie van uteriene stromale poliepen significant verhoogd bij vrouwtjes bij 80 mg/kg/dag bij systemische blootstelling 20 maal de menselijke blootstelling bij 40 mg/dag op basis van de AUC. Een verhoogde incidentie van poliepen werd niet gezien bij lagere doses.
In een 107 weken durende carcinogeniteitsstudie bij muizen die 10, 60 of 200 mg/kg/dag via een orale maagsonde kregen toegediend, werd een verhoogde incidentie van hepatocellulair adenoom/carcinoom waargenomen bij 200 mg/kg/dag bij systemische blootstellingen die 20 keer hoger waren dan de blootstelling bij de mens. bij 40 mg/dag op basis van de AUC. Een verhoogde incidentie van hepatocellulaire tumoren werd niet gezien bij lagere doses.
Rosuvastatine was niet mutageen of clastogeen met of zonder metabolische activering in de Ames-test met Salmonella typhimurium en Escherichia coli, de muislymfoomtest en de chromosomale aberratietest in longcellen van Chinese hamsters. Rosuvastatine was negatief in de in vivo micronucleustest bij muizen.
In vruchtbaarheidsonderzoeken bij ratten met orale toedieningsdoses van 5, 15, 50 mg/kg/dag werden mannetjes gedurende 9 weken voor en tijdens het paren behandeld en vrouwtjes werden 2 weken voor het paren en tijdens het paren tot dag 7 van de dracht behandeld. effect op de vruchtbaarheid werd waargenomen bij 50 mg/kg/dag (systemische blootstellingen tot 10 keer de menselijke blootstelling bij 40 mg/dag op basis van AUC). In testikels van honden die gedurende één maand werden behandeld met rosuvastatine van 30 mg/kg/dag, werden spermatidische reuzencellen gezien. Spermatidische reuzencellen werden waargenomen bij apen na een behandeling van 6 maanden met 30 mg/kg/dag naast vacuolatie van tubulair epitheel van de seminiferi. Blootstellingen bij de hond waren 20 keer en bij de aap 10 keer de menselijke blootstelling bij 40 mg/dag op basis van lichaamsoppervlak. Soortgelijke bevindingen zijn waargenomen met andere geneesmiddelen in deze klasse.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
CRESTOR 5 mg is gecontra-indiceerd voor gebruik bij zwangere vrouwen, aangezien de veiligheid bij zwangere vrouwen niet is vastgesteld en er geen duidelijk voordeel is van therapie met CRESTOR 20 mg tijdens de zwangerschap. Omdat HMG-CoA-reductaseremmers de cholesterolsynthese en mogelijk de synthese van andere biologisch actieve stoffen afgeleid van cholesterol verminderen, kan CRESTOR schade aan de foetus veroorzaken bij toediening aan zwangere vrouwen. CRESTOR 5 mg moet worden gestaakt zodra zwangerschap wordt herkend [zie CONTRA-INDICATIES ]. Beperkte gepubliceerde gegevens over het gebruik van rosuvastatine zijn onvoldoende om een geneesmiddelgerelateerd risico op ernstige aangeboren afwijkingen of miskraam vast te stellen. In reproductiestudies bij dieren waren er geen nadelige ontwikkelingseffecten bij orale toediening van rosuvastatine tijdens de organogenese bij systemische blootstellingen gelijk aan een maximale aanbevolen dosis voor de mens (MRHD) van 40 mg/dag bij ratten of konijnen (gebaseerd op respectievelijk AUC en lichaamsoppervlak). ). Bij ratten en konijnen trad een verminderde overleving van de jongen / foetus op bij respectievelijk 12 keer en equivalent aan de MRHD van 40 mg / dag [zie Gegevens ].
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2-4% en 15-20%.
Gegevens
Menselijke gegevens
Beperkte gepubliceerde gegevens over rosuvastatine hebben geen verhoogd risico op ernstige aangeboren afwijkingen of miskraam aangetoond. Zeldzame meldingen van aangeboren afwijkingen zijn ontvangen na intra-uteriene blootstelling aan andere statines. In een beoordeling van ongeveer 100 prospectief gevolgde zwangerschappen bij vrouwen die waren blootgesteld aan simvastatine of lovastatine, was de incidentie van aangeboren afwijkingen, spontane abortussen en foetale sterfte/doodgeboorte niet groter dan wat in de algemene bevolking zou worden verwacht. Het aantal gevallen is voldoende om een ≥3- tot 4-voudige toename van aangeboren afwijkingen ten opzichte van de achtergrondincidentie uit te sluiten. Bij 89% van de prospectief gevolgde zwangerschappen werd de medicamenteuze behandeling gestart voorafgaand aan de zwangerschap en werd deze stopgezet op een bepaald moment in het eerste trimester toen zwangerschap werd vastgesteld.
Dierlijke gegevens
Rosuvastatine passeert de placenta bij ratten en konijnen en wordt aangetroffen in foetaal weefsel en vruchtwater bij respectievelijk 3% en 20% van de maternale plasmaconcentratie na een enkelvoudige orale dosis van 25 mg/kg op dag 16 van de dracht bij ratten. Een hogere foetale weefseldistributie (25% maternale plasmaconcentratie) werd waargenomen bij konijnen na een enkelvoudige orale maagsonde van 1 mg/kg op dag 18 van de dracht.
Toediening van rosuvastatine duidde niet op een teratogeen effect bij ratten bij ≤25 mg/kg/dag of bij konijnen ≤3 mg/kg/dag (doses equivalent aan de MRHD van 40 mg/dag gebaseerd op respectievelijk AUC en lichaamsoppervlak).
Bij vrouwelijke ratten die 5, 15 en 50 mg/kg/dag kregen vóór de paring en doorgaan tot dag 7 van de dracht, resulteerde dit in een verminderd foetaal lichaamsgewicht (vrouwelijke jongen) en vertraagde ossificatie bij 50 mg/kg/dag (10 maal de menselijke blootstelling bij de MRHD-dosis van 40 mg/dag op basis van de AUC).
Bij drachtige ratten die 2, 10 en 50 mg/kg/dag rosuvastatine kregen vanaf dag 7 van de dracht tot dag 21 van de lactatie (spenen), trad een verminderde overleving van de jongen op bij 50 mg/kg/dag (dosis equivalent aan 12 maal de MRHD van 40 mg lichaamsoppervlak per dag).
Bij drachtige konijnen die 0,3, 1 en 3 mg/kg/dag rosuvastatine kregen van dag 6 tot dag 18 van de dracht, werd verminderde foetale levensvatbaarheid en maternale mortaliteit waargenomen bij 3 mg/kg/dag (dosis equivalent aan de MRHD van 40 mg/dag). dag op basis van lichaamsoppervlak).
Borstvoeding
Risico Samenvatting
Het gebruik van rosuvastatine is gecontra-indiceerd tijdens het geven van borstvoeding [zie CONTRA-INDICATIES ]. Beperkte gegevens wijzen erop dat CRESTOR aanwezig is in moedermelk. Er is geen informatie beschikbaar over de effecten van het geneesmiddel op de zuigeling die borstvoeding krijgt of de effecten van het geneesmiddel op de melkproductie. In verband met de kans op ernstige bijwerkingen bij een zuigeling die borstvoeding krijgt, dient u patiënten te adviseren dat borstvoeding niet wordt aanbevolen tijdens de behandeling met CRESTOR.
Vrouwtjes en mannetjes met reproductief potentieel
anticonceptie
CRESTOR kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw [zie Gebruik bij specifieke populaties ]. Adviseer vrouwen in de vruchtbare leeftijd om effectieve anticonceptie te gebruiken tijdens de behandeling met CRESTOR.
Pediatrisch gebruik
Bij kinderen en adolescenten van 8 tot 17 jaar met heterozygote familiaire hypercholesterolemie is de veiligheid en werkzaamheid van CRESTOR 10 mg als aanvulling op een dieet om de totale cholesterol-, LDL-C- en ApoB-spiegels te verlagen wanneer, na een adequate proef met dieettherapie, LDL -Cmax hoger is dan 190 mg/dL of wanneer LDL-C hoger is dan 160 mg/dL en er is een positieve familiegeschiedenis van premature CVD of twee of meer andere CVD-risicofactoren, werden vastgesteld in één gecontroleerde studie en in één open-label, ongecontroleerde proces [zie Klinische studies ]. De werkzaamheid op lange termijn van CRESTOR-therapie, gestart in de kindertijd om de morbiditeit en mortaliteit op volwassen leeftijd te verminderen, is niet vastgesteld.
De veiligheid en werkzaamheid van CRESTOR 5 mg bij kinderen en adolescenten van 10 tot 17 jaar met heterozygote familiaire hypercholesterolemie werden geëvalueerd in een gecontroleerd klinisch onderzoek van 12 weken, gevolgd door 40 weken open-label blootstelling. Patiënten die werden behandeld met 5 mg, 10 mg en 20 mg CRESTOR 10 mg per dag hadden een bijwerkingenprofiel dat over het algemeen vergelijkbaar was met dat van patiënten die met placebo werden behandeld. Er was geen detecteerbaar effect van CRESTOR op groei, gewicht, BMI (body mass index) of seksuele rijping [zie Klinische studies ] bij kinderen en adolescenten (10 tot 17 jaar).
CRESTOR is niet onderzocht in gecontroleerde klinische onderzoeken met prepuberale patiënten of patiënten jonger dan 10 jaar met heterozygote familiaire hypercholesterolemie. De veiligheid en werkzaamheid van CRESTOR werden echter geëvalueerd in een twee jaar durend open-label ongecontroleerd onderzoek met kinderen en adolescenten van 8 tot 17 jaar met heterozygote familiaire hypercholesterolemie [zie Klinische studies ]. De veiligheid en werkzaamheid van CRESTOR 5 mg bij het verlagen van LDL-C leek over het algemeen overeen te komen met die waargenomen bij volwassen patiënten, ondanks beperkingen van de ongecontroleerde onderzoeksopzet.
Kinderen en adolescenten van 7 tot 15 jaar met homozygote familiaire hypercholesterolemie werden onderzocht in een 6 weken durende gerandomiseerde, placebogecontroleerde, cross-over studie met CRESTOR 20 mg eenmaal daags gevolgd door 12 weken open-label behandeling [zie Klinische studies ]. Over het algemeen was het veiligheidsprofiel in dit onderzoek consistent met dat van het eerder vastgestelde veiligheidsprofiel bij volwassenen.
Hoewel niet alle bijwerkingen die zijn vastgesteld bij de volwassen populatie zijn waargenomen in klinische onderzoeken bij kinderen en adolescenten, dienen dezelfde waarschuwingen en voorzorgen voor volwassenen te worden overwogen voor kinderen en adolescenten. Adolescente vrouwen moeten worden geadviseerd over geschikte anticonceptiemethoden tijdens de behandeling met CRESTOR 5 mg [zie: Gebruik bij specifieke populaties ].
Geriatrisch gebruik
Van de 10.275 patiënten in klinische onderzoeken met CRESTOR waren 3159 (31%) 65 jaar en ouder en 698 (6,8%) 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Oudere patiënten lopen een hoger risico op myopathie en CRESTOR moet met voorzichtigheid worden voorgeschreven aan ouderen [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Blootstelling aan rosuvastatine wordt niet beïnvloed door lichte tot matige nierinsufficiëntie (CLcr ≥30 ml/min/1,73 m²). Blootstelling aan rosuvastatine is in klinisch significante mate verhoogd bij patiënten met ernstige nierfunctiestoornis (CLcr DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Leverfunctiestoornis
CRESTOR is gecontra-indiceerd bij patiënten met een actieve leverziekte, waaronder onverklaarbare aanhoudende verhogingen van levertransaminasespiegels. Het is bekend dat chronische alcoholleverziekte de blootstelling aan rosuvastatine verhoogt; CRESTOR 20 mg moet met voorzichtigheid worden gebruikt bij deze patiënten [zie CONTRA-INDICATIES , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Aziatische patiënten
Farmacokinetische studies hebben een ongeveer 2-voudige toename aangetoond van de mediane blootstelling aan rosuvastatine bij Aziatische proefpersonen in vergelijking met blanke controles. De dosering van CRESTOR moet worden aangepast bij Aziatische patiënten [zie: DOSERING EN ADMINISTRATIE en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Er is geen specifieke behandeling in geval van overdosering. In geval van overdosering moet de patiënt symptomatisch worden behandeld en zo nodig ondersteunende maatregelen worden genomen. Hemodialyse verbetert de klaring van rosuvastatine niet significant.
CONTRA-INDICATIES
CRESTOR 20 mg is gecontra-indiceerd bij de volgende aandoeningen:
- Patiënten met een bekende overgevoeligheid voor een van de bestanddelen van dit product. Overgevoeligheidsreacties waaronder huiduitslag, pruritus, urticaria en angio-oedeem zijn gemeld met CRESTOR (zie ONGEWENSTE REACTIES ].
- Patiënten met een actieve leverziekte, waaronder mogelijk onverklaarbare aanhoudende verhogingen van levertransaminasespiegels [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
- zwangerschap [zie Gebruik bij specifieke populaties ].
- Borstvoeding. Beperkte gegevens wijzen erop dat CRESTOR 20 mg aanwezig is in moedermelk. Omdat statines mogelijk ernstige bijwerkingen kunnen veroorzaken bij zuigelingen die borstvoeding geven, mogen vrouwen die een behandeling met CRESTOR nodig hebben hun zuigelingen geen borstvoeding geven [zie Gebruik bij specifieke populaties ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
CRESTOR 10 mg is een selectieve en competitieve remmer van HMG-CoA-reductase, het snelheidsbeperkende enzym dat 3-hydroxy-3-methylglutaryl-co-enzym A omzet in mevalonaat, een voorloper van cholesterol. In vivo studies bij dieren en in vitro studies in gekweekte dierlijke en menselijke cellen hebben aangetoond dat rosuvastatine een hoge opname en selectiviteit heeft voor de werking in de lever, het doelorgaan voor cholesterolverlaging. In in vivo en in vitro studies produceert rosuvastatine zijn lipidenmodificerende effecten op twee manieren. Ten eerste verhoogt het het aantal lever-LDL-receptoren op het celoppervlak om de opname en het katabolisme van LDL te verbeteren. Ten tweede remt rosuvastatine de hepatische synthese van VLDL, wat het totale aantal VLDL- en LDL-deeltjes vermindert.
farmacodynamiek
CRESTOR 5 mg verlaagt dosisafhankelijk verhoogd LDL-cholesterol en verlaagt totaal cholesterol en triglyceriden en verhoogt HDL-cholesterol [zie Klinische studies ]. Een therapeutische respons op CRESTOR 5 mg is duidelijk binnen 1 week na aanvang van de behandeling en 90% van de maximale respons wordt gewoonlijk binnen 2 weken bereikt. De maximale respons wordt gewoonlijk bereikt na 4 weken en houdt daarna aan. Individualisering van de medicijndosering moet gebaseerd zijn op de therapeutische respons [zie DOSERING EN ADMINISTRATIE ].
Farmacokinetiek
Absorptie
In klinische farmacologische studies bij de mens werden de piekplasmaconcentraties van rosuvastatine 3 tot 5 uur na orale toediening bereikt. Zowel de Cmax als de AUC namen ongeveer evenredig toe met de dosis CRESTOR 10 mg. De absolute biologische beschikbaarheid van rosuvastatine is ongeveer 20%.
Toediening van CRESTOR met voedsel had geen invloed op de AUC van rosuvastatine.
De AUC van rosuvastatine verschilt niet na toediening van het medicijn 's avonds of 's ochtends.
Verdeling
Het gemiddelde distributievolume bij steady-state van rosuvastatine is ongeveer 134 liter. Rosuvastatine wordt voor 88% gebonden aan plasma-eiwitten, voornamelijk albumine. Deze binding is omkeerbaar en onafhankelijk van plasmaconcentraties.
Eliminatie
Rosuvastatine wordt voornamelijk geëlimineerd door excretie in de feces. De eliminatiehalfwaardetijd van rosuvastatine is ongeveer 19 uur.
Metabolisme
Rosuvastatine wordt niet uitgebreid gemetaboliseerd; ongeveer 10% van een radioactief gelabelde dosis wordt teruggevonden als metaboliet. De belangrijkste metaboliet is N-desmethylrosuvastatine, dat voornamelijk wordt gevormd door cytochroom P450 \ 2C9, en in vitro-onderzoeken hebben aangetoond dat N-desmethylrosuvastatine ongeveer een zesde tot de helft van de HMG-CoA-reductaseremmende activiteit van de moederverbinding heeft. . Over het algemeen wordt meer dan 90% van de actieve plasma-HMG-CoA-reductaseremmende activiteit verklaard door de moederverbinding.
uitscheiding
Na orale toediening worden rosuvastatine en zijn metabolieten voornamelijk uitgescheiden in de feces (90%). Na een intraveneuze dosis verliep ongeveer 28% van de totale lichaamsklaring via de nieren en 72% via de lever.
Specifieke populaties
Raciale of etnische groepen
Een populatiefarmacokinetische analyse bracht geen klinisch relevante verschillen in farmacokinetiek aan het licht tussen blanke, Spaanse en zwarte of Afro-Caribische groepen. Farmacokinetische onderzoeken, waaronder één uitgevoerd in de VS, hebben echter een ongeveer 2-voudige verhoging van de mediane blootstelling (AUC en Cmax) aangetoond bij Aziatische proefpersonen in vergelijking met een blanke controlegroep.
Mannelijke en vrouwelijke patiënten
Er waren geen verschillen in plasmaconcentraties van rosuvastatine tussen mannen en vrouwen.
Pediatrische patiënten
In een farmacokinetische populatieanalyse van twee pediatrische onderzoeken met patiënten met heterozygote familiaire hypercholesterolemie van respectievelijk 10 tot 17 jaar en 8 tot 17 jaar, bleek de blootstelling aan rosuvastatine vergelijkbaar met of lager dan de blootstelling aan rosuvastatine bij volwassen patiënten.
Geriatrische patiënten
Er waren geen verschillen in plasmaconcentraties van rosuvastatine tussen de niet-bejaarde en oudere populaties (leeftijd ≥65 jaar).
Patiënten met nierinsufficiëntie
Lichte tot matige nierfunctiestoornis (CLcr ≥30 ml/min/1,73 m²) had geen invloed op de plasmaconcentraties van rosuvastatine. De plasmaconcentraties van rosuvastatine namen echter in klinisch significante mate toe (ongeveer driemaal) bij patiënten met ernstige nierfunctiestoornis (CLcr 80 ml/min/ 1,73 m²).
Hemodialyse
Steady-state plasmaconcentraties van rosuvastatine bij patiënten die chronische hemodialyse ondergaan waren ongeveer 50% hoger in vergelijking met gezonde vrijwilligers met een normale nierfunctie.
Patiënten met leverinsufficiëntie
Bij patiënten met chronische alcoholische leverziekte waren de plasmaconcentraties van rosuvastatine licht verhoogd.
Bij patiënten met de ziekte van Child-Pugh A waren de Cmax en AUC verhoogd met respectievelijk 60% en 5% in vergelijking met patiënten met een normale leverfunctie. Bij patiënten met de ziekte van Child-Pugh B waren de Cmax en AUC respectievelijk 100% en 21% verhoogd in vergelijking met patiënten met een normale leverfunctie.
Onderzoek naar geneesmiddelinteracties
De klaring van rosuvastatine is niet in klinisch significante mate afhankelijk van het metabolisme door cytochroom P450 3A4.
Rosuvastatine is een substraat voor bepaalde transporteiwitten, waaronder het leveropnametransporteiwit, organisch aniontransporterend polyproteïne 1B1 (OATP1B1) en het effluxtransporter-borstkankerresistentie-eiwit (BCRP). Gelijktijdige toediening van CRESTOR 10 mg met geneesmiddelen die deze transporteiwitten remmen (bijv. ciclosporine, bepaalde HIV-proteaseremmers) kan leiden tot verhoogde plasmaconcentraties van rosuvastatine (zie DOSERING EN ADMINISTRATIE en DRUG-INTERACTIES ].
farmacogenomica
Dispositie van HMG-CoA-reductaseremmers, waaronder rosuvastatine, omvat OATP1B1 en andere transporteiwitten. Hogere plasmaconcentraties van rosuvastatine zijn gemeld bij zeer kleine groepen patiënten (n=3 tot 5) met twee verminderd functionerende allelen van het gen dat codeert voor OATP1B1 (SLCO1B1 521T > C). De frequentie van dit genotype (dwz SLCO1B1 521 C/C) is over het algemeen lager dan 5% in de meeste raciale/etnische groepen. De impact van dit polymorfisme op de werkzaamheid en/of veiligheid van rosuvastatine is niet duidelijk vastgesteld.
Dierlijke toxicologie en/of farmacologie
Toxiciteit van het centrale zenuwstelsel
CZS-vasculaire laesies, gekenmerkt door perivasculaire bloedingen, oedeem en mononucleaire celinfiltratie van perivasculaire ruimten, zijn waargenomen bij honden die werden behandeld met verschillende andere leden van deze geneesmiddelenklasse. Een chemisch vergelijkbaar medicijn in deze klasse veroorzaakte dosisafhankelijke oogzenuwdegeneratie (Walleriaanse degeneratie van retinogene vezels) bij honden, in een dosis die plasmaspiegels produceerde die ongeveer 30 keer hoger waren dan het gemiddelde medicijnniveau bij mensen die de hoogste aanbevolen dosis namen. Oedeem, bloeding en gedeeltelijke necrose in het interstitium van de choroïde plexus werden waargenomen bij een stervende vrouwelijke hond op dag 24 bij 90 mg/kg/dag door orale sondevoeding (systemische blootstelling 100 maal de menselijke blootstelling bij 40 mg/dag op basis van AUC). Opaciteit van het hoornvlies werd waargenomen bij honden die gedurende 52 weken werden behandeld met 6 mg/kg/dag via een orale sonde (systemische blootstelling 20 maal de blootstelling bij de mens bij 40 mg/dag op basis van de AUC). Cataract werd waargenomen bij honden die gedurende 12 weken werden behandeld met een orale maagsonde van 30 mg/kg/dag (systemische blootstelling 60 maal de menselijke blootstelling bij 40 mg/dag op basis van de AUC). Dysplasie van het netvlies en verlies van het netvlies werden waargenomen bij honden die gedurende 4 weken werden behandeld met een orale maagsonde van 90 mg/kg/dag (systemische blootstellingen 100 maal de blootstelling bij de mens bij 40 mg/dag op basis van de AUC). Doses 30 mg/kg/dag (systemische blootstellingen ≤60 maal de menselijke blootstelling bij 40 mg/dag gebaseerd op de AUC) lieten geen retinale bevindingen zien tijdens de behandeling gedurende maximaal één jaar.
Onderzoek naar juveniele toxicologie
In een juveniele studie kregen ratten een orale dosis van 10 of 50 mg/kg/dag vanaf het spenen gedurende 9 weken voorafgaand aan het paren, tijdens het paren en tot de dag vóór necropsie voor mannetjes of tot dag 7 van de dracht voor vrouwtjes. Er werden geen effecten op seksuele ontwikkeling, testiculaire en epididymale verschijning of vruchtbaarheid waargenomen bij beide doseringen (2 keer of tot 24 keer de menselijke blootstelling (AUC) bij de maximale pediatrische dosis van 20 mg/dag).
Klinische studies
Hyperlipidemie en gemengde dyslipidemie
CRESTOR 5 mg vermindert Total-C, LDL-C, ApoB, nonHDL-C en TG en verhoogt HDL-C bij volwassen patiënten met hyperlipidemie en gemengde dyslipidemie.
Dosis-variërend onderzoek
In een multicenter, dubbelblind, placebogecontroleerd, dosisbereikonderzoek bij patiënten met hyperlipidemie CRESTOR, gegeven als een enkele dagelijkse dosis gedurende 6 weken, verminderde significant Total-C, LDL-C, nonHDL-C en ApoB over de hele dosis bereik (tabel 6).
Actief-gecontroleerde studie
CRESTOR 5 mg werd vergeleken met de HMG-CoA-reductaseremmers atorvastatine, simvastatine en pravastatine in een multicenter, open-label, dosisbereikonderzoek bij 2240 patiënten met hyperlipidemie of gemengde dyslipidemie. Na randomisatie werden patiënten gedurende 6 weken behandeld met een enkele dagelijkse dosis van CRESTOR 20 mg, atorvastatine, simvastatine of pravastatine (Figuur 1 en Tabel 7).
Figuur 1: Percentage LDL-C-verandering per dosis CRESTOR 20 mg, atorvastatine, simvastatine en pravastatine in week 6 bij patiënten met hyperlipidemie of gemengde dyslipidemie 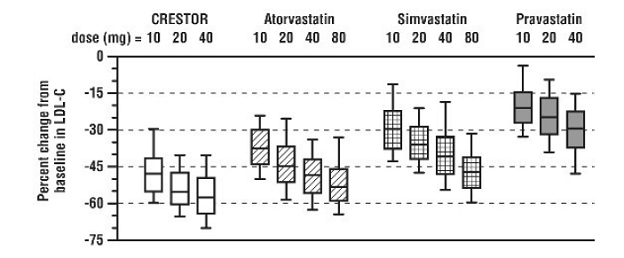
Boxplots zijn een weergave van de 25e, 50e en 75e percentielwaarden, met snorharen die de 10e en 90e percentielwaarden vertegenwoordigen. Gemiddelde baseline LDL-C: 189 mg/Dl
Heterozygote familiale hypercholesterolemie
Actief-gecontroleerde studie
In een onderzoek bij patiënten met heterozygote FH (gemiddelde LDL bij baseline van 291) werden patiënten gerandomiseerd naar CRESTOR 20 mg of atorvastatine 20 mg. De dosis werd verhoogd met tussenpozen van 6 weken. Bij elke dosis werden in beide behandelingsgroepen significante LDL-C-verlagingen gezien ten opzichte van de uitgangswaarde (Tabel 8).
Hypertriglyceridemie
Dosis-responsonderzoek
In een dubbelblind, placebogecontroleerd dosis-responsonderzoek bij patiënten met baseline-TG-spiegels van 273 tot 817 mg/dL, verminderde CRESTOR 10 mg als een enkele dagelijkse dosis (5 tot 40 mg) gedurende 6 weken de serum-TG-spiegels significant ( Tabel 9).
Primaire dysbetalipoproteïnemie (type III hyperlipoproteïnemie)
In een gerandomiseerde, multicenter, dubbelblinde cross-over studie gingen 32 patiënten (27 met ε2/ε2 en 4 met apo E-mutatie [Arg145Cys] met primaire dysbetalipoproteïnemie (Type III hyperlipoproteïnemie) een voedingsinloopperiode van 6 weken in op de NCEP. Therapeutic Lifestyle Change (TLC)-dieet Na de introductie van het dieet werden patiënten gerandomiseerd naar een reeks behandelingen in combinatie met het TLC-dieet gedurende 6 weken: rosuvastatine 10 mg gevolgd door rosuvastatine 20 mg of rosuvastatine 20 mg gevolgd door rosuvastatine 10 mg CRESTOR verlaagde niet-HDL-C (primair eindpunt) en circulerende resterende lipoproteïneniveaus.De resultaten worden weergegeven in de onderstaande tabel.
Homozygote familiale hypercholesterolemie
Dosis-titratie-onderzoek
In een open-label onderzoek met geforceerde titratie werden homozygote FH-patiënten (n=40, 8-63 jaar) geëvalueerd op hun respons op CRESTOR 20 tot 40 mg getitreerd met een interval van 6 weken. In de totale populatie was de gemiddelde LDL-C-verlaging vanaf baseline 22%. Ongeveer een derde van de patiënten had baat bij het verhogen van de dosis van 20 mg naar 40 mg met een verdere LDL-verlaging van meer dan 6%. Bij de 27 patiënten met een LDL-C-reductie van ten minste 15%, was de gemiddelde LDL-C-reductie 30% (mediaan 28% reductie). Van de 13 patiënten met een LDL-C-verlaging van
Pediatrische patiënten met homozygote familiaire hypercholesterolemie
CRESTOR werd onderzocht in een gerandomiseerde, dubbelblinde, placebogecontroleerde, multicenter, cross-over studie bij 14 kinderen en adolescenten met homozygote familiaire hypercholesterolemie. De studie omvatte een voedingsaanloopfase van 4 weken waarin patiënten dagelijks 10 mg CRESTOR kregen, een cross-overfase die twee behandelingsperioden van 6 weken omvatte met ofwel CRESTOR 20 mg of placebo in willekeurige volgorde, gevolgd door een 12- week open-label fase waarin alle patiënten CRESTOR 20 mg kregen. De leeftijd van de patiënten varieerde van 7 tot 15 jaar (mediaan 11 jaar), 50% was man, 71% was blank, 21% was Aziatisch, 7% was zwart en er waren geen patiënten van Spaanse etniciteit. Vijftig procent onderging aferesetherapie en 57% slikte ezetimibe. Patiënten die deelnamen aan het onderzoek met aferesetherapie of ezetimibe zetten de behandeling gedurende het gehele onderzoek voort. De gemiddelde LDL-C bij baseline was 416 mg/dL (bereik 152 tot 716 mg/dL). In totaal voltooiden 13 patiënten beide behandelingsperioden van de gerandomiseerde cross-overfase; één patiënt trok de toestemming in vanwege het onvermogen om tijdens de cross-overfase bloed te laten afnemen.
CRESTOR 20 mg verminderde significant LDL-C, totaal cholesterol, ApoB en non-HDL-C vergeleken met placebo (Tabel 11).
Pediatrische patiënten met heterozygote familiaire hypercholesterolemie
In een dubbelblinde, gerandomiseerde, multicenter, placebogecontroleerde, 12 weken durende studie werden 176 (97 mannen en 79 vrouwen) kinderen en adolescenten met heterozygote familiaire hypercholesterolemie gerandomiseerd naar rosuvastatine 5, 10 of 20 mg of placebo per dag. De leeftijd van de patiënten varieerde van 10 tot 17 jaar (mediane leeftijd van 14 jaar) met ongeveer 30% van de patiënten van 10 tot 13 jaar en ongeveer 17%, 18%, 40% en 25% in Tanner-stadia II, III, IV, en V, respectievelijk. Vrouwtjes waren minstens 1 jaar postmenarche. De gemiddelde LDL-C bij baseline was 233 mg/dL (bereik van 129 tot 399). De 12 weken durende dubbelblinde fase werd gevolgd door een 40 weken durende open-label dosistitratiefase, waarbij alle patiënten (n=173) dagelijks 5 mg, 10 mg of 20 mg rosuvastatine kregen.
Rosuvastatine verlaagde de LDL-C (primaire eindpunt), het totale cholesterol en de ApoB-spiegels bij elke dosis significant in vergelijking met placebo. Resultaten worden getoond in Tabel 12 hieronder.
Aan het einde van de 12 weken durende, dubbelblinde behandelingsperiode was het percentage patiënten dat het LDL-C-doel van minder dan 110 mg/dl (2,8 mmol/l) bereikte 0% voor placebo, 12% voor rosuvastatine 5 mg , 41% voor rosuvastatine 10 mg en 41% voor rosuvastatine 20 mg. Voor de open-labelfase van 40 weken werd 71% van de patiënten getitreerd tot de maximale dosis van 20 mg en bereikte 41% van de patiënten het LDL-C-doel van 110 mg/dL.
Rosuvastatine werd ook onderzocht in een twee jaar durende open-label, ongecontroleerde, titratie-naar-doelstudie met 175 kinderen en adolescenten met heterozygote familiaire hypercholesterolemie van 8 tot 17 jaar oud (79 jongens en 96 meisjes). Alle patiënten hadden een gedocumenteerd genetisch defect in de LDL-receptor of in ApoB. Ongeveer 89% was blank, 7% was Aziatisch, 1% was zwart en minder dan 1% was Spaans. De gemiddelde LDL-C bij baseline was 236 mg/dL. Achtenvijftig (33%) patiënten waren prepuberaal bij aanvang. De startdosering van rosuvastatine voor alle kinderen en adolescenten was eenmaal daags 5 mg. Kinderen van 8 tot jonger dan 10 jaar (n=41 bij baseline) konden titreren tot een maximale dosering van 10 mg eenmaal daags, en kinderen en adolescenten van 10 tot 17 jaar konden titreren tot een maximale dosering van 20 mg eenmaal daags.
De verlagingen van LDL-C ten opzichte van baseline waren over het algemeen consistent in alle leeftijdsgroepen binnen de studie, evenals met eerdere ervaring in zowel volwassen als pediatrische gecontroleerde studies.
De werkzaamheid op lange termijn van een behandeling met rosuvastatine, gestart in de kindertijd om de morbiditeit en mortaliteit op volwassen leeftijd te verminderen, is niet vastgesteld.
Vertraging van de progressie van atherosclerose
In het onderzoek "Meinging Effects on Intima Media Thickness: an Evaluation Of Rosuvastatine 40 mg" (METEOR)-studie, werd het effect van therapie met CRESTOR op carotis-atherosclerose beoordeeld door middel van B-mode echografie bij patiënten met verhoogd LDL-C, met een laag risico (Framingham-risico).
Het veranderingspercentage op jaarbasis vanaf baseline voor de placebogroep was +0,0131 mm/jaar (p
Op individueel patiëntniveau in de met CRESTOR behandelde groep vertoonde 52,1% van de patiënten geen ziekteprogressie (gedefinieerd als een negatieve jaarlijkse veranderingssnelheid), vergeleken met 37,7% van de patiënten in de placebogroep.
Primaire preventie van hart- en vaatziekten
In de "Justification for the Use of Statines in Primary Prevention: An Intervention Trial Evaluating Rosuvastatine" (JUPITER) studie, werd het effect van CRESTOR (rosuvastatine calcium) op het optreden van ernstige cardiovasculaire (CV) ziektegebeurtenissen beoordeeld bij 17.802 mannen (≥50 jaar). ) en vrouwen (≥ 60 jaar) die geen klinisch evidente cardiovasculaire ziekte hadden, LDL-C-waarden
Het primaire eindpunt was een samengesteld eindpunt bestaande uit de tijd tot het eerste optreden van een van de volgende ernstige CV-gebeurtenissen: CV overlijden, niet-fataal myocardinfarct, niet-fatale beroerte, ziekenhuisopname voor instabiele angina of een arteriële revascularisatieprocedure.
Rosuvastatine verminderde significant het risico op ernstige CV-voorvallen (252 voorvallen in de placebogroep vs. 142 voorvallen in de rosuvastatinegroep) met een statistisch significante (p
Figuur 2: Tijd tot het eerste optreden van ernstige cardiovasculaire gebeurtenissen in JUPITER 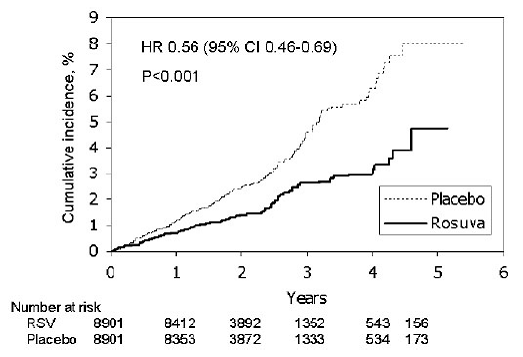
De afzonderlijke componenten van het primaire eindpunt worden weergegeven in figuur 3. Rosuvastatine verminderde significant het risico op niet-fataal myocardinfarct, niet-fatale beroerte en arteriële revascularisatieprocedures. Er waren geen significante behandelingsverschillen tussen de rosuvastatine- en placebogroep voor overlijden als gevolg van cardiovasculaire oorzaken of ziekenhuisopnames voor onstabiele angina.
Rosuvastatine verminderde significant het risico op een myocardinfarct (6 fatale voorvallen en 62 niet-fatale voorvallen bij met placebo behandelde proefpersonen versus 9 fatale voorvallen en 22 niet-fatale voorvallen bij met rosuvastatine behandelde proefpersonen) en het risico op beroerte (6 fatale voorvallen en 58 niet-fatale voorvallen bij met placebo behandelde proefpersonen vs. 3 fatale voorvallen en 30 niet-fatale voorvallen bij met rosuvastatine behandelde proefpersonen).
In een post-hoc subgroepanalyse van JUPITER-proefpersonen (n=1405; rosuvastatine=725, placebo=680) met een hsCRP 2 mg/l en geen andere traditionele risicofactoren (roken, BP ≥140/90 of het nemen van antihypertensiva, lage HDL-C) behalve leeftijd, na correctie voor hoge HDL-C, was er geen significant behandelingsvoordeel bij behandeling met rosuvastatine.
Afbeelding 3: Grote CV-gebeurtenissen per behandelgroep in JUPITER 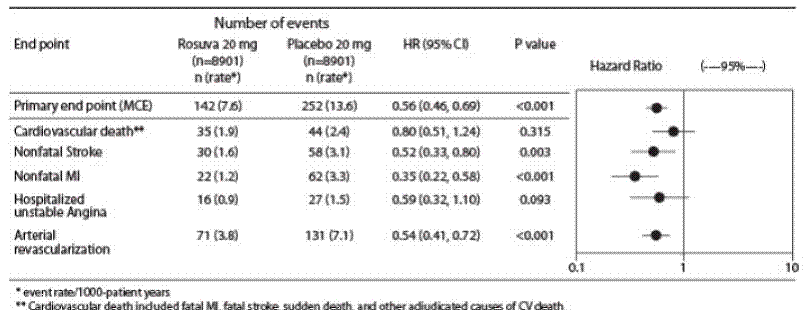
Na één jaar verhoogde rosuvastatine HDL-C en verlaagde het LDL-C, hsCRP, totaal cholesterol en serumtriglycerideniveaus (p
PATIËNT INFORMATIE
CRESTOR® (Kres-tor) rosuvastatine calcium tabletten
Lees deze patiënteninformatie zorgvuldig door voordat u begint met het innemen van CRESTOR 20 mg en elke keer dat u een nieuwe vulling krijgt. Als u vragen heeft over CRESTOR, neem dan contact op met uw arts. Alleen uw arts kan bepalen of CRESTOR geschikt voor u is.
Wat is CRESTOR?
CRESTOR 20 mg is een receptgeneesmiddel dat een cholesterolverlagend geneesmiddel bevat, rosuvastatinecalcium genaamd. Het grootste deel van het cholesterol in uw bloed wordt in de lever gemaakt. CRESTOR 20 mg werkt door cholesterol op twee manieren te verlagen: CRESTOR 5 mg blokkeert een enzym in de lever waardoor de lever minder cholesterol aanmaakt, en CRESTOR 20 mg verhoogt de opname en afbraak door de lever van cholesterol dat al in het bloed zit.
- CRESTOR wordt samen met een dieet gebruikt om:
- het niveau van uw "slechte" cholesterol (LDL) verlagen
- het niveau van uw "goede" cholesterol (HDL) verhogen
- het vetgehalte in uw bloed verlagen (triglyceriden)
- de opbouw van vetophopingen (plaque) in de wanden van bloedvaten vertragen
- CRESTOR wordt gebruikt voor de behandeling van:
- volwassenen die hun cholesterolgehalte niet onder controle kunnen krijgen door alleen een dieet en lichaamsbeweging
- kinderen van 8 tot 17 jaar met heterozygote familiaire hypercholesterolemie (een erfelijke aandoening die hoge LDL-waarden veroorzaakt)
- kinderen van 7 tot 17 jaar met homozygote familiaire hypercholesterolemie (een erfelijke aandoening die hoge LDL-waarden veroorzaakt).
CRESTOR 20 mg is niet goedgekeurd voor gebruik bij kinderen met heterozygote familiaire hypercholesterolemie jonger dan 8 jaar of voor gebruik bij kinderen met homozygote familiaire hypercholesterolemie jonger dan 7 jaar.
CRESTOR 5 mg wordt gebruikt om het risico op hartaanvallen en beroertes te verminderen bij mannen van 50 jaar en ouder en vrouwen van 60 jaar en ouder die geen bekende hartziekte hebben maar wel bepaalde aanvullende risicofactoren hebben.
Het is niet bekend of CRESTOR 10 mg veilig en effectief is bij mensen met dyslipidemieën van Fredrickson Type I en V.
Wie mag CRESTOR niet gebruiken?
Gebruik CRESTOR niet als u:
- als u allergisch bent voor rosuvastatinecalcium of voor één van de bestanddelen van CRESTOR. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in CRESTOR.
- leverproblemen hebben.
- zwanger bent of denkt zwanger te zijn, of van plan bent zwanger te worden. CRESTOR 20 mg kan uw ongeboren baby schaden. Als u zwanger wordt, stop dan met het gebruik van CRESTOR en bel onmiddellijk uw arts. Als u niet van plan bent zwanger te worden, moet u effectieve anticonceptie (anticonceptie) gebruiken terwijl u CRESTOR gebruikt.
- zijn borstvoeding. Geneesmiddelen zoals CRESTOR 5 mg kunnen in uw moedermelk terechtkomen en kunnen schadelijk zijn voor uw baby.
Wat moet ik mijn arts vertellen voor en tijdens het gebruik van CRESTOR?
Vertel het uw arts als u:
- onverklaarbare spierpijn of -zwakte heeft
- nierproblemen heeft of heeft gehad
- leverproblemen heeft of heeft gehad
- drink meer dan 2 glazen alcohol per dag
- schildklierproblemen hebben
- 65 jaar of ouder zijn
- zijn van Aziatische afkomst
- zwanger bent of denkt zwanger te zijn, of van plan bent zwanger te worden
- geven borstvoeding
Vertel uw arts over alle medicijnen die u gebruikt, inclusief recept- en vrij verkrijgbare medicijnen, vitamines en kruidensupplementen.
Praat met uw arts voordat u nieuwe geneesmiddelen gaat gebruiken.
Het gebruik van CRESTOR 20 mg met bepaalde andere geneesmiddelen kan elkaar beïnvloeden en bijwerkingen veroorzaken. CRESTOR kan de manier waarop andere geneesmiddelen werken beïnvloeden, en andere geneesmiddelen kunnen de werking van CRESTOR beïnvloeden.
Vertel het uw arts vooral als u:
- ciclosporine (een geneesmiddel voor uw immuunsysteem)
- gemfibrozil (een geneesmiddel met fibrinezuur voor het verlagen van cholesterol)
- antivirale geneesmiddelen, waaronder HIV- of hepatitis C-proteaseremmers (zoals lopinavir, ritonavir, fosamprenavir, tipranavir, atazanavir of simeprevir)
- bepaalde antischimmelmiddelen (zoals itraconazol, ketoconazol en fluconazol)
- cumarine-anticoagulantia (geneesmiddelen die bloedstolsels voorkomen, zoals warfarine)
- niacine of nicotinezuur
- fibrinezuurderivaten (zoals fenofibraat)
- colchicine (een geneesmiddel tegen jicht)
Vraag uw arts of apotheker om een lijst van deze geneesmiddelen als u het niet zeker weet.
Ken alle medicijnen die u gebruikt. Houd er een lijst van bij om uw arts en apotheker te laten zien wanneer u een nieuw geneesmiddel krijgt.
Hoe moet ik CRESTOR 10 mg innemen?
- Neem CRESTOR precies zoals uw arts u heeft verteld om het in te nemen.
- Neem CRESTOR, via de mond, 1 keer per dag in. Slik de tablet heel door.
- CRESTOR kan op elk moment van de dag worden ingenomen, met of zonder voedsel.
- Niet doen verander uw dosis of stop met CRESTOR 10 mg zonder met uw arts te overleggen, zelfs als u zich goed voelt.
- Uw arts kan voor en tijdens uw behandeling met CRESTOR bloedonderzoek doen om uw cholesterolgehalte te controleren. Uw arts kan uw dosis CRESTOR 10 mg indien nodig wijzigen.
- Uw arts kan u laten beginnen met een cholesterolverlagend dieet voordat u CRESTOR krijgt. Blijf op dit dieet als u CRESTOR gebruikt.
- Wacht ten minste 2 uur na inname van CRESTOR om een antacidum in te nemen dat een combinatie van aluminium en magnesiumhydroxide bevat.
- Als u een dosis CRESTOR 10 mg bent vergeten, neem deze dan in zodra u eraan denkt. Echter, neem geen 2 doses CRESTOR 10 mg binnen 12 uur na elkaar.
- Als u te veel CRESTOR 20 mg of een overdosis heeft ingenomen, neem dan onmiddellijk contact op met uw arts of ga naar de eerste hulpafdeling van het dichtstbijzijnde ziekenhuis.
Wat zijn de mogelijke bijwerkingen van CRESTOR 20 mg?
CRESTOR 10 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- Spierpijn, gevoeligheid en zwakte (myopathie). Spierproblemen, waaronder spierafbraak, kunnen bij sommige mensen ernstig zijn en zelden nierbeschadiging veroorzaken die tot de dood kan leiden. Vertel het uw arts meteen als:
- u heeft onverklaarbare spierpijn, gevoeligheid of zwakte, vooral als u koorts heeft of zich vermoeider voelt dan normaal, terwijl u CRESTOR gebruikt.
- spierproblemen heeft die niet verdwijnen, zelfs niet nadat uw arts u heeft gezegd te stoppen met het gebruik van CRESTOR. Uw arts kan verdere tests doen om de oorzaak van uw spierproblemen vast te stellen.
Uw kansen op het krijgen van spierproblemen zijn groter als u:
- bepaalde andere geneesmiddelen gebruikt terwijl u CRESTOR inneemt
- 65 jaar of ouder zijn
- schildklierproblemen (hypothyreoïdie) heeft die niet onder controle zijn
- nierproblemen hebben
- nemen hogere doses CRESTOR
- Lever problemen. Uw arts moet bloedonderzoek doen om uw lever te controleren voordat u begint met het gebruik van CRESTOR 5 mg en als u symptomen van leverproblemen heeft terwijl u CRESTOR gebruikt. Bel onmiddellijk uw arts als u een van de volgende symptomen van leverproblemen heeft:
- zich ongewoon moe of zwak voelen
- verlies van eetlust
- pijn in de bovenbuik
- donkere urine
- geel worden van uw huid of het wit van uw ogen
De meest voorkomende bijwerkingen kunnen zijn: hoofdpijn, spierpijn, buikpijn, zwakte en misselijkheid.
Bijkomende bijwerkingen die zijn gemeld met CRESTOR zijn geheugenverlies en verwardheid.
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van CRESTOR. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Hoe moet ik CRESTOR 20 mg bewaren?
- Bewaar CRESTOR 10 mg bij kamertemperatuur, tussen 20 ° C en 25 ° C en op een droge plaats.
- Gooi medicijnen die over de datum zijn of niet meer nodig zijn, veilig weg.
Bewaar CRESTOR 10 mg en alle geneesmiddelen buiten het bereik van kinderen.
Wat zijn de ingrediënten in CRESTOR?
Actief ingrediënt: rosuvastatine als rosuvastatine calcium
Inactieve ingredienten: microkristallijne cellulose NF, lactosemonohydraat NF, tribasisch calciumfosfaat NF, crospovidon NF, magnesiumstearaat NF, hypromellose NF, triacetine NF, titaniumdioxide USP, geel ijzeroxide en rood ijzeroxide NF.
Algemene informatie over het veilige en effectieve gebruik van CRESTOR
Geneesmiddelen worden soms voorgeschreven voor andere doeleinden dan vermeld in een patiëntenbijsluiter. Gebruik CRESTOR 10 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef CRESTOR 20 mg niet aan andere mensen, ook niet als ze dezelfde medische aandoening hebben als u. Het kan hen schaden.
U kunt uw apotheker of arts om informatie vragen over CRESTOR 5 mg die is geschreven voor gezondheidswerkers.
Deze patiëntinformatie is goedgekeurd door de Amerikaanse Food and Drug Administration. Herzien 9/2018
