Behandeling van cholesterol: Lipitor 10mg, 20mg, 40mg Atorvastatin Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Lipitor 40 mg en hoe wordt het gebruikt?
Lipitor 10 mg is een receptgeneesmiddel dat wordt gebruikt om de bloedspiegels van "slechte" cholesterol (low-density lipoproteïne, of LDL) te verlagen, om de niveaus van "goede" cholesterol (high-density lipoproteïne, of HDL) te verhogen, en om triglyceriden te verlagen en om de symptomen van een hoog cholesterolgehalte (hyperlipidemie) te behandelen en het risico op een beroerte, hartaanval of andere hartcomplicaties te verlagen. Lipitor 40 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Lipitor 10 mg behoort tot een klasse geneesmiddelen die lipidenverlagende middelen, statines en HMG-CoA-reductaseremmers worden genoemd.
Het is niet bekend of Lipitor 10 mg veilig en effectief is bij kinderen jonger dan 10 jaar.
Wat zijn de mogelijke bijwerkingen van Lipitor?
Lipitor 10 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- pijn of een branderig gevoel bij het plassen,
- pijn in de bovenbuik,
- zwakheid,
- zich moe voelen,
- verlies van eetlust,
- donkere urine,
- geel worden van de huid of ogen (geelzucht),
- weinig of niet plassen,
- zwelling in uw voeten of enkels, en
- kortademig
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Lipitor zijn:
- gewrichtspijn,
- verstopte neus,
- keelpijn,
- diarree, en
- pijn in uw armen of benen
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Lipitor. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
LIPITOR is een synthetisch lipidenverlagend middel. Atorvastatine is een remmer van 3-hydroxy-3-methylglutaryl-co-enzym A (HMG-CoA)-reductase. Dit enzym katalyseert de omzetting van HMG-CoA in mevalonaat, een vroege en snelheidsbeperkende stap in de biosynthese van cholesterol.
Atorvastatinecalcium is [R-(R*, R*)]-2-(4-fluorfenyl)-β, δ-dihydroxy-5-(1-methylethyl)-3-fenyl-4-[(fenylamino)carbonyl]- 1Hpyrrool-1-heptaanzuur, calciumzout (2:1)trihydraat. De empirische formule van atorvastatinecalcium is (C33H34FN2O5)2Ca•3H2O en het molecuulgewicht is 1209,42. De structuurformule is:
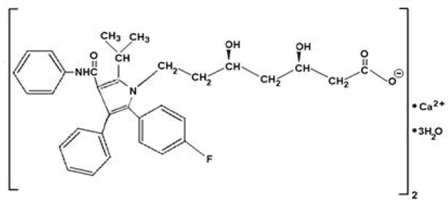
Atorvastatinecalcium is een wit tot gebroken wit kristallijn poeder dat onoplosbaar is in waterige oplossingen met een pH van 4 en lager. Atorvastatinecalcium is zeer slecht oplosbaar in gedestilleerd water, pH 7,4 fosfaatbuffer en acetonitril; enigszins oplosbaar in ethanol; en vrij oplosbaar in methanol.
LIPITOR-tabletten voor orale toediening bevatten 10, 20, 40 of 80 mg atorvastatine en de volgende inactieve ingrediënten: calciumcarbonaat, USP; candelillawas, FCC; croscarmellosenatrium, NF; hydroxypropylcellulose, NF; lactosemonohydraat, NF; magnesiumstearaat, NF; microkristallijne cellulose, NF; Opadry White YS-1-7040 (hypromellose, polyethyleenglycol, talk, titaniumdioxide); polysorbaat 80, NF; simethiconemulsie.
INDICATIES
Therapie met lipidenveranderende middelen zou slechts één onderdeel moeten zijn van interventie met meerdere risicofactoren bij personen met een significant verhoogd risico op atherosclerotische vaatziekte als gevolg van hypercholesterolemie. Medicamenteuze therapie wordt aanbevolen als aanvulling op een dieet wanneer de respons op een dieet met een beperkt gehalte aan verzadigd vet en cholesterol en andere niet-farmacologische maatregelen alleen onvoldoende is geweest. Bij patiënten met CHD of meerdere risicofactoren voor CHD kan LIPITOR 20 mg gelijktijdig met een dieet worden gestart.
Preventie van hart- en vaatziekten bij volwassenen
Bij volwassen patiënten zonder klinisch evidente coronaire hartziekte, maar met meerdere risicofactoren voor coronaire hartziekte zoals leeftijd, roken, hypertensie, lage HDL-C of een familiegeschiedenis van vroege coronaire hartziekte, is LIPITOR 10 mg geïndiceerd voor:
- Verminder het risico op een hartinfarct
- Verminder het risico op een beroerte
- Verminder het risico op revascularisatieprocedures en angina
Bij volwassen patiënten met type 2-diabetes en zonder klinisch evidente coronaire hartziekte, maar met meerdere risicofactoren voor coronaire hartziekte zoals retinopathie, albuminurie, roken of hypertensie, is LIPITOR geïndiceerd voor:
- Verminder het risico op een hartinfarct
- Verminder het risico op een beroerte
Bij volwassen patiënten met klinisch evidente coronaire hartziekte is LIPITOR 20 mg geïndiceerd voor:
- Verminder het risico op niet-fataal myocardinfarct
- Verminder het risico op fatale en niet-fatale beroerte
- Verminder het risico op revascularisatieprocedures
- Verminder het risico op ziekenhuisopname voor CHF
- Verminder het risico op angina
Hyperlipidemie
LIPITOR 20 mg is geïndiceerd:
- Als aanvulling op een dieet om verhoogde totaal-C-, LDL-C-, apo B- en TG-spiegels te verlagen en HDL-C te verhogen bij volwassen patiënten met primaire hypercholesterolemie (heterozygoot familiaal en niet-familiaal) en gemengde dyslipidemie (Fredrickson Types IIa en IIb) ;
- Als aanvulling op een dieet voor de behandeling van volwassen patiënten met verhoogde serum-TG-spiegels (Fredrickson Type IV);
- Voor de behandeling van volwassen patiënten met primaire dysbetalipoproteïnemie (Fredrickson Type III) die niet adequaat reageren op een dieet;
- Om totaal-C en LDL-C te verlagen bij patiënten met homozygote familiaire hypercholesterolemie (HoFH) als aanvulling op andere lipidenverlagende behandelingen (bijv. LDL-aferese) of als dergelijke behandelingen niet beschikbaar zijn;
- Als aanvulling op een dieet om de totale C-, LDL-C- en apo B-spiegels te verlagen bij pediatrische patiënten van 10 tot 17 jaar met heterozygote familiaire hypercholesterolemie (HeFH) als na een adequate proef met dieettherapie de volgende bevindingen zijn: Cadeau:
- er is een positieve familiegeschiedenis van vroegtijdige hart- en vaatziekten of
- twee of meer andere cardiovasculaire risicofactoren zijn aanwezig bij de pediatrische patiënt
Beperkingen van gebruik
LIPITOR 40 mg is niet onderzocht bij aandoeningen waarbij de belangrijkste lipoproteïne-afwijking een verhoging van chylomicronen is (Fredrickson Type I en V).
DOSERING EN ADMINISTRATIE
Hyperlipidemie en gemengde dyslipidemie
De aanbevolen startdosering van LIPITOR 10 mg is eenmaal daags 10 of 20 mg. Patiënten die een grote verlaging van LDL-C nodig hebben (meer dan 45%) kunnen worden gestart met 40 mg eenmaal daags. Het doseringsbereik van LIPITOR is 10 tot 80 mg eenmaal daags. LIPITOR 10 mg kan als een enkele dosis op elk moment van de dag worden toegediend, met of zonder voedsel. De startdosis en onderhoudsdoses van LIPITOR moeten individueel worden aangepast aan de kenmerken van de patiënt, zoals het doel van de therapie en de respons. Na het starten en/of na titratie van LIPITOR 10 mg, moeten de lipideniveaus binnen 2 tot 4 weken worden geanalyseerd en moet de dosering dienovereenkomstig worden aangepast.
Heterozygote familiaire hypercholesterolemie bij pediatrische patiënten (10 jaar tot 17 jaar oud)
De aanbevolen startdosering van LIPITOR 10 mg is 10 mg/dag; het gebruikelijke doseringsbereik is eenmaal daags 10 tot 20 mg oraal [zie Klinische studies ]. Doses moeten worden aangepast aan het aanbevolen doel van de therapie [zie: AANWIJZINGEN EN GEBRUIK en KLINISCHE FARMACOLOGIE ]. Aanpassingen moeten worden gemaakt met tussenpozen van 4 weken of meer.
Homozygote familiale hypercholesterolemie
De dosering van LIPITOR 20 mg bij patiënten met HoFH is 10 tot 80 mg per dag. LIPITOR 20 mg moet bij deze patiënten worden gebruikt als aanvulling op andere lipidenverlagende behandelingen (bijv. LDL-aferese) of als dergelijke behandelingen niet beschikbaar zijn.
Gelijktijdige lipidenverlagende therapie
LIPITOR 20 mg kan worden gebruikt met galzuurharsen. De combinatie van HMG-CoA-reductaseremmers (statines) en fibraten moet over het algemeen met voorzichtigheid worden gebruikt [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
Dosering bij patiënten met nierinsufficiëntie
Nierziekte heeft geen invloed op de plasmaconcentraties of LDL-C-verlaging van LIPITOR; daarom is dosisaanpassing bij patiënten met nierdisfunctie niet nodig [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Dosering bij patiënten die ciclosporine, claritromycine, itraconazol, letermovir of bepaalde proteaseremmers gebruiken
Bij patiënten die ciclosporine of de hiv-proteaseremmer tipranavir plus ritonavir of de hepatitis C-virus (HCV)-proteaseremmer glecaprevir plus pibrentasvir of letermovir gebruiken bij gelijktijdige toediening met ciclosporine, moet behandeling met LIPITOR 40 mg worden vermeden. Gebruik bij hiv-patiënten die lopinavir plus ritonavir gebruiken de laagst benodigde dosis LIPITOR. Bij patiënten die claritromycine, itraconazol, elbasvir plus grazoprevir of bij patiënten met HIV die een combinatie van saquinavir plus ritonavir, darunavir plus ritonavir, fosamprenavir, fosamprenavir plus ritonavir of letermovir gebruiken, moet de behandeling met LIPITOR worden beperkt tot 20 mg, en een passende klinische beoordeling is aanbevolen om ervoor te zorgen dat de laagst benodigde dosis LIPITOR 20 mg wordt gebruikt. Bij patiënten die de hiv-proteaseremmer nelfinavir gebruiken, moet de behandeling met LIPITOR 10 mg worden beperkt tot 40 mg [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en DRUG-INTERACTIES ].
HOE GELEVERD
Doseringsvormen en sterke punten
LIPITOR-tabletten zijn wit, elliptisch, filmomhuld en verkrijgbaar in vier sterktes (zie tabel 1).
Opslag en behandeling
10 mg tabletten (10 mg atorvastatine): gecodeerd “PD 155” aan de ene kant en “10” aan de andere.
NDC 0071-155-23 flessen van 90 NDC 0071-0155-40 10 x 10 eenheidsdosisblisterverpakkingen
20 mg tabletten (20 mg atorvastatine): gecodeerd met “PD 156” aan de ene kant en “20” aan de andere kant.
NDC 0071-0156-23 flessen van 90 NDC 0071-0156-40 10 x 10 eenheidsdosisblisterverpakkingen
40 mg tabletten (40 mg atorvastatine): gecodeerd met “PD 157” aan de ene kant en “40” aan de andere kant.
NDC 0071-157-23 flessen van 90 NDC 0071-157-40 10 x 10 eenheidsdosisblisterverpakkingen
80 mg tabletten (80 mg atorvastatine): gecodeerd met “PD 158” aan de ene kant en “80” aan de andere kant.
NDC 0071-0158-23 flessen van 90 NDC 0071-0158-73 flessen van 500 NDC 0071-0158-92 8 x 8 eenheidsdosisblisterverpakkingen
Opslag
Bewaren bij een gecontroleerde kamertemperatuur van 20 - 25 ° C (68 - 77 ° F) [zie USP].
Gedistribueerd door: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Herzien: aug. 2021
BIJWERKINGEN
De volgende ernstige bijwerkingen worden in meer detail besproken in andere rubrieken van het etiket:
- Myopathie en rabdomyolyse [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leverenzymafwijkingen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen deze mogelijk niet overeen met de percentages die in de praktijk worden waargenomen.
In de LIPITOR placebogecontroleerde klinische studiedatabase van 16.066 patiënten (8755 LIPITOR vs. 7311 placebo; leeftijdsbereik 10-93 jaar, 39% vrouwen, 91% blanken, 3% zwarten, 2% Aziaten, 4% overig) met een mediane behandelingsduur van 53 weken, 9,7% van de patiënten op LIPITOR 10 mg en 9,5% van de patiënten op placebo stopten vanwege bijwerkingen ongeacht de causaliteit. De vijf meest voorkomende bijwerkingen bij patiënten die werden behandeld met LIPITOR 20 mg die leidden tot stopzetting van de behandeling en die vaker voorkwamen dan bij placebo waren: myalgie (0,7%), diarree (0,5%), misselijkheid (0,4%), verhoging van alanineaminotransferase (0,4). %), en toename van leverenzymen (0,4%).
De meest gemelde bijwerkingen (incidentie ≥ 2% en meer dan placebo), ongeacht de causaliteit, bij patiënten die werden behandeld met LIPITOR in placebogecontroleerde onderzoeken (n=8755) waren: nasofaryngitis (8,3%), artralgie (6,9%), diarree ( 6,8%), pijn in extremiteit (6,0%) en urineweginfectie (5,7%).
Tabel 2 geeft een samenvatting van de frequentie van klinische bijwerkingen, ongeacht de causaliteit, gemeld bij ≥ 2% en met een snelheid groter dan placebo bij patiënten die werden behandeld met LIPITOR (n=8755), uit zeventien placebogecontroleerde onderzoeken.
Andere bijwerkingen die in placebogecontroleerde onderzoeken zijn gemeld, zijn onder meer:
Lichaam als geheel: malaise, koorts; Spijsverteringsstelsel: buikpijn, oprispingen, winderigheid, hepatitis, cholestase; Musculoskeletaal systeem: musculoskeletale pijn, spiervermoeidheid, nekpijn, gewrichtszwelling; Metabolisch en voedingssysteem: verhoging van transaminasen, abnormale leverfunctietest, verhoging van alkalische fosfatase in het bloed, verhoging van creatinefosfokinase, hyperglykemie; Zenuwstelsel: nachtmerrie; Ademhalingssysteem: epistaxis; Huid en aanhangsels: netelroos; Speciale zintuigen: wazig zien, oorsuizen; Urogenitaal systeem: witte bloedcellen urine positief.
Anglo-Scandinavische Cardiac Outcomes Trial (ASCOT)
In ASCOT [zie Klinische studies met 10.305 deelnemers (leeftijdscategorie 40-80 jaar, 19% vrouwen; 94,6% blanken, 2,6% Afrikanen, 1,5% Zuid-Aziaten, 1,3% gemengd/anders) behandeld met LIPITOR 10 mg per dag (n=5.168) of placebo (n = 5.137), was het veiligheids- en verdraagbaarheidsprofiel van de groep die werd behandeld met LIPITOR 10 mg vergelijkbaar met dat van de groep die werd behandeld met placebo gedurende een mediane follow-up van 3,3 jaar.
Collaborative Atorvastatine Diabetes Study (CARDS)
In KAARTEN [zie Klinische studies ] met 2.838 proefpersonen (leeftijdscategorie 39-77 jaar, 32% vrouwen; 94,3% blanken, 2,4% Zuid-Aziaten, 2,3% Afro-Caribisch, 1,0% overig) met type 2-diabetes behandeld met LIPITOR 10 mg per dag (n=1.428) of placebo (n=1.410), was er geen verschil in de totale frequentie van bijwerkingen of ernstige bijwerkingen tussen de behandelingsgroepen gedurende een mediane follow-up van 3,9 jaar. Er werden geen gevallen van rabdomyolyse gemeld.
Onderzoek naar nieuwe doelen (TNT)
In TNT [zie Klinische studies met 10.0001 proefpersonen (leeftijdscategorie 29-78 jaar, 19% vrouwen; 94,1% blanken, 2,9% zwarten, 1,0% Aziaten, 2,0% overig) met klinisch evidente CHD die werden behandeld met LIPITOR 10 mg per dag (n=5006) of LIPITOR 80 mg per dag (n=4995), waren er meer ernstige bijwerkingen en stopzettingen als gevolg van bijwerkingen in de hooggedoseerde atorvastatinegroep (respectievelijk 92, 1,8%; 497, 9,9%) dan in de laaggedoseerde groep (69 , 1,4%; respectievelijk 404, 8,1%) gedurende een mediane follow-up van 4,9 jaar. Aanhoudende transaminaseverhogingen (≥3 x ULN tweemaal binnen 4-10 dagen) kwamen voor bij 62 (1,3%) personen met atorvastatine 80 mg en bij negen (0,2%) personen met atorvastatine 10 mg. Verhogingen van CK (≥ 10 x ULN) waren over het algemeen laag, maar waren hoger in de hooggedoseerde atorvastatinegroep (13, 0,3%) dan in de laaggedoseerde atorvastatinegroep (6, 0,1%).
Incrementele afname van eindpunten door onderzoek naar agressieve lipidenverlaging (IDEAL)
In IDEAAL [zie Klinische studies met 8.888 proefpersonen (leeftijdscategorie 26-80 jaar, 19% vrouwen; 99,3% blanken, 0,4% Aziaten, 0,3% zwarten, 0,04% overig) behandeld met LIPITOR 80 mg/dag (n=4439) of simvastatine 20-40 mg dagelijks (n=4449), was er geen verschil in de totale frequentie van bijwerkingen of ernstige bijwerkingen tussen de behandelingsgroepen gedurende een mediane follow-up van 4,8 jaar.
Preventie van beroertes door agressieve verlaging van het cholesterolgehalte (SPARCL)
In SPARCL waarbij 4731 proefpersonen betrokken waren (leeftijdscategorie 21-92 jaar, 40% vrouwen; 93,3% blanken, 3,0% zwarten, 0,6% Aziaten, 3,1% overig) zonder klinisch duidelijke CHD maar met een beroerte of transient ischemic attack (TIA) binnen de vorige 6 maanden behandeld met LIPITOR 80 mg (n=2365) of placebo (n=2366) voor een mediane follow-up van 4,9 jaar, was er een hogere incidentie van aanhoudende levertransaminaseverhogingen (≥ 3 x ULN tweemaal binnen 4-10 dagen) in de atorvastatinegroep (0,9%) vergeleken met placebo (0,1%). Verhogingen van CK (>10 x ULN) waren zeldzaam, maar waren hoger in de atorvastatinegroep (0,1%) in vergelijking met placebo (0,0%). Diabetes werd gemeld als bijwerking bij 144 proefpersonen (6,1%) in de atorvastatinegroep en 89 proefpersonen (3,8%) in de placebogroep [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In een post-hoc analyse verminderde LIPITOR 80 mg de incidentie van ischemische beroerte (218/2365, 9,2% vs. 274/2366, 11,6%) en verhoogde de incidentie van hemorragische beroerte (55/2365, 2,3% vs. 33/ 2366, 1,4%) vergeleken met placebo. De incidentie van fatale hemorragische beroerte was vergelijkbaar tussen groepen (17 LIPITOR 40 mg versus 18 placebo). De incidentie van niet-fatale hemorragische beroertes was significant hoger in de atorvastatinegroep (38 niet-fatale hemorragische beroertes) in vergelijking met de placebogroep (16 niet-fatale hemorragische beroertes). Proefpersonen die deelnamen aan het onderzoek met een hemorragische beroerte leken een verhoogd risico te lopen op een hemorragische beroerte [7 (16%) LIPITOR vs. 2 (4%) placebo].
Er waren geen significante verschillen tussen de behandelingsgroepen voor mortaliteit door alle oorzaken: 216 (9,1%) in de LIPITOR 80 mg/dag-groep versus 211 (8,9%) in de placebogroep. Het aantal proefpersonen dat een cardiovasculaire dood doormaakte, was numeriek kleiner in de LIPITOR 80 mg-groep (3,3%) dan in de placebogroep (4,1%). De proporties van proefpersonen die niet-cardiovasculair overlijden ondervonden, waren numeriek groter in de LIPITOR 80 mg-groep (5,0%) dan in de placebogroep (4,0%).
Bijwerkingen van klinische onderzoeken met LIPITOR 20 mg bij pediatrische patiënten
In een 26 weken durende gecontroleerde studie bij jongens en postmenarchale meisjes met HeFH (leeftijd 10 tot 17 jaar) (n=140, 31% vrouw; 92% blanken, 1,6% zwarten, 1,6% Aziaten, 4,8% overig), en het verdraagbaarheidsprofiel van LIPITOR 10 tot 20 mg per dag, als aanvulling op een dieet om de totale cholesterol-, LDL-C- en apo B-spiegels te verlagen, was over het algemeen vergelijkbaar met dat van placebo [zie Gebruik in speciale populaties en Klinische studies ].
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van LIPITOR na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bijwerkingen geassocieerd met LIPITOR-therapie die sinds de introductie op de markt zijn gemeld en die hierboven niet zijn vermeld, ongeacht de beoordeling van de causaliteit, omvatten de volgende: anafylaxie, angioneurotisch oedeem, bulleuze huiduitslag (inclusief erythema multiforme, Stevens-Johnson-syndroom en toxische epidermale necrolyse), rabdomyolyse , myositis, vermoeidheid, peesruptuur, fataal en niet-fataal leverfalen, duizeligheid, depressie, perifere neuropathie, pancreatitis en interstitiële longziekte.
Er zijn zeldzame meldingen geweest van immuungemedieerde necrotiserende myopathie geassocieerd met statinegebruik [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Er zijn zeldzame postmarketingmeldingen geweest van cognitieve stoornissen (bijv. geheugenverlies, vergeetachtigheid, amnesie, geheugenstoornis, verwardheid) geassocieerd met statinegebruik. Deze cognitieve problemen zijn gemeld voor alle statines. De meldingen zijn over het algemeen niet-ernstig en reversibel na stopzetting van de statine, met variabele tijden tot het begin van de symptomen (1 dag tot jaren) en het verdwijnen van de symptomen (mediaan van 3 weken).
DRUG-INTERACTIES
Geneesmiddelinteracties die het risico op myopathie en rabdomyolyse met LIPITOR kunnen vergroten
LIPITOR is een substraat van CYP3A4 en transporters (bijv. OATP1B1/1B3, P-gp of BCRP). De plasmaspiegels van LIPITOR kunnen aanzienlijk worden verhoogd bij gelijktijdige toediening van CYP3A4-remmers en transporteiwitten. Tabel 3 bevat een lijst van geneesmiddelen die de blootstelling aan Lipitor kunnen verhogen en het risico op myopathie en rabdomyolyse kunnen verhogen bij gelijktijdig gebruik en instructies om deze te voorkomen of te behandelen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Geneesmiddelinteracties die de blootstelling aan LIPITOR kunnen verminderen
Tabel 4 geeft geneesmiddelinteracties weer die de blootstelling aan LIPITOR 20 mg kunnen verminderen en instructies om deze te voorkomen of te behandelen.
LIPITOR 20 mg effecten op andere geneesmiddelen
Tabel 5 geeft het effect van LIPITOR op andere geneesmiddelen en instructies om deze te voorkomen of te behandelen.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Myopathie en rabdomyolyse
LIPITOR 10 mg kan myopathie veroorzaken (spierpijn, gevoeligheid of zwakte met creatinekinase (CK) boven tien keer de bovengrens van normaal) en rabdomyolyse (met of zonder acuut nierfalen secundair aan myoglobinurie). Zeldzame sterfgevallen zijn opgetreden als gevolg van rabdomyolyse bij gebruik van statine, waaronder LIPITOR.
Risicofactoren voor myopathie
Risicofactoren voor myopathie zijn onder meer 65 jaar of ouder, ongecontroleerde hypothyreoïdie, nierfunctiestoornis, gelijktijdig gebruik met bepaalde andere geneesmiddelen en hogere LIPITOR-dosering (zie DRUG-INTERACTIES ].
Stappen om het risico op myopathie en rabdomyolyse te voorkomen of te verminderen
Blootstelling aan LIPITOR kan worden verhoogd door geneesmiddelinteracties als gevolg van remming van cytochroom P450-enzym 3A4 (CYP3A4) en/of transporteiwitten (bijv. borstkankerresistent eiwit [BCRP], organisch aniontransporterend polypeptide [OATP1B1/OATP1B3] en P-glycoproteïne [P -gp]), wat resulteert in een verhoogd risico op myopathie en rabdomyolyse. Gelijktijdig gebruik van ciclosporine, gemfibrozil, tipranavir plus ritonavir of glecaprevir plus pibrentasvir met LIPITOR wordt niet aanbevolen. Aanpassingen van de dosering van LIPITOR 40 mg worden aanbevolen voor patiënten die bepaalde antivirale, azool-antischimmelmiddelen of macrolide-antibiotica gebruiken [zie DOSERING EN ADMINISTRATIE ]. Er zijn gevallen van myopathie/rabdomyolyse gemeld met atorvastatine gelijktijdig toegediend met lipidenmodificerende doses (>1 gram/dag) van niacine, fibraten, colchicine en ledipasvir plus sofosbuvir. Overweeg of het voordeel van het gebruik van deze producten opweegt tegen het verhoogde risico op myopathie en rabdomyolyse [zie DRUG-INTERACTIES ].
Gelijktijdige inname van grote hoeveelheden, meer dan 1,2 liter per dag, grapefruitsap wordt niet aanbevolen bij patiënten die LIPITOR gebruiken (zie DRUG-INTERACTIES ].
Stop met LIPITOR als er duidelijk verhoogde CK-spiegels optreden of als myopathie wordt gediagnosticeerd of vermoed. Spiersymptomen en CK-verhogingen kunnen verdwijnen als LIPITOR wordt stopgezet. Stop tijdelijk met LIPITOR 40 mg bij patiënten met een acute of ernstige aandoening met een hoog risico op het ontwikkelen van nierfalen secundair aan rabdomyolyse (bijv. sepsis; shock; ernstige hypovolemie; grote operatie; trauma; ernstige metabole, endocriene of elektrolytstoornissen; of ongecontroleerde epilepsie) .
Informeer patiënten over het risico op myopathie en rabdomyolyse bij het starten of verhogen van de LIPITOR-dosering. Instrueer patiënten om onverklaarbare spierpijn, gevoeligheid of zwakte onmiddellijk te melden, vooral als deze gepaard gaat met malaise of koorts.
Immuun-gemedieerde necrotiserende myopathie
Er zijn zeldzame meldingen geweest van immuungemedieerde necrotiserende myopathie (IMNM), een auto-immuunmyopathie, geassocieerd met statinegebruik. IMNM wordt gekenmerkt door: proximale spierzwakte en verhoogd serumcreatinekinase, die aanhouden ondanks stopzetting van de statinebehandeling; positief anti-HMG CoA-reductase-antilichaam; spierbiopsie die necrotiserende myopathie toont; en verbetering met immunosuppressiva. Aanvullende neuromusculaire en serologische tests kunnen nodig zijn. Behandeling met immunosuppressiva kan nodig zijn. Overweeg zorgvuldig het risico op IMNM voordat u begint met een andere statine. Als de therapie wordt gestart met een andere statine, controleer dan op tekenen en symptomen van IMNM.
Lever disfunctie
Statines zijn, net als sommige andere lipidenverlagende therapieën, in verband gebracht met biochemische afwijkingen van de leverfunctie. Aanhoudende verhogingen (>3 maal de bovengrens van normaal [ULN] die bij 2 of meer gelegenheden optreden) van serumtransaminasen kwamen voor bij 0,7% van de patiënten die LIPITOR kregen in klinische onderzoeken. De incidentie van deze afwijkingen was 0,2%, 0,2%, 0,6% en 2,3% voor respectievelijk 10, 20, 40 en 80 mg.
Eén patiënt in klinische onderzoeken ontwikkelde geelzucht. Verhogingen van leverfunctietesten (LFT) bij andere patiënten waren niet geassocieerd met geelzucht of andere klinische tekenen of symptomen. Na verlaging van de dosis, onderbreking van het geneesmiddel of stopzetting van de behandeling keerden de transaminasespiegels terug naar of in de buurt van de waarden van voor de behandeling zonder gevolgen. Achttien van de 30 patiënten met aanhoudende LFT-verhogingen zetten de behandeling voort met een verlaagde dosis LIPITOR.
Het wordt aanbevolen om leverenzymtests uit te voeren voordat de behandeling met LIPITOR 40 mg wordt gestart en herhaald zoals klinisch geïndiceerd. Er zijn zeldzame postmarketingmeldingen geweest van fataal en niet-fataal leverfalen bij patiënten die statines gebruikten, waaronder atorvastatine. Als tijdens de behandeling met LIPITOR 10 mg ernstige leverbeschadiging met klinische symptomen en/of hyperbilirubinemie of geelzucht optreedt, moet de behandeling onmiddellijk worden onderbroken. Als er geen alternatieve etiologie wordt gevonden, start LIPITOR dan niet opnieuw.
LIPITOR 10 mg dient met voorzichtigheid te worden gebruikt bij patiënten die aanzienlijke hoeveelheden alcohol consumeren en/of een voorgeschiedenis hebben van leverziekte. Actieve leverziekte of onverklaarbare aanhoudende transaminaseverhogingen zijn contra-indicaties voor het gebruik van LIPITOR (zie CONTRA-INDICATIES ].
Endocriene functie
Verhogingen van HbA1c en nuchtere serumglucosespiegels zijn gemeld met HMG-CoA-reductaseremmers, waaronder LIPITOR.
Statines interfereren met de cholesterolsynthese en kunnen theoretisch de productie van bijnieren en/of gonadale steroïden afremmen. Klinische studies hebben aangetoond dat LIPITOR 20 mg de basale plasmacortisolconcentratie niet verlaagt of de bijnierreserve aantast. De effecten van statines op de mannelijke vruchtbaarheid zijn niet onderzocht bij voldoende aantallen patiënten. De eventuele effecten op de hypofyse-gonadale as bij premenopauzale vrouwen zijn niet bekend. Voorzichtigheid is geboden als een statine gelijktijdig wordt toegediend met geneesmiddelen die de spiegels of activiteit van endogene steroïde hormonen kunnen verlagen, zoals ketoconazol, spironolacton en cimetidine.
CNS-toxiciteit
Hersenbloeding werd gezien bij een vrouwelijke hond die gedurende 3 maanden werd behandeld met 120 mg/kg/dag. Hersenbloeding en vacuolatie van de oogzenuw werden gezien bij een andere vrouwelijke hond die in stervende toestand werd opgeofferd na 11 weken van toenemende doses tot 280 mg/kg/dag. De dosis van 120 mg/kg resulteerde in een systemische blootstelling van ongeveer 16 keer de oppervlakte-onder-de-curve van het menselijk plasma (AUC, 0-24 uur) gebaseerd op de maximale dosis voor de mens van 80 mg/dag. Een enkele tonische convulsie werd waargenomen bij elk van de 2 reuen (één behandeld met 10 mg/kg/dag en één met 120 mg/kg/dag) in een 2 jaar durende studie. Er zijn geen CZS-laesies waargenomen bij muizen na chronische behandeling tot 2 jaar bij doses tot 400 mg/kg/dag of bij ratten bij doses tot 100 mg/kg/dag. Deze doses waren 6 tot 11 keer (muis) en 8 tot 16 keer (rat) de humane AUC (0-24) gebaseerd op de maximaal aanbevolen humane dosis van 80 mg/dag.
CZS-vasculaire laesies, gekenmerkt door perivasculaire bloedingen, oedeem en mononucleaire celinfiltratie van perivasculaire ruimten, zijn waargenomen bij honden die werden behandeld met andere leden van deze klasse. Een chemisch vergelijkbaar geneesmiddel in deze klasse veroorzaakte degeneratie van de oogzenuw (Walleriaanse degeneratie van retinogene vezels) bij klinisch normale honden op een dosisafhankelijke manier in een dosis die plasmageneesmiddelspiegels produceerde die ongeveer 30 keer hoger waren dan het gemiddelde geneesmiddelniveau bij mensen die de hoogste aanbevolen dosis.
Gebruik bij patiënten met een recente beroerte of TIA
In een post-hoc analyse van de studie Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) waarin LIPITOR 80 mg vs. placebo werd toegediend aan 4.731 proefpersonen zonder CHD die in de voorafgaande 6 maanden een beroerte of TIA hadden gehad, was een hogere incidentie van hemorragische beroerte werd gezien in de LIPITOR 80 mg-groep vergeleken met placebo (55, 2,3% atorvastatine vs. 33, 1,4% placebo; HR: 1,68, 95% BI: 1,09, 2,59; p=0,0168). De incidentie van fatale hemorragische beroerte was vergelijkbaar in alle behandelingsgroepen (respectievelijk 17 vs. 18 voor de atorvastatine- en placebogroepen). De incidentie van niet-fatale hemorragische beroerte was significant hoger in de atorvastatinegroep (38, 1,6%) in vergelijking met de placebogroep (16, 0,7%).
Sommige baselinekenmerken, waaronder hemorragische en lacunaire beroerte bij aanvang van de studie, waren geassocieerd met een hogere incidentie van hemorragische beroerte in de atorvastatinegroep [zie ONGEWENSTE REACTIES ].
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Patiënten die LIPITOR 10 mg gebruiken, moeten erop worden gewezen dat cholesterol een chronische aandoening is en dat ze zich moeten houden aan hun medicatie samen met hun door het National Cholesterol Education Program (NCEP) aanbevolen dieet, een regelmatig trainingsprogramma waar nodig, en periodieke testen van een nuchter lipidenpanel om doelbereik bepalen.
Patiënten moeten worden geïnformeerd over stoffen die ze niet gelijktijdig met atorvastatine mogen gebruiken (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ). Patiënten moeten ook worden geadviseerd om andere beroepsbeoefenaren in de gezondheidszorg die een nieuw medicijn voorschrijven te informeren dat ze LIPITOR gebruiken.
Spierpijn
Alle patiënten die met LIPITOR beginnen, moeten worden geïnformeerd over het risico op myopathie en moeten worden verteld om onverklaarbare spierpijn, gevoeligheid of zwakte onmiddellijk te melden, vooral als deze gepaard gaat met malaise of koorts of als deze spiertekens of -symptomen aanhouden na het stoppen met LIPITOR. Het risico hierop is groter bij het nemen van bepaalde soorten medicijnen of het consumeren van grotere hoeveelheden (>1 liter) grapefruitsap. Ze moeten alle medicijnen, zowel op recept als zonder recept, bespreken met hun zorgverlener.
Lever enzymen
Het wordt aanbevolen om leverenzymtests uit te voeren voordat wordt gestart met LIPITOR 40 mg en als er tekenen of symptomen van leverbeschadiging optreden. Alle patiënten die met LIPITOR worden behandeld, moeten worden geadviseerd om onmiddellijk alle symptomen te melden die kunnen wijzen op leverbeschadiging, waaronder vermoeidheid, anorexia, ongemak in de rechter bovenbuik, donkere urine of geelzucht.
Embryofetale toxiciteit
Adviseer vrouwen met voortplantingsvermogen van het risico voor een foetus, om effectieve anticonceptie te gebruiken tijdens de behandeling en om hun zorgverlener op de hoogte te stellen van een bekende of vermoede zwangerschap [zie CONTRA-INDICATIES en Gebruik bij specifieke populaties ].
Borstvoeding
Adviseer vrouwen geen borstvoeding te geven tijdens de behandeling met LIPITOR [zie CONTRA-INDICATIES en Gebruik bij specifieke populaties ].
De etikettering van dit product is mogelijk bijgewerkt. Ga voor de meest recente voorschrijfinformatie naar www.pfizer.com.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
In een 2 jaar durende carcinogeniteitsstudie bij ratten met doseringen van 10, 30 en 100 mg/kg/dag werden 2 zeldzame tumoren gevonden in spieren bij hooggedoseerde vrouwtjes: in één was er een rabdomyosarcoom en in een andere, er was een fibrosarcoom. Deze dosis vertegenwoordigt een plasma-AUC (0-24)-waarde van ongeveer 16 keer de gemiddelde blootstelling aan geneesmiddel in menselijk plasma na een orale dosis van 80 mg.
Een 2 jaar durende carcinogeniteitsstudie bij muizen die 100, 200 of 400 mg/kg/dag kregen, resulteerde in een significante toename van leveradenomen bij hooggedoseerde mannetjes en levercarcinomen bij hooggedoseerde vrouwtjes. Deze bevindingen deden zich voor bij plasma-AUC-waarden (0-24) van ongeveer 6 keer de gemiddelde blootstelling aan geneesmiddel in menselijk plasma na een orale dosis van 80 mg.
In vitro was atorvastatine niet mutageen of clastogeen in de volgende tests met en zonder metabole activering: de Ames-test met Salmonella typhimurium en Escherichia coli, de HGPRT forward-mutatietest in longcellen van Chinese hamsters en de chromosomale aberratietest in longcellen van Chinese hamsters . Atorvastatine was negatief in de in vivo micronucleustest bij muizen.
Bij vrouwelijke ratten veroorzaakte atorvastatine in doses tot 225 mg/kg (56 maal de menselijke blootstelling) geen nadelige effecten op de vruchtbaarheid. Studies bij mannelijke ratten uitgevoerd met doses tot 175 mg/kg (15 maal de menselijke blootstelling) brachten geen veranderingen in de vruchtbaarheid teweeg. Er was aplasie en aspermie in de epididymis van 2 van de 10 ratten die gedurende 3 maanden werden behandeld met 100 mg/kg/dag atorvastatine (16 maal de humane AUC bij de dosis van 80 mg); het gewicht van de testis was significant lager bij 30 en 100 mg/kg en het epididymale gewicht was lager bij 100 mg/kg. Mannelijke ratten die gedurende 11 weken voorafgaand aan de paring 100 mg/kg/dag kregen, hadden een verminderde beweeglijkheid van het sperma, een verminderde spermatidenconcentratie en een toename van abnormaal sperma. Atorvastatine veroorzaakte geen nadelige effecten op de spermaparameters of de histopathologie van de voortplantingsorganen bij honden die gedurende twee jaar doses van 10, 40 of 120 mg/kg kregen.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
LIPITOR 10 mg is gecontra-indiceerd voor gebruik bij zwangere vrouwen, aangezien de veiligheid bij zwangere vrouwen niet is vastgesteld en er geen duidelijk voordeel is van lipidenverlagende geneesmiddelen tijdens de zwangerschap. Omdat HMG-CoA-reductaseremmers de cholesterolsynthese verminderen en mogelijk de synthese van andere biologisch actieve stoffen afgeleid van cholesterol, kan LIPITOR schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. LIPITOR 40 mg moet worden gestaakt zodra zwangerschap wordt herkend [zie CONTRA-INDICATIES ]. Beperkte gepubliceerde gegevens over het gebruik van atorvastatine zijn onvoldoende om een geneesmiddelgerelateerd risico op ernstige aangeboren misvormingen of miskraam vast te stellen. In reproductiestudies bij dieren bij ratten en konijnen waren er geen aanwijzingen voor embryo-foetale toxiciteit of aangeboren misvormingen bij doses tot respectievelijk 30 en 20 maal de menselijke blootstelling bij de maximaal aanbevolen dosis voor de mens (MRHD) van 80 mg, gebaseerd op oppervlakte (mg/m2). Bij ratten die atorvastatine kregen toegediend tijdens dracht en lactatie, werd een verminderde postnatale groei en ontwikkeling waargenomen bij doses ≥ 6 maal de MRHD (zie Gegevens ).
Het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2-4 % en 15-20 %.
Gegevens
Menselijke gegevens
Beperkte gepubliceerde gegevens over atorvastatinecalcium uit observationele onderzoeken, meta-analyses en casusrapporten hebben geen verhoogd risico op ernstige aangeboren afwijkingen of miskraam aangetoond. Zeldzame meldingen van aangeboren afwijkingen zijn ontvangen na intra-uteriene blootstelling aan andere HMGCoA-reductaseremmers. In een beoordeling van ongeveer 100 prospectief gevolgde zwangerschappen bij vrouwen die waren blootgesteld aan simvastatine of lovastatine, was de incidentie van aangeboren afwijkingen, spontane abortussen en foetale sterfte/doodgeboorte niet groter dan wat in de algemene bevolking zou worden verwacht. Het aantal gevallen is voldoende om een ≥3- tot 4-voudige toename van aangeboren afwijkingen ten opzichte van de achtergrondincidentie uit te sluiten. Bij 89% van de prospectief gevolgde zwangerschappen werd de medicamenteuze behandeling gestart voorafgaand aan de zwangerschap en werd deze stopgezet op een bepaald moment in het eerste trimester toen zwangerschap werd vastgesteld.
Dierlijke gegevens
Atorvastatine passeert de placenta van de rat en bereikt een niveau in de foetale lever dat gelijk is aan dat van maternaal plasma. Atorvastatine werd toegediend aan drachtige ratten en konijnen tijdens de organogenese in orale doses tot respectievelijk 300 mg/kg/dag en 100 mg/kg/dag. Atorvastatine was niet teratogeen bij ratten bij doses tot 300 mg/kg/dag of bij konijnen bij doses tot 100 mg/kg/dag. Deze doses resulteerden in veelvouden van ongeveer 30 keer (rat) of 20 keer (konijn) de menselijke blootstelling bij de MRHD op basis van oppervlakte (mg/m2). Bij ratten resulteerde de voor de moeder toxische dosis van 300 mg/kg in een verhoogd postimplantatieverlies en een verlaagd foetaal lichaamsgewicht. Bij de maternaal toxische doses van 50 en 100 mg/kg/dag bij konijnen was er meer postimplantatieverlies en bij 100 mg/kg/dag was het foetale lichaamsgewicht afgenomen.
In een onderzoek bij drachtige ratten waaraan 20, 100 of 225 mg/kg/dag werd toegediend vanaf dag 7 van de dracht tot dag 20 van de lactatie (spenen), was er een verminderde overleving bij de geboorte, postnatale dag 4, spenen en na het spenen bij pups van moeders die 225 mg/kg/dag kregen toegediend, een dosis waarbij maternale toxiciteit werd waargenomen. Het lichaamsgewicht van de pups nam af tot dag 21 na de geboorte bij 100 mg/kg/dag en tot dag 91 na de geboorte bij 225 mg/kg/dag. De ontwikkeling van de pup was vertraagd (rotarod prestatie bij 100 mg/kg/dag en akoestische schrik bij 225 mg/kg/dag; loslaten van de oorschelpen en opening van de ogen bij 225 mg/kg/dag). Deze doses komen overeen met 6 keer (100 mg/kg) en 22 keer (225 mg/kg) de menselijke blootstelling bij de MRHD, gebaseerd op AUC.
Borstvoeding
Risico Samenvatting
LIPITOR 40 mg gebruik is gecontra-indiceerd tijdens borstvoeding [zie CONTRA-INDICATIES ]. Er is geen informatie beschikbaar over de effecten van het geneesmiddel op de zuigeling die borstvoeding krijgt of de effecten van het geneesmiddel op de melkproductie. Het is niet bekend of atorvastatine aanwezig is in moedermelk, maar er is aangetoond dat een ander geneesmiddel in deze klasse overgaat in de moedermelk en dat atorvastatine aanwezig is in rattenmelk. Vanwege het potentieel voor ernstige bijwerkingen bij een zuigeling die borstvoeding krijgt, dient u vrouwen te adviseren dat borstvoeding niet wordt aanbevolen tijdens de behandeling met LIPITOR.
Vrouwtjes en mannetjes met reproductief potentieel
anticonceptie
LIPITOR kan schade aan de foetus veroorzaken wanneer het wordt toegediend aan een zwangere vrouw. Adviseer vrouwen met reproductief vermogen om effectieve anticonceptie te gebruiken tijdens de behandeling met LIPITOR (zie: Gebruik bij specifieke populaties ].
Pediatrisch gebruik
Heterozygote familiaire hypercholesterolemie (HeFH)
De veiligheid en werkzaamheid van LIPITOR 20 mg zijn vastgesteld bij pediatrische patiënten in de leeftijd van 10 tot 17 jaar, met HeFH als aanvulling op een dieet om de totale cholesterol-, LDL-C- en apo-B-spiegels te verlagen wanneer, na een adequaat dieetonderzoek therapie zijn de volgende aanwezig:
- LDL-C ≥ 190 mg/dL, of
- LDL-C ≥ 160 mg/dL en
- een positieve familiegeschiedenis van FH, of premature HVZ bij een eerste- of tweedegraads familielid, of
- twee of meer andere cardiovasculaire risicofactoren aanwezig zijn.
Het gebruik van LIPITOR 20 mg voor deze indicatie wordt ondersteund door bewijs van [zie DOSERING EN ADMINISTRATIE , ONGEWENSTE REACTIES , KLINISCHE FARMACOLOGIE , en Klinische studies ]:
- Een placebogecontroleerd klinisch onderzoek met een duur van 6 maanden bij 187 jongens en postmenarchale meisjes in de leeftijd van 10 tot 17 jaar. Patiënten die werden behandeld met 10 mg of 20 mg LIPITOR per dag hadden een bijwerkingenprofiel dat over het algemeen vergelijkbaar was met dat van patiënten die met placebo werden behandeld. In deze beperkte gecontroleerde studie was er geen significant effect op de groei of seksuele rijping bij jongens of op de lengte van de menstruatiecyclus bij meisjes.
- Een drie jaar durend open-label ongecontroleerd onderzoek met 163 pediatrische patiënten van 10 tot 15 jaar met HeFH die werden getitreerd om een doel-LDL-C
Adviseer postmenarchale meisjes over anticonceptie-aanbevelingen, indien van toepassing voor de patiënt [zie Gebruik bij specifieke populaties ].
De werkzaamheid op lange termijn van LIPITOR-therapie, gestart in de kindertijd om de morbiditeit en mortaliteit op volwassen leeftijd te verminderen, is niet vastgesteld.
De veiligheid en werkzaamheid van LIPITOR 10 mg zijn niet vastgesteld bij pediatrische patiënten jonger dan 10 jaar met HeFH.
Homozygote familiaire hypercholesterolemie (HoFH)
De klinische werkzaamheid van LIPITOR 20 mg met doseringen tot 80 mg/dag gedurende 1 jaar werd geëvalueerd in een ongecontroleerd onderzoek bij patiënten met HoFH, waaronder 8 pediatrische patiënten [zie Klinische studies ].
Geriatrisch gebruik
Van de 39.828 patiënten die LIPITOR 40 mg kregen in klinische onderzoeken, waren 15.813 (40%) ≥65 jaar oud en 2.800 (7%) ≥75 jaar oud. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere volwassenen kan niet worden uitgesloten. Aangezien hoge leeftijd (≥65 jaar) een predisponerende factor is voor myopathie, dient LIPITOR met voorzichtigheid te worden voorgeschreven aan ouderen.
Leverfunctiestoornis
Lipitor is gecontra-indiceerd bij patiënten met een actieve leverziekte, waaronder onverklaarbare aanhoudende verhogingen van levertransaminasespiegels [zie CONTRA-INDICATIES en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Er is geen specifieke behandeling voor overdosering met LIPITOR. In het geval van een overdosis moet de patiënt symptomatisch worden behandeld en zo nodig ondersteunende maatregelen worden genomen. Vanwege de uitgebreide geneesmiddelbinding aan plasma-eiwitten wordt niet verwacht dat hemodialyse de klaring van LIPITOR 20 mg significant zal verbeteren.
CONTRA-INDICATIES
- Actieve leverziekte, die mogelijk onverklaarbare aanhoudende verhogingen van levertransaminasespiegels kan omvatten
- Overgevoeligheid voor een van de bestanddelen van dit medicijn
- Zwangerschap [zie Gebruik bij specifieke populaties].
- Borstvoeding [zie Gebruik bij specifieke populaties].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
LIPITOR 20 mg is een selectieve, competitieve remmer van HMG-CoA-reductase, het snelheidsbeperkende enzym dat 3-hydroxy-3-methylglutaryl-co-enzym A omzet in mevalonaat, een voorloper van sterolen, waaronder cholesterol. In diermodellen verlaagt LIPITOR 40 mg plasmacholesterol- en lipoproteïneniveaus door remming van HMG-CoA-reductase en cholesterolsynthese in de lever en door verhoging van het aantal lever-LDL-receptoren op het celoppervlak om opname en katabolisme van LDL te verbeteren; LIPITOR vermindert ook de LDL-productie en het aantal LDL-deeltjes.
farmacodynamiek
LIPITOR, evenals enkele van zijn metabolieten, zijn farmacologisch actief bij mensen. De lever is de primaire plaats van actie en de belangrijkste plaats van cholesterolsynthese en LDL-klaring. Geneesmiddeldosering, in plaats van systemische geneesmiddelconcentratie, correleert beter met LDL-C-verlaging. Individualisering van de medicijndosering moet gebaseerd zijn op de therapeutische respons [zie: DOSERING EN ADMINISTRATIE ].
Farmacokinetiek
Absorptie
LIPITOR wordt snel geabsorbeerd na orale toediening; maximale plasmaconcentraties treden op binnen 1 tot 2 uur. De mate van absorptie neemt evenredig toe met de dosis LIPITOR. De absolute biologische beschikbaarheid van atorvastatine (moedergeneesmiddel) is ongeveer 14% en de systemische beschikbaarheid van HMG-CoA-reductaseremmende activiteit is ongeveer 30%. De lage systemische beschikbaarheid wordt toegeschreven aan presystemische klaring in gastro-intestinale mucosa en/of first-pass metabolisme in de lever. Hoewel voedsel de snelheid en mate van geneesmiddelabsorptie verlaagt met respectievelijk ongeveer 25% en 9%, zoals beoordeeld aan de hand van Cmax en AUC, is de LDL-C-verlaging vergelijkbaar, ongeacht of LIPITOR 40 mg met of zonder voedsel wordt gegeven. De plasmaconcentraties van LIPITOR 20 mg zijn lager (ongeveer 30% voor Cmax en AUC) na toediening 's avonds van het geneesmiddel in vergelijking met 's ochtends. De LDL-C-verlaging is echter hetzelfde, ongeacht het tijdstip van de toediening van het geneesmiddel [zie: DOSERING EN ADMINISTRATIE ].
Verdeling
Het gemiddelde distributievolume van LIPITOR 20 mg is ongeveer 381 liter. LIPITOR 20 mg is voor ≥98% gebonden aan plasma-eiwitten. Een bloed/plasma-verhouding van ongeveer 0,25 duidt op een slechte penetratie van het geneesmiddel in de rode bloedcellen. Op basis van waarnemingen bij ratten wordt LIPITOR 10 mg waarschijnlijk uitgescheiden in de moedermelk [zie CONTRA-INDICATIES en Gebruik bij specifieke populaties ].
Metabolisme
LIPITOR 20 mg wordt uitgebreid gemetaboliseerd tot ortho- en parahydroxyderivaten en verschillende bèta-oxidatieproducten. In vitro remming van HMG-CoA-reductase door ortho- en geparahydroxyleerde metabolieten is gelijk aan die van LIPITOR. Ongeveer 70% van de circulerende remmende activiteit voor HMG-CoA-reductase wordt toegeschreven aan actieve metabolieten. In vitro-onderzoeken wijzen op het belang van metabolisme van LIPITOR 40 mg door cytochroom P450 3A4, consistent met verhoogde plasmaconcentraties van 20 mg LIPITOR bij mensen na gelijktijdige toediening met erytromycine, een bekende remmer van dit isozym [zie DRUG-INTERACTIES ]. Bij dieren ondergaat de ortho-hydroxymetaboliet verdere glucuronidering.
uitscheiding
LIPITOR 20 mg en zijn metabolieten worden voornamelijk geëlimineerd in de gal na hepatisch en/of extrahepatisch metabolisme; het medicijn lijkt echter geen enterohepatische recirculatie te ondergaan. De gemiddelde plasma-eliminatiehalfwaardetijd van LIPITOR bij mensen is ongeveer 14 uur, maar de halfwaardetijd van remmende activiteit voor HMG-CoA-reductase is 20 tot 30 uur vanwege de bijdrage van actieve metabolieten. Na orale toediening wordt minder dan 2% van een dosis LIPITOR in de urine teruggevonden.
Specifieke populaties
geriatrische
De plasmaconcentraties van LIPITOR zijn hoger (ongeveer 40% voor Cmax en 30% voor AUC) bij gezonde oudere proefpersonen (leeftijd ≥65 jaar) dan bij jonge volwassenen. Klinische gegevens wijzen op een grotere mate van LDL-verlaging bij elke dosis geneesmiddel bij oudere patiënten in vergelijking met jongere volwassenen [zie Gebruik bij specifieke populaties ].
pediatrisch
De schijnbare orale klaring van atorvastatine bij pediatrische proefpersonen leek vergelijkbaar met die van volwassenen wanneer allometrisch geschaald naar lichaamsgewicht, aangezien het lichaamsgewicht de enige significante covariabele was in het farmacokinetische populatiemodel van atorvastatine met gegevens waaronder pediatrische HeFH-patiënten (leeftijd 10 tot 17 jaar, n=29) in een open-label onderzoek van 8 weken.
Geslacht
Plasmaconcentraties van LIPITOR 40 mg bij vrouwen verschillen van die bij mannen (ongeveer 20% hoger voor Cmax en 10% lager voor AUC); er is echter geen klinisch significant verschil in LDL-C-verlaging met LIPITOR 10 mg tussen mannen en vrouwen.
Nierfunctiestoornis
Nierziekte heeft geen invloed op de plasmaconcentraties of LDL-C-verlaging van LIPITOR; dus dosisaanpassing bij patiënten met nierdisfunctie is niet nodig [zie: DOSERING EN ADMINISTRATIE en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Hemodialyse
Hoewel er geen onderzoeken zijn uitgevoerd bij patiënten met nierziekte in het eindstadium, wordt niet verwacht dat hemodialyse de klaring van LIPITOR 10 mg significant zal verbeteren, aangezien het geneesmiddel in hoge mate aan plasma-eiwitten wordt gebonden.
Leverfunctiestoornis
Bij patiënten met chronische alcoholische leverziekte zijn de plasmaconcentraties van LIPITOR aanzienlijk verhoogd. Cmax en AUC zijn elk 4 keer groter bij patiënten met de ziekte van Childs-Pugh A. Cmax en AUC zijn respectievelijk ongeveer 16-voudig en 11-voudig verhoogd bij patiënten met de ziekte van Childs-Pugh B (zie CONTRA-INDICATIES ].
Geneesmiddelinteractiestudies
Atorvastatine is een substraat van de hepatische transporters, OATP1B1 en OATP1B3 transporters. Metabolieten van atorvastatine zijn substraten van OATP1B1. Atorvastatine is ook geïdentificeerd als een substraat van de effluxtransporter BCRP, die de intestinale absorptie en biliaire klaring van atorvastatine kan beperken.
TABEL 6: Effect van gelijktijdig toegediende geneesmiddelen op de farmacokinetiek van atorvastatine
TABEL 7: Effect van atorvastatine op de farmacokinetiek van gelijktijdig toegediende geneesmiddelen
LIPITOR had geen klinisch significant effect op de protrombinetijd bij toediening aan patiënten die chronische warfarinebehandeling kregen.
Klinische studies
Preventie van hart- en vaatziekten
In de Anglo-Scandinavische Cardiac Outcomes Trial (ASCOT) werd het effect van LIPITOR 10 mg op fatale en niet-fatale coronaire hartziekte beoordeeld bij 10.305 hypertensieve patiënten van 40-80 jaar (gemiddeld 63 jaar), zonder een eerder myocardinfarct. infarct en met TC-waarden ≤251 mg/dL (6,5 mmol/L). Bovendien hadden alle patiënten ten minste 3 van de volgende cardiovasculaire risicofactoren: mannelijk geslacht (81,1%), leeftijd >55 jaar (84,5%), roken (33,2%), diabetes (24,3%), voorgeschiedenis van CHD in een eerste- graad relatief (26%), TC:HDL >6 (14,3%), perifere vaatziekte (5,1%), linkerventrikelhypertrofie (14,4%), eerder cerebrovasculair voorval (9,8%), specifieke ECG-afwijking (14,3%), proteïnurie /albuminurie (62,4%). In deze dubbelblinde, placebogecontroleerde studie werden patiënten behandeld met antihypertensieve therapie (Doel BP
Het effect van 10 mg/dag LIPITOR op de lipidenspiegels was vergelijkbaar met dat in eerdere klinische onderzoeken.
LIPITOR verminderde significant het aantal coronaire voorvallen [ofwel fatale coronaire hartziekte (46 voorvallen in de placebogroep vs. 40 voorvallen in de LIPITOR 40 mg-groep) of niet-fataal MI (108 voorvallen in de placebogroep vs. 60 voorvallen in de LIPITOR 20 mg groep)] met een relatieve risicoreductie van 36% [(gebaseerd op incidenties van 1,9% voor LIPITOR 40 mg vs. 3,0% voor placebo), p=0,0005 (zie figuur 1)]. De risicoreductie was consistent, ongeacht leeftijd, rookstatus, obesitas of aanwezigheid van nierdisfunctie. Het effect van LIPITOR werd gezien ongeacht de baseline LDL-waarden. Vanwege het kleine aantal evenementen waren de resultaten voor vrouwen niet overtuigend.
Figuur 1: Effect van LIPITOR 10 mg/dag op cumulatieve incidentie van niet-fataal myocardinfarct of overlijden door coronaire hartziekte (in ASCOT-LLA)
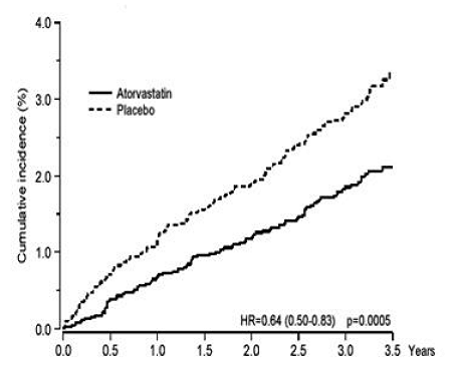
LIPITOR 40 mg verminderde ook significant het relatieve risico op revascularisatieprocedures met 42% (incidentie van 1,4% voor LIPITOR 20 mg en 2,5% voor placebo). Hoewel de afname van fatale en niet-fatale beroertes geen vooraf bepaald significantieniveau bereikte (p=0,01), werd een gunstige trend waargenomen met een relatieve risicoreductie van 26% (incidentie van 1,7% voor LIPITOR en 2,3% voor placebo) . Er was geen significant verschil tussen de behandelingsgroepen voor overlijden door cardiovasculaire oorzaken (p=0,51) of niet-cardiovasculaire oorzaken (p=0,17).
In de Collaborative Atorvastatine Diabetes Study (CARDS) werd het effect van LIPITOR op de eindpunten van hart- en vaatziekten (CVD) beoordeeld bij 2838 proefpersonen (94% blank, 68% man) in de leeftijd van 40-75 jaar met type 2-diabetes op basis van WHO-criteria, zonder voorgeschiedenis van hart- en vaatziekten en met LDL ≤ 160 mg/dL en TG ≤ 600 mg/dL. Naast diabetes hadden proefpersonen 1 of meer van de volgende risicofactoren: actueel roken (23%), hypertensie (80%), retinopathie (30%) of microalbuminurie (9%) of macroalbuminurie (3%). Er waren geen proefpersonen die hemodialyse ondergingen in het onderzoek. In dit multicenter, placebogecontroleerde, dubbelblinde klinische onderzoek werden proefpersonen willekeurig toegewezen aan LIPITOR 10 mg per dag (1429) of placebo (1411) in een verhouding van 1:1 en werden ze gevolgd voor een mediane duur van 3,9 jaar. Het primaire eindpunt was het optreden van een van de belangrijkste cardiovasculaire voorvallen: myocardinfarct, acuut overlijden door CHZ, onstabiele angina, coronaire revascularisatie of beroerte. De primaire analyse was de tijd tot het eerste optreden van het primaire eindpunt.
Basiskenmerken van proefpersonen waren: gemiddelde leeftijd van 62 jaar, gemiddelde HbA 7,7%; mediaan LDL-C 120 mg/dL; mediane TC 207 mg/dL; mediane TG 151 mg/dL; mediaan HDL-C 52 mg/dL.
Het effect van LIPITOR 10 mg/dag op de lipidenspiegels was vergelijkbaar met het effect dat werd gezien in eerdere klinische onderzoeken.
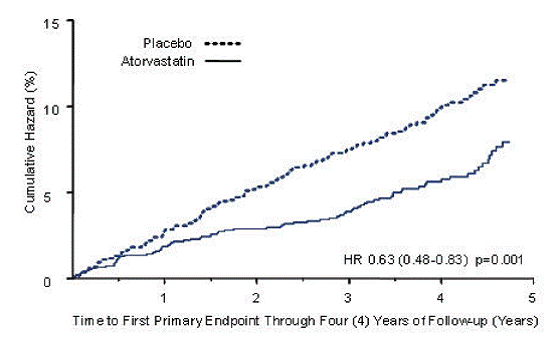
LIPITOR verminderde significant het aantal ernstige cardiovasculaire voorvallen (primaire eindpuntgebeurtenissen) (83 voorvallen in de LIPITOR-groep vs. 127 voorvallen in de placebogroep) met een relatieve risicoreductie van 37%, HR 0,63, 95% BI (0,48; 0,83) (p=0,001) (zie figuur 2). Een effect van LIPITOR werd gezien ongeacht leeftijd, geslacht of baseline lipideniveaus.
LIPITOR 20 mg verminderde het risico op beroerte significant met 48% (21 voorvallen in de LIPITOR 10 mg-groep vs. 39 voorvallen in de placebogroep), HR 0,52, 95% BI (0,31; 0,89) (p=0,016) en verminderde het risico op MI met 42% (38 voorvallen in de LIPITOR-groep vs. 64 voorvallen in de placebogroep), HR 0,58, 95,1% BI (0,39; 0,86) (p=0,007). Er was geen significant verschil tussen de behandelingsgroepen voor angina, revascularisatieprocedures en acute CHD-sterfte.
Er waren 61 sterfgevallen in de LIPITOR-groep versus 82 sterfgevallen in de placebogroep (HR 0,73, p=0,059).
Figuur 2: Effect van LIPITOR 10 mg/dag op de tijd tot het optreden van een ernstig cardiovasculair voorval (myocardinfarct, acute CHD-sterfte, onstabiele angina, coronaire revascularisatie of beroerte) bij CARDS
In de Treating to New Targets Study (TNT) werd het effect van LIPITOR 80 mg/dag vs. LIPITOR 10 mg/dag op de vermindering van cardiovasculaire voorvallen beoordeeld bij 10.001 proefpersonen (94% blank, 81% man, 38% ≥65 jaar) met klinisch evidente coronaire hartziekte die een LDL-C-doelwaarde van
Behandeling met LIPITOR 80 mg/dag verminderde significant de frequentie van MCVE (434 voorvallen in de 80 mg/dag-groep vs. 548 voorvallen in de 10 mg/dag-groep) met een relatieve risicoreductie van 22%, HR 0,78, 95% BI (0,69, 0,89), p=0,0002 (zie figuur 3 en tabel 9). De algehele risicoreductie was consistent, ongeacht leeftijd (
Figuur 3: Effect van LIPITOR 80 mg/dag vs. 10 mg/dag op tijd tot optreden van ernstige cardiovasculaire gebeurtenissen (TNT)
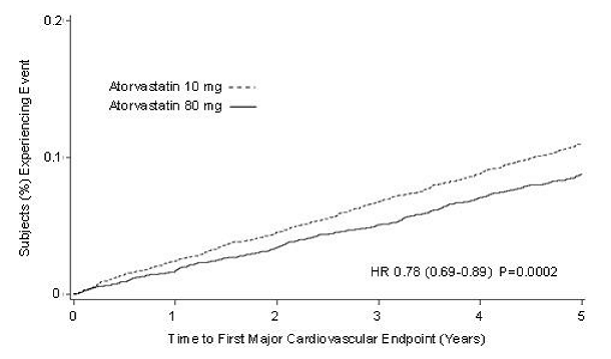
TABEL 8: Overzicht van werkzaamheidsresultaten in TNT
Van de voorvallen die het primaire werkzaamheidseindpunt vormden, verminderde behandeling met LIPITOR 80 mg/dag significant het aantal niet-fatale, niet-proceduregerelateerde MI en fatale en niet-fatale beroerte, maar niet overlijden door CHD of gereanimeerde hartstilstand (Tabel 8). Van de vooraf gedefinieerde secundaire eindpunten verminderde behandeling met LIPITOR 80 mg/dag significant de snelheid van coronaire revascularisatie, angina en ziekenhuisopname voor hartfalen, maar niet voor perifere vaatziekte. De verlaging van het aantal CHF met ziekenhuisopname werd alleen waargenomen bij 8% van de patiënten met een voorgeschiedenis van CHF.
Er was geen significant verschil tussen de behandelingsgroepen voor mortaliteit door alle oorzaken (Tabel 8). De proporties proefpersonen die cardiovasculaire sterfte doormaakten, inclusief de componenten van CHD-dood en fatale beroerte, waren numeriek kleiner in de LIPITOR 80 mg-groep dan in de LIPITOR 10 mg-behandelingsgroep. De proporties van proefpersonen die niet-cardiovasculaire dood ervoeren, waren numeriek groter in de LIPITOR 80 mg-groep dan in de LIPITOR 10 mg-behandelingsgroep.
In de Incremental Daling in Endpoints Through Aggressive Lipid Lowering Study (IDEAL) werd behandeling met LIPITOR 80 mg/dag vergeleken met behandeling met simvastatine 20-40 mg/dag bij 8.888 proefpersonen tot 80 jaar met een voorgeschiedenis van CHD tot beoordelen of vermindering van CV risico kan worden bereikt. De patiënten waren voornamelijk mannen (81%), blank (99%) met een gemiddelde leeftijd van 61,7 jaar en een gemiddelde LDL-C van 121,5 mg/dL bij randomisatie; 76% onderging statinetherapie. In dit prospectieve, gerandomiseerde, open-label, geblindeerde eindpuntonderzoek (PROBE) zonder aanloopperiode werden proefpersonen gevolgd voor een mediane duur van 4,8 jaar. De gemiddelde LDL-C-, TC-, TG-, HDL- en niet-HDL-cholesterolwaarden in week 12 waren 78, 145, 115, 45 en 100 mg/dL tijdens behandeling met 80 mg LIPITOR 40 mg en 105, 179, 142, 47 en 132 mg/dL tijdens behandeling met 20-40 mg simvastatine.
Er was geen significant verschil tussen de behandelingsgroepen voor het primaire eindpunt, de frequentie van het eerste ernstige coronaire voorval (fataal CHD, niet-fataal MI en gereanimeerde hartstilstand): 411 (9,3%) in de LIPITOR 80 mg/dag-groep vs. 463 (10,4%) in de simvastatine 20-40 mg/dag-groep, HR 0,89, 95% BI (0,78; 1,01), p=0,07.
Er waren geen significante verschillen tussen de behandelingsgroepen voor mortaliteit door alle oorzaken: 366 (8,2%) in de LIPITOR 80 mg/dag-groep vs. 374 (8,4%) in de simvastatine 20-40 mg/dag-groep. De proporties proefpersonen die overlijden door CV of niet-CV ervoeren waren vergelijkbaar voor de LIPITOR 80 mg-groep en de simvastatine 20-40 mg-groep.
Hyperlipidemie en gemengde dyslipidemie
LIPITOR verlaagt totaal-C, LDL-C, VLDL-C, apo B en TG, en verhoogt HDL-C bij patiënten met hyperlipidemie (heterozygote familiale en niet-familiale) en gemengde dyslipidemie (Fredrickson Types IIa en IIb). Therapeutische respons wordt binnen 2 weken waargenomen en maximale respons wordt gewoonlijk binnen 4 weken bereikt en gehandhaafd tijdens chronische therapie.
LIPITOR is effectief bij een grote verscheidenheid aan patiëntenpopulaties met hyperlipidemie, met en zonder hypertriglyceridemie, bij mannen en vrouwen, en bij ouderen.
In twee multicenter, placebogecontroleerde, dosis-responsstudies bij patiënten met hyperlipidemie, verminderde LIPITOR, gegeven als een enkele dosis gedurende 6 weken, het totaal-C, LDL-C, apo B en TG significant. (Gepoolde resultaten worden gegeven in Tabel 9.)
TABEL 9: Dosisrespons bij patiënten met primaire hyperlipidemie (aangepast gemiddeld % verandering ten opzichte van baseline)*
Bij patiënten met Fredrickson type IIa en IIb hyperlipoproteïnemie, gepoold uit 24 gecontroleerde onderzoeken, waren de mediane (25e en 75e  percentiel) procentuele veranderingen ten opzichte van baseline in HDL-C voor LIPITOR 10, 20, 40 en 80 mg 6,4 (-1,4, 14), 8,7 (0, 17), 7,8 (0, 16) en 5,1 (-2,7, 15), respectievelijk. Bovendien toonde analyse van de gepoolde gegevens consistente en significante dalingen in totaal-C, LDL-C, TG, totaal-C/HDL-C en LDLC/HDL-C aan.
In drie multicenter, dubbelblinde onderzoeken bij patiënten met hyperlipidemie werd LIPITOR vergeleken met andere statines. Na randomisatie werden patiënten gedurende 16 weken behandeld met LIPITOR 10 mg per dag of een vaste dosis van het vergelijkende middel (Tabel 10).
TABEL 10: Gemiddelde procentuele verandering vanaf baseline op eindpunt (dubbelblinde, gerandomiseerde, actief-gecontroleerde onderzoeken)
De impact op de klinische resultaten van de verschillen in lipidenveranderende effecten tussen behandelingen weergegeven in Tabel 10 is niet bekend. Tabel 10 bevat geen gegevens waarin de effecten van LIPITOR 10 mg en hogere doses lovastatine, pravastatine en simvastatine worden vergeleken. De geneesmiddelen die in de in de tabel samengevatte onderzoeken worden vergeleken, zijn niet noodzakelijk onderling uitwisselbaar.
Hypertriglyceridemie
De respons op LIPITOR bij 64 patiënten met geïsoleerde hypertriglyceridemie (Fredrickson Type IV) die in verschillende klinische onderzoeken werden behandeld, wordt weergegeven in de onderstaande tabel (Tabel 11). Voor de met LIPITOR behandelde patiënten was de mediane (min, max) baseline TG-spiegel 565 (267-1502).
TABEL 11: Gecombineerde patiënten met geïsoleerde verhoogde TG: mediane (min, max) procentuele verandering ten opzichte van baseline
Dysbetalipoproteïnemie
De resultaten van een open-label cross-over studie van 16 patiënten (genotypes: 14 apo E2/E2 en 2 apo E3/E2) met dysbetalipoproteïnemie (Fredrickson Type III) worden weergegeven in de onderstaande tabel (Tabel 12).
TABEL 12: Open-label crossover-onderzoek van 16 patiënten met dysbetalipoproteïnemie (Fredrickson Type III)
Homozygote familiale hypercholesterolemie
In een onderzoek zonder een gelijktijdige controlegroep kregen 29 patiënten van 6 tot 37 jaar met HoFH maximale dagelijkse doses van 20 tot 80 mg LIPITOR. De gemiddelde LDL-C-verlaging in deze studie was 18%. Vijfentwintig patiënten met een verlaging van LDL-C hadden een gemiddelde respons van 20% (bereik van 7% tot 53%, mediaan van 24%); de overige 4 patiënten hadden een stijging van 7% tot 24% in LDL-C. Vijf van de 29 patiënten hadden geen LDL-receptorfunctie. Hiervan hadden 2 patiënten ook een portacaval shunt en hadden ze geen significante verlaging van LDL-C. De overige 3 receptor-negatieve patiënten hadden een gemiddelde LDL-C-verlaging van 22%.
Heterozygote familiaire hypercholesterolemie bij pediatrische patiënten
In een dubbelblinde, placebogecontroleerde studie gevolgd door een open-label fase, werden 187 jongens en postmenarchale meisjes van 10 tot 17 jaar (gemiddelde leeftijd 14,1 jaar) met heterozygote familiaire hypercholesterolemie (HeFH) of ernstige hypercholesterolemie gerandomiseerd naar LIPITOR (n=140) of placebo (n=47) gedurende 26 weken en daarna kregen ze allemaal LIPITOR 40 mg gedurende 26 weken. Opname in het onderzoek vereiste 1) een baseline LDL-C-niveau ≥ 190 mg/dL of 2) een baseline LDL-C-niveau ≥ 160 mg/dL en een positieve familiegeschiedenis van FH of gedocumenteerde premature cardiovasculaire ziekte in een eerste of tweede graad familielid. De gemiddelde baseline LDL-C-waarde was 218,6 mg/dL (bereik: 138,5-385,0 mg/dL) in de LIPITOR-groep vergeleken met 230,0 mg/dL (bereik: 160,0-324,5 mg/dL) in de placebogroep . De dosering van LIPITOR (eenmaal daags) was 10 mg gedurende de eerste 4 weken en werd verhoogd tot 20 mg als de LDL-C-spiegel > 130 mg/dL was. Het aantal met LIPITOR behandelde patiënten dat na week 4 tijdens de dubbelblinde fase optitratie tot 20 mg nodig had, was 78 (55,7%).
LIPITOR 10 mg verlaagde significant de plasmaspiegels van totaal-C, LDL-C, triglyceriden en apolipoproteïne B tijdens de 26 weken durende dubbelblinde fase (zie tabel 13).
TABEL 13: Lipidenveranderende effecten van LIPITOR bij adolescente jongens en meisjes met heterozygote familiaire hypercholesterolemie of ernstige hypercholesterolemie (gemiddelde procentuele verandering vanaf baseline bij eindpunt in intention-to-treat-populatie)
De gemiddelde bereikte LDL-C-waarde was 130,7 mg/dL (bereik: 70,0–242,0 mg/dL) in de LIPITOR 10 mg-groep vergeleken met 228,5 mg/dL (bereik: 152,0–385,0 mg/dL) in de placebogroep. groep tijdens de 26 weken durende dubbelblinde fase.
Atorvastatine werd ook onderzocht in een drie jaar durend open-label, ongecontroleerd onderzoek met 163 patiënten met HeFH in de leeftijd van 10 tot 15 jaar (82 jongens en 81 meisjes). Alle patiënten hadden een klinische diagnose van HeFH, bevestigd door genetische analyse (indien niet reeds bevestigd door familiegeschiedenis). Ongeveer 98% was blank en minder dan 1% was zwart of Aziatisch. De gemiddelde LDL-C bij baseline was 232 mg/dL. De startdosering van atorvastatine was 10 mg eenmaal daags en de doses werden aangepast om een streefwaarde van
De werkzaamheid op lange termijn van behandeling met LIPITOR 20 mg bij kinderen om de morbiditeit en mortaliteit op volwassen leeftijd te verminderen, is niet vastgesteld.
PATIËNT INFORMATIE
LIPITOR® atorvastatine calciumtabletten (LIP-ih-tore))
Lees de patiënteninformatie die bij LIPITOR 20 mg wordt geleverd voordat u begint met het innemen ervan en elke keer dat u een nieuwe vulling krijgt. Mogelijk is er nieuwe informatie. Deze bijsluiter vervangt niet het praten met uw arts over uw aandoening of behandeling.
Als u vragen heeft over LIPITOR, neem dan contact op met uw arts of apotheker.
Wat is LIPITOR?
LIPITOR is een receptgeneesmiddel dat het cholesterol in uw bloed verlaagt. Het verlaagt het LDL-C (“slechte” cholesterol) en triglyceriden in uw bloed. Het kan ook uw HDL-C ("goede" cholesterol) verhogen. LIPITOR is bedoeld voor volwassenen en kinderen ouder dan 10 jaar bij wie het cholesterolgehalte niet voldoende wordt verlaagd door lichaamsbeweging en een vetarm dieet alleen.
LIPITOR kan het risico op een hartaanval, beroerte, bepaalde soorten hartchirurgie en pijn op de borst verlagen bij patiënten met een hartaandoening of risicofactoren voor hartaandoeningen, zoals:
- leeftijd, roken, hoge bloeddruk, laag HDL-C, hartziekte in de familie.
LIPITOR 20 mg kan het risico op een hartaanval of beroerte verlagen bij patiënten met diabetes en risicofactoren zoals:
- oogproblemen, nierproblemen, roken of hoge bloeddruk.
LIPITOR 40 mg begint na ongeveer 2 weken te werken.
Wat is cholesterol?
Cholesterol en triglyceriden zijn vetten die in je lichaam worden gemaakt. Ze zijn ook te vinden in voedingsmiddelen. Je hebt wat cholesterol nodig voor een goede gezondheid, maar te veel is niet goed voor je. Cholesterol en triglyceriden kunnen uw bloedvaten verstoppen. Het is vooral belangrijk om uw cholesterol te verlagen als u een hartaandoening heeft, rookt, diabetes of hoge bloeddruk heeft, ouder bent of als een hartaandoening vroeg in uw familie begint.
Wie mag LIPITOR 40 mg niet gebruiken?
Gebruik LIPITOR 10 mg niet als u:
- zwanger bent of denkt zwanger te zijn, of van plan bent zwanger te worden. LIPITOR kan uw ongeboren baby schaden. Als u zwanger wordt, stop dan met het innemen van LIPITOR 40 mg en bel onmiddellijk uw arts.
- zijn borstvoeding. LIPITOR 20 mg kan in uw moedermelk terechtkomen en kan schadelijk zijn voor uw baby.
- leverproblemen hebben.
- zijn allergisch voor LIPITOR of een van de ingrediënten. Het werkzame bestanddeel is atorvastatine. Zie het einde van deze bijsluiter voor een volledige lijst van ingrediënten in LIPITOR.
De dosering van LIPITOR 20 mg is niet vastgesteld bij kinderen jonger dan 10 jaar.
Voordat u begint LIPITOR
Vertel het uw arts als u:
- spierpijn of zwakte hebben
- drink meer dan 2 glazen alcohol per dag
- diabetes hebben
- een schildklierprobleem hebben
- nierproblemen hebben
Sommige geneesmiddelen mogen niet met LIPITOR worden ingenomen. Vertel uw arts over alle geneesmiddelen die u gebruikt, inclusief geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. LIPITOR en bepaalde andere geneesmiddelen kunnen op elkaar inwerken en ernstige bijwerkingen veroorzaken. Vertel het uw arts vooral als u geneesmiddelen gebruikt voor:
- je immuunsysteem
- cholesterol
- infecties
- anticonceptie
- hartfalen
- HIV of AIDS
- hepatitis C-virus
- antivirale middelen
Ken alle medicijnen die u gebruikt. Houd er een lijst van bij om uw arts en apotheker te laten zien.
Hoe moet ik LIPITOR 40 mg gebruiken?
- Neem LIPITOR 20 mg precies zoals uw arts heeft voorgeschreven. Verander uw dosis niet en stop niet met LIPITOR zonder met uw arts te overleggen. Uw arts kan tijdens uw behandeling met LIPITOR bloedonderzoek doen om uw cholesterolgehalte te controleren. Uw dosis LIPITOR kan worden gewijzigd op basis van deze bloedtestresultaten.
- Neem LIPITOR elke dag op elk moment van de dag en elke dag op ongeveer hetzelfde tijdstip. LIPITOR 10 mg kan met of zonder voedsel worden ingenomen. Breek LIPITOR-tabletten niet voordat u ze inneemt.
- Uw arts moet u laten beginnen met een vetarm dieet voordat u LIPITOR geeft. Blijf op dit vetarme dieet als u LIPITOR gebruikt.
- Als u een dosis LIPITOR bent vergeten, neem deze dan in zodra u eraan denkt. Gebruik LIPITOR 10 mg niet als het meer dan 12 uur geleden is dat u uw laatste dosis heeft overgeslagen. Wacht en neem de volgende dosis op uw normale tijd. Neem niet tegelijkertijd 2 doses LIPITOR 10 mg in.
- Als u te veel LIPITOR of een overdosis heeft ingenomen, neem dan onmiddellijk contact op met uw arts of het Antigifcentrum. Of ga naar de dichtstbijzijnde spoedeisende hulp.
Wat moet ik vermijden tijdens het gebruik van LIPITOR 10 mg?
- Praat met uw arts voordat u met nieuwe geneesmiddelen begint. Dit omvat geneesmiddelen op recept en zonder recept, vitamines en kruidensupplementen. LIPITOR en bepaalde andere geneesmiddelen kunnen op elkaar inwerken en ernstige bijwerkingen veroorzaken.
- Raak niet zwanger. Als u zwanger wordt, stop dan onmiddellijk met het gebruik van LIPITOR en bel uw arts.
Wat zijn de mogelijke bijwerkingen van LIPITOR 10 mg?
LIPITOR kan ernstige bijwerkingen veroorzaken. Deze bijwerkingen zijn slechts bij een klein aantal mensen voorgekomen. Uw arts kan u hierop controleren. Deze bijwerkingen verdwijnen meestal als uw dosis wordt verlaagd of als LIPITOR wordt stopgezet. Deze ernstige bijwerkingen zijn onder meer:
- Spier problemen. LIPITOR 40 mg kan ernstige spierproblemen veroorzaken die kunnen leiden tot nierproblemen, waaronder nierfalen. U heeft een grotere kans op spierproblemen als u bepaalde andere geneesmiddelen gebruikt met LIPITOR.
- Lever problemen. Uw arts moet bloedonderzoek doen om uw lever te controleren voordat u LIPITOR 20 mg gaat gebruiken en als u symptomen van leverproblemen heeft terwijl u LIPITOR gebruikt. Bel onmiddellijk uw arts als u de volgende symptomen van leverproblemen heeft:
- moe of zwak voelen
- verlies van eetlust
- pijn in de bovenbuik
- donker amberkleurige urine
- geel worden van uw huid of het wit van uw ogen
Bel onmiddellijk uw arts als u:
- spierproblemen zoals zwakte, gevoeligheid of pijn die optreden zonder een goede reden, vooral als u ook koorts heeft of zich vermoeider voelt dan normaal. Dit kan een vroeg teken zijn van een zeldzaam spierprobleem.
- spierproblemen die niet verdwijnen, zelfs niet nadat uw arts u heeft geadviseerd om te stoppen met het gebruik van LIPITOR. Uw arts kan verdere tests doen om de oorzaak van uw spierproblemen vast te stellen.
- allergische reacties, waaronder zwelling van het gezicht, de lippen, de tong en/of de keel die ademhalings- of slikproblemen kan veroorzaken en die onmiddellijke behandeling nodig kan hebben.
- misselijkheid en overgeven.
- bruine of donkergekleurde urine hebben.
- je voelt je vermoeider dan normaal
- uw huid en het oogwit worden geel.
- buikpijn.
- allergische huidreacties.
In klinische onderzoeken meldden patiënten de volgende vaak voorkomende bijwerkingen tijdens het gebruik van LIPITOR: diarree, maagklachten, spier- en gewrichtspijn en veranderingen in sommige laboratoriumbloedonderzoeken.
De volgende aanvullende bijwerkingen zijn gemeld met LIPITOR:
vermoeidheid, peesproblemen, geheugenverlies en verwardheid.
Neem contact op met uw arts of apotheker als u bijwerkingen heeft waar u last van heeft of die niet weggaan.
Dit zijn niet alle bijwerkingen van LIPITOR. Vraag uw arts of apotheker om een volledige lijst.
Hoe bewaar ik LIPITOR
- Bewaar LIPITOR bij kamertemperatuur, 68 tot 77 ° F (20 tot 25 ° C).
- Bewaar geen medicijnen die over datum zijn of die u niet meer nodig heeft.
- Houd LIPITOR en alle geneesmiddelen buiten het bereik van kinderen. Zorg ervoor dat als u medicijnen weggooit, dit buiten het bereik van kinderen is.
Algemene informatie over LIPITOR
Soms worden medicijnen voorgeschreven voor aandoeningen die niet in de patiëntenbijsluiter staan. Gebruik LIPITOR 10 mg niet voor een aandoening waarvoor het niet is voorgeschreven. Geef LIPITOR niet aan andere mensen, ook niet als ze hetzelfde probleem hebben als jij. Het kan hen schaden.
Deze folder vat de belangrijkste informatie over LIPITOR samen. Als u meer informatie wilt, neem dan contact op met uw arts. U kunt uw arts of apotheker om informatie vragen over LIPITOR die is geschreven voor gezondheidswerkers. Of u kunt naar de LIPITOR-website gaan op www.lipitor.com.
Wat zijn de ingrediënten in LIPITOR?
Actief ingrediënt: atorvastatine calcium
Inactieve ingredienten: calciumcarbonaat, USP; candelillawas, FCC; croscarmellosenatrium, NF; hydroxypropylcellulose, NF; lactosemonohydraat, NF; magnesiumstearaat, NF; microkristallijne cellulose, NF; Opadry White YS-1-7040 (hypromellose, polyethyleenglycol, talk, titaniumdioxide); polysorbaat 80, NF; simethiconemulsie.
