Elocon 5g Mometasone Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Elocon 5g en hoe wordt het gebruikt?
Elocon (mometasonfuroaat) Crème, 0, 1% is een lokale crème, lotion of zalf met corticosteroïden die is geïndiceerd voor de verlichting van de inflammatoire en jeukende manifestaties van op corticosteroïden reagerende dermatosen bij patiënten van 2 jaar of ouder.
Wat zijn bijwerkingen van Elocon 5g?
Vaak voorkomende bijwerkingen van Elocon zijn:
- huiduitslag,
- jeuk,
- brandend,
- roodheid,
- droogte,
- dunner of zachter worden van uw huid,
- huiduitslag of irritatie rond uw mond,
- gezwollen haarzakjes,
- spataderen,
- gevoelloosheid of tintelingen,
- veranderingen in de kleur van de behandelde huid,
- blaren,
- puistjes,
- korstvorming van de behandelde huid, of
- striae.
OMSCHRIJVING
ELOCON (mometasonfuroaat) Crème, 0, 1% bevat mometasonfuroaat voor lokaal gebruik. Mometasonfuroaat is een synthetisch corticosteroïd met ontstekingsremmende werking.
Chemisch gezien is mometasonfuroaat 9α,21-dichloor-11β,17-dihydroxy-16α-methylpregna-1,4-dieen3,20-dion 17-(2-furoaat), met de empirische formule C27 H30CI2O6, een molecuulgewicht van 521,4 en de volgende structuurformule:
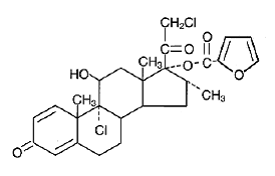
Mometasonfuroaat is een wit tot gebroken wit poeder dat praktisch onoplosbaar is in water, slecht oplosbaar in octanol en matig oplosbaar in ethylalcohol.
Elke gram ELOCON 5 g crème, 0,1% bevat 1 mg mometasonfuroaat in een witte tot gebroken witte crèmebasis van aluminiumzetmeeloctenylsuccinaat (gammabestraald), hexyleenglycol, gehydrogeneerde sojalecithine, fosforzuur, gezuiverd water, titaniumdioxide, wit zacht paraffine en witte was.
INDICATIES
ELOCON® Cream is een corticosteroïde die is geïndiceerd voor de verlichting van de inflammatoire en jeukende manifestaties van op corticosteroïden reagerende dermatosen bij patiënten van 2 jaar of ouder.
DOSERING EN ADMINISTRATIE
Breng eenmaal daags een dun laagje ELOCON Cream aan op de aangetaste huidzones. ELOCON Cream kan worden gebruikt bij pediatrische patiënten van 2 jaar of ouder. Aangezien de veiligheid en werkzaamheid van ELOCON Cream niet zijn vastgesteld bij pediatrische patiënten jonger dan 2 jaar; gebruik in deze leeftijdsgroep wordt niet aanbevolen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik in specifieke populaties ].
De therapie dient te worden gestaakt wanneer controle is bereikt. Als er binnen 2 weken geen verbetering wordt waargenomen, kan een herbeoordeling van de diagnose nodig zijn. De veiligheid en werkzaamheid van ELOCON Cream bij pediatrische patiënten gedurende meer dan 3 weken gebruik zijn niet vastgesteld.
ELOCON Cream mag niet worden gebruikt met occlusieve verbanden, tenzij voorgeschreven door een arts. ELOCON 5g Crème mag niet in het luiergebied worden aangebracht als het kind nog luiers of een plastic broekje nodig heeft, aangezien deze kledingstukken occlusief verband kunnen vormen.
ELOCON Cream is alleen voor uitwendig gebruik. Het is niet voor oraal, oogheelkundig of intravaginaal gebruik.
Vermijd gebruik op het gezicht, de lies of de oksels.
HOE GELEVERD
Doseringsvormen en sterke punten
Crème, 0,1%. Elke gram ELOCON Cream bevat 1 mg mometasonfuroaat in een witte tot gebroken witte gladde en homogene crèmebasis.
Opslag en behandeling
ELOCON Crème is wit tot gebroken wit van kleur en wordt geleverd in 15 gram ( NDC 0085-3149-01) en 50 gram ( NDC 0085-3149-03) buizen.
Bewaren bij 25°C (77°F); excursies toegestaan tot 15-30°C (59-86°F) [zie USP-gecontroleerde kamertemperatuur ]. Vermijd overmatige hitte.
Gefabriceerd voor: Merck Sharp & Dohme Corp., een dochteronderneming van Merck & Co., Inc., Whitehouse Station, NJ 08889, VS. Gefabriceerd door: Schering-Plough Labo NV Heist-op-den-Berg, België. Herzien: april 2013
BIJWERKINGEN
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
In gecontroleerde klinische onderzoeken met 319 proefpersonen was de incidentie van bijwerkingen geassocieerd met het gebruik van ELOCON 5g Cream 1,6%. Gerapporteerde reacties omvatten verbranding, jeuk en huidatrofie. Er zijn ook meldingen ontvangen van rosacea in verband met het gebruik van ELOCON 5g Cream. In gecontroleerde klinische onderzoeken (n = 74) met pediatrische proefpersonen van 2 tot 12 jaar oud, was de incidentie van bijwerkingen geassocieerd met het gebruik van ELOCON 5g Cream ongeveer 7%. Gerapporteerde reacties omvatten steken, pruritus en furunculose.
Van de volgende bijwerkingen werd gemeld dat ze mogelijk of waarschijnlijk verband hielden met de behandeling met ELOCON 5g Cream tijdens klinische onderzoeken bij 4% van de 182 pediatrische proefpersonen van 6 maanden tot 2 jaar: verlaagde glucocorticoïde spiegels, 2; paresthesie, 2; folliculitis, 1; moniliasis, 1; bacteriële infectie, 1; huiddepigmentatie, 1. De volgende tekenen van huidatrofie werden ook waargenomen bij 97 proefpersonen die in een klinisch onderzoek met ELOCON Cream werden behandeld: glans, 4; teleangiëctasie, 1; verlies van elasticiteit, 4; verlies van normale markeringen op de huid, 4; dunheid, 1; en blauwe plekken, 1.
De volgende aanvullende lokale bijwerkingen zijn gemeld met lokale corticosteroïden, maar kunnen vaker voorkomen bij het gebruik van occlusieve verbanden. Deze reacties zijn: irritatie, droogheid, folliculitis, hypertrichose, acne-achtige uitbarstingen, hypopigmentatie, periorale dermatitis, allergische contactdermatitis, secundaire infectie, striae en miliaria.
DRUG-INTERACTIES
Er zijn geen geneesmiddelinteractiestudies uitgevoerd met ELOCON Cream.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Effecten op het endocriene systeem
Systemische absorptie van lokale corticosteroïden kan reversibele onderdrukking van de hypothalamus-hypofyse-bijnier (HPA)-as veroorzaken met kans op glucocorticosteroïde-insufficiëntie. Dit kan optreden tijdens de behandeling of na het staken van de behandeling. Manifestaties van het syndroom van Cushing, hyperglykemie en glucosurie kunnen bij sommige patiënten ook worden veroorzaakt door systemische absorptie van lokale corticosteroïden tijdens de behandeling. Factoren die een patiënt die een topisch corticosteroïd gebruikt vatbaar maken voor onderdrukking van de HPA-as, zijn onder meer het gebruik van krachtige steroïden, grote behandeloppervlakken, langdurig gebruik, gebruik van occlusieve verbanden, veranderde huidbarrière, leverfalen en jonge leeftijd.
Vanwege de mogelijkheid van systemische absorptie kan het voor het gebruik van lokale corticosteroïden nodig zijn dat patiënten periodiek worden beoordeeld op HPA-asonderdrukking. Dit kan worden gedaan met behulp van de adrenocorticotroop hormoon (ACTH) stimulatietest.
In een onderzoek waarin de effecten van mometasonfuroaatcrème op de HPA-as werden geëvalueerd, werd gedurende 7 dagen tweemaal daags 15 gram toegediend aan zes volwassen proefpersonen met psoriasis of atopische dermatitis. De resultaten laten zien dat het medicijn een lichte verlaging van de secretie van bijniercorticosteroïden veroorzaakte.
Als HPA-asonderdrukking wordt opgemerkt, moet worden geprobeerd het geneesmiddel geleidelijk af te bouwen, de frequentie van toediening te verminderen of een minder krachtig corticosteroïd te vervangen. Herstel van de HPA-asfunctie is over het algemeen snel na stopzetting van lokale corticosteroïden. In zeldzame gevallen kunnen tekenen en symptomen van glucocorticosteroïde-insufficiëntie optreden, waardoor aanvullende systemische corticosteroïden nodig zijn.
Pediatrische patiënten kunnen gevoeliger zijn voor systemische toxiciteit bij equivalente doses vanwege hun grotere verhouding tussen huidoppervlak en lichaamsgewicht [zie Gebruik bij specifieke populaties ].
Allergische contactdermatitis
Als irritatie optreedt, moet ELOCON Cream worden gestaakt en moet een geschikte therapie worden ingesteld. Allergische contactdermatitis met corticosteroïden wordt meestal gediagnosticeerd door een falen van genezing waar te nemen in plaats van een klinische exacerbatie op te merken, zoals bij de meeste lokale producten die geen corticosteroïden bevatten. Een dergelijke observatie moet worden bevestigd met geschikte diagnostische patchtests.
Gelijktijdige huidinfecties
Als gelijktijdige huidinfecties aanwezig zijn of zich ontwikkelen, moet een geschikt antischimmel- of antibacterieel middel worden gebruikt. Als er niet onmiddellijk een gunstige respons optreedt, moet het gebruik van ELOCON 5g Cream worden gestaakt totdat de infectie voldoende onder controle is.

Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen dierstudies op lange termijn uitgevoerd om het carcinogene potentieel van ELOCON 5g Cream te evalueren. Langdurige carcinogeniteitsonderzoeken van mometasonfuroaat werden uitgevoerd via de inhalatieroute bij ratten en muizen. In een 2 jaar durende carcinogeniteitsstudie bij Sprague Dawley-ratten, vertoonde mometasonfuroaat geen statistisch significante toename van tumoren bij inhalatiedoses tot 67 mcg/kg (ongeveer 0,04 maal de geschatte maximale klinische topische dosis van ELOCON 5g crème op basis van mcg/m² ). In een carcinogeniteitsonderzoek van 19 maanden bij Zwitserse CD-1-muizen vertoonde mometasonfuroaat geen statistisch significante toename van de incidentie van tumoren bij inhalatiedoses tot 160 mcg/kg (ongeveer 0,05 maal de geschatte maximale klinische topische dosis van ELOCON Cream op een mcg/m² basis).
Mometasonfuroaat verhoogde chromosomale afwijkingen in een in vitro Chinese hamster-ovariumceltest, maar verhoogde de chromosomale afwijkingen niet in een in vitro Chinese hamsterlongceltest. Mometasonfuroaat was niet mutageen in de Ames-test of muislymfoomtest en was niet clastogeen in een in vivo micronucleustest bij muizen, een test op chromosomale aberratie van beenmerg bij ratten of een test op chromosomale aberratie in mannelijke geslachtscellen bij muizen. Mometasonfuroaat induceerde ook geen ongeplande DNA-synthese in vivo in hepatocyten van ratten.
In reproductieonderzoeken bij ratten werd geen verminderde vruchtbaarheid bij mannelijke of vrouwelijke ratten veroorzaakt door subcutane doses tot 15 mcg / kg (ongeveer 0, 01 keer de geschatte maximale klinische topische dosis van ELOCON 5 g Cream, op basis van mcg / m²).
Gebruik bij specifieke populaties
Zwangerschap
Teratogene effecten - Zwangerschap Categorie C
Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Daarom mag ELOCON 5g Cream alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel opweegt tegen het potentiële risico voor de foetus.
Van corticosteroïden is aangetoond dat ze teratogeen zijn bij laboratoriumdieren wanneer ze systemisch worden toegediend in relatief lage doseringen. Van sommige corticosteroïden is aangetoond dat ze teratogeen zijn na toediening via de huid bij proefdieren.
Bij toediening aan zwangere ratten, konijnen en muizen verhoogde mometasonfuroaat foetale misvormingen. De doses die misvormingen veroorzaakten, verminderden ook de groei van de foetus, zoals gemeten aan de hand van een lager foetaal gewicht en/of vertraagde ossificatie. Mometasonfuroaat veroorzaakte ook dystokie en gerelateerde complicaties bij toediening aan ratten aan het einde van de dracht.
Bij muizen veroorzaakte mometasonfuroaat een gespleten gehemelte bij subcutane doses van 60 mcg/kg en hoger. De overleving van de foetus was verminderd tot 180 mcg/kg. Bij 20 mcg/kg werd geen toxiciteit waargenomen. (Doses van 20, 60 en 180 mcg/kg in de muis zijn ongeveer 0,01, 0,02 en 0,05 maal de geschatte maximale klinische topische dosis van ELOCON Cream op basis van mcg/m².)
Bij ratten veroorzaakte mometasonfuroaat navelbreuken bij plaatselijke doses van 600 mcg/kg en hoger. Een dosis van 300 mcg/kg veroorzaakte vertragingen in de ossificatie, maar geen misvormingen. (Doses van 300 en 600 mcg/kg bij ratten zijn ongeveer 0,2 en 0,4 keer de geschatte maximale klinische topische dosis van ELOCON 5g Cream op basis van mcg/m².)
Bij konijnen veroorzaakte mometasonfuroaat meerdere misvormingen (bijv. gebogen voorpoten, agenesie van de galblaas, navelbreuk, hydrocefalie) bij lokale doses van 150 mcg/kg en hoger (ongeveer 0,2 maal de geschatte maximale klinische topische dosis van ELOCON Cream op een mcg/ m² basis). In een oraal onderzoek verhoogde mometasonfuroaat de resorptie en veroorzaakte het een gespleten gehemelte en/of misvormingen van het hoofd (hydrocefalie en bolle kop) bij 700 mcg/kg. Bij 2800 mcg/kg werden de meeste nesten afgebroken of geresorbeerd. Er werd geen toxiciteit waargenomen bij 140 mcg/kg. (Doses van 140, 700 en 2800 mcg/kg bij konijnen zijn ongeveer 0,2, 0,9 en 3,6 keer de geschatte maximale klinische topische dosis van ELOCON 5g Cream op basis van mcg/m².)
Wanneer ratten subcutane doses mometasonfuroaat kregen tijdens de zwangerschap of tijdens de latere stadia van de zwangerschap, veroorzaakte 15 mcg/kg langdurige en moeilijke bevallingen en verminderde het het aantal levendgeborenen, het geboortegewicht en de vroege overleving van de pup. Soortgelijke effecten werden niet waargenomen bij 7,5 mcg/kg. (Doses van 7,5 en 15 mcg/kg bij ratten zijn ongeveer 0,005 en 0,01 maal de geschatte maximale klinische topische dosis van ELOCON Cream op basis van mcg/m².)
Moeders die borstvoeding geven
Systemisch toegediende corticosteroïden komen voor in de moedermelk en kunnen de groei onderdrukken, de endogene productie van corticosteroïden verstoren of andere ongewenste effecten veroorzaken. Het is niet bekend of lokale toediening van corticosteroïden kan leiden tot voldoende systemische absorptie om detecteerbare hoeveelheden in de moedermelk te produceren. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, is voorzichtigheid geboden wanneer ELOCON 5g Cream wordt toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
ELOCON Cream kan met voorzichtigheid worden gebruikt bij pediatrische patiënten van 2 jaar of ouder, hoewel de veiligheid en werkzaamheid van geneesmiddelgebruik langer dan 3 weken niet zijn vastgesteld. Aangezien de veiligheid en werkzaamheid van ELOCON 5g Cream niet zijn vastgesteld bij pediatrische patiënten jonger dan 2 jaar, wordt het gebruik ervan in deze leeftijdsgroep niet aanbevolen.
In een pediatrisch onderzoek werden 24 proefpersonen met atopische dermatitis, van wie 19 proefpersonen in de leeftijd van 2 tot 12 jaar, eenmaal daags behandeld met ELOCON Cream. De meeste proefpersonen verdwenen binnen 3 weken. ELOCON 5g crème veroorzaakte HPA-asonderdrukking bij ongeveer 16% van de pediatrische proefpersonen in de leeftijd van 6 tot 23 maanden, die een normale bijnierfunctie vertoonden door middel van de Cortrosyn-test voordat ze met de behandeling begonnen, en die gedurende ongeveer 3 weken werden behandeld gedurende een gemiddeld lichaamsoppervlak van 41% (bereik 15%-94%). De criteria voor onderdrukking waren: basaal cortisolniveau van ≤ 5 mcg/dL, 30 minuten post-stimulatieniveau van ≤ 18 mcg/dL of een verhoging van KLINISCHE FARMACOLOGIE ].
Vanwege een hogere verhouding van huidoppervlak tot lichaamsgewicht, lopen pediatrische patiënten een groter risico dan volwassenen met HPA-asonderdrukking en het syndroom van Cushing wanneer ze worden behandeld met lokale corticosteroïden. Ze lopen daarom ook een groter risico op bijnierinsufficiëntie tijdens en/of na stopzetting van de behandeling. Pediatrische patiënten kunnen gevoeliger zijn dan volwassenen voor huidatrofie, inclusief striae, wanneer ze worden behandeld met lokale corticosteroïden. Pediatrische patiënten die topische corticosteroïden toepassen op meer dan 20% van het lichaamsoppervlak, lopen een groter risico op HPA-asonderdrukking.
HPA-asonderdrukking, het syndroom van Cushing, lineaire groeivertraging, vertraagde gewichtstoename en intracraniële hypertensie zijn gemeld bij pediatrische patiënten die lokale corticosteroïden kregen. Manifestaties van bijniersuppressie bij kinderen omvatten lage plasmacortisolspiegels en een afwezigheid van respons op ACTH-stimulatie. Manifestaties van intracraniële hypertensie zijn onder meer uitpuilende fontanellen, hoofdpijn en bilateraal papiloedeem.
ELOCON Cream mag niet worden gebruikt bij de behandeling van luierdermatitis.
Geriatrisch gebruik
Klinische onderzoeken met ELOCON 5g Cream omvatten 190 proefpersonen van 65 jaar en ouder en 39 proefpersonen van 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Een grotere gevoeligheid van sommige ouderen kan echter niet worden uitgesloten.
OVERDOSERING
Topisch aangebrachte ELOCON Cream kan in voldoende hoeveelheden worden geabsorbeerd om systemische effecten te produceren [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
CONTRA-INDICATIES
Geen.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Net als andere lokale corticosteroïden heeft mometasonfuroaat ontstekingsremmende, jeukwerende en vasoconstrictieve eigenschappen. Het mechanisme van de ontstekingsremmende activiteit van de lokale steroïden is in het algemeen onduidelijk. Men denkt echter dat corticosteroïden werken door de inductie van fosfolipase A2-remmende eiwitten, gezamenlijk lipocortinen genoemd. Er wordt verondersteld dat deze eiwitten de biosynthese van krachtige ontstekingsmediatoren zoals prostaglandinen en leukotriënen regelen door de afgifte van hun gemeenschappelijke voorloper arachidonzuur te remmen. Arachidonzuur wordt vrijgemaakt uit membraanfosfolipiden door fosfolipase A2.
farmacodynamiek
Studies uitgevoerd met ELOCON 5g Cream geven aan dat het middelmatig krachtig is in vergelijking met andere lokale corticosteroïden.
In een onderzoek waarin de effecten van mometasonfuroaatcrème op de HPA-as werden geëvalueerd, werd gedurende 7 dagen tweemaal daags 15 gram toegediend aan zes volwassen proefpersonen met psoriasis of atopische dermatitis. De crème werd zonder occlusie aangebracht op ten minste 30% van het lichaamsoppervlak. De resultaten toonden aan dat het medicijn een lichte verlaging van de secretie van bijniercorticosteroïden veroorzaakte [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Zevenennegentig pediatrische proefpersonen in de leeftijd van 6 tot 23 maanden met atopische dermatitis werden opgenomen in een open-label HPA-asveiligheidsonderzoek. ELOCON Cream werd eenmaal daags gedurende ongeveer 3 weken aangebracht over een gemiddeld lichaamsoppervlak van 41% (bereik 15%-94%). Bij ongeveer 16% van de proefpersonen die een normale bijnierfunctie vertoonden volgens de Cortrosyn-test voordat de behandeling werd gestart, werd bijniersuppressie waargenomen aan het einde van de behandeling met ELOCON 5g Cream. De criteria voor onderdrukking waren: basaal cortisolniveau van ≤ 5 mcg/dL, 30 minuten post-stimulatieniveau van ≤ 18 mcg/dL of een verhoging van Gebruik in specifieke populaties ].
Farmacokinetiek
De mate van percutane absorptie van lokale corticosteroïden wordt bepaald door vele factoren, waaronder het vehiculum en de integriteit van de epidermale barrière. Studies bij mensen geven aan dat ongeveer 0,4% van de aangebrachte dosis ELOCON 5g Cream in de bloedsomloop komt na 8 uur contact op de normale huid zonder occlusie. Ontsteking en/of andere ziekteprocessen in de huid kunnen de percutane absorptie verhogen.
Klinische studies
De veiligheid en werkzaamheid van de ELOCON 5g-crème voor de behandeling van op corticosteroïden reagerende dermatosen werden geëvalueerd in twee gerandomiseerde, dubbelblinde, voertuiggecontroleerde klinische onderzoeken, één bij psoriasis en één bij atopische dermatitis. In deze onderzoeken werden in totaal 366 proefpersonen (12-81 jaar), van wie 177 ELOCON Cream kregen en 181 proefpersonen voertuigcrème, geëvalueerd. ELOCON Cream of de voertuigcrème werden gedurende 21 dagen eenmaal daags aangebracht.
Uit de twee onderzoeken bleek dat ELOCON 5g Cream effectief is bij de behandeling van psoriasis en atopische dermatitis.
PATIËNT INFORMATIE
Informeer patiënten over het volgende:
- Gebruik ELOCON 5g Cream zoals voorgeschreven door de arts. Het is alleen voor uitwendig gebruik.
- Vermijd contact met de ogen.
- Gebruik ELOCON Cream niet op het gezicht, de oksels of de lies, tenzij voorgeschreven door de arts.
- Gebruik ELOCON 5g Cream niet voor een andere aandoening dan waarvoor het is voorgeschreven.
- Het behandelde huidgebied mag niet worden verbonden of anderszins worden bedekt of omwikkeld om occlusief te zijn, tenzij voorgeschreven door de arts.
- Meld eventuele tekenen van lokale bijwerkingen aan de arts.
- Adviseer patiënten om ELOCON 5g Cream niet te gebruiken bij de behandeling van luierdermatitis. Breng ELOCON Cream niet aan in het luiergebied, omdat luiers of plastic broekjes occlusief verband kunnen vormen.
- Beëindig de therapie wanneer de controle is bereikt. Als er binnen 2 weken geen verbetering wordt waargenomen, neem dan contact op met de arts.
- Gebruik geen andere producten die corticosteroïden bevatten met ELOCON Cream zonder eerst met de arts te overleggen.
