Brand Temovate 15g Clobetasol Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Temovate en hoe wordt het gebruikt?
Temovate is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van plaque- en hoofdhuidpsoriasis en op corticosteroïden reagerende dermatosen. Temovate kan alleen of in combinatie met andere medicijnen worden gebruikt.
Temovate behoort tot een klasse geneesmiddelen genaamd Corticosteroïden, Actueel.
Het is niet bekend of Temovate veilig en effectief is bij kinderen jonger dan 12 jaar.
Wat zijn de mogelijke bijwerkingen van Temovate?
Temovate kan ernstige bijwerkingen veroorzaken, waaronder:
- verslechtering van uw huidaandoening,
- roodheid, warmte, zwelling, sijpelen of ernstige irritatie van een behandelde huid,
- wazig zien,
- tunnelvisie,
- oogpijn,
- halo's rond lichten zien,
- verhoogde dorst,
- droge mond,
- fruitige ademgeur,
- gewichtstoename in uw gezicht en schouders,
- langzame wondgenezing,
- huidverkleuring,
- dunner wordende huid,
- meer lichaamshaar,
- vermoeidheid,
- stemmingswisselingen,
- menstruatieveranderingen, en
- seksuele veranderingen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Temovate zijn:
- verbranding, jeuk, zwelling of irritatie van de behandelde huid,
- droge of gebarsten huid,
- roodheid of korstvorming rond uw haarzakjes,
- spataderen,
- striae,
- dunner wordende huid,
- uitslag of netelroos,
- acne, en
- tijdelijk haarverlies
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Temovate. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
TEMOVATE® (clobetasolpropionaatcrème en -zalf) Crème en zalf, 0, 05% bevat de werkzame stof clobetasolpropionaat, een synthetische corticosteroïde, voor lokaal dermatologisch gebruik. Clobetasol, een analoog van prednisolon, heeft een hoge mate van glucocorticoïde activiteit en een lichte mate van mineralocorticoïde activiteit.
Chemisch gezien is clobetasolpropionaat (11ß,16ß)-21-chloor-9-fluor-11-hydroxy-16-methyl-17-(1-oxopropoxy)-pregna-1,4-dieen-3,20-dion, en het heeft de volgende structuurformule:
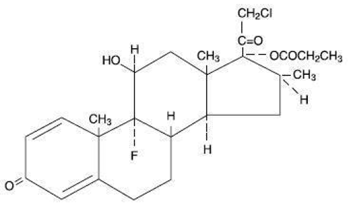
Clobetasolpropionaat heeft de molecuulformule C25H32CIFO5 en een molecuulgewicht van 467. Het is een wit tot crèmekleurig kristallijn poeder dat onoplosbaar is in water.
TEMOVATE® Cream bevat clobetasolpropionaat 0, 5 mg / g in een crèmebasis van propyleenglycol, glycerylmonostearaat, cetostearylalcohol, glycerylstearaat, PEG 100-stearaat, witte was, chloorcresol, natriumcitraat, citroenzuurmonohydraat en gezuiverd water.
TEMOVATE®-zalf bevat clobetasolpropionaat 0, 5 mg / g in een basis van propyleenglycol, sorbitansesquioleaat en witte vaseline.
INDICATIES
TEMOVATE® Crème en Zalf zijn superkrachtige corticosteroïdenformuleringen die zijn geïndiceerd voor de verlichting van de inflammatoire en jeukende manifestaties van op corticosteroïden reagerende dermatosen. Behandeling langer dan 2 opeenvolgende weken wordt niet aanbevolen en de totale dosering mag niet hoger zijn dan 50 g/week vanwege het vermogen van het geneesmiddel om de hypothalamus-hypofyse-bijnieras (HPA-as) te onderdrukken. Gebruik bij pediatrische patiënten jonger dan 12 jaar wordt niet aanbevolen.
Zoals met andere zeer actieve corticosteroïden, dient de behandeling te worden gestaakt wanneer de controle is bereikt. Als er binnen 2 weken geen verbetering wordt waargenomen, kan een herbeoordeling van de diagnose nodig zijn.
DOSERING EN ADMINISTRATIE
Breng tweemaal daags een dunne laag TEMOVATE® Crème of Zalf aan op de aangetaste huidzones en wrijf zachtjes en volledig in (zie AANWIJZINGEN EN GEBRUIK ).
TEMOVATE® Crème en Zalf zijn topische corticosteroïden met een superhoge potentie; daarom, de behandeling moet worden beperkt tot 2 opeenvolgende weken en hoeveelheden van meer dan 50 g/week mogen niet worden gebruikt.
Zoals met andere zeer actieve corticosteroïden, dient de behandeling te worden gestaakt wanneer de controle is bereikt. Als er binnen 2 weken geen verbetering wordt waargenomen, kan een herbeoordeling van de diagnose nodig zijn.
TEMOVATE® crème en zalf mogen niet worden gebruikt met occlusieve verbanden.
Geriatrisch gebruik
In onderzoeken waarbij geriatrische patiënten (65 jaar of ouder, zie: PREVENTIEVE MAATREGELEN zijn behandeld met TEMOVATE® crème of zalf, verschilde de veiligheid niet van die bij jongere patiënten; daarom wordt geen dosisaanpassing aanbevolen.
HOE GELEVERD
TEMOVATE® (clobetasolpropionaatcrème) Crème, 0, 05% wordt geleverd in:
buisjes van 30 g ( NDC 10337-163-30), en tubes van 60 g ( NDC 10337-163-60).
TEMOVATE® (clobetasolpropionaatzalf) Zalf, 0, 05% wordt geleverd in:
buizen van 15 g ( NDC 10337-162-15), en buizen van 30 g ( NDC 10337-162-30).
Bewaren tussen 15° en 30°C (59° en 86°F). TEMOVATE® Cream mag niet worden gekoeld. PharmaDerm
Een divisie van Fougera Pharmaceuticals Inc., Melville, NY 11747 VS. Herzien: januari 2012
BIJWERKINGEN
In gecontroleerde klinische onderzoeken waren de meest voorkomende bijwerkingen die voor TEMOVATE® Cream werden gemeld een branderig en prikkend gevoel bij 1% van de behandelde patiënten. Minder frequente bijwerkingen waren jeuk, huidatrofie en barsten en kloven van de huid.
In gecontroleerde klinische onderzoeken waren de meest voorkomende bijwerkingen die voor TEMOVATE®-zalf werden gemeld een branderig gevoel, irritatie en jeuk bij 0, 5% van de behandelde patiënten. Minder frequente bijwerkingen waren steken, barsten, erytheem, folliculitis, gevoelloosheid van vingers, huidatrofie en teleangiëctasie.
Het syndroom van Cushing is gemeld bij zuigelingen en volwassenen als gevolg van langdurig gebruik van topische clobetasolpropionaatformuleringen.
De volgende aanvullende lokale bijwerkingen zijn gemeld met lokale corticosteroïden en ze kunnen vaker voorkomen bij het gebruik van occlusieve verbanden en sterkere corticosteroïden. Deze reacties worden weergegeven in een ongeveer afnemende volgorde van optreden: droogheid, acne-achtige uitbarstingen, hypopigmentatie, periorale dermatitis, allergische contactdermatitis, secundaire infectie, irritatie, striae en miliaria.

DRUG-INTERACTIES
Geen informatie verstrekt.
WAARSCHUWINGEN
Geen informatie verstrekt. Alsjeblieft zie VOORZORGSMAATREGELEN sectie hieronder.
PREVENTIEVE MAATREGELEN
Algemeen
TEMOVATE® crème en zalf mogen niet worden gebruikt bij de behandeling van rosacea of periorale dermatitis en mogen niet worden gebruikt op het gezicht, de lies of de oksels.
Systemische absorptie van lokale corticosteroïden kan reversibele HPA-asonderdrukking veroorzaken met mogelijk glucocorticosteroïde-insufficiëntie na stopzetting van de behandeling. Manifestaties van het syndroom van Cushing, hyperglykemie en glucosurie kunnen bij sommige patiënten ook worden veroorzaakt door systemische absorptie van lokale corticosteroïden tijdens de behandeling.
Patiënten die een topisch steroïde aanbrengen op een groot oppervlak of op gebieden onder occlusie, moeten periodiek worden beoordeeld op tekenen van HPA-asonderdrukking. Dit kan worden gedaan met behulp van de ACTH-stimulatie, AM-plasma-cortisol en urinaire vrije cortisol-tests. Patiënten die superkrachtige corticosteroïden krijgen, mogen niet langer dan 2 weken per keer worden behandeld en vanwege het verhoogde risico op HPA-suppressie mogen alleen kleine gebieden tegelijk worden behandeld.
TEMOVATE® crème en zalf produceerden HPA-asonderdrukking bij gebruik in doses van slechts 2 g/dag gedurende 1 week bij patiënten met eczeem.
Als HPA-asonderdrukking wordt opgemerkt, moet worden geprobeerd het geneesmiddel te staken, de frequentie van toediening te verminderen of een minder krachtig corticosteroïd te vervangen. Herstel van de HPA-asfunctie is over het algemeen snel na stopzetting van lokale corticosteroïden. Af en toe kunnen tekenen en symptomen van glucocorticosteroïde-insufficiëntie optreden waarvoor aanvullende systemische corticosteroïden nodig zijn. Voor informatie over systemische suppletie, zie de voorschrijfinformatie voor die producten.
Pediatrische patiënten kunnen gevoeliger zijn voor systemische toxiciteit bij equivalente doses vanwege hun grotere verhouding tussen huidoppervlak en lichaamsgewicht (zie PREVENTIEVE MAATREGELEN : Pediatrisch gebruik ).
Als irritatie optreedt, moet TEMOVATE® crème en zalf worden gestaakt en moet een geschikte therapie worden ingesteld. Allergische contactdermatitis met corticosteroïden wordt meestal gediagnosticeerd door een falen van genezing waar te nemen in plaats van een klinische exacerbatie op te merken, zoals bij de meeste lokale producten die geen corticosteroïden bevatten. Een dergelijke observatie moet worden bevestigd met geschikte diagnostische patchtests.
Als gelijktijdige huidinfecties aanwezig zijn of zich ontwikkelen, moet een geschikt antischimmel- of antibacterieel middel worden gebruikt. Als er niet snel een gunstige reactie optreedt, moet het gebruik van TEMOVATE® crème en zalf worden gestaakt totdat de infectie voldoende onder controle is.
Laboratorium testen
De volgende tests kunnen nuttig zijn bij het evalueren van patiënten op HPA-asonderdrukking:
ACTH-stimulatietest AM-plasma-cortisoltest Urinevrije cortisoltest
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen dierstudies op lange termijn uitgevoerd om het carcinogene potentieel van clobetasolpropionaat te evalueren.
Studies bij ratten na subcutane toediening met doseringen tot 50 mcg/kg/dag lieten zien dat de vrouwtjes een toename vertoonden van het aantal geresorbeerde embryo's en een afname van het aantal levende foetussen bij de hoogste dosis.
Clobetasolpropionaat was niet-mutageen in 3 verschillende testsystemen: de Ames-test, de Saccharomyces cerevisiae-genconversietest en de E. coli B WP2-fluctuatietest.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C. Van corticosteroïden is aangetoond dat ze teratogeen zijn bij laboratoriumdieren wanneer ze systemisch worden toegediend in relatief lage doseringen. Van sommige corticosteroïden is aangetoond dat ze teratogeen zijn na dermale toepassing op proefdieren.
Clobetasolpropionaat is niet getest op teratogeniteit bij topische toepassing; het wordt echter percutaan geabsorbeerd en bij subcutane toediening was het een significant teratogeen bij zowel konijnen als muizen. Clobetasolpropionaat heeft een groter teratogeen potentieel dan steroïden die minder krachtig zijn.
Teratogeniteitsonderzoeken bij muizen die de subcutane route gebruikten, resulteerden in foetotoxiciteit bij de hoogste geteste dosis (1 mg/kg) en teratogeniteit bij alle geteste dosisniveaus tot 0,03 mg/kg. Deze doses zijn respectievelijk ongeveer 1, 4 en 0, 04 keer de humane topische dosis TEMOVATE®-crème en -zalf. De waargenomen afwijkingen waren onder meer een gespleten gehemelte en skeletafwijkingen.
Bij konijnen was clobetasolpropionaat teratogeen in doses van 3 en 10 mcg/kg. Deze doses zijn respectievelijk ongeveer 0, 02 en 0, 05 keer de humane topische dosis TEMOVATE® Cream and Zalf. De waargenomen afwijkingen waren onder meer een gespleten gehemelte, cranioschisis en andere skeletafwijkingen.
Er zijn geen adequate en goed gecontroleerde onderzoeken naar het teratogene potentieel van clobetasolpropionaat bij zwangere vrouwen. TEMOVATE® crème en zalf mogen alleen tijdens de zwangerschap worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt.
Moeders die borstvoeding geven
Systemisch toegediende corticosteroïden komen voor in de moedermelk en kunnen de groei onderdrukken, de endogene productie van corticosteroïden verstoren of andere ongewenste effecten veroorzaken. Het is niet bekend of lokale toediening van corticosteroïden kan leiden tot voldoende systemische absorptie om detecteerbare hoeveelheden in de moedermelk te produceren. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer TEMOVATE® crème of zalf wordt toegediend aan een zogende vrouw.
Pediatrisch gebruik
De veiligheid en effectiviteit van TEMOVATE® crème en zalf bij pediatrische patiënten zijn niet vastgesteld. Gebruik bij pediatrische patiënten jonger dan 12 jaar wordt niet aanbevolen. Vanwege een hogere verhouding van huidoppervlak tot lichaamsgewicht, lopen pediatrische patiënten een groter risico dan volwassenen met HPA-asonderdrukking en Cushing-syndroom wanneer ze worden behandeld met lokale corticosteroïden. Ze lopen daarom ook een groter risico op bijnierinsufficiëntie tijdens of na het staken van de behandeling. Bijwerkingen, waaronder striae, zijn gemeld bij onjuist gebruik van lokale corticosteroïden bij zuigelingen en kinderen.
HPA-asonderdrukking, Cushing-syndroom, lineaire groeivertraging, vertraagde gewichtstoename en intracraniële hypertensie zijn gemeld bij kinderen die lokale corticosteroïden kregen. Manifestaties van bijniersuppressie bij kinderen omvatten lage plasmacortisolspiegels en een afwezigheid van respons op ACTH-stimulatie. Manifestaties van intracraniële hypertensie zijn onder meer uitpuilende fontanellen, hoofdpijn en bilateraal papiloedeem.
Geriatrisch gebruik
Een beperkt aantal patiënten van 65 jaar of ouder is behandeld met TEMOVATE® Cream (n = 231) en met TEMOVATE® Zalf (n = 101) in klinische onderzoeken in de VS en buiten de VS. Hoewel het aantal patiënten te klein is om een afzonderlijke analyse van de werkzaamheid en veiligheid mogelijk te maken, waren de bijwerkingen die in deze populatie werden gemeld vergelijkbaar met de bijwerkingen die door jongere patiënten werden gemeld. Op basis van beschikbare gegevens is geen aanpassing van de dosering van TEMOVATE® crème en zalf bij geriatrische patiënten gerechtvaardigd.
OVERDOSERING
Topisch aangebrachte TEMOVATE® crème en zalf kunnen in voldoende hoeveelheden worden geabsorbeerd om systemische effecten te produceren (zie: PREVENTIEVE MAATREGELEN ).
CONTRA-INDICATIES
TEMOVATE® (clobetasolpropionaatcrème en -zalf) Crème en zalf, 0, 05% is gecontra-indiceerd bij patiënten met een voorgeschiedenis van overgevoeligheid voor een van de componenten van de preparaten.
KLINISCHE FARMACOLOGIE
Net als andere lokale corticosteroïden heeft clobetasolpropionaat ontstekingsremmende, jeukwerende en vasoconstrictieve eigenschappen. Het mechanisme van de ontstekingsremmende activiteit van de lokale steroïden is in het algemeen onduidelijk. Men denkt echter dat corticosteroïden werken door de inductie van fosfolipase A2-remmende eiwitten, gezamenlijk lipocortinen genoemd. Er wordt verondersteld dat deze eiwitten de biosynthese van krachtige ontstekingsmediatoren zoals prostaglandinen en leukotriënen regelen door de afgifte van hun gemeenschappelijke voorloper, arachidonzuur, te remmen. Arachidonzuur wordt vrijgemaakt uit membraanfosfolipiden door fosfolipase A2.
Farmacokinetiek
De mate van percutane absorptie van lokale corticosteroïden wordt bepaald door vele factoren, waaronder het vehiculum en de integriteit van de epidermale barrière. Het is niet aangetoond dat occlusief verband met hydrocortison gedurende maximaal 24 uur de penetratie verhoogt; occlusie van hydrocortison gedurende 96 uur verbetert echter de penetratie aanzienlijk. Topische corticosteroïden kunnen worden geabsorbeerd door de normale intacte huid. Ontsteking en/of andere ziekteprocessen in de huid kunnen de percutane absorptie verhogen.
Studies uitgevoerd met TEMOVATE® crème en zalf geven aan dat ze in het superhoge bereik van potentie zijn in vergelijking met andere lokale corticosteroïden.
PATIËNT INFORMATIE
Patiënten die lokale corticosteroïden gebruiken, moeten de volgende informatie en instructies krijgen:
