Zanaflex 2mg, 4mg Tizanidine Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Zanaflex 2 mg en hoe wordt het gebruikt?
Zanaflex 2 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van spierstijfheid (spasticiteit) die gepaard gaan met aandoeningen zoals hersenverlamming of andere neurologische aandoeningen. Zanaflex 2 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Zanaflex 2 mg behoort tot een klasse geneesmiddelen die centrale alfa-2-adrenerge agonist wordt genoemd.
Het is niet bekend of Zanaflex veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Zanaflex?
Zanaflex 2 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- lage bloeddruk,
- abnormale leverfunctietesten,
- slaperigheid,
- hallucinaties,
- overmatige slaperigheid,
- trage hartslag,
- droge mond,
- vermoeidheid, en
- zwakheid
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Zanaflex zijn:
- droge mond,
- vermoeidheid,
- zwakheid,
- vermoeidheid,
- vermoeidheid,
- duizeligheid,
- urineweginfectie,
- constipatie,
- abnormale leverfunctietesten,
- braken,
- spraakstoornis,
- lui oog (amblyopie),
- urinaire frequentie,
- griep symptomen,
- ongecontroleerde spierbewegingen,
- nervositeit,
- keelpijn, en
- loopneus
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Zanaflex. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
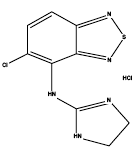
Zanaflex® (tizanidinehydrochloride) is een centrale alfa2-adrenerge agonist. Tizanidine HCl is een wit tot gebroken wit, fijn kristallijn poeder, dat geurloos is of een zwakke karakteristieke geur heeft. Tizanidine is slecht oplosbaar in water en methanol; oplosbaarheid in water neemt af naarmate de pH stijgt. De chemische naam is 5-chloor-4-(2-imidazolin-2-ylamino)-2,1,3-benzothiadiazool-monohydrochloride. De molecuulformule van Tizanidine is C9H8ClN5S-HCl, het molecuulgewicht is 290,2 en de structuurformule is:
Zanaflex 4 mg Capsules® worden geleverd als capsules van 2, 4 en 6 mg voor orale toediening. Zanaflex Capsules® bevatten het werkzame bestanddeel tizanidinehydrochloride (2,29 mg equivalent aan 2 mg tizanidinebase, 4,58 mg equivalent aan 4 mg tizanidinebase en 6,87 mg equivalent aan 6 mg tizanidinebase), en de inactieve ingrediënten hypromellose, siliciumdioxide, suikerbolletjes, titaniumdioxide, gelatine en kleurstoffen.
Zanaflex®-tabletten worden geleverd als tabletten van 4 mg voor orale toediening. Zanaflex®-tabletten bevatten het actieve ingrediënt, tizanidinehydrochloride (4,58 mg equivalent aan 4 mg tizanidinebase) en de inactieve ingrediënten, colloïdaal siliciumdioxide, stearinezuur, microkristallijne cellulose en watervrije lactose.
INDICATIES
Zanaflex is geïndiceerd voor de behandeling van spasticiteit. Vanwege de korte duur van het therapeutisch effect, dient behandeling met Zanaflex te worden gereserveerd voor die dagelijkse activiteiten en tijden waarop verlichting van spasticiteit het belangrijkst is [zie DOSERING EN ADMINISTRATIE ].
DOSERING EN ADMINISTRATIE
Doseringsinformatie
Zanaflex 2 mg Capsules® of Zanaflex® tabletten kunnen met of zonder voedsel worden voorgeschreven. Zodra de formulering is gekozen en de beslissing om met of zonder voedsel te nemen is genomen, mag dit regime niet worden gewijzigd.
Voedsel heeft complexe effecten op de farmacokinetiek van tizanidine, die verschillen met de verschillende formuleringen. Zanaflex-capsules en Zanaflex-tabletten zijn bio-equivalent aan elkaar in nuchtere toestand (meer dan 3 uur na een maaltijd), maar niet onder gevoede omstandigheden (binnen 30 minuten na een maaltijd). Deze farmacokinetische verschillen kunnen resulteren in klinisch significante verschillen bij het wisselen van toediening van tablet en capsules en bij het wisselen van toediening tussen gevoede of nuchtere toestand. Deze veranderingen kunnen leiden tot meer bijwerkingen, of een vertraagde of snellere aanvang van de activiteit, afhankelijk van de aard van de overschakeling. Om deze reden moet de voorschrijver grondig bekend zijn met de veranderingen in kinetiek die verband houden met deze verschillende aandoeningen [zie KLINISCHE FARMACOLOGIE ].
De aanbevolen startdosering is 2 mg. Omdat het effect van Zanaflex ongeveer 1 tot 2 uur na de dosis een piek bereikt en tussen 3 en 6 uur na de dosis verdwijnt, kan de behandeling indien nodig worden herhaald met tussenpozen van 6 tot 8 uur, tot een maximum van drie doses in 24 uur.
De dosering kan geleidelijk worden verhoogd met 2 mg tot 4 mg bij elke dosis, met 1 tot 4 dagen tussen de dosisverhogingen, totdat een bevredigende vermindering van de spiertonus is bereikt. De totale dagelijkse dosis mag niet hoger zijn dan 36 mg. Enkelvoudige doses hoger dan 16 mg zijn niet onderzocht.
Dosering bij patiënten met nierinsufficiëntie
Zanaflex moet met voorzichtigheid worden gebruikt bij patiënten met nierinsufficiëntie (creatinineklaring WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Dosering bij patiënten met leverinsufficiëntie
Zanaflex 4 mg moet met voorzichtigheid worden gebruikt bij patiënten met een leverfunctiestoornis. Bij deze patiënten moeten tijdens de titratie de individuele doses worden verlaagd. Als hogere doses nodig zijn, moeten de individuele doses worden verhoogd in plaats van de doseringsfrequentie. Monitoring van aminotransferasespiegels wordt aanbevolen voor baseline en 1 maand nadat de maximale dosis is bereikt, of als leverbeschadiging wordt vermoed (zie Gebruik bij specifieke populaties ].
Stoppen met medicijnen
Als de behandeling moet worden gestaakt, met name bij patiënten die gedurende lange perioden (9 weken of langer) hoge doses (20 mg tot 36 mg per dag) hebben gekregen of die mogelijk gelijktijdig met narcotica worden behandeld, moet de dosis langzaam worden verlaagd ( 2 mg tot 4 mg per dag) om het risico op ontwennings- en reboundhypertensie, tachycardie en hypertonie te minimaliseren (zie Drugsmisbruik en afhankelijkheid ].
HOE GELEVERD
Doseringsvormen en sterke punten
Capsules
mg: Lichtblauwe ondoorzichtige romp met een lichtblauwe ondoorzichtige dop met “2 MG” gedrukt op de dop 4 mg: Witte ondoorzichtige romp met een blauwe ondoorzichtige dop met “4 MG” gedrukt op de dop 6 mg: Blauwe ondoorzichtige romp met een witte streep en blauwe ondoorzichtige dop met "6 MG" gedrukt op de dop
Tabletten
4 mg witte, niet-omhulde tabletten met een viersnijdende breukstreep aan de ene kant en de inscriptie “A594” aan de andere kant
Opslag en behandeling
Zanaflex Capsules®
Zanaflex Capsules® (tizanidinehydrochloride) capsules zijn verkrijgbaar in drie sterktes als tweedelige harde gelatinecapsules die tizanidinehydrochloride 2,29 mg, 4,58 mg en 6,87 mg bevatten, overeenkomend met 2 mg, 4 mg en 6 mg tizanidinebase.
De capsules van 2 mg hebben een lichtblauwe ondoorzichtige romp met een lichtblauwe ondoorzichtige dop met de opdruk “2 MG” op de dop: flesjes van 150 capsules ( NDC 70515-602-15)
De capsules van 4 mg hebben een witte ondoorzichtige romp met een blauwe ondoorzichtige dop met de opdruk “4 MG” op de dop: flesjes van 150 capsules ( NDC 70515-604-15)
De capsules van 6 mg hebben een blauwe ondoorzichtige romp met een witte streep en een blauwe ondoorzichtige dop met de opdruk “6 MG” op de capsules: flacons van 150 capsules ( NDC 70515-606-15)
Bewaren bij 25°C (77°F); excursies toegestaan tot 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ]. Doseer in containers met kindveilige sluiting.
Zanaflex®-tabletten
Zanaflex® (tizanidinehydrochloride) tabletten zijn verkrijgbaar als 4 mg witte, niet-omhulde tabletten die tizanidinehydrochloride 4, 58 mg bevatten, overeenkomend met 4 mg tizanidinebase. De tabletten hebben aan de ene kant een vierhoekige breukstreep en aan de andere kant de inscriptie “A594”. Tabletten worden als volgt geleverd: flessen van 150 tabletten ( NDC 70515-594-15).
Bewaren bij 25°C (77°F); excursies toegestaan tot 15°C tot 30°C (59°F tot 86°F) [zie USP-gecontroleerde kamertemperatuur ].
Doseer in containers met kindveilige sluiting.
Gefabriceerd voor: Covis Pharma Zug, 6300 Zwitserland. Herzien: december 2020
BIJWERKINGEN
De volgende bijwerkingen worden elders in andere rubrieken van de voorschrijfinformatie beschreven:
- hypotensie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Leverletsel [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Sedatie [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Hallucinose/psychotisch-achtige symptomen [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
- Overgevoeligheidsreacties [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die zijn waargenomen in de klinische onderzoeken van een geneesmiddel niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen deze mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
Er zijn drie dubbelblinde, gerandomiseerde, placebogecontroleerde klinische onderzoeken uitgevoerd om het effect van tizanidine op de spasticiteitscontrole te evalueren. Er zijn twee onderzoeken uitgevoerd bij patiënten met multiple sclerose en één bij patiënten met een dwarslaesie. Elke studie had een actieve behandelingsperiode van 13 weken die een titratiefase van 3 weken omvatte tot de maximaal verdraagbare dosis tot 36 mg/dag in drie verdeelde doses, een plateaufase van 9 weken waarin de dosis tizanidine constant werd gehouden en een Afbouw van de dosis van 1 week. In totaal kregen 264 patiënten tizanidine en 261 patiënten placebo. In de drie onderzoeken varieerde de leeftijd van de patiënten van 15-69 jaar en 51,4 procent was vrouw. De mediane dosis tijdens de plateaufase varieerde van 20-28 mg/dag.
De meest voorkomende bijwerkingen die werden gemeld in placebogecontroleerde klinische onderzoeken met meerdere doses waarbij 264 patiënten met spasticiteit betrokken waren, waren droge mond, slaperigheid/sedatie, asthenie (zwakte, vermoeidheid en/of vermoeidheid) en duizeligheid. Driekwart van de patiënten beoordeelde de voorvallen als licht tot matig en een kwart van de patiënten beoordeelde de voorvallen als ernstig. Deze gebeurtenissen leken dosisgerelateerd te zijn.
Tabel 1 geeft een overzicht van de tekenen en symptomen die werden gemeld bij meer dan 2% van de patiënten in drie placebogecontroleerde onderzoeken met meerdere doses die Zanaflex kregen, waarbij de frequentie in de Zanaflex-groep groter was dan in de placebogroep. Voor vergelijkingsdoeleinden wordt ook de overeenkomstige frequentie van het voorval (per 100 patiënten) bij met placebo behandelde patiënten gegeven.
In het placebogecontroleerde onderzoek met enkelvoudige dosis waarbij 142 patiënten met spasticiteit als gevolg van multiple sclerose betrokken waren (onderzoek 1) [zie Klinische studies werd de patiënten specifiek gevraagd of ze een van de vier meest voorkomende bijwerkingen hadden ervaren: droge mond, slaperigheid (slaperigheid), asthenie (zwakte, vermoeidheid en/of vermoeidheid) en duizeligheid. Daarnaast werden hypotensie en bradycardie waargenomen. Het optreden van deze reacties is samengevat in Tabel 2. Andere voorvallen werden in het algemeen gemeld met een snelheid van 2% of minder.
Postmarketingervaring
De volgende bijwerkingen zijn vastgesteld tijdens het gebruik van Zanaflex na goedkeuring. Omdat deze reacties vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om op betrouwbare wijze hun frequentie te schatten of een oorzakelijk verband met blootstelling aan geneesmiddelen vast te stellen.
Bepaalde voorvallen, zoals slaperigheid, droge mond, hypotensie, verlaagde bloeddruk, bradycardie, duizeligheid, zwakte of asthenie, spierspasmen, hallucinaties, vermoeidheid, abnormale leverfunctietesten en hepatotoxiciteit, zijn waargenomen in postmarketing- en klinische onderzoeken en worden besproken in eerdere secties van dit document.
De volgende bijwerkingen zijn vastgesteld tijdens de postmarketingervaring van Zanaflex. Op basis van de verstrekte informatie over deze reacties kan een causaal verband met Zanaflex niet geheel worden uitgesloten. De gebeurtenissen worden weergegeven in volgorde van afnemende klinische significantie; ernst in de postmarketingomgeving wordt niet gerapporteerd.
- Stevens Johnson-syndroom
- Anafylactische reactie
- Exfoliatieve dermatitis
- Ventriculaire tachycardie
- Hepatitis
- stuiptrekkingen
- Depressie
- Artralgie
- paresthesie
- Uitslag
- Tremor
DRUG-INTERACTIES
Fluvoxamine
Gelijktijdig gebruik van fluvoxamine en Zanaflex 4 mg is gecontra-indiceerd. Veranderingen in de farmacokinetiek van tizanidine bij toediening met fluvoxamine resulteerden in significant verlaagde bloeddruk, toegenomen slaperigheid en toegenomen psychomotorische stoornis [zie CONTRA-INDICATIES en KLINISCHE FARMACOLOGIE ].
Ciprofloxacine
Gelijktijdig gebruik van ciprofloxacine en Zanaflex is gecontra-indiceerd. Veranderingen in de farmacokinetiek van tizanidine bij toediening met ciprofloxacine resulteerden in significant verlaagde bloeddruk, toegenomen slaperigheid en toegenomen psychomotorische stoornis [zie CONTRA-INDICATIES en KLINISCHE FARMACOLOGIE ].
CYP1A2-remmers anders dan fluvoxamine en ciprofloxacine
Vanwege mogelijke geneesmiddelinteracties, gelijktijdig gebruik van Zanaflex met andere CYP1A2-remmers, zoals zileuton, andere fluoroquinolonen dan sterke CYP1A2-remmers (die gecontra-indiceerd zijn), antiaritmica (amiodaron, mexiletine, propafenon en verapamil), cimetidine, famotidine, orale aciclovir en ticlopidine) moeten worden vermeden. Als het gebruik ervan klinisch noodzakelijk is, moet de therapie worden gestart met een dosis van 2 mg en worden verhoogd in stappen van 2-4 mg per dag op basis van de respons van de patiënt op de therapie. Als bijwerkingen zoals hypotensie, bradycardie of overmatige slaperigheid optreden, verminder of stop dan de behandeling met Zanaflex (zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Orale anticonceptiva
Gelijktijdig gebruik van Zanaflex 2 mg met orale anticonceptiva wordt niet aanbevolen. Als gelijktijdig gebruik echter klinisch noodzakelijk is, start dan Zanaflex 4 mg met een enkele dosis van 2 mg en verhoog deze in stappen van 2-4 mg per dag op basis van de respons van de patiënt op de therapie. Als bijwerkingen zoals hypotensie, bradycardie of overmatige slaperigheid optreden, verminder of stop dan de behandeling met Zanaflex (zie KLINISCHE FARMACOLOGIE ].
Alcohol
Alcohol verhoogt de totale hoeveelheid geneesmiddel in de bloedbaan na een dosis Zanaflex. Dit ging gepaard met een toename van bijwerkingen van Zanaflex. De CZS-onderdrukkende effecten van Zanaflex en alcohol zijn additief [zie KLINISCHE FARMACOLOGIE ].
Andere CZS-depressiva
De sedatieve effecten van Zanaflex met CZS-depressiva (bijv. benzodiazepines, opioïden, tricyclische antidepressiva) kunnen additief zijn. Controleer patiënten die Zanaflex 2 mg innemen met een ander CZS-depressivum op symptomen van overmatige sedatie [zie KLINISCHE FARMACOLOGIE ].
α2-adrenerge agonisten
Omdat hypotensieve effecten cumulatief kunnen zijn, wordt het niet aanbevolen Zanaflex 4 mg te gebruiken met andere α2-adrenerge agonisten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Drugsmisbruik en afhankelijkheid
Misbruik
Het misbruikpotentieel werd niet geëvalueerd in studies bij mensen. Ratten waren in staat om tizanidine van zoutoplossing te onderscheiden in een standaard discriminatieparadigma, na training, maar slaagden er niet in de effecten van morfine, cocaïne, diazepam of fenobarbital op tizanidine te generaliseren.
Afhankelijkheid
Tizanidine is nauw verwant aan clonidine, dat vaak wordt misbruikt in combinatie met verdovende middelen en waarvan bekend is dat het bij abrupt stoppen symptomen van rebound veroorzaakt. Drie gevallen van rebound-symptomen bij plotseling stoppen met tizanidine zijn gemeld. De casusrapporten suggereren dat deze patiënten ook verdovende middelen gebruikten. Ontwenningsverschijnselen waren onder meer hypertensie, tachycardie, hypertonie, tremor en angst. Ontwenningsverschijnselen treden vaker op in gevallen waarin hoge doses worden gebruikt, vooral gedurende langere perioden, of bij gelijktijdig gebruik van verdovende middelen. Als de therapie moet worden gestaakt, moet de dosis langzaam worden verlaagd om het risico op ontwenningsverschijnselen te minimaliseren [zie: DOSERING EN ADMINISTRATIE ].
Van apen werd aangetoond dat ze tizanidine zelf toedienen op een dosisafhankelijke manier, en abrupte stopzetting van tizanidine veroorzaakte voorbijgaande tekenen van ontwenning bij doses > 35 maal de maximaal aanbevolen dosis voor de mens op basis van mg/m². Deze voorbijgaande ontwenningsverschijnselen (verhoogde voortbeweging, spiertrekkingen en aversief gedrag jegens de waarnemer) werden niet ongedaan gemaakt door toediening van naloxon.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de PREVENTIEVE MAATREGELEN sectie.
PREVENTIEVE MAATREGELEN
Hypotensie
Tizanidine is een α2-adrenerge agonist die hypotensie kan veroorzaken. Syncope is gemeld in de postmarketingomgeving. De kans op significante hypotensie kan mogelijk worden geminimaliseerd door titratie van de dosis en door de aandacht te vestigen op tekenen en symptomen van hypotensie voordat de dosis wordt verhoogd. Bovendien kunnen patiënten die van een liggende naar een vaste rechtopstaande positie bewegen een verhoogd risico lopen op hypotensie en orthostatische effecten.
Controleer op hypotensie wanneer Zanaflex wordt gebruikt bij patiënten die gelijktijdig antihypertensiva krijgen. Het wordt niet aanbevolen om Zanaflex 2 mg te gebruiken met andere α2-adrenerge agonisten. Klinisch significante hypotensie (dalingen van zowel de systolische als de diastolische druk) is gemeld bij gelijktijdige toediening van ofwel fluvoxamine ofwel ciprofloxacine en enkelvoudige doses van 4 mg Zanaflex. Daarom is gelijktijdig gebruik van Zanaflex met fluvoxamine of met ciprofloxacine, krachtige remmers van CYP1A2, gecontra-indiceerd [zie CONTRA-INDICATIES en DRUG-INTERACTIES ].
Risico op leverletsel
Zanaflex kan hepatocellulair leverletsel veroorzaken. Zanaflex 4 mg moet met voorzichtigheid worden gebruikt bij patiënten met een leverfunctiestoornis. Monitoring van aminotransferasespiegels wordt aanbevolen voor baseline en 1 maand nadat de maximale dosis is bereikt, of als leverbeschadiging wordt vermoed (zie DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Sedatie
Zanaflex kan sedatie veroorzaken, wat de dagelijkse activiteit kan verstoren. In de onderzoeken met meerdere doses bereikte de prevalentie van patiënten met sedatie een piek na de eerste week van titratie en bleef daarna stabiel gedurende de duur van de onderhoudsfase van het onderzoek. De CZS-onderdrukkende effecten van Zanaflex met alcohol en andere CZS-depressiva (bijv. benzodiazepines, opioïden, tricyclische antidepressiva) kunnen additief zijn. Controleer patiënten die Zanaflex 4 mg innemen met een ander CZS-depressivum op symptomen van overmatige sedatie [zie DRUG-INTERACTIES ].

Hallucinose/psychotisch-achtige symptomen
Het gebruik van Zanaflex 4 mg is in verband gebracht met hallucinaties. Gevormde, visuele hallucinaties of wanen zijn gemeld bij 5 van de 170 patiënten (3%) in twee Noord-Amerikaanse gecontroleerde klinische onderzoeken. De meeste patiënten waren zich ervan bewust dat de gebeurtenissen onwerkelijk waren. Eén patiënt ontwikkelde een psychose in verband met de hallucinaties. Eén patiënt van deze 5 bleef problemen houden gedurende ten minste 2 weken na stopzetting van tizanidine. Overweeg te stoppen met Zanaflex bij patiënten die hallucinaties ontwikkelen.
Interactie met CYP1A2-remmers
Vanwege mogelijke geneesmiddelinteracties is Zanaflex 4 mg gecontra-indiceerd bij patiënten die krachtige CYP1A2-remmers gebruiken, zoals fluvoxamine of ciprofloxacine. Bijwerkingen zoals hypotensie, bradycardie of overmatige slaperigheid kunnen optreden wanneer Zanaflex wordt ingenomen met andere CYP1A2-remmers, zoals zileuton, andere fluoroquinolonen dan ciprofloxacine (gecontra-indiceerd), antiaritmica (amiodaron, mexiletine, propafenon), cimetidine, anticonceptiva, aciclovir en ticlopidine). Gelijktijdig gebruik moet worden vermeden, tenzij de noodzaak voor behandeling met Zanaflex 2 mg klinisch duidelijk is. Gebruik in dat geval voorzichtig [zie DRUG-INTERACTIES en KLINISCHE FARMACOLOGIE ].
Overgevoeligheidsreacties
Zanaflex kan anafylaxie veroorzaken. Tekenen en symptomen, waaronder ademhalingsproblemen, urticaria en angio-oedeem van de keel en tong zijn gemeld. Patiënten moeten worden geïnformeerd over de tekenen en symptomen van ernstige allergische reacties en moeten worden geïnstrueerd om te stoppen met Zanaflex en onmiddellijk medische hulp in te roepen als deze tekenen en symptomen optreden [zie CONTRA-INDICATIES ].
Verhoogd risico op bijwerkingen bij patiënten met nierinsufficiëntie
Zanaflex moet met voorzichtigheid worden gebruikt bij patiënten met nierinsufficiëntie (creatinineklaring DOSERING EN ADMINISTRATIE en Gebruik bij specifieke populaties ].
Bijwerkingen van intrekking
Bijwerkingen van ontwenning zijn onder meer rebound-hypertensie, tachycardie en hypertonie. Om het risico op deze reacties te minimaliseren, met name bij patiënten die gedurende lange tijd (9 weken of langer) hoge doses (20 tot 28 mg per dag) hebben gekregen of die mogelijk gelijktijdig met narcotica worden behandeld, moet de dosis worden verlaagd. langzaam (2 tot 4 mg per dag) [zie DOSERING EN ADMINISTRATIE ].
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Tizanidine werd gedurende 78 weken aan muizen toegediend in orale doses tot 16 mg/kg/dag, wat 2 keer de maximaal aanbevolen dosis voor de mens (MRHD) van 36 mg/dag is op basis van het lichaamsoppervlak (mg/m²). Tizanidine werd gedurende 104 weken aan ratten toegediend in orale doses tot 9 mg/kg/dag, wat 2,5 maal de MRHD is op basis van mg/m². Er was geen toename van tumoren bij beide soorten.
Mutagenese
Tizanidine was negatief in in vitro (bacteriële omgekeerde mutatie [Ames], zoogdiergenmutatie en chromosomale aberratietest in zoogdiercellen) en in vivo (beenmergmicronucleus en cytogenetica) test.
Aantasting van de vruchtbaarheid
Orale toediening van tizanidine aan ratten voor en tijdens de paring en voortzetting tijdens de vroege dracht bij vrouwtjes resulteerde in verminderde vruchtbaarheid bij mannetjes- en vrouwtjesratten bij doses van respectievelijk 30 en 10 mg/kg/dag. Er werd geen effect op de vruchtbaarheid waargenomen bij doses van 10 (mannelijk) en 3 (vrouwelijk) mg/kg/dag, wat respectievelijk ongeveer 3 keer en vergelijkbaar is met de MRHD, op basis van mg/m².
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
Er zijn geen adequate gegevens over het ontwikkelingsrisico dat samenhangt met het gebruik van Zanaflex 2 mg bij zwangere vrouwen. In dierstudies resulteerde toediening van tizanidine tijdens de zwangerschap in ontwikkelingstoxiciteit (embryofoetale en postnatale sterfte en groeistoornissen) bij doses die lager waren dan de klinisch gebruikte doses, die niet in verband werden gebracht met maternale toxiciteit (zie Dierlijke gegevens ).
In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskraam bij klinisch erkende zwangerschappen respectievelijk 2% - 4% en 15% - 20%. Het achtergrondrisico van ernstige geboorteafwijkingen en miskraam voor de aangegeven populatie is niet bekend.
Gegevens
Dierlijke gegevens
Orale toediening van tizanidine (0,3 tot 100 mg/kg/dag) aan drachtige ratten tijdens de periode van organogenese resulteerde in embryofoetale en postnatale sterfte van nakomelingen en verlagingen van het lichaamsgewicht bij doses van 30 mg/kg/dag en hoger. Maternale toxiciteit werd waargenomen bij de hoogste geteste dosis. De dosis zonder effect voor embryofoetale ontwikkelingstoxiciteit bij ratten (3 mg/kg/dag) is vergelijkbaar met de maximaal aanbevolen dosis voor de mens (MRHD) van 36 mg/dag op basis van het lichaamsoppervlak (mg/m²).
Orale toediening van tizanidine (1 tot 100 mg/kg/dag) aan drachtige konijnen tijdens de periode van organogenese resulteerde bij alle doses in embryofoetale en postnatale sterfte van nakomelingen. Maternale toxiciteit werd waargenomen bij de hoogste geteste dosis. Orale toediening van tizanidine (10 en 30 mg/kg/dag) tijdens de perinatale periode van de zwangerschap (2-6 dagen voor de bevalling) resulteerde bij beide doses in een verhoogde postnatale sterfte bij de nakomelingen. Een dosis zonder effect voor embryofoetale ontwikkelingstoxiciteit bij konijnen werd niet geïdentificeerd. De laagste geteste dosis (1 mg/kg/dag) is lager dan de MRHD op basis van mg/m².
In een pre- en postnataal ontwikkelingsonderzoek bij ratten resulteerde orale toediening van tizanidine (3 tot 30 mg/kg/dag) in een verhoogde postnatale mortaliteit bij nakomelingen. Een dosis zonder effect voor pre- en postnatale ontwikkelingstoxiciteit werd niet vastgesteld. De laagste geteste dosis (3 mg/kg/dag) is vergelijkbaar met de MRHD op respectievelijk mg/m²-basis.
Borstvoeding
Risico Samenvatting
Er zijn geen gegevens over de aanwezigheid van tizanidine in moedermelk, de effecten op de zuigeling die borstvoeding krijgt of de effecten op de moedermelkproductie. Dierstudies hebben de aanwezigheid van tizanidine in de melk van zogende dieren gemeld.
De ontwikkelings- en gezondheidsvoordelen van borstvoeding moeten in overweging worden genomen, samen met de klinische behoefte van de moeder aan Zanaflex 4 mg en eventuele nadelige effecten op de zuigeling die borstvoeding krijgt van Zanaflex of van de onderliggende maternale aandoening.
Vrouwtjes en mannetjes met reproductief potentieel
Er zijn geen adequate en goed gecontroleerde onderzoeken bij mensen naar het effect van Zanaflex 4 mg op het vrouwelijke of mannelijke voortplantingsvermogen. Orale toediening van tizanidine aan mannelijke en vrouwelijke ratten resulteerde in nadelige effecten op de vruchtbaarheid [zie: Niet-klinische toxicologie ].
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Van Zanaflex 2 mg is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op bijwerkingen van dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren.
Klinische onderzoeken met Zanaflex 2 mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Een cross-studievergelijking van farmacokinetische gegevens na toediening van een enkelvoudige dosis van 6 mg Zanaflex 2 mg toonde aan dat jongere proefpersonen het geneesmiddel vier keer sneller oplosten dan oudere proefpersonen. Bij oudere patiënten met nierinsufficiëntie (creatinineklaring
Verminderde nierfunctie
Van Zanaflex is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op bijwerkingen van dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Bij patiënten met nierinsufficiëntie (creatinineklaring DOSERING EN ADMINISTRATIE , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
Verminderde leverfunctie
De invloed van leverinsufficiëntie op de farmacokinetiek van tizanidine is niet onderzocht. Omdat tizanidine uitgebreid wordt gemetaboliseerd in de lever, zou leverinsufficiëntie naar verwachting significante effecten hebben op de farmacokinetiek van tizanidine [zie DOSERING EN TOEDIENING , WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Een beoordeling van de database voor veiligheidstoezicht bracht gevallen van opzettelijke en onopzettelijke overdosering met Zanaflex aan het licht. Sommige gevallen leidden tot de dood en veel van de opzettelijke overdoses waren met meerdere geneesmiddelen, waaronder CZS-depressiva. De klinische verschijnselen van een overdosis tizanidine waren consistent met de bekende farmacologie. In de meeste gevallen werd een afname van het sensorium waargenomen, waaronder lethargie, slaperigheid, verwardheid en coma. Een depressieve hartfunctie wordt ook waargenomen, waaronder meestal bradycardie en hypotensie. Ademhalingsdepressie is een ander veel voorkomend kenmerk van een overdosis tizanidine.
Als zich een overdosis voordoet, moeten basisstappen worden ondernomen om de geschiktheid van een luchtweg te garanderen en moeten de cardiovasculaire en respiratoire systemen worden gecontroleerd. Tizanidine is een in vet oplosbaar geneesmiddel, dat slechts in geringe mate oplosbaar is in water en methanol. Daarom is dialyse waarschijnlijk geen efficiënte methode om het medicijn uit het lichaam te verwijderen. Over het algemeen verdwijnen de symptomen binnen één tot drie dagen na stopzetting van tizanidine en toediening van een geschikte therapie. Vanwege het vergelijkbare werkingsmechanisme zijn de symptomen en de behandeling van een overdosis tizanidine vergelijkbaar met die na een overdosis clonidine. Neem voor de meest recente informatie over de behandeling van overdosering contact op met een antigifcentrum.
CONTRA-INDICATIES
Zanaflex is gecontra-indiceerd bij patiënten die krachtige remmers van CYP1A2 gebruiken, zoals fluvoxamine of ciprofloxacine [zie DRUG-INTERACTIES ].
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
Tizanidine is een centrale alfa-2-adrenerge receptoragonist en vermindert vermoedelijk spasticiteit door de presynaptische remming van motorneuronen te verhogen. De effecten van tizanidine zijn het grootst op polysynaptische routes. Men denkt dat het algehele effect van deze acties de facilitering van spinale motorneuronen vermindert.
Farmacokinetiek
Absorptie en distributie
Na orale toediening wordt tizanidine in wezen volledig geabsorbeerd. De absolute orale biologische beschikbaarheid van tizanidine is ongeveer 40% (CV = 24%), als gevolg van een uitgebreid first-pass levermetabolisme. Tizanidine wordt uitgebreid door het lichaam gedistribueerd met een gemiddeld steady-state distributievolume van 2,4 l/kg (CV = 21%) na intraveneuze toediening aan gezonde volwassen vrijwilligers. Tizanidine is voor ongeveer 30% gebonden aan plasma-eiwitten.
Verschillen tussen Zanaflex 4 mg Capsules® en Zanaflex®-tabletten
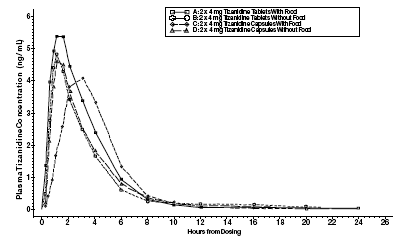
Zanaflex 2 mg Capsules® en Zanaflex® tabletten zijn bio-equivalent aan elkaar in nuchtere toestand, maar niet in gevoede toestand. Een enkele dosis van ofwel twee 4 mg tabletten of twee 4 mg capsules werd toegediend onder voedende en nuchtere omstandigheden in een open label, vier periodes, gerandomiseerde cross-over studie bij 96 menselijke vrijwilligers, van wie er 81 in aanmerking kwamen voor de statistische analyse. Na orale toediening van ofwel de tablet ofwel de capsule (in nuchtere toestand), traden de piekplasmaconcentraties van tizanidine op 1,0 uur na dosering met een halfwaardetijd van ongeveer 2 uur. Wanneer twee tabletten van 4 mg met voedsel werden toegediend, nam de gemiddelde maximale plasmaconcentratie met ongeveer 30% toe en de mediane tijd tot de piekplasmaconcentratie met 25 minuten tot 1 uur en 25 minuten. Wanneer daarentegen twee capsules van 4 mg met voedsel werden toegediend, nam de gemiddelde maximale plasmaconcentratie met 20% af en nam de mediane tijd tot de piekplasmaconcentratie met 2 tot 3 uur toe. Bijgevolg is de gemiddelde Cmax voor de capsule bij toediening met voedsel ongeveer 66% van de Cmax voor de tablet bij toediening met voedsel. Voedsel verhoogde ook de mate van absorptie van zowel de tabletten als de capsules. De stijging met de tablet (~30%) was significant groter dan met de capsule (~10%). Dientengevolge, wanneer elk met voedsel werd toegediend, was de hoeveelheid die uit de capsule werd geabsorbeerd ongeveer 80% van de hoeveelheid die uit de tablet werd geabsorbeerd. Toediening van de capsule-inhoud gestrooid op appelmoes was niet bio-equivalent aan toediening van een intacte capsule in nuchtere toestand. Toediening van de inhoud van de capsule op appelmoes resulteerde in een toename van 15%-20% in Cmax en AUC van tizanidine en een afname van 15 minuten in de mediane vertragingstijd en tijd tot piekconcentratie vergeleken met toediening van een intacte capsule tijdens vasten.
Afbeelding 1: Gemiddelde tizanidineconcentratie versus tijdprofielen voor Zanaflex-tabletten en -capsules (2 × 4 mg) onder nuchtere en gevoede omstandigheden
Metabolisme en uitscheiding
Tizanidine heeft een lineaire farmacokinetiek ten opzichte van de doses die zijn bestudeerd in klinische ontwikkeling (1-20 mg). Tizanidine heeft een halfwaardetijd van ongeveer 2,5 uur (CV=33%). Ongeveer 95% van een toegediende dosis wordt gemetaboliseerd. Het primaire cytochroom P450-iso-enzym dat betrokken is bij het tizanidinemetabolisme is CYP1A2. Van tizanidinemetabolieten is niet bekend dat ze actief zijn; hun halfwaardetijden variëren van 20 tot 40 uur.
Na enkelvoudige en meervoudige orale toediening van 14C-tizanidine werd gemiddeld 60% en 20% van de totale radioactiviteit teruggevonden in respectievelijk de urine en de feces.
Specifieke populaties
Leeftijdseffecten
Er is geen specifiek farmacokinetisch onderzoek uitgevoerd om leeftijdseffecten te onderzoeken. Uit een cross-studievergelijking van farmacokinetische gegevens na toediening van een enkelvoudige dosis van 6 mg Zanaflex 2 mg bleek dat jongere proefpersonen het geneesmiddel vier keer sneller oplosten dan oudere proefpersonen. Zanaflex 4 mg is niet onderzocht bij kinderen [zie Gebruik bij specifieke populaties ].
Leverfunctiestoornis
De invloed van leverinsufficiëntie op de farmacokinetiek van tizanidine is niet onderzocht. Omdat tizanidine uitgebreid wordt gemetaboliseerd in de lever, zou een leverfunctiestoornis naar verwachting significante effecten hebben op de farmacokinetiek van tizanidine. Zanaflex wordt niet aanbevolen bij deze patiëntenpopulatie [zie Gebruik bij specifieke populaties ].
Nierfunctiestoornis
De klaring van tizanidine is bij oudere patiënten met nierinsufficiëntie (creatinineklaring WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Geslachtseffecten
Er is geen specifiek farmacokinetisch onderzoek uitgevoerd om geslachtseffecten te onderzoeken. Retrospectieve analyse van farmacokinetische gegevens, na toediening van enkelvoudige en meervoudige doses van 4 mg Zanaflex 2 mg, toonde echter aan dat geslacht geen effect had op de farmacokinetiek van tizanidine.
Race-effecten
Farmacokinetische verschillen als gevolg van ras zijn niet onderzocht.
Geneesmiddelinteracties
CYP1A2-remmers
De interactie tussen Zanaflex en fluvoxamine of ciprofloxacine is hoogstwaarschijnlijk te wijten aan remming van CYP1A2 door fluvoxamine of ciprofloxacine. Het effect van fluvoxamine op de farmacokinetiek van een enkele dosis van 4 mg Zanaflex werd onderzocht bij 10 gezonde proefpersonen. De Cmax, AUC en halfwaardetijd van tizanidine namen respectievelijk 12-voudig, 33-voudig en 3-voudig toe. Het effect van ciprofloxacine op de farmacokinetiek van een enkele dosis van 4 mg Zanaflex 4 mg werd onderzocht bij 10 gezonde proefpersonen. De Cmax en AUC van tizanidine namen respectievelijk 7- en 10 keer toe [zie: CONTRA-INDICATIES ].
Hoewel er geen klinische studies zijn waarin de effecten van andere CYP1A2-remmers op tizanidine, andere CYP1A2-remmers, zoals zileuton, andere fluorochinolonen, antiaritmica (amiodaron, mexiletine, propafenon en verapamil), cimetidine, famotidine, orale anticonceptiva, aciclovir, kan ook leiden tot aanzienlijke verhogingen van de bloedconcentraties van tizanidine [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
In vitro-onderzoeken van cytochroom P450-iso-enzymen met gebruikmaking van menselijke levermicrosomen geven aan dat noch tizanidine, noch de belangrijkste metabolieten het metabolisme van andere geneesmiddelen die door cytochroom P450-iso-enzymen worden gemetaboliseerd, zullen beïnvloeden.
Orale anticonceptiva
Er is geen specifiek farmacokinetisch onderzoek uitgevoerd om de interactie tussen orale anticonceptiva en Zanaflex te onderzoeken. Retrospectieve analyse van populatiefarmacokinetische gegevens na toediening van enkelvoudige en meervoudige doses van 4 mg Zanaflex toonde echter aan dat vrouwen die gelijktijdig orale anticonceptiva gebruikten een 50% lagere klaring van tizanidine hadden vergeleken met vrouwen die geen orale anticonceptiva gebruikten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
paracetamol
Tizanidine vertraagde de Tmax van paracetamol met 16 minuten. Acetaminophen had geen invloed op de farmacokinetiek van tizanidine.
Alcohol
Alcohol verhoogde de AUC van tizanidine met ongeveer 20%, terwijl ook de Cmax met ongeveer 15% toenam. Dit ging gepaard met een toename van bijwerkingen van tizanidine. De CZS-onderdrukkende effecten van tizanidine en alcohol zijn additief.
Klinische studies
Het vermogen van tizanidine om verhoogde spiertonus geassocieerd met spasticiteit te verminderen, werd aangetoond in twee adequate en goed gecontroleerde onderzoeken bij patiënten met multiple sclerose of ruggenmergletsel (onderzoeken 1 en 2).
Onderzoek met enkelvoudige dosis bij patiënten met multiple sclerose met spasticiteit
In onderzoek 1 werden patiënten met multiple sclerose gerandomiseerd om enkelvoudige orale doses geneesmiddel of placebo te krijgen. Patiënten en beoordelaars waren blind voor de behandelingstoewijzing en er werd geprobeerd de kans te verkleinen dat beoordelaars indirect op de hoogte zouden worden gebracht van de behandelingstoewijzing (ze boden bijvoorbeeld geen directe zorg aan patiënten en mochten geen vragen stellen over bijwerkingen). In totaal kregen 140 patiënten placebo, 8 mg of 16 mg Zanaflex.
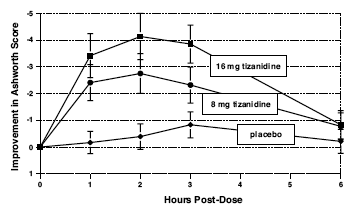
De respons werd beoordeeld door lichamelijk onderzoek; spiertonus werd beoordeeld op een 5-puntsschaal (Ashworth-score), waarbij een score van 0 werd gebruikt om de normale spiertonus te beschrijven. Een score van 1 duidde op een lichte spastische vangst, terwijl een score van 2 een meer uitgesproken spierweerstand aangaf. Een score van 3 werd gebruikt om een aanzienlijke toename van de toon te beschrijven, waardoor passieve beweging moeilijk werd. Een door spasticiteit geïmmobiliseerde spier kreeg een score van 4. Spasmetellingen werden ook verzameld.
Beoordelingen werden gemaakt op 1, 2, 3 en 6 uur na de behandeling. Een statistisch significante verlaging van de Ashworth-score voor Zanaflex 2 mg in vergelijking met placebo werd 1, 2 en 3 uur na de behandeling gedetecteerd. Afbeelding 2 hieronder toont een vergelijking van de gemiddelde verandering in spiertonus vanaf de basislijn, zoals gemeten met de Ashworth-schaal. De grootste afname van de spiertonus was 1 tot 2 uur na de behandeling. Zes uur na de behandeling was de spiertonus in de groepen van 8 en 16 mg Zanaflex 2 mg niet te onderscheiden van de spiertonus bij met placebo behandelde patiënten. Bij een bepaalde patiënt was de verbetering van de spiertonus gecorreleerd met de plasmaconcentratie. Plasmaconcentraties waren bij een bepaalde dosis variabel van patiënt tot patiënt. Hoewel 16 mg een groter effect had, kwamen bijwerkingen, waaronder hypotensie, vaker voor en waren ernstiger dan in de 8 mg-groep. Er waren geen verschillen in het aantal spasmen dat in elke groep voorkwam.
Afbeelding 2: Onderzoek met een enkele dosis - gemiddelde verandering in spiertonus vanaf baseline zoals gemeten met de Ashworth-schaal ± 95% betrouwbaarheidsinterval (een negatieve Ashworth-score betekent een verbetering van spiertonus vanaf baseline)
Onderzoek van zeven weken bij patiënten met ruggenmergletsel met spasticiteit
In een onderzoek van 7 weken (onderzoek 2) werden 118 patiënten met spasticiteit als gevolg van een dwarslaesie gerandomiseerd naar placebo of Zanaflex. Om de integriteit van de verblinding te verzekeren, werden stappen genomen die vergelijkbaar waren met die welke in de eerste studie werden genomen.
De patiënten werden gedurende 3 weken getitreerd tot een maximaal getolereerde dosis of 36 mg per dag gegeven in drie ongelijke doses (bijv. 10 mg 's morgens en' s middags en 16 mg 's avonds). De patiënten werden vervolgens gedurende 4 extra weken op hun maximaal getolereerde dosis gehouden (dwz de onderhoudsfase). Tijdens de onderhoudsfase werd de spiertonus beoordeeld op de Ashworth-schaal binnen een periode van 2,5 uur na de ochtend- of middagdosis. Het aantal spasmen overdag werd dagelijks door patiënten geregistreerd.
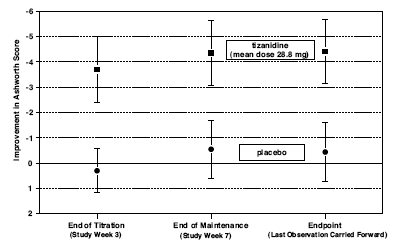
Op het eindpunt (het in het protocol gespecificeerde tijdstip van uitkomstbeoordeling) was er een statistisch significante afname in spiertonus en frequentie van spasmen in de met Zanaflex behandelde groep vergeleken met placebo. De afname van de spiertonus ging niet gepaard met een afname van de spierkracht (een wenselijk resultaat), maar leidde ook niet tot enig consistent voordeel van met Zanaflex behandelde patiënten op metingen van activiteiten van het dagelijks leven. Afbeelding 3 hieronder toont een vergelijking van de gemiddelde verandering in spiertonus vanaf de basislijn, zoals gemeten met de Ashworth-schaal.
Afbeelding 3: Onderzoek van zeven weken - gemiddelde verandering in spiertonus 0,5 - 2,5 uur na dosering zoals gemeten met de Ashworth-schaal ± 95% betrouwbaarheidsinterval (een negatieve Ashworth-score duidt op een verbetering van de spiertonus vanaf baseline)
PATIËNT INFORMATIE
Ernstige geneesmiddelinteracties
Adviseer patiënten dat ze Zanaflex niet mogen gebruiken als ze fluvoxamine of ciprofloxacine gebruiken vanwege het verhoogde risico op ernstige bijwerkingen, waaronder ernstige verlaging van de bloeddruk en sedatie. Instrueer patiënten om hun arts of apotheker te informeren wanneer ze beginnen of stoppen met het innemen van medicatie vanwege de risico's die gepaard gaan met interactie tussen Zanaflex en andere geneesmiddelen.
Zanaflex-dosering
Vertel patiënten dat ze Zanaflex 2 mg precies zoals voorgeschreven moeten innemen (consistent met of zonder voedsel) en niet tussen tabletten en capsules te wisselen. Informeer patiënten dat ze niet meer Zanaflex 2 mg mogen innemen dan voorgeschreven vanwege het risico op bijwerkingen bij enkelvoudige doses van meer dan 8 mg of totale dagelijkse doses van meer dan 36 mg. Vertel patiënten dat ze niet plotseling moeten stoppen met Zanaflex 4 mg, omdat rebound-hypertensie en tachycardie kunnen optreden.
Effecten van Zanaflex
Waarschuw patiënten dat ze hypotensie kunnen krijgen en wees voorzichtig bij het overschakelen van een liggende of zittende naar een staande positie. Vertel patiënten dat Zanaflex ervoor kan zorgen dat ze verdoofd of slaperig worden en dat ze voorzichtig moeten zijn bij het uitvoeren van activiteiten die alertheid vereisen, zoals het besturen van een voertuig of het bedienen van machines. Vertel patiënten dat de sedatie additief kan zijn wanneer Zanaflex 4 mg wordt ingenomen in combinatie met geneesmiddelen (baclofen, benzodiazepines) of stoffen (bijv. alcohol) die werken als CZS-depressiva. Herinner patiënten eraan dat als ze afhankelijk zijn van hun spasticiteit om hun houding en evenwicht in beweging te houden, of wanneer spasticiteit wordt gebruikt om een betere functie te verkrijgen, Zanaflex de spasticiteit vermindert en voorzichtigheid moet worden betracht.
