Robaxin 500mg Methocarbamol Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Robaxin 500 mg en hoe wordt het gebruikt?
Robaxin 500 mg is een receptgeneesmiddel dat wordt gebruikt voor de behandeling van de symptomen van spierspasmen veroorzaakt door pijn of letsel en tetanus. Robaxin 500 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
- Robaxin 500 mg behoort tot een klasse geneesmiddelen die skeletspierrelaxanten worden genoemd.
- Het is niet bekend of Robaxin 500 mg veilig en effectief is bij kinderen jonger dan 16 jaar.
Wat zijn de mogelijke bijwerkingen van Robaxin 500 mg?
Robaxin 500 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- trage hartslagen,
- koorts,
- rillingen,
- griep symptomen,
- toevallen (convulsies), en
- geel worden van uw huid of ogen (geelzucht)
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Robaxin zijn:
- duizeligheid,
- slaperigheid,
- misselijkheid,
- braken,
- maagklachten,
- blozen (warmte, roodheid of tintelend gevoel),
- verwardheid,
- problemen met geheugen,
- wazig zien,
- dubbel zicht,
- slaapproblemen (slapeloosheid), en
- gebrek aan coordinatie
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Robaxin. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
robaxin® / robaxin®-750 (methocarbamol-tabletten, USP), een carbamaatderivaat van guaifenesine, is een depressivum van het centrale zenuwstelsel (CZS) met kalmerende en musculoskeletale ontspannende eigenschappen.
De chemische naam van methocarbamol is 3-(2-methoxyfenoxy)-1,2propaandiol 1-carbamaat en heeft de empirische formule C11H15NO5. Het molecuulgewicht is 241,24. De structuurformule is hieronder weergegeven.
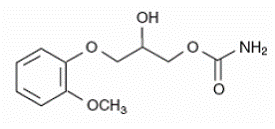
Methocarbamol is een wit poeder, slecht oplosbaar in water en chloroform, oplosbaar in alcohol (alleen bij verhitting) en propyleenglycol, en onoplosbaar in benzeen en n-hexaan.
robaxin® is verkrijgbaar als een lichtoranje, ronde, filmomhulde tablet met 500 mg methocarbamol, USP voor orale toediening. De aanwezige inactieve ingrediënten zijn maïszetmeel, FD&C Geel 6, hydroxypropylcellulose, hypromellose, magnesiumstearaat, polysorbaat 20, povidon, propyleenglycol, natriumsacharine, natriumlaurylsulfaat, natriumzetmeelglycolaat, stearinezuur, titaniumdioxide.
robaxin®-750 is verkrijgbaar als een oranje capsulevormige, filmomhulde tablet met 750 mg methocarbamol, USP voor orale toediening. Naast de inactieve ingrediënten die aanwezig zijn in robaxin®, bevat robaxin® 750 ook D&C Yellow 10.
INDICATIES
De injecteerbare vorm van methocarbamol is geïndiceerd als aanvulling op rust, fysiotherapie en andere maatregelen voor de verlichting van ongemak geassocieerd met acute, pijnlijke musculoskeletale aandoeningen. Het werkingsmechanisme van dit medicijn is niet duidelijk geïdentificeerd, maar kan verband houden met de kalmerende eigenschappen. Methocarbamol ontspant gespannen skeletspieren bij de mens niet direct.
DOSERING EN ADMINISTRATIE
Uitsluitend voor intraveneus en intramusculair gebruik. De totale dosering voor volwassenen mag niet hoger zijn dan 30 ml (3 injectieflacons) per dag gedurende meer dan 3 opeenvolgende dagen, behalve bij de behandeling van tetanus. Als de aandoening aanhoudt, kan een soortgelijke kuur worden herhaald na een medicijnvrije periode van 48 uur. Dosering en frequentie van injectie moeten gebaseerd zijn op de ernst van de aandoening die wordt behandeld en de genoteerde therapeutische respons.
Voor de verlichting van matige symptomen kan één dosis van 1 gram (één injectieflacon van 10 ml) voldoende zijn. Gewoonlijk hoeft deze injectie niet te worden herhaald, aangezien de toediening van de orale vorm de door de injectie geïnitieerde verlichting gewoonlijk zal ondersteunen. Voor de ernstigste gevallen of in postoperatieve omstandigheden waarin orale toediening niet mogelijk is, mogen extra doses van 1 gram om de 8 uur worden herhaald tot een maximum van 3 g/dag gedurende niet meer dan 3 opeenvolgende dagen.
Aanwijzingen voor intraveneus gebruik
ROBAXIN Injectable kan onverdund rechtstreeks in de ader worden toegediend met een maximale snelheid van drie ml per minuut. Het kan ook worden toegevoegd aan een intraveneuze infuus van natriumchloride-injectie (steriele isotone natriumchloride-oplossing voor parenteraal gebruik) of vijf procent dextrose-injectie (steriele 5 procent dextrose-oplossing); één injectieflacon die als een enkele dosis wordt gegeven, mag niet worden verdund tot meer dan 250 ml voor IV-infusie. NA MENGEN MET IV INFUSIEVLOEISTOFFEN NIET KOELEN. Voorzichtigheid is geboden om vasculaire extravasatie van deze hypertone oplossing te voorkomen, wat kan leiden tot tromboflebitis. Het verdient de voorkeur dat de patiënt tijdens en gedurende ten minste 10 tot 15 minuten na de injectie in een liggende positie ligt.
Aanwijzingen voor intramusculair gebruik
Wanneer de intramusculaire route is geïndiceerd, mag niet meer dan vijf ml (een halve injectieflacon) in elk gluteaal gebied worden geïnjecteerd. Indien nodig kunnen de injecties met tussenpozen van acht uur worden herhaald. Wanneer een bevredigende verlichting van de symptomen is bereikt, kan deze gewoonlijk worden gehandhaafd met tabletten.
Niet aanbevolen voor subcutane toediening.
Speciale instructies voor gebruik bij tetanus
Er is klinisch bewijs dat suggereert dat methocarbamol een gunstig effect kan hebben bij de beheersing van de neuromusculaire manifestaties van tetanus. Het vervangt echter niet de gebruikelijke procedure van debridement, tetanus-antitoxine, penicilline, tracheotomie, aandacht voor vochtbalans en ondersteunende zorg. ROBAXIN Injectable moet zo snel mogelijk aan het regime worden toegevoegd.
Voor volwassenen
Injecteer een of twee injectieflacons rechtstreeks in de slang van de eerder ingebrachte verblijfnaald. Er kan nog eens 10 ml of 20 ml aan de infuusfles worden toegevoegd, zodat in totaal maximaal 30 ml (drie injectieflacons) als startdosis wordt gegeven (zie PREVENTIEVE MAATREGELEN ). Deze procedure moet om de zes uur worden herhaald totdat de omstandigheden het inbrengen van een maagsonde mogelijk maken. Verpletterde methocarbamol-tabletten gesuspendeerd in water of zoutoplossing kunnen dan via deze buis worden toegediend. Totale dagelijkse orale doses tot 24 gram kunnen nodig zijn, afhankelijk van de respons van de patiënt.
Voor pediatrische patiënten
Een minimale aanvangsdosis van 15 mg/kg of 500 mg/m² wordt aanbevolen. Deze dosering kan indien nodig om de zes uur worden herhaald. De totale dosis mag niet hoger zijn dan 1,8 g/m² gedurende 3 opeenvolgende dagen. De onderhoudsdosering kan worden gegeven door middel van injectie in een slang of door middel van IV-infusie met een geschikte hoeveelheid vloeistof. Zie de aanwijzingen voor IV-gebruik.
HOE GELEVERD
ROBAXIN 500 mg injecteerbaar (100 mg / ml) geleverd in - 10 ml injectieflacons voor eenmalig gebruik in verpakkingen van 25 ( NDC 0641-6103-25).
Bewaren bij 20°- 25°C (68°- 77°F), excursies toegestaan tot 15°- 30°C (59°-86°F).
Niet gemaakt van natuurlijk rubberlatex.
Om VERMOEDELIJKE ONGEWENSTE REACTIES te melden, neemt u contact op met West-Ward Pharmaceuticals Corp. op 1-877-845-0689 of de FDA op 1-800-FDA-1088 of www.fda.gov/medwatch.
Bel voor productinformatie 1-877-845-0689.
Gefabriceerd door: WEST-WARD A HIKMA COMPANY, Eatontown, NJ 07724 VS. Herzien: okt 2017
BIJWERKINGEN
De volgende bijwerkingen zijn gemeld samen met de toediening van methocarbamol. Sommige voorvallen kunnen te wijten zijn aan een te hoge snelheid van intraveneuze injectie.
Lichaam als geheel: Anafylactische reactie, angioneurotisch oedeem, koorts, hoofdpijn
Cardiovasculair systeem: Bradycardie, blozen, hypotensie, syncope, tromboflebitis
In de meeste gevallen van syncope was er spontaan herstel. In andere werden epinefrine, injecteerbare steroïden en/of injecteerbare antihistaminica gebruikt om het herstel te bespoedigen.
Spijsverteringsstelsel: Dyspepsie, geelzucht (inclusief cholestatische geelzucht), misselijkheid en braken
Hemic en lymfatisch systeem: leukopenie
Immuunsysteem: Overgevoeligheidsreacties

Zenuwstelsel: Amnesie, verwardheid, dubbelzien, duizeligheid of licht gevoel in het hoofd, slaperigheid, slapeloosheid, lichte spiercoördinatie, nystagmus, sedatie, toevallen (inclusief grand mal), duizeligheid
Het optreden van convulsieve aanvallen tijdens intraveneuze toediening van methocarbamol is gemeld bij patiënten met convulsies. Het psychische trauma van de procedure kan een bijdragende factor zijn geweest. Hoewel verschillende waarnemers succes hebben gemeld bij het beëindigen van epileptiforme aanvallen met ROBAXIN Injectable, wordt toediening aan patiënten met epilepsie niet aanbevolen (zie PREVENTIEVE MAATREGELEN , Algemeen ).
Huid en speciale zintuigen: Wazig zien, conjunctivitis, verstopte neus, metaalsmaak, pruritus, huiduitslag, urticaria
Ander: Pijn en vervelling op de injectieplaats
DRUG-INTERACTIES
Zien WAARSCHUWINGEN EN VOORZORGSMAATREGELEN voor interactie met CZS-medicijnen en alcohol.
Methocarbamol kan het effect van pyridostigminebromide remmen. Daarom moet methocarbamol met voorzichtigheid worden gebruikt bij patiënten met myasthenia gravis die anticholinesterasemiddelen krijgen.
Geneesmiddel-/laboratoriumtestinteracties
Methocarbamol kan een kleurinterferentie veroorzaken in bepaalde screeningtests voor 5hydroxyindolazijnzuur (5-HIAA) met nitrosonaftholreagens en in screeningtests voor urinair vanillylmandelzuur (VMA) met behulp van de Gitlow-methode.
WAARSCHUWINGEN
Aangezien methocarbamol een algemeen CZS-onderdrukkend effect kan hebben, moeten patiënten die ROBAXIN Injectable krijgen, worden gewaarschuwd voor gecombineerde effecten met alcohol en andere CZS-onderdrukkende middelen.
Veilig gebruik van ROBAXIN Injectable is niet vastgesteld met betrekking tot mogelijke nadelige effecten op de ontwikkeling van de foetus. Er zijn zeer zeldzame meldingen geweest van foetale en aangeboren afwijkingen na in utero blootstelling aan methocarbamol. Daarom mag ROBAXIN Injectable niet worden gebruikt bij vrouwen die zwanger zijn of kunnen worden en met name tijdens de vroege zwangerschap, tenzij naar het oordeel van de arts de mogelijke voordelen opwegen tegen de mogelijke gevaren (zie PREVENTIEVE MAATREGELEN , Zwangerschap ).
Gebruik bij activiteiten die mentale alertheid vereisen
Methocarbamol kan de mentale en/of fysieke vermogens aantasten die nodig zijn voor het uitvoeren van gevaarlijke taken, zoals het bedienen van machines of het besturen van een motorvoertuig. Patiënten moeten worden gewaarschuwd voor het bedienen van machines, inclusief auto's, totdat ze er redelijk zeker van zijn dat de behandeling met methocarbamol hun vermogen om dergelijke activiteiten uit te voeren niet nadelig beïnvloedt.
PREVENTIEVE MAATREGELEN
Algemeen
Net als bij andere middelen die intraveneus of intramusculair worden toegediend, moet zorgvuldig toezicht worden gehouden op de dosis en de injectiesnelheid. De injectiesnelheid mag niet hoger zijn dan 3 ml per minuut, dwz één injectieflacon van 10 ml in ongeveer drie minuten. Aangezien ROBAXIN 500 mg injecteerbaar hypertoon is, moet vasculaire extravasatie worden vermeden. Een liggende positie verkleint de kans op nevenreacties.
Bloed dat in de spuit wordt opgezogen, vermengt zich niet met de hypertone oplossing. Dit fenomeen doet zich voor bij veel andere intraveneuze preparaten. Het bloed kan worden geïnjecteerd met methocarbamol, of de injectie kan worden gestopt wanneer de zuiger het bloed bereikt, afhankelijk van de voorkeur van de arts.
De totale dosering mag niet hoger zijn dan 30 ml (drie injectieflacons) per dag gedurende meer dan drie opeenvolgende dagen, behalve bij de behandeling van tetanus.
Voorzichtigheid is geboden bij het gebruik van de injecteerbare vorm bij patiënten met vermoede of bekende epileptische aandoeningen.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Er zijn geen langetermijnstudies uitgevoerd om het carcinogene potentieel van methocarbamol te evalueren. Er zijn geen onderzoeken uitgevoerd om het effect van methocarbamol op mutagenese of het potentieel om de vruchtbaarheid te verminderen, te beoordelen.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie C
Er zijn geen reproductiestudies bij dieren uitgevoerd met methocarbamol. Het is ook niet bekend of methocarbamol schade aan de foetus kan veroorzaken bij toediening aan een zwangere vrouw of de reproductiecapaciteit kan beïnvloeden. ROBAXIN 500 mg Injectable mag alleen aan een zwangere vrouw worden gegeven als dit duidelijk nodig is.
Veilig gebruik van ROBAXIN Injectable is niet vastgesteld met betrekking tot mogelijke nadelige effecten op de ontwikkeling van de foetus. Er zijn meldingen geweest van foetale en aangeboren afwijkingen na in utero blootstelling aan methocarbamol. Daarom mag ROBAXIN 500 mg Injectable niet worden gebruikt bij vrouwen die zwanger zijn of kunnen worden en met name tijdens de vroege zwangerschap, tenzij naar het oordeel van de arts de mogelijke voordelen opwegen tegen de mogelijke gevaren (zie WAARSCHUWINGEN ).
Moeders die borstvoeding geven
Methocarbamol en/of zijn metabolieten worden uitgescheiden in de melk van honden; het is echter niet bekend of methocarbamol of zijn metabolieten in de moedermelk worden uitgescheiden. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk, is voorzichtigheid geboden wanneer ROBAXIN 500 mg injectable wordt toegediend aan een vrouw die borstvoeding geeft.
Pediatrisch gebruik
De veiligheid en werkzaamheid van ROBAXIN Injectable bij pediatrische patiënten zijn niet vastgesteld, behalve bij tetanus. Zien DOSERING EN ADMINISTRATIE , Speciale routebeschrijving voor Gebruik bij tetanus , Voor pediatrische patiënten .
OVERDOSERING
Er is beperkte informatie beschikbaar over de acute toxiciteit van methocarbamol. Een overdosis methocarbamol gaat vaak samen met alcohol of andere CZS-depressiva en omvat de volgende symptomen: misselijkheid, slaperigheid, wazig zien, hypotensie, toevallen en coma. Tijdens postmarketingervaring zijn sterfgevallen gemeld bij een overdosis methocarbamol alleen of in de aanwezigheid van andere CZS-depressiva, alcohol of psychotrope geneesmiddelen.
Behandeling
Behandeling van overdosering omvat symptomatische en ondersteunende behandeling. Ondersteunende maatregelen omvatten het in stand houden van een adequate luchtweg, het bewaken van de urineproductie en vitale functies en indien nodig toediening van intraveneuze vloeistoffen. Het nut van hemodialyse bij de behandeling van overdosering is niet bekend.
CONTRA-INDICATIES
ROBAXIN 500 mg Injectable mag niet worden toegediend aan patiënten met bekende of vermoede nierpathologie. Deze voorzichtigheid is noodzakelijk vanwege de aanwezigheid van polyethyleenglycol 300 in het voertuig.
Van een veel grotere hoeveelheid polyethyleenglycol 300 dan aanwezig is in de aanbevolen doses ROBAXIN Injectable is bekend dat het een verhoogde reeds bestaande acidose en ureumretentie heeft bij patiënten met nierinsufficiëntie. Hoewel de hoeveelheid in dit preparaat ruim binnen de veiligheidsgrenzen ligt, is voorzichtigheid geboden bij deze contra-indicatie.
ROBAXIN Injectable is gecontra-indiceerd bij patiënten die overgevoelig zijn voor methocarbamol of voor een van de injectiecomponenten.
KLINISCHE FARMACOLOGIE
Het werkingsmechanisme van methocarbamol bij de mens is niet vastgesteld, maar kan te wijten zijn aan een algemene depressie van het CZS. Het heeft geen directe werking op het contractiele mechanisme van dwarsgestreepte spieren, de motorische eindplaat of de zenuwvezel.
Farmacokinetiek
Bij gezonde vrijwilligers varieert de plasmaklaring van methocarbamol tussen 0,20 en 0,80 l/u/kg, de gemiddelde plasma-eliminatiehalfwaardetijd tussen 1 en 2 uur en de plasma-eiwitbinding tussen 46% en 50%.
Methocarbamol wordt gemetaboliseerd via dealkylering en hydroxylering. Conjugatie van methocarbamol is ook waarschijnlijk. In wezen worden alle methocarbamolmetabolieten uitgescheiden in de urine. Kleine hoeveelheden onveranderd methocarbamol worden ook uitgescheiden in de urine.
Speciale populaties
Ouderen
De gemiddelde (± SD) eliminatiehalfwaardetijd van methocarbamol bij oudere gezonde vrijwilligers (gemiddelde (± SD) leeftijd, 69 (± 4) jaar) was licht verlengd in vergelijking met een jongere (gemiddelde (± SD) leeftijd, 53,3 (± 8,8 jaar) ) jaar), gezonde populatie (respectievelijk 1,5 (± 0,4) uur versus 1,1 (± 0,27) uur). De fractie gebonden methocarbamol was licht verlaagd bij ouderen versus jongere vrijwilligers (respectievelijk 41 tot 43% versus 46 tot 50%).
Nierfunctiestoornis
De klaring van methocarbamol bij 8 patiënten met nierinsufficiëntie die onderhoudshemodialyse ondergingen, was met ongeveer 40% verminderd in vergelijking met 17 normale proefpersonen, hoewel de gemiddelde (± SD) eliminatiehalfwaardetijd in deze twee groepen vergelijkbaar was (1,2 (± 0,6) versus 1,1 ( ± 0,3) uur, respectievelijk).
Leverfunctiestoornis
Bij 8 patiënten met cirrose secundair aan alcoholmisbruik, was de gemiddelde totale klaring van methocarbamol met ongeveer 70% verminderd in vergelijking met die verkregen bij 8 normale proefpersonen met dezelfde leeftijd en hetzelfde gewicht. De gemiddelde (± SD) eliminatiehalfwaardetijd bij de patiënten met cirrose en de normale proefpersonen was respectievelijk 3,38 (± 1,62) uur en 1,11 (± 0,27) uur. Het percentage methocarbamol gebonden aan plasma-eiwitten was verlaagd tot ongeveer 40 tot 45% vergeleken met 46 tot 50% bij de normale proefpersonen.
PATIËNT INFORMATIE
Patiënten moeten worden gewaarschuwd dat methocarbamol slaperigheid of duizeligheid kan veroorzaken, wat hun vermogen om motorvoertuigen of machines te bedienen kan verminderen.
Omdat methocarbamol een algemeen CZS-depressief effect kan hebben, moeten patiënten worden gewaarschuwd voor gecombineerde effecten met alcohol en andere CZS-depressiva.
