Microzide 25mg Hydrochlorothiazide Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Microzide 25 mg en hoe wordt het gebruikt?
Microzide is een receptgeneesmiddel dat wordt gebruikt om de symptomen van hoge bloeddruk (hypertensie) en zwelling (oedeem) te behandelen. Microzide kan alleen of in combinatie met andere medicijnen worden gebruikt.
Microzide behoort tot een klasse geneesmiddelen die diuretica, thiazide, wordt genoemd.
Het is niet bekend of Microzide veilig en effectief is bij kinderen jonger dan 6 maanden.
Wat zijn de mogelijke bijwerkingen van Microzide?
Microzide kan ernstige bijwerkingen veroorzaken, waaronder:
- duizeligheid,
- oogpijn,
- zichtproblemen,
- geel worden van de huid of ogen (geelzucht),
- bleke huid,
- gemakkelijk blauwe plekken,
- ongebruikelijke bloeding (neus, mond, vagina of rectum),
- kortademigheid,
- piepende ademhaling,
- hoesten met schuimend slijm,
- pijn op de borst,
- droge mond,
- dorst,
- slaperigheid,
- gebrek aan energie,
- rusteloosheid,
- spierpijn of zwakte,
- snelle hartslag,
- misselijkheid,
- braken,
- weinig of geen urine,
- koorts,
- keelpijn,
- zwelling in uw gezicht of tong,
- branden in je ogen, en
- huidpijn gevolgd door een rode of paarse huiduitslag die zich uitbreidt (vooral in het gezicht of bovenlichaam) en blaarvorming en vervelling veroorzaakt
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Microzide zijn:
- misselijkheid,
- braken,
- verlies van eetlust,
- diarree,
- constipatie,
- spierspasmen,
- duizeligheid, en
- hoofdpijn
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Microzide. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
MICROZIDE® (hydrochloorthiazide, USP 12,5 mg) is het 3,4-dihydroderivaat van chloorthiazide. De chemische naam is 6-chloor-3,4-dihydro-2H-1,2,4-benzothiadiazine-7-sulfonamide 1,1-dioxide. De empirische formule is C7H8CIN304S2; het molecuulgewicht is 297,74; en de structuurformule is:
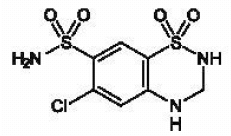
Het is een wit of praktisch wit kristallijn poeder dat enigszins oplosbaar is in water, maar goed oplosbaar is in natriumhydroxide-oplossing.
MICROZIDE (hydrochloorthiazidecapsule) wordt geleverd als capsules van 12,5 mg voor oraal gebruik.
Inactieve ingredienten : colloïdaal siliciumdioxide, maïszetmeel, lactosemonohydraat, magnesiumstearaat. Gelatinecapsules bevatten D&C Red No. 28, D&C Yellow No. 10, FD&C Blue No. 1, gelatine, titaniumdioxide. De capsules zijn bedrukt met eetbare inkt die zwart ijzeroxide bevat, D&C Yellow No. 10, FD&C Blue No. 1, FD&C Blue No. 2, FD&C Red No. 40.
INDICATIES
MICROZIDE (hydrochloorthiazidecapsule) is geïndiceerd bij de behandeling van hypertensie, hetzij als het enige therapeutische middel, hetzij in combinatie met andere antihypertensiva. In tegenstelling tot kaliumsparende combinatie-diuretica, kan MICROZIDE (hydrochloorthiazide-capsule) worden gebruikt bij die patiënten bij wie de ontwikkeling van hyperkaliëmie niet kan worden geriskeerd, inclusief patiënten die ACE-remmers gebruiken.
Gebruik tijdens de zwangerschap
Het routinematig gebruik van diuretica bij een overigens gezonde vrouw is ongepast en stelt moeder en foetus bloot aan onnodig gevaar. Diuretica voorkomen de ontwikkeling van toxemie tijdens de zwangerschap niet en er is geen bevredigend bewijs dat ze nuttig zijn bij de behandeling van ontwikkelde toxemie.
Oedeem tijdens de zwangerschap kan het gevolg zijn van pathologische oorzaken of van de fysiologische en mechanische gevolgen van zwangerschap. Diuretica zijn geïndiceerd tijdens de zwangerschap wanneer oedeem het gevolg is van pathologische oorzaken, net zoals bij afwezigheid van zwangerschap. Afhankelijk oedeem tijdens de zwangerschap als gevolg van beperking van de veneuze terugkeer door de uitgezette baarmoeder wordt goed behandeld door middel van elevatie van de onderste ledematen en het gebruik van een steunslang; het gebruik van diuretica om het intravasculaire volume te verlagen is in dit geval onlogisch en onnodig. Er is hypervolemie tijdens een normale zwangerschap die noch schadelijk is voor de foetus noch voor de moeder (bij afwezigheid van hart- en vaatziekten), maar die bij de meeste zwangere vrouwen gepaard gaat met oedeem, inclusief gegeneraliseerd oedeem. Als dit oedeem ongemak veroorzaakt, zal een verhoogde lighouding vaak verlichting bieden. In zeldzame gevallen kan dit oedeem extreem ongemak veroorzaken dat niet wordt verlicht door rust. In deze gevallen kan een korte kuur met diuretica verlichting bieden en passend zijn.
DOSERING EN ADMINISTRATIE
Voor controle van hypertensie : De aanvangsdosis voor volwassenen van MICROZIDE (hydrochloorthiazidecapsule) is één capsule die eenmaal daags wordt gegeven, alleen of in combinatie met andere antihypertensiva. Totale dagelijkse doses van meer dan 50 mg worden niet aanbevolen.
HOE GELEVERD
MICROZIDE (hydrochloorthiazidecapsule) Capsules zijn #4 Teal Opaque/Teal Opaque tweedelige harde gelatinecapsules bedrukt met MICROZIDE (hydrochloorthiazidecapsule) en 12,5 mg in zwarte inkt. Ze worden geleverd in flessen van 100 met kindveilige sluitingen ( NDC 52544-622-01).
Doseer in een strakke, lichtbestendige container zoals gedefinieerd in de USP.
Buiten bereik van kinderen houden.
Bewaren bij 20°-25°C (68°-77°F). [Zie USP-gecontroleerde kamertemperatuur.] Beschermen tegen licht, vocht, bevriezing, -20°C (-4°F). Houd de container goed gesloten.
Medische vragen richten aan: WATSON., Medical Communications PO Box 1953, Morristown, NJ 07962-1953. 800-272-5525. Gefabriceerd door: Watson Pharma Private Limited. Verna, Salcette, Goa 403 722 INDIA. Gedistribueerd door: Watson Pharma, Inc. Morristown, NJ 07962 VS. Herzien: februari 2011
BIJWERKINGEN
Er is aangetoond dat de bijwerkingen geassocieerd met hydrochloorthiazide dosisgerelateerd zijn. In gecontroleerde klinische onderzoeken waren de bijwerkingen die werden gemeld bij doses van 12,5 mg hydrochloorthiazide eenmaal daags vergelijkbaar met die van placebo. De volgende bijwerkingen zijn gemeld voor doses hydrochloorthiazide van 25 mg en hoger en zijn binnen elke categorie gerangschikt naar afnemende ernst.
Lichaam als geheel : Zwakheid.
Cardiovasculair : Hypotensie inclusief orthostatische hypotensie (kan verergeren door alcohol, barbituraten, narcotica of antihypertensiva).
Spijsvertering Pancreatitis, geelzucht (intrahepatische cholestatische geelzucht), diarree, braken, sialadenitis, krampen, constipatie, maagirritatie, misselijkheid, anorexia.
hematologisch : Aplastische anemie, agranulocytose, leukopenie, hemolytische anemie, trombocytopenie.
overgevoeligheid : Anafylactische reacties, necrotiserende angiitis (vasculitis en cutane vasculitis), ademnood inclusief pneumonitis en longoedeem, lichtgevoeligheid, koorts, urticaria, huiduitslag, purpura.
metabolisch : Elektrolytenonbalans (zie PREVENTIEVE MAATREGELEN ), hyperglykemie, glycosurie, hyperurikemie.
Musculoskeletaal : Spierspasmen.
Zenuwstelsel/Psychiatrisch : Duizeligheid, paresthesie, duizeligheid, hoofdpijn, rusteloosheid.
nier : Nierfalen, nierfunctiestoornis, interstitiële nefritis (zie: WAARSCHUWINGEN ).
Huid : Erythema multiforme inclusief Stevens-Johnson syndroom, exfoliatieve dermatitis inclusief toxische epidermale necrolyse, alopecia.
Speciale zintuigen Voorbijgaand wazig zien, xanthopsie.
Urogenitaal : Impotentie.
Wanneer de bijwerkingen matig of ernstig zijn, moet de dosering van thiazide worden verlaagd of moet de therapie worden stopgezet.
DRUG-INTERACTIES
Bij gelijktijdige toediening kunnen de volgende geneesmiddelen een wisselwerking hebben met thiazidediuretica:
Alcohol, barbituraten of verdovende middelen - potentiëring van orthostatische hypotensie kan optreden.
Antidiabetica - (orale middelen en insuline) dosisaanpassing van het antidiabetica kan nodig zijn.
Andere antihypertensiva - additief effect of potentiëring.
Colestyramine- en colestipolharsen - Colestyramine- en colestipolharsen binden het hydrochloorthiazide en verminderen de absorptie uit het maagdarmkanaal met respectievelijk 85 en 43 procent.
Corticosteroïde, ACTH - versterkte elektrolytdepletie, in het bijzonder hypokaliëmie.
Pressoramines (bijv. noradrenaline) - mogelijk verminderde respons op pressoramines, maar niet voldoende om het gebruik ervan uit te sluiten.
Skeletspierverslappers, niet-depolariserend (bijv. tubocurarine) mogelijk verhoogde respons op de spierverslapper.
Lithium - mogen over het algemeen niet samen met diuretica worden gegeven. Diuretica verminderen de renale klaring van lithium en verhogen het risico op lithiumtoxiciteit aanzienlijk. Raadpleeg de bijsluiter voor lithiumpreparaten vóór gebruik van dergelijke preparaten met MICROZIDE (hydrochloorthiazidecapsule).
Steroïdeloze ontstekingsremmers - Bij sommige patiënten kan de toediening van een niet-steroïde anti-inflammatoir middel de diuretische, natriuretische en antihypertensieve effecten van lis-, kaliumsparende en thiazidediuretica verminderen. Wanneer MICROZIDE (hydrochloorthiazidecapsule) en niet-steroïde anti-inflammatoire middelen gelijktijdig worden gebruikt, moeten de patiënten nauwlettend worden geobserveerd om te bepalen of het gewenste effect van het diureticum wordt bereikt.
Geneesmiddel-/laboratoriumtestinteracties
Thiaziden moeten worden stopgezet voordat tests voor de bijschildklierfunctie worden uitgevoerd (zie: VOORZORGSMAATREGELEN, Algemeen ).
WAARSCHUWINGEN
Diabetes en hypoglykemie: Latente diabetes mellitus kan manifest worden en diabetespatiënten die thiaziden krijgen, kunnen een aanpassing van hun insulinedosis nodig hebben.
Nierziekte: Cumulatieve effecten van de thiaziden kunnen optreden bij patiënten met een verminderde nierfunctie. Bij dergelijke patiënten kunnen thiaziden azotemie veroorzaken.
PREVENTIEVE MAATREGELEN
Elektrolyt- en vloeistofbalansstatus
In gepubliceerde onderzoeken kwam klinisch significante hypokaliëmie consequent minder vaak voor bij patiënten die 12,5 mg hydrochloorthiazide kregen dan bij patiënten die hogere doses kregen. Desalniettemin dient periodieke bepaling van serumelektrolyten te worden uitgevoerd bij patiënten die een risico lopen op het ontwikkelen van hypokaliëmie. Patiënten moeten worden geobserveerd op tekenen van vocht- of elektrolytenstoornissen, dwz hyponatriëmie, hypochloremische alkalose en hypokaliëmie en hypomagnesiëmie.
Waarschuwingssignalen of symptomen van een verstoorde vocht- en elektrolytenbalans zijn onder meer een droge mond, dorst, zwakte, lethargie, slaperigheid, rusteloosheid, spierpijn of -krampen, spiervermoeidheid, hypotensie, oligurie, tachycardie en gastro-intestinale stoornissen zoals misselijkheid en braken.
Hypokaliëmie kan optreden, vooral bij stevige diurese wanneer ernstige cirrose aanwezig is, tijdens gelijktijdig gebruik van corticosteroïden of adrenocorticotroop hormoon (ACTH) of na langdurige therapie. Interferentie met een adequate orale inname van elektrolyten zal ook bijdragen aan hypokaliëmie. Hypokaliëmie en hypomagnesiëmie kunnen ventriculaire aritmieën veroorzaken of de reactie van het hart op de toxische effecten van digitalis sensibiliseren of overdrijven. Hypokaliëmie kan worden vermeden of behandeld door kaliumsuppletie of een verhoogde inname van kaliumrijk voedsel.
Verdunningshyponatriëmie is levensbedreigend en kan optreden bij oedemateuze patiënten bij warm weer; geschikte therapie is waterbeperking in plaats van zouttoediening, behalve in zeldzame gevallen wanneer de hyponatriëmie levensbedreigend is. Bij daadwerkelijke zoutuitputting is een geschikte vervanging de therapie van keuze.
Hyperurikemie
Hyperurikemie of acute jicht kan optreden bij bepaalde patiënten die thiazidediuretica krijgen.
Verminderde leverfunctie
Thiaziden moeten met voorzichtigheid worden gebruikt bij patiënten met een verminderde leverfunctie. Ze kunnen hepatisch coma veroorzaken bij patiënten met een ernstige leverziekte.
Bijschildklierziekte
De uitscheiding van calcium wordt verminderd door thiaziden en pathologische veranderingen in de bijschildklieren, met hypercalciëmie en hypofosfatemie, zijn waargenomen bij enkele patiënten die langdurig met thiazide werden behandeld.
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Twee jaar durende voedingsstudies bij muizen en ratten, uitgevoerd onder auspiciën van het National Toxicology Program (NTP), brachten geen bewijs aan het licht van een carcinogeen potentieel van hydrochloorthiazide bij vrouwelijke muizen (in doses tot ongeveer 600 mg/kg/dag) of bij mannelijke muizen. en vrouwelijke ratten (in doses van ongeveer 100 mg/kg/dag). Het NTP vond echter dubbelzinnig bewijs voor hepatocarcinogeniteit bij mannelijke muizen. Hydrochloorthiazide was in vitro niet genotoxisch in de Ames-mutageniteitstest van Salmonella typhimurium-stammen TA 98, TA 100, TA 1535, TA 1537 en TA 1538 en in de Chinese Hamster Ovary (CHO)-test voor chromosomale afwijkingen, of in vivo in testen met muis kiemcelchromosomen, Chinese hamsterbeenmergchromosomen en het geslachtsgebonden recessieve letale eigenschapsgen van Drosophila. Positieve testresultaten werden alleen verkregen in de in vitro CHO Sister Chromatid Exchange (clastogeniciteit) en in de Mouse Lymphoma Cell (mutageniteit) assays, met gebruikmaking van concentraties van hydrochloorthiazide van 43 tot 1300 mcg/ml, en in de Aspergillus nidulans non-disjunction assay bij een niet nader gespecificeerde concentratie.
Hydrochloorthiazide had geen nadelige effecten op de vruchtbaarheid van muizen en ratten van beide geslachten in onderzoeken waarbij deze soorten via hun dieet werden blootgesteld aan doses tot respectievelijk 100 en 4 mg/kg vóór de conceptie en tijdens de dracht.
Zwangerschap
Teratogene effecten
Zwangerschap Categorie B: Studies waarin hydrochloorthiazide oraal werd toegediend aan zwangere muizen en ratten tijdens hun respectieve perioden van belangrijke organogenese in doses tot respectievelijk 3000 en 1000 mg hydrochloorthiazide/kg, leverden geen bewijs op van schade aan de foetus.
Er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Nietteratogene effecten
Thiaziden passeren de placentabarrière en komen voor in navelstrengbloed. Er is een risico op foetale of neonatale geelzucht, trombocytopenie en mogelijk andere bijwerkingen die bij volwassenen zijn opgetreden.
Moeders die borstvoeding geven
Thiaziden worden uitgescheiden in de moedermelk. Vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding geven, moet worden besloten of de borstvoeding moet worden gestaakt of dat hydrochloorthiazide moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Ouderen Gebruik
Een grotere bloeddrukdaling en een toename van bijwerkingen kan worden waargenomen bij ouderen (dwz > 65 jaar) met hydrochloorthiazide. De behandeling starten met de laagst beschikbare dosis hydrochloorthiazide (12,5 mg) wordt daarom aanbevolen. Als verdere titratie nodig is, moeten stappen van 12,5 mg worden toegepast.
OVERDOSERING
De meest voorkomende tekenen en symptomen die worden waargenomen, zijn die veroorzaakt door elektrolytdepletie (hypokaliëmie, hypochloremie, hyponatriëmie) en uitdroging als gevolg van overmatige diurese. Als ook digitalis is toegediend, kan hypokaliëmie hartritmestoornissen verergeren.
In geval van overdosering dienen symptomatische en ondersteunende maatregelen te worden genomen. Emesis moet worden opgewekt of maagspoeling worden uitgevoerd. Corrigeer uitdroging, verstoring van de elektrolytenbalans, levercoma en hypotensie volgens vastgestelde procedures. Indien nodig zuurstof of kunstmatige beademing toedienen voor ademhalingsstoornissen. De mate waarin hydrochloorthiazide wordt verwijderd door hemodialyse is niet vastgesteld.
De orale LD50 van hydrochloorthiazide is hoger dan 10 g/kg bij muizen en ratten.
CONTRA-INDICATIES
Hydrochloorthiazide is gecontra-indiceerd bij patiënten met anurie. Overgevoeligheid voor dit product of andere van sulfonamide afgeleide geneesmiddelen is ook gecontra-indiceerd.
KLINISCHE FARMACOLOGIE
Hydrochloorthiazide blokkeert de reabsorptie van natrium- en chloride-ionen en verhoogt daardoor de hoeveelheid natrium die door de distale tubulus gaat en het uitgescheiden volume water. Een deel van het extra natrium dat aan de distale tubulus wordt aangeboden, wordt daar uitgewisseld voor kalium- en waterstofionen. Bij voortgezet gebruik van hydrochloorthiazide en uitputting van natrium, hebben compenserende mechanismen de neiging om deze uitwisseling te verhogen en kunnen ze overmatig verlies van kalium-, waterstof- en chloride-ionen veroorzaken. Hydrochloorthiazide vermindert ook de uitscheiding van calcium en urinezuur, kan de uitscheiding van jodide verhogen en kan de glomerulaire filtratiesnelheid verminderen. Metabole toxiciteiten geassocieerd met overmatige elektrolytveranderingen veroorzaakt door hydrochloorthiazide bleken dosisgerelateerd te zijn.
Farmacokinetiek en metabolisme
Hydrochloorthiazide wordt goed geabsorbeerd (65% tot 75%) na orale toediening. De absorptie van hydrochloorthiazide is verminderd bij patiënten met congestief hartfalen.
Piekplasmaconcentraties worden waargenomen binnen 1 tot 5 uur na toediening en variëren van 70 tot 490 ng/ml na orale doses van 12,5 tot 100 mg. Plasmaconcentraties zijn lineair gerelateerd aan de toegediende dosis. De concentraties hydrochloorthiazide zijn 1,6 tot 1,8 keer hoger in volbloed dan in plasma. Er is gerapporteerd dat binding aan serumeiwitten ongeveer 40% tot 68% is. Er is gemeld dat de plasma-eliminatiehalfwaardetijd 6 tot 15 uur is. Hydrochloorthiazide wordt voornamelijk via de nieren geëlimineerd. Na orale doses van 12,5 tot 100 mg verschijnt 55% tot 77% van de toegediende dosis in de urine en wordt meer dan 95% van de geabsorbeerde dosis als onveranderd geneesmiddel in de urine uitgescheiden. Bij patiënten met nierziekte zijn de plasmaconcentraties van hydrochloorthiazide verhoogd en is de eliminatiehalfwaardetijd verlengd.
Wanneer MICROZIDE (hydrochloorthiazidecapsule) met voedsel wordt toegediend, wordt de biologische beschikbaarheid met 10% verminderd, wordt de maximale plasmaconcentratie met 20% verlaagd en neemt de tijd tot de maximale concentratie toe van 1,6 tot 2,9 uur.
farmacodynamiek
Aangenomen wordt dat acute antihypertensieve effecten van thiaziden het gevolg zijn van een vermindering van het bloedvolume en het hartminuutvolume, secundair aan een natriuretisch effect, hoewel ook een direct vaatverwijdend mechanisme is voorgesteld. Bij chronische toediening keert het plasmavolume terug naar normaal, maar neemt de perifere vasculaire weerstand af. Het exacte mechanisme van het antihypertensieve effect van hydrochloorthiazide is niet bekend.
Thiaziden hebben geen invloed op de normale bloeddruk. De werking begint binnen 2 uur na toediening, het piekeffect wordt waargenomen na ongeveer 4 uur en de activiteit houdt tot 24 uur aan.
Klinische studies
In een 4 weken durende dubbelblinde, placebogecontroleerde studie met parallelle groepen met 87 patiënten, hadden patiënten die MICROZIDE (hydrochloorthiazide-capsule) kregen een verlaging van de systolische en diastolische bloeddruk in zittende houding die significant groter was dan die gezien bij patiënten die placebo kregen. In gepubliceerde placebogecontroleerde onderzoeken waarin 12,5 mg hydrochloorthiazide werd vergeleken met 25 mg, behield de dosis van 12,5 mg het grootste deel van de placebogecorrigeerde bloeddrukverlaging die werd waargenomen bij 25 mg.
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de WAARSCHUWINGEN en PREVENTIEVE MAATREGELEN secties.
