Behandeling van diarree: Furosemide 40mg, 100mg Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Furosemide en hoe wordt het gebruikt?
Furosemide 40 mg is een diureticum dat een antranilzuurderivaat is dat wordt gebruikt voor de behandeling van oedeem geassocieerd met congestief hartfalen, cirrose van de lever en nierziekte, waaronder het nefrotisch syndroom. Furosemide 40 mg is bijzonder nuttig wanneer een middel met een groter diuretisch vermogen gewenst is. Furosemide 40 mg is ook geïndiceerd als aanvullende therapie bij acuut longoedeem.
Wat zijn de mogelijke bijwerkingen van Furosemide?
Furosemide 100 mg kan ernstige bijwerkingen veroorzaken, waaronder:
- meer plassen,
- dorst,
- spierkrampen,
- jeuk,
- uitslag,
- zwakheid,
- duizeligheid,
- draaierig gevoel (duizeligheid),
- diarree,
- maagpijn, en
- constipatie
WAARSCHUWING
Furosemide 100 mg tabletten zijn een krachtig diureticum dat, indien in overmatige hoeveelheden gegeven, kan leiden tot een ernstige diurese met uitputting van water en elektrolyten. Daarom is zorgvuldig medisch toezicht vereist en moeten de dosering en het doseringsschema worden aangepast aan de individuele behoeften van de patiënt. (Zie DOSERING EN TOEDIENING.)
OMSCHRIJVING
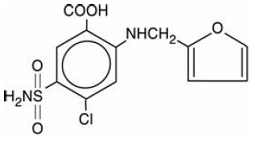
Furosemide-tabletten zijn een diureticum dat een antranilzuurderivaat is. Furosemide-tabletten voor orale toediening bevatten furosemide als het actieve ingrediënt en de volgende inactieve ingrediënten: maïszetmeel, watervrij lactose, magnesiumstearaat, gepregelatineerd zetmeel, microkristallijne cellulose, natriumzetmeelglycolaat en colloïdaal siliciumdioxide. Chemisch gezien is het 4-chloor-N-furfuryl-5-sulfamoylantranilzuur. Furosemide-tabletten zijn verkrijgbaar als witte tabletten voor orale toediening in doseringssterkten van 20, 40 en 80 mg. Furosemide 40 mg is een wit tot gebroken wit geurloos kristallijn poeder. Het is praktisch onoplosbaar in water, matig oplosbaar in alcohol, goed oplosbaar in verdunde alkalische oplossingen en onoplosbaar in verdunde zuren.
Het CAS-registratienummer is 54-31-9.
De structuurformule is als volgt:
INDICATIES
Oedeem
Furosemide 40 mg tabletten zijn geïndiceerd bij volwassenen en pediatrische patiënten voor de behandeling van oedeem geassocieerd met congestief hartfalen, cirrose van de lever en nierziekte, inclusief het nefrotisch syndroom. Furosemide 40 mg tabletten zijn bijzonder nuttig wanneer een middel met een groter diuretisch vermogen gewenst is.
Hypertensie
Orale Furosemide 40 mg tabletten kunnen bij volwassenen worden gebruikt voor de behandeling van hypertensie, alleen of in combinatie met andere antihypertensiva. Hypertensieve patiënten die niet voldoende onder controle kunnen worden gebracht met thiaziden, zullen waarschijnlijk ook niet voldoende onder controle kunnen worden gebracht met alleen Furosemide-tabletten.
DOSERING EN ADMINISTRATIE
Oedeem
De therapie moet individueel worden afgestemd op de respons van de patiënt om een maximale therapeutische respons te verkrijgen en om de minimale dosis te bepalen die nodig is om die respons te behouden.
volwassenen
De gebruikelijke aanvangsdosis van Furosemide 100 mg tabletten is 20 tot 80 mg, gegeven als een enkele dosis. Gewoonlijk volgt een snelle diurese. Indien nodig kan dezelfde dosis 6 tot 8 uur later worden toegediend of kan de dosis worden verhoogd. De dosis mag met 20 of 40 mg worden verhoogd en niet eerder dan 6 tot 8 uur na de vorige dosis worden gegeven totdat het gewenste diuretisch effect is bereikt. De individueel bepaalde enkelvoudige dosis dient dan één- of tweemaal per dag te worden gegeven (bijv. om 8 uur en 14 uur). De dosis Furosemide 100 mg tabletten kan zorgvuldig worden getitreerd tot 600 mg/dag bij patiënten met klinisch ernstige oedemateuze toestanden.
Oedeem kan het meest efficiënt en veilig worden gemobiliseerd door Furosemide 40 mg tabletten op 2 tot 4 opeenvolgende dagen per week te geven.
Wanneer doses van meer dan 80 mg/dag gedurende langere perioden worden gegeven, zijn zorgvuldige klinische observatie en laboratoriummonitoring bijzonder raadzaam. (Zien PREVENTIEVE MAATREGELEN : Laboratorium testen .)
Geriatrische patiënten
Over het algemeen moet de dosiskeuze voor de oudere patiënt voorzichtig zijn, meestal beginnend aan de lage kant van het doseringsbereik (zie: PREVENTIEVE MAATREGELEN : Geriatrisch gebruik ).
Pediatrische patiënten
De gebruikelijke aanvangsdosis van orale Furosemide 40 mg tabletten bij pediatrische patiënten is 2 mg/kg lichaamsgewicht, gegeven als een enkele dosis. Als de diuretische respons niet bevredigend is na de aanvangsdosis, mag de dosering niet eerder dan 6 tot 8 uur na de vorige dosis met 1 of 2 mg/kg worden verhoogd. Doses hoger dan 6 mg/kg lichaamsgewicht worden niet aanbevolen. Voor onderhoudstherapie bij pediatrische patiënten moet de dosis worden aangepast tot het minimale effectieve niveau.
Hypertensie
De therapie moet individueel worden afgestemd op de respons van de patiënt om een maximale therapeutische respons te verkrijgen en om de minimale dosis te bepalen die nodig is om de therapeutische respons te behouden.
volwassenen
De gebruikelijke startdosering van Furosemide 40 mg tabletten voor hypertensie is 80 mg, gewoonlijk verdeeld in 40 mg tweemaal daags. De dosering moet dan worden aangepast aan de respons. Als de respons niet bevredigend is, voeg dan andere antihypertensiva toe.
Veranderingen in bloeddruk moeten zorgvuldig worden gecontroleerd wanneer Furosemide 40 mg tabletten worden gebruikt met andere antihypertensiva, vooral tijdens de initiële behandeling. Om overmatige bloeddrukdaling te voorkomen, moet de dosering van andere middelen met ten minste 50 procent worden verlaagd wanneer Furosemide 100 mg-tabletten aan het regime worden toegevoegd. Aangezien de bloeddruk onder het versterkende effect van Furosemide-tabletten valt, kan een verdere verlaging van de dosering of zelfs stopzetting van andere antihypertensiva noodzakelijk zijn.
Geriatrische patiënten
Over het algemeen dient de dosiskeuze en dosisaanpassing voor oudere patiënten voorzichtig te zijn, gewoonlijk beginnend aan de lage kant van het doseringsbereik (zie PREVENTIEVE MAATREGELEN : Geriatrisch gebruik ).
HOE GELEVERD
Furosemide 40 mg tabletten 20 mg worden geleverd als witte tot gebroken witte, ronde, platte tabletten met afgeschuinde rand, samengeperste tabletten, met de inscriptie "EP" en "116" aan de ene kant en effen aan de andere kant in flessen van 100 ( NDC 69315-116-01), en 1000 ( NDC 69315-116-10).
Furosemide-tabellen 40 mg worden geleverd als witte tot gebroken witte, ronde, platte tabletten met afgeschuinde rand, in tweeën gedeeld, met de inscriptie "EP" boven de helft en "117" onder de helft aan de ene kant en "40" aan de andere kant in flessen van 100 ( NDC 69315-117-01) en 1000 ( NDC 69315-117-10).
Furosemide 40 mg tabletten 80 mg worden geleverd als witte tot gebroken witte, ronde, platte tabletten met afgeschuinde rand, in tweeën gedeeld, met de inscriptie "EP" boven de helft en "118" onder de helft aan de ene kant en "80" aan de andere kant in flessen van 100 ( NDC 69315-118-01) en 500 ( NDC 69315-118-05).
Opmerking: Doseer in goed gesloten, lichtbestendige containers. Blootstelling aan licht kan een lichte verkleuring veroorzaken. Verkleurde tabletten mogen niet worden verstrekt.
Voldoet aan USP-ontbindingstest 2
Bewaren bij 20° -25° C (68° -77° F) [ Zie USP-gecontroleerde kamertemperatuur ].
Gefabriceerd door: Leading Pharma, LLC, Fairfield, NJ 07004. Herzien: okt 2018
BIJWERKINGEN
Bijwerkingen zijn hieronder gecategoriseerd per orgaansysteem en gerangschikt naar afnemende ernst.
Reacties van het maagdarmstelsel
Systemische overgevoeligheidsreacties
Reacties van het centrale zenuwstelsel
Hematologische reacties
Dermatologische overgevoeligheidsreacties
Cardiovasculaire reactie
- Orthostatische hypotensie kan optreden en verergeren door alcohol, barbituraten of verdovende middelen.
- Verhoging van cholesterol- en triglyceridenserumspiegels
Andere reacties
- hyperglykemie
- glycosurie
- hyperurikemie
- spierspasmen
- zwakheid
- rusteloosheid
- urineblaas krampen
- tromboflebitis
- koorts
Wanneer de bijwerkingen matig of ernstig zijn, moet de dosering van Furosemide-tabletten worden verlaagd of de therapie worden stopgezet.
BEL UW ARTS VOOR MEDISCH ADVIES OVER BIJWERKINGEN. U KUNT BIJWERKINGEN MELDEN AAN DE FDA OP 1-800-FDA-1088 OF LEADING PHARMA, LLC OP 1-844-740-7500.
DRUG-INTERACTIES
Furosemide-tabletten kunnen het ototoxische potentieel van aminoglycoside-antibiotica verhogen, vooral bij een verminderde nierfunctie. Behalve in levensbedreigende situaties, vermijd deze combinatie.
Furosemide-tabletten mogen niet gelijktijdig met ethacrynzuur worden gebruikt vanwege de mogelijkheid van ototoxiciteit. Patiënten die gelijktijdig hoge doses salicylaten krijgen met Furosemide 100 mg tabletten, zoals bij reumatische aandoeningen, kunnen bij lagere doses salicylaattoxiciteit krijgen vanwege competitieve renale excretieplaatsen.
Er is een risico op ototoxische effecten als cisplatine en Furosemide-tabletten gelijktijdig worden gegeven. Bovendien kan de nefrotoxiciteit van nefrotoxische geneesmiddelen zoals cisplatine worden versterkt als Furosemide 40 mg-tabletten niet in lagere doses en met een positieve vochtbalans worden gegeven wanneer ze worden gebruikt om geforceerde diurese te bereiken tijdens de behandeling met cisplatine.
Furosemide 100 mg tabletten hebben de neiging het skeletspierontspannende effect van tubocurarine tegen te werken en kunnen de werking van succinylcholine versterken.
Lithium mag over het algemeen niet samen met diuretica worden gegeven, omdat ze de renale klaring van lithium verminderen en een hoog risico op lithiumtoxiciteit opleveren.
Furosemide 100 mg tabletten in combinatie met angiotensineconverterende enzymremmers of angiotensine II-receptorblokkers kunnen leiden tot ernstige hypotensie en verslechtering van de nierfunctie, waaronder nierfalen. Een onderbreking of verlaging van de dosering van Furosemide-tabletten, angiotensineconverterende enzymremmers of angiotensinereceptorblokkers kan noodzakelijk zijn.
Potentiëring vindt plaats met ganglionaire of perifere adrenerge blokkerende geneesmiddelen.
Furosemide 40 mg tabletten kunnen de arteriële gevoeligheid voor noradrenaline verminderen. Noradrenaline kan echter nog steeds effectief worden gebruikt.
Gelijktijdige toediening van sucralfaat en Furosemide-tabletten kan de natriuretische en antihypertensieve effecten van Furosemide 40 mg-tabletten verminderen. Patiënten die beide geneesmiddelen krijgen, moeten nauwlettend worden geobserveerd om te bepalen of het gewenste diuretische en/of antihypertensieve effect van Furosemide 100 mg tabletten wordt bereikt. De inname van Furosemide 100 mg-tabletten en sucralfaat moet met een tussenpoos van ten minste twee uur worden onderbroken.
In geïsoleerde gevallen kan intraveneuze toediening van Furosemide-tabletten binnen 24 uur na inname van chloraalhydraat leiden tot blozen, zweetaanvallen, rusteloosheid, misselijkheid, verhoging van de bloeddruk en tachycardie. Het gelijktijdig gebruik van Furosemide 40 mg tabletten met chloraalhydraat wordt daarom niet aanbevolen.
Fenytoïne interfereert rechtstreeks met de nierwerking van Furosemide-tabletten. Er zijn aanwijzingen dat behandeling met fenytoïne leidt tot een afname van de intestinale absorptie van Furosemide 100 mg-tabletten en bijgevolg tot lagere piekserumconcentraties van furosemide 40 mg.
Methotrexaat en andere geneesmiddelen die, zoals Furosemide-tabletten, een aanzienlijke renale tubulaire secretie ondergaan, kunnen het effect van Furosemide-tabletten verminderen. Omgekeerd kan Furosemide 100 mg tabletten de renale eliminatie verminderen van andere geneesmiddelen die tubulaire secretie ondergaan. Behandeling met hoge doses van zowel Furosemide 100 mg-tabletten als deze andere geneesmiddelen kan leiden tot verhoogde serumspiegels van deze geneesmiddelen en kan hun toxiciteit en de toxiciteit van Furosemide 40 mg-tabletten versterken.
Furosemide 100 mg tabletten kunnen het risico op door cefalosporine geïnduceerde nefrotoxiciteit verhogen, zelfs bij een lichte of voorbijgaande nierfunctiestoornis.
Gelijktijdig gebruik van ciclosporine en furosemide-tabletten is geassocieerd met een verhoogd risico op jichtartritis secundair aan door Furosemide-tabletten geïnduceerde hyperurekemie en ciclosporine-stoornis van de renale uraatuitscheiding. Eén onderzoek bij zes proefpersonen toonde aan dat de combinatie van furosemide 100 mg en acetylsalicylzuur tijdelijk de creatinineklaring verminderde bij patiënten met chronische nierinsufficiëntie. Er zijn casusrapporten van patiënten die verhoogde BUN-, serumcreatinine- en serumkaliumspiegels en gewichtstoename ontwikkelden wanneer furosemide 100 mg werd gebruikt in combinatie met NSAID's.
Literatuurrapporten geven aan dat gelijktijdige toediening van indomethacine de natriuretische en antihypertensieve effecten van Furosemide-tabletten (furesomide) bij sommige patiënten kan verminderen door remming van de prostaglandinesynthese. Indomethacine kan ook de plasmareninespiegels, de aldosteronuitscheiding en de evaluatie van het renineprofiel beïnvloeden. Patiënten die zowel indomethacine als Furosemide-tabletten krijgen, moeten nauwlettend worden geobserveerd om te bepalen of het gewenste diuretische en/of antihypertensieve effect van Furosemide 40 mg-tabletten wordt bereikt.
WAARSCHUWINGEN
Bij patiënten met levercirrose en ascites kan de behandeling met Furosemide 100 mg tabletten het best in het ziekenhuis worden gestart. Bij levercoma en in toestanden van elektrolytdepletie mag de therapie niet worden ingesteld totdat de basisconditie is verbeterd. Plotselinge veranderingen van de vocht- en elektrolytenbalans bij patiënten met cirrose kunnen levercoma veroorzaken; daarom is strikte observatie noodzakelijk tijdens de periode van diurese. Aanvullende kaliumchloride en, indien nodig, een aldosteronantagonist zijn nuttig bij het voorkomen van hypokaliëmie en metabole alkalose.
Als tijdens de behandeling van ernstige progressieve nierziekte toenemende azotemie en oligurie optreden, moet de behandeling met Furosemide-tabletten worden stopgezet.

Gevallen van tinnitus en reversibele of onomkeerbare slechthorendheid en doofheid zijn gemeld. Rapporten geven gewoonlijk aan dat ototoxiciteit van Furosemide-tabletten gepaard gaat met snelle injectie, ernstige nierinsufficiëntie, het gebruik van hogere dan aanbevolen doses, hypoproteïnemie of gelijktijdige behandeling met aminoglycoside-antibiotica, ethacrynzuur of andere ototoxische geneesmiddelen. Als de arts ervoor kiest om een hoge dosis parenterale therapie te gebruiken, wordt een gecontroleerde intraveneuze infusie aanbevolen (voor volwassenen is een infusiesnelheid van niet meer dan 4 mg Furosemide 100 mg tabletten per minuut gebruikt). (Zien PREVENTIEVE MAATREGELEN : DRUG-INTERACTIES )
PREVENTIEVE MAATREGELEN
Algemeen
Overmatige diurese kan uitdroging en afname van het bloedvolume met circulatoire collaps en mogelijk vasculaire trombose en embolie veroorzaken, vooral bij oudere patiënten. Zoals met elk effectief diureticum, kan elektrolytdepletie optreden tijdens behandeling met Furosemide-tabletten, vooral bij patiënten die hogere doses krijgen en een beperkte zoutinname. Hypokaliëmie kan optreden met Furosemide 40 mg tabletten, vooral bij stevige diurese, onvoldoende orale inname van elektrolyten, wanneer cirrose aanwezig is, of bij gelijktijdig gebruik van corticosteroïden, ACTH, zoethout in grote hoeveelheden of langdurig gebruik van laxeermiddelen. Digitalis-therapie kan de metabole effecten van hypokaliëmie, met name myocardiale effecten, versterken.
Alle patiënten die met Furosemide-tabletten worden behandeld, moeten worden geobserveerd op deze tekenen of symptomen van een verstoorde vocht- of elektrolytenbalans (hyponatriëmie, hypochloremische alkalose, hypokaliëmie, hypomagnesiëmie of hypocalciëmie): droge mond, dorst, zwakte, lethargie, slaperigheid, rusteloosheid, spierpijn of krampen , spiervermoeidheid, hypotensie, oligurie, tachycardie, aritmie of gastro-intestinale stoornissen zoals misselijkheid en braken. Verhogingen van de bloedglucose en veranderingen in glucosetolerantietests (met afwijkingen van de nuchtere en 2-uurs postprandiale suiker) zijn waargenomen, en zelden is precipitatie van diabetes mellitus gemeld.
Bij patiënten met ernstige symptomen van urineretentie (vanwege blaasledigingsstoornissen, prostaathyperplasie, urethravernauwing), kan de toediening van furosemide 100 mg acute urineretentie veroorzaken die verband houdt met verhoogde productie en retentie van urine. Deze patiënten moeten dus zorgvuldig worden gecontroleerd, vooral tijdens de beginfase van de behandeling.
Bij patiënten met een hoog risico op nefropathie met radiocontrast kan Furosemide 100 mg tabletten leiden tot een hogere incidentie van verslechtering van de nierfunctie na toediening van radiocontrast in vergelijking met patiënten met een hoog risico die alleen intraveneuze hydratatie kregen voordat ze radiocontrast kregen.
Bij patiënten met hypoproteïnemie (bijv. geassocieerd met nefrotisch syndroom) kan het effect van Furosemide-tabletten worden verzwakt en de ototoxiciteit ervan worden versterkt.
Asymptomatische hyperurikemie kan optreden en jicht kan in zeldzame gevallen worden versneld.
Patiënten die allergisch zijn voor sulfonamiden kunnen ook allergisch zijn voor Furosemide 40 mg tabletten. De mogelijkheid bestaat van verergering of activering van systemische lupus erythematodes.
Zoals met veel andere geneesmiddelen, moeten patiënten regelmatig worden geobserveerd op het mogelijke optreden van bloeddyscrasieën, lever- of nierbeschadiging of andere idiosyncratische reacties.
Laboratorium testen
Serumelektrolyten (met name kalium), CO2, creatinine en BUN moeten regelmatig worden bepaald tijdens de eerste paar maanden van de behandeling met Furosemide 100 mg tabletten en daarna periodiek. Serum- en urine-elektrolytbepalingen zijn met name belangrijk wanneer de patiënt hevig braakt of parenterale vloeistoffen krijgt. Afwijkingen moeten worden gecorrigeerd of het medicijn moet tijdelijk worden stopgezet. Andere medicijnen kunnen ook de serumelektrolyten beïnvloeden.
Omkeerbare verhogingen van BUN kunnen optreden en gaan gepaard met uitdroging, wat moet worden vermeden, vooral bij patiënten met nierinsufficiëntie.
Urine en bloedglucose moeten periodiek worden gecontroleerd bij diabetici die Furosemide-tabletten krijgen, zelfs bij diegenen die verdacht worden van latente diabetes.
Furosemide-tabletten kunnen de serumspiegels van calcium (er zijn zeldzame gevallen van tetanie gemeld) en magnesium verlagen. Dienovereenkomstig moeten de serumspiegels van deze elektrolyten periodiek worden bepaald.
Bij te vroeg geboren baby's kunnen Furosemide-tabletten nefrocalcinose/nefrolithiase veroorzaken, daarom moet de nierfunctie worden gecontroleerd en moet er echografie van de nieren worden uitgevoerd. (zien PREVENTIEVE MAATREGELEN : Pediatrisch gebruik )
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Furosemide werd getest op carcinogeniteit door orale toediening bij één muizenstam en één rattenstam. Een kleine maar significant verhoogde incidentie van borstkliercarcinomen trad op bij vrouwelijke muizen bij een dosis van 17,5 maal de maximale dosis voor de mens van 600 mg. Er waren marginale verhogingen van soms voorkomende tumoren bij mannelijke ratten bij een dosis van 15 mg/kg (iets hoger dan de maximale dosis voor de mens), maar niet bij 30 mg/kg.
Furosemide had geen mutagene activiteit in verschillende stammen van Salmonella typhimurium wanneer getest in aanwezigheid of afwezigheid van een in vitro metabool activeringssysteem, en twijfelachtig positief voor genmutatie in muislymfoomcellen in aanwezigheid van rattenlever S9 bij de hoogste geteste dosis. Furosemide induceerde in vitro geen uitwisseling van zusterchromatiden in menselijke cellen, maar andere onderzoeken naar chromosomale afwijkingen in menselijke cellen in vitro gaven tegenstrijdige resultaten. In Chinese hamstercellen veroorzaakte het chromosomale schade, maar was twijfelachtig positief voor de uitwisseling van zusterchromatiden. Studies naar de inductie door furosemide van chromosomale afwijkingen bij muizen waren niet overtuigend. De urine van ratten die met dit geneesmiddel werden behandeld, induceerde geen genconversie in Saccharomyces cerevisiae.
Furosemide-tabletten (furosemide) veroorzaakten geen verslechtering van de vruchtbaarheid bij mannelijke of vrouwelijke ratten, bij 100 mg/kg/dag (de maximale effectieve diureticumdosis bij ratten en 8 maal de maximale humane dosis van 600 mg/dag).
Zwangerschap
Zwangerschap Categorie C
Van furosemide is aangetoond dat het onverklaarbare maternale sterfte en abortus veroorzaakt bij konijnen bij 2, 4 en 8 keer de maximaal aanbevolen dosis voor de mens. Er zijn geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Furosemide 100 mg tabletten mogen alleen tijdens de zwangerschap worden gebruikt als het mogelijke voordeel opweegt tegen het mogelijke risico voor de foetus.
Behandeling tijdens de zwangerschap vereist monitoring van de groei van de foetus vanwege het potentieel voor hogere geboortegewichten.
De effecten van furosemide 40 mg op de embryonale en foetale ontwikkeling en op drachtige moederdieren werden onderzocht bij muizen, ratten en konijnen.
Furosemide 100 mg veroorzaakte onverklaarbare maternale sterfte en abortus bij konijnen bij de laagste dosis van 25 mg/kg (2 maal de maximale aanbevolen dosis voor de mens van 600 mg/dag). In een ander onderzoek veroorzaakte een dosis van 50 mg/kg (4 maal de maximaal aanbevolen dosis voor de mens van 600 mg/dag) ook moedersterfte en abortussen bij toediening aan konijnen tussen dag 12 en 17 van de dracht. In een derde studie overleefde geen van de drachtige konijnen een dosis van 100 mg/kg. Gegevens uit de bovenstaande onderzoeken wijzen op foetale letaliteit die vooraf kan gaan aan maternale sterfte.
De resultaten van de muizenstudie en een van de drie konijnenstudies toonden ook een verhoogde incidentie en ernst van hydronefrose (uitzetting van het nierbekken en, in sommige gevallen, van de urineleiders) bij foetussen afkomstig van de behandelde moederdieren in vergelijking met de incidentie bij foetussen uit de controlegroep.
Gebruik in specifieke populaties
Moeders die borstvoeding geven
Omdat het in de moedermelk voorkomt, is voorzichtigheid geboden wanneer Furosemide wordt toegediend aan een moeder die borstvoeding geeft.
Furosemide kan de lactatie remmen.
Pediatrisch gebruik
Bij premature baby's kunnen Furosemide-tabletten nefrocalcinose/nefrolithiase veroorzaken.
Nefrocalcinose/nefrolithiase is ook waargenomen bij kinderen jonger dan 4 jaar zonder voorgeschiedenis van prematuriteit die chronisch werden behandeld met Furosemide 100 mg tabletten. Bij pediatrische patiënten die Furosemide 40 mg tabletten krijgen, dient de nierfunctie te worden gecontroleerd en dient nierechografie te worden overwogen.
Als Furosemide 40 mg tabletten worden toegediend aan premature baby's tijdens de eerste levensweken, kan dit het risico op persistentie van open ductus arteriosus verhogen.
Geriatrisch gebruik
Gecontroleerde klinische onderzoeken met Furosemide 100 mg-tabletten omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor de oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
Van dit geneesmiddel is bekend dat het grotendeels door de nieren wordt uitgescheiden en het risico op toxische reacties op dit geneesmiddel kan groter zijn bij patiënten met een verminderde nierfunctie. Omdat oudere patiënten een grotere kans hebben op een verminderde nierfunctie, moet voorzichtigheid worden betracht bij het kiezen van de dosering en kan het nuttig zijn om de nierfunctie te controleren. (Zie PREVENTIEVE MAATREGELEN : Algemeen en DOSERING EN ADMINISTRATIE .)
OVERDOSERING
De belangrijkste tekenen en symptomen van overdosering met Furosemide zijn uitdroging, afname van het bloedvolume, hypotensie, verstoorde elektrolytenbalans, hypokaliëmie en hypochloremische alkalose, en zijn uitbreidingen van de diuretische werking ervan.
De acute toxiciteit van Furosemide is vastgesteld bij muizen, ratten en honden. In alle drie overschreed de orale LD50 1000 mg/kg lichaamsgewicht, terwijl de intraveneuze LD50 varieerde van 300 tot 680 mg/kg. De acute intragastrische toxiciteit bij neonatale ratten is 7 tot 10 keer die van volwassen ratten.
De concentratie van Furosemide 100 mg tabletten in biologische vloeistoffen geassocieerd met toxiciteit of overlijden is niet bekend.
Behandeling van overdosering is ondersteunend en bestaat uit het vervangen van overmatig vocht- en elektrolytenverlies. Serumelektrolyten, kooldioxidegehalte en bloeddruk moeten regelmatig worden bepaald. Adequate drainage moet worden verzekerd bij patiënten met obstructie van de urineblaasuitgang (zoals prostaathypertrofie).
Hemodialyse versnelt de eliminatie van furosemide 100 mg niet.
CONTRA-INDICATIES
Furosemide 40 mg tabletten zijn gecontra-indiceerd bij patiënten met anurie en bij patiënten met een voorgeschiedenis van overgevoeligheid voor furosemide.
KLINISCHE FARMACOLOGIE
Bij onderzoek naar het werkingsmechanisme van Furosemide 40 mg tabletten is gebruik gemaakt van micropunctuuronderzoeken bij ratten, stopflow-experimenten bij honden en verschillende klaringsonderzoeken bij zowel mensen als proefdieren. Er is aangetoond dat Furosemide-tabletten voornamelijk de absorptie van natrium en chloride remt, niet alleen in de proximale en distale tubuli maar ook in de lus van Henle. De hoge mate van werkzaamheid is grotendeels te danken aan de unieke werkingsplaats. De werking op de distale tubulus is onafhankelijk van enig remmend effect op koolzuuranhydrase en aldosteron.
Recent bewijs suggereert dat furosemideglucuronide het enige of op zijn minst het belangrijkste biotransformatieproduct is van furosemide 100 mg bij de mens. Furosemide 40 mg wordt in hoge mate gebonden aan plasma-eiwitten, voornamelijk aan albumine. Plasmaconcentraties variërend van 1 tot 400 g/ml zijn voor 91 tot 99% gebonden bij gezonde personen. De ongebonden fractie is gemiddeld 2,3 tot 4,1% bij therapeutische concentraties.
Het begin van diurese na orale toediening is binnen 1 uur. Het piekeffect treedt op binnen het eerste of tweede uur. De duur van het diuretisch effect is 6 tot 8 uur.
Bij nuchtere normale mannen is de gemiddelde biologische beschikbaarheid van furosemide 40 mg uit Furosemide-tabletten en Furosemide 40 mg orale oplossing respectievelijk 64% en 60% van die van een intraveneuze injectie van het geneesmiddel. Hoewel furosemide 100 mg sneller wordt geabsorbeerd uit de drank (50 minuten) dan uit de tablet (87 minuten), verschillen de piekplasmaspiegels en de oppervlakte onder de plasmaconcentratie-tijdcurves niet significant. De piekplasmaconcentraties nemen toe met toenemende dosis, maar de tijd tot de piek verschilt niet tussen de doses. De terminale halfwaardetijd van furosemide is ongeveer 2 uur.
Aanzienlijk meer furosemide 100 mg wordt uitgescheiden in de urine na de IV-injectie dan na de tablet of orale oplossing. Er zijn geen significante verschillen tussen de twee orale formuleringen in de hoeveelheid onveranderd geneesmiddel die in de urine wordt uitgescheiden.
geriatrische populatie
De binding van furosemide 40 mg aan albumine kan verminderd zijn bij oudere patiënten. Furosemide 40 mg wordt voornamelijk onveranderd in de urine uitgescheiden. De renale klaring van furosemide na intraveneuze toediening bij oudere gezonde mannelijke proefpersonen (60-70 jaar) is statistisch significant kleiner dan bij jongere gezonde mannelijke proefpersonen (20-35 jaar). Het aanvankelijke diuretisch effect van furosemide bij oudere proefpersonen is verminderd in vergelijking met jongere proefpersonen. (Zien PREVENTIEVE MAATREGELEN : Geriatrisch gebruik .)
PATIËNT INFORMATIE
Patiënten die Furosemide 40 mg tabletten krijgen, moeten erop worden gewezen dat ze symptomen kunnen krijgen van overmatig vocht- en/of elektrolytenverlies. De orthostatische hypotensie die soms optreedt, kan gewoonlijk worden behandeld door langzaam op te staan. Kaliumsupplementen en/of dieetmaatregelen kunnen nodig zijn om hypokaliëmie onder controle te houden of te voorkomen.
Patiënten met diabetes mellitus moeten worden verteld dat furosemide de bloedglucosespiegels kan verhogen en daardoor de urineglucosetests kan beïnvloeden. De huid van sommige patiënten kan gevoeliger zijn voor de effecten van zonlicht tijdens het gebruik van furosemide.
Hypertensieve patiënten moeten medicijnen vermijden die de bloeddruk kunnen verhogen, inclusief vrij verkrijgbare producten voor onderdrukking van de eetlust en verkoudheidssymptomen.
