Dostinex 0.25mg, 0.5mg Cabergoline Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Dostinex 0,25 mg en hoe wordt het gebruikt?
Dostinex (cabergoline) is een dopaminereceptorantagonist die wordt gebruikt voor de behandeling van een hormonale disbalans waarbij te veel prolactine in het bloed aanwezig is (ook hyperprolactinemie genoemd).
Wat zijn bijwerkingen van Dostinex?
Vaak voorkomende bijwerkingen van Dostinex 0,25 mg zijn onder meer:
- misselijkheid,
- braken,
- maagklachten of pijn,
- indigestie,
- constipatie,
- gas,
- duizeligheid,
- ronddraaiend gevoel,
- duizeligheid,
- slaperigheid,
- nervositeit,
- vermoeidheid,
- hoofdpijn,
- depressieve bui,
- opvliegers,
- gevoelloosheid of tintelend gevoel, of
- droge mond.
Vertel het uw arts als u zeldzame maar ernstige bijwerkingen van Dostinex ervaart, waaronder:
- kortademigheid,
- aanhoudende hoest,
- gezwollen enkels of voeten,
- ongebruikelijke vermoeidheid,
- mentale / stemmingswisselingen (zoals nervositeit),
- ongewone sterke driften (zoals meer gokken, verhoogde seksuele driften),
- visie verandert,
- pijnlijke menstruatie, of
- Borstpijn.
OMSCHRIJVING
DOSTINEX-tabletten bevatten cabergoline, een dopaminereceptoragonist. De chemische naam voor cabergoline is 1-[(6-allylergolin-8β-yl)-carbonyl]-1-[3-(dimethylamino)propyl]-3-ethylureum. De empirische formule is C26H37N5O2 en het molecuulgewicht is 451,62. De structuurformule is als volgt:
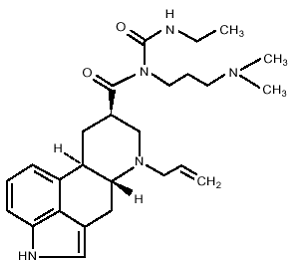
Cabergoline is een wit poeder dat oplosbaar is in ethylalcohol, chloroform en N,N-dimethylformamide (DMF); slecht oplosbaar in 0,1 N zoutzuur; zeer slecht oplosbaar in n-hexaan; en onoplosbaar in water.
DOSTINEX 0,25 mg tabletten, voor orale toediening, bevatten 0,5 mg cabergoline. Inactieve ingrediënten bestaan uit leucine, USP en lactose, NF.
INDICATIES
DOSTINEX 0,5 mg tabletten zijn geïndiceerd voor de behandeling van hyperprolactinemische aandoeningen, hetzij idiopathisch, hetzij veroorzaakt door hypofyseadenomen.
DOSERING EN ADMINISTRATIE
De aanbevolen dosering van DOSTINEX 0,25 mg tabletten voor het starten van de therapie is 0,25 mg tweemaal per week. De dosering kan worden verhoogd met 0,25 mg tweemaal per week tot een dosering van 1 mg tweemaal per week, afhankelijk van de serumprolactinespiegel van de patiënt. Alvorens met de behandeling te beginnen, moet cardiovasculaire evaluatie worden uitgevoerd en moet echocardiografie worden overwogen om te beoordelen op hartklepaandoeningen.
Doseringsverhogingen mogen niet sneller dan om de 4 weken plaatsvinden, zodat de arts de reactie van de patiënt op elk doseringsniveau kan beoordelen. Als de patiënt niet adequaat reageert en er geen bijkomend voordeel wordt waargenomen bij hogere doses, moet de laagste dosis worden gebruikt die maximale respons oplevert en moeten andere therapeutische benaderingen worden overwogen. Patiënten die langdurig worden behandeld met DOSTINEX 0,25 mg dienen periodiek hun hartstatus te beoordelen en echocardiografie dient te worden overwogen.
Nadat een normale serumprolactinespiegel 6 maanden is gehandhaafd, kan DOSTINEX 0,5 mg worden stopgezet, met periodieke controle van de serumprolactinespiegel om te bepalen of en wanneer de behandeling met DOSTINEX moet worden hervat. De duurzaamheid van de werkzaamheid na 24 maanden behandeling met DOSTINEX is niet vastgesteld.
HOE GELEVERD
DOSTINEX-tabletten zijn witte, capsulevormige tabletten met een breukgleuf die 0,5 mg cabergoline bevatten. Elke tablet heeft een breukstreep aan één kant en heeft de letter P en de letter U aan weerszijden van de breukstreep. De andere kant van de tablet is gegraveerd met het nummer 700.
DOSTINEX is als volgt verkrijgbaar:
Flessen van 8 tabletten NDC 0013-7001-12
Opslag
Bewaren bij een gecontroleerde kamertemperatuur van 20 ° tot 25 ° C (68 ° tot 77 ° F) [zie USP ].
Het label van dit product is mogelijk bijgewerkt. Ga voor actuele volledige voorschrijfinformatie naar www.pfizer.com
Gedistribueerd door: Pharmacia & Upjohn Company Division van Pfizer Inc., NY, NY 10017. Herzien: september 2014
BIJWERKINGEN
De veiligheid van DOSTINEX 0,25 mg tabletten is geëvalueerd bij meer dan 900 patiënten met hyperprolactinemische aandoeningen. De meeste bijwerkingen waren licht of matig van ernst.
In een 4 weken durende, dubbelblinde, placebogecontroleerde studie bestond de behandeling uit placebo of cabergoline in vaste doses van 0,125, 0,5, 0,75 of 1,0 mg tweemaal per week. Doses werden gehalveerd tijdens de eerste week. Aangezien een mogelijk dosisgerelateerd effect alleen voor misselijkheid werd waargenomen, zijn de vier cabergoline-behandelingsgroepen gecombineerd. De incidentie van de meest voorkomende bijwerkingen tijdens het placebogecontroleerde onderzoek wordt weergegeven in de volgende tabel.
Incidentie van gemelde bijwerkingen tijdens de 4-weekse, dubbelblinde, placebo-gecontroleerde studie
In de 8 weken durende, dubbelblinde periode van de vergelijkende studie met bromocriptine, werd DOSTINEX (in een dosis van 0,5 mg tweemaal per week) stopgezet vanwege een bijwerking bij 4 van de 221 patiënten (2%) terwijl bromocriptine (in een dosis van 2,5 mg tweemaal daags) werd stopgezet bij 14 van de 231 patiënten (6%). De meest voorkomende redenen voor stopzetting van DOSTINEX waren hoofdpijn, misselijkheid en braken (respectievelijk 3, 2 en 2 patiënten); de meest voorkomende redenen om te stoppen met bromocriptine waren misselijkheid, braken, hoofdpijn en duizeligheid of vertigo (respectievelijk 10, 3, 3 en 3 patiënten). De incidentie van de meest voorkomende bijwerkingen tijdens het dubbelblinde deel van het vergelijkende onderzoek met bromocriptine wordt weergegeven in de volgende tabel.
Incidentie van gemelde bijwerkingen tijdens de 8 weken durende, dubbelblinde periode van het vergelijkende onderzoek met bromocriptine
Andere bijwerkingen die werden gemeld met een incidentie van
Lichaam als geheel: gezichtsoedeem, griepachtige symptomen, malaise
Cardiovasculair systeem: hypotensie, syncope, hartkloppingen
Spijsverteringsstelsel: droge mond, winderigheid, diarree, anorexia
Metabolisch en voedingssysteem: gewichtsverlies, gewichtstoename
Zenuwstelsel: slaperigheid, nervositeit, paresthesie, slapeloosheid, angst
Ademhalingssysteem: verstopte neus, epistaxis
Huid en aanhangsels: acne, jeuk
Speciale zintuigen: abnormaal zicht
Urogenitaal systeem: dysmenorroe, verhoogd libido
De veiligheid van cabergoline is geëvalueerd bij ongeveer 1.200 patiënten met de ziekte van Parkinson in gecontroleerde en ongecontroleerde onderzoeken bij doseringen tot 11,5 mg/dag, wat de maximaal aanbevolen dosering van cabergoline voor hyperprolactinemische aandoeningen ruimschoots overschrijdt. Naast de bijwerkingen die optraden bij patiënten met hyperprolactinemische aandoeningen, waren de meest voorkomende bijwerkingen bij patiënten met de ziekte van Parkinson dyskinesie, hallucinaties, verwardheid en perifeer oedeem. Hartfalen, pleurale effusie, longfibrose en maag- of darmzweren kwamen zelden voor. Er is één geval van constrictieve pericarditis gemeld.
Postmarketing-surveillancegegevens
De volgende gebeurtenissen zijn gemeld in verband met DOSTINEX: cardiale valvulopathie en extracardiale fibrotische reacties (zie WAARSCHUWINGEN , Cardiale valvulopathie en extracardiale fibrotische reacties ).
Andere voorvallen zijn gemeld in verband met cabergoline: hyperseksualiteit, verhoogd libido en pathologisch gokken (zie: PREVENTIEVE MAATREGELEN , Psychiatrisch ). Bovendien zijn gevallen van alopecia, agressie en psychotische stoornis gemeld bij patiënten die DOSTINEX gebruiken. Sommige van deze meldingen waren bij patiënten die eerder bijwerkingen hebben gehad op dopamine-agonistproducten.
DRUG-INTERACTIES
DOSTINEX 0,5 mg mag niet gelijktijdig worden toegediend met D-antagonisten, zoals fenothiazinen, butyrofenonen, thioxanthenen of metoclopramide.
WAARSCHUWINGEN
Zwangerschap
Dopamine-agonisten mogen in het algemeen niet worden gebruikt bij patiënten met door zwangerschap veroorzaakte hypertensie, bijvoorbeeld pre-eclampsie, eclampsie en postpartum hypertensie, tenzij het mogelijke voordeel opweegt tegen het mogelijke risico.
Fibrotische complicaties
Cardiale valvulopathie
Alle patiënten moeten een cardiovasculaire evaluatie ondergaan, inclusief echocardiogram, om de mogelijke aanwezigheid van hartklepaandoeningen te beoordelen. Als een klepaandoening wordt vastgesteld, mag de patiënt niet met DOSTINEX worden behandeld. (Zien CONTRA-INDICATIES ) Postmarketinggevallen van hartvalvulopathie zijn gemeld bij patiënten die DOSTINEX kregen. Deze gevallen zijn over het algemeen opgetreden tijdens toediening van hoge doses DOSTINEX (> 2 mg/dag) voor de behandeling van de ziekte van Parkinson. Gevallen van hartvalvulopathie zijn ook gemeld bij patiënten die lagere doses DOSTINEX kregen voor de behandeling van hyperprolactinemische aandoeningen.
Er werd een retrospectief cohortonderzoek in meerdere landen uitgevoerd waarbij gebruik werd gemaakt van huisartsgegevens en registratiesystemen in het VK, Italië en Nederland om het verband te beoordelen tussen nieuw gebruik van dopamine-agonisten, waaronder cabergoline (n = 27.812) voor de ziekte van Parkinson en hyperprolactinemie en hartfalen. valvulaire regurgitatie (CVR), andere fibrosen en andere cardiopulmonale voorvallen gedurende maximaal 12 jaar follow-up. In deze studie werd het gebruik van cabergoline bij personen met de ziekte van Parkinson geassocieerd met een verhoogd risico op CVR in vergelijking met niet-ergot-afgeleide dopamine-agonisten (DA's) en levodopa [incidentiepercentage (IR) per 10.000 persoonsjaren van 68,1 (95 % betrouwbaarheidsinterval (BI): 37,2–115.3) voor cabergoline vs. 10,0 (95% BI: 5,2–19,4) voor niet-moederkoren DA's en 11,3 (95% BI: 7,2 –17,0) voor levodopa]. In de onderzoeksanalyse die beperkt was tot personen met met dopamine-agonist behandelde hyperprolactinemie (n=8.386), hadden in vergelijking met niet-gebruik (n=15.147) personen die waren blootgesteld aan cabergoline geen verhoogd risico op CVR. De bevindingen met betrekking tot het risico op CVR geassocieerd met behandeling met cabergoline voor personen met de ziekte van Parkinson (verhoogd risico) en personen met hyperprolactinemie (geen verhoogd risico) komen overeen met de bevindingen in andere gepubliceerde onderzoeken.
Artsen dienen de laagste effectieve dosis DOSTINEX te gebruiken voor de behandeling van hyperprolactinemische aandoeningen en dienen periodiek de noodzaak van voortzetting van de behandeling met DOSTINEX opnieuw te beoordelen. Na de start van de behandeling moet klinische en diagnostische monitoring (bijvoorbeeld röntgenfoto van de borst, CT-scan en cardiale echocardiogram) worden uitgevoerd om het risico op hartvalvulopathie te beoordelen. De aanbevolen frequentie van routinematige echocardiografische monitoring is elke 6 tot 12 maanden of zoals klinisch geïndiceerd bij de aanwezigheid van tekenen en symptomen zoals oedeem, nieuw hartgeruis, dyspneu of congestief hartfalen.
DOSTINEX moet worden stopgezet als een echocardiogram nieuwe klepregurgitatie, klepvernauwing of verdikking van de klepbladen aan het licht brengt.
DOSTINEX moet met voorzichtigheid worden gebruikt bij patiënten die worden blootgesteld aan andere medicijnen die verband houden met valvulopathie.

Extracardiale fibrotische reacties
Postmarketing gevallen van pleurale, pericardiale en retroperitoneale fibrose zijn gemeld na toediening van DOSTINEX. Sommige meldingen waren bij patiënten die eerder waren behandeld met andere ergotine-dopamineagonisten. DOSTINEX mag niet worden gebruikt bij patiënten met een voorgeschiedenis van cardiale of extracardiale fibrotische aandoeningen.
Fibrotische aandoeningen kunnen een sluipend begin hebben en patiënten moeten worden gecontroleerd op manifestaties van progressieve fibrose. Daarom moet tijdens de behandeling aandacht worden besteed aan de tekenen en symptomen van:
- Pleuro-pulmonale ziekte zoals kortademigheid, kortademigheid, aanhoudende hoest of pijn op de borst.
- Nierinsufficiëntie of ureterale/abdominale vasculaire obstructie die kan optreden met pijn in de lendenen/flank en oedeem van de onderste ledematen, evenals eventuele abdominale massa's of gevoeligheid die kunnen wijzen op retroperitoneale fibrose.
- Hartfalen: Gevallen van valvulaire en pericardiale fibrose hebben zich vaak gemanifesteerd als hartfalen. Daarom moet valvulaire fibrose (en constrictieve pericarditis) worden uitgesloten als dergelijke symptomen optreden.
Klinische en diagnostische monitoring zoals de bezinkingssnelheid van erytrocyten, thoraxfoto, serumcreatininemetingen en andere onderzoeken moeten worden overwogen bij aanvang en indien nodig tijdens de behandeling van patiënten met DOSTINEX.
Na de diagnose van pleurale effusie of pulmonale fibrose, werd gemeld dat de stopzetting van DOSTINEX resulteerde in verbetering van tekenen en symptomen.
PREVENTIEVE MAATREGELEN
Algemeen
Aanvangsdoses hoger dan 1,0 mg kunnen orthostatische hypotensie veroorzaken. Voorzichtigheid is geboden bij het toedienen van DOSTINEX met andere medicijnen waarvan bekend is dat ze de bloeddruk verlagen.
Postpartum lactatieremming of -onderdrukking
DOSTINEX 0,25 mg is niet geïndiceerd voor de remming of onderdrukking van fysiologische lactatie. Het gebruik van bromocriptine, een andere dopamine-agonist voor dit doel, is in verband gebracht met gevallen van hypertensie, beroerte en toevallen.
Leverfunctiestoornis
Aangezien cabergoline uitgebreid wordt gemetaboliseerd door de lever, moet voorzichtigheid worden betracht en moet zorgvuldige controle worden uitgeoefend bij het toedienen van DOSTINEX 0, 5 mg aan patiënten met leverinsufficiëntie.
Psychiatrisch
Pathologisch gokken, verhoogd libido en hyperseksualiteit zijn gemeld bij patiënten die werden behandeld met dopamine-agonisten, waaronder cabergoline. Dit was over het algemeen reversibel na verlaging van de dosis of stopzetting van de behandeling (zie: Postmarketing-surveillancegegevens ).
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogeniteitsonderzoeken werden uitgevoerd bij muizen en ratten met cabergoline toegediend via een sonde in doses tot respectievelijk 0,98 mg/kg/dag en 0,32 mg/kg/dag. Deze doses zijn 7 keer en 4 keer de maximaal aanbevolen dosis voor de mens, berekend op basis van het lichaamsoppervlak, waarbij gebruik wordt gemaakt van totaal mg/m²/week bij knaagdieren en mg/m²/week voor een mens van 50 kg.
Er was een lichte toename in de incidentie van cervicale en uteriene leiomyomen en uteriene leiomyosarcomen bij muizen. Bij ratten was er een lichte toename van kwaadaardige tumoren van de baarmoederhals en baarmoeder en interstitiële celadenomen. Het optreden van tumoren bij vrouwelijke knaagdieren kan verband houden met de langdurige onderdrukking van de prolactinesecretie, omdat prolactine bij knaagdieren nodig is voor de instandhouding van het corpus luteum. Bij afwezigheid van prolactine wordt de verhouding oestrogeen/progesteron verhoogd, waardoor het risico op baarmoedertumoren toeneemt. Bij mannelijke knaagdieren ging de verlaging van de serumprolactinespiegels gepaard met een verhoging van het luteïniserend hormoon in het serum, waarvan wordt gedacht dat het een compenserend effect is om de steroïdesynthese in de testikels in stand te houden. Aangezien men denkt dat deze hormonale mechanismen soortspecifiek zijn, is de relevantie van deze tumoren voor de mens niet bekend.
Het mutagene potentieel van cabergoline werd geëvalueerd en bleek negatief te zijn in een reeks in vitro-tests. Deze tests omvatten de bacteriële mutatietest (Ames) met Salmonella typhimurium, de genmutatietest met Schizosaccharomyces pombe P1- en V79 Chinese hamstercellen, DNA-schade en -herstel in Saccharomyces cerevisiae D4 en chromosomale aberraties in menselijke lymfocyten. Cabergoline was ook negatief in de beenmergmicronucleustest bij de muis.
Bij vrouwelijke ratten remde een dagelijkse dosis van 0,003 mg/kg gedurende 2 weken voorafgaand aan de paring en gedurende de gehele paringsperiode de conceptie. Deze dosis vertegenwoordigt ongeveer 1/28 van de maximaal aanbevolen dosis voor de mens, berekend op basis van het lichaamsoppervlak, waarbij gebruik wordt gemaakt van totaal mg/m²/week bij ratten en mg/m²/week voor een mens van 50 kg.
Zwangerschap
Teratogene effecten - Categorie B
Er zijn reproductieonderzoeken uitgevoerd met cabergoline bij muizen, ratten en konijnen die via een sonde werden toegediend. (Een veelvoud van de maximaal aanbevolen dosis voor de mens in deze rubriek wordt berekend op basis van het lichaamsoppervlak, waarbij gebruik wordt gemaakt van totaal mg/m²/week voor dieren en mg/m²/week voor een mens van 50 kg.)
Er waren maternotoxische effecten, maar geen teratogene effecten bij muizen die cabergoline kregen in doses tot 8 mg/kg/dag (ongeveer 55 maal de maximaal aanbevolen dosis voor de mens) tijdens de periode van organogenese.
Een dosis van 0,012 mg/kg/dag (ongeveer 1/7 van de maximaal aanbevolen dosis voor de mens) tijdens de periode van organogenese bij ratten veroorzaakte een toename van embryofoetaal verlies na implantatie. Deze verliezen kunnen te wijten zijn aan de prolactineremmende eigenschappen van cabergoline bij ratten. Bij dagelijkse doses van 0,5 mg/kg/dag (ongeveer 19 maal de maximaal aanbevolen dosis voor de mens) tijdens de periode van organogenese bij konijnen, veroorzaakte cabergoline maternotoxiciteit, gekenmerkt door een verlies van lichaamsgewicht en verminderde voedselconsumptie. Doses van 4 mg/kg/dag (ongeveer 150 maal de maximaal aanbevolen dosis voor de mens) tijdens de periode van organogenese bij het konijn veroorzaakten een verhoogd optreden van verschillende misvormingen. In een ander onderzoek bij konijnen werden echter geen behandelingsgerelateerde misvormingen of embryo-foetotoxiciteit waargenomen bij doses tot 8 mg/kg/dag (ongeveer 300 maal de maximaal aanbevolen dosis voor de mens).
Bij ratten remden doses hoger dan 0,003 mg/kg/dag (ongeveer 1/28 de maximaal aanbevolen dosis voor de mens) vanaf 6 dagen vóór de partus en gedurende de lactatieperiode de groei en veroorzaakten ze de dood van de nakomelingen als gevolg van verminderde melksecretie.
Er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons van de mens, mag dit medicijn alleen tijdens de zwangerschap worden gebruikt als dit duidelijk nodig is.
Moeders die borstvoeding geven
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen worden uitgescheiden in de moedermelk en vanwege de mogelijkheid van ernstige bijwerkingen bij zuigelingen die borstvoeding geven van cabergoline, moet worden besloten of de borstvoeding moet worden gestaakt of dat het geneesmiddel moet worden gestaakt, rekening houdend met het belang van het geneesmiddel voor de moeder. Het gebruik van DOSTINEX voor het remmen of onderdrukken van fysiologische lactatie wordt niet aanbevolen (zie: PREVENTIEVE MAATREGELEN sectie).
De prolactineverlagende werking van cabergoline suggereert dat het de lactatie zal verstoren. Vanwege deze interferentie met borstvoeding, mag DOSTINEX 0,5 mg niet worden gegeven aan postpartum vrouwen die borstvoeding geven of van plan zijn borstvoeding te geven.
Pediatrisch gebruik
De veiligheid en werkzaamheid van DOSTINEX 0,5 mg bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Klinische onderzoeken met DOSTINEX 0, 5 mg omvatten niet voldoende aantallen proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere patiënten. Andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Over het algemeen moet de dosiskeuze voor een oudere patiënt voorzichtig zijn, meestal beginnend aan het lage uiteinde van het doseringsbereik, als gevolg van de grotere frequentie van verminderde lever-, nier- of hartfunctie en van gelijktijdige ziekte of andere medicamenteuze behandeling.
OVERDOSERING
Van overdosering kan worden verwacht dat ze verstopte neus, syncope of hallucinaties veroorzaken. Indien nodig moeten maatregelen worden genomen om de bloeddruk te ondersteunen.
CONTRA-INDICATIES
DOSTINEX-tabletten zijn gecontra-indiceerd bij patiënten met:
- Ongecontroleerde hypertensie of bekende overgevoeligheid voor ergotderivaten.
- Geschiedenis van hartklepaandoeningen, zoals gesuggereerd door anatomisch bewijs van valvulopathie van een klep, bepaald door evaluatie voorafgaand aan de behandeling, inclusief echocardiografische demonstratie van klepbladverdikking, klepvernauwing of gemengde klepvernauwingstenose. (Zien WAARSCHUWINGEN )
- Geschiedenis van pulmonale, pericardiale of retroperitoneale fibrotische aandoeningen. (Zien WAARSCHUWINGEN )
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
De secretie van prolactine door de hypofysevoorkwab staat voornamelijk onder hypothalamische remmende controle, waarschijnlijk uitgeoefend door de afgifte van dopamine door tuberoinfundibulaire neuronen. Cabergoline is een langwerkende dopaminereceptoragonist met een hoge affiniteit voor D2-receptoren. Resultaten van in vitro-onderzoeken tonen aan dat cabergoline een direct remmend effect heeft op de secretie van prolactine door hypofyse-lactotrofen van ratten. Cabergoline verlaagde de serumprolactinespiegels bij opnieuw geserpineerde ratten. Receptorbindingsonderzoeken geven aan dat cabergoline een lage affiniteit heeft voor dopamine D1-, α1- en α2-adrenerge en 5-HT1- en 5-HT2-serotoninereceptoren.
Klinische studies
De prolactineverlagende werkzaamheid van DOSTINEX 0,25 mg werd aangetoond bij hyperprolactinemische vrouwen in twee gerandomiseerde, dubbelblinde, vergelijkende onderzoeken, één met placebo en de andere met bromocriptine. In de placebogecontroleerde studie (placebo n=20; cabergoline n=168), veroorzaakte DOSTINEX 0,5 mg een dosisgerelateerde verlaging van de serumprolactinespiegels met prolactine genormaliseerd na 4 weken behandeling bij 29%, 76%, 74% en 95 % van de patiënten die respectievelijk 0,125, 0,5, 0,75 en 1,0 mg tweemaal per week kregen.
In de 8 weken durende, dubbelblinde periode van de vergelijkende studie met bromocriptine (cabergoline n=223; bromocriptine n=236 in de intent-to-treat-analyse) werd prolactine genormaliseerd bij 77% van de patiënten die werden behandeld met DOSTINEX 0,5 mg tweemaal per week vergeleken met 59% van degenen die werden behandeld met tweemaal daags 2,5 mg bromocriptine. Herstel van de menstruatie trad op bij 77% van de vrouwen die met DOSTINEX werden behandeld, vergeleken met 70% van degenen die met bromocriptine werden behandeld. Bij patiënten met galactorroe verdween dit symptoom bij 73% van degenen die met DOSTINEX werden behandeld, vergeleken met 56% van degenen die met bromocriptine werden behandeld.
Farmacokinetiek
Absorptie
Na enkelvoudige orale doses van 0,5 mg tot 1,5 mg, gegeven aan 12 gezonde volwassen vrijwilligers, werden binnen 2 tot 3 uur gemiddelde piekplasmaspiegels van 30 tot 70 picogram (pg)/ml cabergoline waargenomen. Over het dosisbereik van 0,5 tot 7 mg leken de cabergoline-plasmaspiegels dosisproportioneel te zijn bij 12 gezonde volwassen vrijwilligers en negen volwassen parkinsonpatiënten. Een onderzoek met herhaalde doses bij 12 gezonde vrijwilligers suggereert dat de steady-state-spiegels na een eenmaal per week doseringsschema naar verwachting twee- tot driemaal hoger zullen zijn dan na een enkele dosis. De absolute biologische beschikbaarheid van cabergoline is niet bekend. Een aanzienlijk deel van de toegediende dosis ondergaat een first-pass-effect. De eliminatiehalfwaardetijd van cabergoline geschat op basis van urinaire gegevens van 12 gezonde proefpersonen varieerde van 63 tot 69 uur. Het langdurige prolactineverlagende effect van cabergoline kan verband houden met de langzame eliminatie en lange halfwaardetijd.
Verdeling
Bij dieren, op basis van de totale radioactiviteit, heeft cabergoline (en/of zijn metabolieten) een uitgebreide weefseldistributie laten zien. Radioactiviteit in de hypofyse overschreed die in plasma met een factor 100 en werd geëlimineerd met een halfwaardetijd van ongeveer 60 uur. Deze bevinding komt overeen met het langdurige prolactineverlagende effect van het medicijn. Autoradiografie-onderzoeken van het hele lichaam bij zwangere ratten lieten geen foetale opname zien, maar hoge niveaus in de baarmoederwand. Significante radioactiviteit (ouder plus metabolieten) gedetecteerd in de melk van zogende ratten suggereert een potentieel voor blootstelling aan zuigelingen die borstvoeding geven. Het medicijn wordt uitgebreid door het lichaam verspreid. Cabergoline is matig gebonden (40% tot 42%) aan humane plasma-eiwitten op een concentratie-onafhankelijke manier. Het is onwaarschijnlijk dat gelijktijdige toediening van sterk eiwitgebonden geneesmiddelen de dispositie ervan beïnvloedt.
Metabolisme
Bij zowel dieren als mensen wordt cabergoline uitgebreid gemetaboliseerd, voornamelijk via hydrolyse van de acylureabinding of de ureumgroep. Door cytochroom P-450 gemedieerd metabolisme lijkt minimaal te zijn. Cabergoline veroorzaakt geen enzyminductie en/of -remming bij ratten. Hydrolyse van de acylurea- of ureumgroep heft het prolactineverlagende effect van cabergoline op en de belangrijkste metabolieten die tot nu toe zijn geïdentificeerd, dragen niet bij aan het therapeutische effect.
uitscheiding
Na orale toediening van radioactief cabergoline aan vijf gezonde vrijwilligers, werd ongeveer 22% en 60% van de dosis binnen 20 dagen uitgescheiden in respectievelijk de urine en de feces. Minder dan 4% van de dosis werd onveranderd in de urine uitgescheiden. De niet-renale en renale klaring van cabergoline is respectievelijk ongeveer 3,2 l/min en 0,08 l/min. De uitscheiding via de urine bij patiënten met hyperprolactinemie was vergelijkbaar.
Speciale populaties
Nierinsufficiëntie
De farmacokinetiek van cabergoline was niet veranderd bij 12 patiënten met matige tot ernstige nierinsufficiëntie, zoals beoordeeld aan de hand van de creatinineklaring.
Leverinsufficiëntie
Bij 12 patiënten met milde tot matige leverdisfunctie (Child-Pugh-score ≤ 10) werd geen effect op de gemiddelde cabergoline Cmax of de oppervlakte onder de plasmaconcentratiecurve (AUC) waargenomen. Patiënten met ernstige insufficiëntie (Child-Pugh-score > 10) vertonen echter een substantiële toename van de gemiddelde cabergoline Cmax en AUC, en daarom is voorzichtigheid geboden.
Ouderen
Het effect van leeftijd op de farmacokinetiek van cabergoline is niet onderzocht.
Interactie tussen voedsel en geneesmiddelen
Bij 12 gezonde volwassen vrijwilligers veranderde voedsel de kinetiek van cabergoline niet.
farmacodynamiek
Dosisrespons met remming van plasmaprolactine, aanvang van maximaal effect en duur van effect is gedocumenteerd na enkelvoudige cabergolinedoses aan gezonde vrijwilligers (0,05 tot 1,5 mg) en hyperprolactinemische patiënten (0,3 tot 1 mg). Bij vrijwilligers was prolactineremming duidelijk bij doses > 0,2 mg, terwijl doses ≥ 0,5 mg bij de meeste proefpersonen maximale onderdrukking veroorzaakten. Hogere doses produceren prolactinesuppressie bij een groter deel van de proefpersonen en met een eerder begin en een langere werkingsduur. Bij 12 gezonde vrijwilligers resulteerden doses van 0,5, 1 en 1,5 mg in volledige prolactineremming, met een maximaal effect binnen 3 uur bij 92% tot 100% van de proefpersonen na de doses van 1 en 1,5 mg vergeleken met 50% van de proefpersonen na de dosis van 0,5 mg. mg dosis.
Bij hyperprolactinemische patiënten (N=51) was de maximale afname van prolactine na een enkelvoudige dosis cabergoline van 0,6 mg vergelijkbaar met 2,5 mg bromocriptine; de duur van het effect was echter aanzienlijk langer (14 dagen versus 24 uur). De tijd tot maximaal effect was korter voor bromocriptine dan voor cabergoline (6 uur vs. 48 uur).
Bij 72 gezonde vrijwilligers resulteerden enkelvoudige of meervoudige doses (tot 2 mg) cabergoline in selectieve remming van prolactine zonder duidelijk effect op andere hypofysevoorkwabhormonen (GH, FSH, LH, ACTH en TSH) of cortisol.
PATIËNT INFORMATIE
Patiënten moeten worden geïnstrueerd om hun arts op de hoogte te stellen als ze vermoeden dat ze zwanger zijn, zwanger worden of van plan zijn zwanger te worden tijdens de behandeling. Als er een vermoeden van zwangerschap bestaat, moet een zwangerschapstest worden gedaan en moet de voortzetting van de behandeling met hun arts worden besproken.
Patiënten moeten hun arts op de hoogte stellen als ze kortademigheid, aanhoudende hoest, ademhalingsmoeilijkheden bij het liggen of zwelling in hun ledematen ontwikkelen.
