Proscar 5mg Gebruik, bijwerkingen en dosering. Prijs in online apotheek. Generieke medicijnen zonder recept.
Wat is Proscar 5 mg en hoe wordt het gebruikt?
Proscar is een receptgeneesmiddel dat wordt gebruikt om de symptomen van goedaardige prostaathyperplasie en androgene alopecia te behandelen. Dit geneesmiddel is alleen voor gebruik bij mannen. Proscar 5 mg kan alleen of in combinatie met andere medicijnen worden gebruikt.
Proscar behoort tot een klasse geneesmiddelen die 5-alfa-reductaseremmers worden genoemd.
Het is niet bekend of Proscar 5 mg veilig en effectief is bij kinderen.
Wat zijn de mogelijke bijwerkingen van Proscar 5 mg?
Proscar kan ernstige bijwerkingen veroorzaken, waaronder:
- ernstige of aanhoudende misselijkheid,
- moeite met ademhalen,
- zwelling van uw gezicht, lippen, tong of keel,
- borst knobbels,
- borstpijn of gevoeligheid,
- tepelontlading, en
- andere borstveranderingen
Roep meteen medische hulp in als u een van de bovenstaande symptomen heeft.
De meest voorkomende bijwerkingen van Proscar zijn:
- verlies van interesse in seks,
- impotentie,
- moeite hebben om een orgasme te krijgen, en
- abnormale ejaculatie
Vertel het uw arts als u een bijwerking heeft die u hindert of die niet weggaat.
Dit zijn niet alle mogelijke bijwerkingen van Proscar. Vraag uw arts of apotheker om meer informatie.
Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
OMSCHRIJVING
PROSCAR (finasteride), een synthetische 4-azasteroïde verbinding, is een specifieke remmer van steroïde Type II 5α-reductase, een intracellulair enzym dat het androgeentestosteron omzet in 5α-dihydrotestosteron (DHT).
Finasteride is 4-azaandrost-1-een-17-carboxamide, N-(1,1-dimethylethyl)-3-oxo-,(5α,17ß)-. De empirische formule van finasteride is C23H36N2O2 en het molecuulgewicht is 372,55. De structuurformule is:
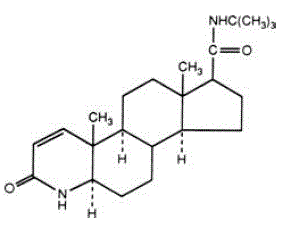
Finasteride is een wit kristallijn poeder met een smeltpunt in de buurt van 250°C. Het is vrij oplosbaar in chloroform en in oplosmiddelen met een lager alcoholgehalte, maar is praktisch onoplosbaar in water.
PROSCAR (finasteride) tabletten voor orale toediening zijn filmomhulde tabletten die 5 mg finasteride en de volgende inactieve ingrediënten bevatten: waterige lactose, microkristallijne cellulose, gepregelatiniseerd zetmeel, natriumzetmeelglycolaat, hydroxypropylcellulose LF, hydroxypropylmethylcellulose, titaniumdioxide, magnesiumstearaat , talk, docusaatnatrium, FD&C Blue 2 aluminiumlak en geel ijzeroxide.
INDICATIES
Monotherapie
PROSCAR® is geïndiceerd voor de behandeling van symptomatische goedaardige prostaathyperplasie (BPH) bij mannen met een vergrote prostaat om:
- Symptomen verbeteren
- Verminder het risico op acute urineretentie
- Verminder het risico van de noodzaak van een operatie, waaronder transurethrale resectie van de prostaat (TURP) en prostatectomie.
Combinatie met Alpha-Blocker
PROSCAR 5 mg toegediend in combinatie met de alfablokker doxazosine is geïndiceerd om het risico op symptomatische progressie van BPH te verminderen (een bevestigde stijging van ≥ 4 punten in de symptoomscore van de American Urological Association (AUA).
Beperkingen van gebruik
PROSCAR is niet goedgekeurd voor de preventie van prostaatkanker.
DOSERING EN ADMINISTRATIE
PROSCAR kan met of zonder maaltijden worden toegediend.
Monotherapie
De aanbevolen dosis PROSCAR is één tablet (5 mg) eenmaal per dag [zie Klinische studies ].
Combinatie met Alpha-Blocker
De aanbevolen dosis PROSCAR is één tablet (5 mg) eenmaal per dag ingenomen in combinatie met de alfablokker doxazosine [zie: Klinische studies ].
HOE GELEVERD
Doseringsvormen en sterke punten
5 mg blauwe, gemodificeerde appelvormige, filmomhulde tabletten, met aan de ene kant de code MSD 72 en aan de andere kant PROSCAR 5 mg.
Opslag en behandeling
Nr. 3094 - PROSCAR tabletten 5 mg zijn blauwe, gemodificeerde appelvormige, filmomhulde tabletten, met aan de ene kant de code MSD 72 en aan de andere kant PROSCAR. Ze worden als volgt geleverd:
NDC 0006-0072-31 gebruikseenheid flessen van 30 NDC 0006-0072-58 gebruikseenheid flessen van 100.
Opslag en behandeling
Bewaren bij kamertemperatuur lager dan 30 ° C (86 ° F). Tegen licht beschermen en container goed gesloten houden.
Vrouwen mogen geen fijngemaakte of gebroken PROSCAR 5 mg tabletten hanteren als ze zwanger zijn of mogelijk zwanger kunnen zijn vanwege de mogelijkheid van absorptie van finasteride en het daaruit voortvloeiende potentiële risico voor een mannelijke foetus [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en Gebruik bij specifieke populaties ].
Gedistribueerd door: Merck Sharp & Dohme Corp., een dochteronderneming van MERCK & CO.,INC., Whitehouse Station, NJ 08889, VS. Herzien: juni 2021
BIJWERKINGEN
Ervaring met klinische proeven
Omdat klinische onderzoeken onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de bijwerkingen die in de klinische onderzoeken van een geneesmiddel zijn waargenomen niet direct worden vergeleken met de percentages in de klinische onderzoeken van een ander geneesmiddel en komen mogelijk niet overeen met de percentages die in de klinische praktijk worden waargenomen.
4-jarige placebogecontroleerde studie (PLESS)
In PLESS werden 1524 patiënten behandeld met PROSCAR en 1516 patiënten behandeld met placebo beoordeeld op veiligheid gedurende een periode van 4 jaar. De meest frequent gemelde bijwerkingen waren gerelateerd aan de seksuele functie. 3,7% (57 patiënten) behandeld met PROSCAR 5 mg en 2,1% (32 patiënten) behandeld met placebo stopten met de behandeling als gevolg van bijwerkingen gerelateerd aan seksuele functie, de meest gemelde bijwerkingen.
Tabel 1 geeft de enige klinische bijwerkingen weer die door de onderzoeker mogelijk, waarschijnlijk of zeker gerelateerd zijn aan het geneesmiddel, waarbij de incidentie op PROSCAR 5 mg ≥1% en hoger was dan placebo gedurende de 4 jaar van het onderzoek. In jaar 2-4 van de studie was er geen significant verschil tussen de behandelingsgroepen in de incidentie van impotentie, verminderd libido en ejaculatiestoornis.
Fase III-onderzoeken en open verlengingen van 5 jaar
Het bijwerkingenprofiel in de 1-jarige, placebogecontroleerde, fase III-onderzoeken, de 5-jarige open verlengingen en PLESS waren vergelijkbaar.
Onderzoek naar medische therapie van prostaatsymptomen (MTOPS)
In het MTOPS-onderzoek werden 3047 mannen met symptomatische BPH gerandomiseerd naar PROSCAR 5 mg/dag (n=768), doxazosine 4 of 8 mg/dag (n=756), de combinatie van PROSCAR 5 mg/dag en doxazosine 4 of 8 mg/dag (n=786), of placebo (n=737) gedurende 4 tot 6 jaar. [Zie een Klinische studies .]
De incidentiepercentages van geneesmiddelgerelateerde bijwerkingen gemeld door ≥2% van de patiënten in een behandelingsgroep in de MTOPS-studie staan vermeld in tabel 2.
De afzonderlijke bijwerkingen die vaker voorkwamen in de combinatiegroep dan bij elk van de geneesmiddelen alleen waren: asthenie, orthostatische hypotensie, perifeer oedeem, duizeligheid, verminderd libido, rhinitis, abnormale ejaculatie, impotentie en abnormale seksuele functie (zie tabel 2). Hiervan was de incidentie van abnormale ejaculatie bij patiënten die combinatietherapie kregen vergelijkbaar met de som van de incidenties van deze bijwerking die werd gemeld voor de twee monotherapieën.
Combinatietherapie met finasteride en doxazosine ging niet gepaard met nieuwe klinische bijwerkingen.
Vier patiënten in MTOPS meldden de negatieve ervaring borstkanker. Drie van deze patiënten kregen alleen finasteride en één kreeg combinatietherapie. [Zie een Langetermijngegevens .]
De MTOPS-studie is niet specifiek ontworpen om statistische vergelijkingen tussen groepen te maken voor gerapporteerde bijwerkingen. Bovendien zijn directe vergelijkingen van veiligheidsgegevens tussen de MTOPS-studie en eerdere studies van de enkelvoudige middelen mogelijk niet geschikt op basis van verschillen in patiëntenpopulatie, dosering of doseringsschema en andere procedurele en onderzoeksontwerpelementen.
Langetermijngegevens
Hoogwaardige prostaatkanker
De PCPT-studie was een 7-jarige gerandomiseerde, dubbelblinde, placebogecontroleerde studie waaraan 18.882 mannen ≥55 jaar deelnamen met een normaal digitaal rectaal onderzoek en een PSA ≤3,0 ng/ml. Mannen kregen dagelijks PROSCAR (finasteride 5 mg) of placebo. Patiënten werden jaarlijks geëvalueerd met PSA en digitale rectale onderzoeken. Biopsieën werden uitgevoerd voor verhoogde PSA, een abnormaal digitaal rectaal onderzoek of het einde van de studie. De incidentie van Gleason-score 8-10 prostaatkanker was hoger bij mannen die werden behandeld met finasteride (1,8%) dan bij mannen die werden behandeld met placebo (1,1%) [zie: INDICATIES en WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ]. In een 4 jaar durende placebogecontroleerde klinische studie met een andere 5α-reductaseremmer (dutasteride, AVODART), werden vergelijkbare resultaten waargenomen voor Gleason-score 8-10 prostaatkanker (1% dutasteride versus 0,5% placebo).
Er is geen klinisch voordeel aangetoond bij patiënten met prostaatkanker die worden behandeld met PROSCAR.
Borstkanker
Tijdens het 4 tot 6 jaar durende placebo- en comparator-gecontroleerde MTOPS-onderzoek waaraan 3047 mannen deelnamen, waren er 4 gevallen van borstkanker bij mannen die met finasteride werden behandeld, maar geen gevallen bij mannen die niet met finasteride werden behandeld. Tijdens het 4 jaar durende, placebogecontroleerde PLESS-onderzoek waaraan 3040 mannen deelnamen, waren er 2 gevallen van borstkanker bij met placebo behandelde mannen, maar geen gevallen bij mannen die met finasteride werden behandeld. Tijdens de 7 jaar durende placebogecontroleerde Prostaatkanker Preventie Trial (PCPT) waaraan 18.882 mannen deelnamen, was er 1 geval van borstkanker bij mannen die werden behandeld met finasteride, en 1 geval van borstkanker bij mannen die werden behandeld met placebo. De relatie tussen langdurig gebruik van finasteride en mannelijke borstneoplasie is momenteel niet bekend.
seksuele functie
Er zijn geen aanwijzingen voor toegenomen seksuele bijwerkingen bij een langere behandelingsduur met PROSCAR. Nieuwe meldingen van drugsgerelateerde seksuele bijwerkingen namen af met de duur van de therapie.
Postmarketingervaring
De volgende aanvullende bijwerkingen zijn gemeld tijdens postmarketingervaring met PROSCAR. Omdat deze gebeurtenissen vrijwillig worden gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om een betrouwbare schatting te maken van hun frequentie of een oorzakelijk verband te leggen met blootstelling aan drugs:
- overgevoeligheidsreacties, zoals pruritus, urticaria en angio-oedeem (inclusief zwelling van de lippen, tong, keel en gezicht)
- testiculaire pijn
- hematospermie
- seksuele disfunctie die aanhield na stopzetting van de behandeling, waaronder erectiestoornissen, verminderd libido en ejaculatiestoornissen (bijv. verminderd ejaculaatvolume). Deze voorvallen werden zelden gemeld bij mannen die PROSCAR gebruikten voor de behandeling van BPH. De meeste mannen waren ouder en gebruikten gelijktijdig medicatie en/of hadden comorbide aandoeningen. De onafhankelijke rol van PROSCAR 5 mg bij deze voorvallen is niet bekend.
- mannelijke onvruchtbaarheid en/of slechte zaadkwaliteit werden zelden gemeld bij mannen die PROSCAR 5 mg gebruikten voor de behandeling van BPH. Normalisatie of verbetering van slechte zaadkwaliteit is gemeld na stopzetting van finasteride. De onafhankelijke rol van PROSCAR in deze gebeurtenissen is onbekend.
- depressie
- mannelijke borstkanker.
De volgende aanvullende bijwerking gerelateerd aan seksuele disfunctie die aanhield na stopzetting van de behandeling, is gemeld tijdens postmarketingervaring met finasteride in lagere doses die werden gebruikt om mannelijke kaalheid te behandelen. Omdat de gebeurtenis vrijwillig wordt gemeld door een populatie van onbekende grootte, is het niet altijd mogelijk om de frequentie ervan betrouwbaar in te schatten of een oorzakelijk verband met blootstelling aan drugs vast te stellen:
- orgasme stoornissen
DRUG-INTERACTIES
Cytochroom P450-gekoppeld geneesmiddelmetaboliserend enzymsysteem
Er zijn geen geneesmiddelinteracties van klinisch belang vastgesteld. Finasteride lijkt het cytochroom P450-gekoppelde geneesmiddelmetaboliserende enzymsysteem niet te beïnvloeden. Verbindingen die bij de mens zijn getest, omvatten antipyrine, digoxine, propranolol, theofylline en warfarine en er werden geen klinisch betekenisvolle interacties gevonden.
Andere gelijktijdige therapie
Hoewel er geen specifieke interactiestudies zijn uitgevoerd, werd PROSCAR 5 mg gelijktijdig gebruikt in klinische studies met paracetamol, acetylsalicylzuur, bètablokkers, angiotensine-converting enzyme (ACE)-remmers, analgetica, anticonvulsiva, bèta-adrenerge blokkers, diuretica, calcium kanaalblokkers, cardiale nitraten, HMG-CoA-reductaseremmers, niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's), benzodiazepines, H2Â-antagonisten en chinolon-anti-infectiemiddelen zonder bewijs van klinisch significante nadelige interacties.
WAARSCHUWINGEN
Inbegrepen als onderdeel van de "PREVENTIEVE MAATREGELEN" Sectie
PREVENTIEVE MAATREGELEN
Effecten op prostaatspecifiek antigeen (PSA) en het gebruik van PSA bij de detectie van prostaatkanker
In klinische onderzoeken verminderde PROSCAR de serum-PSA-concentratie met ongeveer 50% binnen zes maanden na de behandeling. Deze afname is voorspelbaar over het gehele bereik van PSA-waarden bij patiënten met symptomatische BPH, hoewel deze bij individuen kan variëren.
Voor de interpretatie van seriële PSA's bij mannen die PROSCAR gebruiken, moet ten minste zes maanden na het starten van de behandeling een nieuwe PSA-basislijn worden vastgesteld en daarna moet de PSA periodiek worden gecontroleerd. Elke bevestigde stijging van de laagste PSA-waarde tijdens het gebruik van PROSCAR 5 mg kan wijzen op de aanwezigheid van prostaatkanker en moet worden geëvalueerd, zelfs als de PSA-waarden nog steeds binnen het normale bereik liggen voor mannen die geen 5α-reductaseremmer gebruiken. Niet-naleving van de PROSCAR-therapie kan ook de PSA-testresultaten beïnvloeden. Om een geïsoleerde PSA-waarde te interpreteren bij patiënten die zes maanden of langer met PROSCAR 5 mg zijn behandeld, moeten de PSA-waarden worden verdubbeld ter vergelijking met de normale waarden bij onbehandelde mannen. Deze aanpassingen behouden het nut van PSA om prostaatkanker op te sporen bij mannen die met PROSCAR worden behandeld.
PROSCAR kan ook verlagingen van de serum-PSA veroorzaken in aanwezigheid van prostaatkanker.
De verhouding van vrij tot totaal PSA (percentage vrij PSA) blijft zelfs onder invloed van PROSCAR constant. Als clinici ervoor kiezen om procent gratis PSA te gebruiken als hulpmiddel bij de detectie van prostaatkanker bij mannen die finasteridetherapie ondergaan, lijkt het niet nodig om de waarde ervan aan te passen.
Verhoogd risico op hoogwaardige prostaatkanker
Mannen van 55 jaar en ouder met een normaal digitaal rectaal onderzoek en een PSA ≤3,0 ng/ml bij baseline die finasteride 5 mg/dag gebruikten in de 7-jarige Prostate Cancer Prevention Trial (PCPT) hadden een verhoogd risico op Gleason-score 8-10 prostaatkanker (finasteride 1,8% versus placebo 1,1%). [Zie een INDICATIES en ONGEWENSTE REACTIES .] Vergelijkbare resultaten werden waargenomen in een 4 jaar durende placebogecontroleerde klinische studie met een andere 5α-reductaseremmer (dutasteride, AVODART) (1% dutasteride versus 0,5% placebo). 5-reductaseremmers kunnen het risico op het ontwikkelen van hoogwaardige prostaatkanker verhogen. Of het effect van 5α-reductaseremmers om het prostaatvolume te verminderen, of studiegerelateerde factoren, de resultaten van deze onderzoeken beïnvloedden, is niet vastgesteld.
Blootstelling van vrouwen
Risico voor mannelijke foetus
PROSCAR is gecontra-indiceerd bij zwangere vrouwen en bij vrouwen die mogelijk zwanger kunnen zijn en is niet geïndiceerd voor gebruik bij vrouwen. Op basis van dierstudies en het werkingsmechanisme kan PROSCAR 5 mg een abnormale ontwikkeling van uitwendige genitaliën veroorzaken bij een mannelijke foetus als het wordt toegediend aan een zwangere vrouw. Vrouwen die zwanger zijn of mogelijk zwanger zijn, mogen geen fijngemaakte of gebroken PROSCAR 5 mg tabletten hanteren. PROSCAR 5 mg tabletten zijn omhuld en voorkomen contact met het werkzame bestanddeel tijdens normaal gebruik, op voorwaarde dat de tabletten niet gebroken of fijngemaakt zijn. Als een zwangere vrouw in contact komt met fijngemaakte of gebroken PROSCAR 5 mg tabletten, moet het contactgebied onmiddellijk worden gewassen met water en zeep. [Zie een CONTRA-INDICATIES ,EEN Gebruik bij specifieke populaties ,EEN KLINISCHE FARMACOLOGIE , en een HOE GELEVERD .]
Pediatrische patiënten en vrouwen
PROSCAR is niet geïndiceerd voor gebruik bij pediatrische patiënten [zie Gebruik bij specifieke populaties en KLINISCHE FARMACOLOGIE ] of vrouwen [zie ook WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ,EEN Gebruik bij specifieke populaties ,EEN KLINISCHE FARMACOLOGIE , en een HOE GELEVERD ].
Effect op spermakenmerken
Behandeling met PROSCAR gedurende 24 weken om de spermaparameters bij gezonde mannelijke vrijwilligers te evalueren, bracht geen klinisch betekenisvolle effecten op de spermaconcentratie, mobiliteit, morfologie of pH aan het licht. Er werd een mediane afname van 0,6 ml (22,1%) van het ejaculaatvolume met een gelijktijdige afname van het totale aantal zaadcellen per ejaculaat waargenomen. Deze parameters bleven binnen het normale bereik en waren reversibel na stopzetting van de therapie met een gemiddelde tijd van 84 weken tot terugkeer naar de uitgangswaarde.
Overweging van andere urologische aandoeningen
Voordat de behandeling met PROSCAR 5 mg wordt gestart, moet rekening worden gehouden met andere urologische aandoeningen die vergelijkbare symptomen kunnen veroorzaken. Bovendien kunnen prostaatkanker en BPH naast elkaar bestaan.
Patiënten met een groot resterend urinevolume en/of ernstig verminderde urinestroom moeten zorgvuldig worden gecontroleerd op obstructieve uropathie. Deze patiënten komen mogelijk niet in aanmerking voor behandeling met finasteride.
Informatie over patiëntbegeleiding
Adviseer de patiënt om de door de FDA goedgekeurde patiëntetikettering te lezen ( PATIËNT INFORMATIE ).
Verhoogd risico op hoogwaardige prostaatkanker
Patiënten moeten worden geïnformeerd dat er een toename was van hooggradige prostaatkanker bij mannen die werden behandeld met 5α-reductaseremmers die zijn geïndiceerd voor BPH-behandeling, waaronder PROSCAR 5 mg, in vergelijking met degenen die werden behandeld met placebo in onderzoeken naar het gebruik van deze geneesmiddelen ter preventie van prostaatkanker. kanker [zie INDICATIES ,EEN WAARSCHUWINGEN EN VOORZORGSMAATREGELEN , en een ONGEWENSTE REACTIES ].
Blootstelling van vrouwen - risico voor mannelijke foetus
Artsen dienen patiënten te informeren dat vrouwen die zwanger zijn of mogelijk zwanger kunnen zijn, geen fijngemaakte of gebroken PROSCAR-tabletten mogen hanteren vanwege de mogelijkheid van absorptie van finasteride en het daaruit voortvloeiende potentiële risico voor de mannelijke foetus. PROSCAR-tabletten zijn omhuld en voorkomen contact met het werkzame bestanddeel tijdens normaal gebruik, op voorwaarde dat de tabletten niet zijn gebroken of fijngemaakt. Als een vrouw die zwanger is of mogelijk zwanger kan zijn, in contact komt met fijngemaakte of gebroken PROSCAR-tabletten, moet het contactgebied onmiddellijk worden gewassen met water en zeep [zie CONTRA-INDICATIES ,EEN WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ,EEN Gebruik bij specifieke populaties en HOE GELEVERD ].
Aanvullende instructies
Artsen dienen patiënten te informeren dat het volume van het ejaculaat bij sommige patiënten kan afnemen tijdens de behandeling met PROSCAR. Deze afname lijkt de normale seksuele functie niet te verstoren. Impotentie en verminderd libido kunnen echter optreden bij patiënten die met PROSCAR worden behandeld [zie ONGEWENSTE REACTIES ].
Artsen dienen hun patiënten te instrueren om eventuele veranderingen in hun borsten, zoals knobbels, pijn of tepelafscheiding, onmiddellijk te melden. Borstveranderingen waaronder borstvergroting, gevoeligheid en neoplasma zijn gemeld [zie ONGEWENSTE REACTIES ].
Artsen dienen hun patiënten te instrueren om de bijsluiter van de patiënt te lezen voordat de behandeling met PROSCAR 5 mg wordt gestart en deze elke keer dat het voorschrift wordt vernieuwd, opnieuw te lezen, zodat ze op de hoogte zijn van de actuele informatie voor patiënten met betrekking tot PROSCAR.
Niet-klinische toxicologie
Carcinogenese, mutagenese, verminderde vruchtbaarheid
Carcinogenese
Er werd geen bewijs van een tumorverwekkend effect waargenomen in een 24 maanden durende studie bij Sprague-Dawley-ratten die doses finasteride kregen tot 160 mg/kg/dag bij mannetjes en 320 mg/kg/dag bij vrouwtjes. Deze doses veroorzaakten een respectievelijke systemische blootstelling bij ratten van 111 en 274 maal de blootstelling die werd waargenomen bij de mens die de aanbevolen dosis voor de mens van 5 mg/dag kreeg. Alle blootstellingsberekeningen waren gebaseerd op de berekende AUC (0-24 uur) voor dieren en de gemiddelde AUC (0-24 uur) voor de mens (0,4 g•uur/ml).
In een carcinogeniteitsonderzoek van 19 maanden bij CD-1-muizen werd een statistisch significante (p≤0,05) toename in de incidentie van testiculaire Leydig-celadenomen waargenomen bij 228 maal de menselijke blootstelling (250 mg/kg/dag). Bij muizen bij 23 maal de menselijke blootstelling, geschat (25 mg/kg/dag) en bij ratten bij 39 maal de menselijke blootstelling (40 mg/kg/dag) werd een toename in de incidentie van Leydig-celhyperplasie waargenomen. Een positieve correlatie tussen de proliferatieve veranderingen in de Leydig-cellen en een verhoging van de serum-LH-spiegels (2- tot 3-voudig boven de controle) is aangetoond bij beide knaagdiersoorten die werden behandeld met hoge doses finasteride. Er werden geen geneesmiddelgerelateerde Leydig-celveranderingen waargenomen bij ratten of honden die gedurende 1 jaar werden behandeld met finasteride 30 en 350 keer (respectievelijk 20 mg/kg/dag en 45 mg/kg/dag) of bij muizen die 19 maanden werden behandeld met 2,3 keer de menselijke blootstelling, geschat (2,5 mg/kg/dag).
Mutagenese
Er werd geen bewijs van mutageniteit waargenomen in een in vitro bacteriële mutagenesetest, een zoogdiercelmutagenesetest of in een in vitro alkalische elutietest. In een in vitro chromosoomafwijkingstest, waarbij gebruik werd gemaakt van ovariumcellen van Chinese hamsters, was er een lichte toename van chromosoomafwijkingen. Deze concentraties komen overeen met 4000-5000 keer de piekplasmaspiegels bij de mens bij een totale dosis van 5 mg. In een in vivo chromosoomafwijkingstest bij muizen werd geen behandelingsgerelateerde toename van chromosoomafwijkingen waargenomen met finasteride bij de maximaal getolereerde dosis van 250 mg/kg/dag (228 maal de blootstelling bij de mens), zoals bepaald in de carcinogeniteitsstudies.
Aantasting van de vruchtbaarheid
Bij geslachtsrijpe mannelijke konijnen die werden behandeld met finasteride bij een blootstelling van 543 maal de menselijke blootstelling (80 mg/kg/dag) gedurende maximaal 12 weken, werd geen effect op de vruchtbaarheid, het aantal zaadcellen of het ejaculaatvolume waargenomen. Bij geslachtsrijpe mannelijke ratten die werden behandeld met 61 keer de menselijke blootstelling (80 mg/kg/dag), waren er geen significante effecten op de vruchtbaarheid na 6 of 12 weken behandeling; wanneer de behandeling echter tot 24 of 30 weken werd voortgezet, was er een duidelijke afname van de vruchtbaarheid, vruchtbaarheid en een bijbehorende significante afname van het gewicht van de zaadblaasjes en de prostaat. Al deze effecten waren omkeerbaar binnen 6 weken na stopzetting van de behandeling. Er is geen geneesmiddelgerelateerd effect op de testikels of op de paringsprestaties waargenomen bij ratten of konijnen. Deze afname van de vruchtbaarheid bij met finasteride behandelde ratten is secundair aan het effect op de bijkomende geslachtsorganen (prostaat en zaadblaasjes), wat resulteert in het niet vormen van een zaadprop. De zaadprop is essentieel voor een normale vruchtbaarheid bij ratten en is niet relevant voor de mens.
Gebruik bij specifieke populaties
Zwangerschap
Risico Samenvatting
PROSCAR is gecontra-indiceerd bij zwangere vrouwen en niet geïndiceerd voor gebruik bij vrouwen. Op basis van dierstudies en het werkingsmechanisme kan PROSCAR 5 mg een abnormale ontwikkeling van uitwendige genitaliën veroorzaken bij een mannelijke foetus als het wordt toegediend aan een zwangere vrouw [zie: WAARSCHUWINGEN EN VOORZORGSMAATREGELEN en KLINISCHE FARMACOLOGIE ].
In een embryo-foetale ontwikkelingsstudie bij ratten was er een dosisafhankelijke toename van hypospadie die optrad bij 3,6 tot 100% van de mannelijke nakomelingen van zwangere ratten die oraal finasteride kregen toegediend tijdens de periode van belangrijke organogenese in doses van ongeveer 0,1 tot 86 maal het maximum aanbevolen dosis voor de mens (MRHD) van 5 mg/dag (gebaseerd op AUC bij dierdoses van 0,1 tot 100 mg/kg/dag).
Verlaagd prostaat- en zaadblaasjesgewicht, vertraagde preputiale scheiding en voorbijgaande tepelontwikkeling werden ook waargenomen bij mannelijke nakomelingen bij orale maternale doses van ongeveer 0,03 maal de MRHD (gebaseerd op AUC bij een dierdosis van 0,03 mg/kg/dag), samen met een verminderde anogenitale afstand bij mannelijke nakomelingen bij orale maternale doses van ongeveer 0,003 maal de MRHD (gebaseerd op de AUC bij een dierdosis van 0,003 mg/kg/dag).
PROSCAR is een Type II 5α-reductaseremmer die de omzetting van testosteron in 5α-dihydrotestosteron (DHT), een hormoon dat nodig is voor de normale ontwikkeling van mannelijke genitaliën, voorkomt. Als dit geneesmiddel tijdens de zwangerschap wordt gebruikt, of als de patiënte zwanger wordt tijdens het gebruik van dit geneesmiddel, moet de patiënt op de hoogte worden gesteld van het mogelijke gevaar voor de mannelijke foetus.
Abnormale mannelijke genitale ontwikkeling is een verwacht gevolg wanneer de omzetting van testosteron in 5α-dihydrotestosteron (DHT) wordt geremd door 5α-reductaseremmers. Deze uitkomsten zijn vergelijkbaar met die gerapporteerd bij mannelijke zuigelingen met genetische 5α-reductasedeficiëntie. Vrouwen kunnen worden blootgesteld aan finasteride door contact met fijngemaakte of gebroken PROSCAR-tabletten of sperma van een mannelijke partner die PROSCAR gebruikt. Wat betreft blootstelling aan finasteride via de huid, PROSCAR 5 mg tabletten zijn omhuld en voorkomen huidcontact met finasteride tijdens normaal gebruik als de tabletten niet fijngemaakt of gebroken zijn. Vrouwen die zwanger zijn of mogelijk zwanger zijn, mogen geen fijngemaakte of gebroken PROSCAR 5 mg tabletten hanteren vanwege de mogelijke blootstelling van een mannelijke foetus. Met betrekking tot mogelijke blootstelling aan finasteride via sperma zijn er drie onderzoeken uitgevoerd waarin de finasterideconcentraties in sperma zijn gemeten bij mannen die PROSCAR 5 mg/dag kregen. In deze onderzoeken werd geschat dat de hoogste hoeveelheid finasteride in sperma 50 tot 100 keer lager was dan de dosis finasteride (5 g) die geen effect had op de circulerende DHT-spiegels bij mannen [zie Gegevens en KLINISCHE FARMACOLOGIE ].
Gegevens
Menselijke gegevens
In 2 onderzoeken met gezonde proefpersonen (n=69) die PROSCAR 5 mg/dag kregen gedurende 6-24 weken, varieerden de finasterideconcentraties in het sperma van niet-detecteerbaar ( KLINISCHE FARMACOLOGIE ].

Dierlijke gegevens
In een embryo-foetale ontwikkelingsstudie kregen zwangere ratten finasteride tijdens de periode van belangrijke organogenese (draagtijd 6 tot 17). Bij maternale doses oraal finasteride van ongeveer 0,1 tot 86 maal de maximaal aanbevolen dosis voor de mens (MRHD) van 5 mg/dag (gebaseerd op de AUC bij dierdoses van 0,1 tot 100 mg/kg/dag) was er een dosisafhankelijke toename van hypospadie. dat voorkwam bij 3,6 tot 100% van de mannelijke nakomelingen. Blootstellingsveelvouden werden geschat met behulp van gegevens van niet-zwangere ratten. Dagen 16 tot 17 van de zwangerschap is een kritieke periode bij mannelijke foetale ratten voor differentiatie van de uitwendige genitaliën. Bij orale maternale doses van ongeveer 0,03 maal de MRHD (gebaseerd op de AUC bij een dierdosis van 0,03 mg/kg/dag), hadden mannelijke nakomelingen een verlaagd prostaat- en zaadblaasjesgewicht, vertraagde preputiale scheiding en voorbijgaande tepelontwikkeling. Een verminderde anogenitale afstand trad op bij mannelijke nakomelingen van zwangere ratten die ongeveer 0,003 keer de MRHD kregen (gebaseerd op de AUC bij een dierdosis van 0,003 mg/kg/dag). Er werden geen afwijkingen waargenomen bij vrouwelijke nakomelingen bij een maternale dosis finasteride.
Er werden geen ontwikkelingsafwijkingen waargenomen bij de nakomelingen van onbehandelde vrouwtjes die gepaard waren met met finasteride behandelde mannelijke ratten die ongeveer 61 keer de MRHD kregen (gebaseerd op de AUC bij een dierdosis van 80 mg/kg/dag). Een licht verminderde vruchtbaarheid werd waargenomen bij mannelijke nakomelingen na toediening van ongeveer 3 keer de MRHD (gebaseerd op de AUC bij een dierdosis van 3 mg/kg/dag) aan vrouwelijke ratten tijdens de late dracht en lactatie. Onder deze omstandigheden werden geen effecten op de vruchtbaarheid waargenomen bij vrouwelijke nakomelingen.
Er werden geen aanwijzingen gevonden voor mannelijke uitwendige genitale misvormingen of andere afwijkingen bij konijnenfoetussen die werden blootgesteld aan finasteride tijdens de periode van belangrijke organogenese (draagtijd 6-18) bij orale doses van de moeder tot 100 mg/kg/dag (blootstellingsniveaus aan finasteride waren niet gemeten bij konijnen). Het is echter mogelijk dat deze studie niet de kritieke periode omvatte voor de effecten van finasteride op de ontwikkeling van mannelijke uitwendige genitaliën bij konijnen.
De foetale effecten van maternale blootstelling aan finasteride tijdens de periode van embryonale en foetale ontwikkeling werden geëvalueerd bij de resusaap (draagtijd 20-100), in een soort en ontwikkelingsperiode die meer voorspellend was voor specifieke effecten bij mensen dan de studies bij ratten en konijnen. Intraveneuze toediening van finasteride aan drachtige apen in doses van wel 800 ng/dag (geschatte maximale bloedconcentratie van 1,86 ng/ml of ongeveer 143 keer de hoogst geschatte blootstelling van zwangere vrouwtjes aan finasteride uit sperma van mannen die 5 mg/dag innamen) resulteerde in zonder afwijkingen bij mannelijke foetussen. Ter bevestiging van de relevantie van het rhesusmodel voor de ontwikkeling van de menselijke foetus, orale toediening van een dosis finasteride (2 mg/kg/dag of ongeveer 18.000 keer de hoogst geschatte bloedspiegels van finasteride uit sperma van mannen die 5 mg/dag innemen) aan zwangere apen resulteerden in uitwendige genitale afwijkingen bij mannelijke foetussen. Er werden geen andere afwijkingen waargenomen bij mannelijke foetussen en er werden bij geen enkele dosis finasteride-gerelateerde afwijkingen waargenomen bij vrouwelijke foetussen.
Borstvoeding
Risico Samenvatting
PROSCAR is niet geïndiceerd voor gebruik bij vrouwen.
Vrouwtjes en mannetjes met reproductief potentieel
Onvruchtbaarheid
vrouwen
PROSCAR is niet geïndiceerd voor gebruik bij vrouwen.
mannen
Behandeling met PROSCAR gedurende 24 weken om de spermaparameters bij gezonde mannelijke vrijwilligers te evalueren, bracht geen klinisch betekenisvolle effecten op de spermaconcentratie, mobiliteit, morfologie of pH aan het licht. Er werd een mediane afname van 0,6 ml (22,1%) van het ejaculaatvolume met een gelijktijdige afname van het totale aantal zaadcellen per ejaculaat waargenomen. Deze parameters bleven binnen het normale bereik en waren reversibel na stopzetting van de therapie met een gemiddelde tijd van 84 weken tot terugkeer naar baseline [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ].
Er zijn postmarketingmeldingen geweest van mannelijke onvruchtbaarheid en/of slechte zaadkwaliteit; normalisatie of verbetering van de zaadkwaliteit is gemeld na stopzetting van finasteride [zie ONGEWENSTE REACTIES ].
Pediatrisch gebruik
PROSCAR 5 mg is niet geïndiceerd voor gebruik bij pediatrische patiënten.
De veiligheid en werkzaamheid bij pediatrische patiënten zijn niet vastgesteld.
Geriatrisch gebruik
Van het totale aantal proefpersonen in PLESS waren 1480 en 105 proefpersonen respectievelijk 65 jaar en ouder en 75 jaar en ouder. Er werden geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen deze proefpersonen en jongere proefpersonen, en andere gerapporteerde klinische ervaringen hebben geen verschillen in respons tussen oudere en jongere patiënten aangetoond. Bij ouderen is geen dosisaanpassing nodig [zie KLINISCHE FARMACOLOGIE en Klinische studies ].
Leverfunctiestoornis
Voorzichtigheid is geboden bij de toediening van PROSCAR bij patiënten met leverfunctiestoornissen, aangezien finasteride uitgebreid in de lever wordt gemetaboliseerd [zie: KLINISCHE FARMACOLOGIE ].
Nierfunctiestoornis
Er is geen dosisaanpassing nodig bij patiënten met nierinsufficiëntie [zie KLINISCHE FARMACOLOGIE ].
OVERDOSERING
Patiënten hebben gedurende drie maanden enkelvoudige doses PROSCAR 5 mg tot 400 mg en meerdere doses PROSCAR 5 mg tot 80 mg/dag gekregen zonder bijwerkingen. Totdat er meer ervaring is opgedaan, kan geen specifieke behandeling voor een overdosering met PROSCAR worden aanbevolen.
Significante letaliteit werd waargenomen bij mannelijke en vrouwelijke muizen bij enkelvoudige orale doses van 1500 mg/m2Â (500 mg/kg) en bij vrouwelijke en mannelijke ratten bij enkelvoudige orale doses van 2360 mg/m2 (400 mg/kg) en 5900 mg/m2 (1000 mg/kg), respectievelijk.
CONTRA-INDICATIES
PROSCAR is gecontra-indiceerd in de volgende gevallen:
- Overgevoeligheid voor een van de bestanddelen van dit medicijn.
- Zwangerschap. Het gebruik van finasteride is gecontra-indiceerd bij vrouwen als ze zwanger zijn of mogelijk zwanger zijn. Vanwege het vermogen van type II 5α-reductaseremmers om de omzetting van testosteron in 5α-dihydrotestosteron (DHT) te remmen, kan finasteride afwijkingen veroorzaken aan de uitwendige genitaliën van een mannelijke foetus van een zwangere vrouw die finasteride krijgt. Als dit medicijn tijdens de zwangerschap wordt gebruikt of als er zwangerschap optreedt tijdens het gebruik van dit medicijn, moet de zwangere vrouw op de hoogte worden gesteld van het mogelijke gevaar voor de mannelijke foetus. [Zie ook WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ,EEN Gebruik bij specifieke populaties , en een HOE GELEVERD .] Bij vrouwelijke ratten hebben lage doses finasteride, toegediend tijdens de zwangerschap, bij mannelijke nakomelingen afwijkingen van de uitwendige genitaliën veroorzaakt.
KLINISCHE FARMACOLOGIE
Werkingsmechanisme
De ontwikkeling en vergroting van de prostaatklier is afhankelijk van het krachtige androgeen, 5α-dihydrotestosteron (DHT). Type II 5α-reductase metaboliseert testosteron tot DHT in de prostaatklier, lever en huid. DHT induceert androgene effecten door te binden aan androgeenreceptoren in de celkernen van deze organen.
Finasteride is een competitieve en specifieke remmer van Type II 5α-reductase waarmee het langzaam een stabiel enzymcomplex vormt. De omzet van dit complex is extreem traag (t ∼ 30 dagen). Dit is zowel in vivo als in vitro aangetoond. Finasteride heeft geen affiniteit voor de androgeenreceptor. Bij de mens zijn de 5α-gereduceerde steroïdmetabolieten in bloed en urine verminderd na toediening van finasteride.
farmacodynamiek
Bij de mens veroorzaakt een enkele orale dosis van 5 mg PROSCAR een snelle verlaging van de DHT-serumconcentratie, waarbij het maximale effect 8 uur na de eerste dosis wordt waargenomen. De onderdrukking van DHT wordt gehandhaafd gedurende het 24-uurs doseringsinterval en bij voortgezette behandeling. Het is aangetoond dat dagelijkse dosering van PROSCAR van 5 mg/dag gedurende maximaal 4 jaar de serum-DHT-concentratie met ongeveer 70% verlaagt. Het mediane circulerende niveau van testosteron nam toe met ongeveer 10-20%, maar bleef binnen het fysiologische bereik. In een afzonderlijke studie bij gezonde mannen die werden behandeld met finasteride 1 mg per dag (n=82) of placebo (n=69), waren de gemiddelde circulerende niveaus van testosteron en estradiol verhoogd met ongeveer 15% in vergelijking met baseline, maar deze bleven binnen de fysiologisch bereik.
Bij patiënten die PROSCAR 5 mg/dag kregen, werden verhogingen van ongeveer 10% waargenomen in luteïniserend hormoon (LH) en follikelstimulerend hormoon (FSH), maar de spiegels bleven binnen het normale bereik. Bij gezonde vrijwilligers veranderde de behandeling met PROSCAR 5 mg de respons van LH en FSH op het gonadotropine-releasing hormoon niet, wat erop wijst dat de hypothalamus-hypofyse-testiculaire as niet werd beïnvloed.
Bij patiënten met BPH heeft PROSCAR geen effect op de circulerende niveaus van cortisol, prolactine, schildklierstimulerend hormoon of thyroxine. Er werd geen klinisch betekenisvol effect waargenomen op het plasmalipidenprofiel (dwz totaal cholesterol, lipoproteïnen met lage dichtheid, lipoproteïnen met hoge dichtheid en triglyceriden) of botmineraaldichtheid.
Volwassen mannen met genetisch overgeërfde Type II 5α-reductasedeficiëntie hebben ook verlaagde niveaus van DHT. Behalve de bijbehorende urogenitale defecten die bij de geboorte aanwezig waren, zijn bij deze personen geen andere klinische afwijkingen waargenomen die verband houden met Type II 5α-reductasedeficiëntie. Deze personen hebben hun hele leven een kleine prostaatklier en ontwikkelen geen BPH.
Bij patiënten met BPH die 7-10 dagen voorafgaand aan de prostatectomie met finasteride (1-100 mg/dag) werden behandeld, werd een ongeveer 80% lager DHT-gehalte gemeten in prostaatweefsel dat tijdens een operatie was verwijderd, vergeleken met placebo; De concentratie in het testosteronweefsel was tot 10 keer hoger dan voor de behandeling, in vergelijking met placebo. Het intraprostaatgehalte van PSA was ook verlaagd.
Bij gezonde mannelijke vrijwilligers die gedurende 14 dagen met PROSCAR 5 mg werden behandeld, resulteerde stopzetting van de therapie in een terugkeer van de DHT-spiegels naar de niveaus van voor de behandeling in ongeveer 2 weken. Bij patiënten die gedurende drie maanden werden behandeld, keerde het prostaatvolume, dat met ongeveer 20% afnam, terug tot dicht bij de uitgangswaarde na ongeveer drie maanden stopzetting van de therapie.
Farmacokinetiek
Absorptie
In een onderzoek onder 15 gezonde jonge proefpersonen was de gemiddelde biologische beschikbaarheid van finasteride 5 mg tabletten 63% (bereik 34-108%), gebaseerd op de verhouding van de oppervlakte onder de curve (AUC) ten opzichte van een intraveneuze (IV) referentiedosis . De maximale plasmaconcentratie van finasteride was gemiddeld 37 ng/ml (bereik, 27-49 ng/ml) en werd 1-2 uur na de dosis bereikt. De biologische beschikbaarheid van finasteride werd niet beïnvloed door voedsel.
Verdeling
Het gemiddelde distributievolume bij steady-state was 76 liter (spreiding: 44-96 liter). Ongeveer 90% van het circulerende finasteride is gebonden aan plasma-eiwitten. Er is een langzame accumulatiefase voor finasteride na meervoudige dosering. Na toediening van 5 mg/dag finasteride gedurende 17 dagen waren de plasmaconcentraties van finasteride 47 en 54% hoger dan na de eerste dosis bij mannen van 45-60 jaar oud (n=12) en ≥70 jaar oud (n=12) , respectievelijk. De gemiddelde dalconcentraties na 17 dagen dosering waren respectievelijk 6,2 ng/ml (bereik 2,49,8 ng/ml) en 8,1 ng/ml (bereik 1,8-19,7 ng/ml) in de twee leeftijdsgroepen. Hoewel in dit onderzoek geen steady-state werd bereikt, was de gemiddelde dalplasmaconcentratie in een ander onderzoek bij patiënten met BPH (gemiddelde leeftijd, 65 jaar) die 5 mg/dag kregen, 9,4 ng/ml (bereik: 7,1 - 13,3 ng/ml; n= 22) na meer dan een jaar doseren.
Van finasteride is aangetoond dat het de bloed-hersenbarrière passeert, maar het lijkt niet preferentieel naar de liquor te worden gedistribueerd.
In 2 onderzoeken met gezonde proefpersonen (n=69) die PROSCAR 5 mg/dag kregen gedurende 6-24 weken, varieerden de finasterideconcentraties in het sperma van niet-detecteerbaar ( Gebruik bij specifieke populaties ].
Metabolisme
Finasteride wordt uitgebreid gemetaboliseerd in de lever, voornamelijk via de cytochroom P450 3A4-enzymsubfamilie. Er zijn twee metabolieten geïdentificeerd, de t-butylzijketen monohydroxyl- en monocarbonzuurmetabolieten, die niet meer dan 20% van de 5α-reductaseremmende activiteit van finasteride bezitten.
uitscheiding
Bij gezonde jonge proefpersonen (n=15) was de gemiddelde plasmaklaring van finasteride 165 ml/min (bereik, 70279 ml/min) en de gemiddelde eliminatiehalfwaardetijd in plasma was 6 uur (bereik, 3-16 uur). Na een orale dosis van Â14C-finasteride bij de mens (n=6), werd gemiddeld 39% (spreiding, 32-46%) van de dosis in de urine uitgescheiden in de vorm van metabolieten; 57% (bereik, 51-64%) werd uitgescheiden in de feces.
De gemiddelde terminale halfwaardetijd van finasteride bij proefpersonen ≥70 jaar was ongeveer 8 uur (spreiding, 6-15 uur; n=12), vergeleken met 6 uur (spreiding, 4-12 uur; n=12) bij proefpersonen 45-60 jaar. Als gevolg hiervan was de gemiddelde AUC (0-24 uur) na 17 dagen dosering 15% hoger bij proefpersonen 70 jaar dan bij proefpersonen in de leeftijd van 45-60 jaar (p=0,02).
pediatrisch
De farmacokinetiek van finasteride is niet onderzocht bij patiënten jonger dan 18 jaar.
Finasteride is niet geïndiceerd voor gebruik bij pediatrische patiënten [zie WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ,EEN Gebruik bij specifieke populaties ].
Geslacht
Finasteride is niet geïndiceerd voor gebruik bij vrouwen [zie CONTRA-INDICATIES ,EEN WAARSCHUWINGEN EN VOORZORGSMAATREGELEN ,EEN Gebruik bij specifieke populaties , en een HOE GELEVERD ].
geriatrische
Bij ouderen is geen dosisaanpassing nodig. Hoewel de eliminatiesnelheid van finasteride verlaagd is bij ouderen, zijn deze bevindingen niet klinisch significant. [Zie een Farmacokinetiek en Gebruik bij specifieke populaties .]
Ras
Het effect van ras op de farmacokinetiek van finasteride is niet onderzocht.
Leverfunctiestoornis
Het effect van leverinsufficiëntie op de farmacokinetiek van finasteride is niet onderzocht. Voorzichtigheid is geboden bij de toediening van PROSCAR 5 mg bij patiënten met leverfunctiestoornissen, aangezien finasteride uitgebreid in de lever wordt gemetaboliseerd. Nierfunctiestoornis
Bij patiënten met een nierfunctiestoornis is geen dosisaanpassing nodig. Bij patiënten met chronische nierinsufficiëntie, met een creatinineklaring variërend van 9,0 tot 55 ml/min, waren de AUC, maximale plasmaconcentratie, halfwaardetijd en eiwitbinding na een enkelvoudige dosis Â14C-finasteride vergelijkbaar met waarden verkregen bij gezonde vrijwilligers. De uitscheiding via de urine van metabolieten was verminderd bij patiënten met nierinsufficiëntie. Deze afname ging gepaard met een toename van de fecale excretie van metabolieten. De plasmaconcentraties van metabolieten waren significant hoger bij patiënten met nierinsufficiëntie (gebaseerd op een 60% toename van de totale radioactiviteit AUC). Finasteride werd echter goed verdragen door BPH-patiënten met een normale nierfunctie die gedurende 12 weken tot 80 mg/dag kregen, waarbij de blootstelling van deze patiënten aan metabolieten vermoedelijk veel groter zou zijn.
Klinische studies
Monotherapie
PROSCAR 5 mg/dag werd aanvankelijk geëvalueerd bij patiënten met symptomen van BPH en vergrote prostaat door middel van digitaal rectaal onderzoek in twee 1 jaar durende, placebogecontroleerde, gerandomiseerde, dubbelblinde onderzoeken en hun open verlengingen van 5 jaar.
PROSCAR 5 mg werd verder geëvalueerd in de PROSCAR Long-Term Efficacy and Safety Study (PLESS), een dubbelblinde, gerandomiseerde, placebo-gecontroleerde, 4-jarige, multicenter studie. 3040 patiënten in de leeftijd tussen 45 en 78 jaar, met matige tot ernstige symptomen van BPH en een vergrote prostaat bij digitaal rectaal onderzoek, werden gerandomiseerd in het onderzoek (1524 naar finasteride, 1516 naar placebo) en 3016 patiënten konden worden beoordeeld op werkzaamheid. 1883 patiënten voltooiden de 4-jarige studie (1000 in de finasteridegroep, 883 in de placebogroep).
Effect op symptoomscore
Symptomen werden gekwantificeerd met behulp van een score die vergelijkbaar was met de American Urological Association Symptom Score, die zowel obstructieve symptomen (beperking van de grootte en kracht van de stroom, gevoel van onvolledige blaaslediging, vertraagd of onderbroken urineren) als irriterende symptomen (nocturie, frequentie overdag, behoefte aan om de urinestroom te belasten of te duwen) door te beoordelen op een schaal van 0 tot 5 voor zes symptomen en een schaal van 0 tot 4 voor één symptoom, voor een totale mogelijke score van 34.
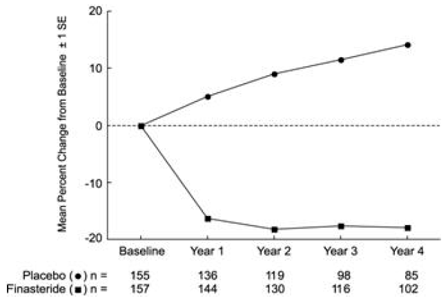
Patiënten in PLESS hadden matige tot ernstige symptomen bij aanvang (gemiddelde van ongeveer 15 punten op een schaal van 0-34 punten). Patiënten gerandomiseerd naar PROSCAR die gedurende 4 jaar in therapie bleven, hadden een gemiddelde (± 1 SD) afname van de symptoomscore van 3,3 (± 5,8) punten vergeleken met 1,3 (± 5,6) punten in de placebogroep. (Zie figuur 1.) Een statistisch significante verbetering in symptoomscore was duidelijk na 1 jaar bij patiënten die werden behandeld met PROSCAR versus placebo (– 2,3 versus – 1,6), en deze verbetering hield aan tot jaar 4.
Figuur 1 Symptoomscore in PLESS
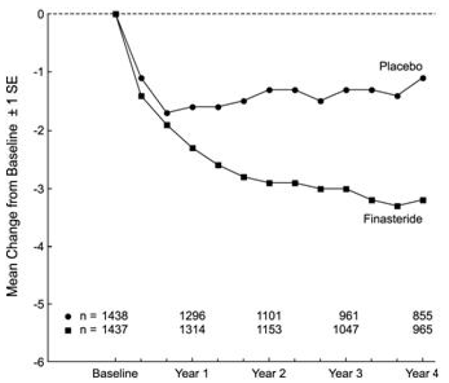
De resultaten die in eerdere onderzoeken werden gezien, waren vergelijkbaar met die in PLESS. Hoewel bij sommige patiënten een vroege verbetering van de urinewegsymptomen werd waargenomen, was over het algemeen een therapeutisch onderzoek van ten minste 6 maanden nodig om te beoordelen of een gunstige respons bij symptoomverlichting was bereikt. De verbetering van de BPH-symptomen werd gedurende het eerste jaar waargenomen en hield aan gedurende nog eens 5 jaar open extensieonderzoeken.
Effect op acute urineretentie en de noodzaak van een operatie
In PLESS werd de werkzaamheid ook beoordeeld door behandelingsfalen te evalueren. Falen van de behandeling werd prospectief gedefinieerd als BPH-gerelateerde urologische voorvallen of klinische verslechtering, gebrek aan verbetering en/of de noodzaak van alternatieve therapie. BPH-gerelateerde urologische voorvallen werden gedefinieerd als urologische chirurgische interventie en acute urineretentie waarvoor katheterisatie nodig was. Van 92% van de patiënten was volledige informatie over voorvallen beschikbaar. De volgende tabel (tabel 5) vat de resultaten samen.
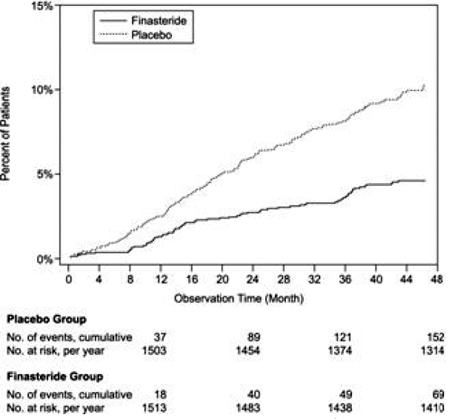
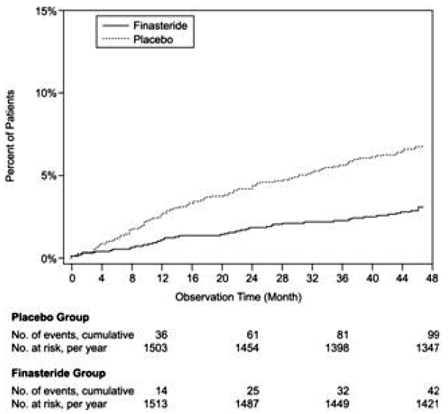
Vergeleken met placebo was PROSCAR geassocieerd met een significant lager risico op acute urineretentie of de noodzaak van BPH-gerelateerde chirurgie [13,2% voor placebo versus 6,6% voor PROSCAR; 51% vermindering van het risico, 95% BI: (34 tot 63%)]. Vergeleken met placebo was PROSCAR 5 mg geassocieerd met een significant lager risico op chirurgie [10,1% voor placebo versus 4,6% voor PROSCAR; 55% reductie in risico, 95% BI: (37 tot 68%)] en met een significant lager risico op acute urineretentie [6,6% voor placebo vs 2,8% voor PROSCAR; 57% vermindering van het risico, 95% BI: (34 tot 72%)]; zie figuren 2 en 3.
Figuur 2 Percentage patiënten dat geopereerd is aan BPH, inclusief TURP
Figuur 3 Percentage patiënten dat acute urineretentie ontwikkelt (spontaan en geprecipiteerd)
Effect op maximale urinestroom
Bij de patiënten in PLESS die voor de duur van het onderzoek in therapie bleven en evalueerbare urinestroomgegevens hadden, verhoogde PROSCAR 5 mg de maximale urinestroomsnelheid met 1,9 ml/sec vergeleken met 0,2 ml/sec in de placebogroep.
Er was een duidelijk verschil tussen de behandelingsgroepen in maximale urinestroomsnelheid in het voordeel van PROSCAR 5 mg tegen maand 4 (1,0 versus 0,3 ml/sec), dat gedurende het hele onderzoek werd gehandhaafd. In de eerdere onderzoeken van 1 jaar was de toename van de maximale urinestroom vergelijkbaar met die van PLESS en hield deze aan gedurende het eerste jaar en gedurende nog eens 5 jaar aan open verlengingsonderzoeken.
Effect op prostaatvolume
In PLESS werd het prostaatvolume jaarlijks beoordeeld door middel van magnetische resonantie beeldvorming (MRI) bij een subgroep van patiënten. Bij patiënten die werden behandeld met PROSCAR 5 mg en die in behandeling bleven, was het prostaatvolume verminderd in vergelijking met zowel baseline als placebo gedurende de 4-jarige studie. PROSCAR verminderde het prostaatvolume met 17,9% (van 55,9 cc bij baseline tot 45,8 cc na 4 jaar) vergeleken met een toename van 14,1% (van 51,3 cc tot 58,5 cc) in de placebogroep (p
De resultaten die in eerdere onderzoeken werden gezien, waren vergelijkbaar met die in PLESS. Het gemiddelde prostaatvolume bij baseline varieerde tussen 40-50 cc. De afname van het prostaatvolume werd gedurende het eerste jaar waargenomen en hield aan gedurende nog eens vijf jaar open extensieonderzoeken.
Figuur 4 Prostaatvolume in PLESS
Prostaatvolume als voorspeller van therapeutische respons
Een meta-analyse waarin gegevens van één jaar werden gecombineerd uit zeven dubbelblinde, placebogecontroleerde onderzoeken met een vergelijkbare opzet, waaronder 4491 patiënten met symptomatische BPH, toonde aan dat bij patiënten die met PROSCAR werden behandeld, de omvang van de symptoomrespons en de mate van verbetering in de maximale urinestroomsnelheid was groter bij patiënten met een vergrote prostaat bij aanvang.
Combinatie met Alpha-Blocker-therapie
De Medical Therapy of Prostatic Symphony (MTOPS) Trial was een dubbelblinde, gerandomiseerde, placebogecontroleerde, multicenter, 4 tot 6 jaar durende studie (gemiddeld 5 jaar) bij 3047 mannen met symptomatische BPH, die gerandomiseerd waren om PROSCAR 5 te krijgen. mg/dag (n=768), doxazosine 4 of 8 mg/dag (n=756), de combinatie van PROSCAR 5 mg/dag en doxazosine 4 of 8 mg/dag (n=786), of placebo (n=737 ). Alle deelnemers ondergingen wekelijkse titratie van doxazosine (of de placebo) van 1 tot 2 tot 4 tot 8 mg/dag. Alleen degenen die het dosisniveau van 4 of 8 mg verdroegen, werden in het onderzoek op doxazosine (of de placebo) gehouden. De laatste getolereerde dosis van de deelnemer (ofwel 4 mg of 8 mg) werd toegediend vanaf het einde van week 4. De laatste dosis doxazosine werd eenmaal per dag toegediend, voor het slapengaan.
De gemiddelde leeftijd van de patiënt bij randomisatie was 62,6 jaar (±7,3 jaar). De patiënten waren blank (82%), Afro-Amerikaans (9%), Hispanic (7%), Aziatisch (1%) of Indiaans (
Het primaire eindpunt was een samengestelde maatstaf van het eerste optreden van een van de volgende vijf uitkomsten: een ≥ 4 punten bevestigde toename van de symptoomscore ten opzichte van de uitgangswaarde, acute urineretentie, BPH-gerelateerde nierinsufficiëntie (creatininestijging), terugkerende urineweginfecties of urosepsis of incontinentie. In vergelijking met placebo resulteerde behandeling met PROSCAR 5 mg, doxazosine of combinatietherapie in een vermindering van het risico op het ervaren van een van deze vijf uitkomstgebeurtenissen met 34% (p=0,002), 39% (p
Het merendeel van de voorvallen (274 van de 351; 78%) was een bevestigde toename van ≥4 punten in de symptoomscore, ook wel progressie van de symptoomscore genoemd. Het risico op progressie van de symptoomscore was verminderd met 30% (p=0,016), 46% (p
Figuur 5 Cumulatieve incidentie van een stijging van 4 punten in de AUA-symptoomscore per behandelgroep
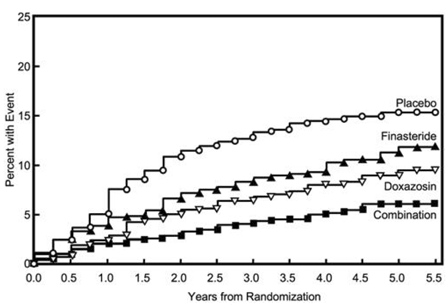
Behandeling met PROSCAR 5 mg, doxazosine of de combinatie van PROSCAR met doxazosine, verminderde de gemiddelde symptoomscore vanaf baseline in jaar 4. Tabel 7 geeft de gemiddelde verandering ten opzichte van baseline voor AUA-symptoomscore per behandelingsgroep voor patiënten die gedurende vier jaar in therapie bleven.
De resultaten van MTOPS komen overeen met de bevindingen van de 4-jarige, placebogecontroleerde studie PLESS [zie Monotherapie ] in die zin dat behandeling met PROSCAR het risico op acute urineretentie en de noodzaak van BPH-gerelateerde chirurgie vermindert. In MTOPS was het risico op het ontwikkelen van acute urineretentie verminderd met 67% bij patiënten die werden behandeld met PROSCAR in vergelijking met patiënten die werden behandeld met placebo (0,8% voor PROSCAR en 2,4% voor placebo). Ook was het risico dat BPH-gerelateerde invasieve therapie nodig was, met 64% verminderd bij patiënten die met PROSCAR werden behandeld in vergelijking met patiënten die met placebo werden behandeld (2,0% voor PROSCAR 5 mg en 5,4% voor placebo).
Samenvatting van klinische onderzoeken
De gegevens uit deze onderzoeken, die verbetering laten zien van BPH-gerelateerde symptomen, vermindering van behandelingsfalen (BPH-gerelateerde urologische voorvallen), verhoogde maximale urinestroom en afnemend prostaatvolume, suggereren dat PROSCAR het ziekteproces van BPH stopt bij mannen met een vergrote prostaat.
PATIËNT INFORMATIE
Geen informatie verstrekt. Raadpleeg de WAARSCHUWINGEN EN VOORZORGSMAATREGELEN sectie.
